Verbascoside Inhibits the Activation of NLRP3 Inflammasome and Improves BV-2 Cell Inflammatory Damage
-
摘要: 目的:探讨桂花中的主要成分毛蕊花糖苷(Verbascoside,VB)抑制NLRP3炎性小体活化改善BV-2细胞炎性损伤及相关机制。方法:利用糖氧剥夺(Oxygen and glucose deprivation, OGD)法诱导BV-2细胞建立炎性损伤模型,实验分为正常对照组、OGD模型组、桂花乙醇提取物(Osmanthus fragrans ethanol extract,OEE)处理组(OGD+OEE)、VB处理组(OGD+VB)。采用MTT法检测BV-2细胞活力;使用乳酸脱氢酶(Lactate dehydrogenase,LDH)细胞毒性试剂盒检测培养液上清中LDH释放量,评价其对细胞膜的影响;利用Hoechst 33342/PI双染技术检测其对细胞焦亡的影响;此外,采用免疫印迹(Western blot)法研究VB对NLRP3、Caspase-1、IL-1β及TNF-α等炎症相关蛋白的表达水平。结果:MTT法结果表明,OEE和VB均能显著促进BV-2细胞存活(P<0.001);LDH检测结果显示,OEE和VB均能极显著地减少培养液上清中LDH的释放(P<0.001),可减少细胞膜损伤;采用Hoechst 33342/PI双染后,OEE和VB组中BV-2细胞的PI阳性细胞数量均明显减少(P<0.01),荧光强度明显减弱。Western blot结果显示,经VB干预后,NLRP3/Caspase-1/IL-1β信号通路细胞焦亡蛋白水平显著降低(P<0.05或P<0.01)。结论:VB能够改善OGD诱导的BV-2细胞炎性损伤,可能是OEE抗炎的主要药效物质基础,其机制与抑制NLRP3/Caspase-1/IL-1β信号通路相关。Abstract: Objective: To investigate the main component verbascoside (VB) in Osmanthus fragrans which inhibits NLRP3 inflammasome activation to improve inflammatory damage in BV-2 cells and its related mechanisms. Methods: A model of inflammatory damage induced by oxygen-glucose deprivation (OGD) in BV-2 cells was employed. The experiment was divided into 4 groups: The normal control group, the OGD model group, the Osmanthus fragrans ethanol extract group (OGD+OEE), and VB group (OGD+VB). The MTT assay was used to evaluate the effects of the treatments on BV-2 cell viability. The release of lactate dehydrogenase (LDH) in the culture supernatant was measured using an LDH cytotoxicity assay kit to assess the impact on the cell membrane. Hoechst 33342/PI double staining was utilized to examine the effect of the treatments on cell pyroptosis. Furthermore, Western blot analysis was conducted to investigate the expression levels of proteins related to the NLRP3 inflammasome pathway, including NLRP3, Caspase-1, IL-1β, and TNF-α. Results: The MTT assay results indicated that both OEE and VB significantly promoted the viability of BV-2 cells (P<0.001). LDH assay results demonstrated that both OEE and VB markedly reduced the release of LDH in the culture supernatant (P<0.001), indicating reduced damage to the cell membrane. Hoechst 33342/PI double staining revealed a significant decrease in the number of PI-positive cells in both the OEE and VB groups (P<0.01), with a marked reduction in fluorescence intensity. The Western blot results indicated that, after treatment with verbascoside, there was a significant decrease in the levels of cell pyroptosis proteins associated with the NLRP3/Caspase-1/IL-1β signaling pathway (P<0.05 or P<0.01). Conclusion: VB can ameliorate OGD-induced inflammatory damage in BV-2 cells, which may constitute the primary pharmacodynamic basis for the anti-inflammatory effects of OEE. The mechanism is associated with the inhibition of the NLRP3/Caspase-1/IL-1β signaling pathway.
-
Keywords:
- verbascoside /
- Osmanthus fragrans /
- BV-2 cells /
- NLRP3 inflammasome /
- OGD model
-
慢性脑缺血(chronic cerebral hypoperfusion,CCH)是一种由多种原因引发的长期脑血流灌注不足疾病,病理机制十分复杂。CCH过程中,长期的脑部血流不足导致胶质细胞被激活,进而炎性神经介质的过量释放[1],触发一系列具有正反馈特性的炎症级联反应,从而加重神经元损伤,其中一个关键环节是与炎症反应密切相关的炎性细胞焦亡。细胞焦亡(pyroptosis)又称细胞炎性坏死,是一种由NLRP3炎性小体介导并通过Caspase蛋白引发的细胞死亡形式[2],不仅在炎症反应的调控中发挥重要作用,而且与CCH的发病机制紧密相关[3]。
当机体受到炎症刺激时,促炎信号分子TNF-α即会产生。TNF-α可促进NLRP3小体的组装和激活,它的存在能加速NLRP3小体的形成,进而引发炎症性细胞因子的产生[4],如IL-1β和IL-18。另外,NLRP3炎症小体是控制IL-1β前体pro-IL-1β的关键[5],并与Caspase 1共同调节IL-1β分泌。NLRP3激活促使Caspase 1前体蛋白裂解为有活性的Caspase 1,后者进一步作用于pro-IL-1β,将其转换为活性IL-1β,从而激发炎症反应的发生[6]。多项研究发现,通过抑制NLRP3炎症小体的激活可以有效降低炎症反应,并能改善CCH损伤[7−9]。此外,近年来众多证据显示,调控NLRP3活性可能是治疗脑卒中的有效手段[10−12]。
毛蕊花糖苷(Verbascoside,VB)普遍存在于肉苁蓉[13]、桂花[14]等药食同源植物中,课题组发现其在桂花乙醇提取物(Osmanthus fragrans ethanol extract,OEE)中含量可高达30%[15]。VB抗炎作用是其最为人所知的生物活性之一[16−17]。研究表明,VB能够通过多种途径减轻炎症反应,如抑制炎症细胞的激活、减少炎症介质的产生以及调节免疫细胞的功能,并且对神经炎症也有改善作用[18],这些特性可为改善CCH相关症状提供一种潜在的治疗选择,并且在保健食品中适用于开发旨在提高脑健康和认知功能的产品。VB的主要来源植物桂花具有温中散寒、活血止痛等功效,被广泛用于调节气血、改善消化系统、治疗牙痛等[19−21],也常作为食材用于制作桂花糕、茶和酒等,具有舒缓情绪、促进消化等特性[22−23],此外,其天然防腐特性可以延长食品保质期[24],减少化学添加剂的使用,加之其独特的香气可以优化食品配方,使桂花及其提取物成为许多药物和功能食品中的极具特色的重要原料或添加剂。
课题组前期研究表明,VB是OEE中含量最高的成分(30.03%),其次为红景天苷(5.21%),且OEE能够显著减轻CCH小鼠长期脑血流灌注不足,并能通过抗细胞凋亡与焦亡,对抗缺血性神经细胞损伤,改善CCH的认知功能障碍等[15]。因此,该研究拟进一步探究OEE中的主要活性成分VB对缺血性神经炎性损伤的作用,这不仅对于防治CCH及其相关疾病的功能食品开发具有重要意义,也将进一步丰富人们对传统药食同源植物在现代应用中的理解。
基于前期基础,该研究将采用糖氧剥夺(Oxygen and glucose deprivation, OGD)法诱导BV-2细胞构建体外细胞炎性损伤模型,初步评价OEE及与其相当剂量的VB抵御BV-2细胞炎症损伤的作用,以此探讨OEE可能的抗炎药效物质基础,并进一步探讨VB抑制NLRP3炎性小体活化的潜在机制。该研究将为开发基于桂花来源的新型抗炎天然产物提供重要的理论依据,也为预防缺血性脑功能障碍保健食品的研发提供新的策略。
1. 材料与方法
1.1 材料与仪器
小鼠源小胶质细胞(BV-2) 中国实验细胞资源共享中心(北京总部);桂花 广西省阳朔县永盛食品有限公司;毛蕊花糖苷 纯度≥98%,重庆美赛生物科技有限公司;DMEM高糖培养基 美国Hyclone公司;DMEM无糖培养基、胎牛血清、青霉素-链霉素溶液 德国Boehringer-Ingelheim公司;MTT粉末 德国Biofroxx公司;乳酸脱氢酶细胞毒性检测试剂盒 上海碧云天生物科技有限公司;MEM培养基 上海源培生物科技有限公司;MEM非必需氨基酸 武汉普赛诺生命科技有限公司。
BX41倒置显微镜、BX63正置显微镜 日本奥林巴斯公司;3111二氧化碳培养箱、3130三气培养箱、Heraeys Multifuge X3R高速冷冻离心机 均购自美国Thermo公司;ZXGP-B2080隔水恒温培养箱 上海智城分析仪器制造有限公司;CHB-100恒温金属浴 杭州博日科技有限公司;XW-80A涡旋仪、TS-8摇床 海门市其林贝尔仪器制造有限公司;SL-Ⅱ型数控层析冷柜 北京松源华兴科技发展有限公司;HH-2数字恒温水浴锅 常州市金坛区环宇科学仪器厂;219266 酶标仪 美国Bio Tek公司;LX-165T2R低速离心机 青岛海特生物医疗有限公司;16030929 高通量快速匀浆器 美国M.P. Biomedicals公司;XRS+凝胶成像仪 美国BIO-RAD公司。
1.2 实验方法
1.2.1 药品配制
桂花乙醇提取物(OEE)的制备参照课题组前期拟定的方法进行[15]。取OEE 1.0 g,加入0.25 mL二甲亚砜(DMSO)、2.25 mL无糖培养基,混匀后用0.22 μm滤头过滤,取1 mL,加40 mL无糖培养基,混匀,分装后−20 ℃保存备用。
毛蕊花糖苷(VB)的配制:称取毛蕊花糖苷标准品5.0 mg,2.5 mL无糖培养基溶解,0.22 μm滤菌器过滤,分装后−20 ℃保存备用。
1.2.2 实验分组与给药
前期预实验考察了不同浓度OEE(10~1000 μg/mL)对OGD损伤BV-2细胞的活力及LDH释放的影响,明确了其浓度为100、200 μg/mL时可显著促进BV-2细胞存活,并减少内容物LDH的释放(P<0.001),故拟定100、200 μg/mL的OEE作为后续实验浓度。并根据HPLC含测结果,即每1 g OEE约含0.3 g VB,故拟定与OEE中含量相当的VB试验浓度为30、60 μg/mL。
将细胞随机分为正常对照组、OGD模型组、OEE组(200、100 μg/mL)及与OEE中含量相当的VB组(60、30 μg/mL),每组设6个复孔。OEE组和VB组预先加入相应浓度物质4 h,随后正常对照组加入125 μL完全培养基,OGD模型组加入125 μL无糖培养基,其余两组加入100 μL无糖培养基与25 μL对应浓度OEE和VB[25]。
1.2.3 桂花乙醇提取物、毛蕊花糖苷对OGD诱导BV-2细胞活力的影响
MTT法检测OEE及VB对OGD诱导BV-2细胞活力的影响。选取对数生长期BV2细胞,调整细胞密度为1×105个/mL,接种于96孔板,37 ℃、5% CO2培养箱培养24 h。按照“1.2.2”项分组与给药方法,随后置三气培养箱培养2 h,弃去上清,倒置相差显微镜下进行形态学观察,MTT法检测细胞活力,利用Bio Tek酶标仪检测吸光度值,并计算细胞存活率。
1.2.4 乳酸脱氢酶释放检测
细胞培养、分组、给药与造模方法同“1.2.3”项,按照碧云天乳酸脱氢酶细胞毒性检测试剂盒说明书进行操作,使用Bio Tek酶标仪在490 nm处测量各孔样品的OD值,结果以LDH释放率表示。
1.2.5 Hoechst 33342/PI双染检测细胞焦亡
将对数生长期BV-2细胞以8×104个/孔接种于24孔板,每孔500 μL。置37 ℃、5% CO2培养箱中24 h后,吸弃原培养基,按照“1.2.3项”进行给药。孵育后弃上清,用300 μL PBS清洗,加入600 μL Hoechst 33342/PI染液(5 μg/mL Hoechst 33342:2 μg/mL PI=1:1),放入37 ℃、5% CO2培养箱孵育20 min,结束后用1 mL PBS漂洗3次,荧光显微镜下观察细胞焦亡情况。
1.2.6 Western blot 检测NLRP3/Caspase-1/IL-1β通路蛋白的表达
将对数生长期数量为2×106个的BV-2细胞接种在10 mm培养皿中,每皿4 mL。置于37 ℃、5% CO2的培养箱中孵育24 h后,吸弃培养基。按照“1.2.2”项进行给药。吹打并收集细胞于15 mL离心管中,4 mL预冷PBS洗涤3次,合并后2500×g,4 ℃离心10 min。弃上清,4 mL预冷PBS重悬细胞沉淀,再次离心。离心结束加300 μL裂解液(RIPA裂解液:PMSF:磷酸酶抑制剂=100:1:1),冰上裂解40 min。裂解结束,于预冷的离心机中14000×g,离心15 min。吸取上清液至新的离心管进行BCA蛋白定量。定量结束,加入上清液1/4体积的5×loading buffer混合均匀,100 ℃加热10 min,以充分变性蛋白,冷却至室温后放−20 ℃备用。
1.3 数据处理
所有数据均采用SPSS软件25.0进行分析。满足正态分布及方差齐性的各组计量数据以单因素ANOVA方差分析,非正态分布的计量数据先应用Kruskal-Wallis检验以比较各组间的差异,结果以“均值±标准差”(x±s)表示,且P<0.05数据有统计学意义。
2. 结果与分析
2.1 桂花乙醇提取物、毛蕊花糖苷对OGD诱导BV-2细胞的保护作用
2.1.1 桂花乙醇提取物、毛蕊花糖苷对OGD损伤BV-2细胞膜的保护作用
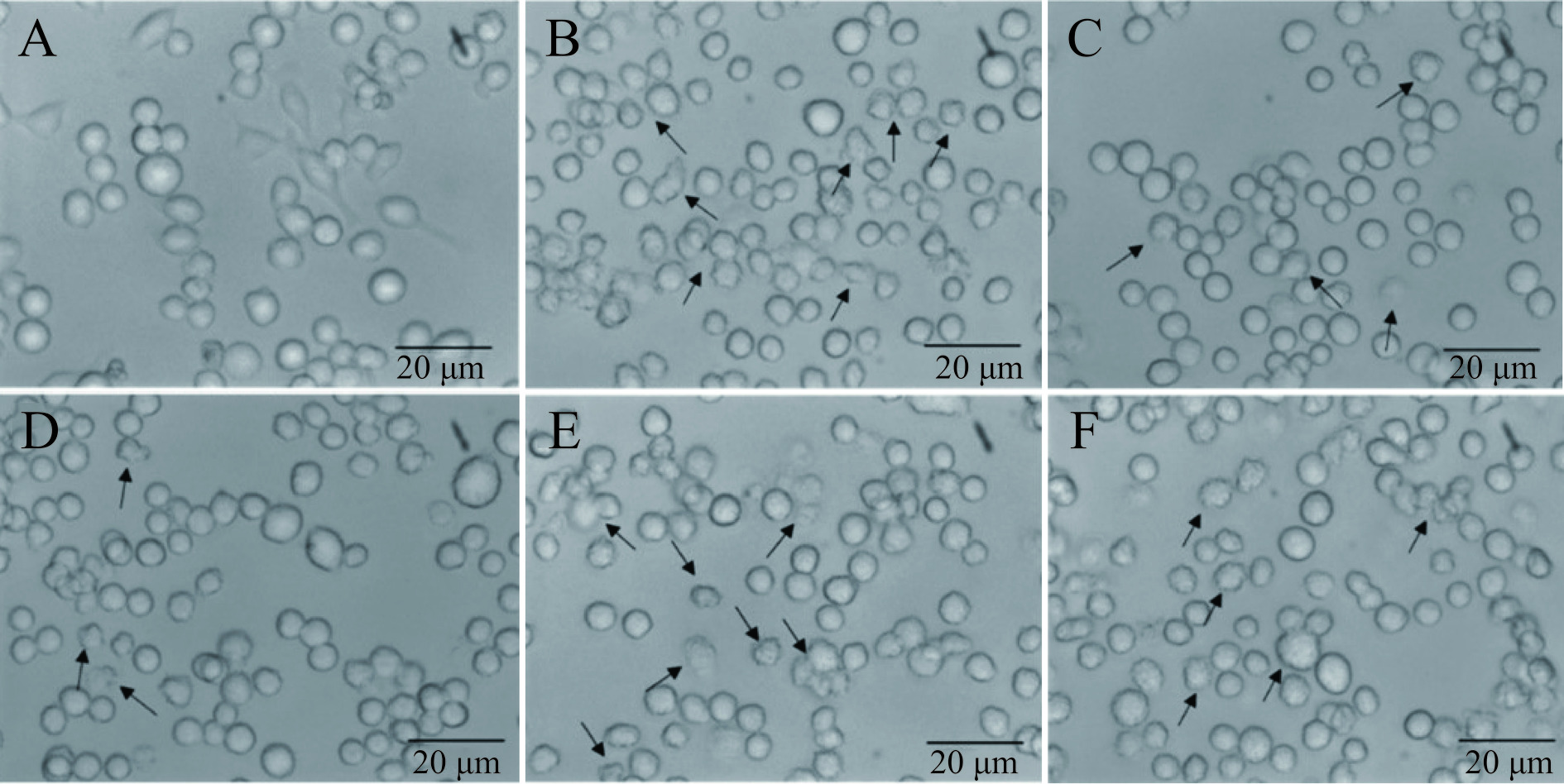
结果如图1,正常对照组BV-2细胞保持未激活状态,其形态为圆形,具有充实的三维结构,分支突起较少;OGD模型组BV-2细胞表现出激活样状态,其圆形结构被破坏,细胞触角更加明显,且细胞碎片数量增加(图1中箭头所示);OEE组与VB组“阿米巴样”细胞减少(图1中箭头所示),形状更加充实立体。通过观察细胞形态可以明显看出,OEE与VB对正常细胞具有促进增殖作用;此外,对OGD损伤细胞也有一定保护作用。
2.1.2 桂花乙醇提取物、毛蕊花糖苷对OGD损伤BV-2细胞活力及LDH释放的影响
结果如表1所示,与正常对照组比较,OGD模型组细胞死亡率显著增加(P<0.001)。与OGD模型组相比,200、100 μg/mL OEE组与相当剂量的VB组存活率明显提高(P<0.001),且OEE和VB对存活率的影响没有显著性差异,均可显著促进OGD损伤BV-2细胞存活。
表 1 桂花乙醇提取物、毛蕊花糖苷对OGD损伤BV-2细胞活力的影响(x±s,n=6)Table 1. Effects of OEE and VB on OGD-induced BV-2cell viability (x±s, n=6)组别 浓度(μg/mL) 存活率(%) 正常对照 − 100.00±4.32 OGD模型 − 55.18±5.04### 桂花乙醇提取物 200 69.91±4.90*** 100 71.22±4.87*** 毛蕊花糖苷 60 66.16±4.85*** 30 70.87±3.03*** 注:与正常对照组比,###P<0.001;与OGD模型组比,***P<0.001。 细胞的炎症性坏死会引发细胞膜结构破损,导致细胞质中的酶泄露至培养基中,包括稳定性较高的乳酸脱氢酶(LDH)。因此,通过测量培养基内LDH的活性,可以作为评估细胞膜损伤程度的间接指标。结果如表2所示,与正常对照组比较,OGD模型组细胞上清LDH释放量显著增加(P<0.001)。与OGD模型组相比,200、100 μg/L OEE与相当剂量VB组,均可显著减少内容物LDH的释放(P<0.001),减轻细胞膜损伤。且VB相较OEE对OGD损伤BV-2细胞LDH释放率的影响无显著性差异。
表 2 桂花乙醇提取物、毛蕊花糖苷对OGD损伤BV-2细胞LDH释放的影响(x±s,n=6)Table 2. Effects of OEE and VB on OGD-induced BV-2 cell LDH release (x±s, n=6)组别 浓度(μg/mL) LDH释放率(%) 正常对照 − 0.00±0.00 OGD模型 − 21.23±0.90### 桂花乙醇提取物 200 4.26±0.64*** 100 4.04±0.73*** 毛蕊花糖苷 60 7.41±1.06*** 30 5.51±0.85*** 注:与正常对照组比,###P<0.001;与OGD模型组比,***P<0.001。 2.2 桂花乙醇提取物、毛蕊花糖苷对BV-2细胞焦亡的影响
Hoechst 33342是一种蓝色荧光染料,可穿透细胞膜并染色细胞核。然而,PI只有在细胞膜破损时才能穿透并红染细胞核。因此,使用Hoechst 33342/PI双染技术可以有效检测细胞焦亡的发生情况。结果如图2所示,OGD模型组BV-2细胞PI红染增多,出现明显的焦亡,而在不同浓度OEE和VB处理后,PI红染有所减少,Hoechst33342蓝染占比相对增大,提示它们对OGD损伤的BV-2细胞损伤具有一定的保护作用。
经Hoechst 33342/PI双染后,进行结果分析显示(表3),相较于正常对照组,OGD模型组BV-2细胞中PI阳性细胞数量极显著上升(P<0.001),BV-2细胞焦亡率明显增加。经OEE及VB干预后,BV-2细胞中的PI阳性细胞数量明显减少(P<0.01或P<0.001),表明OEE及与其含量相当的VB均能有效减轻OGD诱导的BV-2细胞焦亡。分析OEE与对应剂量VB PI阳性细胞率结果显示,100 μg /mL OEE与30 μg/mL VB PI阳性细胞率没有显著性差异,另一剂量略有差异,说明VB作用较OEE相对弱。
表 3 桂花乙醇提取物、毛蕊花糖苷对BV-2细胞焦亡的影响(x±s,n=5)Table 3. Effect of OEE and VB on pyroptosis of BV-2cells (x±s, n=5)组别 浓度(μg/mL) PI阳性细胞率(%) 正常对照 − 0.00±0.00 OGD模型 − 61.07±3.68### 桂花乙醇提取物 200 20.03±1.27*** 100 16.48±5.90*** 毛蕊花糖苷 60 37.54±1.21** 30 22.54±4.70*** 注:与正常对照组比,###P<0.001;与OGD模型组比,**P<0.01,***P<0.001。 2.3 毛蕊花糖苷对OGD诱导BV-2细胞炎性损伤NLRP3/Caspase-1/IL-1β通路蛋白的影响
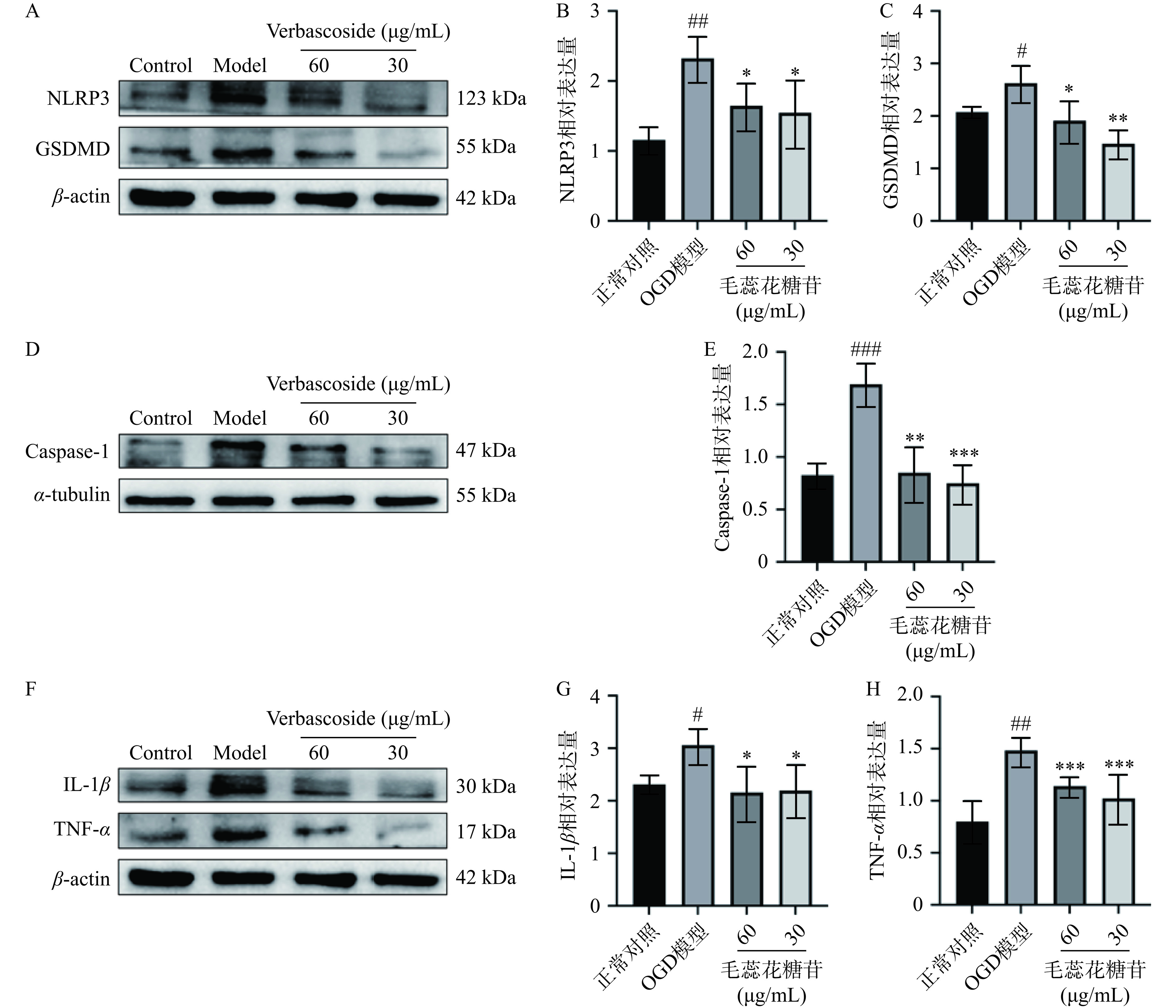
Western blot结果如图3所示,与正常对照组相比,OGD模型组NLRP3、GSDMD、Caspase-1、IL-1β、TNF-α蛋白水平都上调(P<0.05)。经VB干预后,与OGD模型组相比,NLRP3/Caspase-1/IL-1β通路相关蛋白表达水平均显著降低(P<0.05),表明VB能通过抑制NLRP3炎性小体活化抑制炎症因子IL-1β、TNF-α的表达以发挥抗炎作用。
3. 讨论与结论
小胶质细胞(BV-2)是中枢神经系统(CNS)主要的免疫活性细胞[26],当CNS发生损伤时其能够参与炎症进程。研究表明,脑缺血诱发炎症反应发生后,小胶质细胞BV-2大量活化,激活NLRP3炎性小体,调节相关炎症蛋白、因子的表达,如IL-1β、TNF-α等[27−28]。因此,与神经元细胞相比,它与慢性脑缺血后脑组织炎性坏死损伤更为密切。故该研究选择OGD诱导BV-2细胞炎性损伤模型复制慢性脑缺血损伤。
NLRP3炎症小体的组装会触发Caspase-1前体蛋白自动裂解为活性Caspase-1。此外,Caspase-1裂解GSDMD产生GSDMD-NT,后者对焦亡细胞的存活至关重要[29−30]。Poh等[31]研究表明,炎症小体可导致脑缺血后小胶质细胞焦亡,且小胶质细胞和星形胶质细胞在OGD损伤中可发生细胞焦亡[32−33]。细胞焦亡的发生伴随细胞肿胀、膜小孔破损等特征[34]。因此易透过细胞膜的PI染料借助焦亡细胞膜特性进入细胞核内与DNA嵌合,从而使其显示红色荧光;出现焦亡的细胞膜失去完整性,导致胞内物质LDH外流[35−36]。该研究结果表明,OGD模型组BV-2细胞的存活率显著下降,LDH释放率与Hoechst 33342/PI荧光强度均明显升高,可见经OGD处理后细胞出现膜破损、完整性丧失,内容物释放等细胞焦亡损伤现象。然而,在OEE及相当剂量VB干预后,对OGD条件下BV-2细胞的存活率显著上调,同时LDH释放、Hoechst 33342/PI荧光强度均明显降低,说明OEE及VB能够有效抵抗细胞膜破损,改善细胞焦亡损伤,且VB的保护作用与OEE接近或偏弱,提示OEE中除VB外,还存在其它抗炎活性物质。
目前研究表明,NLRP3炎性小体激活能参与脑缺血炎症最初引起的脑损伤过程[7,37]。Pringle等[38]发现炎症因子IL-1β能加剧缺氧所致的神经元损伤。与此一致的是,该研究OGD模型组中Caspase-1显著增加和IL-1β上升可以证明NLRP3炎性小体被激活。同时,NLRP3缺陷或抑制剂可减轻体内缺血性损伤和体外OGD诱导的细胞损伤[39−40]。Dai等[41]研究发现,降低NLRP3、Caspase-1和GSDMD表达以及IL-1β释放可减轻大鼠急性髓质损伤中的炎症反应。最新研究表明,VB治疗可通过减少炎症因子IL-1β和TNF-α等释放显著减少MCAO模型大鼠的脑梗塞面积[42]。该研究中,OGD诱导BV-2细胞中NLRP3炎症小体的激活可被VB显著抑制。这些结果表明VB对OGD诱导BV-2细胞的保护作用与抑制NLRP3炎症小体活化有关。
综上所述,OEE与其相当剂量的VB均能有效促进OGD条件下BV-2细胞的存活,逆转细胞焦亡损伤,VB可能是OEE抗脑缺血炎性损伤的主要活性物质,且其保护机制与抑制NLRP3炎症小体活化,下调相关蛋白Caspase-1、GSDMD、IL-1β等的表达水平抗细胞焦亡有关,当然OEE中的其它抗炎活性成分还有待进一步深入探究。该结果为VB成为一种极具潜力的改善缺血性脑功能障碍的保健食品提供了理论支持,也为桂花相关食疗产品的开发提供了科学依据。
-
表 1 桂花乙醇提取物、毛蕊花糖苷对OGD损伤BV-2细胞活力的影响(x±s,n=6)
Table 1 Effects of OEE and VB on OGD-induced BV-2cell viability (x±s, n=6)
组别 浓度(μg/mL) 存活率(%) 正常对照 − 100.00±4.32 OGD模型 − 55.18±5.04### 桂花乙醇提取物 200 69.91±4.90*** 100 71.22±4.87*** 毛蕊花糖苷 60 66.16±4.85*** 30 70.87±3.03*** 注:与正常对照组比,###P<0.001;与OGD模型组比,***P<0.001。 表 2 桂花乙醇提取物、毛蕊花糖苷对OGD损伤BV-2细胞LDH释放的影响(x±s,n=6)
Table 2 Effects of OEE and VB on OGD-induced BV-2 cell LDH release (x±s, n=6)
组别 浓度(μg/mL) LDH释放率(%) 正常对照 − 0.00±0.00 OGD模型 − 21.23±0.90### 桂花乙醇提取物 200 4.26±0.64*** 100 4.04±0.73*** 毛蕊花糖苷 60 7.41±1.06*** 30 5.51±0.85*** 注:与正常对照组比,###P<0.001;与OGD模型组比,***P<0.001。 表 3 桂花乙醇提取物、毛蕊花糖苷对BV-2细胞焦亡的影响(x±s,n=5)
Table 3 Effect of OEE and VB on pyroptosis of BV-2cells (x±s, n=5)
组别 浓度(μg/mL) PI阳性细胞率(%) 正常对照 − 0.00±0.00 OGD模型 − 61.07±3.68### 桂花乙醇提取物 200 20.03±1.27*** 100 16.48±5.90*** 毛蕊花糖苷 60 37.54±1.21** 30 22.54±4.70*** 注:与正常对照组比,###P<0.001;与OGD模型组比,**P<0.01,***P<0.001。 -
[1] HERNANDEZ I H, VILLA-GONZALEZ M, MARTIN G, et al. Glial cells as therapeutic approaches in brain ischemia-reperfusion injury[J]. Cells, 2021, 10(7).
[2] ZHOU B, ZHANG J Y, LIU X S, et al. Tom20 senses iron-activated ROS signaling to promote melanoma cell pyroptosis[J]. Cell Res,2018,28(12):1171−1185. doi: 10.1038/s41422-018-0090-y
[3] 肖俊杰, 詹青. 慢性脑缺血免疫炎症损伤机制与相关治疗研究进展[J]. 脑与神经疾病杂志, 2009, 17(2): 154−155. [XIAO J J, ZHAN Q. Progress in the study of immune-inflammatory injury mechanisms and related treatments for chronic cerebral ischemia[J]. Journal of Brain and Nervous Diseases, 2009, 17(2): 154−155.] XIAO J J, ZHAN Q. Progress in the study of immune-inflammatory injury mechanisms and related treatments for chronic cerebral ischemia[J]. Journal of Brain and Nervous Diseases, 2009, 17(2): 154−155.
[4] SHI H X, WANG Y, LI X H, et al. NLRP3 activation and mitosis are mutually exclusive events coordinated by NEK7, a new inflammasome component[J]. Nat Immunol,2016,17(3):250−258. doi: 10.1038/ni.3333
[5] ZHAO W M, MA L, CAI C, et al. Caffeine inhibits NLRP3 inflammasome activation by suppressing MAPK/NF-kappaB and A2aR signaling in LPS-induced THP-1 macrophages[J]. Int J Biol Sci,2019,15(8):1571−1581. doi: 10.7150/ijbs.34211
[6] 徐飞飞, 崔恺, 王立有, 等. α-细辛醚通过调控NLRP3通路保护氧糖剥夺/再灌注损伤BV2细胞的研究[J]. 中国药理学通报, 2022, 38(8):1209−1218. [XU F F, CUI K, WANG L Y, et al. Study of α-Asarone protecting BV1202 cells damaged by OGD/R by regulating of NLRP1203 pathway[J]. Chinese Pharmacological Bulletin, 2022, 38(8):1209−1218.] XU F F, CUI K, WANG L Y, et al. Study of α-Asarone protecting BV1202 cells damaged by OGD/R by regulating of NLRP1203 pathway[J]. Chinese Pharmacological Bulletin, 2022, 38(8): 1209−1218.
[7] GONG Z, PAN J R, SHEN Q Y, et al. Mitochondrial dysfunction induces NLRP3 inflammasome activation during cerebral ischemia/reperfusion injury[J]. J Neuroinflammation,2018,15(1):242. doi: 10.1186/s12974-018-1282-6
[8] QIU Z, HE Y H, MING H, et al. Lipopolysaccharide (LPS) aggravates high glucose- and hypoxia/reoxygenation-induced injury through activating ROS-dependent NLRP3 inflammasome-mediated pyroptosis in H9C2 cardiomyocytes[J]. J Diabetes Res,2019,2019:8151836.
[9] 韩冬, 温璐璐, 王珏, 等. 人尿激肽原酶通过调控NLRP3炎性小体对小鼠脑缺血/再灌注损伤的影响[J]. 中风与神经疾病杂志, 2020, 37(7): 629−632. [HAN D, WEN L L, WANG Y, et al. Effect of Human Urinary Kallindinogenase on cerebral ischemia/reperfusion injury through downregulating NL-RP623 inflammasome in mice[J]. Journal of Apoplexy and Nervous Diseases, 2020, 37(7): 629−632.] HAN D, WEN L L, WANG Y, et al. Effect of Human Urinary Kallindinogenase on cerebral ischemia/reperfusion injury through downregulating NL-RP623 inflammasome in mice[J]. Journal of Apoplexy and Nervous Diseases, 2020, 37(7): 629−632.
[10] ALISHAHI M, FARZANEH M, GHAEDRAHMATI F, et al. NLRP3 inflammasome in ischemic stroke:As possible therapeutic target[J]. Int J Stroke,2019,14(6):574−591. doi: 10.1177/1747493019841242
[11] GAO L, DONG Q, SONG Z H, et al. NLRP3 inflammasome:a promising target in ischemic stroke[J]. Inflamm Res,2017,66(1):17−24. doi: 10.1007/s00011-016-0981-7
[12] HONG P, GU R N, LI F X, et al. NLRP3 inflammasome as a potential treatment in ischemic stroke concomitant with diabetes[J]. J Neuroinflammation,2019,16(1):121. doi: 10.1186/s12974-019-1498-0
[13] 郝姗姗, 陈素梅, 闫东海, 等. 肉苁蓉在化妆品中的应用研究进展[J]. 日用化学品科学, 2021, 44(9): 36−41. [HAO S S, CHEN S M, YAN D H, et al. Research progress on the application of Cistanche in cosmetics[J]. Detergent and Cosmetics, 2021, 44(9): 36−41.] HAO S S, CHEN S M, YAN D H, et al. Research progress on the application of Cistanche in cosmetics[J]. Detergent and Cosmetics, 2021, 44(9): 36−41.
[14] 童俊, 刘红兵, 刘颖伟, 等. 基于HPLC-ESI-QTOF-MS技术的金桂花降糖活性物质基础研究[J]. 药学学报, 2023, 58(3): 750−759. [TONG J, LIU H B, LIU Y W, et al. Research on hypoglycemic activity of Osmanthus fragrans var. thunbergii extrat[J]. Acta Pharmaceutica Sinica,2023, 58(3): 750−759.] TONG J, LIU H B, LIU Y W, et al. Research on hypoglycemic activity of Osmanthus fragrans var. thunbergii extrat[J]. Acta Pharmaceutica Sinica,2023, 58(3): 750−759.
[15] 程芳, 张杰, 胡加成, 等. 基于网络药理学与动物实验探究桂花醇提物对慢性脑缺血神经损伤的保护作用及机制[J]. 中草药, 2023, 54(16): 5233−5243. [Protective mechanism of Osmanthus fragrans ethanol extract on chronic cerebral ischemia nerve injury based on network pharmacology and animal experiments[J]. Chinese Traditional and Herbal Drugs, 2023, 54(16): 5233−5243.] Protective mechanism of Osmanthus fragrans ethanol extract on chronic cerebral ischemia nerve injury based on network pharmacology and animal experiments[J]. Chinese Traditional and Herbal Drugs, 2023, 54(16): 5233−5243.
[16] CARRILLO-OCAMPO D, BAZALDUA-GOMEZ S, BONILLA-BARBOSA J R, et al. Anti-inflammatory activity of iridoids and verbascoside isolated from Castilleja tenuiflora[J]. Molecules,2013,18(10):12109−12118. doi: 10.3390/molecules181012109
[17] SPERANZA L, FRANCESCHELLI S, PESCE M, et al. Antiinflammatory effects in THP-1 cells treated with verbascoside[J]. Phytother Res,2010,24(9):1398−1404. doi: 10.1002/ptr.3173
[18] XIAO Y S, REN Q, WU L H. The pharmacokinetic property and pharmacological activity of acteoside:A review[J]. Biomed Pharmacother,2022,153:113296. doi: 10.1016/j.biopha.2022.113296
[19] 李时珍(明). 本草纲目[M]. 长春:时代文艺出版社, 2005. [LI S Z(Ming Dnasty). Compendium of Materia Medica[M]. Changchun:Times Literature and Art Publishing House, 2005.] LI S Z(Ming Dnasty). Compendium of Materia Medica[M]. Changchun: Times Literature and Art Publishing House, 2005.
[20] 安徽省革命委员会卫生局安徽中草药编写组. 安徽中草药:植物药部分[M]. 合肥:安徽人民出版社, 1975. [Anhui Province Revolutionary Committee Health Bureau Anhui Traditional Chinese Medicine Compilation Group. Anhui Traditional Chinese Medicine:Herbal medicine section[M]. Hefei:Anhui Peoples Publishing House.] Anhui Province Revolutionary Committee Health Bureau Anhui Traditional Chinese Medicine Compilation Group. Anhui Traditional Chinese Medicine: Herbal medicine section[M]. Hefei: Anhui Peoples Publishing House.
[21] 《浙江药用植物志》编写组. 浙江药用植物志[M]. 杭州:浙江科学技术出版社, 1980. [Zhejiang Medicinal Plant RecordCompilation Group. Zhejiang medicinal plant record[M]. Hangzhou:Zhejiang Science and Technology Publishing House, 1980.] Zhejiang Medicinal Plant RecordCompilation Group. Zhejiang medicinal plant record[M]. Hangzhou: Zhejiang Science and Technology Publishing House, 1980.
[22] 王雪菲, 周舟, 陈秋怡, 等. 桂花米发糕制作工艺研究[J]. 现代食品, 2023, 29: 58−60. [WANG X F, ZHOU Z, CHEN Q Y, et al. Study on processing technology of Osmanthus steamed Chinese sponge cake[J]. Modern Food, 2023, 29: 58−60.] WANG X F, ZHOU Z, CHEN Q Y, et al. Study on processing technology of Osmanthus steamed Chinese sponge cake[J]. Modern Food, 2023, 29: 58−60.
[23] 王红. 信远斋[J]. 老字号品牌营销,2023(3):1−2. [WANG H. Xinyuanzhai traditional beverage and preserved fruit shop[J]. Heritage Brand Marketing,2023(3):1−2.] WANG H. Xinyuanzhai traditional beverage and preserved fruit shop[J]. Heritage Brand Marketing, 2023(3): 1−2.
[24] 陈光, 史娟. 桂花黄色素微波预处理提取及抑菌作用研究[J]. 食品研究与开发, 2017, 38(21):15−19. [CHEN G, SHI J. Extraction of yellow pigment from Osmanthus fragrans by microwave pretreatment and their antibacterial activity[J]. Food Research and Development, 2017, 38(21):15−19.] CHEN G, SHI J. Extraction of yellow pigment from Osmanthus fragrans by microwave pretreatment and their antibacterial activity[J]. Food Research and Development, 2017, 38(21): 15−19.
[25] 苗珠月, 魏汝恒, 刘可心, 等. 羟基红花黄色素A对糖氧剥夺/复糖复氧诱导的BV2细胞炎性反应的机制研究[J]. 中国临床药理学杂志, 2023, 39(10): 1412−1416. [MIAO Z Y, WEI R H, LIU K X, et al. Mechanistic study of the inflammatory response of hydroxysafflor yellow A on oxygen-glucose deprivation/reoxygenation-induced BV1412 cells[J]. The Chinese Journal of Clinical Pharmacology, 2023, 39(10): 1412−1416.] MIAO Z Y, WEI R H, LIU K X, et al. Mechanistic study of the inflammatory response of hydroxysafflor yellow A on oxygen-glucose deprivation/reoxygenation-induced BV1412 cells[J]. The Chinese Journal of Clinical Pharmacology, 2023, 39(10): 1412−1416.
[26] LI C, WU Y, HUANG M Y, et al. Characterization of inflammatory signals in BV-2 microglia in response to Wnt3a[J]. Biomedicines, 2023, 11(4).
[27] 林慧敏, 段伟兵, 邵瑞, 等. 毛蕊花糖苷通过激活PI3K/AKT通路促进成年小鼠神经干细胞增殖[J]. 中国药理学通报, 2016, 32(6):836−840. [LIN H M, DUAN W B, SHAO R, et al, Acteoside promotes proliferation of neural stem cells from adult mice by activating Pl833K/AKT pathway[J]. Chinese Pharmacological Bulletin, 2016, 32(6):836−840.] LIN H M, DUAN W B, SHAO R, et al, Acteoside promotes proliferation of neural stem cells from adult mice by activating Pl833K/AKT pathway[J]. Chinese Pharmacological Bulletin, 2016, 32(6): 836−840.
[28] 黄炎, 彭拓, 陈诚, 等. 激活PPAR-γ对脑缺血-再灌注损伤中炎症反应的影响[J]. 临床麻醉学杂志, 2020, 36(7):685−690. [HUANG Y, PENG T, CHEN C, et al. Effects of PPAR-γ activation on inflammation in cerebral ischemia and reperfusion injury[J]. Journal of Clinical Anesthesiology, 2020, 36(7):685−690.] HUANG Y, PENG T, CHEN C, et al. Effects of PPAR-γ activation on inflammation in cerebral ischemia and reperfusion injury[J]. Journal of Clinical Anesthesiology, 2020, 36(7): 685−690.
[29] SHI J J, GAO W Q, SHAO F. Pyroptosis:Gasdermin-mediated programmed necrotic cell death[J]. Trends Biochem Sci,2017,42(4):245−254. doi: 10.1016/j.tibs.2016.10.004
[30] SHI J J, ZHAO Y, WANG K J, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature,2015,526(7575):660−665. doi: 10.1038/nature15514
[31] POH L, KANG S W, BAIK S H, et al. Evidence that NLRC4 inflammasome mediates apoptotic and pyroptotic microglial death following ischemic stroke[J]. Brain Behav Immun,2019,75:34−47. doi: 10.1016/j.bbi.2018.09.001
[32] WAN P X, SU W R, ZHANG Y Y, et al. LncRNA H19 initiates microglial pyroptosis and neuronal death in retinal ischemia/reperfusion injury[J]. Cell Death Differ,2020,27(1):176−191. doi: 10.1038/s41418-019-0351-4
[33] XIA P P, PAN Y D, ZHANG F, et al. Pioglitazone confers neuroprotection against ischemia-induced pyroptosis due to its inhibitory effects on HMGB-1/RAGE and Rac1/ROS pathway by activating PPAR-ɤ[J]. Cell Physiol Biochem,2018,45(6):2351−2368. doi: 10.1159/000488183
[34] 王欣悦, 李德冠. 细胞焦亡的发生机制及其在肝脏疾病发生发展中的作用[J]. 临床肝胆病杂志,2021,37(12):2976−2980. [WANG X Y, LI D G. Mechanism of pyroptosis and its role in the development and progression ofliver diseases[J]. Journal of Clinical Hepatology,2021,37(12):2976−2980.] doi: 10.3969/j.issn.1001-5256.2021.12.051 WANG X Y, LI D G. Mechanism of pyroptosis and its role in the development and progression ofliver diseases[J]. Journal of Clinical Hepatology, 2021, 37(12): 2976−2980. doi: 10.3969/j.issn.1001-5256.2021.12.051
[35] 景艳芸, 李陈广, 颜亮, 等. 灯盏花乙素对J774A. 1巨噬细胞中ATP诱导的炎症小体活化和细胞焦亡的影响[J]. 中国药理学通报, 2018, 34(2):174−180. [JING Y Y, LI C G, YAN L, et al. Influences of scutellarin on ATP-induced inflammasome activation andpyroptosis in J774A. 171 macrophages[J]. Chinese Pharmacological Bulletin, 2018, 34(2):174−180.] JING Y Y, LI C G, YAN L, et al. Influences of scutellarin on ATP-induced inflammasome activation andpyroptosis in J774A. 171 macrophages[J]. Chinese Pharmacological Bulletin, 2018, 34(2): 174−180.
[36] 王睿智, 陈志文, 邵乐, 等. 人参皂苷Rb1通过调控Nrf2/ARE信号通路抗氧糖剥夺/复氧后神经细胞焦亡的研究[J]. 中国药理学通报, 2021, 37(10): 1383−1390. [WANG R Z, CHEN Z W, SHAO L, et al. Ginsenoside Rb1381 inhibits neuronal pyroptosis after oxygen-glucose deprivation/ reoxygenation via Nrf1382/ARE signaling pathway[J]. Chinese Pharmacological Bulletin, 2021, 37(10): 1383−1390.] WANG R Z, CHEN Z W, SHAO L, et al. Ginsenoside Rb1381 inhibits neuronal pyroptosis after oxygen-glucose deprivation/ reoxygenation via Nrf1382/ARE signaling pathway[J]. Chinese Pharmacological Bulletin, 2021, 37(10): 1383−1390.
[37] XU Y, ZHANG J, MA L S, et al. The pathogenesis of necroptosis-dependent signaling pathway in cerebral ischemic disease[J]. Behav Neurol,2018,2018:6814393.
[38] PRINGLE A K, NIYADURUPOLA N, JOHNS P, et al. Interleukin-1beta exacerbates hypoxia-induced neuronal damage, but attenuates toxicity produced by simulated ischaemia and excitotoxicity in rat organotypic hippocampal slice cultures[J]. Neurosci Lett,2001,305(1):29−32. doi: 10.1016/S0304-3940(01)01795-5
[39] ISMAEL S, ZHAO L, NASOOHI S, et al. Inhibition of the NLRP3-inflammasome as a potential approach for neuroprotection after stroke[J]. Sci Rep,2018,8(1):5971. doi: 10.1038/s41598-018-24350-x
[40] YANG F, WANG Z Y, WEI X B, et al. NLRP3 deficiency ameliorates neurovascular damage in experimental ischemic stroke[J]. J Cereb Blood Flow Metab,2014,34(4):660−667. doi: 10.1038/jcbfm.2013.242
[41] DAI W Y, WANG X G, TENG H L, et al. Celastrol inhibits microglial pyroptosis and attenuates inflammatory reaction in acute spinal cord injury rats[J]. Int Immunopharmacol,2019,66:215−223. doi: 10.1016/j.intimp.2018.11.029
[42] LIAO Y C, HU J P, GUO C, et al. Acteoside alleviates blood-brain barrier damage induced by ischemic stroke through inhibiting microglia HMGB1/TLR4/NLRP3 signaling[J]. Biochem Pharmacol,2024,220:115968. doi: 10.1016/j.bcp.2023.115968





 下载:
下载:
 下载:
下载:
