Optimization of Microwave-assisted Semidry Degradation of Konjac Glucomannan with Hydrogen Peroxide and Its Characteristics
-
摘要: 魔芋葡甘聚糖(Konjac glucomannan,KGM)因相对分子质量大,水溶液黏度高,加工效率和应用范围受到限制。为探寻高效降低KGM黏度的方法以拓宽其应用市场,本研究以珠芽魔芋粉为原料,基于单因素实验,通过正交试验设计优化微波辅助过氧化氢氧化法(半干法工艺)制备低黏魔芋粉,并表征处理前后魔芋葡甘聚糖理化性质、结构和生理特性变化。结果表明:在微波功率700 W,过氧化氢浓度3%、液料比0.75:1 mL/g,混合均匀的反应物加热反应3 min,魔芋粉黏度由(6341.67±52.04)mPa·s降低为(53.33±5.77)mPa·s,魔芋葡甘聚糖重均分子量由347.31 kDa减小至158.26 kDa,与未处理原料相比分别降低99.16%和54.43%。采用X射线衍射仪、紫外可见光谱仪、红外光谱仪、扫描电镜等解析氧化前后魔芋葡甘聚糖结构,发现氧化使KGM分子链断裂降解,结晶度减小,破坏微观片层结构的同时又保留了特征性基团,微波辅助过氧化氢降黏KGM的效果优于微波或过氧化氢单独处理KGM,降解产物表现出更好的脂肪结合能力与胆汁酸结合能力,进一步证实该方法可以高效、绿色、环保地制备低黏魔芋粉,为低黏KGM开发利用提供了依据。Abstract: The processing efficiency and application range of konjac glucomannan (KGM) are limited because of its high relative molecular mass and the high viscosity of its aqueous solution. In this study, konjac flour from Amorphophallus bulbifer was used as raw material to develop an efficient approach to reducing the viscosity of KGM and broadening its application market. Based on a single-factor test and an orthogonal experimental design for optimization, low-viscosity konjac flour was prepared by microwave-assisted hydrogen peroxide oxidation (a semidry process), and the changes in physicochemical, structural, and physiological characteristics of KGM were characterized before and after the treatment. The results showed that the viscosity of konjac flour decreased from 6341.67±52.04 to 53.33±5.77 mPa·s, and the weight-average molecular weight of KGM decreased from 347.31 to 158.26 kDa when the uniformly mixed reactants were heated and reacted within 3 min at a microwave power of 700 W. The concentration of the hydrogen peroxide was 3%, and the liquid-material ratio was 0.75:1 mL/g. Compared to the untreated raw material, it decreased by 99.16% and 54.43%, respectively. Based on X-ray diffractometry, ultraviolet-visible spectrometry, infrared spectrometry, and scanning electron microscopy analyses of the KGM structure before and after oxidation, the oxidation of the KGM degraded the KGM molecular chain, decreased the crystallinity, and damaged the microscopic lamellar structure while retaining the characteristic groups. Moreover, the effect of the microwave-assisted hydrogen peroxide in decreasing the viscosity of the KGM was superior to that of the KGM treatment with the microwave or hydrogen peroxide only. The degradation products exhibited better fat-binding capacity and bile-acid-binding capacity. Therefore, KGM can be produced in a highly efficient, green, and ecofriendly manner, providing a rationale for the development and utilization of low-viscosity KGM.
-
Keywords:
- konjac glucomannan /
- semidry /
- oxidative degradation /
- low viscosity /
- characteristic
-
魔芋葡甘聚糖(Konjac glucomannan,KGM)是水溶非离子型多糖[1],由D-甘露糖和D-葡萄糖单元组成并通过β-1,4糖苷键连接,具有亲水性、凝胶性、乳化性、成膜增稠性及许多生物活性与健康益处,广泛应用于食品、化妆品、精细化工和制药等领域[2−3]。商品魔芋目前主栽品种有白魔芋(Amorphophallus albus)、花魔芋(Amorphophallus rivirei)、珠芽魔芋(Amorphophallus bulbifer),其中珠芽魔芋是叶面上生长有气生球茎的一大类魔芋,与花魔芋、白魔芋相比,具有抗病性好、适应性强、繁殖系数大及产量高等特点[4],近年来种植面积逐渐扩大,尤其是在低海拔山地种植效果较优。天然KGM相对分子质量大,水溶液黏度高[5],加工使用上都有极大不便,限制了KGM使用量和应用范围,因而研究高效降低KGM溶液黏度的方法,并探索其在降血脂、降胆固醇[6]等生理活性方面的潜在应用,成为了一个迫切需要解决的问题。相较白魔芋粉和花魔芋粉,珠芽魔芋粉的黏度相对较低[7],制备低黏魔芋粉更为适合,且市场价格也较低,具有广阔前景。因此,本文以珠芽魔芋粉为原料,开展低黏度魔芋葡甘聚糖制备工艺研究。
目前,制备低黏魔芋粉的方法有酶解法、化学法、物理法[8]。将物理、化学两种方法相结合可兼具成本低、反应充分、效率高等优点,化学法根据液料比的不同,有湿法、干法和半干法之分[9]。湿法工艺魔芋粉在水中溶胀黏度大,反应效率低且反应物不易混合均匀,产品质量均一性和稳定性不能保证,同时产生废水多,用作沉淀反应产物的乙醇消耗量大;而干法、半干法工艺用水量少,尤其是半干法的反应物混合均匀度更好,反应产物质量更均一和稳定。辅以微波加热反应,可对有机物碳链结构整体穿透,将能量迅速传递到反应物各官能团进行裂解[10],所需时间短、能耗低、反应效率高、反应效果好,在多糖化学改性中,已被广泛证实[11−12]。过氧化氢作为弱氧化剂可使聚合物断链或将聚合物中羟基氧化成羧基,且成本低廉、自身可被分解为氧气和水,环境友好。将微波、过氧化氢结合可以同时满足绿色、环保和高效的要求。目前已有湿法工艺基于微波辅助过氧化氢降解KGM相关研究报道[10],但半干法工艺用于微波辅助过氧化氢氧化制备低黏KGM还未见报道。
本研究以珠芽魔芋粉为原料,采用微波辅助过氧化氢(半干法工艺)将天然KGM降解为低黏KGM(Microwave-assisted hydrogen peroxide treatment of konjac glucomannan,MHK)。考察过氧化氢浓度、微波时间、液料比三个因素对KGM氧化降解的影响,正交试验得出优化工艺条件,制备低黏魔芋粉,并表征其处理前后理化性质、结构和生理特性变化,验证微波辅助过氧化氢氧化法(半干法工艺)降解KGM方法的优越性。以期为扩大工艺规模化制备低黏魔芋粉提供新的思路,为促进功能性降解KGM在食品和医药行业应用提供参考。
1. 材料与方法
1.1 材料与仪器
珠芽魔芋粉 食品级(葡甘聚糖含量≥84%,干基计),四川沐川森态源生物科技有限公司提供;30%过氧化氢 食品级,重庆跃翔化工有限公司;无水乙醇 分析纯,重庆市钛新化工有限公司;金龙鱼大豆油 益海嘉里有限公司;胃蛋白酶(1:3000)、胰酶(1:4000) 上海源叶生物科技有限公司;总胆汁酸测试盒 南京建成生物工程研究所。
MAS-Ⅱ PLUS常压微波反应器 上海新仪微波化学科技有限公司;DV2T黏度计 美国Brookfield公司;WR-18精密色差仪 深圳市威服光电科技有限公司;PL-GPC50凝胶渗透色谱仪 美国Agilent公司;MCP5100旋光仪 奥地利Anton Pear公司;TGA550热重分析仪 美国TA公司;X'Pert3 Powder X射线衍射仪 荷兰PANalytical公司;Spectrum Two红外光谱分析仪 美国PE公司;Phenom Pro扫描电镜 荷兰Phenom World公司。
1.2 实验方法
1.2.1 低黏魔芋粉制备
准确称取4.00 g珠芽魔芋粉,按一定液料比均匀喷洒一定浓度的过氧化氢溶液,快速搅拌均匀,将混合物迅速用可透气纸密封,在700 W微波处理一定时间。待反应结束后,将反应产物加入到3倍体积50%乙醇溶液搅匀并静置沉淀,所得沉淀物置于40 ℃真空干燥箱干燥,干燥物经粉碎过100目筛得到的粉末即为半干法氧化降解KGM产物(MHK),密封,于阴凉、干燥处存放备用。
1.2.2 表观黏度测定
参照CHEN等[13]方法并适当修改,将魔芋粉分散在纯水中制备1%(W/V)浓度水溶液,于30 ℃水浴,150 r/min磁力搅拌溶胀3 h,利用黏度计28号转子在转速为20 r/min、25 ℃下测定并记录样品的表观黏度。
1.2.3 白度(W)测定
取1.2.1中的样品参照HE等[14]方法测定白度。用标准白板校正色差仪,测定样品亮度(L*)、红绿度(a*)与黄蓝度(b*)。按公式(1)计算白度。
W=100−√(100−L∗)2+a∗2+b∗2 (1) 1.2.4 魔芋粉降黏单因素实验
以珠芽魔芋粉为原料,测定其表观黏度和白度,分别考察过氧化氢浓度(0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、微波时间(0、0.5、1.0、1.5、2、2.5、3.0、3.5 min)、液料比(0.25:1、0.50:1、0.75:1、1.00:1、1.25:1、1.50:1 mL/g)对KGM降解的影响。实验过程中不变水平为:过氧化氢浓度2.0%、微波时间2 min、液料比1.00:1 mL/g。
1.2.5 魔芋粉降黏正交试验设计
在单因素实验的基础上,选取过氧化氢浓度、微波时间和液料比为考察因素,以黏度为评价指标,采用L9(34)正交表进行试验设计,因素水平见表1。
表 1 正交试验因素与水平Table 1. Orthogonal test factors and levels水平 因素 A过氧化氢浓度(%) B微波时间(min) C液料比(mL/g) 1 2.0 2.0 0.50:1 2 2.5 2.5 0.75:1 3 3.0 3.0 1.00:1 1.2.6 理化特性测定
1.2.6.1 不同处理KGM样品制备
根据1.2.5正交试验得出的最佳过氧化氢浓度、微波时间、液料比制备三种不同方法处理的样品:微波(MK)、过氧化氢(HK)、微波辅助过氧化氢(MHK)。将KGM、MK、HK、MHK四种样品用于后续分析。
1.2.6.2 分子质量测定
参照ZHOU等[15]方法并作适当修改,配制质量浓度1 mg/mL样品水溶液,过0.22 μm滤膜,采用凝胶渗透色谱测定重均分子量。色谱条件为色谱柱:2x PLgel 8 μm aquagel-OH Mixed-M(7.5×300 mm);流动相:去离子水;流速:1 mL/min;柱温:40 ℃,进样体积:100 μL。以普鲁兰多糖标准品为对照,计算样品分子量及分布。
1.2.6.3 旋光度测定
参照ZHAO等[16]方法并适当修改,配制质量浓度1 mg/mL样品水溶液,在温度20 ℃下测定旋光度,按公式(2)计算比旋光度[17]。
[a]tλ=a×100l×c (2) 式中:a表示旋光度数,°;l表示试管长度,dm;c表示100 mL溶液含样品质量,g;t表示温度,℃;λ表示钠光谱589 nm。
1.2.6.4 热重分析
采用热重分析仪进行热重分析。样品置于20 mL/min的N2气氛下,升温速率10 ℃/min,测定其在25~600 ℃热稳定性。
1.2.7 结构特性表征
1.2.7.1 X射线衍射分析
参照YE等[18]方法,采用X射线衍射仪在电压40 kV,电流40 mA,扫描速率2°/min,2θ=4°~55°[19]对样品进行分析测试。
1.2.7.2 傅里叶红外光谱分析
参照LI等[20]方法并作适当修改,取一定质量样品置于ATR模块中,采用傅里叶红外光谱仪在4000~500 cm−1波数进行红外扫描测定,分辨率:4 cm−1,扫描次数:32次。
1.2.7.3 紫外-可见光全波长扫描
将样品以1 mg/mL溶解在纯水中,在190~600 nm范围内扫描[21]。
1.2.7.4 扫描电镜观察
参照YIN等[22]方法,将样品以1 mg/mL溶解在纯水中并冷冻干燥。取适量冻干后的样品平铺于导电硅胶上,镀金再置于扫描电镜内,10 kV电子束加速电压,分别在250×、1000×放大倍数下观察样品表面形貌。
1.2.8 生理特性测定
1.2.8.1 脂肪结合能力
参照LONG等[23]方法并作适当修改,将样品(0.20 g)分散于大豆油(10 mL)中,涡旋混匀15 min后静置1 h。将反应液以2000 r/min离心20 min,倒出上清液,称量余下物质重量,以沉积物样品的湿重与干重之比计算脂肪结合能力。
1.2.8.2 胆汁酸结合能力
参照巫永华等[24]方法,取1 mL 10 mg/mL样液于试管中,加入1 mL 0.01 mol/L盐酸和1 mL 10 mg/mL胃蛋白酶,37 ℃下振荡消化1 h模拟胃消化环境,空白组加盐酸,样品用纯水代替;调pH至6.3;加入2 mL 10 mg/mL胰酶液,于37 ℃下振荡消化1 h模拟肠消化环境,再加入1.5 mL 0.3 mmol/L胆酸盐消化1 h,5000 r/min离心10 min取上清液。按试剂盒方法操作,按公式(3)计算胆酸钠的结合率。
结合率(%)=空白溶液中胆酸盐浓度−样品溶液中胆酸盐浓度空白溶液中胆酸盐浓度×100 (3) 1.3 数据处理
所有实验均重复3次,采用Excel 2019、SPSS 22软件进行数据处理,采用ORIGIN 2018分析作图。通过Duncan法进行显著性分析,P<0.05为有显著性差异。
2. 结果与分析
2.1 单因素实验结果
2.1.1 过氧化氢浓度对KGM的影响
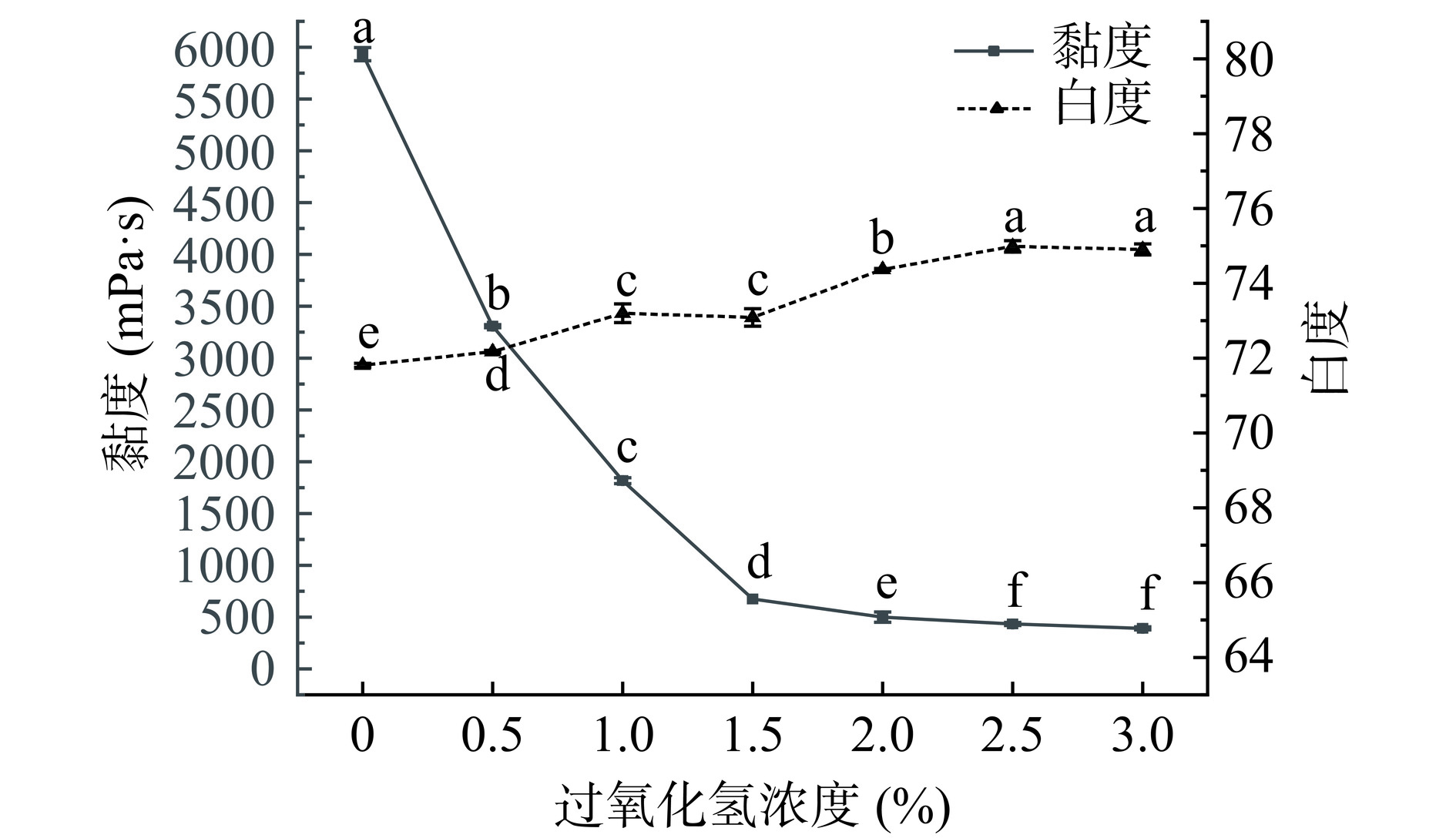
由图1可知,当过氧化氢浓度低于2.5%时,样品黏度随过氧化氢浓度的增加而显著降低(P<0.05),而当过氧化氢浓度超过2.5%,样品黏度随着过氧化氢浓度的增加而变化不明显,直到过氧化氢浓度为3%,样品黏度最低为391.67 mPa·s。这种现象是由于过氧化氢使聚合物断链或将聚合物中的羟基氧化成羧基[10],同时也证明了过氧化氢作为绿色环保的弱氧化剂,氧化能力是有限的,与TANG等[25]的研究结果一致。当过氧化氢浓度为0%(微波单独处理2 min),样品黏度为5933.33 mPa·s,相较原KGM(6341.67 mPa·s)下降6.44%。当微波辅助过氧化氢浓度0.5%处理,样品黏度下降至3308.33 mPa·s,相较KGM下降47.83%,说明微波辅助过氧化氢对KGM的降解效果显著大于单独的微波降解处理(P<0.05)。当过氧化氢浓度在2.0%~3.0%,样品白度显著增加(P<0.05),这一漂白效应可以归因于过氧化氢本身的氧化特性。在水溶液中,其部分以过氢氧离子(HOO−)形态存在,该阴离子是引发漂白作用的主要成分,可以通过增加过氧化氢浓度来提高漂白效果[26−27],WARDHANI等[28]也报道了过氧化氢处理KGM后白度增加的现象。因此,选取过氧化氢浓度正交试验优化因素水平分别为2.0%、2.5%、3.0%。
2.1.2 微波时间对KGM的影响
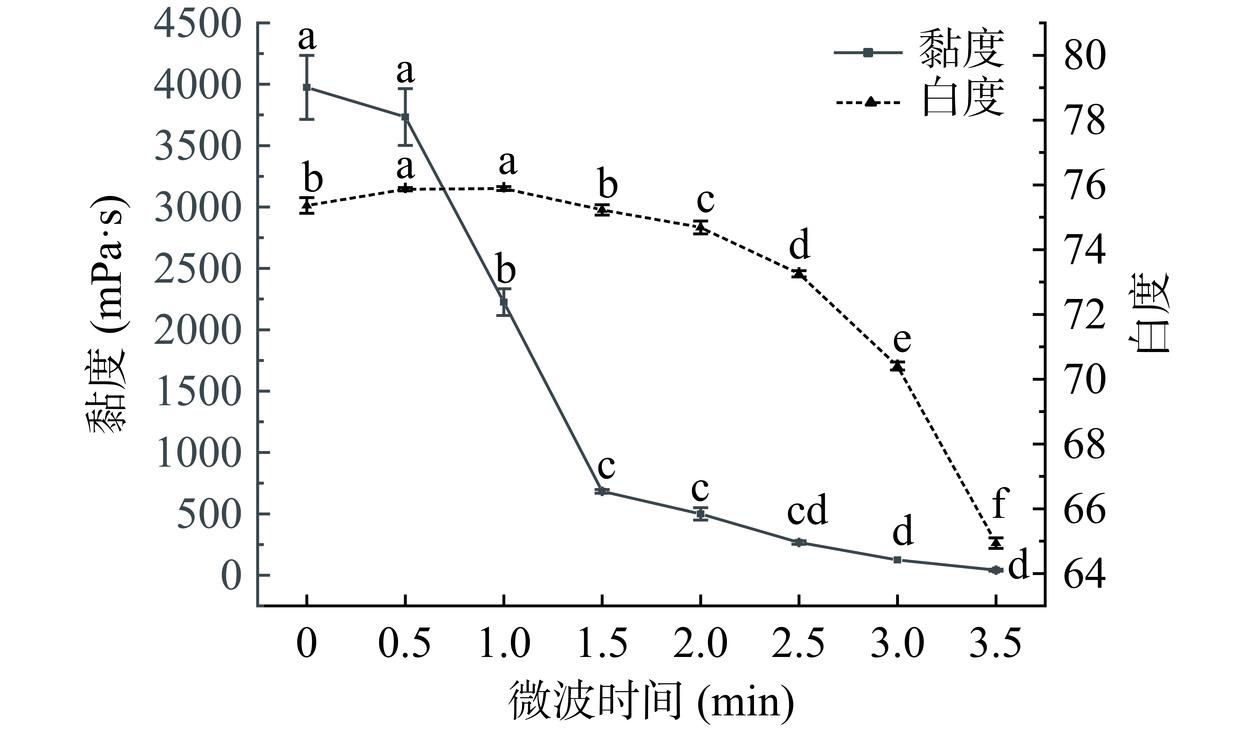
由图2可知,微波辅助过氧化氢处理,随着反应时间增长,KGM黏度显著降低(P<0.05),这与LI等[20]的研究结果一致,一方面是由于反应时间增加使KGM与氧化剂过氧化氢充分接触,另一方面是微波的能量被极性键迅速吸收,可以降低氧化降解的反应活化能[29],微波加热时间越长,产生能量越高,KGM分子链中糖苷键断裂程度也更大。由图2可知,在微波时间为0 min(即2%过氧化氢单独处理时),处理样品黏度为3975.00 mPa·s,较KGM下降37.32%,降黏度效果显著(P<0.05);当微波时间为0.5 min、2%过氧化氢处理,样品黏度下降至3766.67 mPa·s,相较KGM降低40.60%,说明微波辅助过氧化氢氧化降解KGM效果大于微波、过氧化氢单独处理。当微波时间达到3.0 min后,KGM黏度下降不明显,因为反应过程中过氧化氢分解为水和氧气而浓度变低[25],氧化作用减弱。样品白度在微波时间为0.5~2.0 min变化较小,2.0~3.5 min显著降低(P<0.05),在3.0~3.5 min变化最大,直至3.5 min时白度下降至64.94,严重影响产品外观。白度是衡量魔芋及其制品质量的重要指标之一,魔芋粉褐变使其市场价值下降[30]。因此,考虑产品综合品质,选取微波时间正交试验优化因素水平为2.0、2.5、3.0 min。
结合图1、图2可得,2%过氧化氢(微波时间为0 min)单独处理KGM降黏效果优于微波2 min(过氧化氢浓度为0%)单独处理KGM降黏效果。微波辅助过氧化氢处理后KGM黏度显著降低且显著优于微波或过氧化氢单独处理(P<0.05),这可能是因为在微波辅助条件下,能够促进过氧化氢自由基的产生,使得多糖氧化发生得更准确、更有效[31]。因此,微波和过氧化氢对KGM降解具有协同作用,该方法制备低黏KGM,环保、绿色、高效。
2.1.3 液料比对KGM的影响
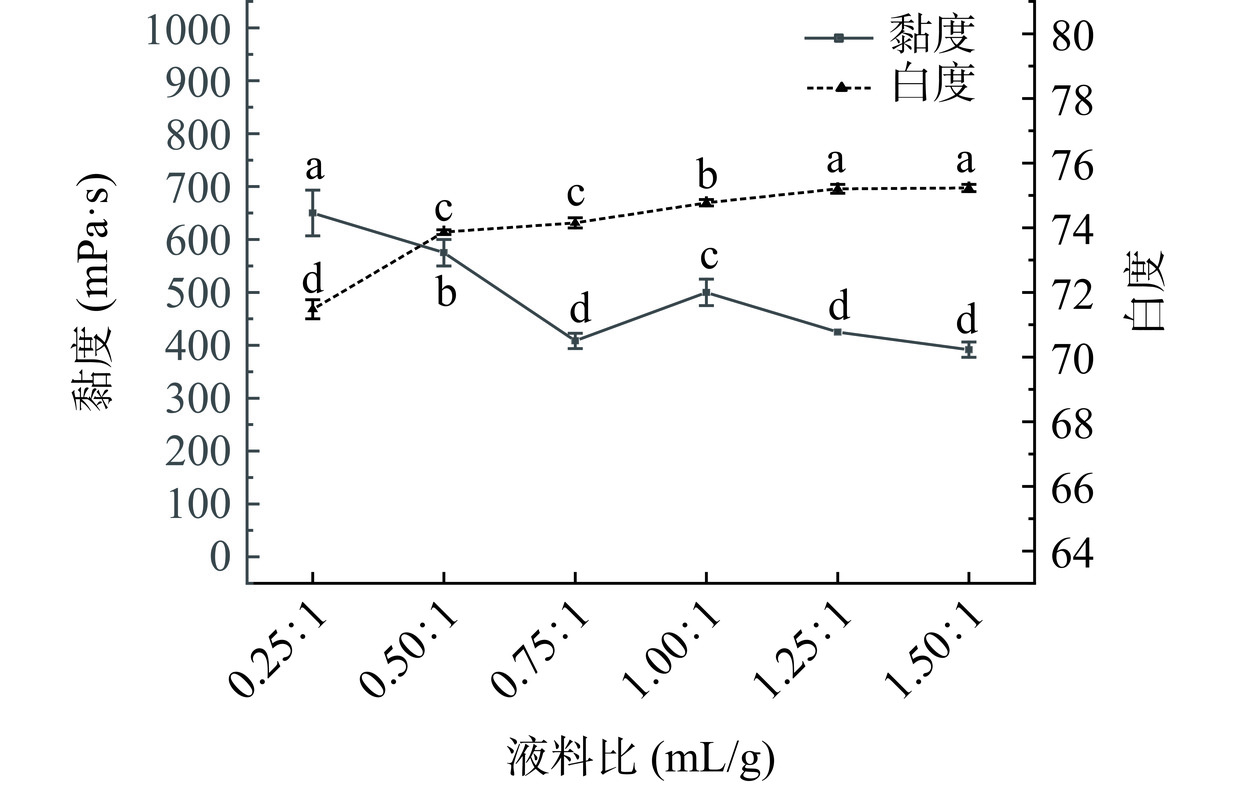
由图3可知,液料比对于KGM黏度的影响随液料比增加,呈现先下降后上升再下降趋势。当液料比小于0.50:1 mL/g,KGM分子不能全部达到半溶胀状态,过氧化氢与KGM分子接触面小,导致过氧化氢氧化反应不充分;当液料比大于1.00:1 mL/g,会使得KGM分子内包覆水量增大,后期用乙醇沉淀较难去除分子内水分[32]。最适液料比能促进KGM和过氧化氢充分接触进行氧化反应。当液料比在0.25:1~1.50:1 mL/g时,白度随着液料比的增加而增大。当液料比为0.75:1 mL/g和1.50:1 mL/g时,样品的黏度差异不显著(P>0.05)。因此,考虑节约经济成本、减少能源消耗,选取液料比正交试验优化因素水平为0.50:1、0.75:1、1.00:1 mL/g。
2.2 正交试验结果
因为正交试验样品得率为85%~88%,白度大于70,均满足市场需求且差异不显著,所以选取KGM黏度(最小值)为正交试验唯一考察指标。由表2极差分析可知,在过氧化氢浓度为2.0%~3.0%,微波时间为2.0~3.0 min,液料比为0.50:1~1.00:1 mL/g范围内,影响黏度的因素主次顺序为:B微波时间>A过氧化氢浓度>C液料比,最佳组合为A3B3C2,即过氧化氢浓度为3%、微波时间为3 min,液料比为0.75:1 mL/g,在该条件制备的样品黏度为(53.33±5.77)mPa·s,经验证实验A3B3C2黏度显著低于正交试验黏度最低组(P<0.05),且样品白度较好,说明优化的制备工艺参数可行且稳定。根据表3方差分析可知,微波时间、过氧化氢浓度均显著影响黏度(P<0.05),而液料比对黏度影响不显著。因此选用A3B3C2组样品用于后续实验研究。
表 2 正交试验结果Table 2. Results of orthogonal test试验号 因素 黏度(mPa·s) A 过氧化氢浓度(%) B 微波时间(min) C 液料比(mL/g) 1 2.0 2.0 0.50:1 541.67 2 3.0 2.0 0.75:1 383.33 3 2.5 2.0 1.00:1 441.67 4 3.0 2.5 0.50:1 225.00 5 2.5 2.5 0.75:1 175.00 6 2.0 2.5 1.00:1 266.67 7 2.5 3.0 0.50:1 93.33 8 2.0 3.0 0.75:1 108.33 9 3.0 3.0 1.00:1 83.33 k1 305.56 455.56 286.67 k2 236.67 222.22 222.22 k3 230.55 95.00 263.89 R 75.00 360.56 64.45 表 3 正交试验方差分析结果Table 3. Results of variance analysis of orthogonal test方差来源 平方和 自由度 均方 F P 过氧化氢浓度 10408.705 2 5204.352 19.357 0.049* 微波时间 200634.583 2 100317.291 373.121 0.003** 液料比 6408.538 2 3204.269 11.918 0.077 误差 537.720 2 268.860 注:R2=0.997,*P<0.05,**P<0.01。 2.3 不同处理KGM性质比较
2.3.1 基本性质
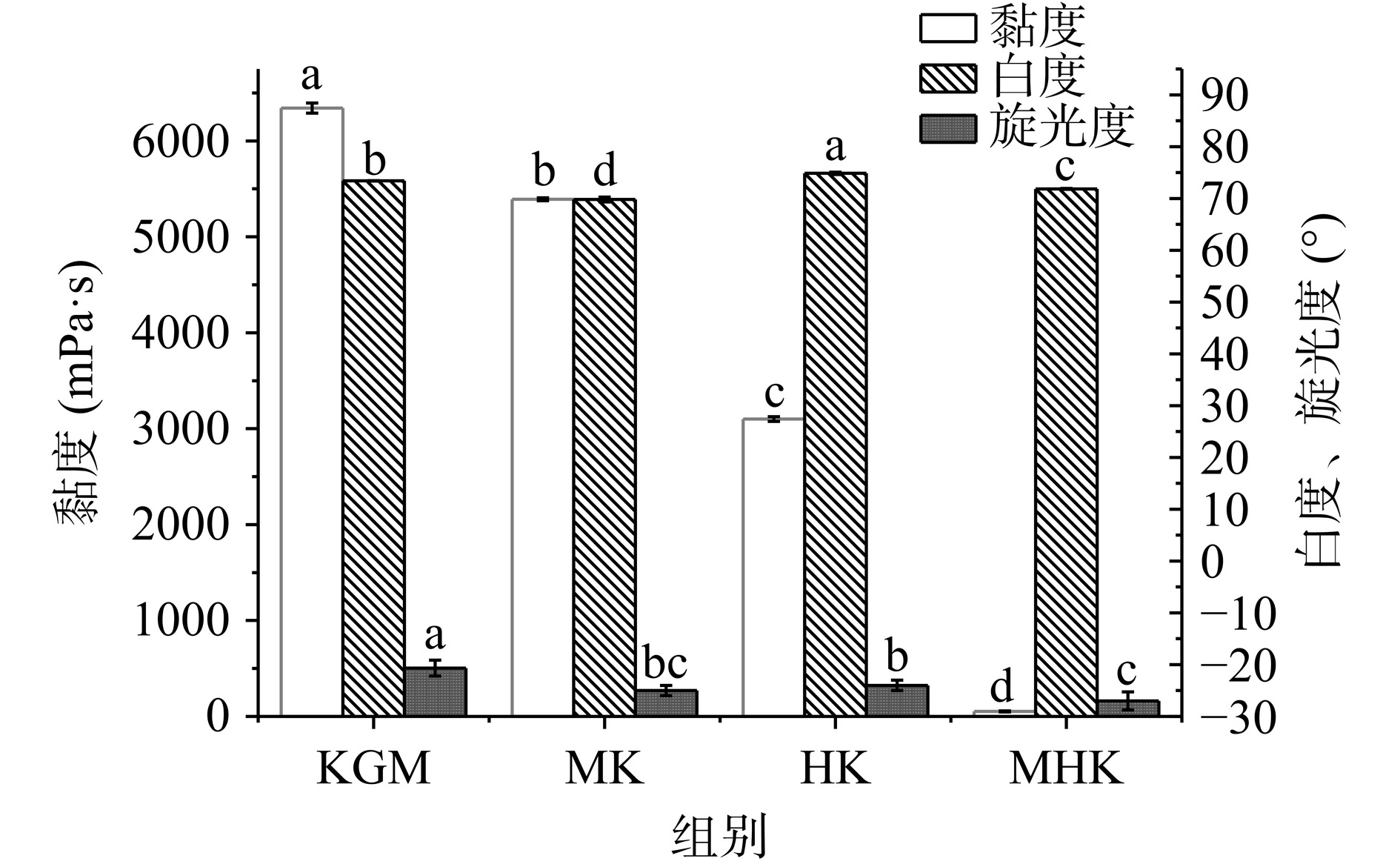
由表4、图4可知,经微波辅助过氧化氢处理,改性KGM的表观黏度、重均分子量、数均分子量均下降,变化规律均为:KGM>MK(微波)>HK(过氧化氢)>MHK(微波辅助过氧化氢),这与LUO等[33]研究结果一致,魔芋分子量越小,形成溶液分子间相互作用(氢键)越弱,其黏度越小;此外,分子链缠绕方式由复杂变得简单,使得溶胶物理交联减小也是KGM溶胶黏度减小的原因[34]。其中MK、HK和MHK的黏度相较KGM分别降低14.98%、51.12%、99.16%,且MHK黏度(53.33 mPa·s)显著小于MK、HK(P<0.05)。HK白度最好为74.85,MK白度最差为69.81。四种样品旋光性均为左旋,经微波、过氧化氢处理后样品旋光度均减小。相关研究表明,KGM相对分子质量与其水溶液黏度呈正相关,分子质量越小,KGM黏度越小,且较低分子量KGM具有更优良抗氧化性与益生性等[35]。
表 4 不同处理KGM的分子量Table 4. Molecular weight of KGM with different treatments组别 数均分子质量Mn(kDa) 重均分子质量Mw(kDa) 分散指数PDI KGM 254.42 347.31 1.37 MK 216.92 323.26 1.49 HK 191.16 282.47 1.48 MHK 96.90 158.26 1.63 总体而言,不同处理KGM降解效果为:单独微波处理<单独过氧化氢处理<微波辅助过氧化氢处理,证明微波和过氧化氢降解KGM具有显著协同作用,说明本研究复合半干法工艺制备低黏KGM的方法有效。本文微波辅助过氧化氢法(半干法工艺)的反应时长为3 min,相较阙凤等[19]的研究半干酶解法缩短了97.5%,魔芋粉黏度降低效果更好;与黄永春等[10]的湿法微波辅助过氧化氢法相比,减少了试剂过氧化氢、乙醇使用量,进一步说明本研究制备低黏魔芋粉采用的微波辅助过氧化氢氧化法(半干法工艺)更加高效和环保。
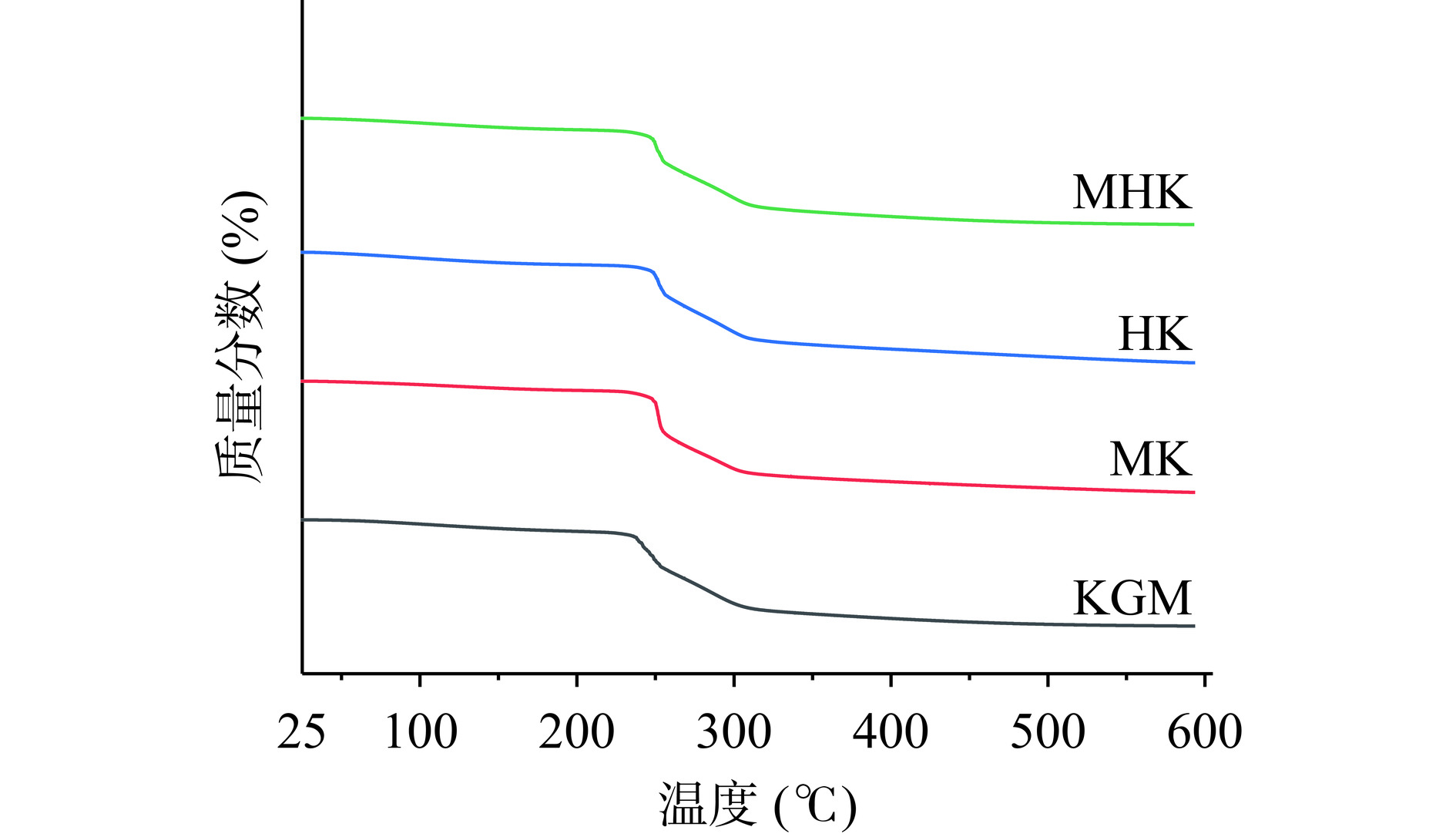
2.3.2 热稳定性分析
TG曲线如图5所示,所有样品均呈现三个阶段热降解模式。第一阶段,四种样品在30~200 ℃范围内质量损失基本一致,主要因为该阶段是其失去结合水和游离水而引起质量损失[36],即水分含量基本相同。第二阶段,220~400 ℃重量显著降低,归因于多糖链热分解产生气体或者发生碳化,包括羧基脱羧反应和糖链化学键断裂[37]。此阶段KGM、MK、HK、MHK质量损失率分别为64.63%、67.73%、62.57%、64.41%,其代表多糖自身热稳定性[38],降解前后热稳定性比较:HK>MHK>KGM>MK。第三阶段为400~600 ℃,魔芋葡甘聚糖热分解基本完成,为缓慢碳化阶段。说明MHK与其他三种样品一样,具有较好的热稳定性。
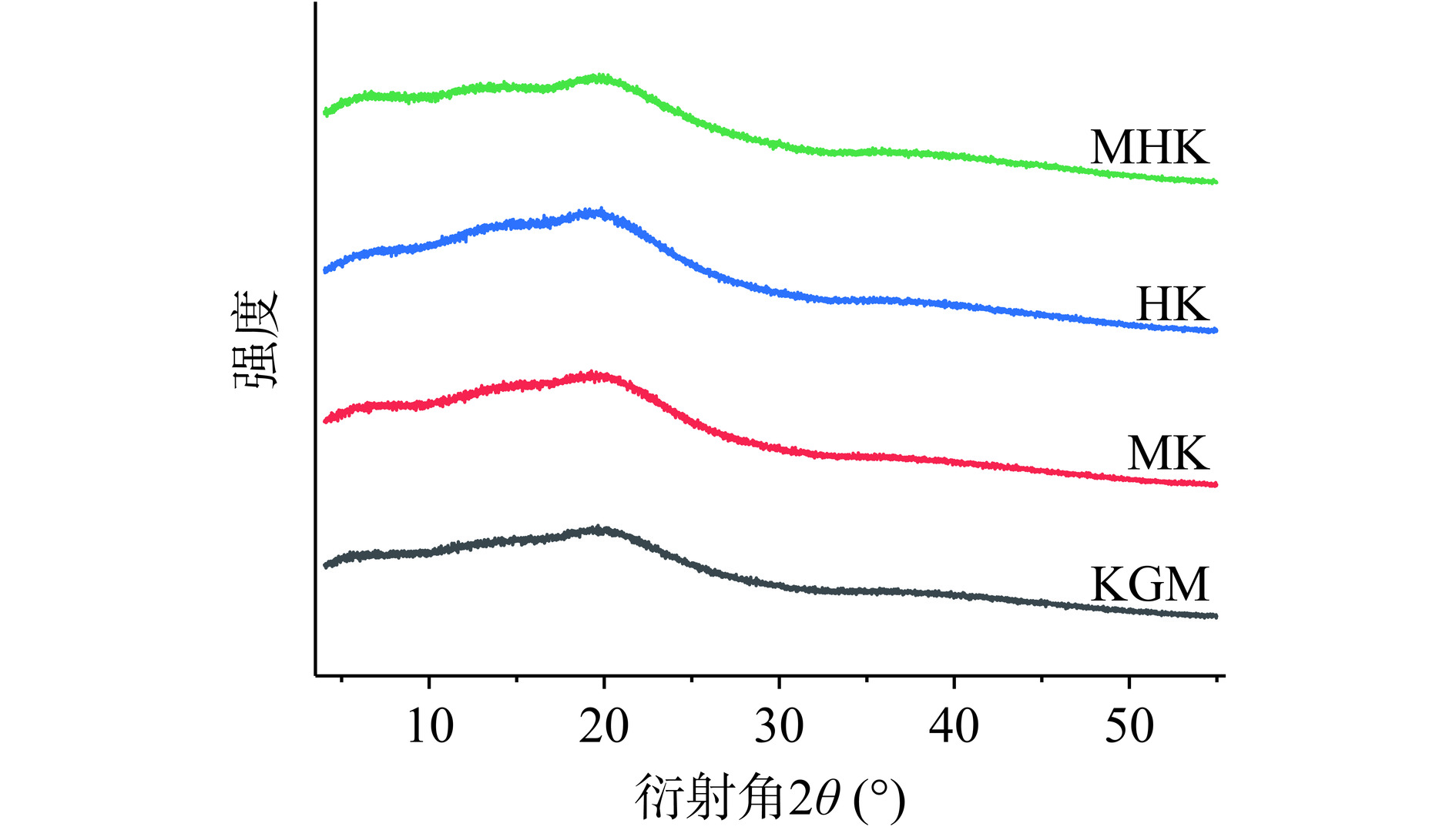
2.3.3 结晶度分析
KGM降解前后的XRD图谱相似,如图6所示均表现出无定形特征。所有样品在2θ=19.7°左右均显示出相对尖锐衍射峰,在13.6°左右有弱肩峰。Jade软件计算样品KGM、MK、HK、MHK的相对结晶度分别为23.22%、22.03%、20.38%、19.25%,说明微波、过氧化氢处理在一定程度上能够降低KGM结晶度,两种处理复合效果更明显,这与LI等[20]的研究结果相似。MK结果表明,微波降低KGM分子量导致部分规则结晶结构遭到破坏,形成低分子呈无规则堆积状态,结晶区消失。HK结果表明,氧化影响KGM聚集结构。一方面,这可能是由于氧化过程中颗粒内结构的混乱造成的。另一方面,KGM氧化后羧基引起静电排斥阻碍分子内氢键形成,导致聚合物结晶区被破坏,结晶度降低可能有助于提高其水溶性[39]。
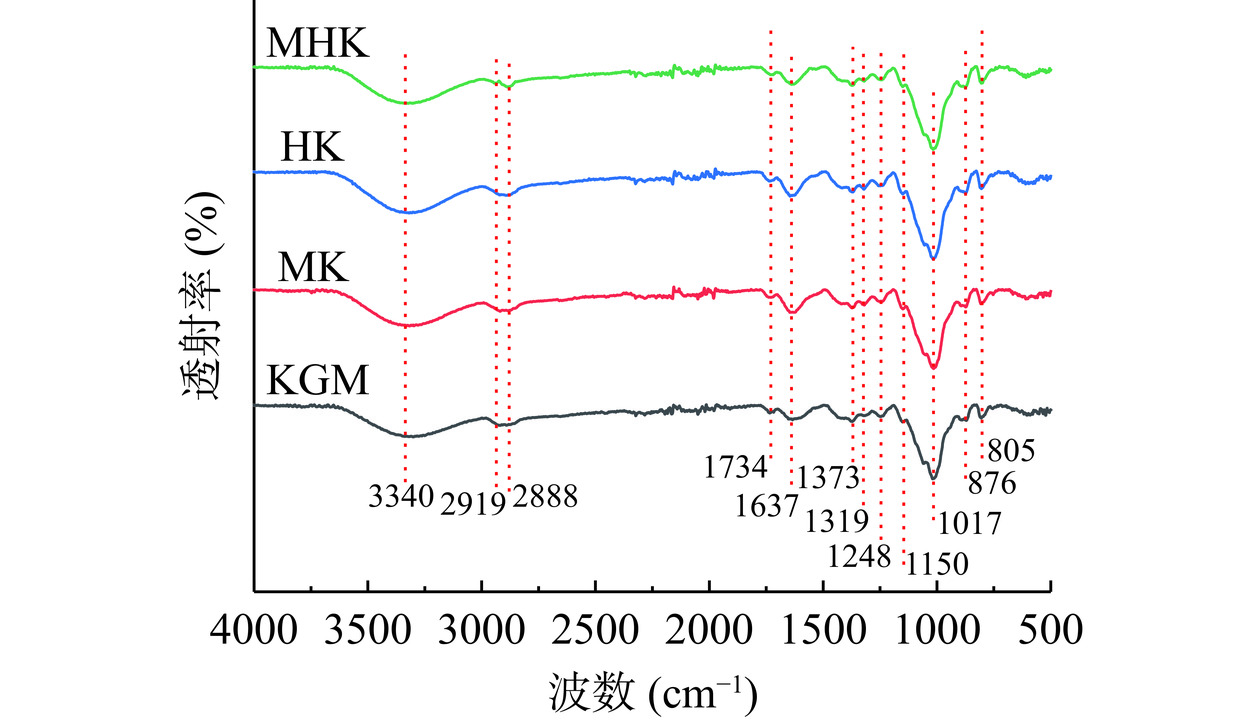
2.3.4 红外光谱分析
如图7所示,处理前后KGM的傅里叶变换红外光谱类似,魔芋葡甘聚糖的主链骨架没有明显变化,3340 cm−1附近吸收峰为糖单元分子内或分子间-OH伸缩振动所导致[40],证实氢键存在。位于1734 cm−1处吸收峰没有消失,表明KGM分子链上特色基团(酯羰基C=O)不会在本研究微波和过氧化氢加工条件下被完全脱除[41]。在876 cm−1和805 cm−1吸收峰归因于KGM分子上β-连接的甘露糖[20],四种样品具有相似频率。图中各红外光谱曲线相似,没有形成新官能团;但吸收峰强度发生变化,说明微波辅助过氧化氢处理并没有完全改变KGM化学基团组成,但存在KGM分子链断裂,可能有基团含量比例差异。因此,KGM降解后仍具备特征化学基团,其分子链断裂是造成其黏度下降的关键因素。
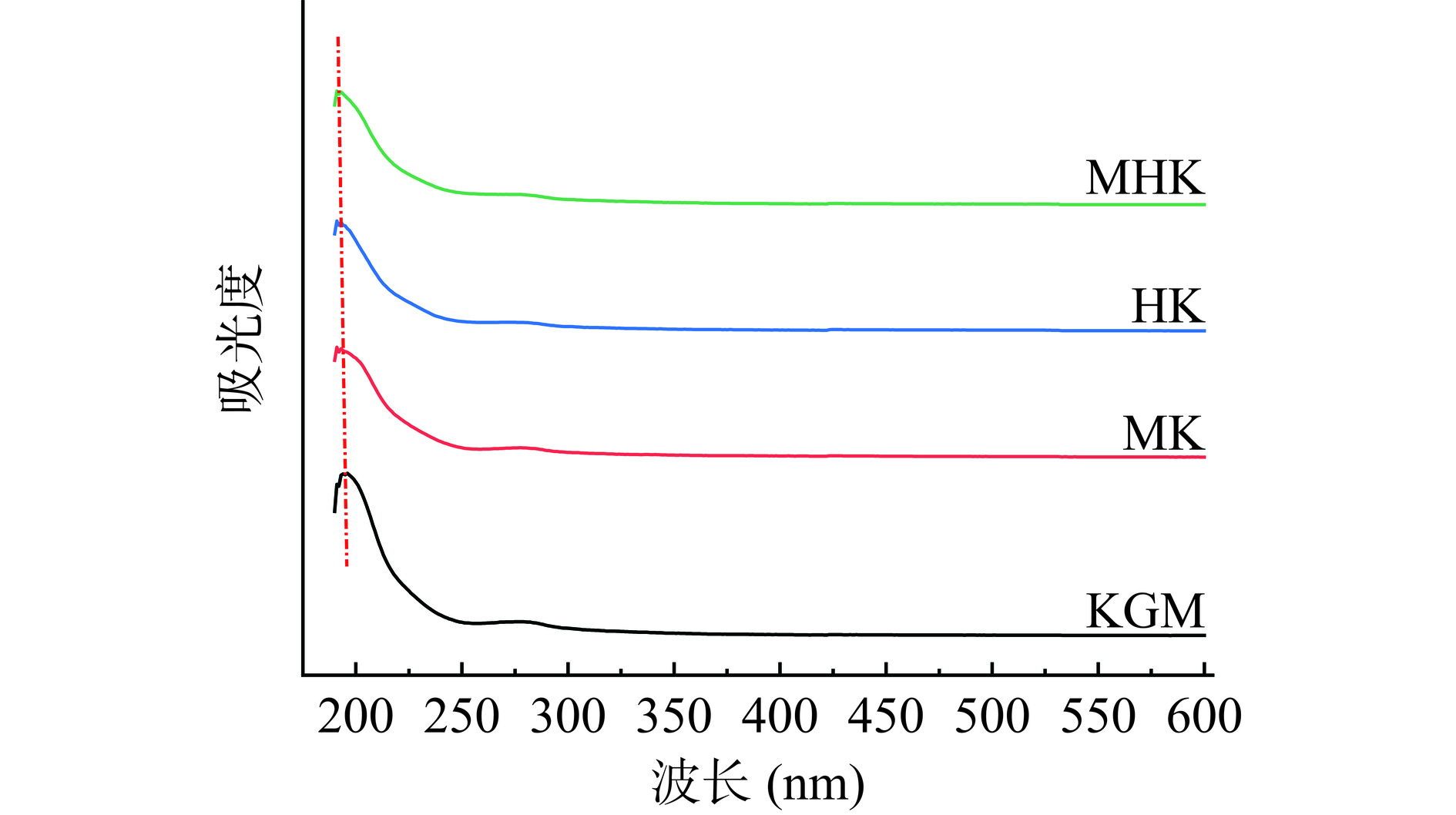
2.3.5 紫外可见光谱分析
紫外可见光谱在190~200、260和280 nm附近分别为多糖、核酸和蛋白质的特征吸收峰;如图8所示,处理前后魔芋粉在195 nm处均有最大吸收峰为多糖的特征曲线[42];在200~400 nm处无明显的吸收峰,表明魔芋粉可能含有极少量核酸和蛋白质。微波、过氧化氢降解没有改变KGM最大紫外吸收峰位置,并且无新吸收峰出现,这说明本文微波辅助过氧化氢处理不会破坏多糖特征基团,能最大保留KGM一些重要生物活性[35],该结果对于使用半干法制备的低黏KGM的应用有一定积极意义。
2.3.6 表观形貌分析
处理前后KGM在不同放大倍数(250倍、1000倍)观察到表观形貌如图9所示。KGM微观结构呈现高密度较完整的片层纤维结构[35],排列有序。微波处理的MK网络结构受到破坏,薄壁轻微破坏,线性结构仍致密有序,孔隙边缘较为光滑。过氧化氢处理的HK网络结构表现出较大的表层破坏,孔隙边缘粗糙,内部结构保持相对完整。微波辅助过氧化氢处理的MHK较KGM,完整薄壁已经被严重破坏,出现较大直径孔洞的同时,孔隙分布不均匀,其内部结构也变得更加稀疏、无序。这与彭曼曼等[43]的研究结果相似,KGM形成的网格结构较完整,大面积片状连续结构致使其有较高分子间摩擦力,因而表观黏度高。微波辅助过氧化氢处理,溶液表观黏度降低,这可能是其分子内和分子间氢键被破坏导致[19],分子链之间缠结减少,片状结构断裂,分子质量进一步减小。
2.3.7 生理特性
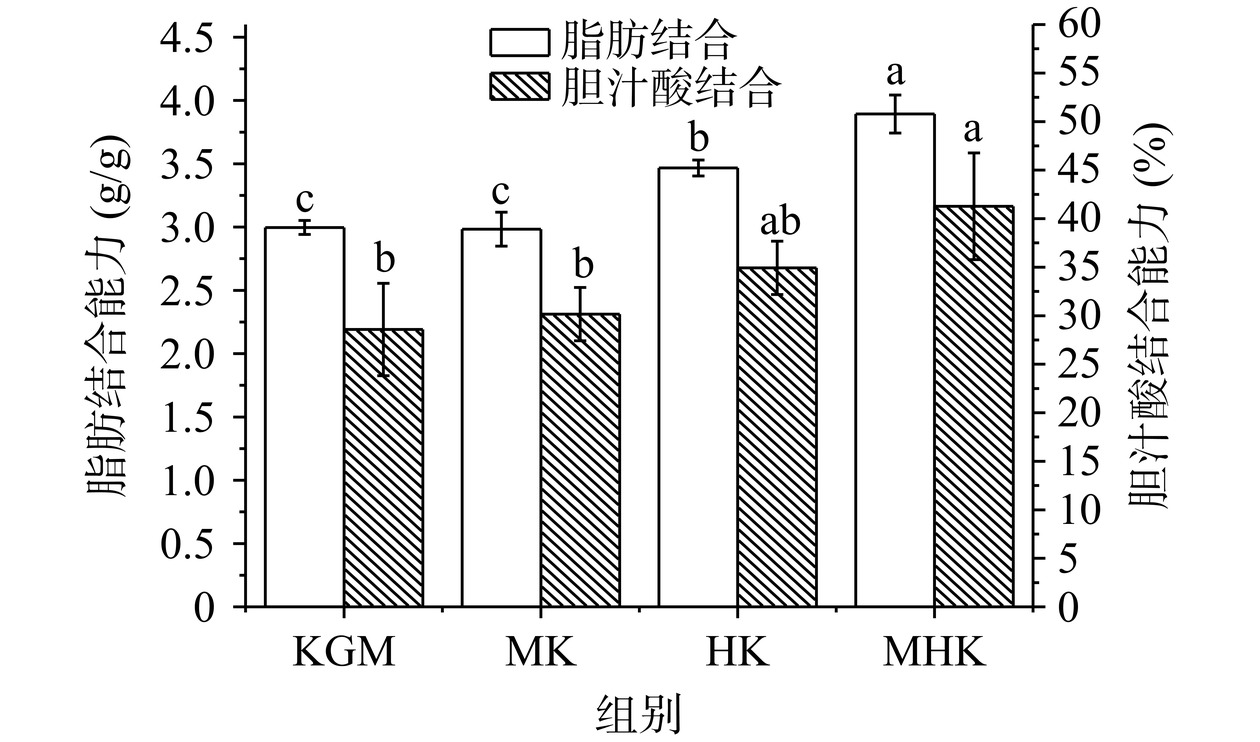
脂肪结合能力是预测多糖降血脂效果的重要指标,多糖在消化道中可以与脂肪结合,阻止身体吸收脂肪[23]。由图10可知,微波辅助过氧化氢氧化降解后KGM的脂肪结合能力显著增强,MHK的脂肪结合能力显著高于KGM、HK、MK(P<0.05)。胆汁酸与植物多糖的结合,可以加速胆汁酸在胃肠道排泄,促进肝脏中胆固醇代谢,降低血清总胆固醇水平,进一步有助于降低患心血管疾病的风险[44]。MHK表现出比KGM更强的胆汁酸结合能力,该结果与KIM等[45]、TANG等[25]采用离心法研究结果相似,低分子量多糖比高分子量结合更多的胆汁酸。氧化改性改善了KGM的生理性能,可能与氧化降解KGM后含有更多亲水羧基有关。因此,微波辅助过氧化氢氧化降解后的KGM表现出更好的脂肪结合、胆汁酸结合能力,对于低黏KGM应用于降血脂、降胆固醇等方面具有积极意义。
3. 结论
采用微波辅助过氧化氢法(半干法工艺)降解KGM制备低黏KGM。研究过氧化氢浓度、微波时间、液料比对KGM降解影响,经优化确定最佳条件:微波功率700 W、过氧化氢浓度3%、微波时间3 min,液料比0.75:1 mL/g,此条件下样品MHK黏度为(53.33±5.77)mPa·s,较未处理魔芋粉降低99.16%。比较KGM、MK、HK、MHK理化性质与结构发现,微波辅助过氧化氢处理降低了KGM表观黏度、分子量,这可能归因于多糖糖苷键断裂并伴随着羰基引入。XRD分析表明,微波辅助过氧化氢处理破坏KGM结晶区,降低其相对结晶度。扫描电镜结果说明微波和过氧化氢对KGM微观结构具有破坏作用。此外,MHK与KGM热稳定性相差很小,魔芋葡甘聚糖特征性基团也没有消失,这能最大保留KGM重要生物活性。微波辅助过氧化氢降解KGM的效果优于微波或过氧化氢单独处理KGM,进一步证实该方法可以高效、绿色、环保地制备低黏魔芋粉,低黏魔芋粉表现出更好的脂肪结合能力、胆汁酸结合能力,对功能性降解KGM在食品和药理行业的制备及应用具有积极意义。
-
表 1 正交试验因素与水平
Table 1 Orthogonal test factors and levels
水平 因素 A过氧化氢浓度(%) B微波时间(min) C液料比(mL/g) 1 2.0 2.0 0.50:1 2 2.5 2.5 0.75:1 3 3.0 3.0 1.00:1 表 2 正交试验结果
Table 2 Results of orthogonal test
试验号 因素 黏度(mPa·s) A 过氧化氢浓度(%) B 微波时间(min) C 液料比(mL/g) 1 2.0 2.0 0.50:1 541.67 2 3.0 2.0 0.75:1 383.33 3 2.5 2.0 1.00:1 441.67 4 3.0 2.5 0.50:1 225.00 5 2.5 2.5 0.75:1 175.00 6 2.0 2.5 1.00:1 266.67 7 2.5 3.0 0.50:1 93.33 8 2.0 3.0 0.75:1 108.33 9 3.0 3.0 1.00:1 83.33 k1 305.56 455.56 286.67 k2 236.67 222.22 222.22 k3 230.55 95.00 263.89 R 75.00 360.56 64.45 表 3 正交试验方差分析结果
Table 3 Results of variance analysis of orthogonal test
方差来源 平方和 自由度 均方 F P 过氧化氢浓度 10408.705 2 5204.352 19.357 0.049* 微波时间 200634.583 2 100317.291 373.121 0.003** 液料比 6408.538 2 3204.269 11.918 0.077 误差 537.720 2 268.860 注:R2=0.997,*P<0.05,**P<0.01。 表 4 不同处理KGM的分子量
Table 4 Molecular weight of KGM with different treatments
组别 数均分子质量Mn(kDa) 重均分子质量Mw(kDa) 分散指数PDI KGM 254.42 347.31 1.37 MK 216.92 323.26 1.49 HK 191.16 282.47 1.48 MHK 96.90 158.26 1.63 -
[1] 谭熙蕾, 徐燕, 周才琼. 魔芋葡甘露聚糖的功能特性及应用研究进展[J]. 食品研究与开发,2021,42(20):214−219. [TAN X L, XU Y, ZHOU C Q. Research progress on the functional properties and application of konjac glucomannan[J]. Food Research and Development,2021,42(20):214−219.] TAN X L, XU Y, ZHOU C Q. Research progress on the functional properties and application of konjac glucomannan[J]. Food Research and Development, 2021, 42(20): 214−219.
[2] DEVARAJ R D, REDDY C K, XU B. Health-promoting effects of konjac glucomannan and its practical applications:A critical review[J]. International Journal of Biological Macromolecules,2019,126:273−281. doi: 10.1016/j.ijbiomac.2018.12.203
[3] DU Q, LIU J, DING Y. Recent progress in biological activities and health benefits of konjac glucomannan and its derivatives[J]. Bioactive Carbohydrates and Dietary Fibre,2021,26:100270. doi: 10.1016/j.bcdf.2021.100270
[4] 冯莹, 阎燚刚, 熊家辉, 等. 珠芽魔芋营养成分的分析和测定[J]. 林业与环境科学,2023,39(5):96−100. [FENG Y, YAN Y G, XIONG J H, et al. Analysis and determination of nutrient components in Amorphophallus bulbifer[J]. Forestry and Environmental Science,2023,39(5):96−100.] doi: 10.3969/j.issn.1006-4427.2023.05.014 FENG Y, YAN Y G, XIONG J H, et al. Analysis and determination of nutrient components in Amorphophallus bulbifer[J]. Forestry and Environmental Science, 2023, 39(5): 96−100. doi: 10.3969/j.issn.1006-4427.2023.05.014
[5] 魏恩慧, 吴继红, 刘冰, 等. 魔芋葡甘聚糖的性质及在食品中的应用[J]. 食品工业,2016,37(5):239−242. [WEI E H, WU J H, LIU B, et al. Characterization and application of konjac glucomannan in food industry[J]. Food Industry,2016,37(5):239−242.] WEI E H, WU J H, LIU B, et al. Characterization and application of konjac glucomannan in food industry[J]. Food Industry, 2016, 37(5): 239−242.
[6] CHUA M, BALDWIN T C, HOCKING T J, et al. Traditional uses and potential health benefits of Amorphophallus konjac K. Koch ex N. E. Br.[J]. Journal of Ethnopharmacology,2010,128(2):268−278. doi: 10.1016/j.jep.2010.01.021
[7] 张东华, 汪庆平. 珠芽魔芋弥勒种(Amorphophallus muelleri)的生物学特性及发展前景[J]. 长江蔬菜,2010(22):71−73. [ZHANG D H, WANG Q P. Biology characteristic and prospect of Amorphophallus muelleri in plantation of konjac[J]. Journal of Changjiang Vegetables,2010(22):71−73.] ZHANG D H, WANG Q P. Biology characteristic and prospect of Amorphophallus muelleri in plantation of konjac[J]. Journal of Changjiang Vegetables, 2010(22): 71−73.
[8] YE S, ZONGO A W S, SHAH B R, et al. Konjac glucomannan (KGM), deacetylated KGM (Da-KGM), and degraded KGM derivatives:A special focus on colloidal nutrition[J]. Journal of Agricultural and Food Chemistry,2021,69(44):12921−12932. doi: 10.1021/acs.jafc.1c03647
[9] 秦清娟, 张媛, 刘倍毓, 等. 半干法酶解制备魔芋葡甘低聚糖工艺及其抗氧化性能研究[J]. 食品工业科技,2013,34(23):186−191. [QIN Q J, ZHANG Y, LIU B Y, et al. Optimization of the preparation of konjac oligo-glucomannan in semi-drying enzymatic hydrolysis method and its antioxidant capacity[J]. Science and Technology of Food Industry,2013,34(23):186−191.] QIN Q J, ZHANG Y, LIU B Y, et al. Optimization of the preparation of konjac oligo-glucomannan in semi-drying enzymatic hydrolysis method and its antioxidant capacity[J]. Science and Technology of Food Industry, 2013, 34(23): 186−191.
[10] 黄永春, 谢清若, 何仁, 等. 微波辅助H2O2降解魔芋葡甘聚糖的研究[J]. 食品科学,2005(8):197−200. [HUANG Y C, XIE Q R, HE R, et al. Study on the degradation of konjac glucomannan with H2O2 under the microwave[J]. Food Science,2005(8):197−200.] HUANG Y C, XIE Q R, HE R, et al. Study on the degradation of konjac glucomannan with H2O2 under the microwave[J]. Food Science, 2005(8): 197−200.
[11] 温丽华, 郑艺欣, 骆贤亮, 等. 协同改性膳食纤维的方法及其在食品加工中的应用研究进展[J]. 食品与发酵工业,2024,50(12):411−420. [WEN L H, ZHENG Y X, LUO X L, et al. Research progress on synergistic modification methods for dietary fiber and the application of modified dietary fiber in food processing[J]. Food and Fermentation Industries,2024,50(12):411−420.] WEN L H, ZHENG Y X, LUO X L, et al. Research progress on synergistic modification methods for dietary fiber and the application of modified dietary fiber in food processing[J]. Food and Fermentation Industries, 2024, 50(12): 411−420.
[12] 许艺娴, 周禹慧, 马小清, 等. 提取方法对真菌多糖得率及结构特征影响研究进展[J]. 食品与发酵工业,2022,48(5):289−301. [XU Y X, ZHOU Y H, MA X Q, et al. Research progress in the effect of extraction methods on the yield and structural characteristics of fungal polysaccharides[J]. Food and Fermentation Industries,2022,48(5):289−301.] XU Y X, ZHOU Y H, MA X Q, et al. Research progress in the effect of extraction methods on the yield and structural characteristics of fungal polysaccharides[J]. Food and Fermentation Industries, 2022, 48(5): 289−301.
[13] CHEN Z, WANG S, SHANG L, et al. An efficient and simple approach for the controlled preparation of partially degraded konjac glucomannan[J]. Food Hydrocolloids,2020,108:106017. doi: 10.1016/j.foodhyd.2020.106017
[14] HE Z, MA T, ZHANG W, et al. Heat-induced gel formation by whey protein isolate-Lycium barbarum polysaccharides at varying pHs[J]. Food Hydrocolloids,2021,115:106607. doi: 10.1016/j.foodhyd.2021.106607
[15] ZHOU S, HUANG G, CHEN G. Extraction, structural analysis, derivatization and antioxidant activity of polysaccharide from Chinese yam[J]. Food Chemistry,2021,361:130089. doi: 10.1016/j.foodchem.2021.130089
[16] ZHAO T, WANG J, WU Y, et al. Purification, characterization, anti-ulcerative colitis activity of Sanghuangporus vaninii acidic polysaccharide A-3 (SVP-A-3)[J]. Carbohydrate Polymer Technologies and Applications,2023,6:100387. doi: 10.1016/j.carpta.2023.100387
[17] 刘艳秋, 王亚茹, 毛迪锐, 等. 轮叶党参多糖的分离纯化及结构研究[J]. 食品与机械,2023,39(9):162−168,240. [LIU Y Q, WANG Y R, MAO D R, et al. Isolation, purification and structure analysis of polysaccharide from Lance Asiabell root[J]. Food & Machinery,2023,39(9):162−168,240.] LIU Y Q, WANG Y R, MAO D R, et al. Isolation, purification and structure analysis of polysaccharide from Lance Asiabell root[J]. Food & Machinery, 2023, 39(9): 162−168,240.
[18] YE S, ZHU J, SHAH B R, et al. Preparation and characterization of konjac glucomannan (KGM) and deacetylated KGM (Da-KGM) obtained by sonication[J]. Journal of the Science of Food and Agriculture,2022,102(10):4333−4344. doi: 10.1002/jsfa.11786
[19] 阙凤, 夏雨婷, 高天麒, 等. β-葡聚糖酶降解魔芋葡甘聚糖产物的制备及结构表征[J]. 食品科学,2023,44(8):9−15. [QUE F, XIA Y T, GAO T Q, et al. Preparation and structural characterization of β-dextranase hydrolytic products of konjac glucomannan[J]. Food Science,2023,44(8):9−15.] QUE F, XIA Y T, GAO T Q, et al. Preparation and structural characterization of β-dextranase hydrolytic products of konjac glucomannan[J]. Food Science, 2023, 44(8): 9−15.
[20] LI Y, LIU H, XIE Y, et al. Preparation, characterization and physicochemical properties of konjac glucomannan depolymerized by ozone assisted with microwave treatment[J]. Food Hydrocolloids,2021,119:106878. doi: 10.1016/j.foodhyd.2021.106878
[21] 马笑笑, 王兵, 刘会平, 等. 响应面法优化茭白多糖硫酸化工艺及其抗氧化活性分析[J]. 食品工业科技,2024,45(7):25−34. [MA X X, WANG B, LIU H P, et al. Optimization of sulfation process of Zizania latifolia polysaccharide by response surface and its antioxidant activity analysis[J]. Science and Technology of Food Industry,2024,45(7):25−34.] MA X X, WANG B, LIU H P, et al. Optimization of sulfation process of Zizania latifolia polysaccharide by response surface and its antioxidant activity analysis[J]. Science and Technology of Food Industry, 2024, 45(7): 25−34.
[22] YIN J Y, MA L Y, XIE M Y, et al. Molecular properties and gut health benefits of enzyme-hydrolyzed konjac glucomannans[J]. Carbohydrate Polymers,2020,237:116117. doi: 10.1016/j.carbpol.2020.116117
[23] LONG X, XIE J, XUE B, et al. Effect of oxidative modification on physicochemical and functional properties of soybean polysaccharides[J]. Journal of Molecular Structure,2022,1262:133047. doi: 10.1016/j.molstruc.2022.133047
[24] 巫永华, 黄莉莉, 王解语, 等. 深共熔溶剂提取桑黄黄酮及体外降血糖、结合胆酸盐能力分析[J]. 食品与发酵工业,2024,50(11):128−136. [WU Y H, HUANG L L, WANG J Y, et al. Deep eutectic solvent extraction of Phellinus igniarius flavonoids and its hypoglycemic and bile salts-binding abilities[J]. Food and Fermentation Industries,2024,50(11):128−136.] WU Y H, HUANG L L, WANG J Y, et al. Deep eutectic solvent extraction of Phellinus igniarius flavonoids and its hypoglycemic and bile salts-binding abilities[J]. Food and Fermentation Industries, 2024, 50(11): 128−136.
[25] TANG H B, WANG L, LI Y P, et al. Effect of acidolysis and oxidation on structure and properties of konjac glucomannan[J]. International Journal of Biological Macromolecules,2019,130:378−387. doi: 10.1016/j.ijbiomac.2019.02.048
[26] 洪润, 柳叶, 李易蔚. 高得率浆过氧化氢漂白的研究进展[J]. 纸和造纸,2024,43(1):7−10. [HONG R, LIU Y, LI Y W. The research progress of hydrogen peroxide bleaching in high yield pulp[J]. Paper and Paper Making,2024,43(1):7−10.] HONG R, LIU Y, LI Y W. The research progress of hydrogen peroxide bleaching in high yield pulp[J]. Paper and Paper Making, 2024, 43(1): 7−10.
[27] 邬应龙. 漂白魔芋微粉的结构与特性研究[D]. 杭州:浙江大学, 2007. [WU Y L. Study on the structural characteristics and properties of bleached pulverized konjac flour[D]. Hangzhou:Zhejiang University, 2007.] WU Y L. Study on the structural characteristics and properties of bleached pulverized konjac flour[D]. Hangzhou: Zhejiang University, 2007.
[28] WARDHANI D H, ULYA H N, MAULANA I, et al. Analyzing the characteristics of degraded glucomannan of Amorphophallus oncophyllus using hydrogen peroxide and ultrasonication[J]. AIMS Agriculture and Food,2023,8(2):566−584. doi: 10.3934/agrfood.2023031
[29] LI K, XING R, LIU S, et al. Microwave-assisted degradation of chitosan for a possible use in inhibiting crop pathogenic fungi[J]. International Journal of Biological Macromolecules,2012,51(5):767−773. doi: 10.1016/j.ijbiomac.2012.07.021
[30] FANG Y, MA J, LEI P, et al. Konjac glucomannan:An emerging specialty medical food to aid in the treatment of type 2 diabetes mellitus[J]. Foods,2023,12(2):363. doi: 10.3390/foods12020363
[31] 彭谦, 周鹏程, 徐同成, 等. H2O2降解多糖的作用机制及降解产物构效关系研究进展[J/OL]. 食品与发酵工业:1−9. [2024-01-25]. DOI:10.13995/j.cnki.11-1802/ts.037846. [PENG Q, ZHOU P X, XU T C, et al. Research progress on mechanism of polysaccharide degradation by H2O2 and structure-activity relationship of degradation products[J/OL]. Food and Fermentation Industries: 1−9. [2024-01-25]. DOI:10.13995/j.cnki.11-1802/ts.037846.] PENG Q, ZHOU P X, XU T C, et al. Research progress on mechanism of polysaccharide degradation by H2O2 and structure-activity relationship of degradation products[J/OL]. Food and Fermentation Industries: 1−9. [2024-01-25]. DOI: 10.13995/j.cnki.11-1802/ts.037846.
[32] 李小菊, 张越非, 钟玲, 等. 响应曲面法优化微波辅助提取魔芋葡甘露聚糖的工艺研究[J]. 时珍国医国药,2013,24(3):525−529. [LI X J, ZHANG Y F, ZHONG L, et al. Optimization of microwave assisted the extraction of konjac glucomannan by response surface methodology[J]. Lishizhen Medicine and Materia Medica Research,2013,24(3):525−529.] LI X J, ZHANG Y F, ZHONG L, et al. Optimization of microwave assisted the extraction of konjac glucomannan by response surface methodology[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(3): 525−529.
[33] LUO X, YAO X, ZHANG C, et al. Preparation of mid-to-high molecular weight konjac glucomannan (MHKGM) using controllable enzyme-catalyzed degradation and investigation of MHKGM properties[J]. Journal of Polymer Research,2012,19(4):9849. doi: 10.1007/s10965-012-9849-x
[34] 唐晓东. β-甘露聚糖酶降解对魔芋葡甘聚糖结构、黏度性质的影响[J]. 粮食加工,2022,47(4):59−62,67. [TANG X D. Effects of β-mannanase degradation on structure and viscosity properties of konjac glucomannan[J]. Grain Processing,2022,47(4):59−62,67.] doi: 10.3969/j.issn.1007-6395.2022.4.xblykj202204015 TANG X D. Effects of β-mannanase degradation on structure and viscosity properties of konjac glucomannan[J]. Grain Processing, 2022, 47(4): 59−62,67. doi: 10.3969/j.issn.1007-6395.2022.4.xblykj202204015
[35] 唐兰兰, 张世奇, 卫子颜, 等. 红外烘烤对魔芋葡甘露聚糖表观黏度以及微观结构的影响[J]. 食品科学,2021,42(17):98−105. [TANG L L, ZHANG S Q, WEI Z Y, et al. Effect of infrared baking on apparent viscosity and microstructure of konjac glucomannan[J]. Food Science,2021,42(17):98−105.] TANG L L, ZHANG S Q, WEI Z Y, et al. Effect of infrared baking on apparent viscosity and microstructure of konjac glucomannan[J]. Food Science, 2021, 42(17): 98−105.
[36] 葛珍珍, 许明月, 靳学远, 等. 脱乙酰基魔芋葡甘聚糖理化性质及其对凉皮质构和体外消化的影响[J]. 食品科学,2023,44(4):85−90. [GE Z Z, XU M Y, JIN X Y, et al. Physicochemical properties of deacetylated konjac glucomannan and its effects on the quality and in vitro digestion characteristics of cold noodles[J]. Food Science,2023,44(4):85−90.] GE Z Z, XU M Y, JIN X Y, et al. Physicochemical properties of deacetylated konjac glucomannan and its effects on the quality and in vitro digestion characteristics of cold noodles[J]. Food Science, 2023, 44(4): 85−90.
[37] 徐雅琴, 杨海红, 李大龙, 等. 黑加仑果实降解多糖理化特性、结构及体外降血糖活性[J]. 食品科学,2021,42(15):37−43. [XU Y Q, YANG H H, LI D L, et al. Physicochemical properties, structural characterization and hypoglycemic activity in vitro of degraded polysaccharides from blackcurrants[J]. Food Science,2021,42(15):37−43.] XU Y Q, YANG H H, LI D L, et al. Physicochemical properties, structural characterization and hypoglycemic activity in vitro of degraded polysaccharides from blackcurrants[J]. Food Science, 2021, 42(15): 37−43.
[38] 王生琳, 宰清勇, 陈华国, 等. 5种枸杞多糖生物活性的比较研究[J]. 中国中药杂志,2024,49(1):110−122. [WANG S L, ZAI Q Y, CHEN H G, et al. Comparison on biological activities of Lycium barbarum polysaccharides extracted with five methods[J]. China Journal of Chinese Materia Medica,2024,49(1):110−122.] WANG S L, ZAI Q Y, CHEN H G, et al. Comparison on biological activities of Lycium barbarum polysaccharides extracted with five methods[J]. China Journal of Chinese Materia Medica, 2024, 49(1): 110−122.
[39] CHEN Y, ZHAO H, LIU X, et al. TEMPO-oxidized konjac glucomannan as appliance for the preparation of hard capsules[J]. Carbohydrate Polymers,2016,143:262−269. doi: 10.1016/j.carbpol.2016.01.072
[40] 胡艳, 李悦, 吴玉萍, 等. 低浓度乙醇对魔芋葡甘聚糖理化特性及其结构影响的研究[J]. 食品与发酵工业,2024,50(14):233−239. [[HU Y, LI Y, WU Y P, et al. Effects of low-concentration ethanol on physicochemical properties and structure of konjac glucomannan[J]. Food and Fermentation Industries,2024,50(14):233−239.] [HU Y, LI Y, WU Y P, et al. Effects of low-concentration ethanol on physicochemical properties and structure of konjac glucomannan[J]. Food and Fermentation Industries, 2024, 50(14): 233−239.
[41] 李恒杰, 汪师帅. 不同黏度的魔芋葡甘聚糖制备及在吐司中的应用[J]. 粮食与油脂,2021,34(12):33−36. [LI H J, WANG S S. Preparation of konjac glucomannan with different viscosity and its application in toast[J]. Cereals & Oils,2021,34(12):33−36.] LI H J, WANG S S. Preparation of konjac glucomannan with different viscosity and its application in toast[J]. Cereals & Oils, 2021, 34(12): 33−36.
[42] 涂晓媛, 褚路路, 王冕, 等. 珊瑚状猴头菇多糖的提取及其体外抗氧化活性分析[J]. 生物技术通报,2023,39(12):276−286. [TU X Y, CHU L L, WANG M, et al. Extraction of polysaccharide from Hericium corallinum and analysis on its in vitro antioxidant activity[J]. Biotechnology Bulletin,2023,39(12):276−286.] TU X Y, CHU L L, WANG M, et al. Extraction of polysaccharide from Hericium corallinum and analysis on its in vitro antioxidant activity[J]. Biotechnology Bulletin, 2023, 39(12): 276−286.
[43] 彭曼曼, 吴思凝, 迪珂君, 等. 超声处理对魔芋葡甘聚糖流变与结构的影响[J]. 食品与发酵工业,2020,46(3):152−159. [PENG M M, WU S N, DI K J, et al. Effect of ultrasonic treatment on the rheology and structure of konjac glucomannan[J]. Food and Fermentation Industries,2020,46(3):152−159.] PENG M M, WU S N, DI K J, et al. Effect of ultrasonic treatment on the rheology and structure of konjac glucomannan[J]. Food and Fermentation Industries, 2020, 46(3): 152−159.
[44] CHEN Z L, WANG C, MA H, et al. Physicochemical and functional characteristics of polysaccharides from okra extracted by using ultrasound at different frequencies[J]. Food Chemistry,2021,361:130138. doi: 10.1016/j.foodchem.2021.130138
[45] KIM H J, WHITE P J. In vitro bile-acid binding and fermentation of high, medium, and low molecular weight β-glucan[J]. Journal of Agricultural and Food Chemistry,2010,58(1):628−634. doi: 10.1021/jf902508t





 下载:
下载:

 下载:
下载:



