Preparation, Identification, and Enzyme Inhibition Kinetic Analysis of Phosvitin α-Amylase Inhibitory Peptides
-
摘要: 为探索卵黄高磷蛋白肽(phosvitin phosphopeptide,PPP)对α-淀粉酶的抑制作用,使其能够调控血糖水平从而缓解Ⅱ型糖尿病,本研究以α-淀粉酶抑制率为指标酶解卵黄高磷蛋白制备PPP,利用酶抑制动力学实验分析PPP对α-淀粉酶的抑制类型,采用液质联用鉴定后用分子对接筛选出高活性的α-淀粉酶抑制肽,最后验证其活性。结果表明,最优酶解条件为先经胰蛋白酶(加酶量7000 U/g)再经胃蛋白酶(加酶量60000 U/g)分别酶解6 h,制得的PPP在浓度7.81×10−3 mg/mL时具有最高α-淀粉酶抑制率70.69%±1.71%。PPP对α-淀粉酶的抑制类型为混合型抑制。鉴定筛选出了两种新型的高活性α-淀粉酶抑制肽FGTEPDAK和IWGR,经验证其IC50值分别为(0.80±0.14)×10−3 mg/mL和(1.80±0.31)×10−3 mg/mL,极显著低于阳性对照阿卡波糖(3.17±0.47)×10−3 mg/mL(P<0.01)。本研究揭示PPP可作为新型降糖物质,应用于缓解Ⅱ型糖尿病的功能性食品开发中。Abstract: To explore the inhibiting effect of phosvitin phosphopeptide (PPP) on α-amylase, enabling it to regulate blood glucose levels and alleviate type Ⅱ diabetes mellitus. This study employed enzymatic hydrolysis of phosvitin with the inhibition rate of α-amylase as an index, followed by enzyme inhibition kinetics experiments to analyze the inhibitory type of PPP on α-amylase. LC-MS identification was conducted, and molecular docking was performed to screen for highly active α-amylase inhibitory peptides, which were subsequently validated. The results showed that optimal enzymatic hydrolysis conditions involved initial hydrolysis with trypsin (7000 U/g), followed by pepsin (60000 U/g) for 6 h each. The prepared PPP exhibited the highest α-amylase inhibition rate 70.69%±1.71% at a concentration of 7.81×10−3 mg/mL. PPP acted as a mixed-type inhibitor. Two novel highly active α-amylase inhibitory peptides FGTEPDAK and IWGR were identified and screened, exhibiting IC50 values of (0.80±0.14)×10−3 mg/mL and (1.80±0.31)×10−3 mg/mL, respectively. Both extremely significantly lower than the positive control acarbose's IC50 value (3.17±0.47)×10−3 mg/mL (P<0.01). This study highlights the potential use of PPP as a new hypoglycemic substance in developing functional foods for alleviating type Ⅱ diabetes mellitus.
-
糖尿病是一种严重的代谢性疾病,对人类健康危害极大[1−2]。Ⅱ型糖尿病患者约占糖尿病患者总数的90%,是最主要的一类,其重要特征为餐后血糖水平持续升高[3]。α-淀粉酶是小肠中催化水解淀粉的主要消化酶之一。抑制α-淀粉酶的活性能够减缓淀粉水解,起到控制血糖水平作用,从而对Ⅱ型糖尿病的干预产生积极影响[4−5]。目前临床上有许多有效的α-淀粉酶抑制剂,如阿卡波糖、二甲双胍、米格列醇等,但这些抑制剂通常伴随许多副作用,如腹胀、腹泻、腹痛[5−8]。因此,寻求更安全、有效的α-淀粉酶抑制剂很有必要。
研究发现,食源性多肽具有α-淀粉酶抑制作用。战旭梅等[9]以玉米为原料制备出玉米蛋白多肽,其α-淀粉酶抑制率为15.01%。李永富等[10]研究发现含有较多疏水性氨基酸的绿豆蛋白肽具有α-淀粉酶抑制活性,最高抑制率可达39.83%。周浩纯等[11]对亚麻籽饼粕蛋白进行酶解,其水解物对α-淀粉酶的抑制活性为27%。苏娜等[12]从骆驼蛋白水解物中鉴定出两条新型多肽HAGPTWNPISIGISFM和IPLPLPLPLP,其抑制α-淀粉酶的IC50值分别为0.067 mg/mL和0.039 mg/mL。食源性α-淀粉酶抑制肽因其安全有效展现出了良好的应用前景。然而,当前研究制备的活性肽对α-淀粉酶的抑制效果还不够高效,效果仍低于阿卡波糖,极大地限制了其实际应用。因此继续探索和寻找更加高效的α-淀粉酶抑制肽具有重要意义。
卵黄高磷蛋白(phosvitin,PV)来源于鸡蛋蛋黄,经酶解后可制备卵黄高磷蛋白多肽(phosvitin phosphopeptide,PPP)[13]。大量研究显示,含有疏水性氨基酸和碱性氨基酸的多肽,对α-淀粉酶具有抑制作用[4−8]。在PV蛋白序列的两端,含有许多疏水性氨基酸,如苯丙氨酸、脯氨酸、丙氨酸、异亮氨酸、色氨酸,以及碱性氨基酸,如赖氨酸、精氨酸等。这意味着PV经过各种水解酶作用成为PPP后,可能具有一定的α-淀粉酶抑制活性。以往的研究中,学者们广泛关注于PPP的金属螯合、抗氧化、抗菌等活性作用[13−17],未曾有过干预Ⅱ型糖尿病的相关研究。因此,本研究的目的是酶解制备PPP,探索其对α-淀粉酶的抑制作用,分析抑制类型,且鉴定筛选出α-淀粉酶最高抑制作用的活性肽段,为PPP应用于缓解Ⅱ型糖尿病的新型功能性食品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
褐壳鸡蛋 购于天津市滨海新区洞庭路明耀超市,原产地为河北省邯郸市馆陶县金鹏养鸡场;α-淀粉酶(50 U/mg) 生物试,美国SIGMA公司;胰蛋白酶(250 U/mg)、胃蛋白酶(10000 U/g) 生物试,北京索莱宝生物科技有限公司;其它试剂均为国产分析纯。
DF-101S磁力搅拌器 杭州旌斐仪器科技有限公司;H1850高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;BK-FD105冷冻干燥机 山东博科生物产业有限公司;FE28-Standard pH计 上海梅特勒-托利多仪器有限公司;MK3酶标仪 美国BIO-TEK 公司;DKB-501A恒温振荡摇床 上海信森实验仪器公司;DK-98-2电热恒温水浴锅 上海虔钧科学仪器。
1.2 实验方法
1.2.1 PPP的制备
从鸡蛋中提取PV[13],并对其进行高温高压(120 ℃、0.14 MPa)预处理[17],制得酶解前的PV蛋白粉末。参考相关文献[9−12]并进行预实验,选用胃蛋白酶、胰蛋白酶对PV蛋白粉末进行酶解以制备PPP,以α-淀粉酶抑制率为指标,探索最佳酶解制备条件。
1.2.1.1 单酶酶添加量的确定
PV蛋白粉末用去离子水制备成10 mg/mL的底物溶液[17]。按照40000 U/g(酶/蛋白)、50000 U/g(酶/蛋白)、60000 U/g(酶/蛋白)、70000 U/g(酶/蛋白)的比例加入胃蛋白酶,胃蛋白酶最适pH2.0,最适温度37 ℃。按照3000 U/g(酶/蛋白)、5000 U/g(酶/蛋白)、7000 U/g(酶/蛋白)、9000 U/g(酶/蛋白)的比例加入胰蛋白酶,胰蛋白酶最适pH8.5,最适温度37 ℃。通过0.1 mol/L的NaOH溶液或HCl溶液调整溶液pH至酶的最适pH,并在酶的最适温度下恒温反应。酶解反应24 h后,样品在85 ℃下水浴灭酶10 min,冷却至室温后,10000×g离心5 min,取上清,冻干后备用,测定其α-淀粉酶抑制率。
1.2.1.2 单酶酶解时间的确定
在上述基础上,确定了胃蛋白酶和胰蛋白酶的最适酶添加量。取适量PV底物溶液,两种酶分别按照确定的最适比例进行添加,并在最适pH和温度下进行恒温反应。每隔固定时间取样(取样时间为6、12、18、24、30 h),样品在85 ℃下水浴灭酶10 min,冷却后10000×g离心5 min,取上清,冻干后备用,测定其α-淀粉酶抑制率。
1.2.1.3 复合酶解顺序的确定
在上述基础上,确定了胃蛋白酶和胰蛋白酶的最适加酶量和最适酶解时间。复合酶解顺序分为两种方式,第一种方式为先添加胃蛋白酶后添加胰蛋白酶酶解,操作步骤为:取适量PV底物溶液,调整pH和温度,首先在胃蛋白酶的最适酶解条件下进行酶解。酶解完成后,85 ℃水浴灭酶10 min,冷却后调整pH和温度,再在胰蛋白酶的最适酶解条件下继续进行酶解。酶解完成后,85 ℃水浴灭酶10 min,冷却后10000×g离心5 min,取上清,冻干后备用,测定其α-淀粉酶抑制率。第二种方式为先添加胰蛋白酶后添加胃蛋白酶酶解,操作步骤类同酶解方式一。
1.2.2 PPP对α-淀粉酶抑制率的测定
PPP对α-淀粉酶抑制率的测定参考苏娜等[12]的方法,稍加修改,并通过预实验,确定样品、α-淀粉酶和淀粉溶液的浓度。以阿卡波糖为阳性对照,用PBS溶液(0.1 mol/L,pH6.8)分别配制样品溶液((1.95~1000)×10−3 mg/mL)、α-淀粉酶(50 U/mL)和淀粉溶液(20 mg/mL)。将25 μL不同浓度的样品溶液(阿卡波糖溶液、不同酶解条件下制备的PPP溶液)添加到25 μL α-淀粉酶溶液中,并在37 ℃环境下孵育10 min。孵育完成后,加入25 μL淀粉溶液,在沸水浴中反应15 min,反应完成后,立刻冰水浴冷却至室温。继续进行显色和测定吸光度操作:加入50 μL二硝基水杨酸(DNS)试剂,并在95 ℃下加热5 min进行反应。反应完成后,立刻冰水浴冷却至室温。随后将混合物加入750 μL去离子水,1000×g离心5 min。将上清液(200 μL)移入96孔板中,用酶标仪在540 nm处测定吸光度。α-淀粉酶的抑制活性使用公式(1)计算:
α-淀粉酶抑制率(%)=Ac−(As−Ab)Ac×100 (1) 式中:As表示测定样品的吸光度;Ab表示用PBS代替α-淀粉酶反应测定的吸光度;Ac表示用PBS代替样品反应测定的吸光度。
1.2.3 PPP对α-淀粉酶的酶抑制动力学分析
PPP对α-淀粉酶的抑制类型通过酶抑制动力学实验确定,参考袁向华等[18]的方法,稍作修改。用PBS溶液(0.1 mol/L,pH6.8)配制淀粉溶液、α-淀粉酶溶液(50 U/mL)和样品溶液。
测定α-淀粉酶的米氏常数Km:将50 μL不同浓度的淀粉溶液(0~10 mg/mL)和25 μL α-淀粉酶溶液分别混合。沸水浴加热15 min后,立刻冰水浴冷却至室温。后续显色和测定吸光度的操作同1.2.2中的操作描述。
测定α-淀粉酶与样品溶液反应后的米氏常数Km:将25 μL样品溶液(1.95×10−3 mg/mL和1 mg/mL)和25 μL α-淀粉酶溶液分别混合,随后在37 ℃环境下反应10 min。反应完成后,再分别加入25 μL不同浓度的淀粉溶液(0~20 mg/mL),沸水浴加热15 min以充分反应。反应完成后,立刻冰水浴冷却至室温。后续显色和测定吸光度的操作同1.2.2中的操作描述。根据米氏方程[19],以底物浓度倒数为横坐标,反应速度倒数为纵坐标,绘制双倒数曲线,并计算动力学参数。
1.2.4 PPP的肽段序列鉴定
PPP的鉴定分析委托杭州科学指南针有限公司采用液相色谱质谱联用/串联质谱技术(liquid chromatography-mass spectrometry/tandem mass spectrometry,LC-MS/MS)完成。具体步骤为:最佳复合酶解条件下制备的PPP加入0.1%的甲酸水溶液复溶,配制为5×10−7 mg/mL的溶液。液相所用的A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱(0.15 mm×150 mm,RP-C18,Column科技公司)以95%的A液进行平衡,柱温为40 ℃。10 μL样品由自动进样器上样到Zorbax 300SB-C18 peptide traps(安捷伦,威尔明顿,DE),再经过液相色谱柱分离。相关液相梯度洗脱程序设置如下:第0~50 min内,B液线性梯度从5%增加到50%,A液线性梯度从95%降至50%;第50~54 min内,B液线性梯度从50%增加到100%,A液线性梯度从50%降至0%;第54~60 min,B液维持在100%,A液维持在0%。PPP经高效液相色谱分离后用Q Exactive HF-X质谱仪进行质谱分析,分析时长:60 min。检测方式为正离子,母离子扫描范围为300~1800 m/z,一级质谱分辨率为7×104(m/z≤200),自动增益控制靶标设置为3×106,最大循环次数为1×10−2 s,动态排除时间为40 s。多肽和多肽的碎片的m/z按照下列方法采集:每次全扫描后采集10个碎片图谱,碎片图谱激活类型为高能碰撞解离,隔离窗为2 m/z,二级质谱分辨率为1.75×104(m/z≤200),归一化碰撞能量为30 eV,未填充率为0.1%。最后对质谱测定的原始文件(Raw File)用Maxquant软件(版本号2.1.1.1)进行检索,基于Uniprot(www.uniprot.org)下载的P02845蛋白数据库[14]进行多肽鉴定及半定量分析。
1.2.5 PPP的筛选
对LC-MS/MS鉴定得到的多肽进行分子对接筛选分析,以获得潜在的最具α-淀粉酶抑制活性的多肽。所有肽段的三维结构均使用ChemDraw和Chem 3D软件构建。利用PDB数据库(http://www.rcsb.org/pdb)获取α-淀粉酶(PDB ID: 1PIF)三维晶体结构。配体和受体结构在对接前均利用Pymol软件进行预处理。使用AutoDock Vina软件对配体和α-淀粉酶受体进行对接。对接结果通过LigPlot+软件进行分析。对接结合能和氢键数目作为主要筛选标准。
1.2.6 多肽合成及活性验证
筛选出的多肽委托合肥科生景肽生物科技有限公司进行合成。合成肽的纯度为98%以上。并通过1.2.2中的方法验证合成肽对α-淀粉酶的抑制活性。
1.3 数据处理
所有测定均进行3次。每组数据使用IBM SPSS Statistics 23进行方差分析,以多重比较法进行显著性分析,显著性水平为P<0.05。利用GraphPad Prism 9进行绘图。
2. 结果与分析
2.1 PPP的制备
2.1.1 胃蛋白酶酶解条件对PPP制备的影响
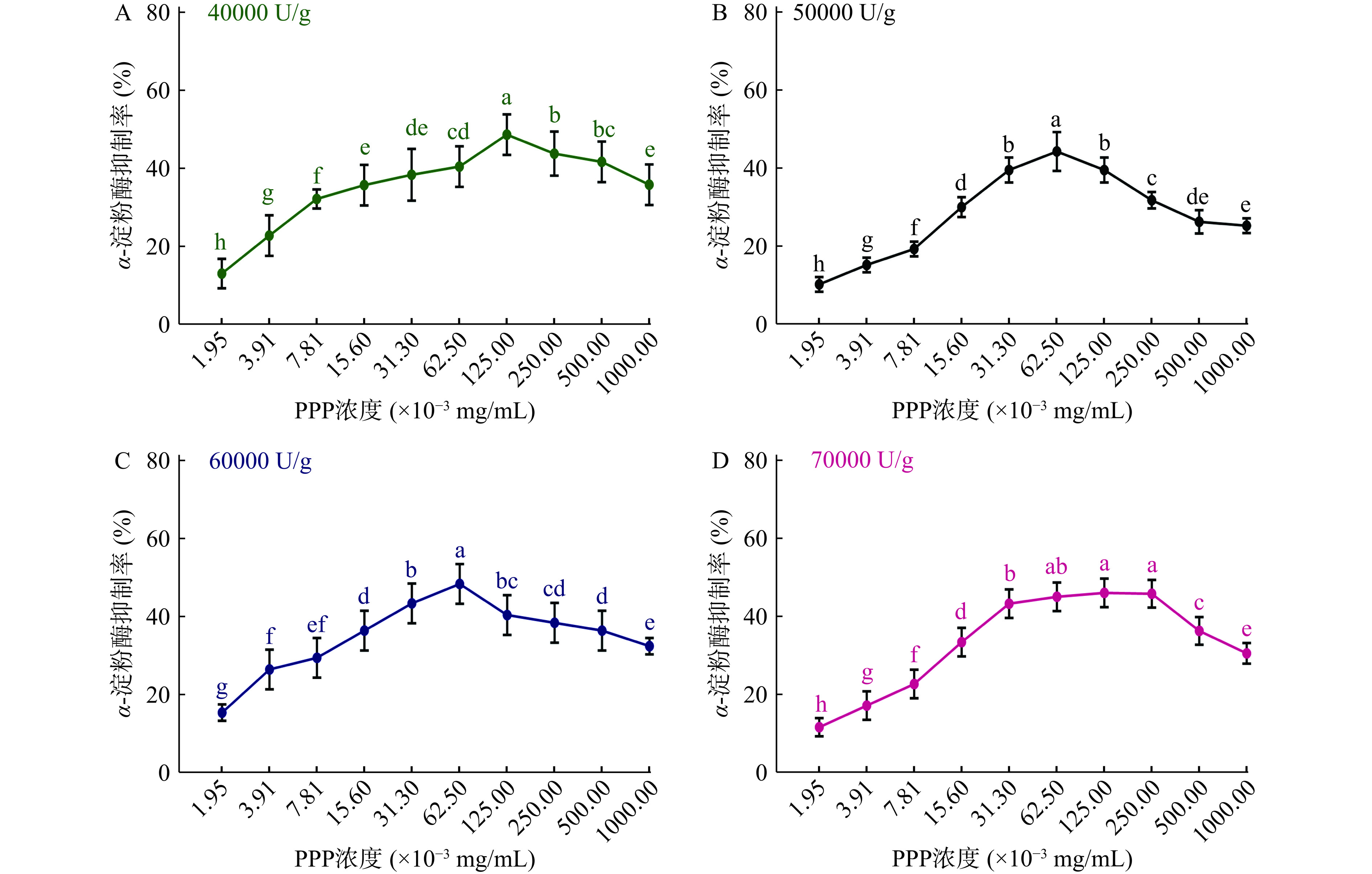
以α-淀粉酶抑制率为指标,采用单因素实验考察胃蛋白酶添加量和酶解时间对PPP制备的影响。图1展示了不同胃蛋白酶添加量制得的PPP对α-淀粉酶的抑制活性。由图可知,不同加酶量制得的PPP随浓度增加((1.95~1000)×10−3 mg/mL)对α-淀粉酶的抑制都呈现先上升后下降的趋势。表1所示为每组制得的PPP能达到的最高α-淀粉酶抑制率及其对应浓度。可知,不同加酶量制得的PPP在(62.5~125)×10−3 mg/mL浓度范围内,达到最高α-淀粉酶抑制率。结合图1和表1,以较低酶添加量且在较低浓度下达到最高α-淀粉酶抑制率为筛选依据,确定60000 U/g为胃蛋白酶的最适加酶量,其在浓度为62.5×10−3 mg/mL时达到最高α-淀粉酶抑制率48.34%±2.16%。
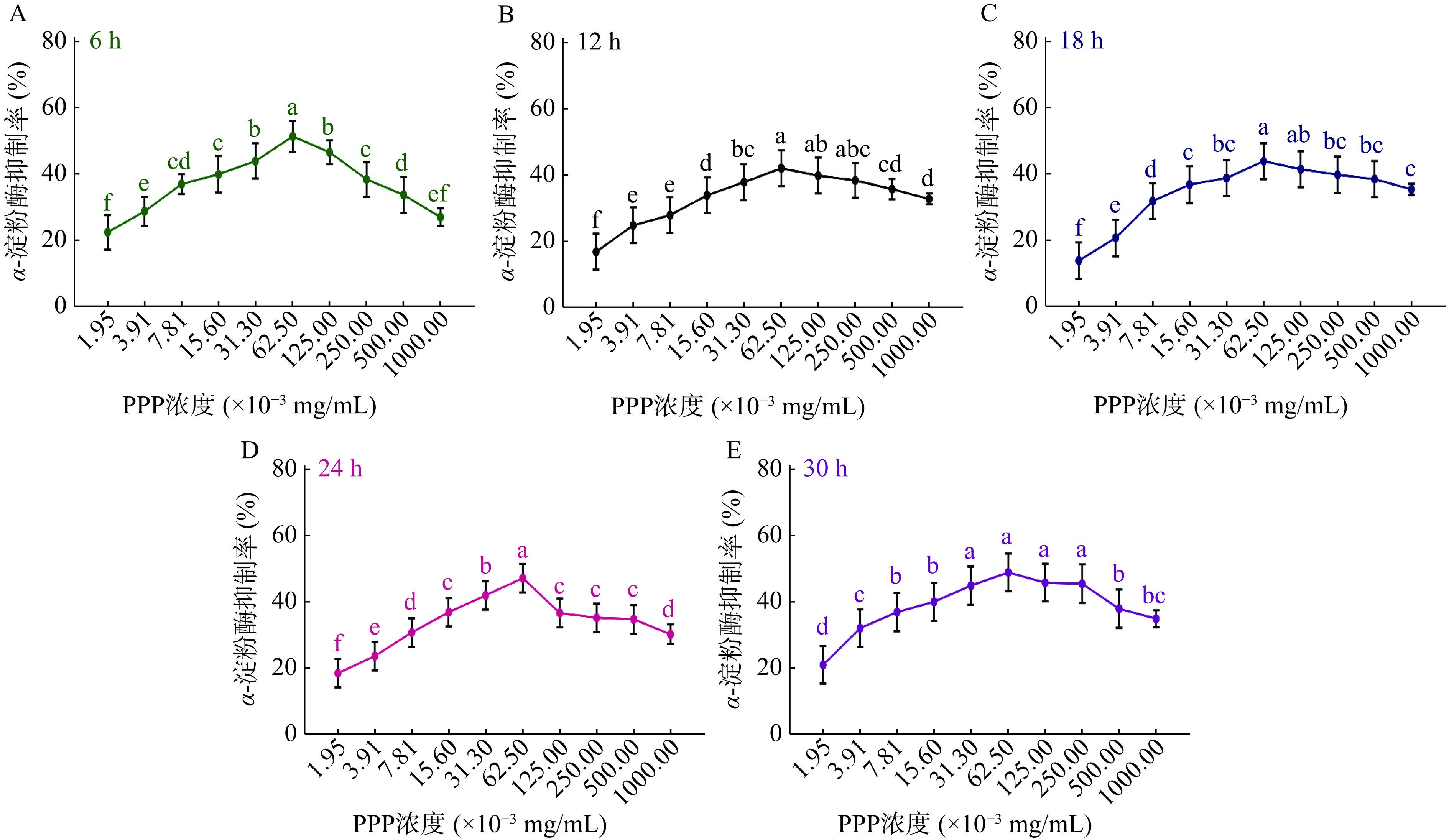
表 1 胃蛋白酶不同添加量制得的PPP对α-淀粉酶的最高抑制率Table 1. The highest inhibition rate of α-amylase by PPP prepared with different pepsin dosage图2所示为胃蛋白酶最适添加量60000 U/g条件下,不同酶解时间制得的PPP对α-淀粉酶的抑制趋势。由图可知不同酶解时间制备出的PPP具有相似的α-淀粉酶抑制效果,整体都随浓度增加呈现先上升后下降的趋势。由表2可知,不同酶解时间制得的PPP在(31.3~62.5)×10−3 mg/mL浓度范围内,达到最高α-淀粉酶抑制率(其中酶解时间为30 h时,PPP在浓度31.3~250 mg/mL,α-淀粉酶抑制率间没有显著性差异,认为在浓度为31.3 mg/mL时,抑制率达到最大值)。与其它酶解时间相比,酶解时间6 h,制得的PPP,在浓度为62.5×10−3 mg/mL时达到最高α-淀粉酶抑制率51.26%±2.16%,差异具有显著性(P<0.05)。因此,确定胃蛋白酶最适酶解时间为6 h。
表 2 胃蛋白酶添加量60000 U/g条件下不同酶解时间制得PPP对α-淀粉酶的最高抑制率Table 2. The highest inhibition rate of PPP on α-amylase was obtained under the condition of pepsin addition amount of60000 U/g and different enzymatic hydrolysis time酶解时间(h) PPP对α-淀粉酶达到最高抑制率
时的浓度(×10−3 mg/mL)PPP对α-淀粉酶的
最高抑制率(%)6 62.5 51.26±2.16a 12 62.5 41.94±2.48c 18 62.5 43.83±2.45bc 24 62.5 47.11±1.45b 30 31.3 44.88±2.40bc 综合上述结果,确定胃蛋白酶最适酶添加量为60000 U/g,最适酶解时间为6 h。
2.1.2 胰蛋白酶酶解条件对PPP制备的影响
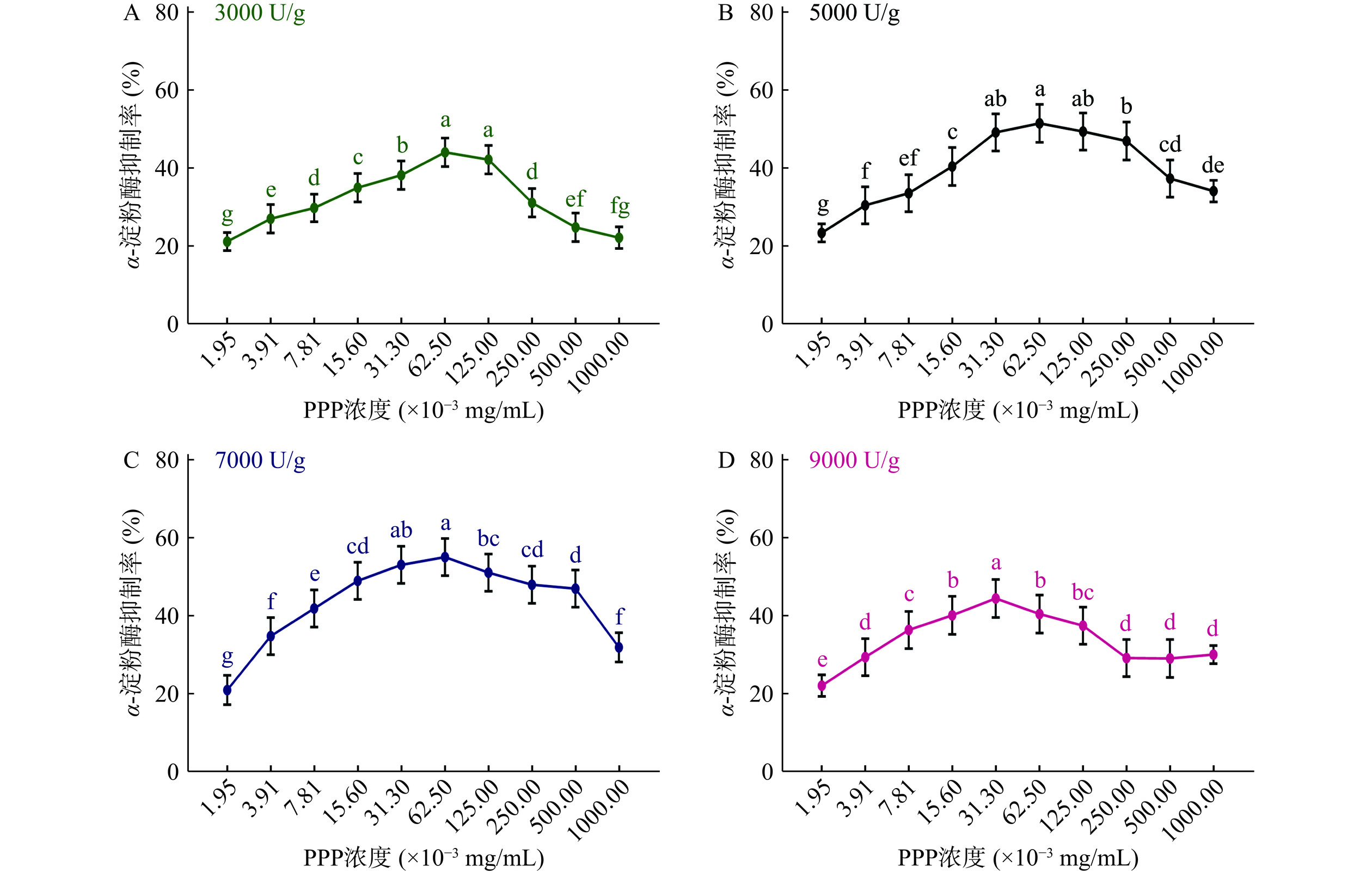
采用单因素实验继续考察胰蛋白酶酶添加量和酶解时间对PPP制备的影响。结合图3和表3可知,不同胰蛋白酶酶添加量条件下制得的PPP随浓度增加对α-淀粉酶的抑制作用呈现先上升后下降的趋势,在(31.3~62.5)×10−3 mg/mL浓度范围内,达到最高α-淀粉酶抑制率。与其它胰蛋白酶酶添加量相比,加酶量为7000 U/g时制得的PPP,在62.5×10−3 mg/mL时具有最高α-淀粉酶抑制率54.90%±1.93%,差异具有显著性(P<0.05)。因此确定胰蛋白酶最适加酶量为7000 U/g。结合图4和表4可知,胰蛋白酶不同酶解时间制备的PPP对α-淀粉酶的抑制作用与胃蛋白酶相似,都未呈现出规律性。这是因为酶解时间与蛋白水解物活性之间并没有绝对的相关性[20−21]。酶解时间越长,酶解便越充分,但活性肽段的生成不一定越多。在胰蛋白酶最适加酶量7000 U/g的条件下,酶解不同时间制得的PPP在(31.3~62.5)×10−3 mg/mL浓度范围内,达到最高α-淀粉酶抑制率(12 h时,PPP浓度31.3~250 mg/mL,α-淀粉酶抑制率间没有显著性差异,认为在浓度为31.3 mg/mL时,抑制率达到最大值)。以较少酶解时间,且在较低浓度下达到最高α-淀粉酶抑制率为筛选依据,确定胰蛋白酶最适酶解时间为6 h,该条件下制得的PPP,在浓度为62.5×10−3 mg/mL时达到最高α-淀粉酶抑制率56.33%±2.58%。
表 3 胰蛋白酶不同添加量制得的PPP对α-淀粉酶的最高抑制率Table 3. The highest inhibition rate of α-amylase by PPP prepared with different trypsin dosage酶添加量(U/g) PPP对α-淀粉酶达到最高抑制率
时的浓度(×10−3 mg/mL)PPP对α-淀粉酶的
最高抑制率(%)3000 62.5 44.02±1.59c 5000 62.5 51.40±1.95b 7000 62.5 54.90±1.93a 9000 31.3 44.41±1.96c 表 4 胰蛋白酶添加量7000 U/g条件下不同酶解时间制得的PPP对α-淀粉酶的最高抑制率Table 4. The highest inhibition rate of PPP on α-amylase was obtained under the condition of trypsin addition amount of7000 U/g and different enzymatic hydrolysis time酶解时间(h) 对α-淀粉酶达到最高抑制率时
PPP的浓度(×10−3 mg/mL)PPP对α-淀粉酶的最高
抑制率(%)6 62.5 56.33±2.58a 12 31.3 45.99±2.29b 18 62.5 53.18±2.09a 24 62.5 53.63±2.47a 30 62.5 54.43±2.26a 综合上述结果,确定胰蛋白酶最适酶添加量为7000 U/g,最适酶解时间为6 h。
2.1.3 复合酶解顺序对PPP制备的影响
与单酶酶解相比,多种酶的复合酶解方式能进一步暴露蛋白质活性位点,增强蛋白水解物的功能活性。何泽贺等[22]的研究发现,利用脯氨酸蛋白酶和α-胰凝乳蛋白酶对泥鳅蛋白进行单一酶解,酶解产物的最高血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制率分别是81.01%和64.91%。而将两种酶用复合的方式对泥鳅蛋白进行酶解可产生抑制率为90.14%的更高活性的ACE抑制肽。因此,为了进一步提高所制备出的PPP对α-淀粉酶的抑制活性,本研究继续在胃蛋白酶和胰蛋白酶的最佳酶解条件下,采用分步复合酶解的方法制备PPP。
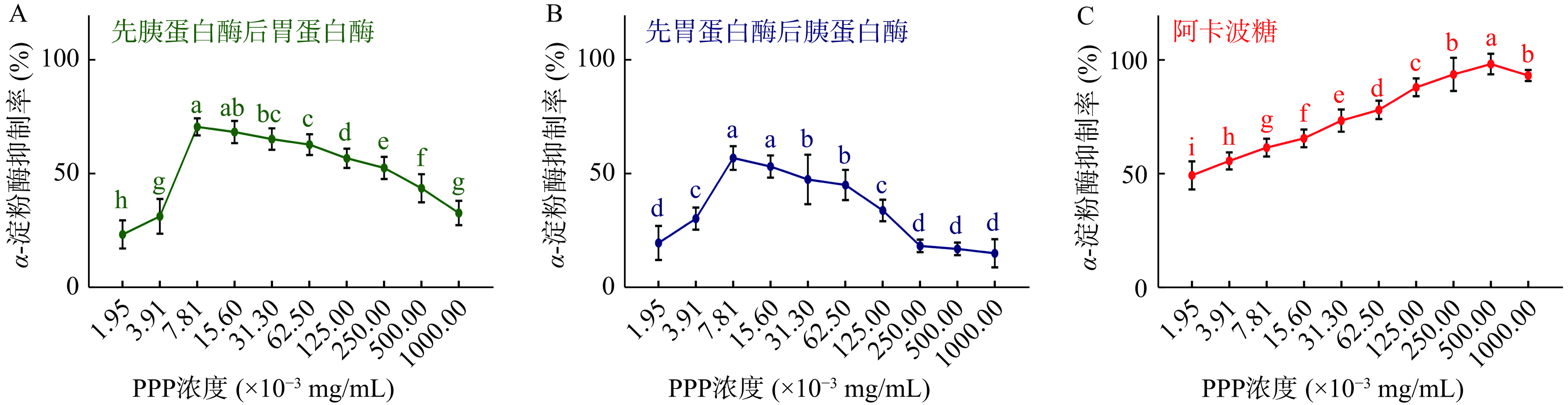
结合图5和表5可知,先胰后胃酶解条件下制得的PPP在浓度为7.81×10−3 mg/mL时,达到最高α-淀粉酶抑制率70.69%±1.71%,高于先胃后胰酶解条件下制得的PPP在同浓度下的抑制率56.98%±2.31%,高于阳性对照阿卡波糖在同浓度下的抑制率59.98%±0.56%,高于单独胃蛋白酶最适酶解条件下的抑制率51.26%±2.16%,高于单独胰蛋白酶最适酶解条件下的抑制率56.33%±2.58%,且远远高于酶解前PV蛋白对α-淀粉酶的抑制率8.32%±0.89%。这些结果表明,与单一酶解相比,先胰蛋白酶后胃蛋白酶的酶解方式,进一步提高了PPP对α-淀粉酶的抑制作用。因此,最佳复合酶解顺序为,先经胰蛋白酶酶解后,再经胃蛋白酶酶解。战旭梅等[9]制备的玉米蛋白肽、李永富等[10]制备的绿豆蛋白肽以及周浩纯等[11]制备的亚麻籽饼粕蛋白肽,对α-淀粉酶的抑制率分别为15.01%、39.83%和27%。本研究经过复合酶解制备出的PPP对α-淀粉酶的抑制率70.69%±1.71%显著高于这些多肽,表明PPP对α-淀粉酶有良好的抑制效果。
表 5 不同酶解顺序制得的PPP对α-淀粉酶的最高抑制率Table 5. The highest inhibition rate of α-amylase by PPP prepared by different enzymolysis sequences酶解顺序 PPP对α-淀粉酶达到最高抑制率
时的浓度(×10−3 mg/mL)PPP对α-淀粉酶的
最高抑制率(%)先胃蛋白酶后
胰蛋白酶7.81 56.98±2.31b 先胰蛋白酶后
胃蛋白酶7.81 70.69±1.71a 2.2 PPP对α-淀粉酶的酶抑制动力学分析
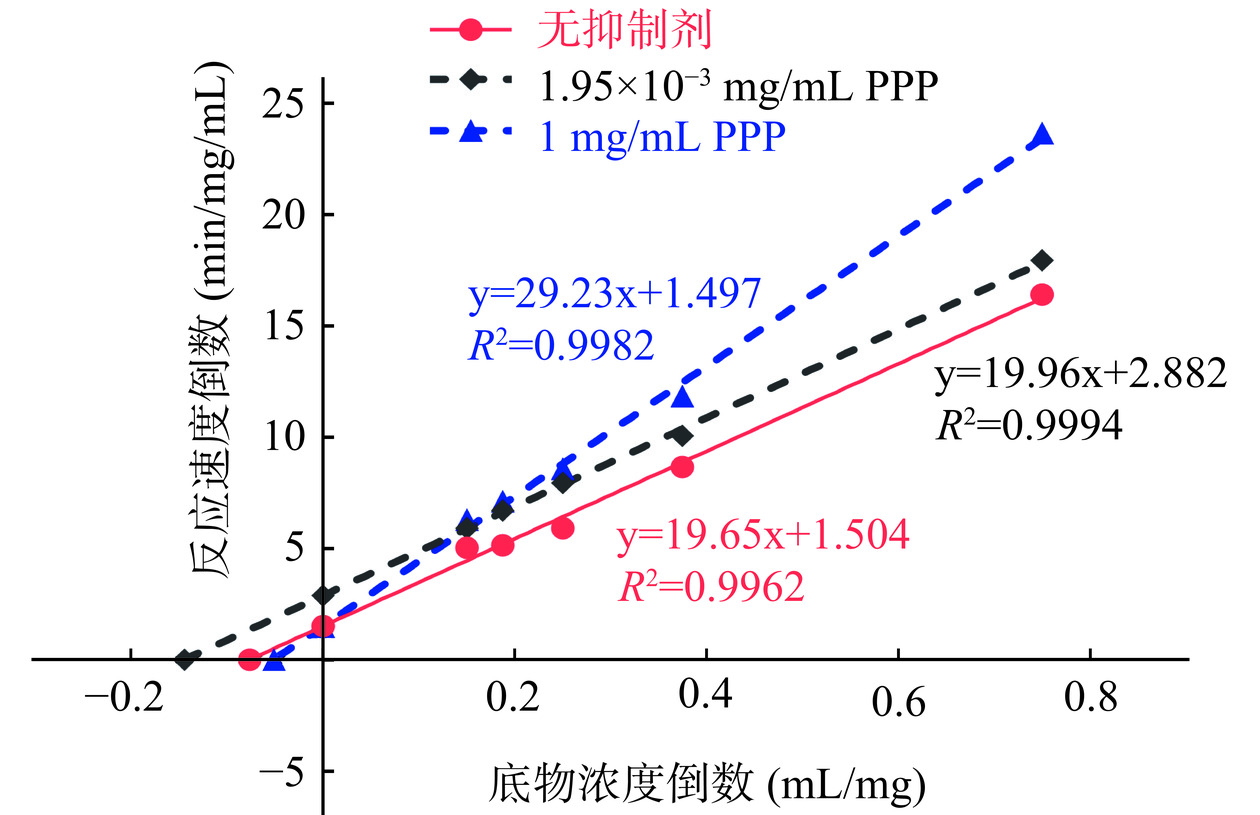
上述所有酶解方式制得的PPP随浓度升高都对α-淀粉酶的抑制作用呈现先上升后下降的趋势。为了分析其中原因,选择最佳复合酶解条件下制得的PPP,利用酶抑制动力学实验,探索其对α-淀粉酶的抑制作用类型[8]。图6为PPP对α-淀粉酶抑制的双倒数曲线,表6展示了动力学参数数值变化。结果显示,当PPP浓度为低浓度1.95×10−3 mg/mL时,α-淀粉酶的米氏常数Km基本保持不变,反应的最大速率Vmax减小,表明此时PPP对于α-淀粉酶的抑制作用类型为非竞争性抑制。当PPP浓度为高浓度1 mg/mL时,α-淀粉酶的Km增大,而Vmax基本不变,表明此时PPP对于α-淀粉酶的抑制作用为竞争性抑制。因此,PPP对于α-淀粉酶的抑制类型为非竞争性和竞争性作用的混合型抑制。图5显示阿卡波糖对α-淀粉酶的抑制作用,当浓度<0.5 mg/mL时抑制率随浓度逐渐上升,当浓度>0.5 mg/mL时抑制率略微下降。阿卡波糖的抑制趋势与相关研究结果一致[18],其抑制类型为混合型抑制。PPP和阿卡波糖对α-淀粉酶的抑制类型一致,均为混合型抑制,这种抑制机制使得PPP对α-淀粉酶的抑制作用也呈现出随浓度先上升后下降的趋势[18,23]。
表 6 不同PPP浓度作用下α-淀粉酶的动力学参数Table 6. Kinetic parameters of α-amylase under different PPP concentrations参数 无抑制剂
(0 mg/mL PPP)1.95×10−3 mg/mL
PPP1 mg/mL
PPP最大反应速率Vmax
(mg/mL/min)0.4185 0.3282 0.4194 米氏常数Km(mg/mL) 6.6590 6.3480 10.720 注: Km是Vmax达到一半时的底物浓度。 2.3 PPP的肽段序列鉴定及筛选
为了进一步从最佳复合酶解条件下制备的PPP中筛选出最具α-淀粉酶抑制活性的肽段,利用LC-MS/MS和分子对接技术对其进行鉴定筛选分析。
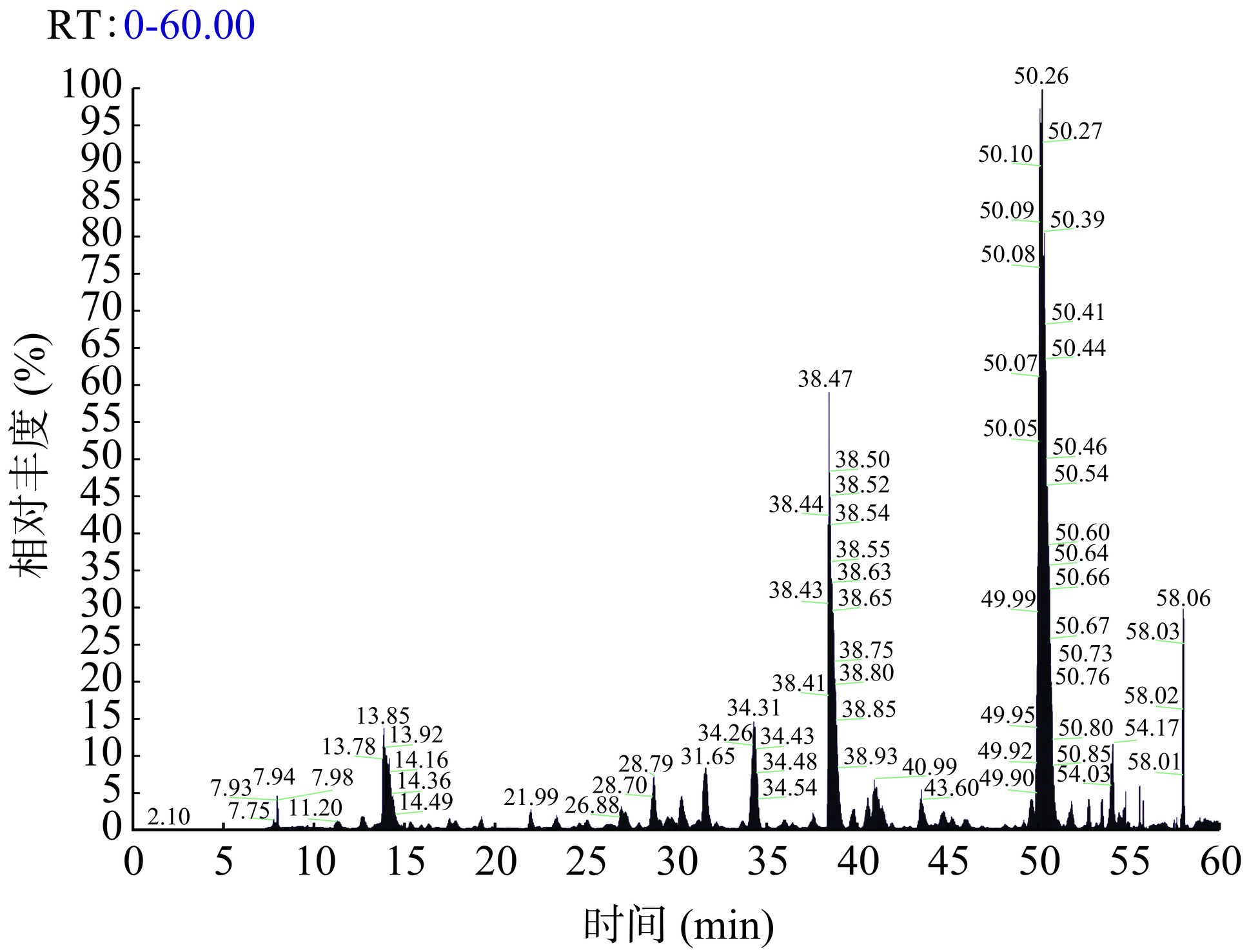
首先,通过对最佳复合酶解条件下制备的PPP进行LC-MS/MS鉴定分析,得到PPP组分中所含有的肽段序列及每条肽段的相对含量。LC-MS/MS分析的总离子流色谱图如图7所示。对质谱采集的Raw File文件,用Maxquant软件检索P02845蛋白数据库进行分析,主搜索part per million(ppm)设置为6,不完全酶切位点数设置为0,非标记定量最小比值数设置为1,运行间匹配时间设置为2 min,肽质量误差为±20 ppm,肽段假发现率≤0.1,由此从PPP中鉴定到202条多肽。这些多肽分子量均小于1700 Da,表明先胰蛋白酶后胃蛋白酶的复合酶解方式,使得PV被充分酶解为小分子多肽。
随后对LC-MS/MS鉴定分析结果进行筛选。质谱峰强度数值的大小与PPP中各个肽段的含量成正比,可对肽段进行半定量分析,某个肽段的峰强度与所有肽段的峰强度总和的比值代表该肽段在总肽段中的相对含量。有研究表明,肽段在蛋白水解物组分中所占含量越大,越可能发挥更重要的功能活性[24−26]。LC-MS/MS鉴定分析结果显示,90%以上的肽段在PPP组分中所占含量不足1%,因此首先筛选出在PPP组分中含量占比>1%(峰强度>1.50×108)的肽段。见表7所示,这13条肽段在PPP组分中所占含量较大,可能发挥更重要的功能作用。
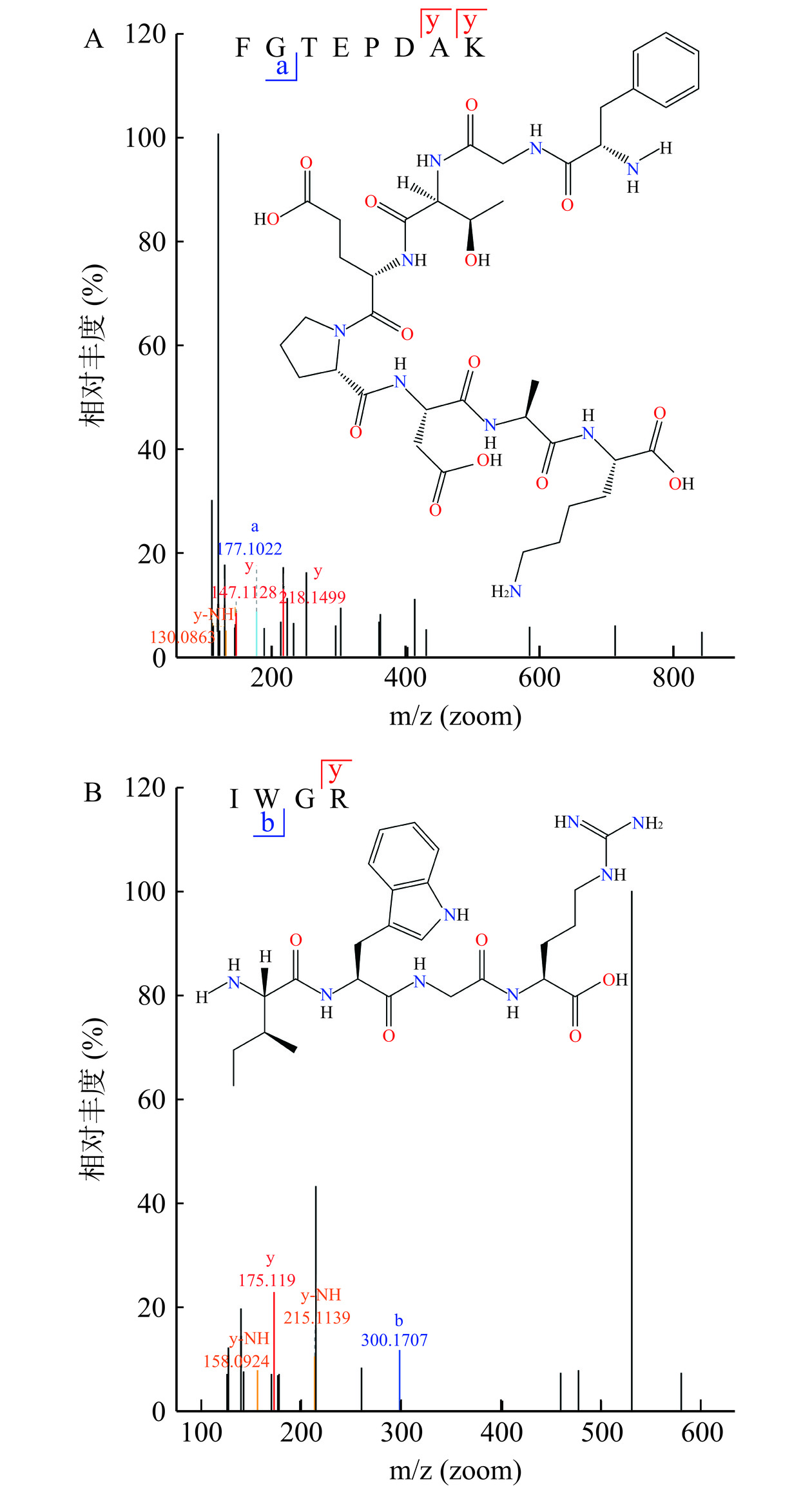
表 7 基于LC-MS/MS分析的PPP组分中含量占比>1%的肽段Table 7. Peptides with >1% content in PPP fractions based on LC-MS/MS analysis序号 肽序列 长度 位置 分子量(Da) 电荷 峰强度 1 RSVSHHSHEHHSGH 14 P02845[1290-1303] 1630.64 2;3 2.76×108 2 EFG 3 P02845[1113-1115] 351.35 1 2.33×108 3 IWG 3 P02845[1320-1322] 374.43 1 2.16×108 4 LSK 3 P02845[1317-1319] 346.42 1 2.12×108 5 KKPMDEEENDQVK 13 P02845[1147-1159] 1589.72 1 2.45×108 6 SGHL 4 P02845[1301-1304] 412.44 1 1.88×108 7 IWGR 4 P02845[1320-1323] 530.62 1 1.87×108 8 KKP 3 P02845[1147-1149] 371.48 1 1.78×108 9 NDQVKQARNKD 11 P02845[1155-1165] 1315.39 2;3 1.64×108 10 WGR 3 P02845[1121-1123] 417.46 1 1.64×108 11 HEI 3 P02845[1324-1326] 397.43 1 1.64×108 12 FGTEPDAK 8 P02845[1123-1130] 863.91 1 1.60×108 13 SKIW 4 P02845[1318-1321] 532.63 1 1.58×108 注:峰强度表示肽段的信号强度。数值越大,表明该肽段在PPP组分中所占含量越大。本表仅筛选展示峰强度>1.50×108的肽段,即该肽段在PPP组分中含量占比>1%。 在这项研究中,AutoDock Vina 软件被用来模拟多肽与α-淀粉酶的对接[25]。对接结合能(Affinity value)是基于各种因素,包括空间效应、排斥、氢键、疏水相互作用和受体-配体复合物之间的灵活性,反映了配体与受体有效结合的可能性。较低的对接分数表明肽和α-淀粉酶之间有更好的结合构象[26]。对接结合能为负值表明受体和配体有结合的可能性,一般来说,其值小于−6 kcal/mol时表明有很大的结合可能性[24,26]。另有研究报道,氢键相互作用可能是氢键、疏水键、π键、范德华力和静电相互作用中最强的分子间力[27]。多肽与α-淀粉酶之间的氢键会促进肽酶复合物的结构稳定性,与酶活抑制密切相关[28]。因此,对初步筛选出的13条多肽,利用分子对接进行进一步分析,将对接结合能和氢键数目作为主要考察指标,以此筛选潜在的卵黄高磷蛋白α-淀粉酶抑制活性肽。表8所示,仅有多肽Phe-Gly-Thr-Glu-Pro-Asp-Ala-Lys(FGTEPDAK)和Ile-Trp-Gly-Arg(IWGR)与α-淀粉酶(1PIF)的对接结合能小于−6 kcal/mol。其中,FGTEPDAK与α-淀粉酶的对接结合能为−7.5 kcal/mol,存在8个氢键,远高于α-淀粉酶(1PIF)原始配体的结合能和氢键数目。IWGR与α-淀粉酶的对接结合能为−8.2 kcal/mol,存在4个氢键,其结合能大于α-淀粉酶(1PIF)原始配体的结合能,而氢键数目与之相近。这些结果表明,FGTEPDAK和IWGR皆可与α-淀粉酶(1PIF)紧密对接,且与α-淀粉酶(1PIF)的原始配体相比,有更好的结合稳定性。在大量研究中,阿卡波糖已被证明对α-淀粉酶具有有效的抑制作用[9−12]。在本项研究中,阳性对照阿卡波糖与α-淀粉酶(1PIF)的对接结合能为−8.1 kcal/mol,氢键数目为6。而FGTEPDAK和IWGR与α-淀粉酶(1PIF)的对接结合能和氢键数目与之相近,这意味着两条肽可能具有有效的α-淀粉酶抑制活性。图8所示为FGTEPDAK和IWGR两条肽段的LC-MS/MS分析二级质谱图和二维化学结构。下一步将进行FGTEPDAK和IWGR的α-淀粉酶抑制活性验证实验。
表 8 基于AutoDock Vina的分子对接模拟筛选Table 8. Molecular docking simulation screening based on AutoDock Vina序号 肽序列 α-淀粉酶 (1PIF) 结合能(kcal/mol) 氢键数目 1 FGTEPDAK −7.5 8 2 IWGR −8.2 4 3 IWG −5.9 3 4 WGR −5.5 3 5 SGHL −5.9 5 6 SKIW −3.2 4 7 EFG −1.9 2 阳性对照 阿卡波糖 −8.1 6 原始配体(1PIF) PCA −6.0 6 CA −5.5 5 CL −5.8 5 注:1PIF:α-淀粉酶的PDB ID;结合能(kcal/mol),当该值小于零时,表明在自然状态下,配体和受体在不受外力作用下可对接,该值越小,表明对接越好。氢键数目越多,表明受体和配体复合物的稳定性越强。 2.4 FGTEPDAK和IWGR的活性验证
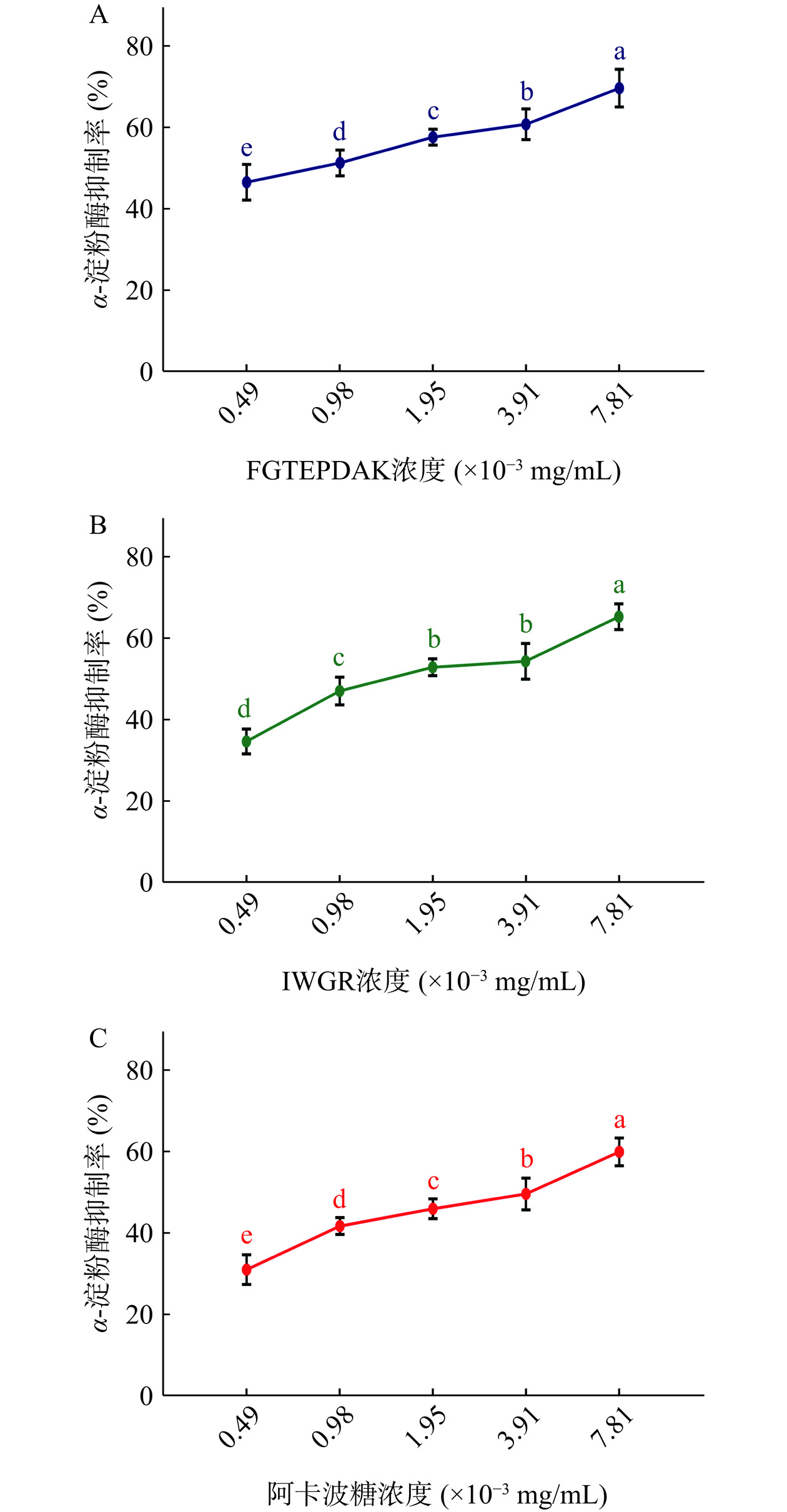
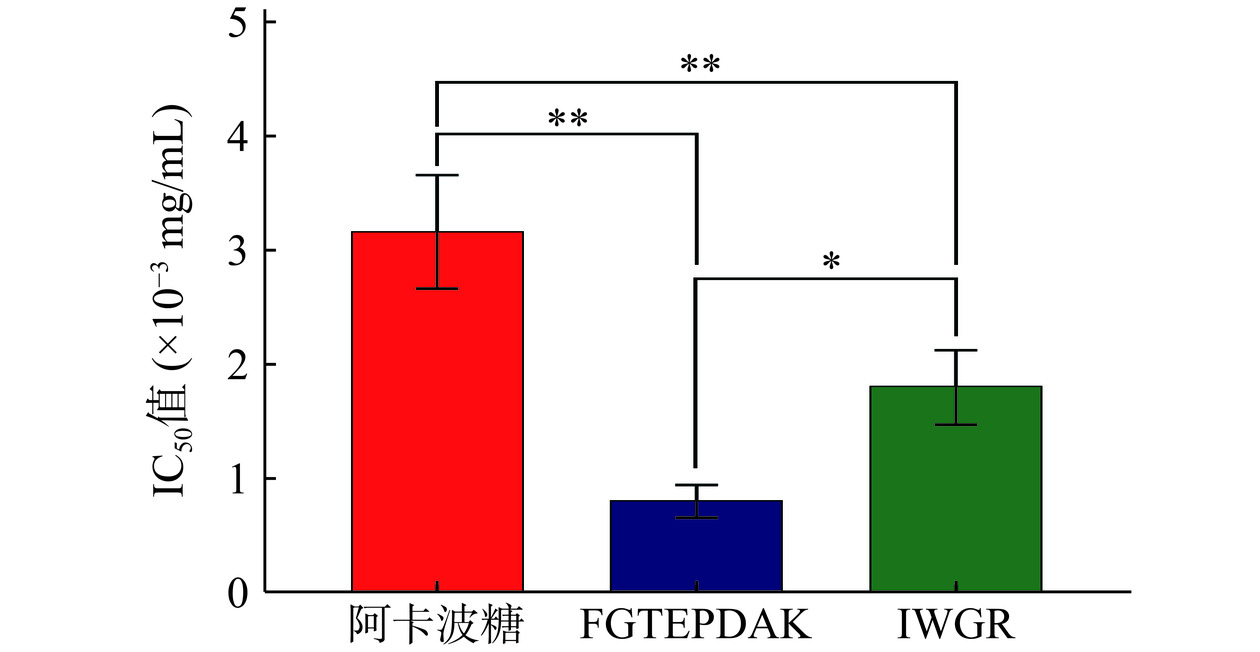
将筛选出的多肽FGTEPDAK和IWGR进行固相合成,以验证其对α-淀粉酶的抑制活性。图9所示为FGTEPDAK、IWGR和阿卡波糖对α-淀粉酶的抑制作用,它们在极低的浓度下皆展现出强抑制活性。利用GraphPad Prism 9软件对图9进行计算分析以得到FGTEPDAK、IWGR和阿卡波糖对α-淀粉酶抑制的IC50值。结果如图10所示,FGTEPDAK对α-淀粉酶抑制的IC50值(0.80±0.14)×10−3 mg/mL以及IWGR对α-淀粉酶抑制的IC50值(1.8±0.31)×10−3 mg/mL皆低于阿卡波糖对α-淀粉酶抑制的IC50值(3.17±0.47)×10−3 mg/mL,两条肽对α-淀粉酶的抑制作用优于阳性对照阿卡波糖,差异具有极显著性(P<0.01)。苏娜等[12]从驼乳蛋白水解物中鉴定出两条新型α-淀粉酶抑制肽HAGPTWNPISIGISFM和IPLPLPLPLP,其抑制α-淀粉酶的IC50值分别为0.067 mg/mL和0.039 mg/mL。蒋美龄等[29]研究发现,一种新型牡蛎蛋白多肽ARNEANVNIY,抑制α-淀粉酶的IC50值为(3.66±0.47)mg/mL。李梦瑶等[30]从牦牛乳蛋白水解物中鉴定出两条新型多肽RPKHPIK和KVLPVPQ,对α-淀粉酶抑制的IC50值分别为0.45 mg/mL和0.86 mg/mL。与这些多肽相比,本项研究筛选出的FGTEPDAK和IWGR对α-淀粉酶具有更强的抑制活性。
多肽的生物活性是由它们所含有的特定氨基酸及所处位置决定的[4−6]。FGTEPDAK含有苯丙氨酸、脯氨酸和丙氨酸三种疏水性氨基酸,以及碱性氨基酸赖氨酸;在IWGR中,存在异亮氨酸、色氨酸两种疏水性氨基酸以及碱性氨基酸精氨酸。两条肽的这些氨基酸组成与大多数已报道的α-淀粉酶抑制肽相似[7−8,26]。与之不同的是,两条肽段的N端都为疏水性氨基酸,C端为碱性氨基酸,这种特定的氨基酸组成和位置分布可能是给予这两条肽段更强α-淀粉酶抑制活性的关键原因。另一方面FGTEPDAK对α-淀粉酶抑制的IC50值低于IWGR,这表明FGTEPDAK的抑制效果优于IWGR,这可能是由于FGTEPDAK中含有更多的与α-淀粉酶抑制相关的疏水性氨基酸造成的[24−26]。
3. 结论
本研究结果显示,卵黄高磷蛋白肽(PPP)的最佳制备条件为先胰蛋白酶(7000 U/g)后胃蛋白酶(60000 U/g)分别酶解6 h。PPP在浓度7.81×10−3 mg/mL时具有最高的α-淀粉酶抑制率70.69%±1.71%。PPP对α-淀粉酶的抑制类型为混合型抑制。鉴定筛选出了两种具有显著α-淀粉酶抑制活性的新型多肽FGTEPDAK和IWGR,其IC50值分别为(0.80±0.14)×10−3 mg/mL和(1.8±0.31)×10−3 mg/mL,极显著低于阳性对照阿卡波糖(3.17±0.47)×10−3 mg/mL(P<0.01)。但是本研究仅通过体外实验对PPP的α-淀粉酶抑制作用进行了探索,在后续的研究中将通过小鼠模型继续研究PPP在体内对α-淀粉酶的抑制效果及其相关机制。综上所述,PPP可作为新型降糖物质应用于缓解Ⅱ型糖尿病的功能性食品的开发中。
-
表 1 胃蛋白酶不同添加量制得的PPP对α-淀粉酶的最高抑制率
Table 1 The highest inhibition rate of α-amylase by PPP prepared with different pepsin dosage
表 2 胃蛋白酶添加量60000 U/g条件下不同酶解时间制得PPP对α-淀粉酶的最高抑制率
Table 2 The highest inhibition rate of PPP on α-amylase was obtained under the condition of pepsin addition amount of60000 U/g and different enzymatic hydrolysis time
酶解时间(h) PPP对α-淀粉酶达到最高抑制率
时的浓度(×10−3 mg/mL)PPP对α-淀粉酶的
最高抑制率(%)6 62.5 51.26±2.16a 12 62.5 41.94±2.48c 18 62.5 43.83±2.45bc 24 62.5 47.11±1.45b 30 31.3 44.88±2.40bc 表 3 胰蛋白酶不同添加量制得的PPP对α-淀粉酶的最高抑制率
Table 3 The highest inhibition rate of α-amylase by PPP prepared with different trypsin dosage
酶添加量(U/g) PPP对α-淀粉酶达到最高抑制率
时的浓度(×10−3 mg/mL)PPP对α-淀粉酶的
最高抑制率(%)3000 62.5 44.02±1.59c 5000 62.5 51.40±1.95b 7000 62.5 54.90±1.93a 9000 31.3 44.41±1.96c 表 4 胰蛋白酶添加量7000 U/g条件下不同酶解时间制得的PPP对α-淀粉酶的最高抑制率
Table 4 The highest inhibition rate of PPP on α-amylase was obtained under the condition of trypsin addition amount of7000 U/g and different enzymatic hydrolysis time
酶解时间(h) 对α-淀粉酶达到最高抑制率时
PPP的浓度(×10−3 mg/mL)PPP对α-淀粉酶的最高
抑制率(%)6 62.5 56.33±2.58a 12 31.3 45.99±2.29b 18 62.5 53.18±2.09a 24 62.5 53.63±2.47a 30 62.5 54.43±2.26a 表 5 不同酶解顺序制得的PPP对α-淀粉酶的最高抑制率
Table 5 The highest inhibition rate of α-amylase by PPP prepared by different enzymolysis sequences
酶解顺序 PPP对α-淀粉酶达到最高抑制率
时的浓度(×10−3 mg/mL)PPP对α-淀粉酶的
最高抑制率(%)先胃蛋白酶后
胰蛋白酶7.81 56.98±2.31b 先胰蛋白酶后
胃蛋白酶7.81 70.69±1.71a 表 6 不同PPP浓度作用下α-淀粉酶的动力学参数
Table 6 Kinetic parameters of α-amylase under different PPP concentrations
参数 无抑制剂
(0 mg/mL PPP)1.95×10−3 mg/mL
PPP1 mg/mL
PPP最大反应速率Vmax
(mg/mL/min)0.4185 0.3282 0.4194 米氏常数Km(mg/mL) 6.6590 6.3480 10.720 注: Km是Vmax达到一半时的底物浓度。 表 7 基于LC-MS/MS分析的PPP组分中含量占比>1%的肽段
Table 7 Peptides with >1% content in PPP fractions based on LC-MS/MS analysis
序号 肽序列 长度 位置 分子量(Da) 电荷 峰强度 1 RSVSHHSHEHHSGH 14 P02845[1290-1303] 1630.64 2;3 2.76×108 2 EFG 3 P02845[1113-1115] 351.35 1 2.33×108 3 IWG 3 P02845[1320-1322] 374.43 1 2.16×108 4 LSK 3 P02845[1317-1319] 346.42 1 2.12×108 5 KKPMDEEENDQVK 13 P02845[1147-1159] 1589.72 1 2.45×108 6 SGHL 4 P02845[1301-1304] 412.44 1 1.88×108 7 IWGR 4 P02845[1320-1323] 530.62 1 1.87×108 8 KKP 3 P02845[1147-1149] 371.48 1 1.78×108 9 NDQVKQARNKD 11 P02845[1155-1165] 1315.39 2;3 1.64×108 10 WGR 3 P02845[1121-1123] 417.46 1 1.64×108 11 HEI 3 P02845[1324-1326] 397.43 1 1.64×108 12 FGTEPDAK 8 P02845[1123-1130] 863.91 1 1.60×108 13 SKIW 4 P02845[1318-1321] 532.63 1 1.58×108 注:峰强度表示肽段的信号强度。数值越大,表明该肽段在PPP组分中所占含量越大。本表仅筛选展示峰强度>1.50×108的肽段,即该肽段在PPP组分中含量占比>1%。 表 8 基于AutoDock Vina的分子对接模拟筛选
Table 8 Molecular docking simulation screening based on AutoDock Vina
序号 肽序列 α-淀粉酶 (1PIF) 结合能(kcal/mol) 氢键数目 1 FGTEPDAK −7.5 8 2 IWGR −8.2 4 3 IWG −5.9 3 4 WGR −5.5 3 5 SGHL −5.9 5 6 SKIW −3.2 4 7 EFG −1.9 2 阳性对照 阿卡波糖 −8.1 6 原始配体(1PIF) PCA −6.0 6 CA −5.5 5 CL −5.8 5 注:1PIF:α-淀粉酶的PDB ID;结合能(kcal/mol),当该值小于零时,表明在自然状态下,配体和受体在不受外力作用下可对接,该值越小,表明对接越好。氢键数目越多,表明受体和配体复合物的稳定性越强。 -
[1] 汪妮, 陈梦霞, 孟凡强, 等. 生姜多糖的提取及其对糖尿病小鼠肠道菌群的调节作用[J]. 食品工业科技,2023,44(4):278−286. [WANG Ni, CHEN Mengxia, MENG Fanqiang, et al. Extraction of polysaccharide from Zingiber officinale roscoe and its regulatory effect on intestinal flora in diabetic mice[J]. Science and Technology of Food Industry,2023,44(4):278−286.] WANG Ni, CHEN Mengxia, MENG Fanqiang, et al. Extraction of polysaccharide from Zingiber officinale roscoe and its regulatory effect on intestinal flora in diabetic mice[J]. Science and Technology of Food Industry, 2023, 44(4): 278−286.
[2] 刘雪梅, 陈文学, 杨铭, 等. 人参糖肽结合耐力运动对高脂血症大鼠血脂和抗氧化功能的影响[J]. 食品科学,2014,35(17):255−259. [LIU Xuemei, CHEN Wenxue, YANG Ming, et al. Effect of ginseng glycopeptide combined with endurance exercise on blood lipids and antioxidative capacity in hyperlipemia rats[J]. Food Science,2014,35(17):255−259.] doi: 10.7506/spkx1002-6630-201417049 LIU Xuemei, CHEN Wenxue, YANG Ming, et al. Effect of ginseng glycopeptide combined with endurance exercise on blood lipids and antioxidative capacity in hyperlipemia rats[J]. Food Science, 2014, 35(17): 255−259. doi: 10.7506/spkx1002-6630-201417049
[3] 孙广平, 宁磊, 方晓琳. 芒果苷改善2型糖尿病大鼠糖脂代谢紊乱的作用及机制研究[J]. 食品工业科技,2023,44(7):385−393. [SUN Guangping, NING Lei, FANG Xiaolin. Effect of mangiferin on the glycolipid metabolism disorder in T2DM rats and its mechanism[J]. Science and Technology of Food Industry,2023,44(7):385−393.] SUN Guangping, NING Lei, FANG Xiaolin. Effect of mangiferin on the glycolipid metabolism disorder in T2DM rats and its mechanism[J]. Science and Technology of Food Industry, 2023, 44(7): 385−393.
[4] NEBOJŠA S, NEBOJŠA K, BRANISLAVA Č S, et al. Traditional multi-herbal formula in diabetes therapy–Antihyperglycemic and antioxidant potential[J]. Arabian Journal of Chemistry,2021,14(10):103347. doi: 10.1016/j.arabjc.2021.103347
[5] MUDGIL P, KAMAL H, YUEN G C, et al. Characterization and identification of novel antidiabetic and antiobesity peptides from camel milk protein hydrolysates[J]. Food Chemistry,2018,259:46−54. doi: 10.1016/j.foodchem.2018.03.082
[6] WANG J, WU T, FANG L, et al. Anti-diabetic effect by walnut (Juglans mandshurica Maxim.)-derived peptide LPLLR through inhibiting α-glucosidase and α-amylase, and alleviating insulin resistance of hepatic HepG2 cells[J]. Journal of Functional Foods,2020,69:103944. doi: 10.1016/j.jff.2020.103944
[7] ZHANG Y, HE S, RUI X, et al. Interactions of C. frondosa-derived inhibitory peptides against angiotensin I-converting enzyme (ACE), α-amylase and lipase[J]. Food Chemistry,2021,367:130695.
[8] ZHOU M, REN G, ZHANG B, et al. Screening and identification of a novel antidiabetic peptide from collagen hydrolysates of Chinese giant salamander skin:Network pharmacology, inhibition kinetics and protection of IR-HepG2 cells[J]. Food & Function,2022,13:50.
[9] 战旭梅, 祁兴普, 赖梦宇, 等. 玉米蛋白酶解产物对α-淀粉酶活性抑制研究[J]. 粮食与油脂,2021,34(5):142−146,155. [ZHAN Xumei, QI Xingpu, LAI Mengyu, et al. Study on the inhibition of corn protein hydrolysates to α-amylase activity[J]. Cereals & Oils,2021,34(5):142−146,155.] doi: 10.3969/j.issn.1008-9578.2021.05.036 ZHAN Xumei, QI Xingpu, LAI Mengyu, et al. Study on the inhibition of corn protein hydrolysates to α-amylase activity[J]. Cereals & Oils, 2021, 34(5): 142−146,155. doi: 10.3969/j.issn.1008-9578.2021.05.036
[10] 李永富, 王雅茹, 黄金荣, 等. 绿豆蛋白α-淀粉酶抑制肽的制备与鉴定[J]. 食品科学,2024,39(2):28. [LI Yongfu, WANG Yaru, HUANG Jinrong, et al. Preparation and identification of α-amylase inhibitory peptides from mung bean protein[J]. Food Science,2024,39(2):28.] doi: 10.7506/spkx1002-6630-20230314-141 LI Yongfu, WANG Yaru, HUANG Jinrong, et al. Preparation and identification of α-amylase inhibitory peptides from mung bean protein[J]. Food Science, 2024, 39(2): 28. doi: 10.7506/spkx1002-6630-20230314-141
[11] 周浩纯, 李赫, 赵迪, 等. 亚麻籽饼粕蛋白提取工艺优化及其水解物抑制α-淀粉酶活性研究[J]. 食品研究与开发,2020,41(21):61−68. [ZHOU Haochun, LI He, ZHAO Di, et al. Optimization of protein extraction process of flaxseed cake and study on its hydrolyzate inhibitory activity of α-amylase[J]. Food Research and Development,2020,41(21):61−68.] doi: 10.12161/j.issn.1005-6521.2020.21.011 ZHOU Haochun, LI He, ZHAO Di, et al. Optimization of protein extraction process of flaxseed cake and study on its hydrolyzate inhibitory activity of α-amylase[J]. Food Research and Development, 2020, 41(21): 61−68. doi: 10.12161/j.issn.1005-6521.2020.21.011
[12] 苏娜, 伊丽, 吉日木图. 驼乳蛋白α-淀粉酶抑制活性肽的制备与鉴定[J]. 食品科学,2020,41(22):148−157. [SU Na, YI Li, JIRI Mutu. Preparation and identification of α-amylase inhibitory peptides from camel milk protein[J]. Food Science,2020,41(22):148−157.] doi: 10.7506/spkx1002-6630-20190926-319 SU Na, YI Li, JIRI Mutu. Preparation and identification of α-amylase inhibitory peptides from camel milk protein[J]. Food Science, 2020, 41(22): 148−157. doi: 10.7506/spkx1002-6630-20190926-319
[13] 张晓维. 卵黄高磷蛋白的分离纯化、结构表征及功能特性研究[D]. 武汉:华中农业大学, 2014. [ZHANG Xiaowei. Preparation, structure characterization and function of phosvitin from hen egg yolk[D]. Wuhan:Huazhong Agricultural University, 2014.] ZHANG Xiaowei. Preparation, structure characterization and function of phosvitin from hen egg yolk[D]. Wuhan: Huazhong Agricultural University, 2014.
[14] HUANG X, MOON S H, LEE J, et al. Effective preparation method of phosphopeptides from phosvitin and the analysis of peptide profiles using tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry,2019,67(51):14086−14101. doi: 10.1021/acs.jafc.9b05973
[15] 宋丽, 朱临娴, 宋璐杉, 等. 钙结合卵黄高磷蛋白磷酸肽的制备及其肽钙螯合物的结构表征[J]. 食品科学,2023,44(6):125−133. [SONG Li, ZHU Linxian, SONG Lushan, et al. Preparation of calcium-binding phosvitin phosphopeptide and structural characterization of its calcium chelate[J]. Food Science,2023,44(6):125−133.] doi: 10.7506/spkx1002-6630-20220414-167 SONG Li, ZHU Linxian, SONG Lushan, et al. Preparation of calcium-binding phosvitin phosphopeptide and structural characterization of its calcium chelate[J]. Food Science, 2023, 44(6): 125−133. doi: 10.7506/spkx1002-6630-20220414-167
[16] 宋璐杉, 乔赛凤, 朱临娴, 等. 卵黄高磷蛋白肽-亚铁螯合物的制备及其稳定性分析[J]. 食品安全质量检测学报,2023,14(14):27−34. [SONG Lushan, QIAO Saifeng, ZHU Linxian, et al. Preparation and stability analysis of phosvitin peptide-ferrous chelate[J]. Journal of Food Safety & Quality,2023,14(14):27−34.] SONG Lushan, QIAO Saifeng, ZHU Linxian, et al. Preparation and stability analysis of phosvitin peptide-ferrous chelate[J]. Journal of Food Safety & Quality, 2023, 14(14): 27−34.
[17] 赵梦蝶. 卵黄高磷蛋白磷酸肽钙复合物的制备及其促钙吸收机制研究[D]. 武汉:华中农业大学, 2021. [ZHAO Mengdie. Preparation of phosvitin phosphopeptide calcium complex and its mechanism of promoting calcium absorption[D]. Wuhan:Huazhong Agricultural University, 2021.] ZHAO Mengdie. Preparation of phosvitin phosphopeptide calcium complex and its mechanism of promoting calcium absorption[D]. Wuhan: Huazhong Agricultural University, 2021.
[18] 袁向华, 周艳玲, 勾洵, 等. 阿卡波糖对胰α-淀粉酶的抑制动力学研究[J]. 世界科技研究与发展,2016,38(1):117−121. [YUAN Xianghua, ZHOU Yanling, GOU Xun, et al. Researches on inhibition kinetics of pancreatic α-amylase by acarbose[J]. World Sci-Tech R & D,2016,38(1):117−121.] YUAN Xianghua, ZHOU Yanling, GOU Xun, et al. Researches on inhibition kinetics of pancreatic α-amylase by acarbose[J]. World Sci-Tech R & D, 2016, 38(1): 117−121.
[19] 王志鹏, 车子良, 马新雨, 等. 酶促反应动力学教学刍议:米氏方程衍生公式与图像[J]. 化学教育,2021,42(8):105−110. [WANG Zhipeng, CHE Ziliang, MA Xinyu, et al. A brief discussion on the teaching of enzymatic reaction kinetics:Derived formulas and images of Mi equation[J]. Chinese Journal of Chemical Education,2021,42(8):105−110.] WANG Zhipeng, CHE Ziliang, MA Xinyu, et al. A brief discussion on the teaching of enzymatic reaction kinetics: Derived formulas and images of Mi equation[J]. Chinese Journal of Chemical Education, 2021, 42(8): 105−110.
[20] LI F, YUE W, YANG J, et al. Overview of the preparation method, structure and function, and application of natural peptides and polypeptides[J]. Biomedicine & Pharmacotherapy,2022,153:113493.
[21] HOU D Z, FENG Q Q, NIU Z T, et al. Promising mung bean proteins and peptides:A comprehensive review of preparation technologies, biological activities, and their potential applications[J]. Food Bioscience,2023,55:102972.
[22] 何泽贺, 肖宇, 刘建朝, 等. 大鳞副泥鳅蛋白制备ACE抑制肽的酶解方式研究[J]. 食品研究与开发,2021,42(7):134−140. [HE Zehe, XIAO Yu, LIU Jianchao, et al. Study on enzymatic hydrolysis of ace inhibitory peptide from loach (Paramisgurnus dabryanus) protein[J]. Food Research and Development,2021,42(7):134−140.] doi: 10.12161/j.issn.1005-6521.2021.07.021 HE Zehe, XIAO Yu, LIU Jianchao, et al. Study on enzymatic hydrolysis of ace inhibitory peptide from loach (Paramisgurnus dabryanus) protein[J]. Food Research and Development, 2021, 42(7): 134−140. doi: 10.12161/j.issn.1005-6521.2021.07.021
[23] 孟成成, 宋永, 何鑫, 等. 金冠豆角籽粒中α-淀粉酶抑制剂的纯化及抑制动力学的研究[J]. 食品安全质量检测学报,2023,14(12):95−202. [MENG Chengcheng, SONG Yong, HE Xin, et al. Purification and inhibition kinetics of α-amylase inhibitor from golden crown snap bean seeds[J]. Journal of Food Safety & Quality,2023,14(12):95−202.] MENG Chengcheng, SONG Yong, HE Xin, et al. Purification and inhibition kinetics of α-amylase inhibitor from golden crown snap bean seeds[J]. Journal of Food Safety & Quality, 2023, 14(12): 95−202.
[24] CARDULLO N, MUCCILLI V, PULVIRENTI L, et al. C-glucosidic ellagitannins and galloylated glucoses as potential functional food ingredients with anti-diabetic properties:A study of α-glucosidase and α-amylase inhibition[J]. Food Chemistry,2020,313:126099. doi: 10.1016/j.foodchem.2019.126099
[25] GU Y, ZHANG J, NIU Y, et al. Virtual screening, and characteristics of novel umami peptides from porcine type I collagen[J]. Food Chemistry,2024,434:137386. doi: 10.1016/j.foodchem.2023.137386
[26] MAO Z, JIANG H, SUN J, MAO X. Virtual screening and structure optimization of xanthine oxidase inhibitory peptides from whole protein sequences of Pacific white shrimp via molecular docking[J]. Food Chemistry,2023,429:136837. doi: 10.1016/j.foodchem.2023.136837
[27] LAKSHMANAN K, AYYAMPERUMAL S, CHRISTY J, et al. Discovery of potential inhibitors for stat3:Ligand-based 3D pharmacophore, virtual screening, molecular docking, dynamic studies, and in vitro evaluation[J]. Journal of Biomolecular Structure & Dynamics,2022,40(21):11320−11338.
[28] SINGLA S, PIPLANI P. Coumarin derivatives as potential inhibitors of acetylcholinesterase:Synthesis, molecular docking, and biological studies[J]. Bioorganic & Medicinal Chemistry,2016,24(19):4587−4599.
[29] 蒋美龄, 陈忠琴, 秦小明, 等. 牡蛎降糖肽的结构表征及其协同花色苷的活性增效作用[J]. 大连海洋大学学报,2023,38(3):455−463. [JIANG Meiling, CHEN Zhongqin, QIN Xiaoming, et al. Structural characterization of oyster glucose-lowering peptides and synergistic synergism of activity by anthocyanins[J]. Journal of Dalian Ocean University,2023,38(3):455−463.] JIANG Meiling, CHEN Zhongqin, QIN Xiaoming, et al. Structural characterization of oyster glucose-lowering peptides and synergistic synergism of activity by anthocyanins[J]. Journal of Dalian Ocean University, 2023, 38(3): 455−463.
[30] 李梦瑶, 梁琪, 宋雪梅. 结合分子对接技术研究牦牛乳干酪苦味肽RK7和KQ7的α-淀粉酶抑制活性[J]. 食品科学,2023,44(2):132−138. [LI Mengyao, LIANG Qi, SONG Xuemei. Using molecular docking to investigate the alpha-amylase inhibitory activity of bitter peptides RK7 and KQ7 derived from yak cheese[J]. Food Science,2023,44(2):132−138.] doi: 10.7506/spkx1002-6630-20220120-197 LI Mengyao, LIANG Qi, SONG Xuemei. Using molecular docking to investigate the alpha-amylase inhibitory activity of bitter peptides RK7 and KQ7 derived from yak cheese[J]. Food Science, 2023, 44(2): 132−138. doi: 10.7506/spkx1002-6630-20220120-197
-
期刊类型引用(1)
1. 朱越,李治宽,高翔,杨静丽,何美军,彭诗琴. 黄精精深加工研究现状. 农业与技术. 2025(04): 35-40 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



