Preparation and Properties of Oat Protein Amyloid Aggregate-Sodium Carboxymethyl Cellulose Composite Film
-
摘要: 为改善燕麦蛋白基复合膜理化特性,本实验将天然燕麦蛋白(OP)改性制备燕麦蛋白淀粉样聚集体(OPA)并进行表征,以此为基质与羧甲基纤维素钠(CMCNa)共同制备复合膜。通过傅里叶红外光谱(FTIR)、差示扫描量热仪(DSC)、扫描电子显微镜(SEM)等方法研究所得复合膜的微观结构及性能,并测定复合膜机械性能、光学性能、含水量、水溶性、水蒸气透过性。结果表明,燕麦蛋白改性后结构发生显著变化,相较于OP/CMCNa复合膜,利用OPA制备的复合膜表面更加光滑,结构更加紧密。且OPA/CMCNa复合膜水溶性较OP/CMCNa复合膜降低了7.02%~15.84%,耐水性显著提高。其中由OPA8制备的复合膜穿刺距离提高到6.513 mm,受力提高到701.2 g,机械性能显著提高。综上,燕麦蛋白淀粉样聚集体可有效改良天然燕麦蛋白基复合膜的透明度、耐水性和机械性能。研究结果可为改性燕麦蛋白复合膜的制备及性能研究提供参考。Abstract: In order to improve the physicochemical properties of oat protein-based composite film, the natural oat protein (OP) was modified to prepare oat protein amyloid aggregates (OPA), and then the composite film was prepared with sodium carboxymethyl cellulose (CMCNa). The microstructure and properties of the composite films were studied by Fourier infrared spectroscopy (FTIR), differential scanning calorimetry (DSC) and scanning electron microscopy (SEM). The mechanical properties, optical properties, moisture content, water solubility and water vapor permeability of the composite films were also determined. The results showed that the structure of the modified oat protein changed significantly. Compared with the OP/CMCNa composite film, the surface of the OPA/CMCNa composite film was smoother and the structure was more compact. Compared with OP/CMCNa composite film, the water solubility of OPA/CMCNa composite film was reduced by 7.02% to 15.84%, and the water resistance of OPA/CMCNa composite film was significantly improved. Among them, the puncture distance of the composite film prepared by OPA8 was increased to 6.513 mm, the force was increased to 701.2 g, and the mechanical properties were significantly improved. In conclusion, oat protein amyloid aggregates can effectively improve the transparency, water resistance and mechanical properties of natural oat protein-based composite films. The results can provide reference for the preparation and properties of modified oat protein composite film.
-
Keywords:
- oat protein /
- amyloid aggregates /
- composite film /
- structural properties /
- mechanical properties
-
包装在食品贮藏、运输和销售方面发挥着至关重要的作用。研究表明传统塑料包装膜不仅在土壤中不易降解,给生态环境带来了巨大压力;且这些高分子塑料在使用期间易迁移至食物中,继而被误食,积累在体内,形成不易降解的微塑料,危害人体健康[1]。因此,开发绿色环保、可降解的食品包装复合膜在食品包装行业具有重要意义。生物质复合膜是一种新型的包装材料,具有优异的生物相容性和易降解性等优点,通常以生物大分子(如蛋白质、多糖、脂质等)为原料,添加增塑剂或交联剂,通过流延、喷涂等方法制备而成[2]。该复合膜作为环境友好型材料,有望代替传统高分子塑料等不易降解材料,正逐渐受到人们的关注。
自组装是指基本构建单元自发形成有序的且具备功能特性的超分子结构的过程。食源性蛋白质可在特定环境下利用蛋白质分子间的相互作用组装淀粉样聚集体,不同的食源性蛋白质可能会形成不同的结构,从而获得不同的功能特性[3]。蛋白淀粉样聚集体是蛋白分子在特定条件下,自发组织或者聚集形成的最终产物。该淀粉样聚集体通常有纳米尺度的厚度和微米范围内的长度,高纵横比等特性,从而能赋予聚集体基材料优良的机械性能[4]。此外,淀粉样聚集体高度有序的氢键网络,也使其具有较高的力学性能[5]。近年来,基于淀粉样聚集体的特殊性能,以此作为模板在有序微纳材料中的应用研究越来越多[6]。相关研究表明,在适当的温度、pH等条件下,如β-乳球蛋白[7]、溶菌酶[8]、燕麦蛋白[9]等均可水解自组装成淀粉样聚集体。
燕麦的总产量居全球第六位,播种面积和总产量仅次于小麦、水稻、玉米、大麦和高粱[10]。与主要谷物类别相比,燕麦含有相对较高的蛋白质(15%~20%)[11]。燕麦蛋白是一种低成本、资源丰富的可再生资源,深入研究其功能特性将有助于开发高附加值产品[12]。近期研究表明,燕麦蛋白除了具有功能性外[13],还可用于制备生物可降解复合膜。但由天然燕麦蛋白开发的复合膜机械性能和阻隔效果较差[14],这严重制约了燕麦蛋白在生物可降解复合膜研究及应用领域的发展。因此亟需开发新型燕麦蛋白基复合膜,以弥补传统天然燕麦蛋白复合膜的不足之处。考虑到食源蛋白类淀粉聚集体的特殊结构性质,在一定条件下对燕麦蛋白改性制备燕麦蛋白淀粉样聚集体,将其应用于复合膜组分中有望改善燕麦蛋白基复合膜的理化特性。
本研究通过对燕麦蛋白改性制备燕麦蛋白淀粉样聚集体并对其进行表征,利用燕麦蛋白和燕麦蛋白淀粉样聚集体作为成膜基质,分别与羧甲基纤维素钠共同制备复合膜,对复合膜表观、色度、耐水性、阻隔性能、机械性能、微观结构及热特性等进行表征,研究淀粉样聚集体对复合膜结构及性能的影响,并选出机械性能优异的燕麦蛋白淀粉样聚集体复合膜。本研究旨在为改善燕麦蛋白基复合膜性能提供新方法。
1. 材料与方法
1.1 材料与仪器
燕麦蛋白(蛋白含量≥80%,干重) 陕西百草鑫田生物科技有限公司;羧甲基纤维素钠(LR) 成都科龙化工试剂厂;甘油(AR)、氢氧化钠(AR) 国药试剂有限公司;盐酸(AR) 南京化学试剂股份有限公司。
HH-42型恒温水浴锅 国华电器有限公司;Lab 1A-50型冻干机 北京博医康实验仪器有限公司;Nano ZES型激光粒度分析仪 英国马尔文仪器有限公司;UV2400型紫外可见分光光度计 上海舜宇恒平科学仪器有限公司;CS-280型色差仪 杭州彩谱科技有限公司;Nicolet iS50型傅里叶变换红外光谱仪 美国赛默飞科技有限公司;J-810型圆二色光谱仪 日本JASCO公司;DSC 204 F1型差示扫描量热仪 德国耐驰仪器制造有限公司;HT7700型透射电子显微镜、Hitachi Regulus 8100型扫描电子显微镜 日本日立公司;TA-XT型质构仪 英国Stable Micro System公司。
1.2 实验方法
1.2.1 燕麦蛋白淀粉样聚集体的制备
取燕麦蛋白100 g加600 mL水,室温下搅拌10 h充分溶解,之后25 ℃离心(10000 r/min,10 min)弃去沉淀,将上液利用再生纤维素透析袋(6000~8000)透析24 h。将透析过的液体均匀分成6份,分别调节pH至2、4、6、8、10、12(记为OP2、OP4、OP6、OP8、OP10、OP12),之后90 ℃加热4 h得到燕麦蛋白淀粉样聚集体溶液,之后冻干备用[15],分别记为OPA2、OPA4、OPA6、OPA8、OPA10、OPA12。
1.2.2 燕麦蛋白淀粉样聚集体的表征
粒径、电位:制备1 mg/mL的OPA样品溶液,采用激光粒度分析仪测定样品粒径及Zeta电位,测定前平衡时间为1 min,测定温度保持在25 ℃,每个样品重复测定3次取平均值;
傅里叶红外光谱:利用傅里叶变换红外光谱仪测定傅里叶变换红外光谱(FTIR),在4000~400 cm−1的范围内采集,利用仪器附带的OMNIC软件对获得的光谱进行分析;
微观结构:将样品稀释到0.1 mg/mL后滴加到由铜网支撑的非晶碳膜上,15 min后用滤纸将铜网上多余的样品移除,用1%(w/v)磷钨酸负染色2 min,多余的磷钨酸用滤纸去除,常温干燥10 min,干燥后采用透射电子显微镜拍摄电子显微照片;
浊度:测定不同OPA溶液(1 mg/mL)在波长600 nm处的吸光度即为该样品的浊度值;
圆二色性光谱:将OPA样品制备0.1 mg/mL溶液,用于圆二色性光谱测定。
1.2.3 燕麦蛋白复合膜的制备
基于OPA表征结果选择具有代表性的燕麦蛋白淀粉样聚集体样品OPA2、OPA8、OPA12,与羧甲基纤维素钠共同制备复合膜。制备4%(w/v)燕麦蛋白淀粉样聚集体溶液和2%(w/v)的羧甲基纤维素钠溶液,磁力搅拌1 h,之后等比例混合均匀,添加1.5%(w/v)的甘油,搅拌20 min。之后将溶液于60 ℃水浴中搅拌加热30 min,取出后冷却至室温,将20 mL成膜溶液倒在内径为9 cm的培养皿上,静置2 min,于60 ℃烘干12 h[16]。燕麦蛋白样品OP2、OP8、OP12相同条件下制膜与燕麦蛋白淀粉样聚集体膜进行对比,研究相同pH条件下燕麦蛋白淀粉样聚集体对复合膜特性的影响。最后将干燥好的燕麦蛋白淀粉样聚集体膜和燕麦蛋白膜从培养皿上小心地剥离,复合膜样品保存在干燥器(RH=62%)中。
1.2.4 复合膜不透明度的测定
使用紫外分光光度计测定复合膜的不透明度[17]。将复合膜样品切成4 cm×1 cm的条带,粘附于比色皿一侧的内表面,在600 nm处测定吸光度,空比色皿作对照。通过以下公式计算不透明度:
不透明度(A/mm)=A/x 式中,A为复合膜在600 nm处的吸光度;x为复合膜厚度(mm)。
1.2.5 复合膜色泽测定
使用手持式色度计测定复合膜色泽,并记录每个样品的L*值、a*值和b*值。每个样品测定5次,取其平均值。总色差ΔE,按以下公式计算[18]:
ΔE=√(a∗)2+(b∗)2+(L∗)2 1.2.6 复合膜水分含量(Moisture Content,MC)的测定
称量复合膜样品(记录为M0,g),并在105 ℃的烤箱中干燥至恒重(记录为M1,g)。对于每种复合膜,重复测定三次确定其水分含量,并根据复合膜的重量损失计算其水分含量(MC):
MC(%)=M0−M1M0×100 1.2.7 复合膜水溶性(Water Solubility,WS)的测定
参照胡瀚文等[19]的方法测定复合膜的溶解度。将膜(2 cm×2 cm)在105 ℃下干燥至恒重,记录为M1,并在25 ℃下浸入50 mL蒸馏水中持续24 h。然后收集复合膜并在105 ℃的烘箱中干燥至恒重,记录为M2,膜的WS通过下式计算:
WS(%)=M1−M2M1×100 1.2.8 复合膜水蒸气透过率(Water Vapor Permeability,WVP)的测定
使用文献中的方法测定WVP并稍作修改[20]。将复合膜样品放置在装有20 mL蒸馏水的烧杯上(直径39 mm,深度52 mm),并用封口膜密封,立即将样品移入装有硅胶(相对湿度为0‰)的干燥器中,在规定时间内使硅胶吸收通过复合膜的水,根据下列公式计算WVP。
水蒸气透过率(g⋅(m⋅s⋅Pa)−1)=Δm×xS×ΔP×t 式中,x为膜厚,mm;S为有效面积,S=16.61×10−4 m2;Δm为水分透过的质量,g;t为间隔时间,s;ΔP为膜两边的压强差,ΔP=3167 Pa(25 ℃)。
1.2.9 复合膜机械性能的测定
根据蔡月等[21]的方法并稍作修改进行复合膜的质构测试。将复合膜切成2.0 cm×2.0 cm的正方形,穿刺速度设置为50 mm/min,复合膜样品用夹具夹紧。
1.2.10 复合膜微观结构测定
使用在10 kV加速电压下操作的场发射扫描电子显微镜分析复合膜的微观结构,并垂直于复合膜表面拍照[22]。
1.2.11 复合膜热特性测定
将复合膜放在密封的约5 mg标准铝盘中,DSC曲线在25~250 ℃的温度范围内,氮气作保护气,加热速率20 ℃/min[23]。
1.2.12 复合膜分子间相互作用分析
傅里叶变换红外光谱仪用于测定4000~400 cm−1范围内复合膜的化学结构,并扫描未放置样品、室温状态下的空气作为扫描背景,通过OMNIC软件分析[24]。
1.3 数据处理
数据表示为平均值±标准差。在IBM SPSS Statistics 26使用单因素方差分析进行统计分析,如果P<0.05,则统计学差异显著。使用Origin 2023软件进行数据处理和图表分析。
2. 结果与分析
2.1 pH对燕麦蛋白淀粉样聚集体形成的影响
2.1.1 不同pH条件对OPA粒径的影响
本实验首先在不同pH条件下制备了不同OPA,探究pH条件对OPA结构特性的影响。粒径能较为直观地反映OPA的颗粒大小与聚集程度,PDI代表聚合物粒径的均一程度。在不同pH条件下,燕麦蛋白热聚集后生成的淀粉样聚集体大小不同,不同pH条件下OPA粒径呈现出单峰或双峰分布,说明此时燕麦蛋白热聚集生成大颗粒OPA的同时,会有部分蛋白形成较小颗粒OPA。不同OPA的平均粒径及PDI如表1所示。pH2~6区间内OPA平均粒径表现出增大的趋势。随着pH的增大慢慢接近燕麦蛋白等电点,燕麦蛋白在pH6条件下生成的OPA颗粒平均粒径最大(447.73±6.07 nm),此时接近燕麦蛋白等电点,分子之间的静电斥力小发生聚集,导致OPA的平均粒径较大。之后,随着pH的继续增加,体系中蛋白质逐渐远离了其等电点,导致蛋白质分子间斥力增加,溶解性增强,因此碱性环境下的OPA样品平均粒径均降低,其中OPA8粒径呈现最小值(119.50±3.36 nm)。此外,热效应使蛋白质分子链展开,内部疏水基团暴露,分子间发生疏水相互作用形成淀粉样聚集体。当溶液碱性增强,蛋白分子间作用力增强,聚集程度增大[25],因此,与OPA8相比,OPA10和OPA12的粒径略有增加。
表 1 不同OPA粒径、PDI、Zeta电位、浊度结果Table 1. Results of particle size, PDI, Zeta potential, turbidity for various OPAOPA种类 粒径(nm) PDI Zeta电位(mV) 浊度(OD600 nm) OPA2 190.26±10.17ab 0.28±0.03 0.88±0.07f 0.064±0.004b OPA4 407.90±24.06c 0.21±0.05 0.47±0.01e 0.081±0.009d OPA6 447.73±6.07c 0.34±0.01 −0.19±0.06d 0.091±0.008e OPA8 119.50±3.36a 0.26±0.04 −0.34±0.11c 0.054±0.004a OPA10 137.67±41.60a 0.41±0.07 −0.76±0.08b 0.063±0.004b OPA12 199.86±51.67ab 0.32±0.02 −1.22±0.16a 0.070±0.008c 注:同列肩标字母不同表示不同组间存在显著性差异(P<0.05),表2~表3同。 2.1.2 不同pH条件对OPA Zeta电位的影响
不同pH条件下OPA的Zeta电位值如表1所示,不同pH下OPA的电位值均呈现显著性变化(P<0.05),其中OPA2样品Zeta电位表现出相对较大的正值,表明此时体系pH远低于OPA等电点,蛋白质中的氨基带正电而羧基被中和。随着pH的增加,OPA的Zeta电位逐渐降低。在pH6~12范围内,OPA的Zeta电位均为负值,表明此时蛋白表面的羧基发生解离使其表现为电负性,而氨基被中和。其中OPA6的电位绝对值最小(−0.19±0.06 mV),这是由于此时体系pH接近OPA等电点,蛋白质分子多以两性离子形式存在,分子间静电斥力最弱,分子净电荷最小。以上结果表明OPA溶液的电荷性变化与蛋白质中的氨基和羧基间电离平衡相关,体系pH通过影响蛋白质侧链上的羧基和氨基的解离程度,进而对蛋白表面所带电荷产生影响[26]。
2.1.3 不同pH条件对OPA浊度的影响
浊度反映了蛋白颗粒在溶液中的分散状态。不同pH条件下OPA溶液浊度结果如表1所示,在pH2~6范围内,样品浊度值逐渐升高,当pH为6时,因其靠近等电点,OPA溶液的浊度值最高,说明此时OPA颗粒最大。在pH8的条件下OPA溶液的浊度达到最低值,原因可能是燕麦蛋白在偏碱性条件下分子内基团暴露程度高,在溶液中分散性好,同时非共价键的相互作用使得体系较稳定,分子间聚集程度减弱。在pH8~12范围内,样品浊度值呈现复升高趋势,更强的碱性环境导致蛋白分子间的相互作用力的增加,蛋白分子间再次交联,导致浊度值增加[27]。
2.1.4 不同pH条件对OPA二级结构的影响
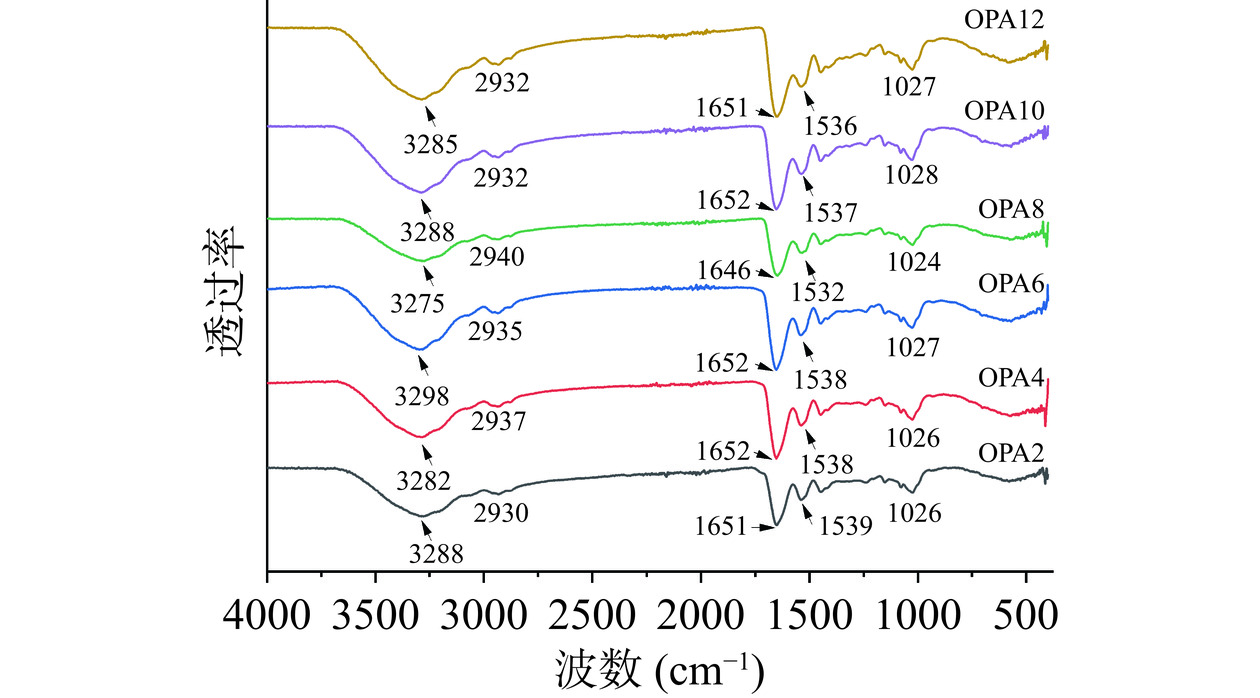
不同OPA的傅里叶红外光谱图如图1所示。在3500~3200 cm−1之间显示出特征性宽吸收带,这归因于羟基(-OH)基团的伸缩振动,在2932 cm−1附近的强烈峰归属于C-H伸缩振动,在1651 cm−1和1538 cm−1附近的两个吸收带分别与C=O和C=C的伸缩振动有关,1026 cm−1附近的振动峰归因于C-O拉伸振动。OPA的以上特征峰在不同pH条件下发生了不同程度的偏移,这可能与不同pH条件下蛋白质分子的电荷状态和聚集程度相关。此外,热处理也会影响到蛋白质的空间结构,如破坏分子内氢键,促进分子间相互作用力等。
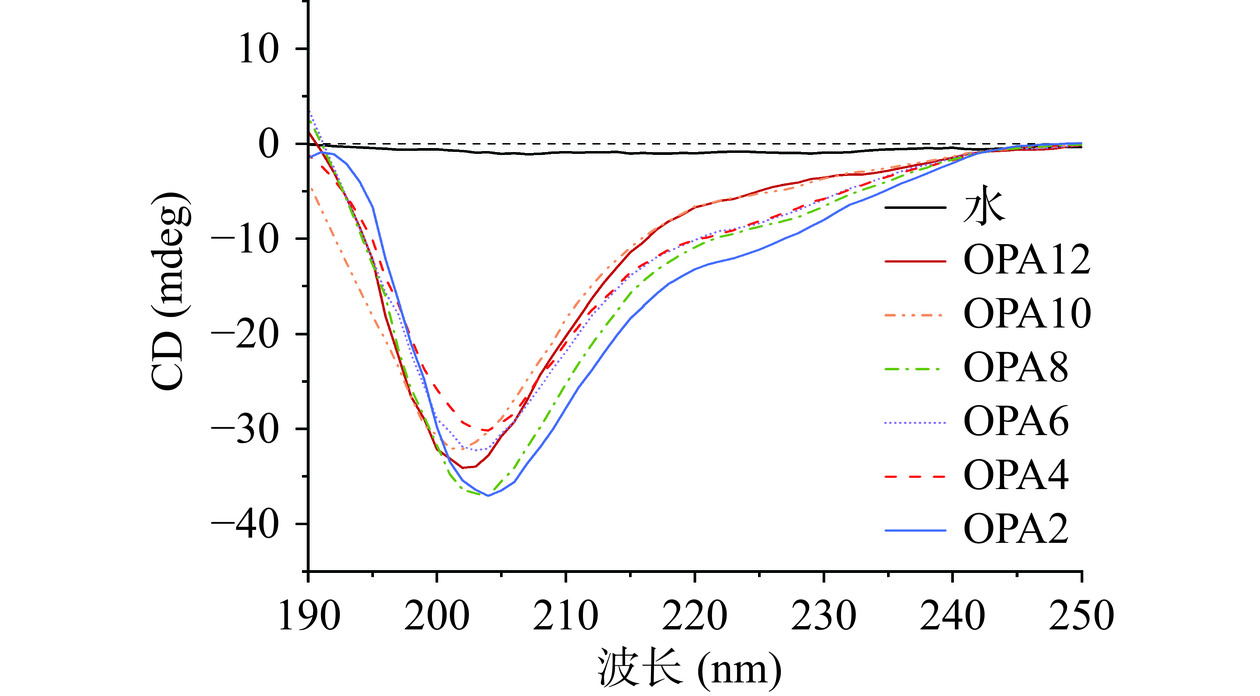
圆二色光谱是一种测定稀释溶液蛋白质构象的敏感技术,通常用于评估蛋白聚集过程中的二级结构变化[26]。图2所示为不同OPA圆二色光谱图,波长范围190~250 nm。从图中可以看出,OPA在200~210 nm处有个负峰。通过利用CD分析软件Dichroweb计算了不同OPA中四种二级结构的百分含量,结果见表2。从表中可以看出,随着pH的增加,α-螺旋相对含量逐渐降低,而β-折叠和无规则卷曲相对含量逐渐升高。α-螺旋结构的稳定性主要来源于羰基(C=O)和氨基(-NH2)之间的氢键。此外,β-折叠结构的稳定性取决于蛋白质分子肽链之间氢键的形成[28]。在热处理过程中,这些氢键逐渐被破坏,导致燕麦蛋白的α-螺旋结构解绕,其氨基酸残基重新结合形成新二级结构。而这种氨基酸残基重排行为主要与其电荷状态和聚集程度有关,即与溶液体系的pH变化相关[29]。由表2可知,随体系的pH的增加,蛋白质分子中部分α-螺旋结构转化为β-折叠。α-螺旋相对含量的降低表明蛋白质变得更加柔韧和未折叠,而β-折叠相对含量的增加表明热处理后蛋白质的聚集程度增加。α-螺旋的减少和β-折叠的增加使得蛋白质骨架稳定,结构有序。燕麦蛋白改性处理使分子展开,进一步增加了分子的无序性,同时热处理使肽链伸展,暴露疏水基团,增加蛋白质表面疏水性[30]。这就意味着分子间的氢键作用会加强,从而导致OPA的聚集程度会变得更大。
表 2 不同OPA的二级结构相对含量Table 2. Secondary structure content of various OPAOPA种类 α-螺旋(%) β-折叠(%) β-转角(%) 无规则卷曲(%) OPA2 58.00±0.58e 1.50±0.08a 18.60±0.29c 19.20±0.43a OPA4 57.60±0.41d 3.30±0.20b 19.10±0.54d 19.80±0.35a OPA6 56.80±0.20d 3.50±0.16b 19.40±0.39d 20.20±0.17a OPA8 48.20±0.62c 6.20±0.25c 18.40±0.28c 26.70±0.16b OPA10 28.90±0.23b 14.70±0.34d 17.30±0.16b 37.60±0.37c OPA12 25.60±0.29a 18.10±0.43e 16.40±0.45a 38.40±0.61d 2.1.5 不同pH条件的OPA的TEM表征
TEM被广泛用于观察蛋白微观结构[31]。天然燕麦蛋白及不同OPA的TEM图像如图3所示。天然燕麦蛋白呈圆球状,未联结聚集。而经过改性后的OPA在形态上有显著差异,OPA2呈纳米纤维状,具有较大的纵横比,低pH和高温的结合促进蛋白质的水解,有助于淀粉样原纤维的自组装[32]。OPA8形貌为成簇的球状聚集体,形状不规则,聚集体颗粒间聚合联结。OPA12呈现出的纳米纤维尺度更小,并伴有小颗粒的聚集体,较高的pH下,疏水性减弱,而二硫键的交联相对稳定。不同pH条件下的热聚集通过影响稳定蛋白质结构的力的平衡,例如内部氢键、范德华相互作用和疏水相互作用[33],从而使不同的OPA形态产生显著差异。
综上所述,在不同的pH环境下,燕麦蛋白淀粉样聚集体的形成受到了显著影响,这一变化不仅涉及聚集体的粒径大小和Zeta电位,还影响了其浊度、二级结构以及微观结构等多个方面。粒径结果显示OPA8表现出最小的粒径。OPA2的FTIR图谱展现出明显区别于其他样品的特征峰,且其TEM图像表现出特有的淀粉样纤维结构。OPA12的β-折叠含量较高,呈现出稳定的淀粉样聚集体状态。因此本研究挑选OPA2、OPA8、OPA12进行后续的复合膜制备,并以OP复合膜作为对照,研究淀粉样聚集体对复合膜理化特性的影响。
2.2 OPA/CMCNa复合膜的表征
2.2.1 复合膜不透明度分析
不透明度是评估食品包装膜包装性的重要指标[34]。不同OP/CMCNa复合膜和OPA/CMCNa复合膜的不透明度结果如图4。pH的变化对复合膜样品不透明度的影响较大,pH8时两种复合膜的不透明度在同种类型复合膜中均表现出最低值,透明度最好;而在pH12条件下两种复合膜样品不透明度相对较高,透明度差,可能是在强碱性条件下均匀性差,从而使得复合膜透明度较低[35]。酸性或碱性条件下两种复合膜都表现出高不透明度,而在中性条件下不透明度最低[36]。OPA/CMCNa复合膜和OP/CMCNa复合膜相比,同pH的OPA/CMCNa复合膜不透明度值明显低于OP/CMCNa复合膜,说明热处理形成的燕麦蛋白淀粉样聚集体提高了复合膜透明度。燕麦蛋白在热处理过程中,蛋白分子解离后重排,溶解度也发生变化,使复合膜透明度提高。
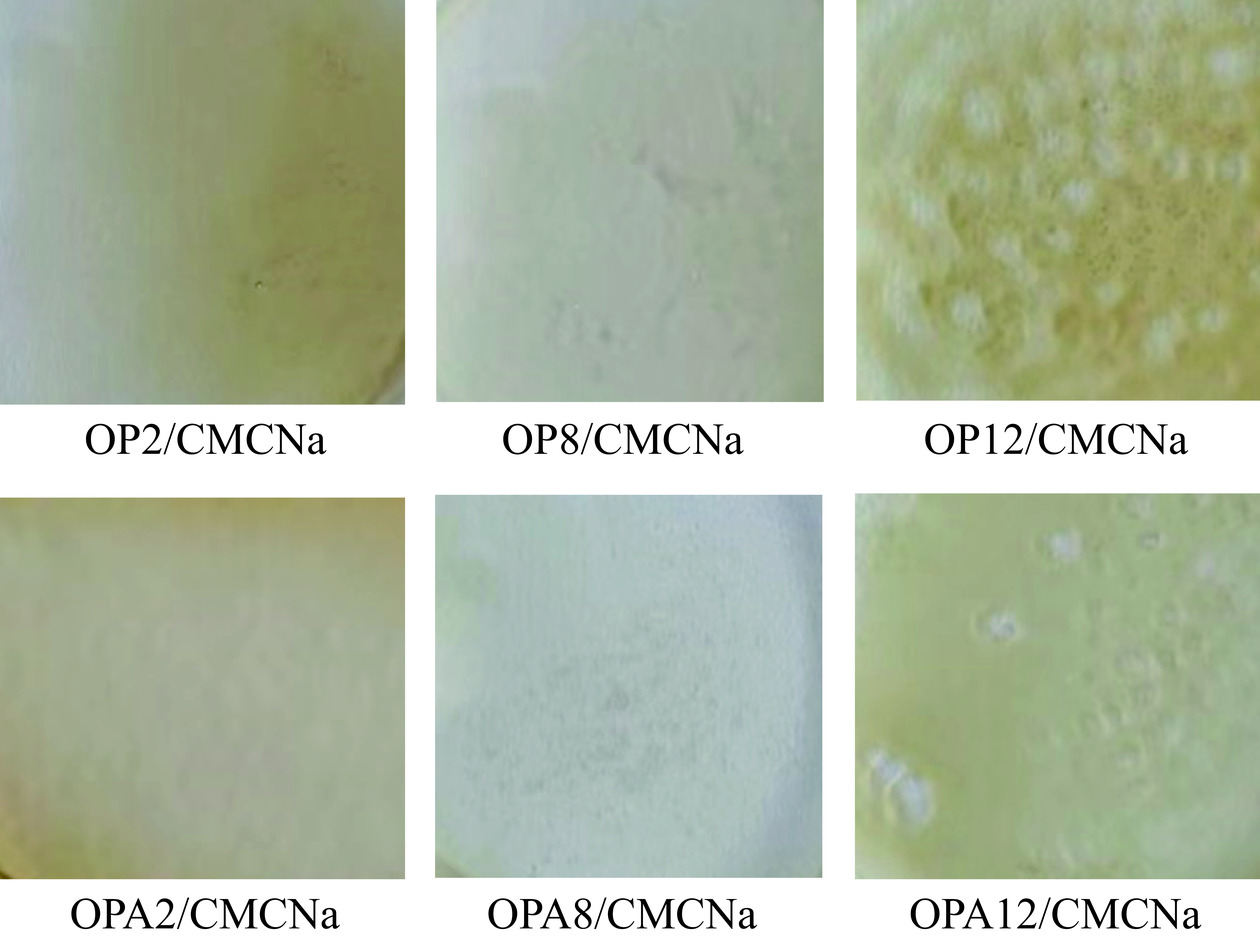
图5是不同类型复合膜的表观图片,不同OP/CMCNa复合膜和OPA/CMCNa复合膜照片是通过覆盖在白色纸张上进行拍摄的,它们的不同之处主要表现在颜色与表面平整度上。不同pH条件对复合膜样品色泽影响较大,pH2条件下形成的OP2复合膜表现为棕黄色,随着pH的升高,复合膜颜色变淡,OP8/CMCNa复合膜表现为淡黄色,接着复合膜颜色随着pH的升高逐渐加深变为深黄色。OP12/CMCNa复合膜与OPA12/CMCNa复合膜的对比最为明显,OP12/CMCNa复合膜表面凹凸不平,出现较多坑洼,表现为深黄色;OPA12/CMCNa复合膜颜色较浅呈淡黄色,表面坑洼明显减少,平整度更高。总体来看,OPA/CMCNa复合膜表观情况更具优势,同时,复合膜表面情况也与其机械性能相关,在后续机械性能测试结果中也有直观体现。
2.2.2 复合膜色差值分析
不同类型的燕麦蛋白膜和燕麦蛋白淀粉样聚集体膜色差值列于表3中,其中L*表示膜的亮度;a*表示红色(+)和绿色(-),b*表示黄色(+)或蓝色(-);ΔE表示膜的色差。结果显示,pH8条件下的两种复合膜表现出优异的透明度,具有较高的亮度(L*值分别为85.41±3.01和85.18±1.03)。相同pH条件下,与OP/CMCNa复合膜相比,OPA/CMCNa复合膜的L*值均有所降低,说明OPA/CMCNa复合膜结构更紧密,减少了复合膜的透光率[37]。同一pH条件下,OPA/CMCNa复合膜a*值明显升高,而b*值明显下降,这表明OPA/CMCNa复合膜显示出的红色值更高,而黄色值较弱。ΔE结果表明pH对OPA复合膜色差影响显著(P<0.05),强酸(pH2)或强碱(pH12)条件下复合膜亮度均显著下降(P<0.05),此时复合膜颜色变深,色泽加深,这可能与不同pH下蛋白质的聚集程度相关。
表 3 不同复合膜色差值结果Table 3. Results of color difference values for various films样品 L* a* b* ΔE OP2/CMCNa 83.03±0.99bc 0.26±0.35ab 13.91±0.93bc 84.19±0.95ab OP8/CMCNa 85.41±3.01d 0.09±0.55b 7.40±3.51a 85.82±2.70b OP12/CMCNa 83.42±1.08bc 0.31±0.15ab 16.36±1.62c 85.03±0.87ab OPA2/CMCNa 82.74±0.58ab 0.38±0.29ab 11.16±1.01b 83.50±0.63a OPA8/CMCNa 85.18±1.03d 0.09±0.45b 4.76±0.30a 85.32±0.92b OPA12/CMCNa 81.44±1.53a 0.85±0.64a 15.91±2.60c 83.03±1.29a 2.2.3 复合膜水分含量和水溶性分析
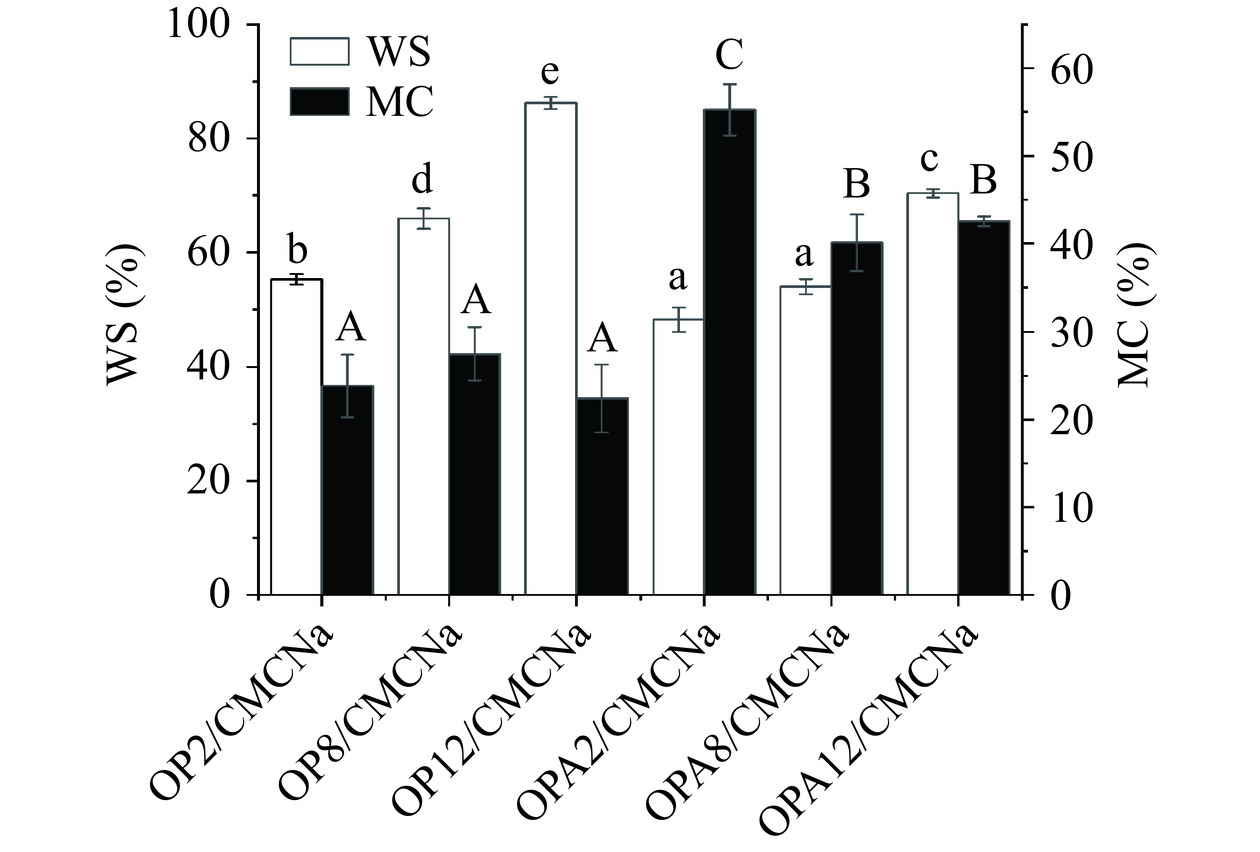
复合膜的水分含量(MC)和水溶性(WS)经常被用来表示复合膜对水的抵抗能力,图6展现出不同复合膜含水量和水溶性结果。不同pH下OP/CMCNa复合膜的MC值无显著性差异,且同等pH下OPA/CMCNa复合膜的MC值均显著高于OP/CMCNa复合膜(P<0.05),这可能是因为生物大分子的热处理和变性过程中形成的分子间二硫键及其与羧甲基纤维素钠之间的相互作用,使复合膜具有更强的保水能力。WS结果表明两种复合膜均表现为与pH正相关,不同pH下OP/CMCNa复合膜的WS值显著性增加(P<0.05),同等pH条件下OPA/CMCNa复合膜水溶性相较于OP/CMCNa复合膜降低了7.02%~15.84%,表明OPA使复合膜耐水性显著提高。可能是因为OPA中存在燕麦蛋白小分子转变为大分子聚集体,使其溶解性降低。且这些大分子聚集体易与羧甲基纤维素钠之间形成更多氢键,从而减少了与水相互作用的活性位点的数量,并增加了膜的疏水性[38],使复合膜更难于受到水分子的侵蚀。
2.2.4 复合膜水蒸气透过率分析
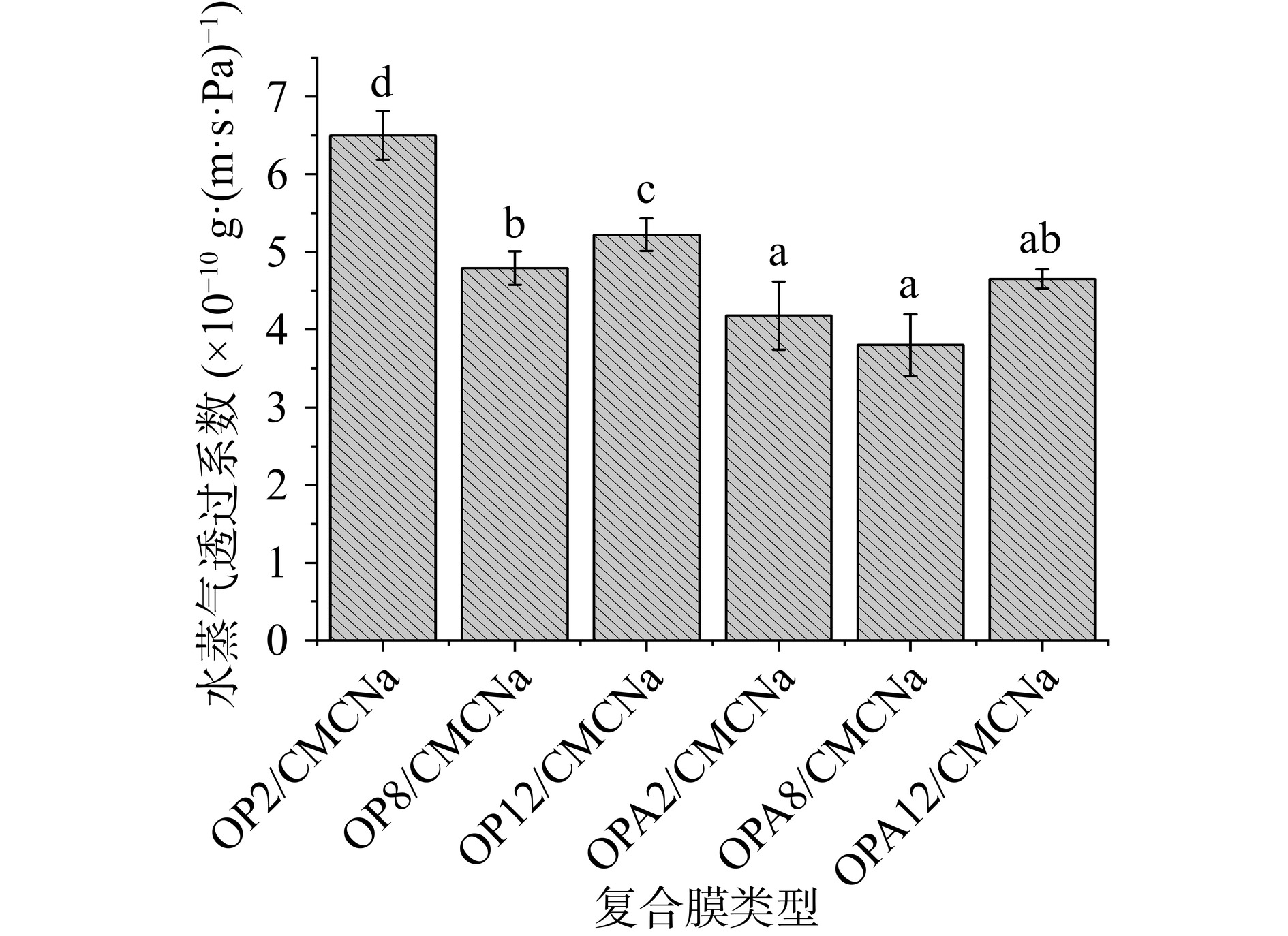
水蒸气透过性(WVP)测定从食物转移到环境中的水分。复合膜需要较低的WVP,以最大限度地减少食物脱水并保持新鲜度[39]。不同类型的OP/CMCNa复合膜和OPA/CMCNa复合膜水蒸气透过率如图7所示,pH条件的改变对复合膜WVP的影响显著(P<0.05),随着pH的增加OP/CMCNa膜和OPA/CMCNa膜都表现为先降低后升高。相同条件下OPA/CMCNa复合膜的WVP值与OP/CMCNa复合膜相比显著降低(P<0.05),OPA8/CMCNa复合膜最低为3.80×10−10 g·(m·s·Pa)−1,表明OPA/CMCNa复合膜对水汽的阻隔效果更好。可能是因为pH条件的改变及热变性促使分子间更多二硫键的生成,OPA与羧甲基纤维素钠交联形成了一个新的紧凑的空间网络,使水分子更难通过[40],使复合膜具有更好的阻隔效果。
2.2.5 复合膜机械性能分析
复合膜的机械性能至关重要,因为它们影响复合膜的耐久性和完整性[41]。为了获得复合膜的最佳力学性能,对不同复合膜的机械性能进行了测试,结果如图8所示。随着穿刺距离的增加,不同方法制备的复合膜受力不同,其中OPA12/CMCNa复合膜的受力最大,达到766.3 g。此外,从穿刺复合膜所需的距离来看,OPA2/CMCNa复合膜需要的刺破长度最大,为6.99 mm。总体来看,OPA8/CMCNa复合膜效果最好,穿刺距离和受力均有显著提升,穿刺距离提高到6.513 mm,受力提高到701.2 g。相同pH条件下,相较于OP/CMCNa复合膜,OPA/CMCNa复合膜展现出显著增强的受力与刺破距离,表明其机械性能得到显著提升。这是因为蛋白分子之间产生了大量的氢键、二硫键等分子间作用力与羧甲基纤维素钠的连接作用增强,形成的复合膜结构稳定,表现出较好的机械性能[42]。这一优化使得OPA/CMCNa复合膜在实际应用中更能承受外部压力,增加了其耐用性和稳定性。
2.2.6 复合膜微观结构分析
扫描电子显微镜可以直观地显示复合膜样品的微观结构,这与复合膜的机械性能、WVP、水溶性等性能密切相关[43]。不同类型的OP/CMCNa复合膜和OPA/CMCNa复合膜表面形态如图9所示,从图中可以清楚地看出,OP/CMCNa复合膜和OPA/CMCNa复合膜的表面形态存在显著差异,且pH条件的改变对复合膜的微观结构也有一定的影响。OP2/CMCNa复合膜表面出现一些小裂缝,这可能是因为此时复合膜内部结构较为松散,内部连接不紧密所致。而随着pH的增加,膜表面形态明显改善,OP8/CMCNa复合膜表面更为平整,但出现较多气泡;OP12/CMCNa复合膜表面相对粗糙,出现明显凸起纹路,这可能是由于燕麦蛋白在羧甲基纤维素钠基体中分散不均匀所致[44]。而OPA/CMCNa复合膜表现出较好的平整性和均一性:OPA2/CMCNa复合膜表面光滑未见裂缝,OPA8/CMCNa复合膜表现出较少的气泡数量,OPA12/CMCNa复合膜表面相对平整,未见明显凸起。利用OPA制备的复合膜样品的微观结构得到了明显改善,相较于OP/CMCNa复合膜,OPA/CMCNa复合膜具有更均匀、光滑的表面形态。结果表明OPA的加入增加了复合膜网络结构的致密性和稳定性。
2.2.7 复合膜热特性分析
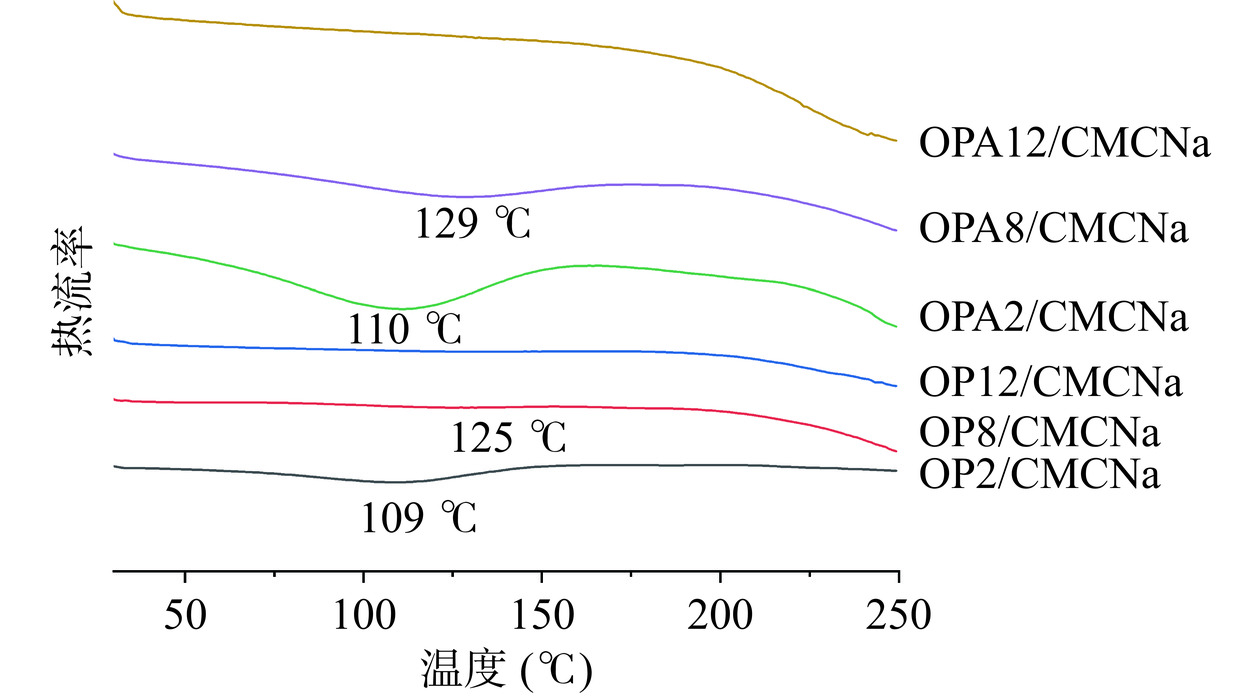
差示扫描量热法(DSC)是研究复合膜热稳定性的一项重要技术。OPA/CMCNa和OP/CMCNa复合膜的DSC曲线如图10,通过曲线分析可知复合膜变性温度。从图中可以看出,在100~150 ℃之间有一个较宽的吸热峰,这与复合膜中的水分蒸发有关[45]。OPA2/CMCNa复合膜和OP2/CMCNa复合膜相比其变性温度无明显差异,但OPA/CMCNa膜热变性所需的能量更高;OPA8/CMCNa复合膜较OP8/CMCNa复合膜变性温度有所提高,显示出更好的热稳定性,这可能归因于在蛋白质聚集过程中蛋白质分子结构的变化,驱动氢键和羟基形成更稳定的结构,打破这些化学键需要更高的热量[46]。
2.2.8 复合膜二级结构分析
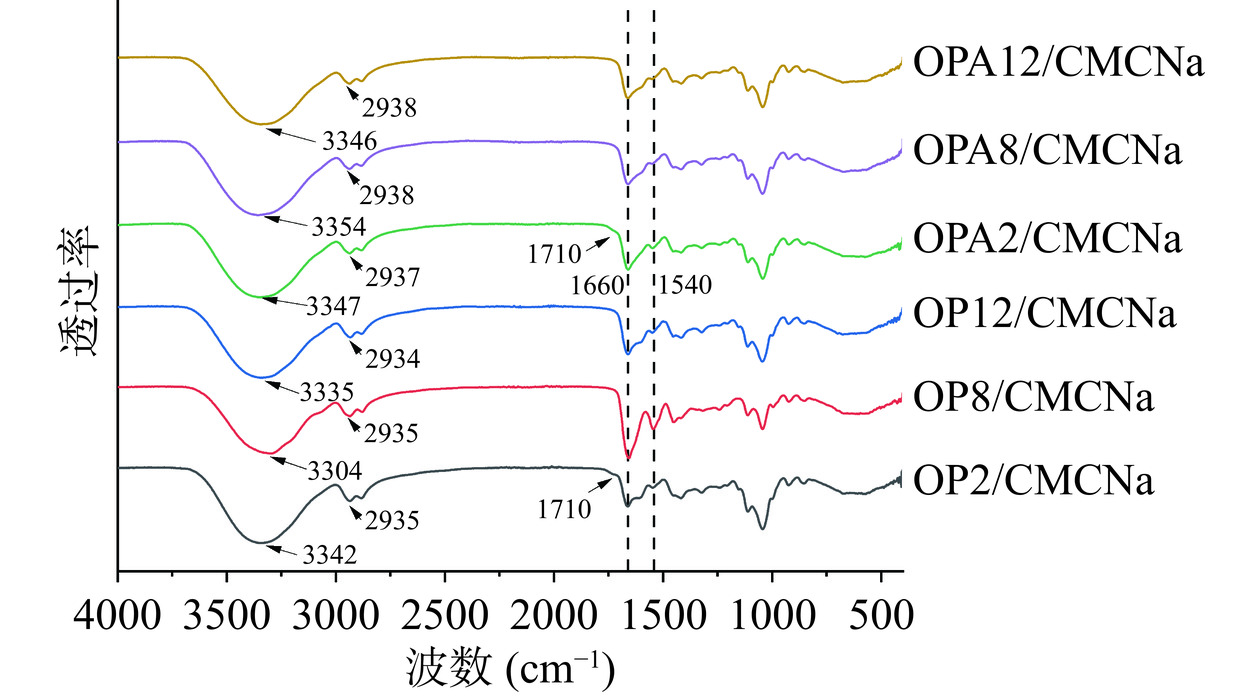
FTIR是用来表征分子间相互作用的一种方法,可以反映样品之间特征基团的不同[47]。图11显示了不同的OP/CMCNa复合膜和OPA/CMCNa复合膜在4000~400 cm−1范围内的FTIR图谱。由图中可以看出,OP2/CMCNa复合膜和OPA2/CMCNa复合膜在1710 cm−1附近出现了明显的区别于其他样品的吸收峰,且在燕麦蛋白淀粉样聚集体表征结果中pH2时的燕麦蛋白淀粉样聚集体同样在此范围内出现了特征峰,因此说明pH对聚集体二级结构的影响会导致其所形成的复合膜二级结构发生相应的改变。OPA/CMCNa复合膜在1660、1540 cm−1处的峰值强度明显低于OP/CMCNa复合膜,说明OPA/CMCNa复合膜内部分子构象均发生改变。其中1660 cm−1处属于C=O伸缩振动[48],1540 cm−1是特征振动吸收峰,由于N-H弯曲振动产生,表明OPA/CMCNa复合膜主肽链上C=O伸缩振动有所减弱,分子中更多的-OH与水作用形成氢键。在所有的复合膜中3600~3200 cm−1范围内的宽峰归因于-O-H、-C-H的拉伸或分子内和分子间的氢键作用,2935 cm−1处的峰是由于C-H伸缩振动引起。OPA/CMCNa复合膜在3342 cm−1处的峰宽有不同程度的增加,在2935 cm−1处的峰强度有所降低,特别是OPA8/CMCNa复合膜变化最为明显,可能是由于分子间氢键的形成。OPA8/CMCNa较OP8/CMCNa在3304 cm−1的吸收峰蓝移至3354 cm−1,移动范围最大,这是由于燕麦蛋白淀粉样聚集体的氨基与羧甲基纤维素钠的羟基之间发生了分子键合,宏观表现为具有较好的拉伸强度[17]。
综上,燕麦蛋白淀粉样聚集体的加入对复合膜的结构特性产生了显著影响。相较于OP/CMCNa复合膜,OPA/CMCNa复合膜展现出更好的表面平整度、更高的透明度和更优越的表观性能。水溶性及水蒸气透过率结果显示OPA/CMCNa复合膜水溶性较OP/CMCNa复合膜降低了7.02%~15.84%,耐水性更强,OPA8/CMCNa复合膜WVP最低为3.80×10−10 g·(m·s·Pa)−1,对水汽的阻隔效果明显提升。此外,SEM及DSC结果显示OPA/CMCNa复合膜表面无裂缝和凹凸,呈现出平整均一的状态,表现出更好的致密性和热稳定性。FTIR和机械性能测试结果证实OPA/CMCNa复合膜内部氢键增加,各组分之间的相互作用力明显增强,机械性能得到显著提升。这些结果共同表明,燕麦蛋白淀粉样聚集体的加入对复合膜的性能进行了多方面的优化,使其在实际应用中更具潜力和价值。
3. 结论
本研究通过在不同pH条件下热处理制备燕麦蛋白淀粉样聚集体,并以此为基质与羧甲基纤维素钠共同制备复合膜,通过微观结构、二级结构、热特性、机械性能、不透明度、水溶性、水蒸气透过率等来研究对复合膜结构及性能的影响。不同pH条件热处理制备的OPA表现出显著的结构差异。在不同的pH环境下,燕麦蛋白淀粉样聚集体的形成受到了显著影响,OPA8表现出最小的粒径,较高的聚集程度。OPA2的FTIR图谱展现出明显区别于其他样品的特征峰,且其TEM图像表现出特有的淀粉样纤维结构。OPA12的β-折叠含量较高,呈现出稳定的淀粉样聚集体状态。此外,由OPA制备的复合膜也表现出优异的薄膜特性。SEM结果显示OPA/CMCNa复合膜表面平整光滑,无裂缝和凹凸。FTIR结果显示OPA/CMCNa复合膜内部氢键作用更强,结构紧密。机械性能结果显示,OPA8/CMCNa复合膜穿刺距离提高到6.513 mm,受力提高到701.2 g,穿刺距离和受力均有显著提升,复合膜机械性能显著提高。总体来看,由燕麦蛋白淀粉样聚集体制备的复合膜表现出优异的透明度、表面平整度、耐水性、热特性、阻隔特性及机械性能。其中OPA8/CMCNa复合膜表面平整均一,透明度较高,表现出较低的水蒸气透过率,较强的耐水性,热稳定性和良好的机械性能,具有广阔的应用前景。本研究为改善燕麦蛋白基复合膜特性提供了新思路。
-
表 1 不同OPA粒径、PDI、Zeta电位、浊度结果
Table 1 Results of particle size, PDI, Zeta potential, turbidity for various OPA
OPA种类 粒径(nm) PDI Zeta电位(mV) 浊度(OD600 nm) OPA2 190.26±10.17ab 0.28±0.03 0.88±0.07f 0.064±0.004b OPA4 407.90±24.06c 0.21±0.05 0.47±0.01e 0.081±0.009d OPA6 447.73±6.07c 0.34±0.01 −0.19±0.06d 0.091±0.008e OPA8 119.50±3.36a 0.26±0.04 −0.34±0.11c 0.054±0.004a OPA10 137.67±41.60a 0.41±0.07 −0.76±0.08b 0.063±0.004b OPA12 199.86±51.67ab 0.32±0.02 −1.22±0.16a 0.070±0.008c 注:同列肩标字母不同表示不同组间存在显著性差异(P<0.05),表2~表3同。 表 2 不同OPA的二级结构相对含量
Table 2 Secondary structure content of various OPA
OPA种类 α-螺旋(%) β-折叠(%) β-转角(%) 无规则卷曲(%) OPA2 58.00±0.58e 1.50±0.08a 18.60±0.29c 19.20±0.43a OPA4 57.60±0.41d 3.30±0.20b 19.10±0.54d 19.80±0.35a OPA6 56.80±0.20d 3.50±0.16b 19.40±0.39d 20.20±0.17a OPA8 48.20±0.62c 6.20±0.25c 18.40±0.28c 26.70±0.16b OPA10 28.90±0.23b 14.70±0.34d 17.30±0.16b 37.60±0.37c OPA12 25.60±0.29a 18.10±0.43e 16.40±0.45a 38.40±0.61d 表 3 不同复合膜色差值结果
Table 3 Results of color difference values for various films
样品 L* a* b* ΔE OP2/CMCNa 83.03±0.99bc 0.26±0.35ab 13.91±0.93bc 84.19±0.95ab OP8/CMCNa 85.41±3.01d 0.09±0.55b 7.40±3.51a 85.82±2.70b OP12/CMCNa 83.42±1.08bc 0.31±0.15ab 16.36±1.62c 85.03±0.87ab OPA2/CMCNa 82.74±0.58ab 0.38±0.29ab 11.16±1.01b 83.50±0.63a OPA8/CMCNa 85.18±1.03d 0.09±0.45b 4.76±0.30a 85.32±0.92b OPA12/CMCNa 81.44±1.53a 0.85±0.64a 15.91±2.60c 83.03±1.29a -
[1] 郑玉玺, 董蕾, 韩明, 等. 壳聚糖-荔枝木质精油可食膜的性能及在冷鲜鸡肉保鲜中的应用[J]. 食品工业科技,2021,42(6):214−219. [ZHENG Y X, DONG L, HAN M, et al. Preparation of edible film based on chitosan-litchi wood essential oil and its application on chilled chicken storage[J]. Science and Technology of Food Industry,2021,42(6):214−219.] ZHENG Y X, DONG L, HAN M, et al. Preparation of edible film based on chitosan-litchi wood essential oil and its application on chilled chicken storage[J]. Science and Technology of Food Industry, 2021, 42(6): 214−219.
[2] 李帅, 孙帆. 可食膜的制备及其在食品工业中的研究进展[J]. 农业科技与信息,2023(8):145−148. [LI S, SUN F. Preparation of edible film and its research progress in food industry[J]. Agricultural Science-Technology and Information,2023(8):145−148.] doi: 10.3969/j.issn.1003-6997.2023.08.034 LI S, SUN F. Preparation of edible film and its research progress in food industry[J]. Agricultural Science-Technology and Information, 2023(8): 145−148. doi: 10.3969/j.issn.1003-6997.2023.08.034
[3] TOMADONI B, CAPELLO C, VALENCIA G A, et al. Self-assembled proteins for food applications:A review[J]. Trends in Food Science & Technology,2020,101:1−16.
[4] XU Y, MA C M, YANG Y, et al. Food-derived protein amyloid-like fibrils:Fibrillation mechanism, structure, and recent advances for the stabilization of emulsions[J]. Food Hydrocolloids,2023,145:109146. doi: 10.1016/j.foodhyd.2023.109146
[5] ADAMCIK J, BERQUAND A, MEZZENGA R. Single-step direct measurement of amyloid fibrils stiffness by peak force quantitative nanomechanical atomic force microscopy[J]. Applied Physics Letters,2011,98(19):333.
[6] WEI G, SU Z, REYNOLDS N P, et al. Self-assembling peptide and protein amyloids:From structure to tailored function in nanotechnology[J]. Chem Soc Rev,2017,46(15):4661−4708. doi: 10.1039/C6CS00542J
[7] HOPPENREIJS L J G, OVERBECK A, BRUNE S E, et al. Amyloid-like aggregation of recombinant β-lactoglobulin at pH3.5 and 7.0:Is disulfide bond removal the key to fibrillation?[J]. International Journal of Biological Macromolecules,2023,242:124855. doi: 10.1016/j.ijbiomac.2023.124855
[8] CHEN Y, LIU Q, YANG F, et al. Lysozyme amyloid fibril:Regulation, application, hazard analysis, and future perspectives[J]. International Journal of Biological Macromolecules,2022,200:151−161. doi: 10.1016/j.ijbiomac.2021.12.163
[9] XU J, TANG M, WANG D, et al. Exploring the self-assembly journey of oat globulin fibrils:From structural evolution to modified functionality[J]. Food Hydrocolloids,2024,149:109587. doi: 10.1016/j.foodhyd.2023.109587
[10] 范昱, 冯亮, 王俊珍, 等. 不同品种燕麦的营养成分分析[J]. 作物杂志,2024(4):71−81. [FAN Y, FENG L, WANG J Z, et al. Nutritional composition analysis of different oats varieties[J]. Crops,2024(4):71−81.] FAN Y, FENG L, WANG J Z, et al. Nutritional composition analysis of different oats varieties[J]. Crops, 2024(4): 71−81.
[11] KUMAR L, SEHRAWAT R, KONG Y. Oat proteins:A perspective on functional properties[J]. LWT,2021,152:112307. doi: 10.1016/j.lwt.2021.112307
[12] KANG L, LIANG Q, CHEN H, et al. Insights into ultrasonic treatment on the properties of pullulan/oat protein/nisin composite film:Mechanical, structural and physicochemical properties[J]. Food Chemistry,2023,402:134237. doi: 10.1016/j.foodchem.2022.134237
[13] 周立, 颜丹云, 赵祎瑾, 等. 燕麦蛋白的提取及功能特性研究进展[J]. 食品研究与开发,2022,43(17):210−217. [ZHOU L, YAN D Y, ZHAO H J, et al. Extraction and functional properties of oat protein:A review[J]. Food Research and Development,2022,43(17):210−217.] ZHOU L, YAN D Y, ZHAO H J, et al. Extraction and functional properties of oat protein: A review[J]. Food Research and Development, 2022, 43(17): 210−217.
[14] HABIBI ZARABADI M, KADIVAR M, KERAMAT J. Production and evaluation the properties of laminated oat protein film and electrospun nylon[J]. Journal of Food Processing and Preservation,2018,42(2):e13513. doi: 10.1111/jfpp.13513
[15] WANG N, SALEH A S M, GAO Y, et al. Effect of protein aggregates on properties and structure of rice bran protein-based film at different pH[J]. Journal of Food Science and Technology,2019,56(11):5116−5127. doi: 10.1007/s13197-019-03984-3
[16] JIANG S, ZOU L, HOU Y, et al. The influence of the addition of transglutaminase at different phase on the film and film forming characteristics of whey protein concentrate-carboxymethyl chitosan composite films[J]. Food Packaging and Shelf Life,2020,25:100546. doi: 10.1016/j.fpsl.2020.100546
[17] 亓伟杰, 连子腾, 代世成, 等. 不同浓度大豆分离蛋白对壳聚糖-纳米纤维可食膜结构及性能的影响[J]. 中国食品学报,2023,23(6):267−275. [QI W J, LIAN Z T, DAI S C, et al. Effects of different concentrations of soybean protein isolate on the structure and properties of chitosan-nanofiber edible films[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(6):267−275.] QI W J, LIAN Z T, DAI S C, et al. Effects of different concentrations of soybean protein isolate on the structure and properties of chitosan-nanofiber edible films[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(6): 267−275.
[18] MEHDIZADEH T, TAJIK H, LANGROODI A M, et al. Chitosan-starch film containing pomegranate peel extract and Thymus kotschyanus essential oil can prolong the shelf life of beef[J]. Meat Science,2020,163:108073. doi: 10.1016/j.meatsci.2020.108073
[19] 胡瀚文, 余雪健, 李旭, 等. 壳聚糖/乳酸链球菌素复合抗菌膜的制备及其性能[J]. 食品与发酵工业,2023,49(11):13−19. [HU H W, YU X J, LI X, et al. Preparation and properties of chitosan/nisin composite antibacterial film[J]. Food and Fermentation Industries,2023,49(11):13−19.] HU H W, YU X J, LI X, et al. Preparation and properties of chitosan/nisin composite antibacterial film[J]. Food and Fermentation Industries, 2023, 49(11): 13−19.
[20] 陈露珠, 李念, 裴诺, 等. 普鲁兰多糖/羧甲基壳聚糖复合膜的制备及其对罗氏沼虾的保鲜效果[J]. 食品与发酵工业,2021,47(24):137−143. [CHEN L Z, LI N, PEI N, et al. Preparation of pullulan/carboxymethyl chitosan composite membrane and its fresh-keeping effect on Macrobrachium rosenbergii[J]. Food and Fermentation Industries,2021,47(24):137−143.] CHEN L Z, LI N, PEI N, et al. Preparation of pullulan/carboxymethyl chitosan composite membrane and its fresh-keeping effect on Macrobrachium rosenbergii[J]. Food and Fermentation Industries, 2021, 47(24): 137−143.
[21] 蔡月, 王梦军, 年琳玉, 等. 茶多酚@沸石咪唑酯骨架材料/壳聚糖/海藻酸钠活性包装膜的制备及表征[J]. 食品科学,2022,43(17):272−281. [CAI Y, WANG M J, NIAN L Y, et al. Preparation and characterization of tea polyphenols@zeolitic lmidazolate framework-8/chitosan/sodium alginate active packaging film[J]. Food Science,2022,43(17):272−281.] CAI Y, WANG M J, NIAN L Y, et al. Preparation and characterization of tea polyphenols@zeolitic lmidazolate framework-8/chitosan/sodium alginate active packaging film[J]. Food Science, 2022, 43(17): 272−281.
[22] WANG X, XIE Y, GE H, et al. Physical properties and antioxidant capacity of chitosan/epigallocatechin-3-gallate films reinforced with nano-bacterial cellulose[J]. Carbohydrate Polymers,2018,179:207−220. doi: 10.1016/j.carbpol.2017.09.087
[23] 宋昱, 王娟娟, 孟令冬, 等. 羧甲基纤维素钠、海藻酸钠、瓜尔豆胶三元混合膜配比优化及膜性能分析[J]. 食品工业科技,2022,43(21):262−270. [SONG Y, WANG J J, MENG L D, et al. Optimization of the ratio of sodium carboxymethyl cellulose, sodium alginate and guar gum in ternary mixed film and performance analysis of the film[J]. Science and Technology of Food Industry,2022,43(21):262−270.] SONG Y, WANG J J, MENG L D, et al. Optimization of the ratio of sodium carboxymethyl cellulose, sodium alginate and guar gum in ternary mixed film and performance analysis of the film[J]. Science and Technology of Food Industry, 2022, 43(21): 262−270.
[24] 刘淑萍, 李亮, 刘让同, 等. 羧甲基纤维素钠改性角蛋白膜的结构与性能[J]. 纺织学报,2019,40(6):14−19. [LIU S P, LI L, LIU R T, et al. Structure and properties of keratin film modified by carboxymethyl cellulose sodium[J]. Journal of Textile Research,2019,40(6):14−19.] LIU S P, LI L, LIU R T, et al. Structure and properties of keratin film modified by carboxymethyl cellulose sodium[J]. Journal of Textile Research, 2019, 40(6): 14−19.
[25] MONGE-MORERA M, VLUYMANS N, HOUSMANS J A J, et al. Modulation of hen egg white protein techno-functionality by amyloid formation[J]. Food Hydrocolloids,2024,146:109171. doi: 10.1016/j.foodhyd.2023.109171
[26] CAO Y, MEZZENGA R. Food protein amyloid fibrils:Origin, structure, formation, characterization, applications and health implications[J]. Advances in Colloid and Interface Science,2019,269:334−356. doi: 10.1016/j.cis.2019.05.002
[27] HUYST A M R, DELEU L J, LUYCKX T, et al. Impact of heat and enzymatic treatment on ovalbumin amyloid-like fibril formation and enzyme-induced gelation[J]. Food Hydrocolloids,2022,131:107784. doi: 10.1016/j.foodhyd.2022.107784
[28] LIANG F, ZHU Y, YE T, et al. Effect of ultrasound assisted treatment and microwave combined with water bath heating on gel properties of surimi-crabmeat mixed gels[J]. LWT,2020,133:110098. doi: 10.1016/j.lwt.2020.110098
[29] CAO H, JIAO X, FAN D, et al. Microwave irradiation promotes aggregation behavior of myosin through conformation changes[J]. Food Hydrocolloids,2019,96:11−19. doi: 10.1016/j.foodhyd.2019.05.002
[30] 郭宇, 姜城红, 杨玉婵, 等. 微波联合金属离子对小麦胚芽蛋白功能特性及结构的影响[J]. 食品科学,2024,45(5):217−224. [GUO Y, JIANG C H, YANG Y C, et al. Effect of microwave combined with metal ions on the properties and structure of wheat embryo protein[J]. Food Science,2024,45(5):217−224.] GUO Y, JIANG C H, YANG Y C, et al. Effect of microwave combined with metal ions on the properties and structure of wheat embryo protein[J]. Food Science, 2024, 45(5): 217−224.
[31] FALSAFI S R, ROSTAMABADI H, ASSADPOUR E, et al. Morphology and microstructural analysis of bioactive-loaded micro/nanocarriers via microscopy techniques; CLSM/SEM/TEM/AFM[J]. Advances in Colloid and Interface Science,2020,280:102166. doi: 10.1016/j.cis.2020.102166
[32] LOVEDAY S M, ANEMA S G, SINGH H. β-Lactoglobulin nanofibrils:The long and the short of it[J]. International Dairy Journal,2017,67:35−45. doi: 10.1016/j.idairyj.2016.09.011
[33] HUYST A M R, DELEU L J, LUYCKX T, et al. Colloidal stability of oil-in-water emulsions prepared from hen egg white submitted to dry and/or wet heating to induce amyloid-like fibril formation[J]. Food Hydrocolloids,2022,125:107450. doi: 10.1016/j.foodhyd.2021.107450
[34] GHANBARZADEH B, ALMASI H. Physical properties of edible emulsified films based on carboxymethyl cellulose and oleic acid[J]. International Journal of Biological Macromolecules,2011,48(1):44−49. doi: 10.1016/j.ijbiomac.2010.09.014
[35] SHAHBAZI Y. Characterization of nanocomposite films based on chitosan and carboxymethylcellulose containing Ziziphora clinopodioides essential oil and methanolic Ficus carica extract[J]. Journal of Food Processing and Preservation,2018,42(2):e13444. doi: 10.1111/jfpp.13444
[36] ZHAO X, LI C, XUE F. Effects of whey protein-polyphenol conjugates incorporation on physicochemical and intelligent pH-sensing properties of carboxymethyl cellulose based films[J]. Future Foods,2023,7:100211. doi: 10.1016/j.fufo.2022.100211
[37] 王娜. 米糠蛋白聚集体及其成膜特性研究[D]. 沈阳:沈阳农业大学, 2020. [WANG N. Research on rice bran protein aggregates and film forming characteristics[D]. Shenyang:Shenyang Agricultural University, 2020.] WANG N. Research on rice bran protein aggregates and film forming characteristics[D]. Shenyang: Shenyang Agricultural University, 2020.
[38] HAN Y, YU M, WANG L. Soy protein isolate nanocomposites reinforced with nanocellulose isolated from licorice residue:Water sensitivity and mechanical strength[J]. Industrial Crops and Products,2018,117:252−259. doi: 10.1016/j.indcrop.2018.02.028
[39] ABDEL AZIZ M S, SALAMA H E, SABAA M W. Biobased alginate/castor oil edible films for active food packaging[J]. LWT,2018,96:455−460. doi: 10.1016/j.lwt.2018.05.049
[40] 郭健. 大豆蛋白热聚集行为控制及其结构表征的研究[D]. 广州:华南理工大学, 2012. [GUO J. Control of soy protein thermal aggregation behavior and structural characterization of soy protein aggregates[D]. Guangzhou:South China University of Technology, 2012.] GUO J. Control of soy protein thermal aggregation behavior and structural characterization of soy protein aggregates[D]. Guangzhou: South China University of Technology, 2012.
[41] NAVARRO-TARAZAGA M L, MASSA A, PÉREZ-GAGO M B. Effect of beeswax content on hydroxypropyl methylcellulose-based edible film properties and postharvest quality of coated plums (Cv. Angeleno)[J]. LWT-Food Science and Technology,2011,44(10):2328−2334. doi: 10.1016/j.lwt.2011.03.011
[42] TULAMANDI S, RANGARAJAN V, RIZVI S S H, et al. A biodegradable and edible packaging film based on papaya puree, gelatin, and defatted soy protein[J]. Food Packaging and Shelf Life,2016,10:60−71. doi: 10.1016/j.fpsl.2016.10.007
[43] MOHAMMADALINEJHAD S, ALMASI H, MORADI M. Immobilization of Echium amoenum anthocyanins into bacterial cellulose film:A novel colorimetric pH indicator for freshness/spoilage monitoring of shrimp[J]. Food Control,2020,113:107169. doi: 10.1016/j.foodcont.2020.107169
[44] OUN A A, RHIM J W. Preparation and characterization of sodium carboxymethyl cellulose/cotton linter cellulose nanofibril composite films[J]. Carbohydrate Polymers,2015,127:101−109. doi: 10.1016/j.carbpol.2015.03.073
[45] 陈欢鑫. 乳酸链球菌素-燕麦蛋白-多糖复合保鲜膜的超声波制备技术研究[D]. 镇江:江苏大学, 2021. [CHEN H X. Study on ultrasonic preparation technology of nisin-oat protein-polysaccharide composite fresh-keeping film[D]. Zhenjiang:Jiangsu University, 2021.] CHEN H X. Study on ultrasonic preparation technology of nisin-oat protein-polysaccharide composite fresh-keeping film[D]. Zhenjiang: Jiangsu University, 2021.
[46] AINIS W N, ERSCH C, IPSEN R. Partial replacement of whey proteins by rapeseed proteins in heat-induced gelled systems:Effect of pH[J]. Food Hydrocolloids,2018,77:397−406. doi: 10.1016/j.foodhyd.2017.10.016
[47] 成晓祎, 孙铭悦, 任轩雨, 等. 大豆球蛋白-马铃薯淀粉可食膜的微观结构及机械性能[J]. 中国食品学报,2023,23(6):276−284. [CHENG X Y, SUN M Y, REN X Y, et al. The microstructure and mechanical properties of soybean globulin-potato starch edible film[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(6):276−284.] CHENG X Y, SUN M Y, REN X Y, et al. The microstructure and mechanical properties of soybean globulin-potato starch edible film[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(6): 276−284.
[48] LIANG J, YAN H, ZHANG J, et al. Preparation and characterization of antioxidant edible chitosan films incorporated with epigallocatechin gallate nanocapsules[J]. Carbohydrate Polymers,2017,171:300−306. doi: 10.1016/j.carbpol.2017.04.081





 下载:
下载:




 下载:
下载:



