Influence of Torulaspora delbrueckii on the Synthesis of Flavor Compounds during the Fermentation Process of Apple Cider
-
摘要: 本研究利用德尔布有孢圆酵母(Torulaspora delbrueckii)与酿酒酵母(Saccharomyces cerevisiae)进行苹果酒发酵实验,通过比较混合发酵与酿酒酵母单独发酵过程中有机酸以及挥发性风味物质差异,探究德尔布有孢圆酵母对苹果酒风味物质合成的影响。结果表明,德尔布有孢圆酵母显著提高了苹果酒中草酸(+0.077 g/L)、乙酸(+1.68 g/L)、L-乳酸(+0.83 g/L)以及琥珀酸(+0.45 g/L)的含量(P<0.01),并减少了苹果酒中高级醇的数量。共现网络分析显示德尔布有孢圆酵母的加入增强了挥发性风味物质合成的稳定性。此外,混合发酵显著提升了苯乙醇、苯甲醛、乙酸苯乙酯、辛酸、己酸等11种挥发性风味物质含量,有助于凸显苹果酒中苹果特征香、花果香,增强蜜甜感。基于差异风味物质通路富集结果,德尔布有孢圆酵母可赋予发酵体系更强的原料利用能力,糖类物质的转化能力以及风味物质合成能力。研究结果表明该菌株有着优异的混合发酵性能,为其在苹果酒酿造中进一步利用提供了依据。Abstract: This study utilized Torulaspora delbrueckii and Saccharomyces cerevisiae for apple cider fermentation experiments. By comparing the differences in organic acids and volatile flavor compounds between mixed fermentation and fermentation with only Saccharomyces cerevisiae, the impact of Torulaspora delbrueckii on the synthesis of flavor compounds in apple cider was investigated. The results indicated that Torulaspora delbrueckii significantly increased the levels of oxalic acid (+0.077 g/L), acetic acid (+1.68 g/L), L-lactic acid (+0.83 g/L), and succinic acid (+0.45 g/L) in apple cider (P<0.01), and reduced the quantity of higher alcohols. Co-occurrence network analysis showed that Torulaspora delbrueckii enhanced the stability of volatile flavor compound synthesis. Moreover, mixed fermentation notably increased the content of 11 volatile flavor compounds, including phenylethyl alcohol, benzaldehyde, phenethyl acetate, octanoic acid, and hexanoic acid, which would help to highlight the apple's characteristic aroma, floral and fruity scents, and enhance the perception of sweetness. Finally, based on the enrichment results of the differential flavor compound pathways, Torulaspora delbrueckii could endow the fermentation system with stronger raw material utilization capacity, sugar conversion ability, and flavor compound synthesis ability. The findings suggest that this strain has excellent mixed fermentation performance, providing a theoretical basis for its further utilization in apple cider brewing.
-
苹果酒是一种以苹果为主要原料发酵而成的酒精饮料,是仅次于葡萄酒的世界第二大果酒,含有丰富的维生素、矿物质以及氨基酸等营养成分,适当饮用具有抗氧化以及预防慢性疾病等功能,有着果香浓郁,味道清新、柔和,易接受等优点,受到世界各地消费者的青睐[1−2]。苹果酒中风味物质主要包括醇类、酯类以及酸类[3],而发酵菌种的选择对苹果酒风味物质合成有着很大影响[4],因此,在苹果酒传统发酵过程中一般选择单一酵母发酵以减少副产物,确保苹果酒品质的一致性[5],目前已有酿酒酵母(Saccharomyces cerevisiae)、贝酵母(Saccharomyces bayanus)、库德毕赤酵母(Pichia kudriavzevii)、孢汉逊酵母(Hanseniaspora vineae)等10余种酵母菌可用于苹果酒发酵中[6]。但是,利用单一菌株进行苹果酒发酵易出现酿造风味单薄、无层次感等问题,无法满足多元化的需求。近年来,利用非酿酒酵母进行混菌发酵来提高苹果酒的风味多样性成为研究的热点。黄娜等[7]利用热带假丝酵母(Candida tropicalis)与酿酒酵母进行混菌发酵实验,苹果酒中风味物质丰富度以及复杂性显著提高。Wei等[8]利用孢汉逊醇母(Hanseniaspora uvarum)以及克鲁维毕赤酵母(Pichia kluyveri)进行苹果酒发酵,相较于二者分别单菌发酵,混菌条件下苹果酒中挥发性酸以及醛类物质的含量显著增加。此外,Hu等[9]通过构建酿酒酵母、库德毕赤酵母以及植物乳杆菌(Lactiplantibacillus plantarum)的多菌发酵体系,显著提升了苹果酒中酯类含量,丰富了苹果酒的花果香。可见,筛选适用于苹果酒发酵的优质酵母菌株对行业发展有着重要意义。
德尔布有孢圆酵母(Torulaspora delbrueckii)作为最早被商业化的非酿酒酵母之一[10],常被用于葡萄酒与啤酒的发酵中,起到提高发酵性能以及减少衍生物的作用[11−13]。近年来有研究发现其与酿酒酵母混合培养有着良好的发酵能力,利于催化苹果酒中天然前体聚合物的水解[14],但其对苹果酒风味的影响还鲜有报道,因此,本研究利用德尔布有孢圆酵母开展苹果酒发酵实验,对苹果酒发酵过程主要有机酸以及挥发性风味物质进行测定,探究其对苹果酒酿造过程风味物质合成的影响,以期为该菌株在苹果酒酿造中的应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
陕西洛川红富士苹果(Malus pumila Mill) 网购;德尔布有孢圆酵母(Torulaspora delbrueckii) 分离自苹果,现保藏于中国典型培养物保藏中心(保藏编号:CCTCC M 2022046);葡萄酒高活性干酵母BV818(Saccharomyces cerevisiae) 湖北安琪酵母股份有限公司;酵母浸出粉胨葡萄糖琼脂培养基(BR)、酵母浸出粉胨葡萄糖液体培养基(BR) 海博生物技术有限公司;无水葡萄糖(AR)、氯化钠(AR)、焦亚硫酸钾(食品级)、2-辛醇(HPLC) 成都市科隆化学品有限公司;酒石酸钾钠(AR) 国药集团化学品试剂有限公司;柠檬酸(食品级) 广西珍露食品有限公司;果胶酶(酶活力≥1000 U/g) 山东科隆特酶制剂有限公司;甲醇(HPLC) 赛默飞世尔科技(中国)有限公司;有机酸标品(草酸、酒石酸、L-苹果酸、L-乳酸、乙酸、柠檬酸、琥珀酸)(HPLC) 成都德思特生物技术有限公司。
SW-CJ-1D超净工作台 浙江苏净净化设备有限公司;ZWYR-D2403恒温培养振荡器 上海智城分析仪器制造有限公司;YH-A10002电子天平 惠州市英衡电子科技有限公司;5430离心机 德国艾本德公司;GI54DS立式自动压力蒸汽灭菌锅 美国致微公司;ST2100 pH计 奥豪斯仪器(常州)有限公司;DW-25W388低温冰箱 海尔集团公司;DM500光学显微镜 德国徕卡公司;0.22 μm微孔滤膜 天津津腾实验设备有限公司;BSP-150生化培养箱 上海博讯医疗生物仪器股份有限公司;WZS80手持糖度计 上海物光仪器有限公司;LC-2030C 3D Plus高效液相色谱仪 岛津企业管理(中国)有限公司;7890A/5975B气相色谱-质谱联用仪 美国Agilent公司;50/30 μm DVB/CAR/PDMS纤维萃取头 美国Supelco公司;固相微萃取装置 苏州安益谱精密仪器有限公司。
1.2 实验方法
1.2.1 实验室规模苹果酒发酵实验
苹果酒发酵参考已有方法[7]进行适当调整。将苹果洗净、去核、切块、榨汁,果汁与水按1:2(W/W)比例配制。加入果胶酶50 mg/L,40 ℃酶解3 h,加入焦亚硫酸钾60 mg/L。添加白砂糖调糖度为20°Brix,柠檬酸调pH为3.5,分装后于105 ℃灭菌15 min备用。非酿酒酵母活化:德尔布有孢圆酵母接种于制备好的斜面培养基,28 ℃培养24 h后利用血球计数板计数;酿酒酵母活化:100 mL无菌水加入5 g干酵母粉、2 g葡萄糖,38 ℃水浴30 min。实验组以各体积分数10%(106 CFU/mL,v/v)同时接种德尔布有孢圆酵母与酿酒酵母于果浆中,空白组仅接种酿酒酵母,所有样品做三份平行,培养箱中25 ℃恒温发酵8 d。间隔24 h取样,于−80 ℃保存,用于后续理化以及风味物质测定。
1.2.2 苹果酒理化指标测定
还原糖测定:GB 5009.7-2016食品中还原糖的测定,第一法 直接滴定法[15];总酸测定:GB 12456-2021食品中总酸的测定,第一法 酸碱指示剂滴定法[16];酒精度测定:GB/T 15038-2006葡萄酒、果酒通用分析方法,4.1.3酒精计法[17]。
1.2.3 苹果酒有机酸测定
利用高效液相色谱(HPLC)对苹果酒中几种重要有机酸进行测定,参考宋雪苗等[18]的方法并修改。样品预处理:取20 mL酒样于5000 r/min离心5 min,取上清液通过0.22 μm微孔滤膜,用1.5 mL液相样品瓶保存待用。有机酸标品制备:配制浓度分别为300、200、100、50、25 mg/L的琥珀酸标品溶液,分别配制200、100、50、20、10、5 mg/L的L-苹果酸、柠檬酸、乙酸、L-乳酸、酒石酸、草酸标品溶液。HPLC条件:使用Z0RBAC SB-C18(250 mm×4.6 mm)色谱柱分离各组分,流动相用甲醇与0.01 moL/L磷酸二氢钾(pH2.5)按5:95比例配制,进样量15 μL,波长210 nm,柱温25 ℃。洗脱程序时间梯度:0~10.9 min,流速0.4 mL/min;10.91~18 min,流速0.7 mL/min。
1.2.4 苹果酒挥发性风味物质的测定
采用顶空固相微萃取气质联用仪(HS-SPME-GC-MS)测定苹果酒中挥发性物质,参考李曼祎[19]的方法。样品预处理:取5 mL酒样、3 g氯化钠、5 μL 2-辛醇(10 mg/L)和1颗磁力搅拌子加入15 mL顶空气相瓶,保鲜膜封口,加盖压实。放置于萃取装置,并插入萃取头(50/30 μm,DVB/CAR/PDMS)设置45 ℃加热,萃取60 min。GC-MS条件:将萃取头于250 ℃热解析5 min,使用Agilent 122-7062 DB-WAX(60 m×250 μm×0.25 μm)色谱柱分离各组分。载气选择氦气,流速1.0 mL/min。起始55 ℃,维持2 min。以3 ℃/min的速率升温到150 ℃,随后以15 ℃/min的速率升温到230 ℃,维持10 min。电子能量70 eV,质量扫描范围 30~500 m/z。定性方法:GC-MS软件鉴定未知物质,结合NIST质谱库比对,筛选匹配因子大于85的鉴定结果,将未知物质的保留时间和质谱信息跟标准物质比对。定量公式如下:
1.3 数据处理
利用IBM® SPSS® Statistics软件(版本26)进行独立样本t检验以及配对样本Wilcoxon符号秩检验,认为P值小于0.05为具有显著性差异,小于0.01为极显著差异;风味物质热图利用R语言(4.2.2)pheatmap包(1.0.12)绘制,风味物质含量进行Z-score标准化处理。使用派森诺云绘图工具进行箱线图绘制,位于https://www.genescloud.cn/chart/SigBoxplot。挥发性风味物质共现网络数据前处理基于R语言(4.2.2)psych包(2.4.1)进行(P<0.05,r>0.6)。利用Gephi(0.9.2)进行共现网络绘制,认为占比大于10%的模块为主要模块。利用SIMCA 14.1建立OPLS-DA模型并计算挥发性风味物质重要性值(VIP值),认为VIP值大于1的挥发性风味物质具有显著性差异。使用MBROLEI(V.2)对挥发性风味化合物进行通路富集,位于https://csbg.cnb.csic.es/mbrole2/analysis.php。
2. 结果与分析
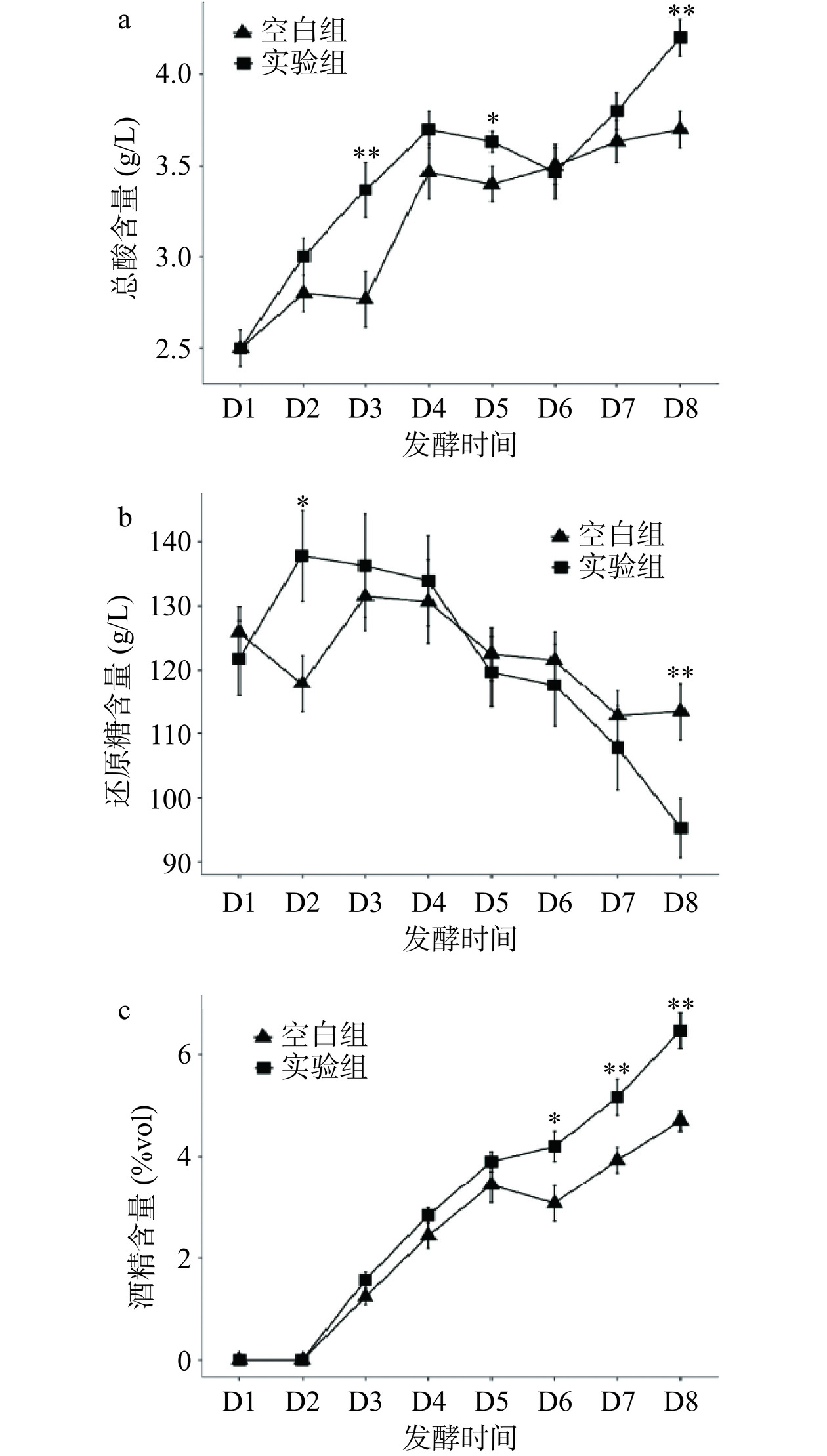
2.1 苹果酒发酵过程理化指标变化情况
图1展示了空白组与实验组苹果酒发酵过程总酸、还原糖以及酒精度含量的变化情况。可见,苹果酒发酵过程中总酸含量总体呈上升趋势,实验组上升速率大于空白组,发酵结束时实验组的总酸含量显著高于空白组(P<0.01),较高的总酸含量有利于抑制微生物的生长,延长果酒保质期,但过高的酸度也可能会影响到口感与风味,苹果酒中总酸含量一般要求≤6.0 g/L[20]。还原糖与酒精度的变化趋势可以反映发酵进行的程度,前1~2 d为苹果酒酒精发酵启动阶段,此时还原糖与酒精度的变化较小,但随着发酵进行,还原糖含量开始显著下降,且实验组的下降速率更快,发酵结束时实验组还原糖含量显著低于空白组(P<0.01),这表明两菌混合发酵体系有着更强的还原糖转化能力。此外,实验组酒精度含量在发酵后期显著高于空白组(P<0.05),这与以往研究中大部分非酿酒酵母在混菌发酵条件下,能够降低酒产品的乙醇含量[7]的结果不同,可能原因是两种酵母菌的竞争关系较弱,已有研究表明,在樱桃酒发酵过程中德尔布有孢圆酵母和酿酒酵母之间不存在相互抑制,可快速适应发酵环境,促进风味物质合成[21]。
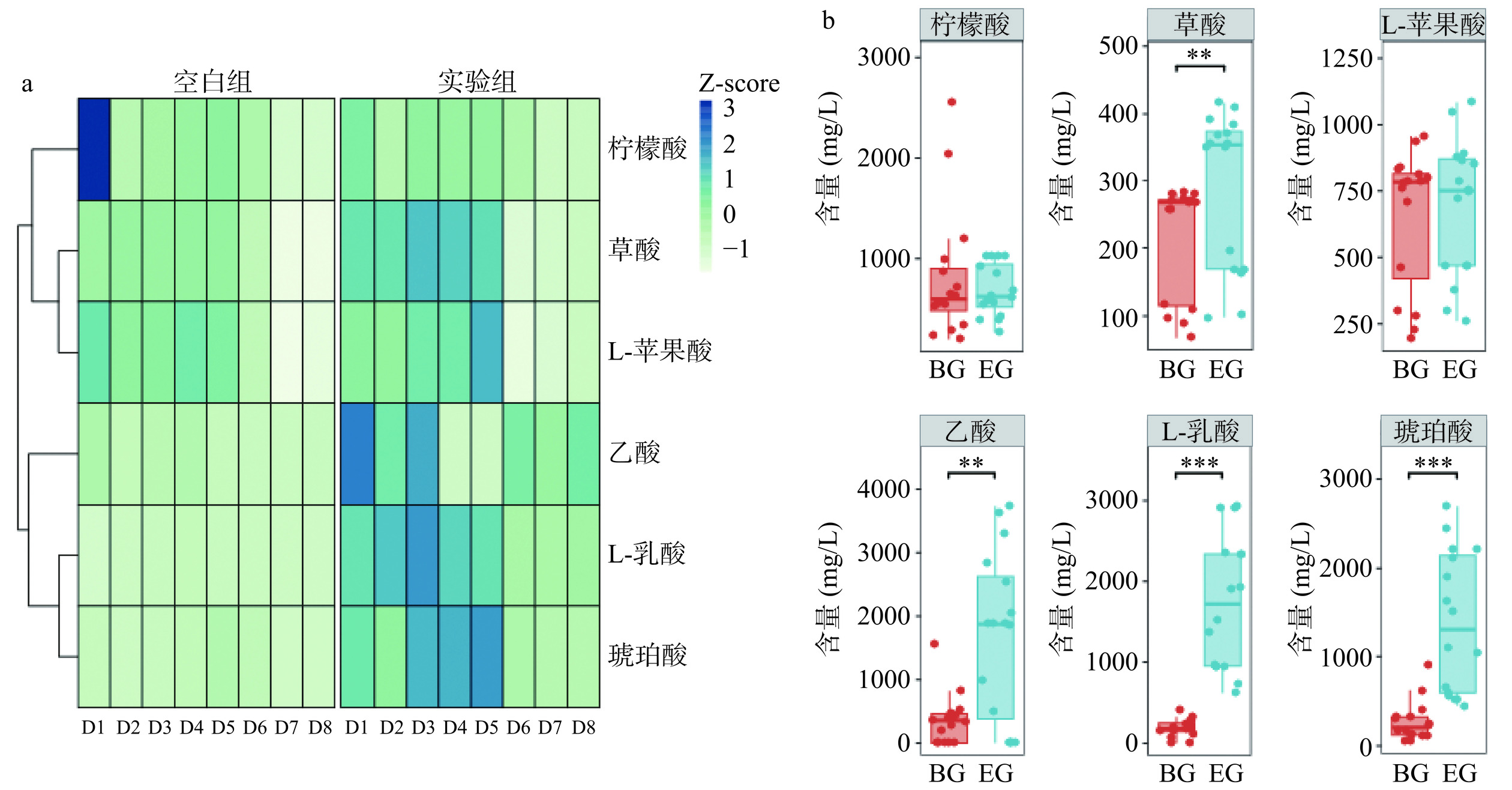
2.2 德尔布有孢圆酵母对苹果酒发酵过程有机酸合成的影响
利用高效液相色谱(HPLC)对苹果酒发酵过程中的草酸、酒石酸、L-苹果酸、L-乳酸、乙酸、柠檬酸和琥珀酸共7种有机酸进行测定,以探究德尔布有孢圆酵母对苹果酒有机酸合成的影响。空白组与实验组共检测到6种有机酸,图2a展示了这6种有机酸在发酵过程中变化情况。可见,相较于发酵初期,发酵后期苹果酒中各类有机酸含量均有不同程度的下降,特别是实验组中草酸、L-苹果酸、L-乳酸以及琥珀酸在发酵进行到5~6 d时含量下降明显,这可能是酵母菌代谢途径调整的结果,酒精发酵过程,有机酸可被酵母作为代谢底物,进而转化消耗[22]。根据Wilcoxon符号秩检验结果(图2b),实验组中草酸、乙酸、L-乳酸以及琥珀酸的平均含量要显著高于空白组(P<0.01)。在发酵结束时分别提高了0.077、1.68、0.83以及0.45 g/L。苹果酒中的草酸多以草酸钙的形式沉积在细胞中,可以给酒体带来一定的酸味,但是含量过高则可能会导致苹果酒口感变粗糙甚至影响健康[23]。乙酸作为醋类风味的主要来源,具有促进体内脂质稳态与降胆固醇的作用[24−25],但在苹果酒中含量不宜过高,否则易产生刺鼻味。L-乳酸常用于食品中酸度的调节,对人体无副作用。琥珀酸则是在提供酸度的同时可以产生一定的盐苦味,对果酒的感官平衡具有重要影响[26],此外,有研究表明,L-乳酸与琥珀酸有利于人体对铁的吸收[27]。合理控制有机酸的浓度,才能达到期望的苹果酒风味。
2.3 德尔布有孢圆酵母对苹果酒挥发性风味物质合成的影响
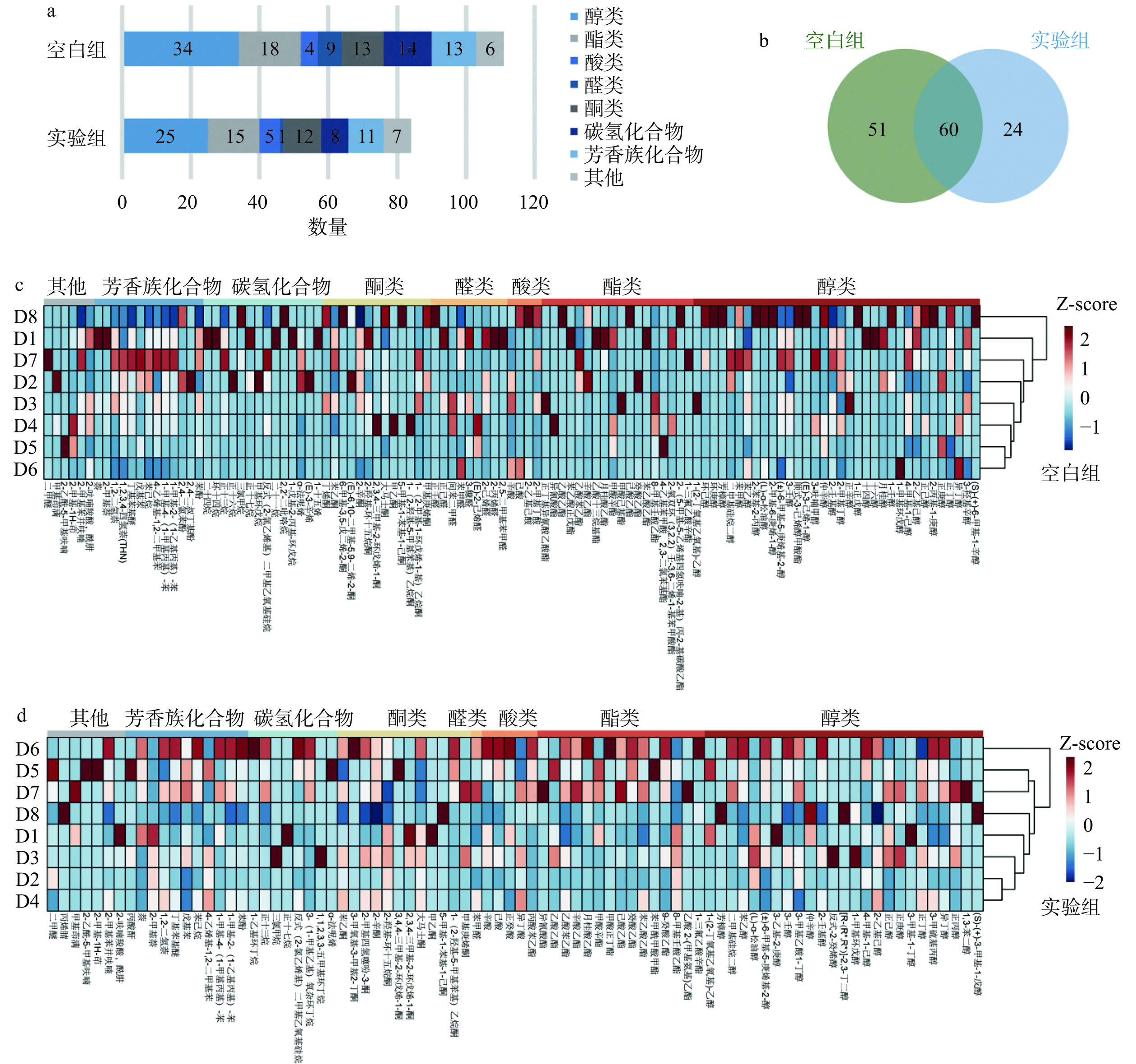
2.3.1 苹果酒发酵过程挥发性风味物质合成情况概述
利用顶空固相微萃取-气相色谱-质谱联用法(HS-SPME-GC-MS)对空白组与实验组中的挥发性风味物质进行测定。图3a、b分别展示了空白组与实验组中挥发性风味物质组成以及重叠情况。两组共检测到135种挥发性风味物质,包括43种醇类、22种酯类、8种酸类、7种醛类、15种酮类、17种碳氢化合物、13种芳香族化合物以及10种其他挥发性风味物质,空白组与实验组分别包含111种与84种,且有51种挥发性风味物质仅存在于空白组中,可见,空白组与实验组中挥发性风味物质数量与种类均存在较大差异。实验组挥发性风味物质丰富度低于空白组,主要差异体现在醇类的数量上,共有18种醇类挥发性风味物质只存在于空白组中,包括1,3-辛二醇、1-辛醇、1-壬醇等多种高级醇。高级醇可以促进果酒的醇香饱满,但过多则会给酒体带来杂醇油味,对人造成不适,需控制在一定范围内[28],相似的,Wang等[29]利用德尔布有孢圆酵母与酿酒酵母进行蓝莓饮料发酵,实验组中高级醇数量明显减少。此外,有24种挥发性风味物质仅存在于实验组中,包括正丙醇、2,3-丁二醇以及丁酸甲酯等,正丙醇带有苦麻味,但适量的正丙醇可以起到衬托酯类风味的作用;2,3-丁二醇可赋予苹果酒绵甜感;丁酸甲酯则具有菠萝特有的风味。图3c、d分别展示了发酵过程空白组与实验组挥发性风味物质变化情况。可见,两组间各类挥发性风味物质合成阶段具有一定的差异,空白组中醇类合成主要集中在发酵后期,而实验组中醇类物质合成没有明显阶段性。相反的,空白组中酯类物质的合成没有表现出明显的阶段性特点,而实验组中,酯类物质则主要集中在发酵第6~7 d。空白组中醛类物质数量多于实验组,且主要集中在发酵前中期,而实验组仅鉴定到苯甲醛一种醛类,其浓度主要集中在发酵中后期。综上,德尔布有孢圆酵母的加入对苹果酒挥发性风味物质的合成起到重要作用。
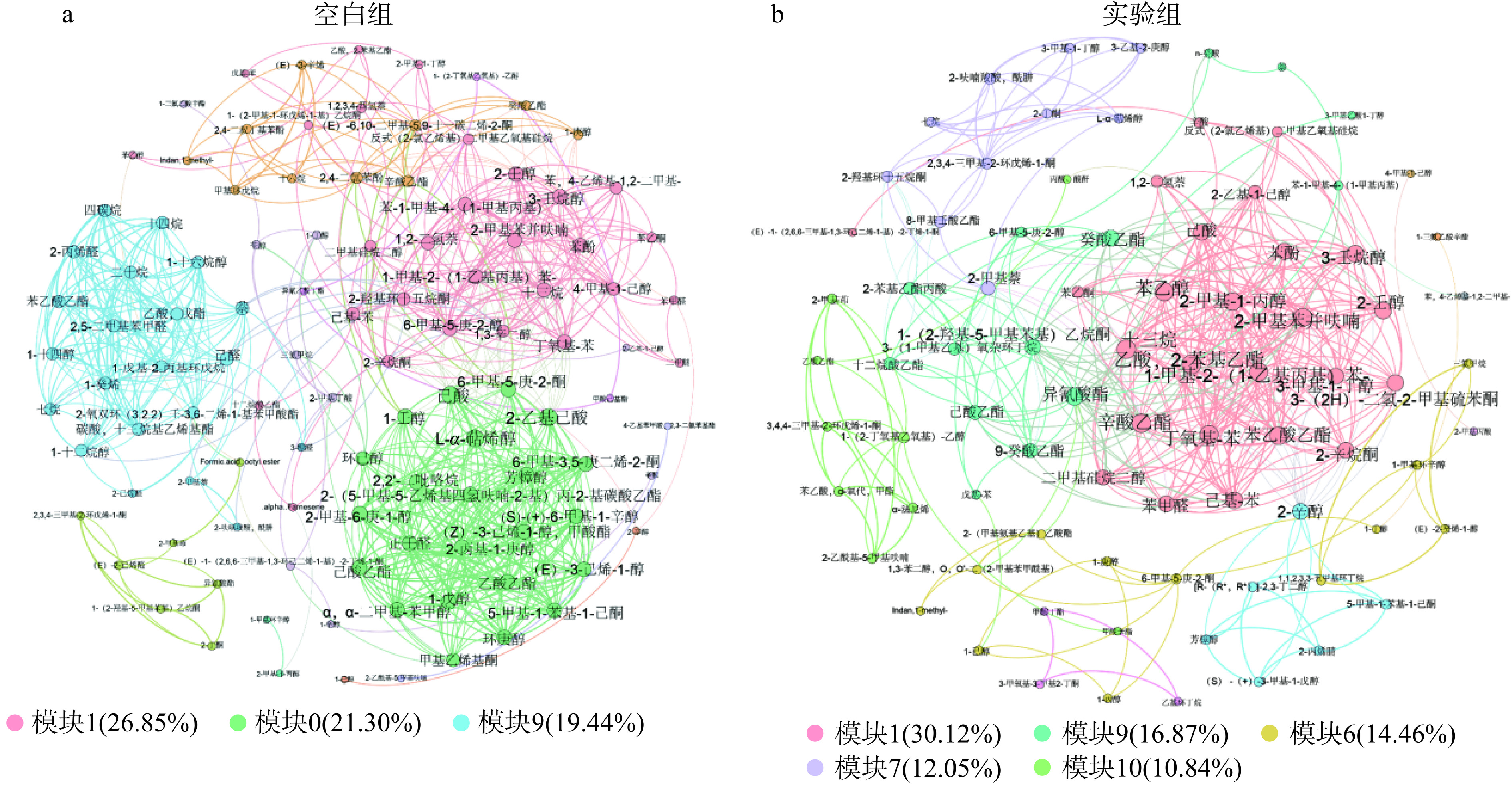
2.3.2 德尔布有孢圆酵母对挥发性风味物质共现关系的影响
共现网络分析可以跨越发酵时间梯度来揭示挥发性风味物质之间潜在的相互联系[30],通过比较空白组与实验组挥发性风味物质网络差异,可进一步探究德尔布有孢圆酵母对挥发性风味物质合成的影响,结果如图4a、b所示。空白组挥发性风味物质网络拥有108个节点,676条边,节点平均聚类系数为0.701;共有3个主要模块,分别是模块1(26.85%)、模块0(21.30%)以及模块9(19.44%),模块化指数0.722,而实验组则拥有83个节点,402条边,节点平均聚类系数为0.703;5个主要模块,分别是模块1(30.12%)、模块9(16.87%)、模块6(14.46%)、模块7(12.05%)、模块10(10.84%),模块化指数0.575。由此可见,空白组的网络规模虽大于实验组,但实验组的节点平均聚类系数与空白组相当,这表明两组的网络复杂性并无较大差异。两个网络中苯乙醇、苯甲醛、苯乙酮、己酸、辛酸、辛酸乙酯以及苯酚均出现在同一模块中,根据热图(图3c、d)显示,它们的含量随苹果酒发酵过程逐渐上升,在第6~7 d达到最高,这表明这几种挥发性风味物质可能具有较强的伴生联系,其合成条件及合成规律都具有一定的相似性。模块化指数用于评价网络图模块化程度,空白组的模块化指数要明显高于实验组,这代表实验组中挥发性风味物质有着更强的“传递性”,而不是仅存在于某天或几天的发酵样品中,而空白组风味物质合成则表现出更强的阶段性。因此,虽然德尔布有孢圆酵母没有对风味物质网络复杂性造成明显影响,但其提高了发酵过程挥发性风味物质合成的稳定性,使得更多的风味物质呈现接续合成的特点。
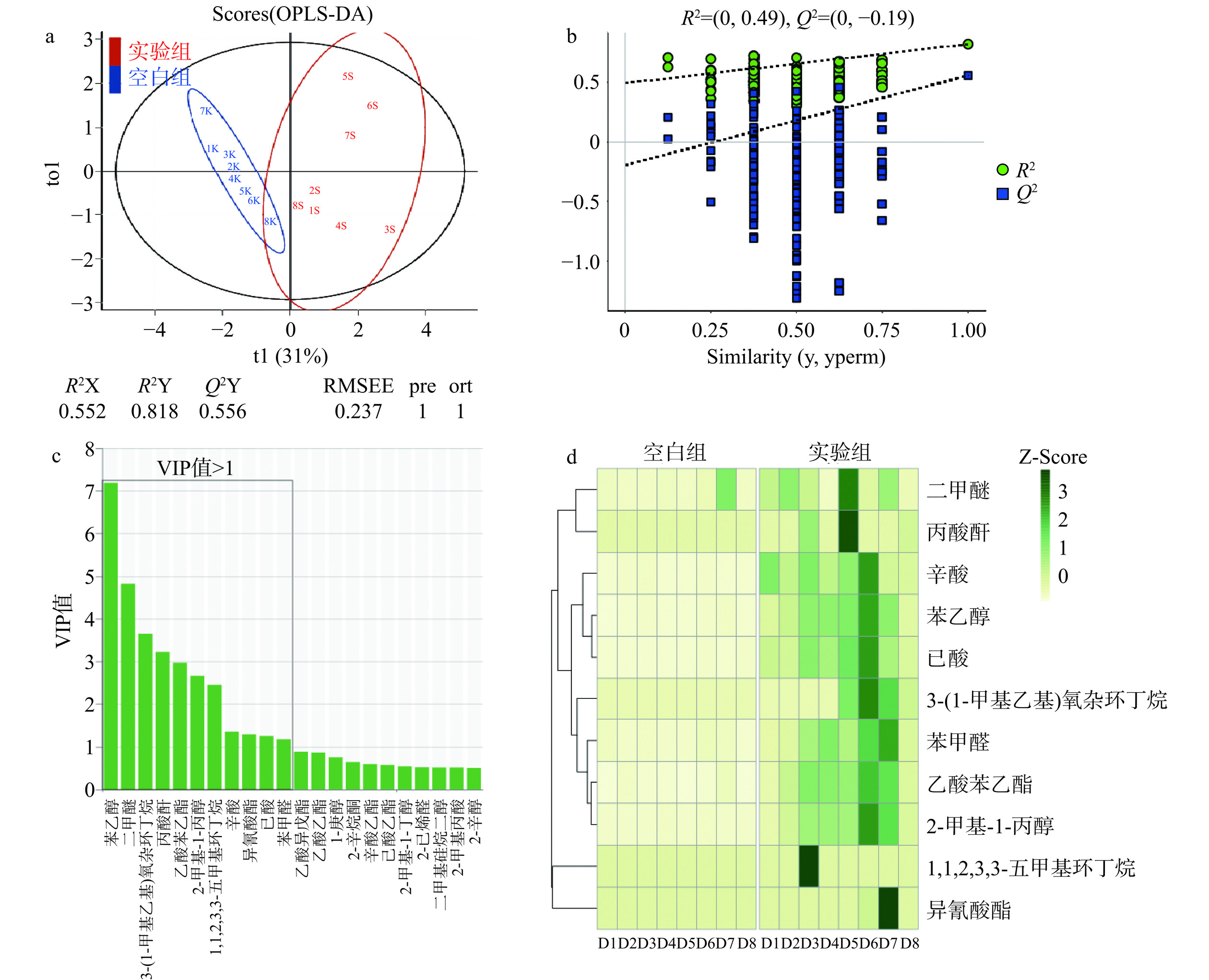
2.3.3 德尔布有孢圆酵母对差异挥发性风味物质合成的影响
为比较空白组与实验组挥发性风味物质的差异情况,揭示关键挥发性风味物质,基于正交偏最小二乘判别分析(OPLS-DA)对两组挥发性风味物质进行了分析。如图5a得分图所示,空白组与实验组挥发性风味物质具有较大差异,体现在,实验组中不同发酵天数样品更为分散,发酵后期样品与前中期样品有较大的差异,而空白组内不同样品则相对集中,这意味着混合发酵下苹果酒中挥发性风味物质的变化更为丰富。图5b为置换检验结果,两条拟合线的斜率大于0,说明模型拟合准确性合格。图5c展示了挥发性风味物质VIP(Variable Importance in the Projection)值的排序结果,其中VIP值大于1的挥发性风味物质共有11种,分别是苯乙醇、二甲醚、3-(1-甲基乙基)氧杂环丁烷、丙酸酐、乙酸苯乙酯、2-甲基-1-丙醇、1,1,2,3,3-五甲基环丁烷、辛酸、异氰酸酯、己酸以及苯甲醛,同时,这11种差异挥发性风味物质含量均在实验组中较突出(图5d),这意味着德尔布有孢圆酵母的加入给酿造体系带来了较为积极的影响。苯乙醇是对两组差异贡献最大的挥发性风味物质,具有独特的芳香特征,可以赋予酒体玫瑰花香味,茉莉花香[31];乙酸苯乙酯可由乙酸酐和苯乙醇在乙酸钠存在下反应而得[32],带有玫瑰花香以及桃子香,可以增加蜜甜感,更重要的是适量的乙酸苯乙酯还可以降低苯乙醇带来的“沉闷”感,赋予花果香“活力”[33];辛酸、己酸、苯甲醛则常常用于苹果香精配方中,具有以凸显新鲜的水果香韵的能力[34];这说明德尔布有孢圆酵母进行苹果酒发酵时具有突出苹果酒中苹果特征香以及增强花果香等重要作用。
2.4 德尔布有孢圆酵母对苹果酒发酵体系代谢功能的影响
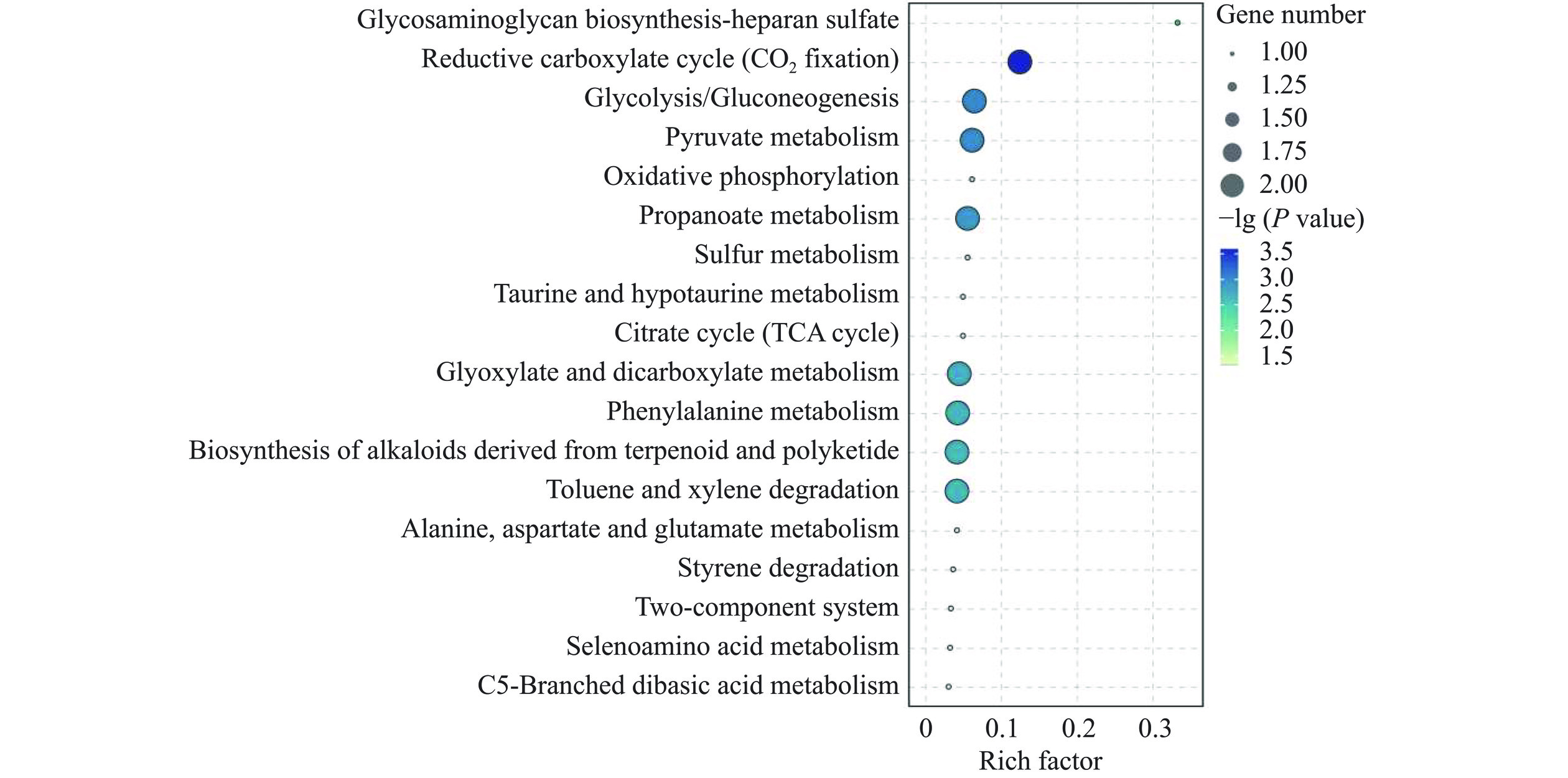
基于KEGG数据库对空白组与实验组间差异风味物质进行通路富集分析,以探究德尔布有孢圆酵母对发酵体系整体代谢功能的影响。所有差异风味物质共富集到33条代谢通路,其中有18条代谢通路显著富集(P<0.05)(图6),主要包括,糖酵解/糖原异生、丙酮酸代谢、丙酸代谢、二羧酸代谢、苯丙氨酸代谢等过程。糖酵解/糖原异生过程主要涉及还原糖的利用,其显著富集意味着混菌体系拥有更强的底物转化能力,这可能是实验组还原糖下降速率高于空白组的原因;乙酸以及乙醇的生成与转化主要在丙酮酸代谢中进行,而实验组中更强的丙酮酸转化能力,可能解释了为何实验组中乙醇以及乙酸含量较高,相似的,宋雪苗等[18]利用德尔布有孢圆酵母与酿酒酵母进行苹果醋发酵,混合发酵下产乙酸能力显著提升;另外,丙酸代谢与二羧酸代谢主要涉及到丙酮酸、丙酸以及多种氨基酸的合成与转换,可为苹果酒中多种风味物质的合成提供前体物;苯丙氨酸代谢则涉及苯乙醛以及苯乙醇的合成,对苹果酒中花果香的形成有着较大的影响,已有研究表明,利用戴尔有孢圆酵母与酿酒酵母混合发酵可以提升发酵体系苯乙醛以及苯乙醇的合成能力[35−36]。可见,德尔布有孢圆酵母的加入提升了苹果酒发酵体系原料利用能力,糖类物质的转化能力以及风味物质合成能力,其在苹果酒发酵过程中起到重要作用。
3. 结论
本研究通过额外接种德尔布有孢圆酵母进行苹果酒发酵实验,相较于酿酒酵母单菌发酵,混合发酵下苹果酒中草酸、乙酸、L-乳酸以及琥珀酸的含量显著提高(P<0.01)。此外,德尔布有孢圆酵母的加入减少了苹果酒中高级醇数量,并对酯类与醛类合成造成了较大的影响。挥发性风味物质共现网络分析进一步揭示了苯乙醇、苯甲醛、苯乙酮、己酸、辛酸等多种风味物质之间潜在的伴生关系,混合发酵下挥发性风味物质合成更具稳定性。基于正交偏最小二乘判别分析,筛选到苯乙醇、二甲醚、3-(1-甲基乙基)氧杂环丁烷、丙酸酐、乙酸苯乙酯等11种差异挥发性风味物质,均在实验组中更为突出,将有利于凸显苹果酒中苹果特征香、蜜甜香以及其他花果香。此外,差异风味物质通路富集结果表明,德尔布有孢圆酵母对发酵体系的原料利用能力,糖类物质的转化能力以及风味物质合成能力有着积极作用。本研究探讨了德尔布有孢圆酵母对苹果酒风味物质合成的影响,其在不同接种量以及不同发酵条件下的酿造性能还有待进一步开展研究。
-
-
[1] CALUGAR P C, COLDEA T E, SALANȚA L C, et al. An overview of the factors influencing apple cider sensory and microbial quality from raw materials to emerging processing technologies[J]. Processes,2021,9(3):502. doi: 10.3390/pr9030502
[2] 朱劼, 李尔炀. 苹果酒酿造工艺研究[J]. 江苏工业学院学报,2007,19(4):17−20. [ZHU J, LI E Y. Study of the cider fermentation technique[J]. Journal of Jiangsu Polytechnic University,2007,19(4):17−20.] ZHU J, LI E Y. Study of the cider fermentation technique[J]. Journal of Jiangsu Polytechnic University, 2007, 19(4): 17−20.
[3] 康三江, 慕钰文, 曾朝珍. 苹果蒸馏酒(白兰地)发酵酿造中挥发性香气成分研究进展[J]. 寒旱农业科学,2023,2(11):990−995. [KANG S J, MU Y W, ZENG C Z. Research progress on volatile aroma components in the fermentation and distillation of apple distillate (Brandy)[J]. Journal of Cold-Arid Agricultural Sciences,2023,2(11):990−995.] doi: 10.3969/j.issn.2097-2172.2023.11.002 KANG S J, MU Y W, ZENG C Z. Research progress on volatile aroma components in the fermentation and distillation of apple distillate (Brandy)[J]. Journal of Cold-Arid Agricultural Sciences, 2023, 2(11): 990−995. doi: 10.3969/j.issn.2097-2172.2023.11.002
[4] 王博, 杨劝生, 谢晓驰. 我国苹果酒的开发现状与前景[J]. 食品工业,2022,43(8):221−226. [WANG B, YANG Q S, XIE X C. Recent progress of apple cider in China[J]. The Food Industry,2022,43(8):221−226.] WANG B, YANG Q S, XIE X C. Recent progress of apple cider in China[J]. The Food Industry, 2022, 43(8): 221−226.
[5] 张婉菁, 王汉屏. 苹果酒国内外研究现状及进展[J]. 现代食品,2020(5):11−13,28. [ZHANG W Q, WANG H P. Research status and progress of cider at home and abroad[J]. Modern Food,2020(5):11−13,28.] ZHANG W Q, WANG H P. Research status and progress of cider at home and abroad[J]. Modern Food, 2020(5): 11−13,28.
[6] 张志勇, 刘震, 周峻岗, 等. 微生物与发酵工艺对苹果酒品质影响的研究概述[J]. 食品与发酵工业,2022,48(19):287−294. [ZHANG Z Y, LIU Z, ZHOU J G, et al. Effect of microorganisms and fermentation process on the quality of apple cider:A review[J]. Food and Fermentation Industries,2022,48(19):287−294.] ZHANG Z Y, LIU Z, ZHOU J G, et al. Effect of microorganisms and fermentation process on the quality of apple cider: A review[J]. Food and Fermentation Industries, 2022, 48(19): 287−294.
[7] 黄娜, 罗玲, 罗惠波, 等. 热带假丝酵母对苹果酒风味物质合成的影响[J]. 食品工业,2023,44(6):143−148. [HUANG N, LUO L, LUO H B, et al. Effect of Candida tropicalis on the synthesis of flavor substances in cider[J]. The Food Industry,2023,44(6):143−148.] HUANG N, LUO L, LUO H B, et al. Effect of Candida tropicalis on the synthesis of flavor substances in cider[J]. The Food Industry, 2023, 44(6): 143−148.
[8] WEI J, ZHANG Y, WANG Y, et al. Assessment of chemical composition and sensorial properties of ciders fermented with different non-Saccharomyces yeasts in pure and mixed fermentations[J]. International Journal of Food Microbiology,2020,318:108471. doi: 10.1016/j.ijfoodmicro.2019.108471
[9] HU L, CHEN X, LIN R, et al. Quality improvement in apple ciders during simultaneous co-fermentation through triple mixed-cultures of Saccharomyces cerevisiae, Pichia kudriavzevii, and Lactiplantibacillus plantarum[J]. Foods,2023,12(3):655. doi: 10.3390/foods12030655
[10] 侯若婷, 赵鹏, 徐馨莹, 等. 德尔布有孢圆酵母与4种酿酒酵母顺序发酵对草莓酒香气与感官喜好性的影响[J]. 食品与发酵工业,2024,50(14):165−172. [HOU R T, ZHAO P, XU X Y, et al. Effect of sequential fermentation with Torulaspora delbrueckii and four Saccharomyces cerevisiaes on volatile aromatic compounds and sensory preferences of strawberry wines[J]. Food and Fermentation Industries,2024,50(14):165−172.] HOU R T, ZHAO P, XU X Y, et al. Effect of sequential fermentation with Torulaspora delbrueckii and four Saccharomyces cerevisiaes on volatile aromatic compounds and sensory preferences of strawberry wines[J]. Food and Fermentation Industries, 2024, 50(14): 165−172.
[11] ZHANG B, TANG C, YANG D, et al. Effects of three indigenous non-Saccharomyces yeasts and their pairwise combinations in co-fermentation with Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines[J]. Food Chemistry,2022,368:130807. doi: 10.1016/j.foodchem.2021.130807
[12] NIKULIN J, AISALA H, GIBSON B. Production of non-alcoholic beer via cold contact fermentation with Torulaspora delbrueckii[J]. Journal of the Institute of Brewing,2022,128(1):28−35. doi: 10.1002/jib.681
[13] CANONICO L, COMITINI F, CIANI M. Torulaspora delbrueckii contribution in mixed brewing fermentations with different Saccharomyces cerevisiae strains[J]. International Journal of Food Microbiology,2017,259:7−13. doi: 10.1016/j.ijfoodmicro.2017.07.017
[14] 曾朝珍, 康三江, 张辉元, 等. 混菌发酵产酶活性与苹果酒风味物质构成的相关性分析[J]. 中国酿造,2020,39(12):74−80. [ZENG C Z, KANG S J, ZHANG H Y, et al. Correlation analysis between enzymatic activity and flavor substances composition in cider by mixed-strain fermentation[J]. China Brewing,2020,39(12):74−80.] doi: 10.11882/j.issn.0254-5071.2020.12.015 ZENG C Z, KANG S J, ZHANG H Y, et al. Correlation analysis between enzymatic activity and flavor substances composition in cider by mixed-strain fermentation[J]. China Brewing, 2020, 39(12): 74−80. doi: 10.11882/j.issn.0254-5071.2020.12.015
[15] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中还原糖的测定:GB 5009.7-2016[S]. 北京:中国标准出版社, 2016. [The National Health and Family Planning Commission of the People's Republic of China. National Food Safety Standard-Determination of reducing sugar in food:GB 5009.7-2016[S]. Beijing:Standards Press of China, 2016.] The National Health and Family Planning Commission of the People's Republic of China. National Food Safety Standard-Determination of reducing sugar in food: GB 5009.7-2016[S]. Beijing: Standards Press of China, 2016.
[16] 中华人民共和国国家卫生健康委员会. 食品安全国家标准 食品中总酸的测定:GB 12456-2021[S]. 北京:中国标准出版社, 2021. [The National Health Commission of the People's Republic of China. National Food Safety Standard-Determination of total acid in food:GB 12456-2021[S]. Beijing:Standards Press of China, 2021.] The National Health Commission of the People's Republic of China. National Food Safety Standard-Determination of total acid in food: GB 12456-2021[S]. Beijing: Standards Press of China, 2021.
[17] 中华人民共和国国家质量监督检验检疫总局. 葡萄酒、果酒通用分析方法:GB/T 15038-2006[S]. 北京:中国标准出版社, 2006. [General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. General analysis methods for wine and fruit wine:GB/T 15038-2006[S]. Beijing:Standards Press of China, 2006.] General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. General analysis methods for wine and fruit wine: GB/T 15038-2006[S]. Beijing: Standards Press of China, 2006.
[18] 宋雪苗, 马世源, 李子健, 等. 苹果内生菌Torulaspora delbrueckii强化对苹果醋风味物质合成的影响[J]. 食品科学,2023,44(20):330−342. [SONG X M, MA S Y, LI Z J, et al. Effect of co-fermentation with the apple endophyte Torulaspora delbrueckii on the synthesis of the flavor substances of apple vinegar[J]. Food Science,2023,44(20):330−342.] doi: 10.7506/spkx1002-6630-20221030-306 SONG X M, MA S Y, LI Z J, et al. Effect of co-fermentation with the apple endophyte Torulaspora delbrueckii on the synthesis of the flavor substances of apple vinegar[J]. Food Science, 2023, 44(20): 330−342. doi: 10.7506/spkx1002-6630-20221030-306
[19] 李曼祎. 枸杞果酒的研制[D]. 无锡:江南大学, 2021. [LI M Y. Research on wolfberry wine[D]. Wuxi:Jiangnan University, 2021.] LI M Y. Research on wolfberry wine[D]. Wuxi: Jiangnan University, 2021.
[20] T/SDYY148-2023, 山东园艺学会团体标准 苹果酒[S]. 北京:中国标准出版社, 2023. [T/SDYY148-2023, Shandong Horticultural Society Group Standard-Apple wine[S]. Beijing:Standards Press of China, 2023.] T/SDYY148-2023, Shandong Horticultural Society Group Standard-Apple wine[S]. Beijing: Standards Press of China, 2023.
[21] 李华敏, 孙舒扬, 黄萍萍, 等. 戴尔有孢圆酵母WA19与酿酒酵母F33混合发酵在樱桃酒酿造中的应用[J]. 食品科学,2018,39(24):123−130. [LI H M, SUN S Y, HUANG P P, et al. Mixed-culture cherry wine fermentation with Torulaspora delbrueckii WA19 and Saccharomyces cerevisiae F33[J]. Food Science,2018,39(24):123−130.] doi: 10.7506/spkx1002-6630-201824019 LI H M, SUN S Y, HUANG P P, et al. Mixed-culture cherry wine fermentation with Torulaspora delbrueckii WA19 and Saccharomyces cerevisiae F33[J]. Food Science, 2018, 39(24): 123−130. doi: 10.7506/spkx1002-6630-201824019
[22] 徐雯. 蓝莓酒发酵过程中关键成分的特性研究[D]. 常州:常州大学, 2021. [XU W. Study on the characteristics of key components in the fermentation process of blueberry wine[D]. Changzhou:Changzhou University, 2021.] XU W. Study on the characteristics of key components in the fermentation process of blueberry wine[D]. Changzhou: Changzhou University, 2021.
[23] FOSTER J, NAKATA P A. An oxalyl-CoA synthetase is important for oxalate metabolism in Saccharomyces cerevisiae[J]. FEBS Letters,2014,588(1):160−166. doi: 10.1016/j.febslet.2013.11.026
[24] YAMASHITA H, FUJISAWA K, ITO E, et al. Improvement of obesity and glucose tolerance by acetate in type 2 diabetic Otsuka Long-Evans Tokushima Fatty (OLETF) rats[J]. Bioscience, Biotechnology, and Biochemistry,2007,71(5):1236−1243. doi: 10.1271/bbb.60668
[25] BUDAK N H, AYKIN E, SEYDIM A C, et al. Functional properties of vinegar[J]. Journal of Food Science,2014,79(5):R757−R764.
[26] FORNEY C F, KALT W, JORDAN M A, et al. Blueberry and cranberry fruit composition during development[J]. Journal of Berry Research,2012,2(3):169−177. doi: 10.3233/JBR-2012-034
[27] ROBLES A, FABJANOWICZ M, CHMIEL T, et al. Determination and identification of organic acids in wine samples. Problems and challenges[J]. TrAC Trends in Analytical Chemistry,2019,120:115630. doi: 10.1016/j.trac.2019.115630
[28] 赵蒙, 孙安, 陈龙. 发酵酒中高级醇的研究进展[J]. 中国酿造,2023,42(5):9−14. [ZHAO M, SUN A, CHEN L. Research progress of higher alcohols in fermented alcoholic drink[J]. China Brewing,2023,42(5):9−14.] ZHAO M, SUN A, CHEN L. Research progress of higher alcohols in fermented alcoholic drink[J]. China Brewing, 2023, 42(5): 9−14.
[29] WANG Y, QI X Y, FU Y, et al. Effects of Torulaspora delbrueckii co-fermented with Saccharomyces cerevisiae on physicochemical and aromatic profiles of blueberry fermented beverage[J]. Food Chemistry,2023,409:135284. doi: 10.1016/j.foodchem.2022.135284
[30] BANERJEE S, SCHLAEPPI K, VAN DER HEIJDEN M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology,2018,16(9):567−576. doi: 10.1038/s41579-018-0024-1
[31] 刘树文. 合成香料技术手册[M]. 北京:中国轻工业出版社, 2000:89−90. [LIU S W. Technical manual for synthetic flavors[M]. Beijing:China Light Industry Press, 2000:89−90.] LIU S W. Technical manual for synthetic flavors[M]. Beijing: China Light Industry Press, 2000: 89−90.
[32] OSCAR M, ANTONI S, XAVIER F, et al. Bioprocesses for 2-phenylethanol and 2-phenylethyl acetate production:Current state and perspectives[J]. Applied Microbiology and Biotechnology,2018,102(23):9991−10004. doi: 10.1007/s00253-018-9384-8
[33] KUO C H, CHIANG S H, JU H Y, et al. Enzymatic synthesis of rose aromatic ester (2-phenylethyl acetate) by lipase[J]. Journal of the Science of Food and Agriculture,2012,92(10):2141−2147. doi: 10.1002/jsfa.5599
[34] DIXON J, HEWETT E W. Factors affecting apple aroma/flavour volatile concentration:A review[J]. New Zealand Journal of Crop and Horticultural Science,2000,28(3):155−173. doi: 10.1080/01140671.2000.9514136
[35] 贾世宽, 刘亚琼, 陈佳威, 等. 戴尔有孢圆酵母与酿酒酵母混合发酵对马瑟兰干红葡萄酒风味品质的影响[J]. 中国食品学报,2023,23(10):157−166. [JIA S K, LIU Y Q, CHEN J W, et al. Effects of mixed fermentation of Torulaspora delbrueckii and Saccharomyces cerevisiae on flavor quality of Marselan dry red wine[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(10):157−166.] JIA S K, LIU Y Q, CHEN J W, et al. Effects of mixed fermentation of Torulaspora delbrueckii and Saccharomyces cerevisiae on flavor quality of Marselan dry red wine[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(10): 157−166.
[36] 尹雪林, 龚丽娟, 钟武, 等. 戴尔有孢圆酵母与酿酒酵母混合发酵对猕猴桃酒香气的影响[J]. 食品科学,2021,42(22):216−223. [YIN X L, GONG L J, ZHONG W, et al. Effect of mixed fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii on the aroma of kiwifruit wine[J]. Food Science,2021,42(22):216−223.] doi: 10.7506/spkx1002-6630-20200730-403 YIN X L, GONG L J, ZHONG W, et al. Effect of mixed fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii on the aroma of kiwifruit wine[J]. Food Science, 2021, 42(22): 216−223. doi: 10.7506/spkx1002-6630-20200730-403
-
期刊类型引用(0)
其他类型引用(4)





 下载:
下载:
 下载:
下载:



