Optimization of Preparation Process and Antioxidant Activity of Kidney Bean-Haskap Composite Fermentation Liquid
-
摘要: 为提高杂粮与小浆果的利用度,研究复配乳酸菌发酵芸豆-蓝靛果复合汁制备发酵液并优化其工艺参数。选取四种乳酸菌对芸豆-蓝靛果复合汁接种发酵,以活菌数为指标筛选复配乳酸菌后,进行单因素实验及响应面优化试验确定复合发酵液的工艺参数,并对其理化性质、生物活性及抗氧化能力进行检测。结果表明,筛选得到复配乳酸菌L1:L2等比例复配接种芸豆-蓝靛果复合汁,优化得到的复合发酵液的最优工艺参数为原料复配比例1:1、初始pH5.0、接种量2%、发酵温度34 ℃,此条件下复合发酵液的活菌数为9.89 lg CFU/mL。经检测,复合发酵液中总酚及黄酮含量均在16 h达到最高,分别为2204.96 µg/mL和701.09 µg/mL。抗氧化实验表明,在发酵过程中芸豆-蓝靛果复合汁的DPPH自由基清除率及ABTS+自由基清除率呈现先上升后缓慢下降的趋势,最高清除值为98.23%和93.77%,最优条件制备的芸豆-蓝靛果复合发酵液抗氧化能力较强。Abstract: In order to improve the utilization value of grains and small berries, the fermentation liquid of kidney bean and haskap was prepared by compound lactic acid bacteria and the fermentation parameters were optimized. Specifically, four kinds of lactic acid bacteria were selected to inoculate and ferment the composition liquid of kidney bean and haskap. After screening the compound lactic acid bacteria based on the number of live bacterial count as the index, the process parameters of the composite fermentation liquid were determined using single factor test and response surface optimization test, as well as its physical and chemical properties, biological activity and antioxidant capacity were evaluated. The compound lactic acid bacteria L1:L2 was selected and inoculated in the composition liquid of kidney bean and haskap. The optimal process parameters of the composite fermentation liquid were a compounding ratio of 1:1, an initial pH of 5.0, an inoculation amount of 2%, and a fermentation temperature at 34 ℃. Under these conditions, the live bacterial count in the composite fermentation liquid was 9.89 lg CFU/mL. The maximum values of total phenol and flavonoid reached at 16 h during fermentation, which were 2204.96 µg/mL and 701.09 µg/mL, respectively. The antioxidant experiments showed that the DPPH and ABTS+ free radical scavenging rates of composite fermentation liquid initially increased and then decreased slowly, with the highest scavenging values of 98.23% and 93.77%, respectively. The optimal process parameters resulted in a strong antioxidant capacity in the composite fermentation liquid of kidney bean and haskap.
-
Keywords:
- kidney bean /
- haskap /
- lactic acid bacteria /
- process optimization /
- antioxidant activity
-
植物发酵液是以一种或多种新鲜果蔬、豆谷类等为原料,经多种益生菌发酵制得的富含生物酶、益生菌、维生素、矿物质和次生代谢产物等营养成分的功能性微生物发酵产品[1]。植物基质中含有多种矿物质、膳食纤维以及维生素等营养成分,可以作为益生菌发酵的良好原料。Xie等[2]基于LC-MS/MS研究发现植物乳杆菌发酵可改变枸杞汁的代谢物谱,提高总酚、黄酮等多种生物活性物质的水平。周瑶等[3]通过利用多种乳酸菌单一或复合发酵番木瓜汁,开发出一种具有改善功能和促进健康特性的番木瓜益生菌发酵饮料。因此,植物经过生物发酵后,发酵液中的各种功效酶、多酚类化合物、黄酮类化合物、有机酸类化合物以及芳香类化合物含量激增,可发挥多种功能活性,如抗氧化、调节肠道功能、减轻肥胖症及抑菌消炎等[4]。
芸豆(Phaseolus vulgaris L.),是全球第二大产量的豆科作物之一[5]。芸豆的蛋白质含量丰富,且含有人体必需氨基酸、维生素B族和矿物质等基本营养物质,不仅属于高钾镁低钠食物[6],还是一种典型的低升糖指数(Glycemic Index)食物[7]。芸豆含有多酚类化合物、黄酮类化合物和有机酸等生物活性成分[8],具有显著的清除自由基、提高机体抗氧化能力的功效[9]。蓝靛果(Lonicera caerulea),忍冬科忍冬属落叶灌木植物,是一种高度抗寒的野生小浆果[10]。因其休眠期较短不适宜在温暖的地区栽种,故主要种植在我国东北、西北等地区[11]。蓝靛果除富含糖类、多种维生素[12]、矿物质等营养物质外,还含有黄酮、花青素[13]、多酚等多种活性物质。其中花青素含量与蔓越莓、黑莓和蓝莓等浆果相比相对较高[14],这与蓝靛果的高抗氧化能力密切相关[15]。有研究表明,豆类植物饮料在发酵过程中产生的有机酸能够通过可溶性配体增加铁、锌的吸收[16]。张秀玲等[17]以蓝靛果熟汁发酵制备蓝靛果酒,结果表明,熟汁发酵的蓝靛果酒含有较高浓度的总酚并表现出较强的DPPH自由基清除能力。包怡红等[18]以蓝靛果和米糠为原料制备一种新型复合酵素,发酵后与发酵前的黄酮含量、总酚含量以及DPPH自由基清除率等抗氧化指标相比均显著升高且各指标之间呈显著相关性(P<0.05)。单一植物原料或复合植物原料经发酵后可提升其生物活性成分含量并增加抗氧化等功能性。
目前有关植物发酵液的研究多集中在果蔬复配上,鲜少有关于豆类与小浆果复配的研究。在本课题组前期以芸豆及大豆为原料所制备的芸豆/大豆复合发酵液可显著增强杂粮抗氧化性能[19]研究的基础上,本文以杂粮和东北野生小浆果为原料,通过单因素及响应面优化试验,接种复合乳酸菌发酵制备一种具有抗氧化性的芸豆-蓝靛果复合发酵液,探究其理化性质、生物活性及抗氧化能力。本研究拓展了芸豆及蓝靛果深加工和高值化利用的新思路,并为杂粮与小浆果复配发酵产品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
芸豆、白糖 市售;FR-3蓝靛果 峰然蓝靛果苗木研发基地;耐高温α-淀粉酶(20000 U/mL)、糖化酶(10000 U/mL)、果胶酶(500 U/g)、没食子酸标准品、黄酮标准品、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS) 上海源叶生物科技有限公司;超氧化物歧化酶(SOD)测试盒 南京建成生物工程研究所;植物乳杆菌(Lactobacillus plantarum,LP) 东北农业大学菌库;鼠李糖乳杆菌(Lactobacillus rhamnosus,LR)、嗜酸乳杆菌(Lactobacillus acidophilus,LA)、嗜热链球菌(Sterptococcus thermophilus,S) 中国微生物菌种保藏中心。
本研究成果进行专利申报中,故对实验中所用菌株进行随机编号,分别为L1,L2,L3,L4。
BS224S电子天平 赛多利斯科学仪器有限公司;HCP-A7多功能料理机 海蒂诗国际集团;pHS-3C型pH计 力辰仪器专营店;Victor Nivo酶标仪 美国PerkinElmer公司;HH-6电热恒温水浴锅 常州荣华仪器制造有限公司。
1.2 实验方法
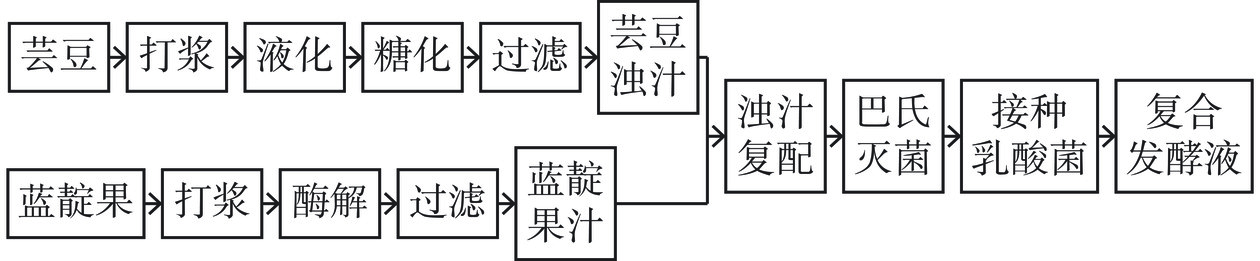
1.2.1 芸豆-蓝靛果复合发酵液制备工艺流程
芸豆打浆后加入高温α-淀粉酶(200 μL/100 mL),水浴97 ℃,液化20 min;放凉后调节芸豆汁pH为4.5,加入糖化酶(200 μL/100 mL),水浴60 ℃,糖化30 min;蓝靛果添加40%蒸馏水,打浆后添加2.5%果胶酶,室温酶解30 min。
1.2.2 菌种的活化
接种乳酸菌菌液至MRS液体培养基37 ℃培养24 h,平板划线接种至MRS固体培养基37 ℃培养48 h,挑取单菌落接种至MRS液体培养基中37 ℃培养24 h,连续接种三代活化菌液待用。
1.2.3 复合乳酸菌发酵菌种及发酵条件筛选
1.2.3.1 发酵菌种及时间选择
以芸豆-蓝靛果复合发酵液活菌数为指标,在初始pH5.0、发酵温度37 ℃、原料复配比例(芸豆汁:蓝靛果汁)为1:1的条件下,接种量为3%的四种乳酸菌(L1、L2、L3、L4)于芸豆-蓝靛果复合汁中,培养0、8、16、24、32、40、48 h。
1.2.3.2 接种量选择
以芸豆-蓝靛果复合发酵液活菌数为指标,在初始pH5.0、发酵温度37 ℃、原料复配比例为1:1的条件下,分别接种四种乳酸菌(L1、L2、L3、L4),接种量为1%、2%、3%、4%、5%,发酵时间为上述试验所得到的各菌种最佳发酵时间。
1.2.3.3 发酵菌种复配比例选择
以芸豆-蓝靛果复合发酵液活菌数为指标,在初始pH5.0、发酵温度37 ℃、原料复配比例为1:1的条件下,将上述两种最优乳酸菌按1:3、1:2、1:1、2:1、3:1比例接种,发酵时间分别为16、24、40 h。
1.2.4 单因素实验设计
芸豆-蓝靛果复合汁初始pH5.0、原料复配比例1:1、复配乳酸菌接种量3%、37 ℃发酵16 h。固定其他条件,分别考察初始pH(4.0、4.5、5.0、5.5、6.0)、原料复配比例(1:5、1:3、1:1、3:1、5:1)、接种量(1%、2%、3%、4%、5%)、发酵温度(31、33、35、37、39 ℃)对芸豆-蓝靛果复合发酵液活菌数的影响。
1.2.5 响应面试验设计
用Design-Expert 10软件中Box-Behnken模型,以芸豆-蓝靛果复合发酵液活菌数为响应值,进行初始pH、接种量、发酵温度3个单因素对芸豆-蓝靛果复合发酵液活菌数的响应面分析,优化发酵工艺参数。试验因素水平如表1所示。
表 1 Box-Behnken试验设计因素及水平Table 1. Factors and levels used in Box-Behnken experimental design水平 因素 A初始pH B接种量(%) C发酵温度(℃) −1 4.5 2 33 0 5.0 3 35 1 5.5 4 37 1.2.6 活菌数的测定
采用平板法计数,以微生物总数的对数(lg CFU/mL)来进行计数。
1.2.7 芸豆-蓝靛果复合发酵液发酵过程中理化性质检测
利用pH计对发酵过程中的pH进行测定;参考GB/T 12456-2008《食品中总酸的测定方法》测定发酵过程中总酸含量;利用手持折光仪测定发酵过程中可溶性固形物;利用3,5-二硝基水杨酸法[20]对发酵过程中还原糖含量进行测定,线性回归方程为y=0.1218x−0.1523,R2=0.9952。
1.2.8 芸豆-蓝靛果复合发酵液发酵过程中生物活性成分检测
1.2.8.1 总酚测定
采用Folin-Ciocalteus法测定[21]。取500 μL复合发酵液,加入10%福林酚溶液2.5 mL,混匀静置4 min后,加入7.5% Na2CO3溶液2 mL,避光反应40 min后,在765 nm处测定吸光值。没食子酸标准溶液的线性回归方程为y=0.0084x+0.0179,R2=0.999。
1.2.8.2 黄酮测定
采用NaNO2-AL(NO3)3比色法测定[22]。取500 μL复合发酵液,加入5% NaNO2溶液250 μL,混匀静置6 min后,加入10% Al(NO3)3溶液250 μL,混匀静置6 min后,加入4% NaOH溶液2 mL,蒸馏水定容,混匀静置15 min,在510 nm处测定吸光值。黄酮标准溶液的线性回归方程为y=0.0413x+0.0349,R2=0.9994。
1.2.9 芸豆-蓝靛果复合发酵液发酵过程中抗氧化能力测定
1.2.9.1 SOD活力测定
使用超氧化物歧化酶(SOD,U/mL)测试盒测定。
1.2.9.2 DPPH自由基清除率测定
用无水乙醇配制DPPH溶液0.2 mmol/L,避光保存。取2 mL不同发酵时间(0、8、16、24、32、40、48 h)复合发酵液于试管中,加入2 mL的DPPH溶液并摇匀,在室温避光反应30 min,在517 nm波长下测其吸光度为A1,用2 mL无水乙醇代替DPPH溶液,测其吸光度为A2,用2 ml蒸馏水代替样液,测其吸光度为A0。DPPH自由基清除率计算公式如下:
DPPH自由基清除率(%)=(1−A1−A2A0)×100 式中:A0:表示空白组的吸光值;A1:表示发酵液的吸光值;A2:表示对照组的吸光值。
1.2.9.3 ABTS+自由基清除能力测定
将配制好的140 mmol/L过硫酸钾440 μL加入到25 mL 7 mmol/L的ABTS溶液中,得到ABTS+自由基工作液,避光反应12~16 h。使用时,用95%的乙醇稀释,使其吸光度在0.7±0.02。1.5 mL不同发酵时间(0、8、16、24、32、40、48 h)复合发酵液中加入1.5 mL ABTS溶液,室温避光放置6 min,734 nm测定其吸光度A1,用1.5 mL蒸馏水代替ABTS溶液,测其吸光度为A2,用1.5 mL蒸馏水代替发酵液原液,测其吸光度为A0,ABTS+自由基清除率计算公式如下:
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 式中:A0:表示空白组的吸光值;A1:表示发酵液的吸光值;A2:表示对照组的吸光值。
1.3 数据处理
上述实验均重复3次,采用SPSS 25进行单因素方差分析(ANOVA)及相关性分析。采用Design Expert 10中Box-Behnken模型进行响应面试验设计及分析,Graph Pad Prism 10软件作图。P<0.05确定为具有统计学意义。
2. 结果与分析
2.1 复合乳酸菌发酵菌种筛选
2.1.1 芸豆-蓝靛果复合发酵液发酵菌种、发酵时间及接种量的选择
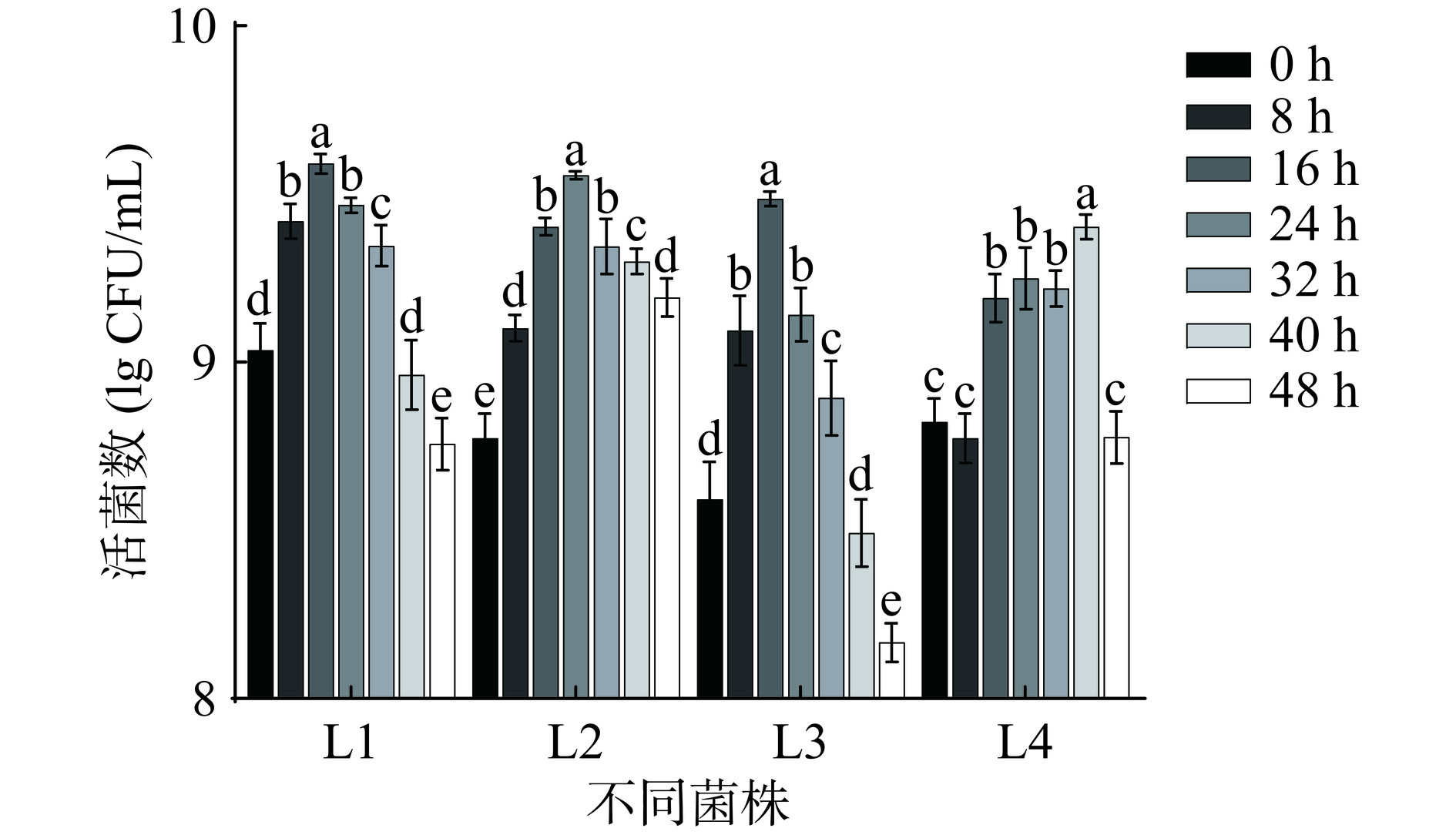
植物原料在发酵过程中产生的葡萄糖等碳水化合物可为细菌菌株生长提供合适的碳源[22]。图1为芸豆-蓝靛果复合发酵液发酵过程中不同乳酸菌的生长趋势变化。在芸豆-蓝靛果复合发酵液中,接种L1与L2菌株的最大活菌数整体高于L3与L4菌株。接种L1和L3菌株在发酵16 h活菌数达到最大,菌株L2在发酵24 h时活菌数最大,菌株L4在发酵40 h时活菌数达到最大。因此,接种菌株L1和L3的最佳发酵时间为16 h,接种菌株L2的最佳发酵时间为24 h,接种菌株L4的最佳发酵时间为40 h。
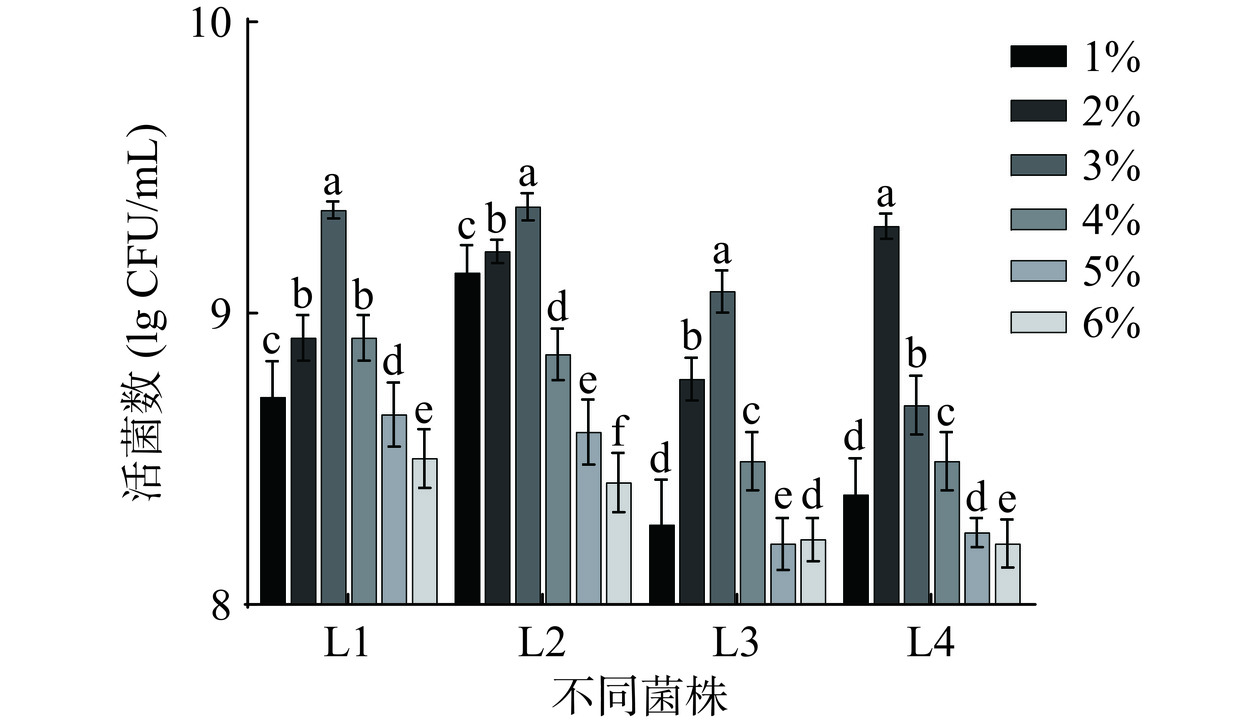
乳酸菌发酵有利于植物生物活性物质代谢和产生,接种量的大小直接影响菌种的生长速度和发酵效率。在上述实验得到的各乳酸菌最佳发酵时间的基础上进行接种量的优化,图2为不同乳酸菌接种量对芸豆-蓝靛果复合发酵液的活菌数的影响。如图2所示,L4在接种量为2%时活菌数最大,达到9.30 lg CFU/mL,L1、L2和L3在接种量为3%时活菌数最大,分别为9.38、9.41和9.14 lg CFU/mL。因此,接种L4的复合发酵液的最佳接种量为2%,L1、L2和L3的最佳接种量为3%。
2.1.2 芸豆-蓝靛果复合发酵液菌种复配比例的选择
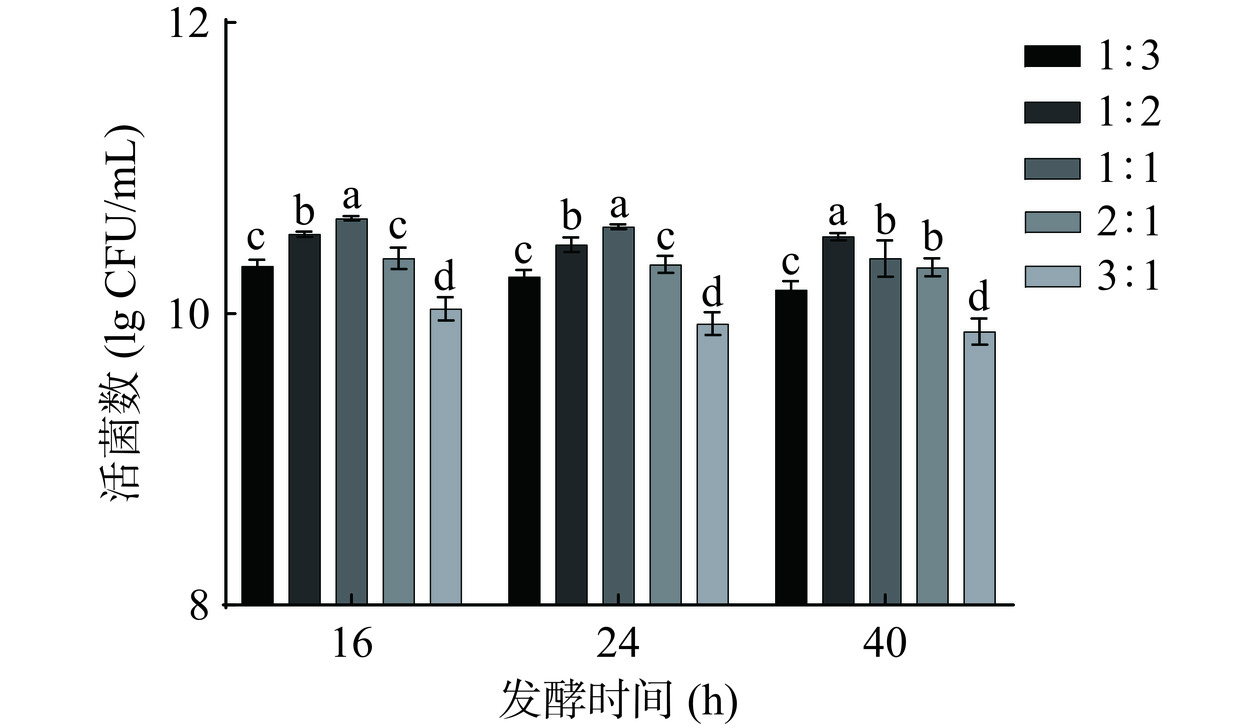
上述实验结果表明芸豆-蓝靛果复合汁中,分别接种L1与L2菌株的最大活菌数整体高于L3与L4菌株。因此选择L1与L2菌株复配发酵16、24、40 h,接种量3%进行菌株复配比例的筛选。由图3可知,活菌数随着乳酸菌复配比例的变化呈先上升后下降的趋势,L1与L2复配比例为1:1,发酵时间为16 h时,其活菌数值达到最大,为10.55 lg CFU/mL。分析此发酵环境,两种乳酸菌存在一定的协同生长作用,活菌数较单一菌种发酵明显增加,但L1菌种含量的增多导致活菌数的下降,可能是由于L1菌种进入生长衰退期所导致的,应选择适宜比例进行发酵,因此选择L1与L2复配比例为1:1,发酵时间16 h进行发酵工艺参数(初始pH、原料比例、接种量和发酵温度)的单因素实验。
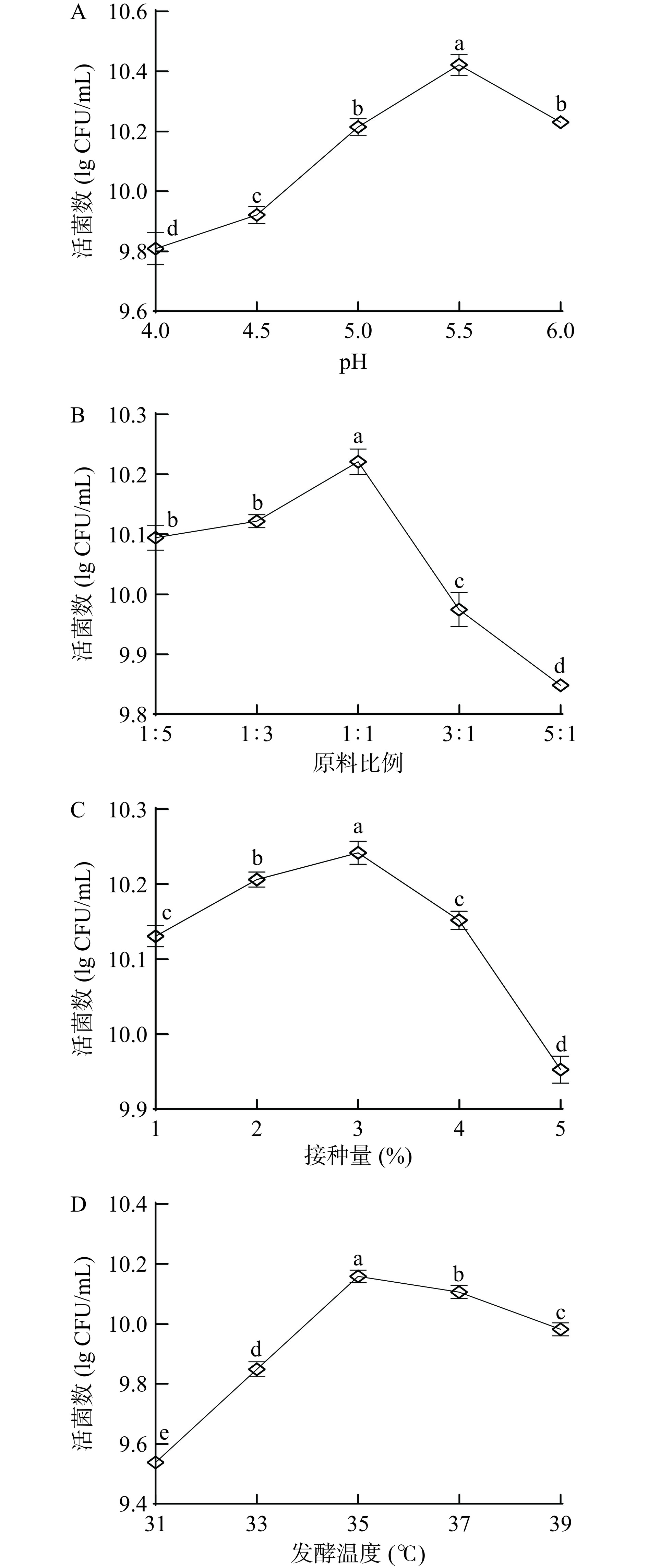
2.2 单因素实验分析
由图4A可知,随初始pH增加复合发酵液的活菌数呈现先上升后下降的趋势,当pH为5.5时,活菌数达到最大值。芸豆及蓝靛果经过乳酸菌发酵产生酸性代谢产物,进而导致发酵液pH降低。发酵液pH过低会导致菌株失活,不利于乳酸菌在复合发酵液中的生长,过高也会抑制乳酸菌的生长,影响复合乳酸菌的生长繁殖以及代谢情况。考虑到乳酸菌的适宜pH,因此选择pH4.5~5.5进行响应面试验。
由图4B可知,随蓝靛果汁比例的减少活菌数开始上升,在原料比例为1:1时芸豆-蓝靛果复合发酵液的活菌数达到最高值,为10.23 lg CFU/mL。适宜的原料比例更有利于菌种生长,二者1:1混合更有利于乳酸菌的繁殖,促进复合乳酸菌在发酵液中产生多种次生代谢产物。因此选择复配比例1:1进行后续试验。
由图4C可知,芸豆-蓝靛果复合发酵液活菌数随复合乳酸菌接种量的增长先上升后下降,在接种量为3%时活菌数达到峰值,为10.25 lg CFU/mL。接种量的高低会影响发酵初期复合乳酸菌的生长速度,当接种量超过复合乳酸菌的适宜接种量时,可能会缩短菌株的延滞期导致其快速到达对数生长期,发酵体系内的营养物质被迅速消耗掉[23],不利于菌株后续生长而导致其活菌数下降。因此选择接种量2%、3%、4%进行响应面优化试验。
由图4D可知,随着发酵温度的升高,复合发酵液的活菌数呈现先上升后下降的趋势,在发酵温度为35 ℃时其活菌数达到最大,为10.17 lg CFU/mL。发酵温度会对微生物的生长造成影响,温度过高或过低均不利于乳酸菌的生长进而影响发酵,因此选择发酵温度为33、35、37 ℃进行响应面优化试验。
2.3 响应面试验结果与分析
2.3.1 响应面结果分析
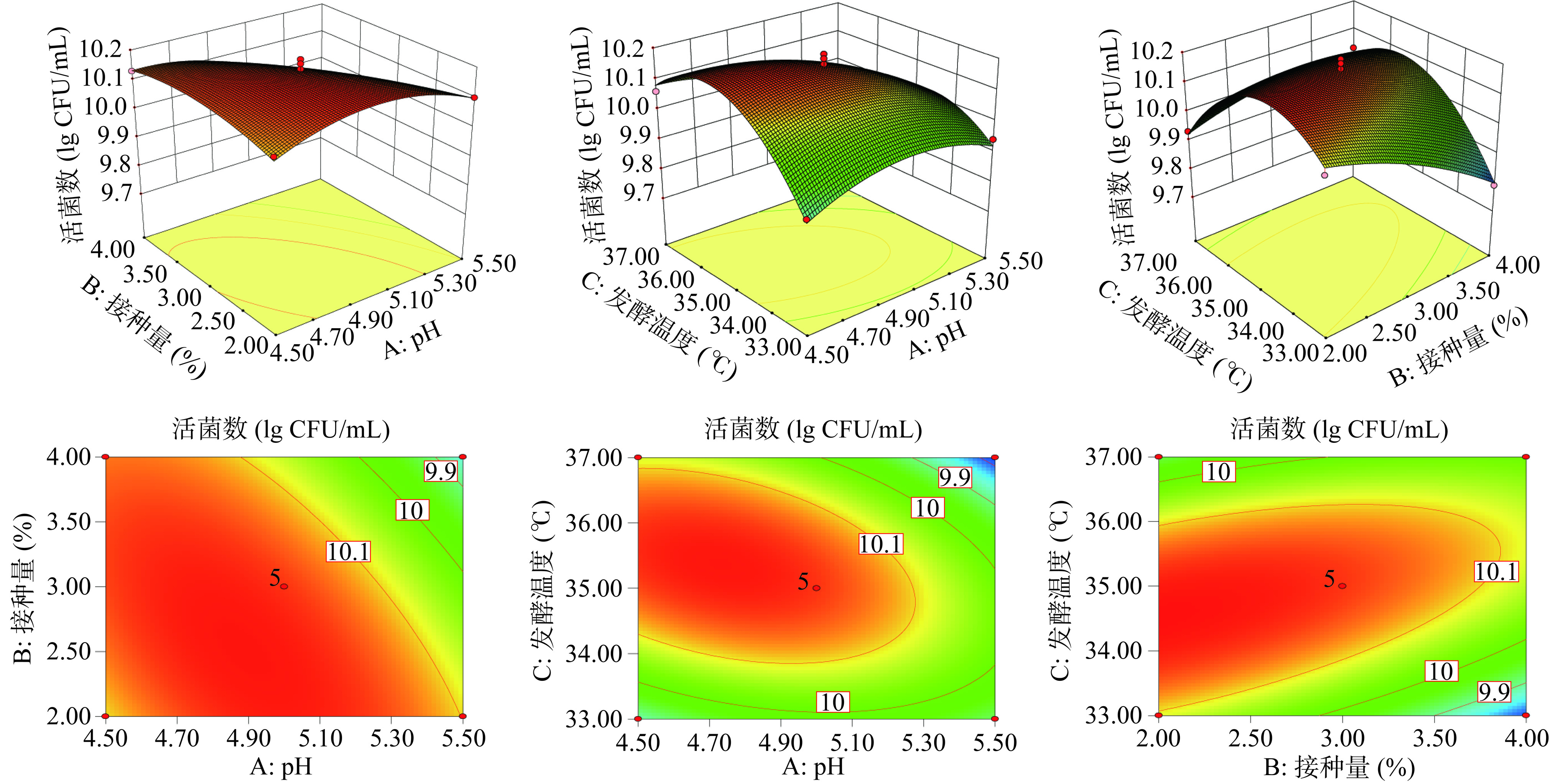
活菌数是反映乳酸菌生长的重要依据,可以判断乳酸菌在芸豆-蓝靛果复合发酵液中的生长状况。本次研究依据Box-Behnken试验设计原则,以初始pH(A)、接种量(B)、发酵温度(C)3个因素作为主要影响因素,以活菌数为响应值,设计3因素3水平试验模型。设计方案及试验结果见表2。经过拟合得到回归方程为:Y=10.16−0.070A−0.052B+0.011C−0.068AB−0.084AC+0.093BC−0.076A2−0.037B2−0.17C2。
表 2 Box-Behnken试验设计及结果Table 2. Box-Behnken experimental design and results试验号 A初始pH B接种量 C发酵温度 活菌数(lg CFU/mL) 1 −1 0 −1 9.90 2 0 0 0 10.16 3 0 0 0 10.20 4 0 0 0 10.18 5 0 1 −1 9.79 6 0 −1 −1 10.07 7 0 0 0 10.14 8 1 0 −1 9.94 9 1 −1 0 10.10 10 −1 −1 0 10.11 11 −1 0 1 10.06 12 0 1 1 10.03 13 0 0 0 10.12 14 −1 1 0 10.13 15 1 1 0 9.85 16 1 0 1 9.76 17 0 −1 1 9.93 由表3可知,所选回归方程模型P<0.0001,说明该二次多项回归方程模型极显著;失拟项不显著(P=0.5225>0.05),表明未知因素对实验结果干扰小,模型选择恰当。模型回归系数R2为0.9784,表明实验结果拟合情况较好,因此可以用此模型预测和分析芸豆-蓝靛果复合发酵液的发酵工艺参数。
表 3 响应面回归模型及方差分析结果Table 3. Response surface regression model and variance analysis results方差来源 离差平方和 自由度 均方和 F值 P值 显著性 模型 0.30 9 0.033 35.20 <0.0001 *** 初始pH(A) 0.039 1 0.039 40.80 0.0004 ** 接种量(B) 0.022 1 0.022 23.09 0.0020 ** 发酵温度(C) 9.136E-004 1 9.136E-004 0.96 0.3598 AB 0.018 1 0.018 19.40 0.0031 ** AC 0.028 1 0.028 29.56 0.0010 ** BC 0.035 1 0.035 36.69 0.0005 ** A2 0.024 1 0.024 25.43 0.0015 ** B2 5.650E-003 1 5.650E-003 5.94 0.0450 * C2 0.12 1 0.12 123.35 <0.0001 *** 残差 6.660E-003 7 9.514E-004 失拟项 2.649E-003 3 8.830E-004 0.88 0.5225 误差项 4.011E-003 4 1.003E-003 总和 0.31 16 注:*表示差异显著,P<0.05;**表示差异高度显著,P<0.01;***表示差异极显著,P<0.0001。 方程一次项中A项、B项对复合发酵液的活菌数影响达到高度显著水平(P<0.01),交互项AB、AC、BC对活菌数影响高度显著(P<0.01)。各因素对复合发酵液活菌数影响顺序依次为初始pH>接种量>发酵温度。
2.3.2 交互结果分析及验证实验结果
图5为各因素交互作用对活菌数的影响,通过三维响应面和二维等高线图分析,初始pH、接种量响应面曲面弯曲程度较大,表明对复合发酵液活菌数影响显著(P<0.05)。各因素交互作用等高线图呈椭圆形,说明交互作用显著。这与方差分析结果相一致。由图5可知,对活菌数影响显著的有交互项初始pH和接种量、交互项初始pH和发酵温度以及交互项接种量与发酵温度。
根据模型通过Design Expert软件分析可得最优条件为:初始pH5.07、接种量2%、发酵温度34.43 ℃,活菌数预测值为10.19 lg CFU/mL。结合实际应用,考虑到成本因素影响,将实验条件调整为:初始pH5.0、接种量2%、发酵温度34 ℃,根据上述条件进行验证,芸豆-蓝靛果复合发酵液活菌数的实际值为9.89 lg CFU/mL,与预测值相近,可以进行后续理化性质和抗氧化评估实验。
2.4 芸豆-蓝靛果复合发酵液发酵过程中理化性质的变化
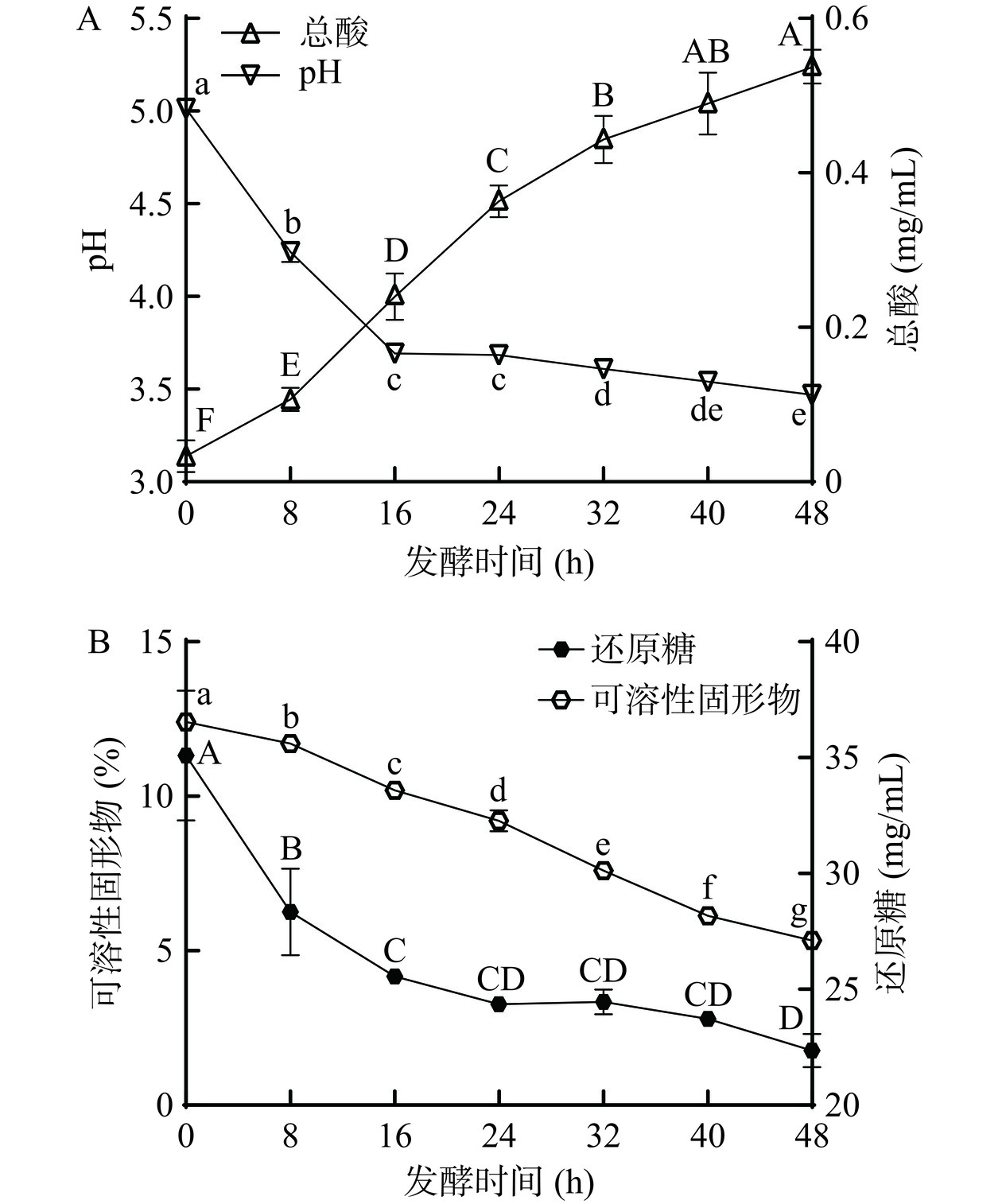
图6A为复合发酵液在发酵过程中的pH和总酸的动态变化。随发酵时间的增加,pH呈现下降的趋势,自发酵0 h至发酵16 h复合发酵液的pH急速下降至3.64,后下降平缓直至发酵48 h下降至3.42;总酸呈现上升的趋势,0 h为0.05 mg/mL,发酵16 h为0.27 mg/mL。pH及总酸的变化可能是由于微生物在发酵过程中大量增殖,消耗糖原代谢产生有机酸等代谢产物,从而导致pH降低并且总酸含量增长。de la Fuente等[24]利用植物乳杆菌TR-71发酵橙子牛奶饮料使其总酸含量上升。
图6B为复合发酵液发酵过程中可溶性固形物和还原糖含量的变化。可溶性固形物含量可直观反映发酵液品质,芸豆-蓝靛果复合发酵过程中的可溶性固形物呈现下降趋势,由12.4%下降至5.3%。还原糖是微生物生长的主要碳源[25],结果表明,还原糖在发酵前16 h迅速下降,由35.10 mg/mL下降至25.22 mg/mL,表明乳酸菌菌株在发酵前期快速消耗还原糖,在发酵24~48 h呈现缓慢下降的趋势;可溶性固形物与还原糖的减少可能是因为乳酸菌菌株在发酵过程中将大分子物质转化为有机酸等小分子物质。
2.5 芸豆-蓝靛果复合发酵液发酵过程中总酚及黄酮含量变化
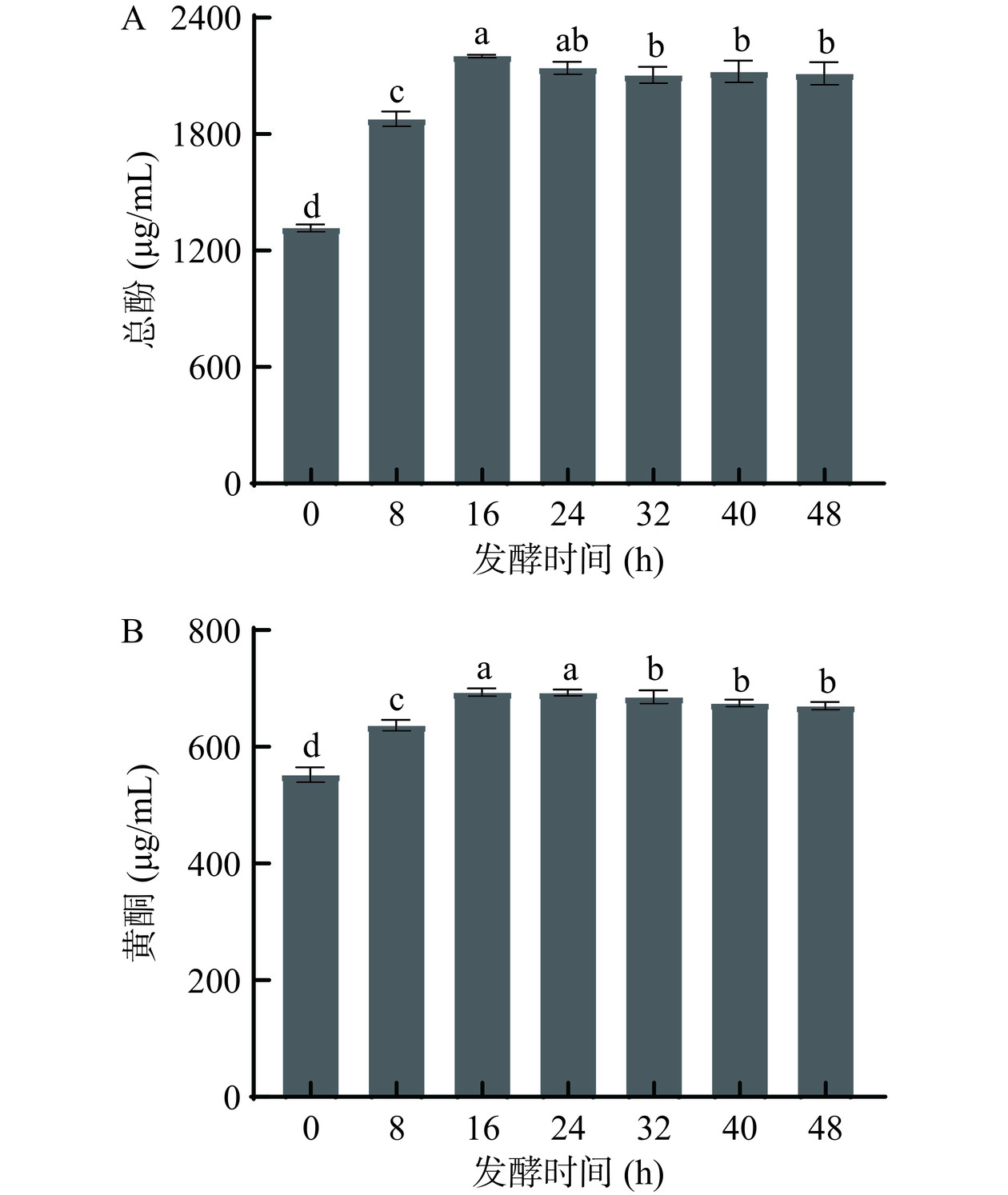
微生物发酵可提高植物中总酚、黄酮等生物活性物质含量[26]。芸豆-蓝靛果复合发酵液发酵过程中总酚含量变化如图7A所示。总酚含量在发酵过程中呈现先上升后小幅下降后趋于平缓的趋势。在发酵16 h总酚含量达到最高,为2204.96 µg/mL,较0 h的1318.06 µg/mL显著升高了886.90 µg/mL,升高了0.40倍(P<0.05),推测由于植物原料经过乳酸菌生长代谢产生次生代谢产物,使发酵液中总酚含量升高[27]。Zhu等[28]利用乳酸菌发酵杨梅果渣后显著提高了总多酚的含量。发酵24 h开始总酚含量小幅下降后趋于平缓,可能是由于发酵后期一些酚类物质发生了非酶促反应聚合,致使总酚含量下降[29]。
由图7B可知,芸豆-蓝靛果复合发酵液发酵过程中黄酮含量呈先上升后缓慢下降的趋势。黄酮含量在发酵16 h达到最大值701.09 µg/mL,较0 h升高了138.01 µg/mL。推测乳酸菌发酵过程中,芸豆-蓝靛果复合发酵液中与不溶性纤维结合的黄酮类化合物被释放,导致黄酮含量上升[30]。发酵24 h后,黄酮含量开始有小幅下降,可能是由于发酵后期成分发生生物转化及结构变化导致其含量变少,这与Shi等[31]通过植物乳杆菌JHT78发酵西瓜汁结果一致。有研究表明,酚类化合物、类黄酮和抗坏血酸等天然抗氧化剂与植物的抗氧化特性有关[32]。王思溥等[33]发现DPPH自由基清除能力和ABTS+自由基清除能力与高浓度酚类物质等存在正相关性。
2.6 芸豆-蓝靛果复合发酵液发酵过程中抗氧化活性变化
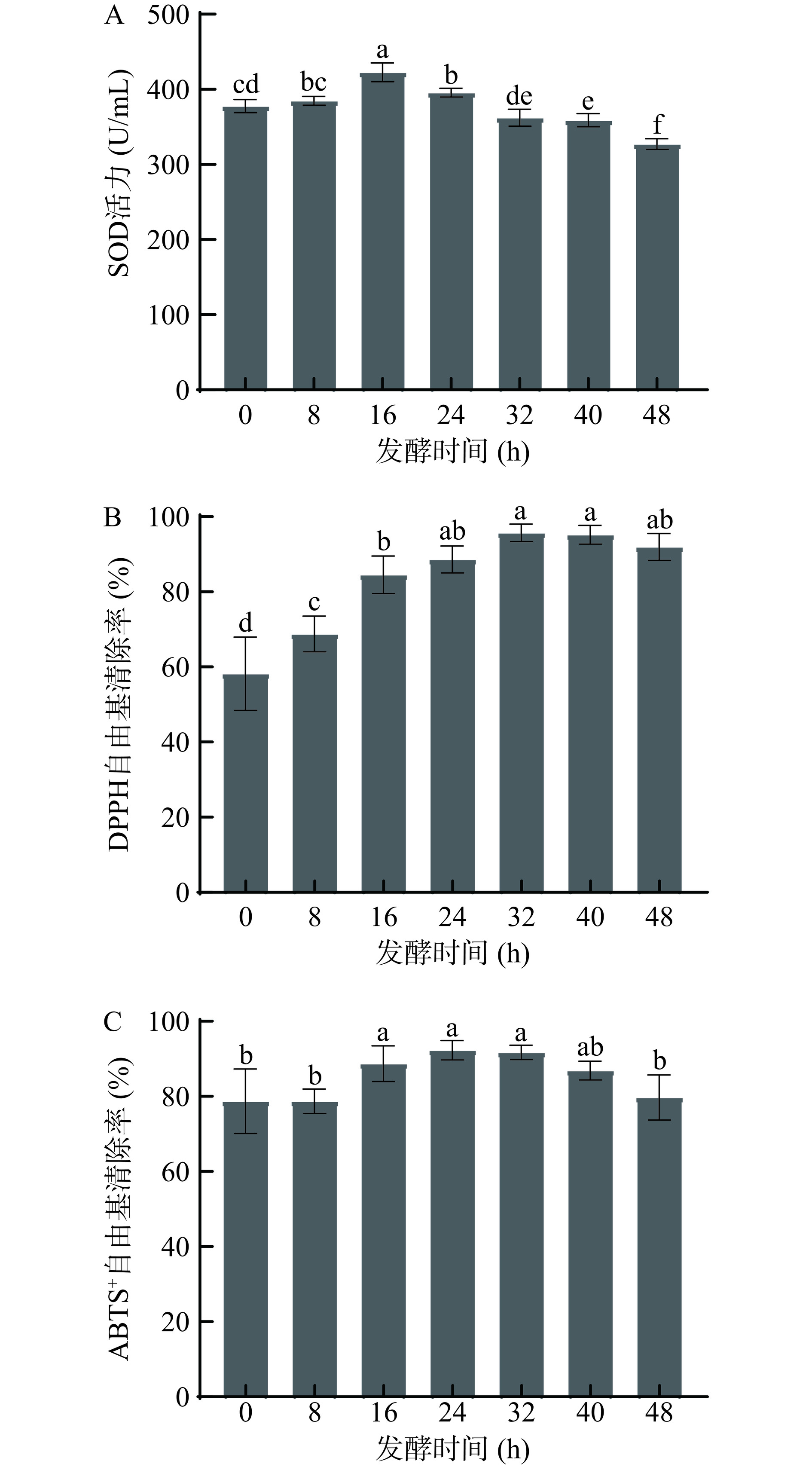
SOD是生物体内重要的自由基清除剂,可用于评估抗氧化活性。图8A为发酵过程中SOD活力的变化,随发酵时间的增加SOD活力值先上升后下降,并在发酵16 h时达到最高值为435.69 U/mL。这与筛选得到的最佳工艺参数相符。发酵后期SOD活力显著下降(P<0.05),可能是由于在发酵过程后期碳水化合物减少,导致复合乳酸菌发酵可利用能量的减少,致使发酵速度降低,导致SOD活力下降[34]。
如图8B为芸豆-蓝靛果复合发酵液发酵过程中DPPH自由基清除率变化。随着发酵时间的增加,DPPH自由基清除率呈先上升后平缓的趋势,整个发酵过程中复合发酵液均对DPPH自由基具有清除能力,在发酵16 h时为84.31%,较发酵0 h显著提升了0.31倍(P<0.05),后在发酵32 h达到最大值为98.23%,说明发酵时间的增长有利于DPPH自由基清除能力的提升。推测可能是由于乳酸菌发酵产生酚类物质等代谢产物[25]以及SOD等功效酶协同作用,使DPPH自由基清除率有所提升。Wang等[35]通过乳酸菌发酵黑苦莓汁探究其酚类物质与抗氧化活性变化,结果表明,发酵黑苦莓汁中的酚酸、类黄酮的转化有助于增强黑苦莓汁的DPPH自由基清除能力。
ABTS+自由基是一种存在较为稳定的自由基,与抗氧化物质发生反应时可使体系褪色,测定其吸光值可计算出样品的ABTS+自由基清除率[36]。图8C为芸豆-蓝靛果复合发酵液发酵过程中ABTS+自由基清除能力的变化,随发酵时间的延长ABTS+自由基清除能力先上升后下降。在发酵16 h清除率为88.11%,较发酵初始显著提升了0.21倍(P<0.05)。Floegel等[37]研究发现酚类化合物与ABTS+自由基清除率存在密切关系。经过复合乳酸菌发酵后使芸豆-蓝靛果复合发酵液总酚及黄酮含量显著升高,这可能是导致芸豆-蓝靛果复合发酵液具有高抗氧化活性的原因。
2.7 芸豆-蓝靛果复合发酵液发酵过程中各指标相关性分析
表4为芸豆-蓝靛果复合发酵液发酵过程中总酚、黄酮、SOD活力、DPPH自由基清除率和ABTS+自由基清除率的相关性分析,结果表明芸豆-蓝靛果复合发酵液中总酚和黄酮分别与抗氧化性具有良好的正相关性。由表4可知,总酚及黄酮与DPPH自由基清除率呈现极显著正相关(P<0.01)。乳酸菌发酵可改变酚类物质增强抗氧化能力。Wang等[38]探究了三株乳酸菌在发酵过程中对紫甘薯汁酚类物质和抗氧化能力的影响,皮尔森相关分析显示DPPH自由基清除能力与咖啡酸和香草酸等酚酸类化合物含量呈显著正相关(P<0.05)。唐双庆等[39]进行了发酵豆类中酚类物质与抗氧化活性的相关性分析,发现总酚含量与DPPH自由基清除活性呈极显著相关(P<0.01),这与本研究结果一致。
表 4 发酵过程中复合发酵液各参数相关性Table 4. Correlation of parameters of composite fermentation liquid in fermentation process指标 总酚 黄酮 SOD
活力DPPH自由基
清除率ABTS+自由基
清除率总酚 1 0.991** 0.038 0.882** 0.638 黄酮 / 1 0.095 0.879** 0.725 SOD活力 / / 1 −0.305 0.328 DPPH自由基清除率 / / / 1 0.672 ABTS+自由基清除率 / / / / 1 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 3. 结论
利用L1:L2等比例复配发酵芸豆-蓝靛果复合汁,发酵时间为16 h、原料复配比例1:1,通过响应面优化得到最优工艺参数(初始pH5.0、接种量2%、发酵温度34 ℃),在此基础上对芸豆-蓝靛果复合发酵液发酵过程中的理化性质、生物活性成分与抗氧化能力进行检测。其中,发酵16 h的总酚含量较发酵前提升了886.90 µg/mL,黄酮含量较发酵前提升了138.01 µg/mL,DPPH自由基清除率较发酵0 h提升了0.31倍。芸豆-蓝靛果复合发酵液发酵过程中总酚及黄酮含量与DPPH自由基清除率呈极显著正相关性(P<0.01)。因此,复合乳酸菌发酵有利于芸豆-蓝靛果中的活性物质含量提升,并可有效增强复合发酵液的抗氧化能力。未来,芸豆-蓝靛果复合发酵液抗氧化活性的物质基础仍需挖掘,其它功能活性还需进一步研究。
-
表 1 Box-Behnken试验设计因素及水平
Table 1 Factors and levels used in Box-Behnken experimental design
水平 因素 A初始pH B接种量(%) C发酵温度(℃) −1 4.5 2 33 0 5.0 3 35 1 5.5 4 37 表 2 Box-Behnken试验设计及结果
Table 2 Box-Behnken experimental design and results
试验号 A初始pH B接种量 C发酵温度 活菌数(lg CFU/mL) 1 −1 0 −1 9.90 2 0 0 0 10.16 3 0 0 0 10.20 4 0 0 0 10.18 5 0 1 −1 9.79 6 0 −1 −1 10.07 7 0 0 0 10.14 8 1 0 −1 9.94 9 1 −1 0 10.10 10 −1 −1 0 10.11 11 −1 0 1 10.06 12 0 1 1 10.03 13 0 0 0 10.12 14 −1 1 0 10.13 15 1 1 0 9.85 16 1 0 1 9.76 17 0 −1 1 9.93 表 3 响应面回归模型及方差分析结果
Table 3 Response surface regression model and variance analysis results
方差来源 离差平方和 自由度 均方和 F值 P值 显著性 模型 0.30 9 0.033 35.20 <0.0001 *** 初始pH(A) 0.039 1 0.039 40.80 0.0004 ** 接种量(B) 0.022 1 0.022 23.09 0.0020 ** 发酵温度(C) 9.136E-004 1 9.136E-004 0.96 0.3598 AB 0.018 1 0.018 19.40 0.0031 ** AC 0.028 1 0.028 29.56 0.0010 ** BC 0.035 1 0.035 36.69 0.0005 ** A2 0.024 1 0.024 25.43 0.0015 ** B2 5.650E-003 1 5.650E-003 5.94 0.0450 * C2 0.12 1 0.12 123.35 <0.0001 *** 残差 6.660E-003 7 9.514E-004 失拟项 2.649E-003 3 8.830E-004 0.88 0.5225 误差项 4.011E-003 4 1.003E-003 总和 0.31 16 注:*表示差异显著,P<0.05;**表示差异高度显著,P<0.01;***表示差异极显著,P<0.0001。 表 4 发酵过程中复合发酵液各参数相关性
Table 4 Correlation of parameters of composite fermentation liquid in fermentation process
指标 总酚 黄酮 SOD
活力DPPH自由基
清除率ABTS+自由基
清除率总酚 1 0.991** 0.038 0.882** 0.638 黄酮 / 1 0.095 0.879** 0.725 SOD活力 / / 1 −0.305 0.328 DPPH自由基清除率 / / / 1 0.672 ABTS+自由基清除率 / / / / 1 注:*表示差异显著,P<0.05;**表示差异极显著,P<0.01。 -
[1] 蔡丽琴, 王伟军, 李延华, 等. 食用酵素发酵代谢及功能特性研究进展[J]. 食品工业科技,2021,42(20):408−414. [CAI L Q, WANG W J, LI Y H, et al. Research progress on fermentation metabolism and functional characteristics of edible fermented extract[J]. Science and Technology of Food Industry,2021,42(20):408−414.] CAI L Q, WANG W J, LI Y H, et al. Research progress on fermentation metabolism and functional characteristics of edible fermented extract[J]. Science and Technology of Food Industry, 2021, 42(20): 408−414.
[2] XIE H, GAO P, LU Z, et al. Changes in physicochemical characteristics and metabolites in the fermentation of goji juice by Lactiplantibacillus plantarum[J]. Food Bioscience,2023,54:102881. doi: 10.1016/j.fbio.2023.102881
[3] 周瑶, 李娟, 贾凤霞, 等. 单一及混合乳酸菌发酵对番木瓜汁品质的影响[J]. 食品与机械,2024,40(1):175−182. [ZHOU Y, LI J, JIA F X, et al. Lactic acid fermentation of papaya juice using single and mixed lactic acid bacteria[J]. Food& Machinery,2024,40(1):175−182.] ZHOU Y, LI J, JIA F X, et al. Lactic acid fermentation of papaya juice using single and mixed lactic acid bacteria[J]. Food& Machinery, 2024, 40(1): 175−182.
[4] 尹欢, 方伟. 药食两用植物酵素活性成分及发酵机理研究进展[J]. 农产品加工,2020(3):89−91. [YIN H, FANG W. Research progress on active components and fermentation mechanism of medicinal and edible plants ferment[J]. Farm Products Processing,2020(3):89−91.] YIN H, FANG W. Research progress on active components and fermentation mechanism of medicinal and edible plants ferment[J]. Farm Products Processing, 2020(3): 89−91.
[5] AYDAR E F, MERTDINÇ Z, DEMIRCAN E, et al. Kidney bean (Phaseolus vulgaris L.) milk substitute as a novel plant-based drink:Fatty acid profile, antioxidant activity, in-vitro phenolic bio-accessibility and sensory characteristics[J]. Innovative Food Science & Emerging Technologies,2023,83:103254.
[6] 周欣雨, 佐兆杭, 王颖, 等. 超声处理对芸豆蛋白理化性质及抗氧化能力的影响[J]. 食品工业科技,2022,43(20):107−112. [ZHOU X Y, ZUO Z H, WANG Y, et al. Effects of ultrasonic treatment on physicochemical properties and antioxidant ability of kidney bean protein[J]. Science and Technology of Food Industry,2022,43(20):107−112.] ZHOU X Y, ZUO Z H, WANG Y, et al. Effects of ultrasonic treatment on physicochemical properties and antioxidant ability of kidney bean protein[J]. Science and Technology of Food Industry, 2022, 43(20): 107−112.
[7] BAI Z, HUANG X, WU G, et al. Polysaccharides from red kidney bean alleviating hyperglycemia and hyperlipidemia in type 2 diabetic rats via gut microbiota and lipid metabolic modulation[J]. Food Chemistry,2023,404:134598. doi: 10.1016/j.foodchem.2022.134598
[8] 王何柱, 朱勇, 朱怡, 等. 7种芸豆中酚类化合物组成及其抗氧化活性[J]. 中国粮油学报,2020,35(9):28−33. [WANG H Z, ZHU Y, ZHU Y, et al. Composition and antioxidant activity of phenolic compounds in 7 kinds of kidney beans[J]. Journal of the Chinese Cereals and Oils Association,2020,35(9):28−33.] WANG H Z, ZHU Y, ZHU Y, et al. Composition and antioxidant activity of phenolic compounds in 7 kinds of kidney beans[J]. Journal of the Chinese Cereals and Oils Association, 2020, 35(9): 28−33.
[9] LOPES C, AKEL F C, de ALBUQUERQUE S A, et al. Effects of processing technologies on the antioxidant properties of common bean (Phaseolus vulgaris L.) and lentil (Lens culinaris) proteins and their hydrolysates[J]. Food Res Int,2023,172:113190. doi: 10.1016/j.foodres.2023.113190
[10] 李凤凤. 蓝靛果花色苷提取、抗氧化性研究及饮料研制[D]. 哈尔滨:东北农业大学, 2019. [LI F F. Extraction and antioxidant of anthocyanin from blue honeysukle berries (Lonicera caerulea L.) and development of beverage[D]. Harbin:Northeast Agricultural University, 2019.] LI F F. Extraction and antioxidant of anthocyanin from blue honeysukle berries (Lonicera caerulea L.) and development of beverage[D]. Harbin: Northeast Agricultural University, 2019.
[11] 王鑫, 毕海鑫, 修伟业, 等. 发酵蓝靛果果汁的工艺优化及香气成分分析[J]. 食品工业科技,2023,44(13):176−185. [WANG X, BI H X, XIU W Y, et al. Process optimization and aroma composition analysis of fermented lonicera edulis juice[J]. Science and Technology of Food Industry,2023,44(13):176−185.] WANG X, BI H X, XIU W Y, et al. Process optimization and aroma composition analysis of fermented lonicera edulis juice[J]. Science and Technology of Food Industry, 2023, 44(13): 176−185.
[12] 李山, 张彦龙, 曾伟民, 等. 蓝靛果果渣花色苷胶束的制备及其稳定性研究[J]. 食品工业科技,2024,45(2):21−29. [LI S, ZHANG Y L, ZENG W M, et al. Study on preparation and stability of anthocyanin micelles from lonicera edulis pomace[J]. Science and Technology of Food Industry,2024,45(2):21−29.] LI S, ZHANG Y L, ZENG W M, et al. Study on preparation and stability of anthocyanin micelles from lonicera edulis pomace[J]. Science and Technology of Food Industry, 2024, 45(2): 21−29.
[13] LI J, LI Z, MA Q, et al. Enhancement of anthocyanins extraction from haskap by cold plasma pretreatment[J]. Innovative Food Science & Emerging Technologies,2023,84:103294.
[14] SENICA M, STAMPAR F, MIKULIC-PETKOVSEK M. Blue honeysuckle (Lonicera cearulea L. subs. edulis) berry; A rich source of some nutrients and their differences among four different cultivars[J]. Scientia Horticulturae,2018,238:215−221. doi: 10.1016/j.scienta.2018.04.056
[15] SAINZ MARTINEZ A, KORNPOINTNER C, HASELMAIR-GOSCH C, et al. Dynamic streamlined extraction of iridoids, anthocyanins and lipids from haskap berries[J]. LWT,2021,138:110633. doi: 10.1016/j.lwt.2020.110633
[16] AKEEM S A, KOLAWOLE F L, JOSEPH J K, et al. Traditional food processing techniques and micronutrients bioavailability of plant and plant-based foods:A review[J]. Annals Food Science and Technology,2019,20:30−41.
[17] 张秀玲, 汲润, 李凤凤, 等. 发酵工艺对蓝靛果酒功能性及香气成分的影响[J]. 食品科学,2022,43(10):189−198. [ZHANG X L, JI R, LI F F, et al. Effects of fermentation processes on the functional and aroma components of lonicera edulis wine[J]. Food Science,2022,43(10):189−198.] doi: 10.7506/spkx1002-6630-20210618-213 ZHANG X L, JI R, LI F F, et al. Effects of fermentation processes on the functional and aroma components of lonicera edulis wine[J]. Food Science, 2022, 43(10): 189−198. doi: 10.7506/spkx1002-6630-20210618-213
[18] 包怡红, 赵鑫磊, 唐妍, 等. 蓝靛果米糠酵素发酵工艺优化及其代谢产物变化分析[J]. 中南林业科技大学学报,2022,42(2):147−158. [BAO Y H, ZHAO X L, TANG Y, et al. The optimization of fermentation technology and the changes of metabolites of Lonicera caerulea rice bran enzyme[J]. Journal of Central South University of Forestry & Technology,2022,42(2):147−158.] BAO Y H, ZHAO X L, TANG Y, et al. The optimization of fermentation technology and the changes of metabolites of Lonicera caerulea rice bran enzyme[J]. Journal of Central South University of Forestry & Technology, 2022, 42(2): 147−158.
[19] 李志芳, 张裕, 王颖, 等. 芸豆/大豆复合发酵液工艺优化及抗氧化活性研究[J]. 中国粮油学报,2022,37(1):164−169. [LI Z F, ZHANG Y, WANG Y, et al. Optimization and antioxidation of compound fermentation liquor of kidman bean and soybean[J]. Journal of the Chinese Cereals and Oils Association,2022,37(1):164−169.] doi: 10.3969/j.issn.1003-0174.2022.01.025 LI Z F, ZHANG Y, WANG Y, et al. Optimization and antioxidation of compound fermentation liquor of kidman bean and soybean[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(1): 164−169. doi: 10.3969/j.issn.1003-0174.2022.01.025
[20] 唐思煜, 翁云丹, 毛舸, 等. 添加蔗糖对裸燕麦酵素发酵过程中理化指标与活性成分变化的影响[J]. 食品工业科技,2019,40(15):78−83. [TANG S Y, WENG Y D, MAO K, et al. Effects of sucrose addition on the changes of physicochemical indexes and active components during oat Jiaosu fermentation[J]. Science and Technology of Food Industry,2019,40(15):78−83.] TANG S Y, WENG Y D, MAO K, et al. Effects of sucrose addition on the changes of physicochemical indexes and active components during oat Jiaosu fermentation[J]. Science and Technology of Food Industry, 2019, 40(15): 78−83.
[21] 杜晓仪, 杨继国, 徐玉娟, 等. 不同益生菌对三华李发酵果汁品质及其体外消化特性的影响[J]. 食品工业科技,2024,45(2):143−151. [DU X Y, YANG J G, XU Y J, et al. Effects of different probiotics on the quality and in vitro digestion characteristics of fermented Sanhua plum juice[J]. Science and Technology of Food Industry,2024,45(2):143−151.] DU X Y, YANG J G, XU Y J, et al. Effects of different probiotics on the quality and in vitro digestion characteristics of fermented Sanhua plum juice[J]. Science and Technology of Food Industry, 2024, 45(2): 143−151.
[22] 边名鸿, 袁天萌, 杨南, 等. 乳杆菌强化发酵对苦荞酵素抗氧化特性及风味的影响[J]. 食品工业科技,2024,45(2):118−125. [BIAN M H, YUAN T M, YANG N, et al. Effects of lactobacillus enhanced fermentation on the antioxidant characteristics and flavor of tartary buckwheat Jiaosu[J]. Science and Technology of Food Industry,2024,45(2):118−125.] BIAN M H, YUAN T M, YANG N, et al. Effects of lactobacillus enhanced fermentation on the antioxidant characteristics and flavor of tartary buckwheat Jiaosu[J]. Science and Technology of Food Industry, 2024, 45(2): 118−125.
[23] 罗心欣, 成雨阳, 王周利, 等. 益生菌发酵猕猴桃汁工艺优化及香气成分动态解析[J]. 食品科学,2019,40(12):168−175. [LUO X X, CHENG Y Y, WANG Z L, et al. Process optimization the development of fermented kiwifruit juice with probiotics and dynamic analysis of aroma composition[J]. Food Science,2019,40(12):168−175.] doi: 10.7506/spkx1002-6630-20180704-056 LUO X X, CHENG Y Y, WANG Z L, et al. Process optimization the development of fermented kiwifruit juice with probiotics and dynamic analysis of aroma composition[J]. Food Science, 2019, 40(12): 168−175. doi: 10.7506/spkx1002-6630-20180704-056
[24] de la FUENTE B, LUZ C, PUCHOL C, et al. Evaluation of fermentation assisted by Lactobacillus brevis POM, and Lactobacillus plantarum (TR-7, TR-71, TR-14) on antioxidant compounds and organic acids of an orange juice-milk based beverage[J]. Food Chemistry,2021,343:128414. doi: 10.1016/j.foodchem.2020.128414
[25] MARKKINEN N, LAAKSONEN O, NAHKU R, et al. Impact of lactic acid fermentation on acids, sugars, and phenolic compounds in black chokeberry and sea buckthorn juices[J]. Food Chemistry,2019,286:204−215. doi: 10.1016/j.foodchem.2019.01.189
[26] HUYNH N T, Van CAMP J, SMAGGHE G, et al. Improved release and metabolism of flavonoids by steered fermentation processes:A review[J]. Int J Mol Sci,2014,15(11):19369−19388. doi: 10.3390/ijms151119369
[27] 王迪, 王颖, 张艳莉, 等. 芸豆酵素发酵过程中组分及抗氧化功能研究[J]. 食品工业科技,2021,42(18):18−24. [WANG D, WANG Y, ZHANG Y L, et al. Components and antioxidant activity during the fermentation process of kidney bean Jiaosu[J]. Science and Technology of Food Industry,2021,42(18):18−24.] WANG D, WANG Y, ZHANG Y L, et al. Components and antioxidant activity during the fermentation process of kidney bean Jiaosu[J]. Science and Technology of Food Industry, 2021, 42(18): 18−24.
[28] ZHU Y, JIANG J, YUE Y, et al. Influence of mixed probiotics on the bioactive composition, antioxidant activity and appearance of fermented red bayberry pomace[J]. LWT-Food Science & Technology,2020,133:110076.
[29] 周佳悦, 夏晓雨, 候艳丽, 等. 不同发酵方式蓝莓果酒发酵过程中理化指标和抗氧化能力的动态变化[J]. 中国酿造,2023,42(5):132−138. [ZHOU J Y, XIA X Y, HOU Y L, et al. Dynamic changes of physiochemical indexes and antioxidant capacity of blueberry wine during fermentation with different fermentation methods[J]. China Brewing,2023,42(5):132−138.] ZHOU J Y, XIA X Y, HOU Y L, et al. Dynamic changes of physiochemical indexes and antioxidant capacity of blueberry wine during fermentation with different fermentation methods[J]. China Brewing, 2023, 42(5): 132−138.
[30] 李紫微, 曹庸, 苗建银. 大豆异黄酮及其苷元的研究进展[J]. 食品工业科技,2019,40(20):348−355. [LI Z W, CAO Y, MIAO J Y. Research progress of soybean isoflavones and their aglycones[J]. Science and Technology of Food Industry,2019,40(20): 348−355.
[31] SHI F, WANG L, LI S. Enhancement in the physicochemical properties, antioxidant activity, volatile compounds, and non-volatile compounds of watermelon juices through Lactobacillus plantarum JHT78 fermentation[J]. Food Chemistry,2023,420:136146. doi: 10.1016/j.foodchem.2023.136146
[32] VERON H E, GAUFFIN C P, FABERSANI E, et al. Cactus pear (Opuntia ficus-indica) juice fermented with autochthonous Lactobacillus plantarum S-811[J]. Food Function,2019,10(2):1085−1097. doi: 10.1039/C8FO01591K
[33] 王思溥, 朱丹, 牛广财, 等. 黑果腺肋花楸酵素自然发酵过程中主要成分与抗氧化活性变化[J]. 食品工业科技,2023,44(15):93−100. [WANG S B, ZHU D, NIU G C, et al. Changes of main components and antioxidant activity of black chokeberry Jiaosu in natural fermentation[J]. Science and Technology of Food Industry,2023,44(15):93−100.] WANG S B, ZHU D, NIU G C, et al. Changes of main components and antioxidant activity of black chokeberry Jiaosu in natural fermentation[J]. Science and Technology of Food Industry, 2023, 44(15): 93−100.
[34] 刘秀娟, 李庆鹏, 崔龙, 等. 混菌发酵苹果酵素工艺研究[J]. 食品安全质量检测学报,2022,13(1):190−198. [LIU X J, LI Q P, CUI L, et al. Study on the process of mixed fermented apple Jiaosu[J]. Journal of Food Safety and Quality,2022,13(1):190−198.] doi: 10.3969/j.issn.2095-0381.2022.1.spaqzljcjs202201026 LIU X J, LI Q P, CUI L, et al. Study on the process of mixed fermented apple Jiaosu[J]. Journal of Food Safety and Quality, 2022, 13(1): 190−198. doi: 10.3969/j.issn.2095-0381.2022.1.spaqzljcjs202201026
[35] WANG J, WEI B, XU J, et al. Influence of lactic acid fermentation on the phenolic profile, antioxidant activities, and volatile compounds of black chokeberry (Aronia melanocarpa) juice[J]. J Food Sci,2024,89(2):834−850. doi: 10.1111/1750-3841.16899
[36] 陈惠敏, 吴晓平, 汪少芸. 黑豆粕饮料发酵工艺的优化及其抗氧化活性评价[J]. 食品工业科技,2023,44(5):129−138. [CHEN H M, WU X P, WANG S Y. Optimization of fermentation technology and evaluation of antioxidant activity of black soybean meal beverage[J]. Science and Technology of Food Industry,2023,44(5):129−138.] CHEN H M, WU X P, WANG S Y. Optimization of fermentation technology and evaluation of antioxidant activity of black soybean meal beverage[J]. Science and Technology of Food Industry, 2023, 44(5): 129−138.
[37] FLOEGEL A, KIM D, CHUNG S, et al. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods[J]. Journal of Food Composition and Analysis,2011,24(7):1043−1048. doi: 10.1016/j.jfca.2011.01.008
[38] WANG Z, TONG Y, TONG Q, et al. Effects of different lactic acid bacteria on phenolic profiles, antioxidant capacities, and volatile compounds in purple sweet potato juice[J]. Journal of Food Science and Technology,2024,61(9):1800−1810. doi: 10.1007/s13197-024-05959-5
[39] 唐双庆, 鲁慧琪, 李秀丽, 等. 枯草芽孢杆菌发酵对豆类中酚类物质及抗氧化活性的影响[J]. 中国食品学报,2024,24(1):291−300. [TANG S Q, LU H Q, LI X L, et al. Effects of Bacillus subtilis fermentation on phenolic compounds and antioxidant activity in legumes[J]. Journal of Chinese Institute of Food Science and Technology,2024,24(1):291−300.] TANG S Q, LU H Q, LI X L, et al. Effects of Bacillus subtilis fermentation on phenolic compounds and antioxidant activity in legumes[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(1): 291−300.





 下载:
下载:
 下载:
下载:



