Effects of Whey Protein Concentrate on the Bioaccessibility and Microstructure of 5-Methyltetrahydrocalcium Folate in Simulated Digestive Environment in Vitro
-
摘要: 生物可及性是5-甲基四氢叶酸钙(5-methyltetrahydrocalcium folate,5-MTHF)发挥生物功能的前提,易受到食品组分的影响。该文以乳清浓缩蛋白(whey protein concentrate,WPC)和5-MTHF为研究对象,利用体外消化系统,探究WPC在不同条件下(浓度、加工方式、胃肠pH、消化时间)对5-MTHF生物可及性的影响,并采用胶体粒径电位仪与激光共聚焦观察消化前后粒子微观结构的变化。结果表明,在胃消化阶段,WPC可将5-MTHF紧密包裹,较好地保护了5-MTHF,并成功转运至肠消化阶段完成释放,提高了5-MTHF的生物可及性。同时,WPC浓度、WPC加工方式、胃肠pH、消化时间等均不同程度影响5-MTHF的生物可及性和粒径、电位。其中,在胃消化阶段,各WPC-5-MTHF组均未检测出5-MTHF,生物可及性为0。在肠消化阶段,WPC-5-MTHF组的生物可及性随WPC浓度的增加而提高,较5-MTHF组的生物可及性提高了11.1%~19.61%;超声处理组、高压均质组、加热处理组的生物可及性较未加工处理组分别减少了8.49%、9.52%、8.75%;在肠pH为7、消化时间为5 h时,WPC-5-MTHF组拥有最佳生物可及性,分别为45.17%、42.32%,与5-MTHF组相比,提高到2倍左右。粒径和电位的结果显示,WPC-5-MTHF组较WPC拥有更小的粒径,更大的电位绝对值,并且WPC-5-MTHF结构的变化会引起消化特性的改变,该研究为5-甲基四氢叶酸钙在乳制品中的应用提供理论指导。Abstract: Bioaccessibility is a prerequisite for 5-methyltetrahydrocalcium folate (5-MTHF) to perform their health functions and is susceptible to the influence of food components. Through in vitro simulated digestion, the effects of whey protein concentrate (WPC) on the bioaccessibility of 5-MTHF under various circumstances (concentration, processing technique, gastrointestinal pH, and digesting duration) were examined. The changes of particle microstructure before and after digestion were observed by colloid particle size potentiometer and laser confocal. According to the findings, 5-MTHF could be securely wrapped, shielded by WPC throughout the stomach stage of digestion, and then moved to the small intestine for full release. Additionally, during the digestive process, the bioaccessibility of WPC-5-MTHF tended to rise in all groups. In the meanwhile, several factors such as WPC concentration, WPC processing technique, gastrointestinal pH, and digestion duration had varied effects on the bioaccessibility of 5-MTHF as well as the particle size and potential of WPC-5-MTHF during the digestive process. Among them, the bioaccessibility was 0 and no 5-MTHF was found in any WPC-5-MTHF group throughout the stomach digesting stage. When compared to the 5-MTHF group, the bioaccessibility of the WPC-5-MTHF group improved by 11.1% to 19.61% during the intestinal digestion stage, exhibiting a positive connection trend with the WPC concentration. When compared to the unprocessed treatment group, the bioaccessibility of the ultrasonic, high pressure homogenization groups was reduced by 8.49%, 9.52%, and 8.75%, respectively. At an intestinal pH of 7 and a digestion time of 5 hours, the WPC-5-MTHF group displayed the best bioaccessibility, which was twice as high as that of the 5-MTHF group, at 45.17% and 42.32%, respectively. The results of particle size and zeta potential showed that the WPC-5-MTHF group had smaller particle size, larger absolute value of zeta potential, and the structural changes of WPC-5-MTHF would cause changes in digestibility characteristics. Theoretical support for the use of 5-methyltetrahydrofolate calcium in dairy products is provided by this work.
-
叶酸是人体必需的水溶性维生素,参与核酸合成、氨基酸转化及细胞分化等[1]。目前合成叶酸是主要的叶酸补充剂[2],但合成叶酸缺乏辅酶活性,必须还原为5-甲基四氢叶酸才能被吸收利用,故其应用存在局限性[3−5]。5-甲基四氢叶酸钙是5-甲基四氢叶酸的新型钙盐形式,呈黄色粉末状,分子量为497.5,具有较高的稳定性,且无需叶酸还原酶转化,可直接被吸收利用。该专利产品作为新型叶酸补充剂,已允许应用于调制乳粉和固体饮料[6],推测未来会广泛应用于更多乳制品及其他食品。目前,国内外对5-甲基四氢叶酸钙的研究主要集中于合成方法、含量检测及疾病预防等[7−10],在食品应用方面的研究甚少,有关食品组分对5-甲基四氢叶酸钙消化特性及生物可及性的影响并不明确。
乳清蛋白是牛乳的主要成分,主要包括β-乳球蛋白(35%~65%)、α-乳白蛋白(12%~25%)、免疫球蛋白(8%)、牛血清白蛋白(5%)及乳铁蛋白(1%),分子量分别为18.3、14.2、150、66.4、80 kDa。其具有较高的营养价值和良好的功能特性,经常作为优质蛋白添加于各种乳制品。乳清蛋白因含有多个结合位点,可与多酚、多糖、维生素等多种食品功能因子相互作用,影响其水溶性、抗氧化性及消化特性[11−13]。已有研究表明,乳清蛋白可改善合成叶酸的稳定性和消化特性,提高其生物可及性[14−16],推测5-甲基四氢叶酸钙作为一种新型叶酸补充剂添加于乳制品,其消化特性也会受到乳清蛋白等食品基质的影响。
生物可及性是衡量营养物质消化特性的重要指标,主要指营养物质从基质释放到胃肠液中的量与总量的比值,很大程度上决定后续的肠道吸收程度。利用体外消化模型探究生物可及性具有简单易行、成本低、可实时监控等优点,是监测营养物质胃肠消化的常用手段。基于此,本研究利用体外消化模型,探究乳清蛋白在不同条件下(浓度、加工方式、消化pH、消化时间)对5-甲基四氢叶酸钙的粒径、电位、生物可及性及微观结构的影响,以期揭示5-甲基四氢叶酸钙作为补充剂添加到乳制品中时,乳清蛋白对其消化阶段产生的影响,为5-甲基四氢叶酸钙在乳制品中的应用提供基础理论支撑。
1. 材料与方法
1.1 材料与仪器
乳清浓缩蛋白(WPC 80,蛋白含量为77%)、5-甲基四氢叶酸钙(纯度>97%) 雅培公司提供;5-甲基四氢叶酸标准品 纯度>98%,Sigma公司;甲酸(色谱纯)、乙腈(色谱纯)、α-唾液淀粉酶(1:4000)、胃蛋白酶(1:10000)、胰蛋白酶(1:4000)、猪胆盐 北京索莱宝科技有限公司。
1260Ⅱ型半制备高效液相色谱仪 美国安捷伦公司;Mastersizer 2000激光粒度仪 英国马尔文帕纳科技有限公司;FV3000激光共聚焦显微镜 日本奥林巴斯公司。
1.2 实验方法
1.2.1 溶液的配制
a.乳清浓缩蛋白(whey protein concentrate,WPC)溶液的制备。准确称取WPC粉末,溶于0.01 mol/L,pH7.0的磷酸盐缓冲液(PBS)中,在室温条件下涡旋2 h,使其充分溶解,置于4 ℃冰箱过夜。
b.5-甲基四氢叶酸钙(5-methyltetrahydrocalcium folate,5-MTHF)溶液的制备。称取0.0027 g的5-MTHF粉末,溶于0.01 mol/L,pH7.0的PBS中,使其终浓度为0.27 μg/mL。室温下磁力搅拌至充分溶解,制备过程完全避光。
c.乳清浓缩蛋白与5-甲基四氢叶酸钙混合溶液的制备(WPC-5-MTHF)。分别取WPC溶液与5-MTHF溶液按照试验所需比例混合,在室温下磁力搅拌0.5 h后,4 ℃下保存24 h,配制过程完全避光。
1.2.2 体外消化模拟
体外消化模型与模拟消化液的配制参照Minekus等[17]的体外模拟方法。建立胃液、肠液模拟体系。模拟胃液(simulated gastric fluid,SGF)、模拟肠液(simulated intestinal fluid,SIF)由相应的电解质原液、酶和水组成,其中电解质原液具体配制见表1。
表 1 SGF、SIF电解液的配制Table 1. Configuration of SGF and SIF electrolyte组成 浓度(mol/L) SGF电解液 SIF电解液 pH1.5 pH7 体积
(mL)终浓度(mmol/L) 体积
(mL)终浓度(mmol/L) KCl 0.5 6.9 6.9 6.8 6.8 KH2PO4 0.5 0.9 0.9 0.8 0.8 NaHCO3 1 12.5 25 42.5 85 NaCl 2 11.8 47.2 9.6 38.4 MgCl2·6H2O 0.15 0.4 0.1 1.1 0.33 (NH4)2CO3 0.5 0.5 0.5 − − HCl 6 1.3 15.6 0.7 8.4 蒸馏水 − 定容至
500 mL− 定容至
500 mL− 1.2.2.1 胃消化模拟
取配制好的WPC、5-MTHF、WPC-5-MTHF溶液10 mL与模拟胃液按体积比为1:1的比例混合,用1 mol/L HCl调节混合液的pH。而后向混合液中加入胃蛋白酶,使其最终浓度为2000 U/mL,然后将其置于37 ℃、85 r/min的恒温培养箱消化120 min,然后冰水浴10 min,备用。
1.2.2.2 肠消化模拟
取各组经胃消化后的溶液10 mL与模拟肠液按体积比为1:1的比例混合,用1 mol/L NaOH调节混合液的pH。而后向混合液中加入胰酶和胆汁,使得胰酶的最终浓度为100 U/mL,胆汁的最终浓度为0.16 mol/L,然后将其置于37 ℃、85 r/min的恒温培养箱消化120 min,然后冰水浴10 min,备用。
以上各消化阶段所取的样品待测液在4 ℃条件下,12000 r/min离心20 min,收集上清液,于−80 ℃冰箱中保存,用于后续指标测定。
1.2.3 单因素实验
1.2.3.1 不同浓度的WPC对5-MTHF消化特性的影响
WPC浓度分别设为0.5、1、2、3、4 g/100 mL,5-MTHF浓度为0.27 μg/mL。将WPC、5-MTHF、WPC-5-MTHF按照1.2.2进行体外消化模拟后,测定生物可及性、粒径、电位。
1.2.3.2 不同加工方式的WPC对5-MTHF消化特性的影响
WPC(3 g/100 mL)分别进行热处理(60 ℃,30 min)、高压均质处理(100 MPa,均质3次)、超声波处理(300 W,15 min),同时设定未处理WPC作为对照组,5-MTHF浓度为0.27 μg/mL。将WPC、5-MTHF、WPC-5-MTHF按照1.2.2进行体外消化模拟后,测定生物可及性、粒径、电位。
1.2.3.3 不同胃消化时间下WPC对5-MTHF消化特性的影响
WPC、5-MTHF浓度分别设为3 g/100 mL、0.27 μg/mL。将WPC、5-MTHF、WPC-5-MTHF按照1.2.2进行体外消化模拟,分别在胃消化时间为0.5、1、1.5、2、2.5 h取样,测定生物可及性、粒径、电位。
1.2.3.4 不同肠消化时间下WPC对5-MTHF消化特性的影响
WPC、5-MTHF浓度分别设为3 g/100 mL、0.27 μg/mL。将WPC、5-MTHF、WPC-5-MTHF按照1.2.2进行体外消化模拟,分别在肠消化时间为1、2、3、4、5 h取样,测定生物可及性、粒径、电位。
1.2.3.5 不同胃pH下WPC对5-MTHF消化特性的影响
胃pH分别设为1.5、2、2.5、3、4;WPC、5-MTHF浓度分别设为3 g/100 mL、0.27 μg/mL。将WPC、5-MTHF、WPC-5-MTHF按照1.2.2进行体外消化模拟后,测定生物可及性、粒径、电位。
1.2.3.6 不同肠pH下WPC对5-MTHF消化特性的影响
肠pH分别设为6、6.5、7、7.5、8;WPC、5-MTHF浓度分别设为3 g/100 mL与0.27 μg/mL。将WPC、5-MTHF、WPC-5-MTHF按照1.2.2进行体外消化模拟后,测定生物可及性、粒径、电位。
1.2.4 生物可及性的测定
经体外消化后的样品,12000 r/min离心20 min,收集上清液,通过0.22 μm的滤膜,然后利用高效液相色谱测定上清液中5-MTHF含量,并计算生物可及性,计算公式如下:
W(%)=CsCt×100 式中:W表示5-MTHF生物可及性,%;Cs表示上清液中游离的5-MTHF含量,µg/mL;Ct:体系中添加的5-MTHF总含量,µg/mL。
高效液相色谱检测MTHF含量条件参考Herbig等[18]方法,具体条件如下:
仪器:半制备高效液相色谱仪 1260II;色谱柱:supersil AQ-C18色谱柱(4.6 mm×250 mm,5 μm);进样量:20 μL;流速:0.8 mL/min;流动相:甲醇:甲酸水=10:90;进样温度:30 ℃;荧光激发波长:295 nm;发射波长:356 nm。
1.2.5 粒径、Zeta电位的测定
将模拟消化后的样品上清液稀释100倍,用粒度电位分析仪的粒度测定模式进行粒径测定,设定扫描次数50次,单次扫描时间10 s,测量最终结果3次;用粒度电位分析仪的Zeta电位测定模式进行Zeta电位测定,设定扫描次数100次,测量最终结果3次。
1.2.6 激光共聚焦的观察
参考Zema等[19]的方法,利用激光共聚焦扫描显微镜观察5-MTHF、WPC、WPC-5-MTHF体外消化前后样品的图像,图片使用Fluo View图像采集软件(奥林巴斯)获取1024×1024的tif格式。其中,WPC浓度为3 g/100 mL,5-MTHF浓度为0.27 μg/mL;胃消化2 h,pH为1.5;肠消化2 h,pH为7。
1.3 数据处理
本研究对3次平行实验数据进行取平均值处理。数据处理采用Statistics 8.0的单因素方差分析,以P<0.05表示数据存在显著差异,采用Origin 2018软件对图表进行绘制。
2. 结果与分析
2.1 不同浓度的WPC对5-MTHF生物可及性以及粒径、电位的影响
2.1.1 不同浓度的WPC对5-MTHF生物可及性的影响
不同浓度的WPC对5-MTHF生物可及性的影响见图1,在胃消化阶段,不同浓度下的WPC-5-MTHF组生物可及性为0;在肠消化阶段5-MTHF的生物可及性与蛋白浓度(0.5~4 g/100 mL)呈现正相关,在蛋白浓度为4 g/100 mL时,5-MTHF的生物可及性达到最大,可达39.71%。分析原因可能是在胃消化阶段WPC将5-MTHF包裹,因WPC具有较好的抗胃蛋白酶水解能力,导致5-MTHF未被释放,在胃中未检测到5-MTHF。而在肠消化过程中WPC-5-MTHF被胰蛋白酶水解,5-MTHF得以释放[20]。
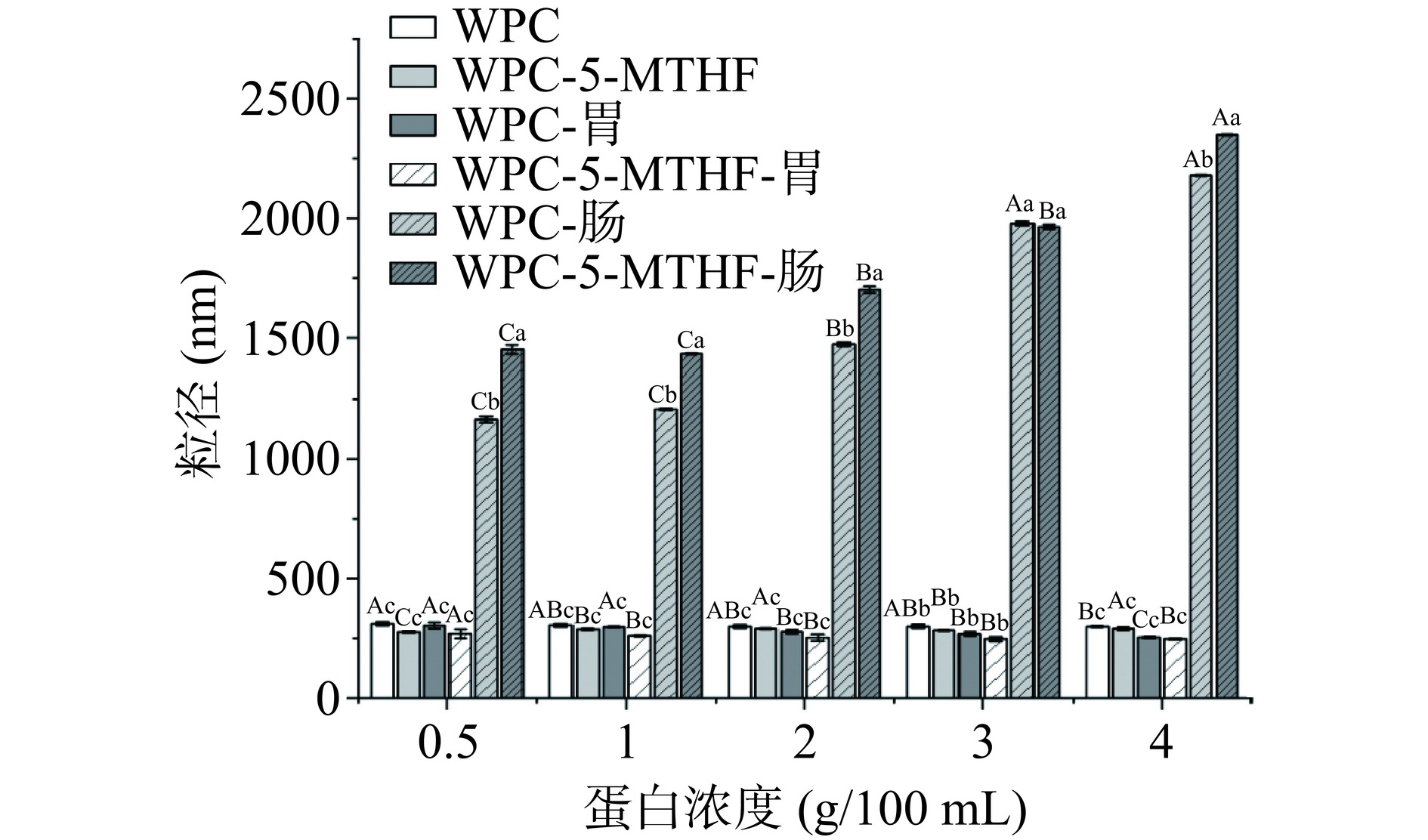
2.1.2 不同浓度的WPC对5-MTHF粒径的影响
由图2可知,各组经过胃消化后粒径变小,与Borreani等[21]、Liu等[22]所观察到的结果一致。原因是WPC中牛血清白蛋白等难以抵抗胃蛋白酶的水解,在消化过程中易降解为小分子物质[23]。而WPC与5-MTHF结合后构象发生改变,部分水解位点难以被靠近,WPC-5-MTHF结构更加紧密[23],致使WPC-5-MTHF在胃消化阶段的粒径减小且小于WPC。肠消化后二者粒径均变大,WPC-5-MTHF的粒径始终大于WPC,且与WPC浓度呈正相关。这是由于胰蛋白酶促进了粒子之间的聚集及胆盐等物质附着在蛋白表面[24]。有研究发现与叶酸结合的β-乳球蛋白比单一β-乳球蛋白更易被胰蛋白酶水解[23]。所以推测与WPC结合后的5-MTHF更易被水解释放,进而提高5-MTHF的生物可及性。
2.1.3 不同浓度的WPC对5-MTHF电位的影响
由表2可知,WPC-5-MTHF组在消化前后的电位绝对值始终高于WPC组,且与蛋白浓度呈现正相关的趋势。WPC和5-MTHF结合可能会诱导蛋白质分子构象的改变,电泳迁移率发生细微变化,从而导致Zeta电位绝对值增大[15]。经过胃消化后,WPC-5-MTHF组电位由负值转为正值,这是由于进入胃环境pH为1.5小于WPC等电点(pI≈4.6)所致。在肠消化期间,WPC-5-MTHF组电位绝对值随蛋白浓度的升高而增加,推测是因有更多带有负电的胰酶、胆盐附着[25],这也导致了WPC-5-MTHF更易被水解,从而释放更多带负电的5-MTHF。
表 2 不同浓度的WPC对5-MTHF电位的影响Table 2. Effects of different concentrations of WPC on the potential of 5-MTHF浓度(g/100 mL) 初始 胃消化 肠消化 WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) 0.5 −27.29±0.55Ab −25.6±0.58Aa 15.7±10.7Ca 10.18±2.14Cb −35.78±0.63Ab −29.0±0.75Aa 1 −28.15±1.24Ab −26.6±1.57Aa 24.6±0.57Ba 19.33±1.20Ab −36.07±0.87Ab −30.1±0.4ABa 2 −30.16±0.28Ba −29.0±1.31Ba 24.8±1.13Ba 19.47±2.05Ab −37.81±1.06Bb −31.2±0.31Ba 3 −32.28±1.01Ca −31.4±1.29Ca 27.0±1.20Aa 17.1±0.75Bb −37.93±0.65Bb −31.7±0.58Ba 4 −33.1±1.07Ca −32.4±1.30Ca 26.7±0.69Aa 16.9±1.45Bb −38.31±0.13Bb −32.01±0.6Ba 注:不同大写字母代表同组在不同蛋白浓度下差异显著(P<0.05),不同小写字母代表不同组在同一蛋白浓度下差异显著(P<0.05)。 2.2 不同加工方式的WPC对5-MTHF生物可及性以及粒径、电位的影响
2.2.1 不同加工方式的WPC对5-MTHF生物可及性的影响
不同加工方式的WPC对5-MTHF生物可及性的影响见图3。各WPC-5-MTHF组在胃消化阶段,均未释放出5-MTHF,使其5-MTHF的生物可及性为0;而在肠消化阶段三个处理组的生物可及性均显著小于未处理组且大于5-MTHF组(P<0.05),但三个处理组之间差异不显著(P>0.05),这表明各WPC-5-MTHF组中的WPC都会对5-MTHF有较好的保护作用。在肠消化阶段,各WPC-5-MTHF组均因WPC被胰蛋白酶水解而使5-MTHF释放,提高了生物可及性。但三个处理组可能由于改性后蛋白的消化率提高,导致5-MTHF被提早释放到消化环境中而部分被降解[26],致使其生物可及性低于未处理组。
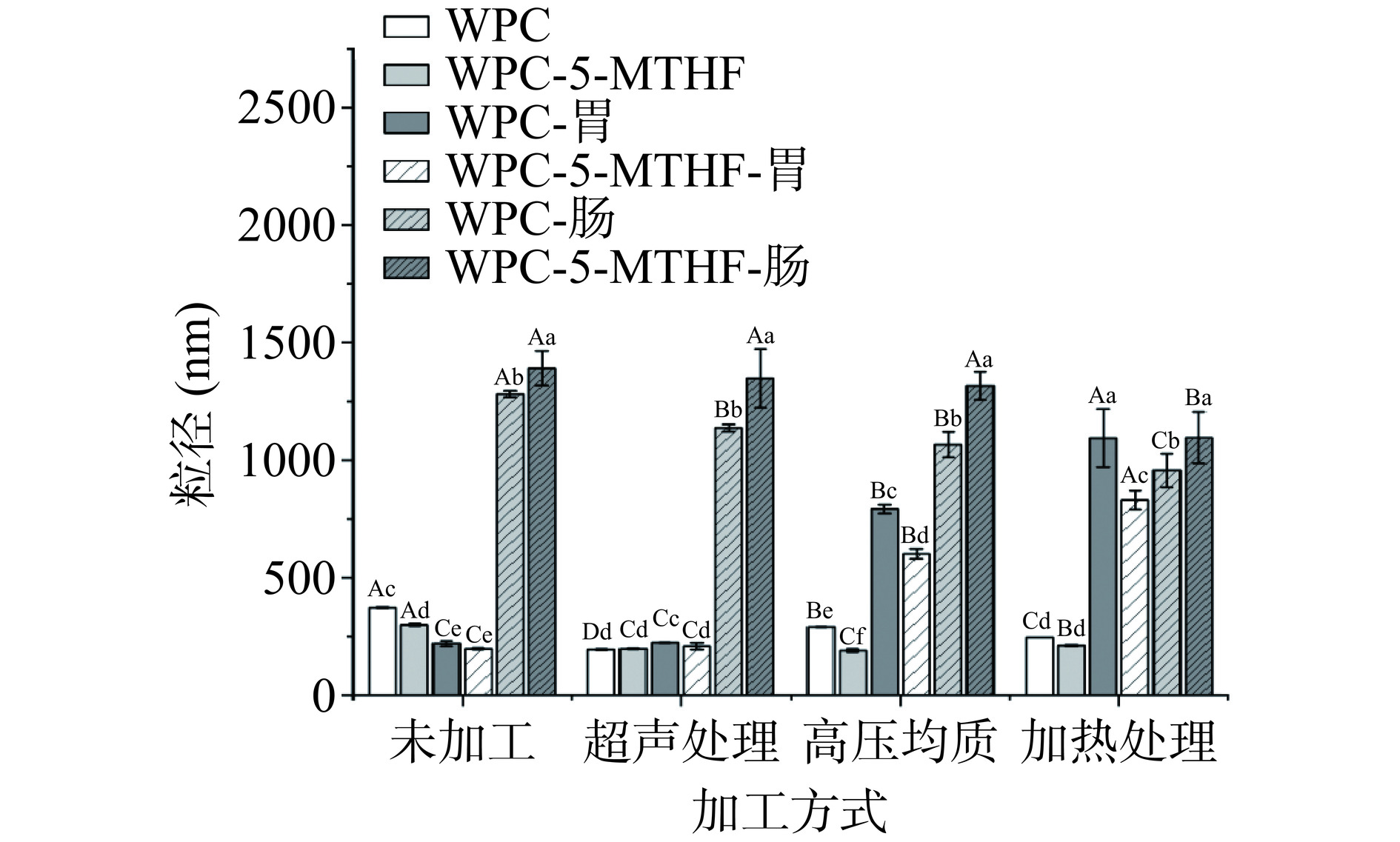
2.2.2 不同加工方式的WPC对5-MTHF粒径的影响
由图4可以看出,消化前WPC-5-MTHF组粒径均小于WPC组。经超声处理、高压均质、加热处理的WPC-5-MTHF组粒径相较于未处理组的粒径显著降低(P<0.05),这是由于蛋白经处理后,二级结构发生改变,粒径减小[27−30]。高压均质、加热处理的WPC-5-MTHF组经胃消化后,粒径显著大于未处理与超声处理组(P<0.05),推测是高压均质、加热处理后的体系表面疏水性增加,改变了蛋白消化过程中的水解度[31],使其更易被水解而发生聚集所致。在肠消化阶段,加热处理组粒径显著低于其他WPC-5-MTHF组(P<0.05)。加热处理后疏水基团大量暴露,可能会导致胰蛋白酶、胆汁盐的结合位点增加,WPC被快速水解为小分子[32],导致粒径减小,同时5-MTHF被提前释放到消化环境中,由此导致生物可及性较低。
2.2.3 不同加工方式的WPC对5-MTHF电位的影响
由表3所示,消化前后的三个处理组电位绝对值均大于未处理组,与张思雨等[30]、刘培玲等[33]、Zhao等[34]的研究结果一致,这是由于经过处理后的蛋白电荷发生重排,更多的负电荷暴露出来。经过胃消化后电位由负值转为正值;在肠消化阶段,三个处理组的WPC-5-MTHF、WPC的电位绝对值均大于未经处理组,推测WPC经过处理后更易被水解出带负电小分子所致。
表 3 不同加工方式的WPC对5-MTHF电位的影响Table 3. Effects of WPC with different processing methods on the potential of 5-MTHF加工方式 初始 胃消化 肠消化 WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) 未经处理 −34.7±1.1Ab −30.73±0.90Aa 13.3±0.55Ca 12.01±0.56Cb −30.46±0.31Ab −29.52±0.18Aa 超声处理 −37.1±1.1Cb −34.77±0.21Da 17.05±1.13Aa 15.06±0.74Ab −31.43±0.59Bb −30.47±0.56Ba 高压均质 −36.4±1.2Bb −33.93±0.85Ca 14.38±1.05Ba 13.67±0.59Ba −31.5±0.34Ba −31.15±0.66Ca 加热处理 −34.9±1.5Ab −32.1±1.01Ba 14.01±0.19Ba 12.4±0.50BCb −31.68±0.74Bb −30.29±0.93Ba 注:不同大写字母代表同组在不同蛋白加工方式下差异显著(P<0.05),不同小写字母代表不同组在同一蛋白加工方式下差异显著(P<0.05)。 2.3 不同胃、肠消化时间下WPC对5-MTHF生物可及性以及粒径、电位的影响
2.3.1 不同胃、肠消化时间下WPC对5-MTHF生物可及性的影响
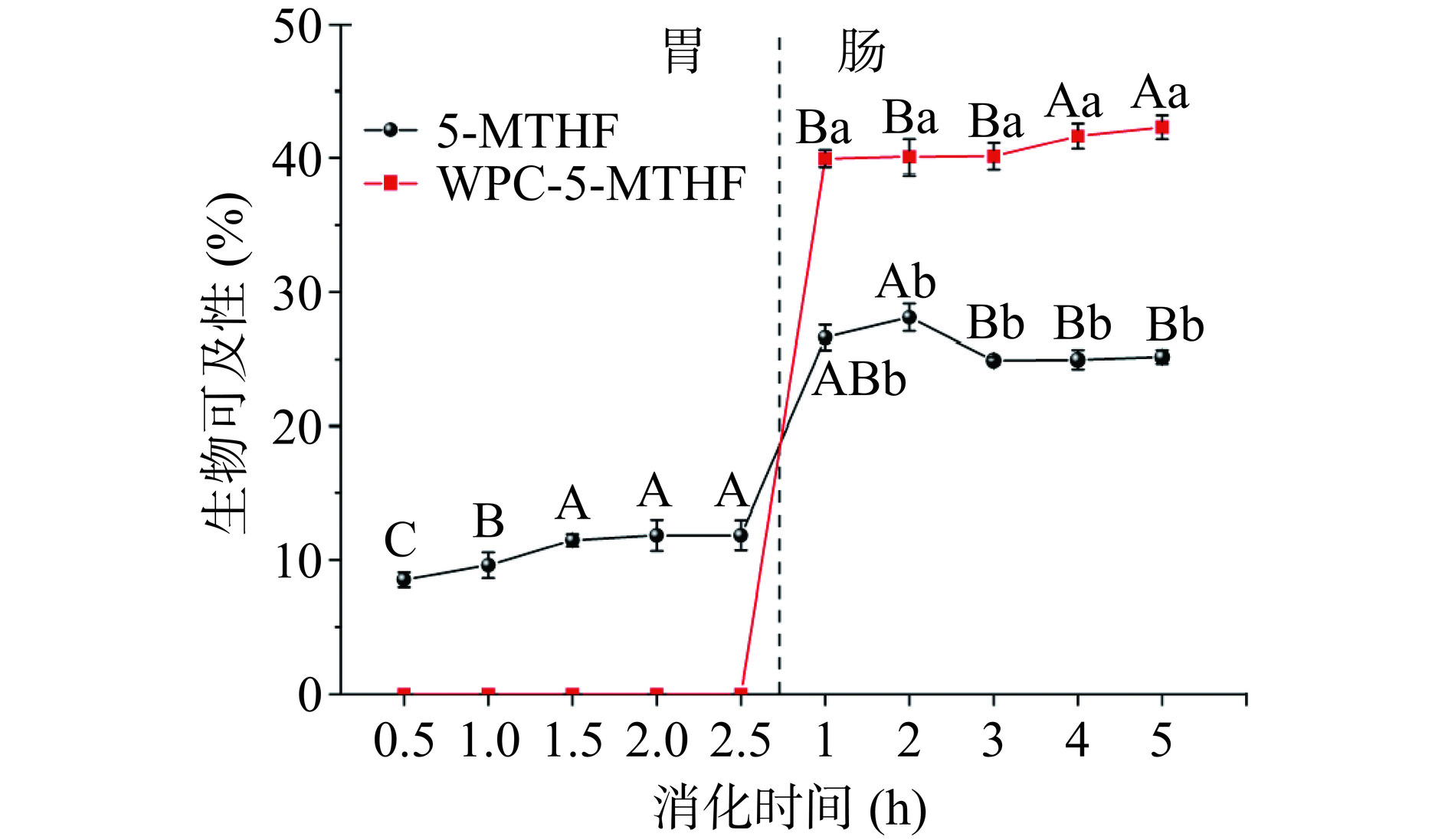
不同胃肠消化时间下WPC对5-MTHF生物可及性的影响见图5。在胃消化阶段,WPC-5-MTHF组未检测到5-MTHF释放,5-MTHF的生物可及性为0。在肠消化阶段,随着消化时间的延长,WPC-5-MTHF组的生物可及性不断升高,可能是在肠消化过程中WPC持续被胰酶水解,从而将包裹住的5-MTHF不断释放出来。在肠消化时间为5.0 h时,WPC-5-MTHF组的生物可及性最高为42.32%,与5-MTHF组相比,可将5-MTHF的生物可及性提高到近2倍。
2.3.2 不同胃、肠消化时间下WPC对5-MTHF粒径的影响
由图6可知,在胃消化时间为0.5 h时,WPC-5-MTHF组粒径显著减小(P<0.05)。但随着时间的延长,粒径大小趋于平稳。这是由于WPC在胃消化30 min后,牛血清白蛋白、α-乳白蛋白等蛋白被完全水解,粒径减小[35]。在肠消化时间1~4 h内,WPC-5-MTHF组粒径随消化时间的延长而显著增大(P<0.05),推测此时不断有胆盐、胰酶等物质附着在蛋白表面所致,且与5-MTHF结合后的WPC更易与消化酶结合,由此导致WPC-5-MTHF组的粒径始终大于WPC组。在肠消化时间为5 h时,粒径减小。可能是蛋白开始被大量水解,此时的5-MTHF可能得到完整的释放。
2.3.3 不同胃、肠消化时间下WPC对5-MTHF电位的影响
表4可见,在胃消化期间,WPC-5-MTHF组较WPC组具有更大的电位绝对值,0.5 h后随着胃消化时间的延长,各组电位值不发生显著变化。在肠消化过程中WPC-5-MTHF组的电位绝对值始终大于WPC,且随着时间的延长,Zeta电位的绝对值不断增大,可能是蛋白不断水解出带负电的小分子所致。随着蛋白的不断水解,5-MTHF不断被释放,进而提高其生物可及性。
表 4 不同胃肠消化时间下WPC对5-MTHF电位的影响Table 4. Effects of WPC on the potential of 5-MTHF under different gastrointestinal digestion times胃消化时间(h) WPC-5-MTHF(mV) WPC(mV) 肠消化时间(h) WPC-5-MTHF(mV) WPC(mV) 初始 −30.19±0.91Cb −28.47±0.63Ba 0.5 20.68±0.86ABa 18.14±0.62Ab 1 −25.72±0.84Aa −25.55±0.47Aa 1 20.34±0.73Ba 18.12±0.47Ab 2 −27.43±0.20Ba −26.75±0.68Ba 1.5 21.28±0.59Aa 18.47±0.63Ab 3 −27.68±0.59Ba −27.0±0.41Ba 2 20.15±0.55Ba 17.62±0.76Ab 4 −27.73±0.47Ba −27.22±0.04Ba 2.5 20.08±0.38Ba 18.18±0.80Ab 5 −28.07±0.69Ba −27.29±0.50Ba 注:不同大写字母代表同组在不同消化时间下差异显著(P<0.05),不同小写字母代表不同组在同一消化时间下差异显著(P<0.05)。 2.4 不同胃、肠pH下WPC对5-MTHF生物可及性以及粒径、电位的影响
2.4.1 不同胃、肠pH下WPC对5-MTHF生物可及性的影响
不同胃肠pH下WPC对5-MTHF生物可及性的影响见图7。在胃消化阶段,WPC-5-MTHF组未检测到5-MTHF释放。5-MTHF组生物可及性随pH的增加不断增大,这可能是由于随着pH的增加,胃蛋白酶对5-MTHF的包裹减少所致[36]。在肠消化阶段,WPC-5-MTHF组的生物可及性显著大于5-MTHF组(P<0.05),且随着pH增大呈现先增大后减小的趋势。在pH为7时,WPC-5-MTHF组生物可及性达到最大,推测在此条件下胰蛋白酶拥有较好酶活性,对蛋白的水解率最大,5-MTHF达到最好的释放。
2.4.2 不同胃、肠pH下WPC对5-MTHF粒径的影响
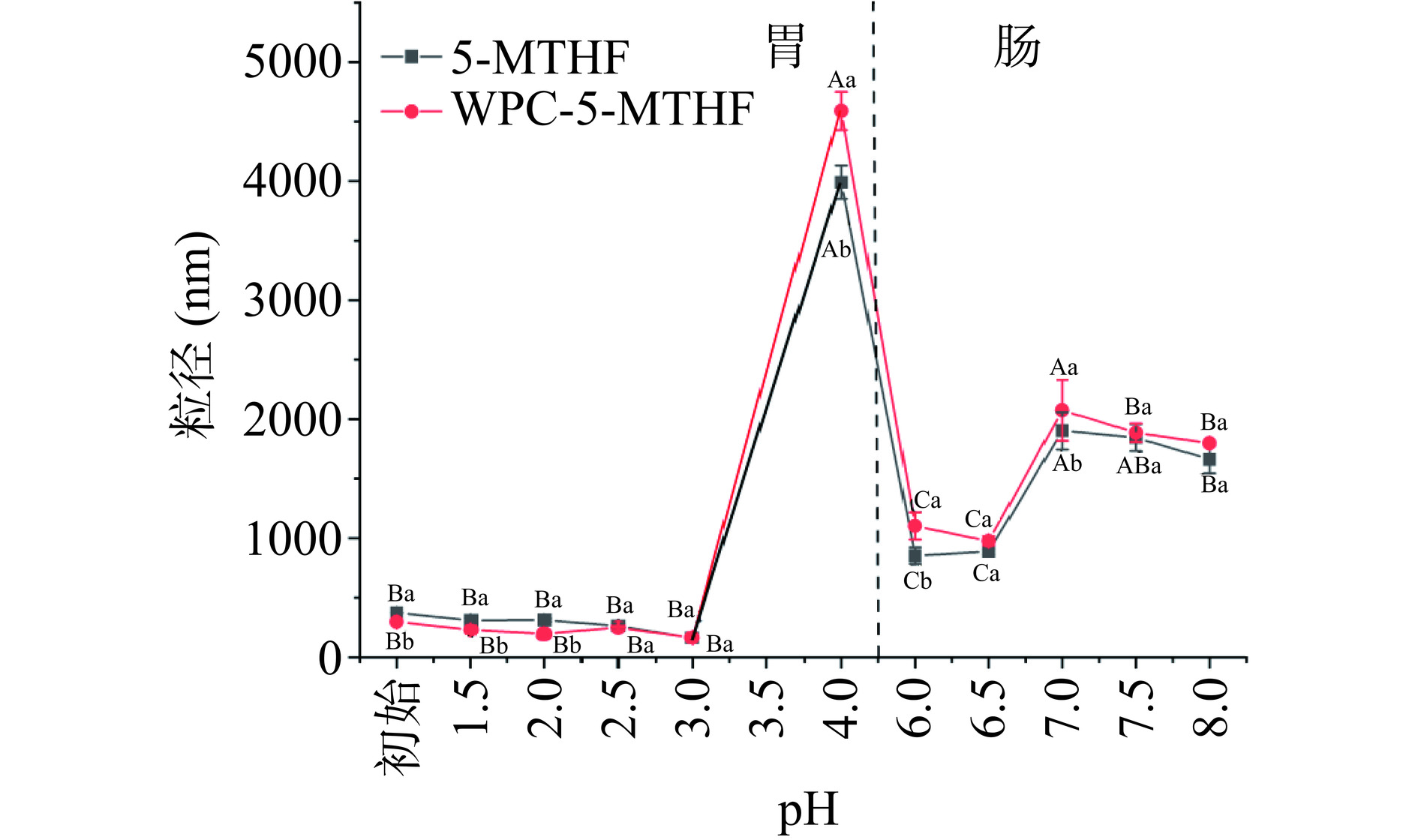
由图8所示,在胃pH为1.5~3时,WPC-5-MTHF组的粒径变化并不显著。在pH为4时,粒径剧增,是由于此时靠近WPC的等电点(pI≈4.6),溶解性最小,形成较大的颗粒团,导致粒径激增,同时与5-MTHF结合后的WPC结构发生变化,表面电荷数改变导致等电点偏移,由此WPC-5-MTHF组的粒径大于WPC组。肠消化阶段,WPC-5-MTHF组粒径呈现先增加后减小的趋势,在pH为7.0时有最大的粒径,推测此时胰蛋白酶有较好的活性,蛋白表面有更多的胰蛋白酶结合,同时与5-MTHF结合后的WPC会更易与消化酶结合,导致WPC-5-MTHF组的粒径大于WPC组。
2.4.3 不同胃、肠pH下WPC对5-MTHF电位的影响
表5可知,在胃消化阶段,随着pH增大,WPC-5-MTHF组、WPC组的电位绝对值不断降低,在pH为4时,WPC组的电位值接近于0,而WPC-5-MTHF组的电位值为-6.79 mV,这是由于与5-MTHF结合后WPC的结构发生改变,暴露在蛋白表面的电荷数也发生改变,进而改变了它的等电点[37]。在肠消化阶段,随着pH增大,电位绝对值不断增加,且WPC-5-MTHF组的电位绝对值始终大于WPC组,pH的改变可能会影响胰蛋白酶的活性,进一步影响WPC的水解程度,从而造成电位的差异。
表 5 不同胃肠pH下WPC对5-MTHF电位的影响Table 5. Effects of WPC on the potential of 5-MTHF at different gastrointestinal pH胃pH WPC-5-MTHF(mV) WPC(mV) 肠pH WPC-5-MTHF(mV) WPC(mV) 初始 −29.43±0.36Eb −26.01±0.66Ea 1.5 21.26±0.35Aa 20.16±0.92Aa 6 −25.78±0.64Ab −24.87±1.41Aa 2 18.49±0.49Ba 16.05±1.47Bb 6.5 −28.49±0.38Bb −26.93±0.24Ba 2.5 16.92±1.80Ba 14.23±1.18Bb 7 −29.26±0.40Cb −26.69±0.61Ba 3 8.93±0.57Ca 7.68±0.47Ca 7.5 −29.11±0.65Cb −26.64±1.32Ba 4 −6.79±0.82Db 1.04±0.58Da 8 −29.77±0.31Cb −27.9±0.62Ca 注:不同大写字母代表同组在不同胃肠pH下差异显著(P<0.05),不同小写字母代表不同组在同一胃肠pH下差异显著(P<0.05)。 2.5 激光共聚焦的观察
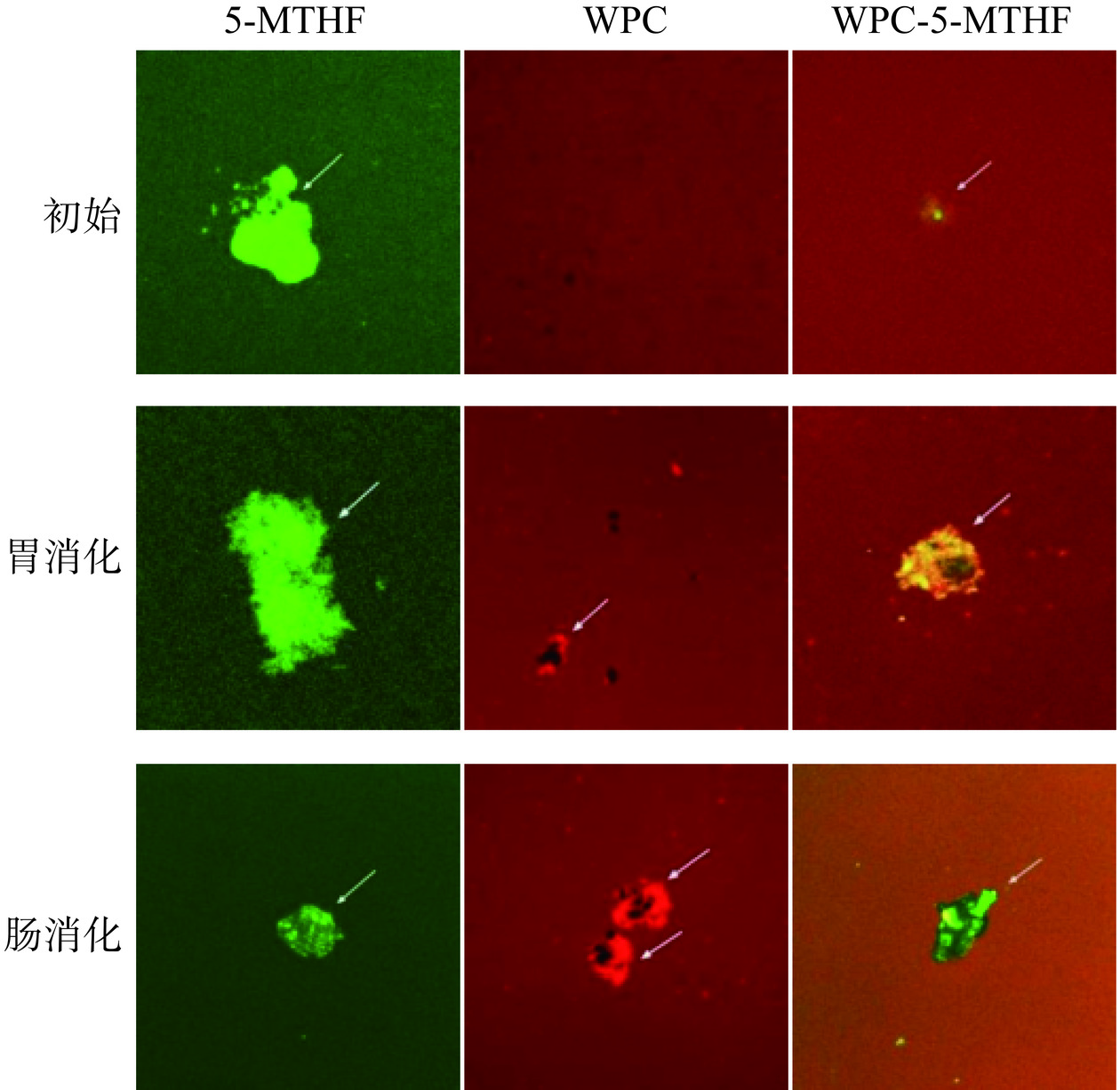
图9显示为5-MTHF、WPC、WPC-5-MTHF进行体外消化前后样品的图像,其中绿色荧光为叶酸,红色荧光为蛋白。在消化前,WPC组、WPC-5-MTHF组的分布较为均匀,未见聚集物出现。而5-MTHF组呈现较为紧密的聚集状态。在胃消化阶段,5-MTHF组结构较为松散,荧光强度减弱。而WPC-5-MTHF组的WPC对5-MTHF呈现紧密的“包裹”状态,几乎无5-MTHF释放,以此抵抗胃环境对5-MTHF的降解,使得5-MTHF在胃消化阶段的生物可及性几乎为0。到达肠消化阶段,在胆盐与胰蛋白酶的作用下,WPC-5-MTHF组、WPC组均有较大的聚集体形成,并且可见WPC-5-MTHF组绿色荧光较胃阶段明显增强,说明在胰蛋白酶的作用下,WPC被水解,5-MTHF被成功释放出来,由此提高5-MTHF的生物可及性;同时WPC-5-MTHF组的荧光强度明显大于5-MTHF组,说明WPC在消化期间对5-MTHF有较好的保护作用。
3. 结论
本研究通过体外消化模拟系统探究在不同浓度、加工方式、胃肠pH、胃肠消化时间条件下,WPC对5-MTHF生物可及性及其微观结构的影响。研究结果发现,WPC-5-MTHF组较WPC组拥有更小的粒径,更大的电位绝对值,表明WPC的构象发生改变,这进一步影响WPC-5-MTHF组中5-MTHF的释放。在胃消化阶段,由于WPC可将5-MTHF包裹,所以未检测到5-MTHF。在肠消化阶段,各WPC-5-MTHF组的生物可及性均显著高于5-MTHF组(P<0.05),其中,在WPC浓度为4 g/100 mL时,WPC-5-MTHF组的生物可及性较5-MTHF组提高到近两倍;经超声、高压均质、加热处理的WPC-5-MTHF组由于易被消化导致其生物可及性显著低于未处理组(P<0.05);在肠pH为7、消化时间为5 h时,WPC-5-MTHF组的生物可及性较5-MTHF组分别提高了27%、18%。该研究为5-MTHF作为食品强化剂应用于乳制品提供理论依据,有助于推动5-MTHF在食品中的广泛应用,拓展其市场潜力。
-
表 1 SGF、SIF电解液的配制
Table 1 Configuration of SGF and SIF electrolyte
组成 浓度(mol/L) SGF电解液 SIF电解液 pH1.5 pH7 体积
(mL)终浓度(mmol/L) 体积
(mL)终浓度(mmol/L) KCl 0.5 6.9 6.9 6.8 6.8 KH2PO4 0.5 0.9 0.9 0.8 0.8 NaHCO3 1 12.5 25 42.5 85 NaCl 2 11.8 47.2 9.6 38.4 MgCl2·6H2O 0.15 0.4 0.1 1.1 0.33 (NH4)2CO3 0.5 0.5 0.5 − − HCl 6 1.3 15.6 0.7 8.4 蒸馏水 − 定容至
500 mL− 定容至
500 mL− 表 2 不同浓度的WPC对5-MTHF电位的影响
Table 2 Effects of different concentrations of WPC on the potential of 5-MTHF
浓度(g/100 mL) 初始 胃消化 肠消化 WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) 0.5 −27.29±0.55Ab −25.6±0.58Aa 15.7±10.7Ca 10.18±2.14Cb −35.78±0.63Ab −29.0±0.75Aa 1 −28.15±1.24Ab −26.6±1.57Aa 24.6±0.57Ba 19.33±1.20Ab −36.07±0.87Ab −30.1±0.4ABa 2 −30.16±0.28Ba −29.0±1.31Ba 24.8±1.13Ba 19.47±2.05Ab −37.81±1.06Bb −31.2±0.31Ba 3 −32.28±1.01Ca −31.4±1.29Ca 27.0±1.20Aa 17.1±0.75Bb −37.93±0.65Bb −31.7±0.58Ba 4 −33.1±1.07Ca −32.4±1.30Ca 26.7±0.69Aa 16.9±1.45Bb −38.31±0.13Bb −32.01±0.6Ba 注:不同大写字母代表同组在不同蛋白浓度下差异显著(P<0.05),不同小写字母代表不同组在同一蛋白浓度下差异显著(P<0.05)。 表 3 不同加工方式的WPC对5-MTHF电位的影响
Table 3 Effects of WPC with different processing methods on the potential of 5-MTHF
加工方式 初始 胃消化 肠消化 WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) WPC-5-MTHF(mV) WPC(mV) 未经处理 −34.7±1.1Ab −30.73±0.90Aa 13.3±0.55Ca 12.01±0.56Cb −30.46±0.31Ab −29.52±0.18Aa 超声处理 −37.1±1.1Cb −34.77±0.21Da 17.05±1.13Aa 15.06±0.74Ab −31.43±0.59Bb −30.47±0.56Ba 高压均质 −36.4±1.2Bb −33.93±0.85Ca 14.38±1.05Ba 13.67±0.59Ba −31.5±0.34Ba −31.15±0.66Ca 加热处理 −34.9±1.5Ab −32.1±1.01Ba 14.01±0.19Ba 12.4±0.50BCb −31.68±0.74Bb −30.29±0.93Ba 注:不同大写字母代表同组在不同蛋白加工方式下差异显著(P<0.05),不同小写字母代表不同组在同一蛋白加工方式下差异显著(P<0.05)。 表 4 不同胃肠消化时间下WPC对5-MTHF电位的影响
Table 4 Effects of WPC on the potential of 5-MTHF under different gastrointestinal digestion times
胃消化时间(h) WPC-5-MTHF(mV) WPC(mV) 肠消化时间(h) WPC-5-MTHF(mV) WPC(mV) 初始 −30.19±0.91Cb −28.47±0.63Ba 0.5 20.68±0.86ABa 18.14±0.62Ab 1 −25.72±0.84Aa −25.55±0.47Aa 1 20.34±0.73Ba 18.12±0.47Ab 2 −27.43±0.20Ba −26.75±0.68Ba 1.5 21.28±0.59Aa 18.47±0.63Ab 3 −27.68±0.59Ba −27.0±0.41Ba 2 20.15±0.55Ba 17.62±0.76Ab 4 −27.73±0.47Ba −27.22±0.04Ba 2.5 20.08±0.38Ba 18.18±0.80Ab 5 −28.07±0.69Ba −27.29±0.50Ba 注:不同大写字母代表同组在不同消化时间下差异显著(P<0.05),不同小写字母代表不同组在同一消化时间下差异显著(P<0.05)。 表 5 不同胃肠pH下WPC对5-MTHF电位的影响
Table 5 Effects of WPC on the potential of 5-MTHF at different gastrointestinal pH
胃pH WPC-5-MTHF(mV) WPC(mV) 肠pH WPC-5-MTHF(mV) WPC(mV) 初始 −29.43±0.36Eb −26.01±0.66Ea 1.5 21.26±0.35Aa 20.16±0.92Aa 6 −25.78±0.64Ab −24.87±1.41Aa 2 18.49±0.49Ba 16.05±1.47Bb 6.5 −28.49±0.38Bb −26.93±0.24Ba 2.5 16.92±1.80Ba 14.23±1.18Bb 7 −29.26±0.40Cb −26.69±0.61Ba 3 8.93±0.57Ca 7.68±0.47Ca 7.5 −29.11±0.65Cb −26.64±1.32Ba 4 −6.79±0.82Db 1.04±0.58Da 8 −29.77±0.31Cb −27.9±0.62Ca 注:不同大写字母代表同组在不同胃肠pH下差异显著(P<0.05),不同小写字母代表不同组在同一胃肠pH下差异显著(P<0.05)。 -
[1] REN H, WANG K, LIU Z, et al. Effect of low dietary folate on mouse spermatogenesis and spindle assembly checkpoint dysfunction may contribute to folate deficiency-induced chromosomal instability in cultured mouse spermatogonia[J]. DNA and Cell Biology,2023,42(8):515−525. doi: 10.1089/dna.2023.0035
[2] SAINI R K, NILE S H, KEUM Y S. Folates:Chemistry, analysis, occurrence, biofortification and bioavailability[J]. Food Research International,2016,89:1−13. doi: 10.1016/j.foodres.2016.07.013
[3] VISENTIN M, DIOP-BOVE N, ZHAO R, et al. The intestinal absorption of folates[J]. Annual Review of Physiology,2014,76:251−274. doi: 10.1146/annurev-physiol-020911-153251
[4] LIAN Z, CHEN H, LIU K, et al. Improved stability of a stable crystal form C of 6S-5-methyltetrahydrofolate calcium salt, method development and validation of an LC-MS/MS method for rat pharmacokinetic comparison[J]. Molecules,2021,26(19):6011. doi: 10.3390/molecules26196011
[5] 连增林, 刘康, 顾锦华, 等. 叶酸与5-甲基四氢叶酸的生物学特征与应用[J]. 中国食品添加剂,2022,33(2):230−239. [LIAN Zenglin, LIU Kang, GU Jinhua, et al. Biological characteristics and application of folic acid and 5-methyltetrahydrofolic acid[J]. Chinese Food Additives,2022,33(2):230−239.] LIAN Zenglin, LIU Kang, GU Jinhua, et al. Biological characteristics and application of folic acid and 5-methyltetrahydrofolic acid[J]. Chinese Food Additives, 2022, 33(2): 230−239.
[6] 食品营养强化剂新品种6S-5-甲基四氢叶酸钙获批氮气等8种食品添加剂获准扩大使用范围[J]. 粮食与饲料工业, 2018(2):6. [Food nutrition fortifier new variety 6S-5-methyltetrahydrofolate calcium was approved nitrogen and other 8 food additives approved to expand the scope of use[J]. Food and Feed Industry, 2018(2):6.] Food nutrition fortifier new variety 6S-5-methyltetrahydrofolate calcium was approved nitrogen and other 8 food additives approved to expand the scope of use[J]. Food and Feed Industry, 2018(2): 6.
[7] 陈娜. 四氢叶酸钙不同给药途径对急性淋巴细胞白血病患儿口腔粘膜炎的预防[J]. 实用临床护理学电子杂志,2017,2(38):5−6. [CHEN Na. Prevention of oral mucositis in children with acute lymphoblastic leukemia by different administration routes of calcium tetrahydrofolate[J]. Electronic Journal of Practical Clinical Nursing,2017,2(38):5−6.] doi: 10.3969/j.issn.2096-2479.2017.38.005 CHEN Na. Prevention of oral mucositis in children with acute lymphoblastic leukemia by different administration routes of calcium tetrahydrofolate[J]. Electronic Journal of Practical Clinical Nursing, 2017, 2(38): 5−6. doi: 10.3969/j.issn.2096-2479.2017.38.005
[8] 薛娟, 马文斌, 涂华, 等. 6S-5-甲基四氢叶酸钙对小鼠免疫力的增强作用研究[J]. 中国医药科学,2021,11(17):29−33. [XUE Juan, MA Wenbin, TU Hua, et al. Study on the enhancement effect of 6S-5-methyltetrahydrofolate calcium on immunity in mice[J]. Chinese Medical Sciences,2021,11(17):29−33.] doi: 10.3969/j.issn.2095-0616.2021.17.008 XUE Juan, MA Wenbin, TU Hua, et al. Study on the enhancement effect of 6S-5-methyltetrahydrofolate calcium on immunity in mice[J]. Chinese Medical Sciences, 2021, 11(17): 29−33. doi: 10.3969/j.issn.2095-0616.2021.17.008
[9] CAO Y, ZENG J, HUANG T, et al. A sensitive, robust and high-throughput isotope dilution LC-MS/MS method for quantifying three folate forms in serum[J]. Bioanalysis,2023,15(5):249−258. doi: 10.4155/bio-2023-0007
[10] WRIGHT A J A, DAINTY J R, FINGLAS P M. Folic acid metabolism in human subjects revisited:Potential implications for proposed mandatory folic acid fortification in the UK[J]. British Journal of Nutrition,2007,98(4):667−675.
[11] KONG F, KANG S, ZHANG J, et al. The non-covalent interactions between whey protein and various food functional ingredients[J]. Food Chemistry,2022,394:133455. doi: 10.1016/j.foodchem.2022.133455
[12] MOHAMMADIAN M, SALAMI M, MOMEN S, et al. Enhancing the aqueous solubility of curcumin at acidic condition through the complexation with whey protein nanofibrils[J]. Food Hydrocolloids,2019,87:902−914. doi: 10.1016/j.foodhyd.2018.09.001
[13] LIU X, SONG Q, LI X, et al. Effects of different dietary polyphenols on conformational changes and functional properties of protein-polyphenol covalent complexes[J]. Food Chemistry,2021,361:130071. doi: 10.1016/j.foodchem.2021.130071
[14] FU X, CHENG H, FANG Z, et al. Mechanism for improved protection of whey protein isolate against the photodecomposition of folic acid[J]. Food Hydrocolloids,2018,79:439−449. doi: 10.1016/j.foodhyd.2018.01.020
[15] CORFIELD R, LALOU G, DI LELLA S, et al. Experimental and modeling approaches applied to the whey proteins and vitamin B9 complexes study[J]. Food Hydrocolloids,2023,142:108834. doi: 10.1016/j.foodhyd.2023.108834
[16] CORFIELD R, MARTINEZ K D, ALLIEVE M C, et al. Whey proteins-folic acid complexes:Formation, isolation and bioavailability in a Lactobacillus casei model[J]. Food Structure,2020,26:100162. doi: 10.1016/j.foostr.2020.100162
[17] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food & Function,2014,5(6):1113−1124.
[18] HERBIG A L, MOUSTIES C, RENARD C M G C. Impact of three warming-up methods on the stability of vitamin C and 5-methyltetrahydrofolate supplemented to apple and carrot purée[J]. LWT,2017,84:668−673. doi: 10.1016/j.lwt.2017.06.031
[19] ZEMA P, PILOSOF A M R. On the binding of folic acid to food proteins performing as vitamin micro/nanocarriers[J]. Food Hydrocolloids,2018,79:509−517. doi: 10.1016/j.foodhyd.2018.01.021
[20] CHAPEAUL A L, BERTRAND N, BRIARD-BION V, et al. Coacervates of whey proteins to protect and improve the oral delivery of a bioactive molecule[J]. Journal of Functional Foods,2017,38:197−204. doi: 10.1016/j.jff.2017.09.009
[21] BORREANI J, LLORCA E, LARREA V, et al. Adding neutral or anionic hydrocolloids to dairy proteins under in vitro gastric digestion conditions[J]. Food Hydrocolloids,2016,57:169−177. doi: 10.1016/j.foodhyd.2016.01.030
[22] LIU L, KONG F. Influence of nanocellulose on in vitro digestion of whey protein isolate[J]. Carbohydrate Polymers,2019,210:399−411. doi: 10.1016/j.carbpol.2019.01.071
[23] 包小妹. β-LG与叶酸和视黄醇三元复合物的结合机制及消化前后结构和性质的变化[D]. 南昌:南昌大学, 2020. [BAO Xiaomei. Binding mechanism of β-LG with folic acid and retinol ternary complex and changes of structure and properties before and after digestion[D]. Nanchang:Nanchang University, 2020.] BAO Xiaomei. Binding mechanism of β-LG with folic acid and retinol ternary complex and changes of structure and properties before and after digestion[D]. Nanchang: Nanchang University, 2020.
[24] YE A, WANG X, LIN Q, et al. Dynamic gastric stability and in vitro lipid digestion of whey-protein-stabilised emulsions:Effect of heat treatment[J]. Food Chemistry,2020,318:126463. doi: 10.1016/j.foodchem.2020.126463
[25] SARKAR A, LI H, CRAY D, et al. Composite whey protein-cellulose nanocrystals at oil-water interface:Towards delaying lipid digestion[J]. Food Hydrocolloids,2018,77:436−444. doi: 10.1016/j.foodhyd.2017.10.020
[26] LIU F, EDELMANN M, PIIRONEN V, et al. The bioaccessibility of folate in breads and the stability of folate vitamers during in vitro digestion[J]. Food & Function,2022,13(6):3220−3233.
[27] WANG C, WANG J, ZHU D, et al. Effect of dynamic ultra-high pressure homogenization on the structure and functional properties of whey protein[J]. Journal of Food Science and Technology,2020,57:1301−1309. doi: 10.1007/s13197-019-04164-z
[28] YAN B, PARK S H, BALASUBRAMANIAM V M. Influence of high pressure homogenization with and without lecithin on particle size and physicochemical properties of whey protein‐based emulsions[J]. Journal of Food Process Engineering,2017,40(6):e12578. doi: 10.1111/jfpe.12578
[29] MENG Y, LIANG Z, ZHANG C, et al. Ultrasonic modification of whey protein isolate:Implications for the structural and functional properties[J]. LWT,2021,152:112272. doi: 10.1016/j.lwt.2021.112272
[30] 张思雨, 程建军, 孙玉雪, 等. 热处理对乳清蛋白原料起泡性、理化特性的影响及关系研究[J]. 食品与发酵工业, 2023, 49(22):117-124. [ZHANG Siyu, CHENG Jianjun, SUN Yuxue, et al. Study on the influence and relationship of heat treatment on the physicochemical properties of whey protein raw materials[J]. Food and Fermentation Industry, 49(22):117-124.] ZHANG Siyu, CHENG Jianjun, SUN Yuxue, et al. Study on the influence and relationship of heat treatment on the physicochemical properties of whey protein raw materials[J]. Food and Fermentation Industry, 49(22): 117-124.
[31] CATTANEO S, MASOTTI F, SILVETTI T, et al. Effect of dairy ingredients on the heat damage and the in vitro digestibility of infant biscuits[J]. European Food Research and Technology,2019,245:2489−2497. doi: 10.1007/s00217-019-03368-z
[32] ZHANG S, VARDHANABHUTI B. Effect of initial protein concentration and pH on in vitro gastric digestion of heated whey proteins[J]. Food Chemistry,2014,145:473−480. doi: 10.1016/j.foodchem.2013.08.076
[33] 刘培玲, 张晴晴, 高增丽, 等. 乳清蛋白改性研究进展[J]. 食品科学,2021,42(23):333−348. [LIU Peiling, ZHANG Qingqing, GAO Zengli, et al. Research progress on modification of whey protein[J]. Food Science,2021,42(23):333−348.] doi: 10.7506/spkx1002-6630-20201023-232 LIU Peiling, ZHANG Qingqing, GAO Zengli, et al. Research progress on modification of whey protein[J]. Food Science, 2021, 42(23): 333−348. doi: 10.7506/spkx1002-6630-20201023-232
[34] ZHAO Z, XIAO Q. Effect of chitosan on the heat stability of whey protein solution as a function of pH[J]. Journal of the Science of Food and Agriculture,2017,97(5):1576−1581. doi: 10.1002/jsfa.7904
[35] MORELL P, FISZMAN S, LORCA E, et al. Designing added-protein yogurts:Relationship between in vitro digestion behavior and structure[J]. Food Hydrocolloids,2017,72:27−34. doi: 10.1016/j.foodhyd.2017.05.026
[36] LÉA S, JULIANE F, STEVEN L F. Pepsin activity as a function of pH and digestion time on caseins and egg white proteins under static in vitro conditions[J]. Food & Function,2021,12(24):12468−12478.
[37] PEREZ O E, DAVID-BIRMAN T, KESSELMAN E, et al. Milk protein-vitamin interactions:Formation of beta-lactoglobulin/folic acid nano-complexes and their impact on in vitro gastro-duodenal proteolysis[J]. Food Hydrocolloids,2014,38:40−47. doi: 10.1016/j.foodhyd.2013.11.010





 下载:
下载:




 下载:
下载:



