Effects of Different Concentrations of Eugenol on the Structure and Emulsion Gel Properties of Myofibrillar Protein
-
摘要: 为了探究丁香酚添加量对肌原纤维蛋白乳液凝胶特性的影响,本文以猪肌原纤维蛋白为研究对象,模拟乳化香肠的加工过程,通过测定不同浓度的丁香酚(0、5、10、20、50、100 mg/g蛋白质)添加对蛋白的二级结构、凝胶强度、保水率、水分分布、流变和微观结构等指标的影响,探讨丁香酚添加量对蛋白凝胶形成的作用规律。结果表明,添加低浓度的丁香酚(20 mg/g)显著提升了蛋白的凝胶强度、保水率(P<0.05),凝胶中不易流动水的含量和储能模量明显增加,蒸煮损失和冻融损失显著降低(P<0.05),凝胶中自由水含量减少。然而,当添加高浓度的丁香酚(100 mg/g)时,凝胶强度和保水率明显降低,蒸煮损失、冻融损失明显升高,且在扫描电镜下可清晰地看到凝胶网络结构粗糙、孔隙明显增大。综上,添加低浓度丁香酚(20 mg/g)可以有效地提高蛋白的凝胶特性,其有潜力成为一种新型的肉制品品质改良剂。Abstract: To explore the effect of eugenol addition on the gel properties of myofibrillar protein emulsions, this study used porcine myofibrillar protein as the research object and simulated the processing of emulsified sausages. The effects of eugenol concentration (0, 5, 10, 20, 50, and 100 mg/g protein) on the protein secondary structure, gel strength, water retention, water distribution, rheology, and microstructure were determined to investigate the effect of eugenol on protein gel formation. The results showed that the addition of low-concentration eugenol (20 mg/g) significantly improved the gel strength and water retention rate of the protein (P<0.05), significantly increased the non-mobile water content and storage modulus of the gel, significantly decreased the cooking loss and freeze-thaw loss (P<0.05), and decreased the free water content of the gel. In contrast, upon the addition of high-concentration eugenol (100 mg/g), the gel strength and water retention were significantly decreased, the cooking loss and freeze-thaw loss were significantly increased, and the gel network structure became rough, and the pore size increased, as revealed by the scanning electron microscopy images. The results confirm that the addition of low-concentration eugenol (20 mg/g) can effectively improve the gel properties of proteins, and it has the potential to be a new type of meat product quality improver.
-
Keywords:
- eugenol /
- myofibrillar protein /
- interaction /
- gel properties /
- rheology
-
乳化肉制品(法兰克福香肠、慕尼黑白肠等)因其具有独特的风味、方便性和营养价值在世界上许多国家都广受欢迎[1−2],这类肉制品是一种热诱导乳化凝胶,主要由凝胶化肉蛋白(作为连续相)和脂肪滴(作为分散相)组成[3−5]。肌原纤维蛋白(Myofibrillar protein,MP)是形成乳化肉制品3D凝胶网络骨架的主要成分[6−8],然而,MP的结构和性质经常会受如:氧化、pH、温度、添加剂等因素的影响[9−10],破坏了MP的结构,进而影响了其形成凝胶的能力。因此,在乳化肉制品的生产过程中,如何通过保持或修饰MP结构,进而提升其凝胶特性,仍是行业亟待解决的问题。
香辛料是肉制品加工中最常用的品质和风味改良剂,且具有很好的抗氧化性,能够大大延长产品的保质期,但香辛料的添加通常会影响肌肉蛋白的功能特性。丁香酚(Eugenol,EG)是丁香中最主要的天然抗氧化成分,具有很强的抗氧化活性[11]。本课题组前期在研究不同剂量的EG对非乳化体系中MP凝胶性能的影响中,发现低剂量EG(10 mg/g)与蛋白互作能够显著地提高凝胶的弹性和成胶能力[12]。另外,Wang等[8]在考察迷迭香酸对MP乳化凝胶结构性质和稳定性的影响时,发现高浓度迷迭香酸(300 µM/g)会导致凝胶的网络结构变差,从而削弱凝胶强度,增加蒸煮损失。加之,Hu等[13]研究也发现中剂量的姜黄素(200 mg/L)改变了乳化凝胶的三维网络结构,提高了凝胶的保水能力和储能模量(G')。因此,探讨具有较强抗氧化性的植物多酚添加量如何影响MP的凝胶形成,进而影响最终的产品质量,显得尤为重要。
目前,丁香酚添加量对肌原纤维蛋白乳液凝胶特性的影响暂不明确。因此,本研究以MP乳液为研究对象,探讨不同浓度EG(0、5、10、20、50、100 mg/g蛋白质)的添加,对MP结构和凝胶形成的影响。首先,通过检测蛋白的二级结构、乳液显微结构等指标,探究EG对MP结构的影响;进而,通过检测凝胶保水率、凝胶强度、冻融损失、流变特性、水分分布和凝胶的微观结构,探究各浓度EG对MP乳化凝胶形成的影响;最终筛选出EG改善凝胶特性的最佳浓度,为丁香酚在乳化肉制品中的应用提供新思路。
1. 材料与方法
1.1 材料与仪器
猪背最长肌、猪背脂 购自北大荒肉品加工有限公司(中国大庆),当天送至实验室。将猪肉切成80~100 g的小块,装入袋中,真空包装,−20 ℃保存;丁香酚、溴化钾、牛血清蛋白等 均购自中国大庆麦克林化学试剂有限公司;所有试剂均为分析级。
T25均质机 IKA艾卡代理商苏州赛恩斯仪器有限公司;TA-XT Plus质构分析仪 英国SMS公司;Centrifuge5810 R高速冷冻离心机 德国Eppendorf公司;Bohlin Gemini2流变仪 莫尔文仪器有限公司;S3400N扫描电镜 日本日立公司;NMI 20-15低场核磁共振成像仪 苏州纽迈分析仪器股份有限公司;TENSORⅡ傅里叶变换红外光谱仪 德国布鲁克有限公司;徕卡Leica显微镜DM750 南京伊若达仪器设备有限公司。
1.2 实验方法
1.2.1 EG-MP复合乳液的制备
参考Park等[14]的方法提取MP,并略作修改。将猪肉解冻2 h,对其进行称重,将其加入到捣碎机中并加入四倍体积(v/w)的蛋白提取液(0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,pH7.0)低档位搅拌1 min,捣碎后的匀浆冷冻离心(4500 r/min,15 min,4 ℃)后去除上清液,将沉淀放入捣碎机中,再次加入四倍体积的蛋白提取液,此步骤重复三次。此后得到的沉淀中加入四倍体积0.1 mol/L NaCl溶液,匀浆后用四层纱布进行过滤,用0.1 mol/L的HCl将pH调至6.25,冷冻离心(5000 r/min,15 min,4 ℃)后所得膏状沉淀为MP。提取的MP储存在4 ℃冰箱中并在48 h内使用。使用15 mmol/L 1,4-哌嗪二乙磺酸(PIPES)(0.6 mol/L NaCl,pH6.25)缓冲液将MP稀释到所需要的浓度(10和40 mg/mL)。将5 mg/mL的EG按照不同的比例与MP(10 mg/mL)进行混合,从而得到EG-MP复合物。参考Chen等[12]对EG浓度的设定,在复合体系中,EG的最终浓度为5、10、20、50、100 mg/g蛋白质,不添加EG的为对照组。在4 ℃的环境中互作12 h。将18 g EG-MP复合物与2 g猪油(将猪背脂与水加入锅中,小火煮制,煮出的油脂经过纱布过滤备用)进行混合,然后使用均质机在10000 r/min下均质1 min,从而形成新鲜的乳状液。
1.2.2 二级结构的测定
傅里叶变换红外光谱(FTIR)可以反映蛋白质的二级结构[15]。二级结构采用Ma等[16]的FTIR方法测定。测定样品为蛋白乳液,将其冻干后与溴化钾混合,压片。FTIR光谱的波数范围为400~4000 cm−1。采用Peak Fit Version 4.12软件(上海中思米科技有限公司)对结果进行分析。
1.2.3 光学显微镜观察
按照Zhao等[17]的方法进行光学显微镜(10倍放大)的测定。将不同浓度的乳液滴在载玻片上,观察添加不同浓度EG乳液的微观结构分布。
1.2.4 制备乳化凝胶
在50 mL的烧杯中加入15 g MP(40 mg/mL)和15 g新鲜乳状液,然后用玻璃棒缓慢搅拌,混合均匀。该混合物的蛋白质浓度为3%(w/w),含油量为5%(w/w)。将该混合物均匀地加入到称量瓶中,称重并记录重量,然后将其放入水浴锅中,以1 ℃/min的加热速率从20 ℃加热到75 ℃。将加热后的称量瓶冷却至室温后放入4 ℃的冰箱中过夜备用。
1.2.5 凝胶强度
参照Chrn等[18]的方法测定凝胶强度。将预处理后的凝胶在37 ℃下平衡1 h,然后在室温下固定在测试平台上,使用连接P/0.5的探针进行测定。试验参数设置如下:试验前速度为2.0 mm/s;试验速度为1.0 mm/s;试验后速度为2.0 mm/s;下压距离为10 mm。
1.2.6 蒸煮损失
参考Tahmasebi等[19]的方法并稍作修改,测定蒸煮损失(%)。蒸煮前的质量记为W0,将凝胶放入80 ℃的水浴中,持续放置30 min。蒸煮后倒置5 min以释放渗出物,释放后的凝胶重量记为W1。凝胶蒸煮损失计算公式为:
蒸煮损失(%)=W0−W1W0×100 1.2.7 保水率
参考Ding等[20]的方法测定凝胶的保水率并略作修改。首先记录离心管的重量为m0。称取约6 g的凝胶放入离心管底部,此时离心管总重量记为m1。然后在4 ℃的离心机中以3000 r/min离心10 min后,用中性滤纸吸干凝胶析出的水,测定此时离心管的质量,标记为m2。通过下列公式计算凝胶的保水率:
保水率(%)=m2−m0m1−m0×100 1.2.8 冻融损失
参考Zhu等[21]的方法测定凝胶冻融损失并略作修改。首先称取约5 g新鲜制备的样品,得到的重量记为m0。然后在−20 ℃冷冻22 h,在37 ℃解冻2 h,样品在1000 r/min下离心15 min,去除多余的水分后称重记为m1。冻融循环进行了三次。按照下列公式计算冻融损失:
冻融损失(%)=m0−m1m0×100 1.2.9 低场核磁共振法测定凝胶中水分分布
参照Aursand等[22]的方法,将凝胶样品置于直径1.8 cm,高18 cm的试管中,测定凝胶水分分布。测定使用CPMG序列在23.2 MHz的共振频率下进行了16次扫描,弛豫时间为0.1~10000 ms。
1.2.10 流变特性
采用Li等[23]描述的动态流变学方法。将MP复合乳液(20 mg/mL)均匀涂在Bohlin Gemini2流变仪的下板上。将直径为30 mm的上板降低至1 mm,用软纸轻轻去除多余的样品,并在板边缘涂上硅油。样品以1 ℃/min的升温速率从20 ℃加热至72 ℃,振荡频率为0.1 Hz,最大应力为0.02。连续监测凝胶的储存模量G'。
1.2.11 扫描电子显微镜观察
参照Xia等[24]的方法进行MP凝胶样品的预处理,将样品放入戊二醛中过夜,用0.2 mol/L磷酸盐缓冲液固定2 h,然后分别用50%、70%、80%、90%的乙醇脱水15 min,再用100%的乙醇脱水3次,每次15 min。将不同浓度的样品进行冷冻干燥,喷金。扫描电子显微镜放大50000倍。
1.3 数据处理
每个指标独立测试三次,每次都需要提取新鲜的蛋白质。结果以平均数±标准差表示。采用SPSS 26软件进行统计学分析,执行Duncan多重比较分析处理,P<0.05表示差异显著。使用Origin 2021软件进行作图。
2. 结果与分析
2.1 不同浓度丁香酚对蛋白乳液二级结构的影响
利用傅里叶变换红外光谱对样品进行扫描,结果如图1A所示,波数在1650~1660 cm−1区间(α-螺旋结构),与对照组相比,随EG浓度的增加,处理组样本的峰值都发生了不同程度的红移。当EG为20 mg/g时,峰值由对照组的1652.8 cm−1增加到最大值1658.5 cm−1,说明EG在乳化过程中促使蛋白质的α-螺旋结构发生改变,C=O密度增加,氢键力降低[25]。当EG添加量大于20 mg/g时,峰值均降至1655.7 cm−1,说明高剂量的EG添加并没有继续破坏蛋白质的α-螺旋结构。
图1B是根据红外谱图的各峰面积,计算得出对应二级结构各组分的相对含量。由图可知,四种结构中占比最高的二级结构为β-转角(1660~1700 cm−1)。EG的添加,导致β-转角结构均发生了不同程度的增加,α-螺旋相对含量较对照组有所下降。β-转角和β-折叠结构是凝胶形成的基础,增加这些结构的占比,有利于提升凝胶性能[26]。当EG为20 mg/g时,β-转角和β-折叠的总量占比最大为70.74%,有利于凝胶的形成。然而,当EG浓度大于20 mg/g时,β-转角和β-折叠结构的占比降低,α-螺旋相对含量增加,不利于凝胶结构的形成。裘乐芸等[27]研究发现,当表没食子儿茶素没食子酸酯浓度升高时,α-螺旋含量呈现出先减小后增加的趋势,β-转角含量呈现出先增加后减小的趋势,说明表没食子儿茶素没食子酸酯的添加促进了MP二级结构α-螺旋向β-转角转化,β-转角的形成有利于蛋白质间的交联,增加凝胶强度。综上可以得出,添加适当浓度(20 mg/g)的EG,促进了蛋白质结构展开,促进了α-螺旋向β-转角和β-折叠转化,有利于凝胶的形成并提高其功能性,添加高剂量(100 mg/g)的EG不利于凝胶化。
2.2 不同浓度丁香酚对蛋白乳液微观结构的影响
采用显微镜可以直观、清晰地观察乳化液中分散相(油滴)的分布,显示分散液滴的大小和乳化液的聚集或絮凝情况[28]。如图2所示,对照组(未添加EG)视野内可见清晰的大液滴,且液滴分布稀疏。这可能是由于未添加EG时,蛋白质的结构未发生变化,蛋白质-蛋白质之间的相互作用较弱,MP没有完全、有效地覆盖油滴所导致的。随着EG浓度的增加,油滴的直径逐渐减小,当EG浓度为20 mg/g时,与对照组相比,油滴密度和均匀度明显增加,油滴直径明显减小。这可能是由于低浓度的EG使蛋白质展开,促进了蛋白质之间的相互作用,均质后使蛋白质均匀、快速地吸附到油滴表面,将油滴完全包裹,从而形成了较小的油滴[29]。当EG浓度达到最大100 mg/g时,油滴的直径最小,但油滴的大小对后续凝胶性的影响程度,还有待其他指标的研究。
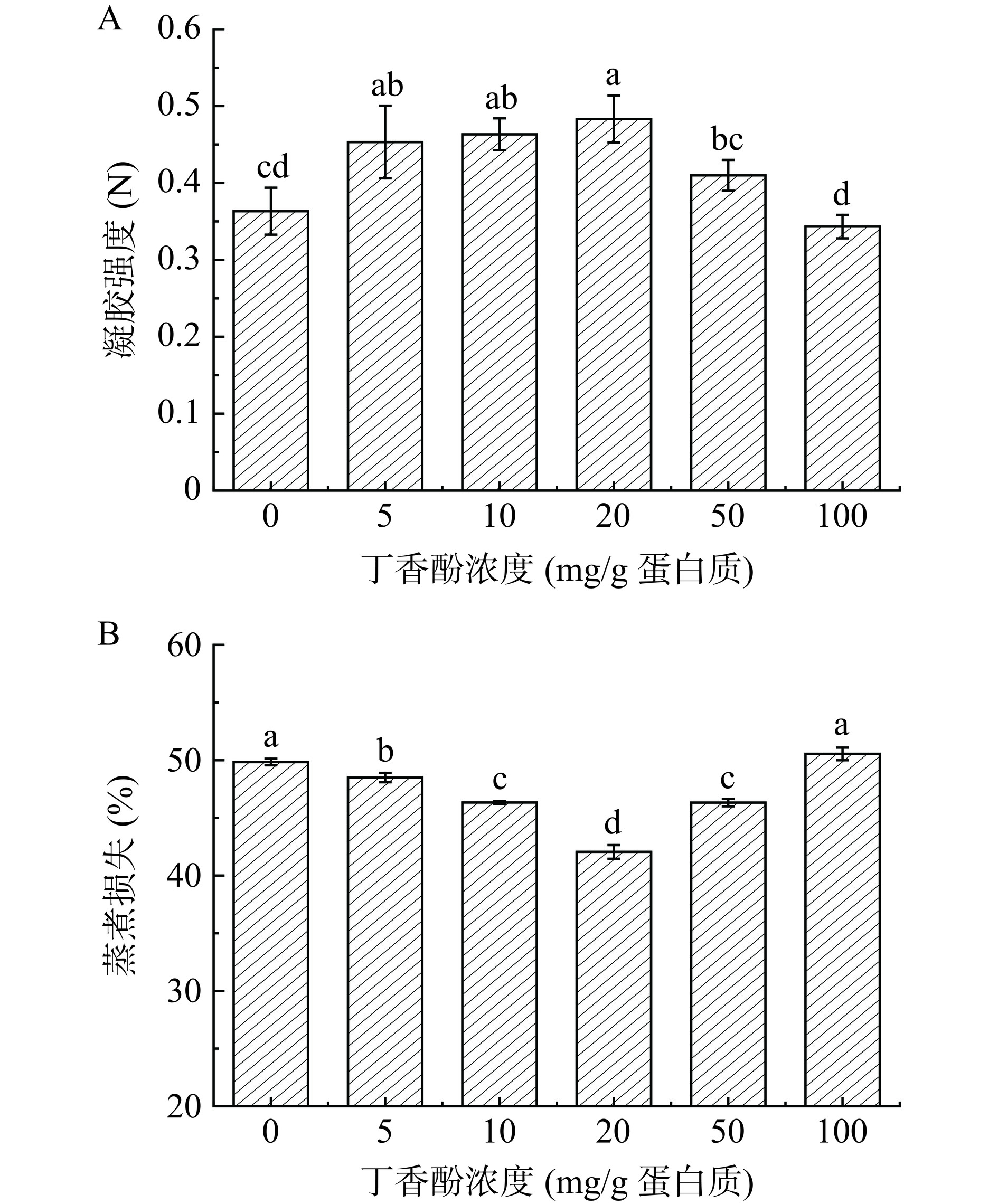
2.3 不同浓度丁香酚对蛋白乳液凝胶强度和蒸煮损失的影响
如图3A所示,与对照组相比,随EG浓度的增加,凝胶强度呈现先增加,后降低的趋势。当EG浓度为5、10和20 mg/g时,均显著改善了蛋白的凝胶强度(P<0.05),浓度为20 mg/g时,凝胶强度达到最大为0.48 N,比对照组(0.36 N)提高了33%,大幅提升了蛋白的凝胶强度。这可能是由于低剂量EG可以促进蛋白质之间的相互作用,增加蛋白质之间的交联,从而提高凝胶强度[12]。然而,当EG为100 mg/g时,凝胶强度为0.34 N,明显低于对照组,形成的凝胶状态较软,这可能是由于高剂量的EG占据了MP中发生交联的活性位点,从而抑制了蛋白质之间的交联,导致凝胶强度降低。这与Chen等[12]的研究结果相一致,即,高浓度的EG显著地降低了蛋白的凝胶强度。这说明,低剂量(20 mg/g)的EG可能通过氢键和疏水相互作用等与蛋白质相互作用,增加蛋白质之间的交联机会,形成更加紧密的凝胶网络,从而有助于增强凝胶强度。
![]() 图 3 不同浓度丁香酚对蛋白乳液凝胶强度(A)和蒸煮损失(B)的影响注:不同小写字母表示差异显著(P<0.05),图4同。Figure 3. Effects of different concentrations of eugenol on gel strength (A) and cooking loss (B) of protein emulsion
图 3 不同浓度丁香酚对蛋白乳液凝胶强度(A)和蒸煮损失(B)的影响注:不同小写字母表示差异显著(P<0.05),图4同。Figure 3. Effects of different concentrations of eugenol on gel strength (A) and cooking loss (B) of protein emulsion由图3B可知,当EG为20 mg/g时,蒸煮损失较对照组显著降低了15.6%(P<0.05)。这可能是由于加入低浓度EG(10和20 mg/g)后,参与凝胶形成的蛋白质结合位点增加,从而促进了凝胶网络结构的形成,最终提高了凝胶的保水性[30]。与上述凝胶强度结果相对应,当EG为100 mg/g时,蒸煮损失较对照组增加1.4%,这可能是由于高浓度EG(100 mg/g)会诱导MP聚集和沉淀,参与凝胶形成的蛋白质结合位点减少,使凝胶网络结构的形成受到了一定的限制。因此,低浓度(10和20 mg/g)的EG能够显著降低凝胶的蒸煮损失(P<0.05)。Jongberg等[31]研究绿茶提取物对乳化肉体系中蒸煮损失的影响与此结果相一致,即高剂量的绿茶提取物会提高乳化肉类系统中的蒸煮损失。综上可以得出,随着EG浓度的增加(至100 mg/g时),MP聚集沉淀,溶解度降低,参与凝胶形成的蛋白质含量降低,这不利于形成良好的三维网状凝胶基质,从而增大了凝胶的蒸煮损失。
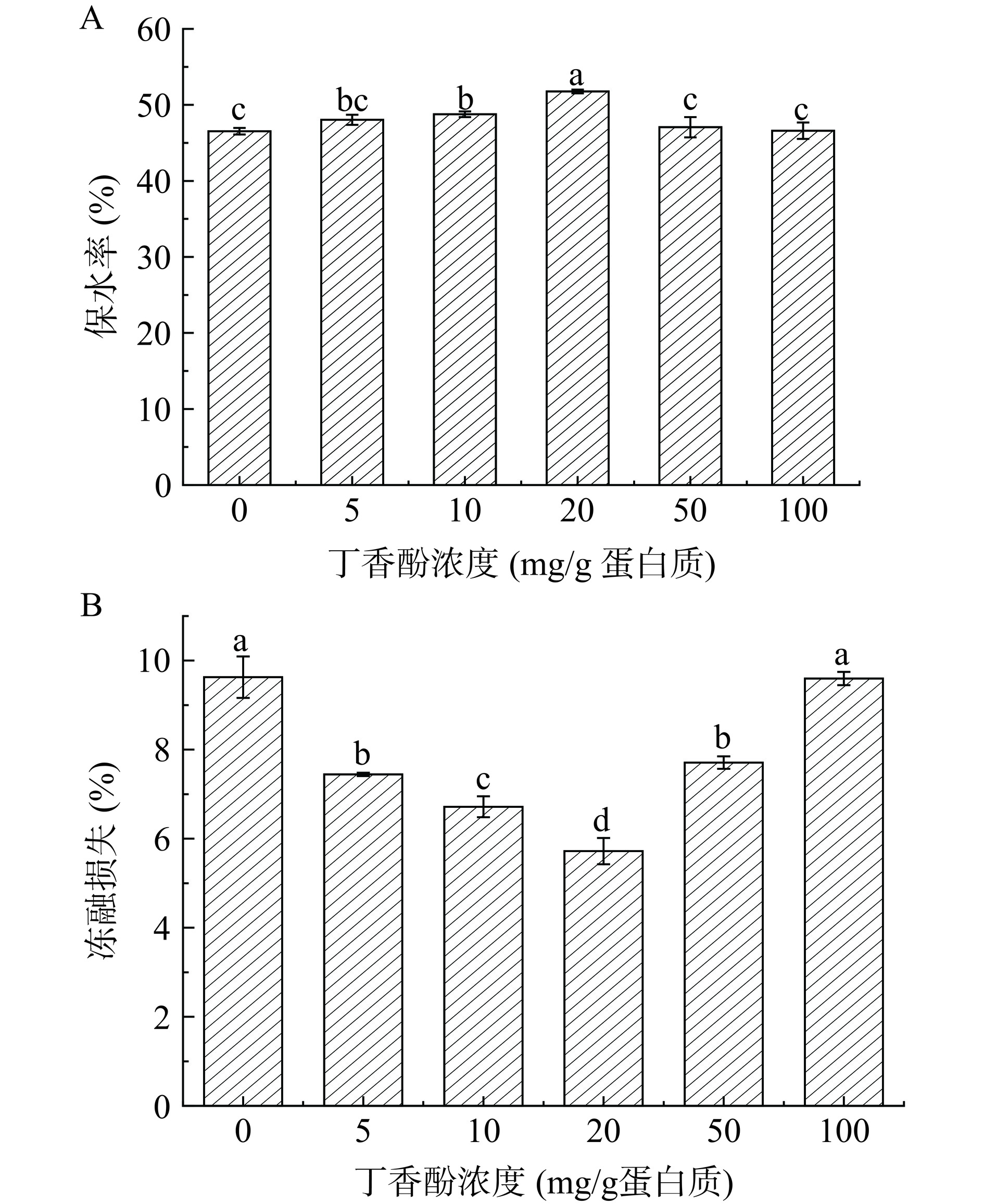
2.4 不同浓度丁香酚对蛋白乳液凝胶保水率和冻融损失的影响
EG对凝胶保水率的影响如图4A所示,随着EG浓度的升高,保水率先增高后降低。当EG浓度为20 mg/g时,凝胶的保水率达到最大值(51.8%),与对照组(不添加EG)相比,保水率显著增加了5.3%(P<0.05)。这可能是由于低浓度的EG促进了与蛋白质之间的交联,填补了MP的空隙,从而减小了凝胶网络的孔径;另一方面,EG可以使MP在油水界面的吸附更紧密,从而提高了凝胶结构的致密性[32]。然而,当EG浓度为100 mg/g时,凝胶的保水率降低,但与对照组(不添加EG)相比差异不显著(P>0.05)。这可能是由于高剂量的EG抑制了蛋白质与蛋白质之间的交联,形成了孔隙较大的凝胶网络结构,导致凝胶中水分流失,降低了凝胶的保水率。贾娜等[33]发现,添加高浓度的没食子酸,会阻碍二硫键交联,抑制了凝胶的形成,从而导致凝胶的保水率降低。因此可以得出,高剂量(100 mg/g)的EG不利于凝胶的形成,从而无法保留更多的水分,这与二级结构所得到的结果相一致。
为了延长产品的保质期,部分乳化肉制品需要冷冻,因此,本研究考察了添加EG的凝胶在冻融条件下的稳定性。由冻融数据分析可知(图4B),随着EG浓度的增加,冻融损失呈先降低后增加的趋势,与对照组相比(9.63%),当EG浓度为20 mg/g时,凝胶的冻融损失显著降低到5.72%(P<0.05),一方面这可能是由于添加低剂量的EG(20 mg/g),可以促进EG-MP和蛋白质-蛋白质之间的相互交联,使更多的蛋白质参与到凝胶的形成过程中,使凝胶形成更加紧密的网络结构,从而防止了凝胶在冻融循环过程中水分的流失,降低了冻融损失。另一方面,低剂量的EG(20 mg/g)可以促进蛋白质快速地吸附在油滴的表面,将油滴完全包裹,在油水界面之间形成较厚的界面蛋白膜,其中的亲水基团延伸至水相,使更多的水参与包裹油滴,减少了冻融循环过程中水分的析出[21,34]。然而,随着EG浓度的增加,凝胶的冻融损失随之增高,与添加低剂量EG(20 mg/g)的凝胶相比,当EG浓度为100 mg/g时,冻融损失显著增加到9.6%(P<0.05),这可能是由于高剂量的EG使蛋白质聚集沉淀,形成了孔隙较大的网络结构,所吸收的水相减少导致冻融循环后所析出的水分增加,冻融损失增加,这与蒸煮损失的结果相一致。
2.5 不同浓度丁香酚对蛋白乳液凝胶水分分布的影响
根据不同的弛豫时间,将所对应的水分子划分为结合水(0.1~100 ms)、不易流动水(100~1000 ms)和自由水(1000~10000 ms),分别对应着图5中的三个峰T21、T22、T23,由图可知,随着EG浓度的增加,T23范围内信号强度的峰值和峰面积A23呈现出先降低后增高的趋势,这说明加入适当的EG降低了凝胶中自由水的含量。与对照组相比,随着EG浓度的增加,峰面积A22呈现出先增高后降低的趋势。当EG浓度为20 mg/g时,峰面积A22达到最大值为94.8%,这说明凝胶中主要的水分为不易流动水,添加低剂量的EG可以增加凝胶中不易流动水的占比。这可能是由于低剂量的EG促进了蛋白质之间的交联,所形成的凝胶网络结构更加的紧密,所能吸收的水分更多。然而,当EG浓度为100 mg/g时,峰面积A22最小(93.7%),这说明高剂量的EG促进了水分流失,增加了自由水占比,这与保水率的结果相一致。Hu等[13]研究发现添加低剂量的姜黄素(100 mg/L),凝胶中不易流动水的含量增加,自由水含量降低,说明姜黄素可以在一定程度上降低凝胶基质中水的流动性,将自由水转化为不易流动水,这与本实验结果一致。综上,添加低剂量(20 mg/g)的EG能够有效增加凝胶中不易流动水含量,促进了凝胶中自由水向不易流动水的转化。
2.6 不同浓度丁香酚对蛋白乳液凝胶流变特性的影响
MP凝胶形成过程的动态弹性变化用G'表示。如图6所示,对照组呈现出典型的肉蛋白动态弹性曲线,出现了两个转变峰,一个在50 ℃,另一个在57 ℃,在45~50 ℃形成初始弹性凝胶。在50 ℃时的峰值是由肌球蛋白的头-头交联引起的。而在57 ℃时出现了谷形,这是由于肌球蛋白在尾部聚集所引起的[35],后续随温度增加,G'值逐渐增加,形成了不可逆的凝胶网络结构。当EG浓度为20 mg/g时,G'峰值为140 Pa,是对照组(83 Pa)的1.7倍,最终G'峰值为996 Pa,是对照组峰值(326 Pa)的3.1倍,显著提升了凝胶的弹性。然而,当EG浓度为100 mg/g蛋白时,峰几乎消失,导致曲线趋于平滑,最终G'值降低,表明形成了弹性较差的凝胶网络结构,暴露了更多的疏水基团,发生了疏水聚集和变性,从而降低了G'值[36]。凝胶的结构和性质取决于蛋白质展开和聚集的相对速率。当展开速率超过聚集速率时,就会促进凝胶的形成,否则,就容易形成较粗的凝胶[37]。温度升高到58 ℃以上,三组(5、10、20 mg/g)凝胶的G'值迅速升高,但对照组和其余EG处理组(50和100 mg/g)的G'值升高缓慢。这与凝胶强度结果相一致,同时这些结果与Cao等[36]研究绿原酸与MP互作得到的结果相一致。即添加低剂量(20 mg/g)的EG促进了蛋白质之间的相互作用,并且促进了蛋白质结构展开,使更多的官能团(β-转角和β-折叠)参与到凝胶的形成过程当中,有利于蛋白凝胶化。
2.7 不同浓度丁香酚对蛋白乳液凝胶微观结构的影响
如图7所示。与高剂量EG凝胶(100 mg/g)相比,低剂量EG凝胶(20 mg/g)的基质更致密、均匀,孔隙更小。与对照组相比,添加低剂量EG(20 mg/g)的凝胶形成更紧密的凝胶网络结构,能够包含更多的水分,这与保水率的结果相一致。此外,凝胶紧密的网络结构能够承受更大的穿刺力,从而减少凝胶的蒸煮损失,提高凝胶的强度。当用高浓度EG(100 mg/g)处理凝胶时,凝胶出现了一些较大的裂缝,导致无法吸收更多的水分,尤其受到环境影响时,更容易造成水分的流失,这与冻融损失的结果相一致。因此,本研究发现,添加低浓度(20 mg/g)EG有利于形成高质量的肌原纤维复合凝胶。贾娜等[33]在研究没食子酸对肌原纤维蛋白凝胶微观结构的影响时发现,添加低剂量(10 µmol/g)的没食子酸时,凝胶网络结构更加紧密、光滑,而添加高剂量(200 µmol/g)时发现凝胶变得粗糙、松散,是由于高剂量的没食子酸抑制了蛋白之间的交联,使蛋白胶束分布不均匀所导致的,这与本实验研究结果相一致。
2.8 低、高浓度丁香酚与肌原纤维蛋白分子互作模式的预测
图8是基于以上的研究结果,总结了不同浓度EG可能影响肌原纤维蛋白乳化凝胶特性的潜在机制。当不添加EG时,蛋白结构未受到EG的影响,乳化后,形成较大的油滴,加热后可形成一个有序的凝胶网络结构,但凝胶中油滴粒径较大。当添加低浓度EG时,其与蛋白和脂肪的界面发生作用,形成的油滴粒径显著减小且均匀,凝胶形成了更紧密的网络结构,这可能是由于EG与MP相互作用,促进了蛋白质展开,暴露了较多的结合位点,使肌原纤维蛋白之间相互交联,形成了更紧密有序的网络结构。然而,当样品中加入高浓度EG时,过量的EG促使蛋白质的结构进一步展开,并与蛋白质的侧链基团相互作用,而后,在机械力的作用下,油滴进一步变小,数量急剧增加,表面积增大,需要更多的蛋白将其包裹,加热后,EG阻碍了蛋白之间的成胶交联,导致形成孔隙较大、粗糙的凝胶。
3. 结论
通过添加不同浓度的EG对蛋白二级结构和凝胶特性影响的结果得出,与对照组相比,添加低剂量的EG(20 mg/g),不仅可以显著提高凝胶强度、保水率(P<0.05)、β-转角和β-折叠的相对含量,还可以显著降低凝胶的冻融损失、蒸煮损失(P<0.05),并且使凝胶的网络结构更加紧密,有效地保护水分不流失。然而,当添加高剂量的EG(100 mg/g)时,明显降低了凝胶的保水率、凝胶强度并且增加了凝胶的冻融损失、蒸煮损失,流变曲线的两个转变峰消失。总的来说,添加低浓度的EG(20 mg/g)可以提高蛋白凝胶特性,添加高浓度EG(100 mg/g)不利于蛋白凝胶化,可能是高剂量的EG促使蛋白质聚集沉淀,从而使凝胶形成了孔隙较大的凝胶网络结构,不利于凝胶形成。本实验筛选出了EG的最佳添加量(20 mg/g),可为乳化肉制品的品质提升提供新思路。
-
图 3 不同浓度丁香酚对蛋白乳液凝胶强度(A)和蒸煮损失(B)的影响
注:不同小写字母表示差异显著(P<0.05),图4同。
Figure 3. Effects of different concentrations of eugenol on gel strength (A) and cooking loss (B) of protein emulsion
-
[1] JIANG S, CAO C, XIA X, et al. Enhancement of the textural and gel properties of frankfurters by adding thermos-reversible or thermos-irreversible curdlan gels[J]. Journal of Food Science,2019,84(5):1068−1077. doi: 10.1111/1750-3841.14595
[2] CHEN Y, JIA X, SUN F, et al. Using a stable pre-emulsified canola oil system that includes porcine plasma protein hydrolysates and oxidized tannic acid to partially replace pork fat in frankfurters[J]. Meat Science,2020,160:107968. doi: 10.1016/j.meatsci.2019.107968
[3] DICKINSON E. Emulsion gels:The structuring of soft solids with protein-stabilized oil droplets[J]. Food Hydrocolloids,2012,28(1):224−241. doi: 10.1016/j.foodhyd.2011.12.017
[4] HAN Z, XU S, SUN J, et al. Effects of fatty acid saturation degree on salt-soluble pork protein conformation and interfacial adsorption characteristics at the oil/water interface[J]. Food Hydrocolloids,2021,113:106472. doi: 10.1016/j.foodhyd.2020.106472
[5] SANTHI D, KALAIKANNAN A, SURESHKUMAR S. Factors influencing meat emulsion properties and product texture:A review[J]. Critical Reviews in Food Science and Nutrition,2017,57(10):2021−2027. doi: 10.1080/10408398.2013.858027
[6] BORTNOWSKA G. Effects of composition and storage time of biopolymers-based emulsion-filled gels on the retention and release of aroma compounds:Thermodynamic and kinetic studies[J]. Food Chemistry,2022,382:132308. doi: 10.1016/j.foodchem.2022.132308
[7] JIANG Y, ZHANG C, ZHAO X, et al. Recovery of emulsifying and gelling protein from waste chicken exudate by using a sustainable pH-shifting treatment[J]. Food Chemistry,2022,387:132886. doi: 10.1016/j.foodchem.2022.132886
[8] WANG S, ZHANG Y, CHEN L, et al. Dose-dependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J]. Food Chemistry,2018,243:50−57. doi: 10.1016/j.foodchem.2017.09.114
[9] HAN Z, LI X, LIU Y, et al. The evolution of pork myosin aggregates and the relationship between aggregation modes and microstructures of O/W emulsions[J]. Food Hydrocolloids,2021,119:106825. doi: 10.1016/j.foodhyd.2021.106825
[10] MIAO J, XU N, CHENG C, et al. Fabrication of polysaccharide-based high internal phase emulsion gels:Enhancement of curcumin stability and bioaccessibility[J]. Food Hydrocolloids,2021,117:106679. doi: 10.1016/j.foodhyd.2021.106679
[11] El-MAATI M F A, MAHGOUB S A, LABIB S M, et al. Phenolic extracts of clove (Syzygium aromaticum) with novel antioxidant and antibacterial activities[J]. European Journal of Integrative Medicine,2016,8(4):494−504. doi: 10.1016/j.eujim.2016.02.006
[12] CHEN H, MA J, PAN D, et al. Concentration-dependent effect of eugenol on porcine myofibrillar protein gel formation[J]. Meat Science,2023,201:109187. doi: 10.1016/j.meatsci.2023.109187
[13] HU L, SHI L, LIU S, et al. Regulation mechanism of curcumin-loaded oil on the emulsification and gelation properties of myofibrillar protein:Emphasizing the dose-response of curcumin[J]. Food Chemistry,2023:136687.
[14] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry,2007,101(3):1239−1246. doi: 10.1016/j.foodchem.2006.03.028
[15] LI X, FAN M, HUANG Q, et al. Effect of micro-and nano-starch on the gel properties, microstructure and water mobility of myofibrillar protein from grass carp[J]. Food Chemistry,2022,366:130579. doi: 10.1016/j.foodchem.2021.130579
[16] MA J, PAN D, DONG Y, et al. The effectiveness of clove extract on oxidization-induced changes of structure and gelation in porcine myofibrillar protein[J]. Foods,2022,11(13):1970. doi: 10.3390/foods11131970
[17] ZHAO X, WU T, XING T, et al. Rheological and physical properties of O/W protein emulsions stabilized by isoelectric solubilization/precipitation isolated protein:The underlying effects of varying protein concentrations[J]. Food Hydrocolloids,2019,95:580−589. doi: 10.1016/j.foodhyd.2018.03.040
[18] CHRN B, ZHOU K, WANG Y, et al. Insight into the mechanism of textural deterioration of myofibrillar protein gels at high temperature conditions[J]. Food Chemistry,2020,330:127186. doi: 10.1016/j.foodchem.2020.127186
[19] TAHMASEBI M, LABBAFI M, EMAM-DJOMEH Z, et al. Manufacturing the novel sausages with reduced quantity of meat and fat:The product development, formulation optimization, emulsion stability and textural characterization[J]. LWT-Food Science and Technology,2016,68:76−84. doi: 10.1016/j.lwt.2015.12.011
[20] DING J, ZHAO X, LI X, et al. Effects of different recovered sarcoplasmic proteins on the gel performance, water distribution and network structure of silver carp surimi[J]. Food Hydrocolloids,2022,131:107835. doi: 10.1016/j.foodhyd.2022.107835
[21] ZHU Y, MCClEMENTS D J, ZHOU W, et al. Influence of ionic strength and thermal pretreatment on the freeze-thaw stability of Pickering emulsion gels[J]. Food Chemistry,2020,303:125401. doi: 10.1016/j.foodchem.2019.125401
[22] AURSAND I G, GALLART-JORNET L, ERIKSON U, et al. Water distribution in brine salted cod (Gadus morhua) and salmon (Salmo salar):A low-field 1H NMR study[J]. Journal of Agricultural and Food Chemistry,2008,56(15):6252−6260. doi: 10.1021/jf800369n
[23] LI C, XIONG Y L, CHEN J. Oxidation-induced unfolding facilitates myosin cross-linking in myofibrillar protein by microbial transglutaminase[J]. Journal of Agricultural and Food Chemistry,2012,60(32):8020−8027. doi: 10.1021/jf302150h
[24] XIA X, KONG B, XIONG Y, et al. Decreased gelling and emulsifying properties of myofibrillar protein from repeatedly frozen-thawed porcine longissimus muscle are due to protein denaturation and susceptibility to aggregation[J]. Meat Science,2010,85(3):481−486. doi: 10.1016/j.meatsci.2010.02.019
[25] PAN D, MA J, DIAO J, et al. Effects of eugenol on the structure and gelling properties of myofibrillar proteins under hydroxyl radical-induced oxidative stress[J]. Food Chemistry:X,2023,20:100946.
[26] HE D, YI X, XIA G, et al. Effects of fish oil on the gel properties and emulsifying stability of myofibrillar proteins:A comparative study of tilapia, hairtail and squid[J]. LWT-Food Science and Technology,2022,161:113373. doi: 10.1016/j.lwt.2022.113373
[27] 裘乐芸, 邢倩, 邓泽元, 等. 植物多酚与鲢鱼肌球蛋白相互作用及其对肌原纤维蛋白结构和凝胶形成的影响[J]. 中国食品学报,2019,21(5):48−56. [QIU L Y, XING Q, DENG Z Y, et al. Interaction of plant polyphenols with silver carp myosin and its effect on the structure and gel formation of myofibrillar protein[J]. Journal of Chinese Institute of Food Science and Technology ,2019,21(5):48−56.] QIU L Y, XING Q, DENG Z Y, et al. Interaction of plant polyphenols with silver carp myosin and its effect on the structure and gel formation of myofibrillar protein[J]. Journal of Chinese Institute of Food Science and Technology , 2019, 21(5): 48−56.
[28] 张风雪. 亚麻籽胶对儿茶素-肌原纤维蛋白互作的抑制作用及乳化凝胶特性的影响[D]. 锦州:渤海大学, 2019. [ZHANG F X. Inhibition of linseed gum on catechin-myofibrin interaction and effect of emulsification gel properties[D]. Jinzhou:Bohai University, 2019.] ZHANG F X. Inhibition of linseed gum on catechin-myofibrin interaction and effect of emulsification gel properties[D]. Jinzhou: Bohai University, 2019.
[29] SUN J, LIU W, FENG M, et al. Characterization of olive oil emulsions stabilized by flaxseed gum[J]. Journal of Food Engineering,2019,247:74−79. doi: 10.1016/j.jfoodeng.2018.11.023
[30] ZHUANG X, HAN M, JIANG X, et al. The effects of insoluble dietary fiber on myofibrillar protein gelation:Microstructure and molecular conformations[J]. Food Chemistry,2019,275:770−777. doi: 10.1016/j.foodchem.2018.09.141
[31] JONGBERG S, TERKELSEN L S, MIKLOS R, et al. Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J]. Meat Science,2015,100:2−9. doi: 10.1016/j.meatsci.2014.09.003
[32] HUANG H, BELWAL T, AALIM H, et al. Protein-polysaccharide complex coated W/O/W emulsion as secondary microcapsule for hydrophilic arbutin and hydrophobic coumaric acid[J]. Food Chemistry,2019,300:125171. doi: 10.1016/j.foodchem.2019.125171
[33] 贾娜, 林世文, 王乐田, 等. 没食子酸诱导肌原纤维蛋白巯基含量和表面疏水性变化对蛋白凝胶特性的影响[J]. 食品科学,2020,41(22):1−7. [JIA N, LIN S W, WANG L T, et al. Effects of gallic acid induced changes of mercapto content and surface hydrophobicity on gel properties of myofibrillar protein[J]. Food Science,2020,41(22):1−7.] JIA N, LIN S W, WANG L T, et al. Effects of gallic acid induced changes of mercapto content and surface hydrophobicity on gel properties of myofibrillar protein[J]. Food Science, 2020, 41(22): 1−7.
[34] 孙领鸽, 毛晓英, 吴庆智, 等. 蛋白质氧化对核桃蛋白界面性质的影响[J]. 中国食品学报,2020,20(9):59−66. [SUN L G, MAO X Y, WU Q Z, et al. Effect of protein oxidation on the interfacial properties of walnut proteins[J]. Journal of Chinese Institute of Food Science and Technology ,2020,20(9):59−66.] SUN L G, MAO X Y, WU Q Z, et al. Effect of protein oxidation on the interfacial properties of walnut proteins[J]. Journal of Chinese Institute of Food Science and Technology , 2020, 20(9): 59−66.
[35] JIA N, LIN S, ZHANG F, et al. Improved effect of flaxseed gum on the weakened gelling properties of myofibrillar protein induced by catechin[J]. Food Chemistry,2022,372:131136. doi: 10.1016/j.foodchem.2021.131136
[36] CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry,2015,180:235−243. doi: 10.1016/j.foodchem.2015.02.036
[37] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡:江南大学, 2016. [CAO Y G. Effect mechanism and application of plant polyphenols on oxidative stability and functional properties of meat proteins[D]. Wuxi:Jiangnan University, 2016.] CAO Y G. Effect mechanism and application of plant polyphenols on oxidative stability and functional properties of meat proteins[D]. Wuxi: Jiangnan University, 2016.






 下载:
下载:





 下载:
下载:



