Antifungal Activity of Essential Oil Isolated from Pelargonium roseum against Grey Mould (Botrytis cinerea) of Cherry Tomato
-
摘要: 为探究玫瑰天竺葵挥发油的化学成分及其对樱桃番茄灰霉病菌的抑菌活性,以评价其作为合成化学杀菌剂的潜在替代品对果蔬采后保鲜的效果。采用水蒸气蒸馏法提取玫瑰天竺葵挥发油,利用气相色谱-质谱联用(GC-MS)分析其化学成分,并通过接触法和熏蒸法测定不同浓度玫瑰天竺葵挥发油及其主要单体化合物对灰葡萄孢菌菌丝生长和孢子萌发的抑制作用。研究结果表明,玫瑰天竺葵挥发油的提取率为0.43%;共鉴定出19个单体化合物,主要成分为香茅醇(52.16%)、橙花醇(21.93%)、甲酸香茅酯(9.87%)和异薄荷醇(5.18%);玫瑰天竺葵挥发油及其单体化合物对菌丝的生长和孢子的萌发均具有显著的抑制作用(P<0.05),且熏蒸法的抑菌活性显著优于接触法,挥发油的使用剂量与抑菌活性间具有剂效关系。在活体熏蒸试验中,玫瑰天竺葵挥发油及其单体化合物对樱桃番茄采后的灰霉病均具有良好的控制效果,当挥发油用量为250.00 mg/L时,抑制率高达98.45%。结果表明,玫瑰天竺葵挥发油具有用作果蔬控病保鲜熏蒸剂的潜力,但其作用机制尚有待进一步研究。Abstract: To investigate the chemical composition of Pelargonium roseum essential oil (EO) and its antifungal activities against Botrytis cinerea of cherry tomato as a potential alternative to synthetic chemical fungicides for postharvest preservation of fruits and vegetables. In this study, the EO of P. roseum was extracted by water vapor distillation, and the chemical components were determined by gas chromatography-mass spectrometry (GC-MS). The inhibitory effects of different concentrations of the EO and its compounds on the growth of mycelium and the germination of spores were determined by the poison food technique and dual culture method, respectively. Results showed that the extraction rate of P. roseum EO was 0.43%, and 19 compounds were identified in the EO. The major constituent was citronellol (52.16%) followed by nerol (21.93%), citronellyl formate (9.87%), and isomenthol (5.18%). And the EO and its compounds had a significant inhibitory effect (P<0.05) on growth of mycelium and germination of spores against B. cinerea. The inhibitory activity of the dual culture method was much better than that of the poison food technique. There was a dosage-effect relationship between the dosage of the EO and inhibitory activity. In vivo vapor contact test results showed that the EO of P. roseum and its compounds had good inhibitory activity against the postharvest grey mould of cherry tomatoes, and the disease control rate was as high as 98.45% when the dosage of EO was 250.00 mg/L. Thus, the results obtained in this study demonstrate the potential of the EO from P. roseum as an eco-friendly natural fungicide using for postharvest disease control, but its mechanism of action needs to be further investigated.
-
Keywords:
- Pelargonium roseum /
- essential oil /
- chemical composition /
- Botrytis cinerea /
- antifungal activity
-
樱桃番茄因其较高的营养价值和柔软多汁的特点而深受消费者的喜爱。但是由于含水量高,在其采后储藏运输过程中极易受到灰葡萄孢菌的侵袭而发生霉变,造成不小的经济损失。灰葡萄孢菌(Botrytis cinerea)是一种植物病原真菌,其引起的灰霉病是蔬菜水果采后的主要病害[1]。灰葡萄孢菌通过产生一系列的细胞壁降解酶、毒素和其他低分子化合物,触发宿主诱导细胞程序性死亡[2]。灰霉病原菌没有明显的寄主特异性,可以感染1000多种植物[3]。目前,控制灰霉病的主要方法依旧是使用化学杀菌剂。但是灰霉病病原菌基因突变发生迅速,病原菌抗性易在田间发展[4]。有研究表明,灰葡萄孢菌分离株已经对苯并咪唑、二甲酰亚胺、环己酰胺和苯胺嘧啶等杀菌剂产生了一些特异性抗性[5]。因此,开发一种能控制采后病原菌的新型无污染、低毒、低残留的化学杀菌剂替代品尤为重要。
大量研究结果表明,利用天然抗真菌化合物来保护水果采后免受病原菌的侵害是一个潜在趋势。许多植物挥发油已经被证明具有抗菌、杀虫、抗氧化和除草的活性,如小叶女贞挥发油被证明对绿霉具有抗真菌活性[6]。茶树精油可有效防控番茄早疫病[7]。柠檬草、棕榈油、肉桂和薄荷挥发油等能够抑制番茄灰霉病菌的生长[8];含桉树挥发油的羧甲基纤维素涂膜可有效控制番茄灰霉病和草莓软腐病的发生[9]。植物挥发油又被称为精油(Essential oils),是从植物材料(花、种子、叶、树皮、果皮和根等)中提取的具有芳香性和挥发性的脂溶性物质[10−11]。在植物界中,只有10%的植物含有挥发油,它们被称为芳香植物[12]。据估计,已知挥发油将近3000种,其中约300种被用于香料和香精市场[13]。挥发油的组成成分取决于物种、收获时期、气候以及提取挥发油所用的植物部位等[14]。
玫瑰天竺葵是天竺葵属多年生草本芳香植物,原产于南非、留尼旺岛、马达加斯加、埃及和摩洛哥等地[15]。除了作为观赏植物被种植外,其挥发油还是使用最广泛的香料之一,是玫瑰香水和香皂不可缺少的组成部分[16]。天竺葵挥发油具有抗菌、阵痛、消炎和杀虫等多种活性。Dianez等[17]发现天竺葵挥发油对番茄灰霉病菌、菌核病菌、尖孢镰刀菌、寄生疫霉、瓜果腐霉、油菜交链孢霉均具有抑制作用。El等[18]研究发现,玫瑰天竺葵挥发油对由灰葡萄孢菌、扩展青霉和匍枝根霉菌引起的苹果病害具有良好的控制效果,挥发油的抗真菌作用与挥发油浓度直接相关;Kujur等[19]通过研究纳米微囊化天竺葵挥发油对黄曲霉生长的抑制效果,发现天竺葵挥发油通过降低黄曲霉中麦角甾醇的含量抑制黄曲霉毒素的产生。本文旨在通过离体和活体试验初步探究玫瑰天竺葵挥发油对樱桃番茄灰霉病的抑制效果,为玫瑰天竺葵挥发油在果实采后保鲜的应用中提供理论基础。
1. 材料与方法
1.1 材料与仪器
玫瑰天竺葵(Pelargonium roseum)地上部分 采自云南省昆明市和云南省楚雄;灰葡萄孢菌(Botrytis cinerea) 为云南省植物病理重点试验室保藏菌种;无水硫酸钠 分析纯,天津市风船化学试剂科技有限公司;80%乙蒜素 乳油,开封大地农化生物科技有限公司;50%多菌灵 可湿性粉剂,江苏蓝丰生物化工股份有限公司;97%香茅醇、98%橙花醇 萨恩化学技术(上海)有限公司;95%甲酸香茅酯 上海麦克林生化科技股份有限公司;樱桃番茄(Lycopersicon esculentum) 采摘自微生物菌种筛选与应用国家地方联合工程研究中心试验温室。
HX2002Z型电子天平 慈溪市天东衡器厂;BCE224l-1CCN型电子天平 赛多利斯科学仪器(北京)有限公司;98-I-C型电热套 天津市泰斯特仪器有限公司;JJ-CJ-1F型洁净工作台 苏州市金净净化设备科技有限公司;LRH-250-G型光照培养箱 韶关市宏泰医疗器械有限公司;DLSB-5L/25型低温冷却循环泵 巩义市予华仪器有限责任公司;Agilent 7890型气相色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 玫瑰天竺葵挥发油的提取
使用水蒸气蒸馏装置对玫瑰天竺葵挥发油进行提取。准确称取400 g新鲜玫瑰天竺葵叶片花序混合物,按1:10的比例加入4000 mL纯净水,持续沸腾提取4 h。关闭装置,静置一段时间后,取上层油状液体,加入无水硫酸钠脱水,将玫瑰天竺葵挥发油转移至棕色样品瓶中,称重,密封保存于4 ℃冰箱备用。挥发油提取率计算公式如下:
挥发油提取率 (%)= 提取的挥发油质量 原材料质量 ×100 (1) 1.2.2 玫瑰天竺葵挥发油化学成分分析
用正己烷将1.2.1得到的玫瑰天竺葵挥发油制备成1.0 mg/mL的溶液。使用GC-MS进行化学成分分析。气相色谱条件:HP-5MS石英毛细管柱(内径30 m×0.25 mm,膜厚0.25 μm);进样口温度230 ℃,检测器温度260 ℃。柱温:初温40 ℃,保温2 min,5 ℃·min−1升温至250 ℃,保持6 min,柱流量1.0 mL·min−1。注射量为1.0 μL;分流比为10:1。质谱条件:电离模式EI;电离能70 eV,四级杆温度150 ℃;离子源温度:230 ℃;接口温度:280 ℃;扫描质量范围:50~550 m/z,氦气(He)流量为1.0 mL·min−1;溶剂延迟6 min。从NIST 08年标准谱库中检索并分析数据。
1.2.3 离体抑菌试验
1.2.3.1 菌丝生长抑制试验
接触法:待PDA培养基冷却至45±5 ℃时,向PDA培养基中加入一定量的玫瑰天竺葵挥发油和单体化合物摇匀,使其最终浓度分别为3.90、7.80、15.63、31.25、62.50、125.00、250.00 mg/L,将配制好的培养基加到无菌培养皿中(直径9 cm),每皿20 mL,以未添加挥发油和单体化合物的处理作为阴性对照,相同方法配制含有同等浓度多菌灵-PDA培养基,以此作为阳性对照。每个处理3次重复。用无菌打孔器打取直径5 mm的病原菌菌饼,将其接种于培养基中央,于25±1 ℃培养箱中黑暗条件下培养7 d后通过十字交叉法测量菌丝生长直径[20]。
熏蒸法:使用滤纸片法[18]探究玫瑰天竺葵挥发油及其单体化合物的抗真菌活性。于直径9 cm的无菌培养皿中加入20 mL PDA培养基,用无菌打孔器打取直径5 mm的病原菌菌饼,将其接种于培养基中央。将培养皿倒置,另一侧盖内放置无菌滤纸片(直径3.30 cm),用微量进样器取一定体积的玫瑰天竺葵挥发油和单体化合物注射到无菌滤纸片上,使每皿最终浓度分别为3.90、7.80、15.63、31.25、62.50、125.00、250.00 mg/L(浓度以培养皿的顶空体积计算),用封口膜密封,进行对扣熏蒸试验,以未添加挥发油和单体化合物的处理作为阴性对照,添加同等浓度的80%乙蒜素乳油的处理作为阳性对照,每个处理三次重复。25±1 ℃培养箱中黑暗条件下培养7 d后通过十字交叉法测量菌丝生长直径。菌丝生长抑制率计算公式如下:
菌丝生长抑制率 (%)=对照组菌丝平均直径−处理组菌丝平均直径对照组菌丝平均直径×100 (2) 毒力回归方程计算:将式(2)中得到的菌丝生长抑制率转化为概率值(Y),并对挥发油及其单体化合物的浓度(X)进行对数转化。然后,将得到的X和Y分别输入GraphPad Prism 9.0.中进非线性回归生成剂量反应曲线的方程/模型。当Y=5时,X的对数值即为EC50值。
1.2.3.2 孢子萌发抑制试验
接触法:待病原菌培养一周后,在病原菌平板中加入5 mL无菌蒸馏水,使用无菌涂布器刮洗病原菌分生孢子,然后使用无菌擦镜纸将菌丝滤除,得到病原菌分生孢子悬浮液。使用血球计数板计数评估分生孢子悬浮液浓度,用无菌蒸馏水将分生孢子悬浮液浓度调至1.0×106 CFU/mL。吸取5 mL马铃薯肉汤培养基(PDB)加入到10 mL无菌离心管中,然后将一定量的天竺葵挥发油和单体化合物加入到PDB培养基中,使其终浓度分别为3.90、7.80、15.63、31.25、62.50、125.00、250.00 mg/L,以不含挥发油和单体化合物的处理为对照组,将200 μL分生孢子悬浮液(1.0×106 CFU/mL)添加到离心管中,每个处理3次重复,25±1 ℃培养箱中黑暗条件下培养48 h。48 h后通过光学显微镜观察100个分生孢子的萌发情况,孢子完全没有萌发的最低浓度定义为最低抑菌浓度(MIC)。从孢子未萌发的离心管中吸取100 μL溶液,并将其重新接种到仅含有PDB培养基的无菌离心管中,将离心管置于同等条件下继续培养48 h,病原菌孢子完全没有萌发的最低浓度为最低杀菌浓度(MFC)[20]。
熏蒸法:于直径9 cm的无菌培养皿中加入20 mL PDA培养基,吸取10 μL分生孢子悬浮液(1.0×106 CFU/mL),接种于PDA平板中央,待干燥后将培养皿倒置,另一侧盖内放置无菌滤纸片(直径3.30 cm),用微量进样器取一定体积的天竺葵挥发油和单体化合物注射到无菌滤纸片上,使每皿最终浓度分别为3.90、7.80、15.63、31.25、62.50、125.00、250.00 mg/L,用封口膜密封,进行对扣熏蒸试验,未添加挥发油和单体化合物的培养皿作为对照组,每个处理三次重复。25±1 ℃培养箱中黑暗条件下培养48 h后观察病原菌孢子萌发情况,记录完全抑制孢子萌发的MIC,于无菌操作台中取出滤纸片,吹净培养皿中的挥发油,同等培养条件下再次密封培养48 h,观察记录没有孢子萌发的MFC。
1.2.4 活体抑菌试验
按照文献[20]的方法进行改进。对新采摘的外观完整、大小均匀的成熟樱桃番茄果实用自来水冲洗,晾干后用75%乙醇浸泡消毒1 min,取出果实将表面酒精用无菌脱脂棉纱布擦净。用无菌注射器针头在果实表面刺一个孔,吸取10 μL病原菌分生孢子悬浮液(1.0×106 CFU/mL)注射到伤口处。在650 mL密闭容器底部平铺3层无菌脱脂棉纱布,加入15 mL无菌水保湿,将接种后的果实放置于密闭容器内,将无菌滤纸圆片(直径3.30 cm)置于塑料三角支撑架(高4 cm,直径4 cm)上,将一定量的天竺葵挥发油和单体化合物添加到无菌滤纸片上,使其终浓度分别为3.90、7.80、15.63、31.25、62.50、125.00、250.00 mg/L(浓度以密闭容器的顶空体积计算),以未添加挥发油和单体化合物的处理作为阴性对照,添加了同等浓度的80%乙蒜素乳油的处理作为阳性对照,容器密封后储存于25±1 ℃培养箱中,每个处理10个果实,三次重复测定。待对照组病原菌完全覆盖果实表面后,使用游标卡尺通过十字交叉法测量果实病斑面积。病斑面积及抑制率计算公式如下:
病班面积 =π×a×b (3) 抑制率(%)=对照组平均病斑面积−处理组平均病斑面积对照组平均病斑面积×100 (4) 式中:a表示果实腐烂处的垂直直径,mm;b表示果实腐烂处的水平直径,mm。
1.3 数据处理
使用Excel 2016进行数据处理,IBM SPSS Statistics 23进行差异显著性分析,GraphPad Prism 9.0进行统计分析与作图。
2. 结果与分析
2.1 玫瑰天竺葵挥发油提取及化学成分分析
通过水蒸气蒸馏法对玫瑰天竺葵的叶片及花序进行提取,得到的挥发油呈现蓝绿色且带有玫瑰香气,其得率为0.43%,这与李珊珊等[21]研究结果有较大差异,可能是受到材料类型、季节变化、栽培环境、收获时间、地理变化以及挥发油的提取和储存方法等的影响[22]。
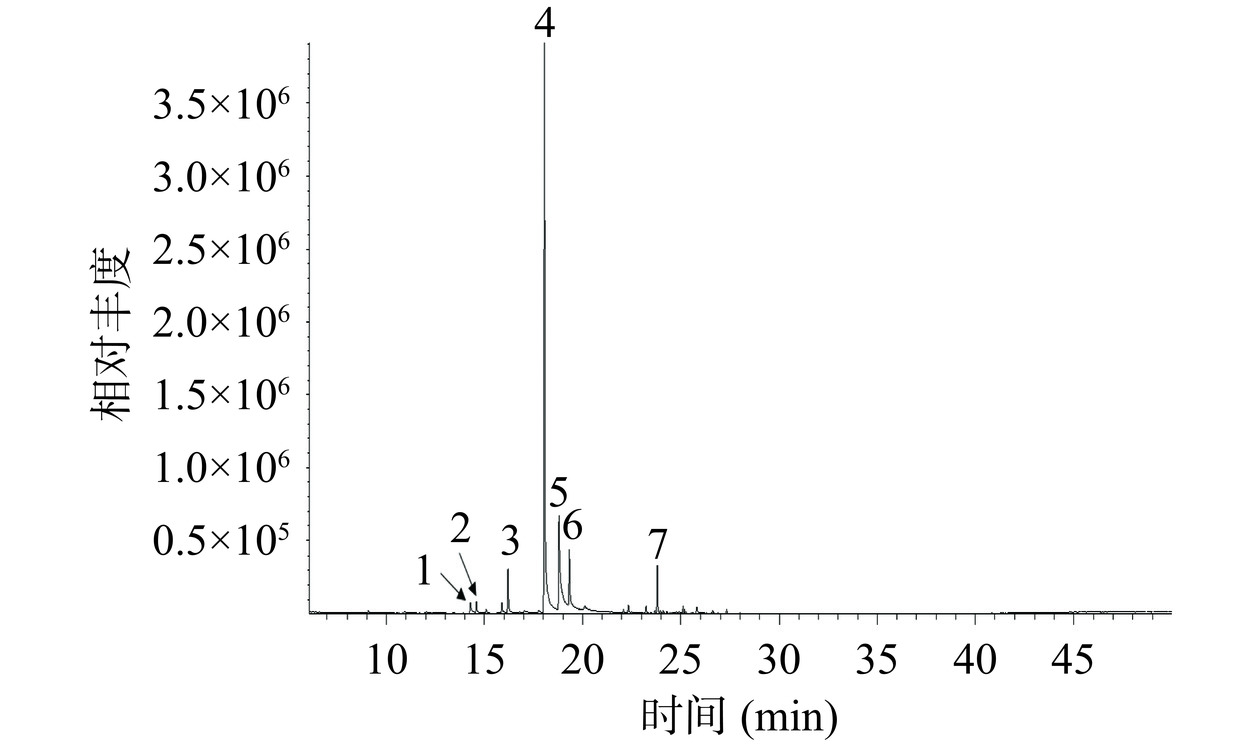
经过水蒸气蒸馏法提取得到的玫瑰天竺葵挥发油按照1.2.2中提及的GC-MS方法进行检测,得到的总离子流图如图1所示,将其与NIST 08标准谱库进行比对,得到挥发油中的各化学成分如表1所示。从玫瑰天竺葵挥发油中共鉴定出19种化合物,均为萜类化合物。其中香茅醇(52.16%)、橙花醇(21.93%)和甲酸香茅酯(9.87%)含量较高,此外还有6,9-愈创木二烯、异薄荷酮、芳樟醇和左旋玫瑰醚(含量均高于1%)。这与Azhdarzadeh等[23]的研究结果有所不同,他们分析发现伊朗南部的玫瑰天竺葵挥发油主要成分为香茅醇(44.63%)、甲酸香茅酯(14.22%)、异薄荷酮(6.34%)、香叶醇(5.30%)和石竹烯(3.55%)。且在以往的研究中,橙花醇并非玫瑰天竺葵挥发油的主要成分[24]。
表 1 玫瑰天竺葵挥发油的化学成分Table 1. Chemical components of P. roseum EO序号 化合物名称 英文名称 保留时间
(min)保留指数 百分含量
(%)主要碎片离子(m/z) 1 α-蒎烯 α-Pinene 9.079 939 0.165 93(99.9);91(46.8);92(41.4);39(38.5);77(36.6);41(31.8);79(29.8);27(28.6);53(13.9);29(12.5) 2 芳樟醇 Linalool 14.286 1082 1.443 71(99.9);93(61.0);41(57.1);43(48.6);69(48.6);55(45.5);80(26.5);121(17.6);39(16.3);67(16.3) 3 左旋玫瑰醚 cis-Rose oxide 14.589 1095 1.191 139(99.9);69(65.7);83(26.5);55(23.2);41(20.2);85(12.3);67(12.0);154(11.0);39(10.2);84(10.0) 4 玫瑰醚 Rose oxide 15.094 1114 0.399 69(99.9);139(93.0);41(84.0);55(63.0);29(46.0);39(44.0);27(42.0);83(40.0);67(28.0);85(24.0) 5 异薄荷酮 Isomenthone 16.202 1157 5.181 112(99.9);69(91.4);41(88.5);55(57.9);70(41.9);56(38.7);139(37.5);43(36.0);97(31.2);27(29.2) 6 α-松油醇 α-Terpineol 17.032 1191 0.345 59(99.9);93(90.9);121(55.5);136(43.8);67(41.7);81(40.8);43(35.7);68(35.2);79(33.7);91(30.9) 7 香茅醇 Citronellol 18.060 1229 52.158 69(99.9);41(94.2);67(58.7);81(51.5);82(49.8);55(48.0);95(44.8);31(28.3);68(27.6);71(27.1) 8 橙花醇 Nerol 18.806 1255 21.93 69(99.9);41(93.4);93(34.8);68(24.5);39(20.1);67(15.8);27(13.8);29(12.9);53(12.8);84(11.8) 9 甲酸香茅酯 Citronelly formate 19.332 1273 9.865 41(99.9);69(97.7);55(60.2);81(38.5);95(38.1);67(36.2);82(36.2);68(35.7);123(24.5);56(22.8) 10 大根香叶烯 Germacrene D 22.094 1367 0.206 161(99.9);105(77.5);91(68.5);41(61.9);119(60.4);79(41.5);81(41.4);93(35.9);77(34.6);27(31.5) 11 β-波旁烯 (-)-β Bourbonene 22.344 1388 0.552 81(99.9);80(73.7);123(57.4);161(24.9);79(20.9);41(17.5);105(10.5);91(9.5);77(8.4);55(7.8) 12 石竹烯 Caryophyllene 23.244 1421 0.536 41(99.9);69(97.6);93(93.7);133(64.6);79(61.4);91(55.1);55(43.2);81(38.9);107(38.9);105(37.2) 13 6,9-愈创木二烯 Guaia-6,9-diene 23.815 1454 3.539 105(99.9);119(60.9);161(43.6);91(37.6);133(26.0);107(24.9);204(23.3);147(20.8);41(19.8);93(19.5) 14 律草烯 Humulene 24.107 1459 0.240 93(99.9);41(33.9);80(32.3);121(28.8);55(18.7);43(16.8);92(15.5);69(14.5);107(14.5);79(14.2) 15 香橙烯 Aromandendrene 24.293 1463 0.214 41(99.9);91(67.8);79(50.7);105(50.2);93(45.5);39(43.4);77(36.5);107(36.5);67(35.8);55(35.4) 16 (+)-喇叭烯 (+)-Ledene 25.133 1492 0.689 107(99.9);41(96.6);105(93.8);93(87.2);91(77.5);161(72.7);135(58.5);119(57.2);79(56.5);81(56.4) 17 δ-杜松烯 Naphthalene 25.796 1511 0.659 161(99.9);134(57.8);119(50.1);204(47.4);105(46.9);81(25.5);159(24.8);91(24.5);41(22.8);93(20.7) 18 结晶玫瑰 Rosacetol 26.606 1534 0.33 107(99.9);149(37.3);43(30.7);77(14.2);79(13.0);105(8.0);102(7.5);108(7.1);51(6.3);172(5.9) 19 呋喃哌啶酮 Furopelargone A 27.320 1550 0.358 43(99.9);163(59.5);234(51.3);123(47.0);149(43.1);191(42.6);109(39.0);91(27.8);121(23.9);81(22.8) 注:主要碎片离子栏中的X(Y):X:碎片离子的m/z;Y:碎片离子的相对丰度。 2.2 离体抑菌试验
2.2.1 菌丝生长抑制
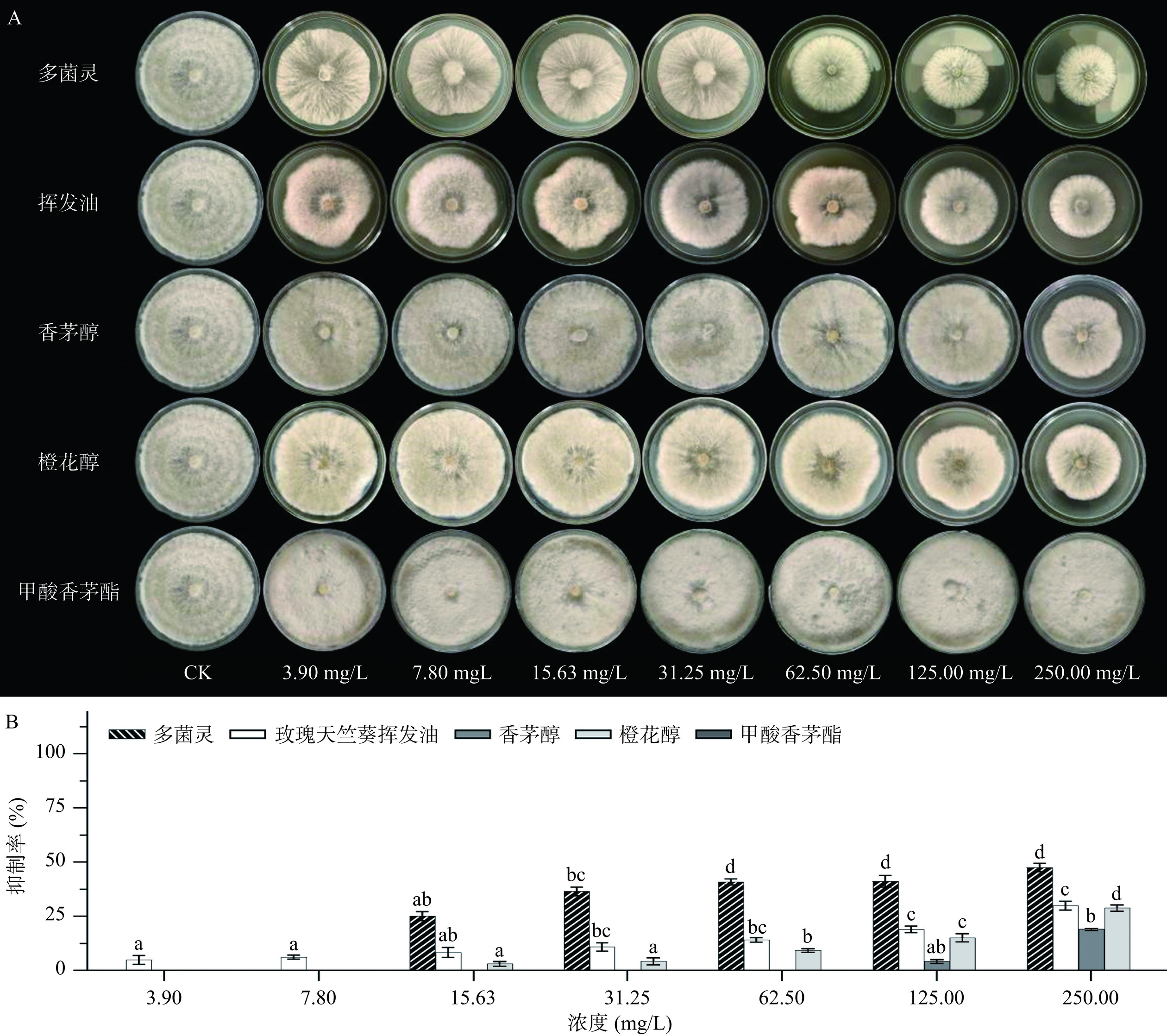
相关研究表明,玫瑰天竺葵挥发油对多种植物病原真菌具有良好的生防效果[18]。通过对玫瑰天竺葵挥发油成分的分析,根据挥发油中单体化合物的占比和易获得性选择了香茅醇、橙花醇和甲酸香茅酯进行灰葡萄孢菌的离体抑菌实验。根据接触法和熏蒸法测定了不同浓度的玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长的影响,表2列出了在25±1 ℃黑暗条件下培养7 d后灰葡萄孢菌菌丝的生长情况以及处理的EC50值和毒力回归曲线。结果表明,接触法和熏蒸法对灰葡萄孢菌菌丝均表现出一定的抑制效果,且呈剂量依赖关系。但是可以明显地看到,在相同浓度处理下,熏蒸法对灰葡萄孢菌菌丝的生长抑制效果远高于接触法(图2,图3)。这一现象可以解释为:一些化合物可以通过去除真菌的细胞膜来增强其渗透性[25]。此外,挥发油的疏水性质导致挥发油在琼脂介质和水中的溶解性都很弱。因此与直接接触相比,气态的挥发油更容易被真菌菌丝吸收[18]。由图2可知,在熏蒸法中玫瑰天竺葵挥发油的抑菌效果稍弱于香茅醇,说明香茅醇具有较强的抗真菌活性,可作为灰葡萄孢菌菌丝的生长抑制剂;此外,玫瑰天竺葵挥发油的抑菌活性显著强于橙花醇和甲酸香茅酯,说明挥发油的抗真菌活性不仅归因于其主要成分,挥发油中的次要化合物以及化合物之间的协同作用也可能会增强其抗真菌活性[26]。在Elouadi等[18]的研究中发现,当玫瑰天竺葵挥发油浓度为2 μL/mL时,其对灰葡萄孢菌具有杀菌作用,植物的种植及采收条件、受试菌株的差异,特别是精油主要成分含量的变化,可能是它们抗菌活性不同的原因。
表 2 玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长的毒力测定Table 2. EC50 values of the P. roseum EO and its individual compounds against the mycelial growth of B. cinerea处理 处理方法 毒力回归方程 R2 EC50
(mg/L)95%置信区间
(mg/L)阳性对照 接触法 Y=2.783X−0.7410 0.6935 14.21 2.842~21.93 熏蒸法 Y=2.118X+2.946 0.6679 6.93 4.152~10.01 玫瑰天竺葵
挥发油接触法 Y=0.596X+2.928 0.9710 1350 818.50~2782 熏蒸法 Y=3.569X+0.862 0.8474 26.96 16.68~42.39 香茅醇 接触法 Y=2.144X−1.918 0.6421 134.3 100.7~135.6 熏蒸法 Y=1.586X+2.958 0.9010 18.16 8.773~23.19 橙花醇 接触法 Y=2.442X−0.9334 0.8321 4037 − 熏蒸法 Y=4.059X+0.5893 0.8209 35.3 25.74~48.3 甲酸香茅酯 接触法 Y=0.2466 1 − − 熏蒸法 Y=3.611X+0.4788 0.7645 60.84 40.88~138.4 注:表中“−”表示未测得此数据。 ![]() 图 2 玫瑰天竺葵挥发油及其单体化合物熏蒸法对灰葡萄孢菌菌丝生长的影响注:A为玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长影响的实物图;B为玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长的抑制率对比图;图B中a,b,c,d等小写字母代表各组浓度抑制率数据间的差异显著性,具有相同标记字母的为差异不显著,具有不同标记字母的为差异显著(P<0.05),图3~图4同。Figure 2. Effects of the P. roseum EO and its individual compounds against mycelia growth of B. cinerea by fumigation
图 2 玫瑰天竺葵挥发油及其单体化合物熏蒸法对灰葡萄孢菌菌丝生长的影响注:A为玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长影响的实物图;B为玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长的抑制率对比图;图B中a,b,c,d等小写字母代表各组浓度抑制率数据间的差异显著性,具有相同标记字母的为差异不显著,具有不同标记字母的为差异显著(P<0.05),图3~图4同。Figure 2. Effects of the P. roseum EO and its individual compounds against mycelia growth of B. cinerea by fumigation2.2.2 孢子萌发抑制
将灰葡萄孢菌孢子在25±1 ℃培养箱中黑暗条件下培养48 h后测定孢子的萌发率。如表3所示,在接触法所设定的浓度范围内,未发现能够对灰葡萄孢菌孢子萌发起到完全抑制作用的药剂,所以未测得其MIC值和MFC值。不同于在熏蒸法对灰葡萄孢菌菌丝生长抑制的结果,在熏蒸法抑制灰葡萄孢菌孢子萌发的实验中,并未测得甲酸香茅酯对灰葡萄孢菌孢子萌发具有抑制作用。玫瑰天竺葵挥发油、香茅醇和橙花醇对灰葡萄孢菌孢子的萌发均具有较强的抑制作用,且玫瑰天竺葵挥发油的抑制效果强于单体化合物,其中香茅醇和橙花醇的MIC值和MFC值均相同,分别为15.63 mg/L和62.50 mg/L。熏蒸法比接触法更有效的原因可以解释为接触法中液相的亲脂分子结合形成胶束,从而抑制挥发油对病原菌孢子的附着,而熏蒸法中挥发油以气相分子发挥作用,气相的挥发油可以自由附着于病原菌孢子[26]。与之相似,Bouzenna等[27]发现含有大量香茅醇的天竺葵挥发油对立枯丝核菌具有高活性,因此单萜醇被认为增加了真菌质膜的通透性,抑制了线粒体膜的呼吸过程[28]。Li等[29]发现当橙花醇浓度为0.25 mL/L时,与对照组相比,橙花醇几乎完全抑制了甘薯长喙壳菌孢子的生长。Wang等[30]发现橙花醇对黑曲霉的抗真菌活性呈现剂量依赖关系,且气相的橙花醇对黑曲霉菌丝生长的抑制效果强于接触处理,浓度为1.25 μL/mL时其可完全抑制黑曲霉孢子的萌发。Felicia等[22]发现挥发油对病原菌的抑制机制主要是由于其独特的疏水性,其可以通过影响病原菌细胞代谢来影响病原菌菌丝增殖和孢子萌发。
表 3 玫瑰天竺葵挥发油及其单体化合物对灰霉病菌孢子萌发的MIC和MFCTable 3. Minimal inhibitory concentrations (MIC) and minimal fungicidal concentrations (MFC) of the P. roseum EO and its individual compounds against spore germination of B. cinerea化合物 接触法 熏蒸法 MIC(mg/L) MFC(mg/L) MIC(mg/L) MFC(mg/L) 玫瑰天竺葵挥发油 NF NF 3.90 31.25 香茅醇 NF NF 31.25 62.50 橙花醇 NF NF 31.25 62.50 甲酸香茅酯 NF NF NF NF 注:NF为在设定浓度范围内未发现抑制效果。 2.3 活体抑菌试验
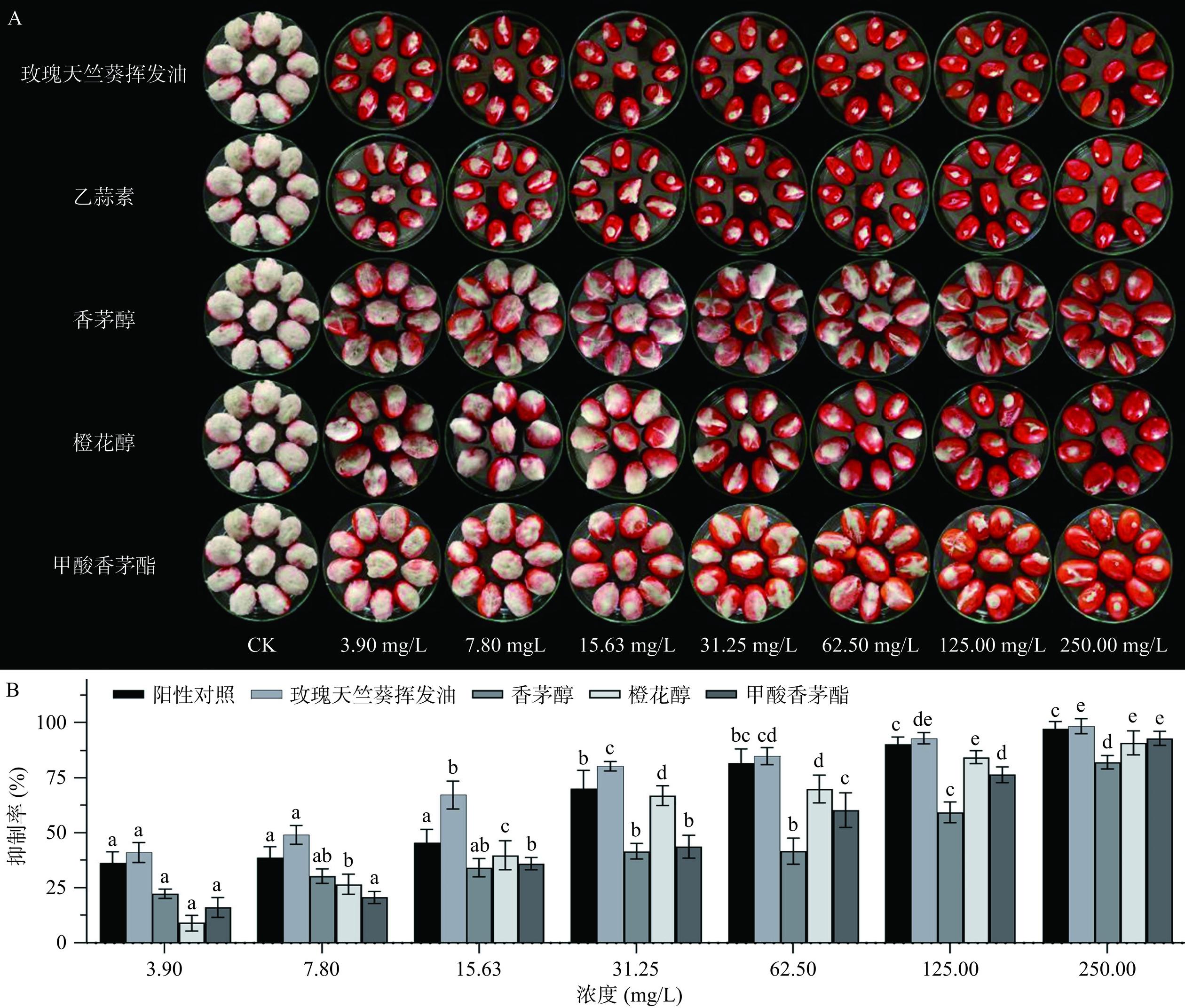
挥发油一大特性是其在气相中具有抑菌活性,这一特性使其适合作为储存新鲜产品的潜在熏蒸剂[31]。使用挥发油作为熏蒸剂可以克服浸渍过程中的污染问题,降低影响产品感官接受性的风险[24]。由图4可知,经玫瑰天竺葵挥发油熏蒸处理过的樱桃番茄果实,其灰霉病的严重程度及发病率随着处理浓度的增加显著降低(P<0.05) ,且挥发油对灰霉病的抑制效果显著强于单体化合物。玫瑰天竺葵挥发油的EC50值为7.79 mg/L(表4),当浓度为250.00 mg/L时,其抑制率为98.45%(图4)。经挥发油处理7 d后,樱桃番茄果实颜色鲜亮,硬度未发生改变,且带有轻微的玫瑰香气。
表 4 玫瑰天竺葵挥发油对及其单体化合物灰葡萄孢菌活体的毒力测定Table 4. EC50 values of the P. roseum EO and its individual compounds against B. cinerea on cherry tomatoes处理 毒力回归方程 R2 EC50
(mg/L)95%置信区间
(mg/L)乙蒜素
(阳性对照)Y=1.296X+3.621 0.9562 29.82 16.30~70.83 玫瑰天竺葵
挥发油Y=1.276X+3.911 0.9783 7.79 5.46~18.19 香茅醇 Y=1.223X−2.0551 0.9491 47.96 35.34~67.31 橙花醇 Y=1.452X+2.988 0.9739 23.06 19.62~26.94 甲酸香茅酯 Y=1.323X+3.039 0.9626 31.23 25.72~37.86 3. 结论
现代食品工业对天然、安全的杀菌剂作为防腐剂的需求日益增加。从植物中开发用于果蔬采后疾病控制的生物杀菌剂是一项具有挑战性的工作。本研究从玫瑰天竺葵挥发油中检测到大量香茅醇(59.99%)、橙花醇(18.20%)和甲酸香茅酯(5.91%)。结果表明,玫瑰天竺葵挥发油及其单体化合物香茅醇和橙花醇对樱桃番茄灰霉病菌具有很强的抗真菌活性,可用于防治樱桃番茄采后灰霉病,从而为合成化学杀菌剂的使用提供了可行的替代方案。且熏蒸处理的抗真菌活性明显强于接触处理。体内实验表明,经玫瑰天竺葵挥发油处理后的樱桃番茄果实发病率显著降低,当挥发油浓度为15.63 mg/L时,抑制率便可达67.18%。综上所述,玫瑰天竺葵挥发油作为一种天然物质,可以直接抑制灰葡萄孢菌菌丝生长和孢子萌发,减少樱桃番茄灰霉病的发生。这表明玫瑰天竺葵挥发油具有作为一种天然杀菌剂的潜力。但是玫瑰天竺葵挥发油的抑菌作用机理还有待进一步研究,且对于挥发油及其单体化合物挥发较快的问题还有待解决。
-
图 2 玫瑰天竺葵挥发油及其单体化合物熏蒸法对灰葡萄孢菌菌丝生长的影响
注:A为玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长影响的实物图;B为玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长的抑制率对比图;图B中a,b,c,d等小写字母代表各组浓度抑制率数据间的差异显著性,具有相同标记字母的为差异不显著,具有不同标记字母的为差异显著(P<0.05),图3~图4同。
Figure 2. Effects of the P. roseum EO and its individual compounds against mycelia growth of B. cinerea by fumigation
表 1 玫瑰天竺葵挥发油的化学成分
Table 1 Chemical components of P. roseum EO
序号 化合物名称 英文名称 保留时间
(min)保留指数 百分含量
(%)主要碎片离子(m/z) 1 α-蒎烯 α-Pinene 9.079 939 0.165 93(99.9);91(46.8);92(41.4);39(38.5);77(36.6);41(31.8);79(29.8);27(28.6);53(13.9);29(12.5) 2 芳樟醇 Linalool 14.286 1082 1.443 71(99.9);93(61.0);41(57.1);43(48.6);69(48.6);55(45.5);80(26.5);121(17.6);39(16.3);67(16.3) 3 左旋玫瑰醚 cis-Rose oxide 14.589 1095 1.191 139(99.9);69(65.7);83(26.5);55(23.2);41(20.2);85(12.3);67(12.0);154(11.0);39(10.2);84(10.0) 4 玫瑰醚 Rose oxide 15.094 1114 0.399 69(99.9);139(93.0);41(84.0);55(63.0);29(46.0);39(44.0);27(42.0);83(40.0);67(28.0);85(24.0) 5 异薄荷酮 Isomenthone 16.202 1157 5.181 112(99.9);69(91.4);41(88.5);55(57.9);70(41.9);56(38.7);139(37.5);43(36.0);97(31.2);27(29.2) 6 α-松油醇 α-Terpineol 17.032 1191 0.345 59(99.9);93(90.9);121(55.5);136(43.8);67(41.7);81(40.8);43(35.7);68(35.2);79(33.7);91(30.9) 7 香茅醇 Citronellol 18.060 1229 52.158 69(99.9);41(94.2);67(58.7);81(51.5);82(49.8);55(48.0);95(44.8);31(28.3);68(27.6);71(27.1) 8 橙花醇 Nerol 18.806 1255 21.93 69(99.9);41(93.4);93(34.8);68(24.5);39(20.1);67(15.8);27(13.8);29(12.9);53(12.8);84(11.8) 9 甲酸香茅酯 Citronelly formate 19.332 1273 9.865 41(99.9);69(97.7);55(60.2);81(38.5);95(38.1);67(36.2);82(36.2);68(35.7);123(24.5);56(22.8) 10 大根香叶烯 Germacrene D 22.094 1367 0.206 161(99.9);105(77.5);91(68.5);41(61.9);119(60.4);79(41.5);81(41.4);93(35.9);77(34.6);27(31.5) 11 β-波旁烯 (-)-β Bourbonene 22.344 1388 0.552 81(99.9);80(73.7);123(57.4);161(24.9);79(20.9);41(17.5);105(10.5);91(9.5);77(8.4);55(7.8) 12 石竹烯 Caryophyllene 23.244 1421 0.536 41(99.9);69(97.6);93(93.7);133(64.6);79(61.4);91(55.1);55(43.2);81(38.9);107(38.9);105(37.2) 13 6,9-愈创木二烯 Guaia-6,9-diene 23.815 1454 3.539 105(99.9);119(60.9);161(43.6);91(37.6);133(26.0);107(24.9);204(23.3);147(20.8);41(19.8);93(19.5) 14 律草烯 Humulene 24.107 1459 0.240 93(99.9);41(33.9);80(32.3);121(28.8);55(18.7);43(16.8);92(15.5);69(14.5);107(14.5);79(14.2) 15 香橙烯 Aromandendrene 24.293 1463 0.214 41(99.9);91(67.8);79(50.7);105(50.2);93(45.5);39(43.4);77(36.5);107(36.5);67(35.8);55(35.4) 16 (+)-喇叭烯 (+)-Ledene 25.133 1492 0.689 107(99.9);41(96.6);105(93.8);93(87.2);91(77.5);161(72.7);135(58.5);119(57.2);79(56.5);81(56.4) 17 δ-杜松烯 Naphthalene 25.796 1511 0.659 161(99.9);134(57.8);119(50.1);204(47.4);105(46.9);81(25.5);159(24.8);91(24.5);41(22.8);93(20.7) 18 结晶玫瑰 Rosacetol 26.606 1534 0.33 107(99.9);149(37.3);43(30.7);77(14.2);79(13.0);105(8.0);102(7.5);108(7.1);51(6.3);172(5.9) 19 呋喃哌啶酮 Furopelargone A 27.320 1550 0.358 43(99.9);163(59.5);234(51.3);123(47.0);149(43.1);191(42.6);109(39.0);91(27.8);121(23.9);81(22.8) 注:主要碎片离子栏中的X(Y):X:碎片离子的m/z;Y:碎片离子的相对丰度。 表 2 玫瑰天竺葵挥发油及其单体化合物对灰葡萄孢菌菌丝生长的毒力测定
Table 2 EC50 values of the P. roseum EO and its individual compounds against the mycelial growth of B. cinerea
处理 处理方法 毒力回归方程 R2 EC50
(mg/L)95%置信区间
(mg/L)阳性对照 接触法 Y=2.783X−0.7410 0.6935 14.21 2.842~21.93 熏蒸法 Y=2.118X+2.946 0.6679 6.93 4.152~10.01 玫瑰天竺葵
挥发油接触法 Y=0.596X+2.928 0.9710 1350 818.50~2782 熏蒸法 Y=3.569X+0.862 0.8474 26.96 16.68~42.39 香茅醇 接触法 Y=2.144X−1.918 0.6421 134.3 100.7~135.6 熏蒸法 Y=1.586X+2.958 0.9010 18.16 8.773~23.19 橙花醇 接触法 Y=2.442X−0.9334 0.8321 4037 − 熏蒸法 Y=4.059X+0.5893 0.8209 35.3 25.74~48.3 甲酸香茅酯 接触法 Y=0.2466 1 − − 熏蒸法 Y=3.611X+0.4788 0.7645 60.84 40.88~138.4 注:表中“−”表示未测得此数据。 表 3 玫瑰天竺葵挥发油及其单体化合物对灰霉病菌孢子萌发的MIC和MFC
Table 3 Minimal inhibitory concentrations (MIC) and minimal fungicidal concentrations (MFC) of the P. roseum EO and its individual compounds against spore germination of B. cinerea
化合物 接触法 熏蒸法 MIC(mg/L) MFC(mg/L) MIC(mg/L) MFC(mg/L) 玫瑰天竺葵挥发油 NF NF 3.90 31.25 香茅醇 NF NF 31.25 62.50 橙花醇 NF NF 31.25 62.50 甲酸香茅酯 NF NF NF NF 注:NF为在设定浓度范围内未发现抑制效果。 表 4 玫瑰天竺葵挥发油对及其单体化合物灰葡萄孢菌活体的毒力测定
Table 4 EC50 values of the P. roseum EO and its individual compounds against B. cinerea on cherry tomatoes
处理 毒力回归方程 R2 EC50
(mg/L)95%置信区间
(mg/L)乙蒜素
(阳性对照)Y=1.296X+3.621 0.9562 29.82 16.30~70.83 玫瑰天竺葵
挥发油Y=1.276X+3.911 0.9783 7.79 5.46~18.19 香茅醇 Y=1.223X−2.0551 0.9491 47.96 35.34~67.31 橙花醇 Y=1.452X+2.988 0.9739 23.06 19.62~26.94 甲酸香茅酯 Y=1.323X+3.039 0.9626 31.23 25.72~37.86 -
[1] YANG D T, SHI H J, ZHANG K, et al. The antifungal potential of the chelating agent EDTA against postharvest plant pathogen Botrytis cinerea[J]. International Journal of Food Microbiology,2023,388:110089. doi: 10.1016/j.ijfoodmicro.2023.110089
[2] WILLIAMSON B, TUDZYNSKI B, TUDZYNSKI P, et al. Botrytis cinerea:The cause of grey mould disease[J]. Molecular Plant Pathology,2007,8(5):561−580. doi: 10.1111/j.1364-3703.2007.00417.x
[3] ELAD Y, PERTOT I, COTES P A M, et al. Plant hosts of Botrytis spp[J]. Botrytis–the Fungus, the Pathogen and its Management in Agricultural Systems, 2016:413−486.
[4] GAO P, QIN J X, LI D L, et al. Inhibitory effect and possible mechanism of a Pseudomonas strain QBA5 against gray mold on tomato leaves and fruits caused by Botrytis cinerea[J]. PLoS One,2018,13(1):e0190932. doi: 10.1371/journal.pone.0190932
[5] MYRESIOTIS C K, KARAOGLANIDIS G S, TZAVELLA-KLONARI K. Resistance of Botrytis cinerea isolates from vegetable crops to anilinopyrimidine, phenylpyrrole, hydroxyanilide, benzimidazole, and dicarboximide fungicides[J]. Plant Disease,2007,91(4):407−413. doi: 10.1094/PDIS-91-4-0407
[6] GLAMOČLIJA J, SOKOVIĆ M, TEŠEVIĆ V, et al. Chemical characterization of Lippia alba essential oil:an alternative to control green molds[J]. Brazilian Journal of Microbiology,2011,42:1537−1546. doi: 10.1590/S1517-83822011000400041
[7] HENDGES C, JOSÉ R S, ZAMBAN V C, et al. Antifungal activity and control of the early blight in tomato through tea tree essential oil[J]. Crop Protection,2021,148:105728. doi: 10.1016/j.cropro.2021.105728
[8] LORENZETTI E R, MONTEIRO F P, SOUZA P E, et al. Bioatividade de óleos essenciais no controle de Botrytis cinerea isolado de morangueiro[J]. Revista Brasileira de Plantas Medicinais,2011,13:619−627. doi: 10.1590/S1516-05722011000500019
[9] DA SILVA P P M, DE OLIVEIRA J, DOS MARES BIAZOTTO A, et al. Essential oils from Eucalyptus staigeriana F. Muell. ex Bailey and Eucalyptus urograndis W. Hill ex Maiden associated to carboxymethylcellulose coating for the control of Botrytis cinerea Pers. Fr. and Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. in strawberries[J]. Industrial Crops and Products,2020,156:112884. doi: 10.1016/j.indcrop.2020.112884
[10] DEANS S G, RITCHIE G. Antibacterial properties of plant essential oils[J]. International Journal of Food Microbiology,1987,5(2):165−180. doi: 10.1016/0168-1605(87)90034-1
[11] HYLDGAARD M, MYGIND T, MEYER R L. Essential oils in food preservation:mode of action, synergies, and interactions with food matrix components[J]. Frontiers in Microbiology,2012,3:12.
[12] SVOBODA K P, GREENAWAY R I. Investigation of volatile oil glands of Satureja hortensis L. (summer savory) and phytochemical comparison of different varieties[J]. International Journal of Aromatherapy,2003,13(4):196−202. doi: 10.1016/S0962-4562(03)00038-9
[13] BURT S. Essential oils:their antibacterial properties and potential applications in foods-A review[J]. International Journal of Food Microbiology,2004,94(3):223−253. doi: 10.1016/j.ijfoodmicro.2004.03.022
[14] BUTNARIU M, SARAC I. Essential oils from plants[J]. Journal of Biotechnology and Biomedical Science,2018,1(4):35−43. doi: 10.14302/issn.2576-6694.jbbs-18-2489
[15] 滕云, 杨丽. 微波无溶剂萃取法提取野菊花精油工艺及成分分析[J]. 食品工业科技,2021,42(18):226−234. [TENG Yun, YANG Li. Extracting process of essential oil from chrysanthemum indicum by solvent-free microwave extraction and its components analysis[J]. Science and Technology of Food Industry,2021,42(18):226−234.] TENG Yun, YANG Li. Extracting process of essential oil from chrysanthemum indicum by solvent-free microwave extraction and its components analysis[J]. Science and Technology of Food Industry, 2021, 42(18): 226−234.
[16] VERMA R S, PADALIA R C, CHAUHAN A. Rose-scented geranium (Pelargonium sp.) oils[J]. Essential Oils in Food Preservation, Flavor and Safety, 2016:697−704.
[17] DIÁNEZ F, SANTOS M, PARRA C, et al. Screening of antifungal activity of 12 essential oils against eight pathogenic fungi of vegetables and mushroom[J]. Letters in Applied Microbiology,2018,67(4):400−410. doi: 10.1111/lam.13053
[18] ELOUADI Y, BENDAIF H, ASSAGGAF H, et al. Efficacy of Pelargonium graveolens essential oils against some postharvest fungal diseases of apple[J]. Advancements in Life Sciences,2022,9(2):195−201.
[19] KUJUR A, KUMAR A, YADAV A, et al. Antifungal and aflatoxin B-1 inhibitory efficacy of nanoencapsulated Pelargonium graveolens L. essential oil and its mode of action[J]. LWT-Food Science & Technology,2020(130):130.
[20] ZHAO Y, YANG Y H, YE M, et al. Chemical composition and antifungal activity of essential oil from Origanum vulgare against Botrytis cinerea[J]. Food Chemistry,2021,365:130506. doi: 10.1016/j.foodchem.2021.130506
[21] 李珊珊, 郑开斌, 黄惠明, 等. 玫瑰天竺葵与波旁天竺葵植物学性状及挥发油成分分析比较[J]. 中药材,2018,41(2):358−364. [LI Shanshan, ZHENG Kaibin, HUANG Huiming, et al. Comparison of botanical traits and essential oils composition analysis between Pelargonium roseum R. Br and Pelargonium asperum Bourbon[J]. Chinese Materia Medica,2018,41(2):358−364.] LI Shanshan, ZHENG Kaibin, HUANG Huiming, et al. Comparison of botanical traits and essential oils composition analysis between Pelargonium roseum R. Br and Pelargonium asperum Bourbon[J]. Chinese Materia Medica, 2018, 41(2): 358−364.
[22] FELICIA W X L, ROVINA K, VONNIE J M, et al. Consolidating plant-based essential oils onto polysaccharides-based coatings:effect on mechanisms and reducing postharvest losses of fruits[J]. Applied Food Research, 2022:100226.
[23] AZHDARZADEH F, HOJJATI M, TAHMUZI D S. Chemical composition and antimicrobial activity of Pelargonium roseum essential oil from southwest of Iran[J]. Journal of Food and Bioprocess Engineering,2018,1(1):33−38.
[24] CARMEN G, HANCU G. Antimicrobial and antifungal activity of Pelargonium roseum essential oils[J]. Advanced Pharmaceutical Bulletin,2014,4(Suppl 2):511.
[25] EDRIS A E, FARRAG E S. Antifungal activity of peppermint and sweet basil essential oils and their major aroma constituents on some plant pathogenic fungi from the vapor phase[J]. Food/Nahrung,2003,47(2):117−121. doi: 10.1002/food.200390021
[26] LAIRD K, PHILLIPS C. Vapour phase:a potential future use for essential oils as antimicrobials?[J]. Letters in Applied Microbiology,2012,54(3):169−174. doi: 10.1111/j.1472-765X.2011.03190.x
[27] BOUZENNA H, KRICHEN L. Pelargonium graveolens L’Her. and Artemisia arborescens L. essential oils:chemical composition, antifungal activity against Rhizoctonia solani and insecticidal activity against Rhysopertha dominica[J]. Natural Product Research,2013,27(9):841−846. doi: 10.1080/14786419.2012.711325
[28] STEVIĆ T, BERIĆ T, ŠAVIKIN K, et al. Antifungal activity of selected essential oils against fungi isolated from medicinal plant[J]. Industrial Crops and Products,2014,55:116−122. doi: 10.1016/j.indcrop.2014.02.011
[29] LI X Z, LIU M, HUANG T K, et al. Antifungal effect of nerol via transcriptome analysis and cell growth repression in sweet potato spoilage fungi Ceratocystis fimbriata[J]. Postharvest Biology and Technology,2021,171:111343. doi: 10.1016/j.postharvbio.2020.111343
[30] WANG Y Z, ZENG X B, ZHOU Z K, et al. Inhibitory effect of nerol against Aspergillus niger on grapes through a membrane lesion mechanism[J]. Food Control,2015,55:54−61. doi: 10.1016/j.foodcont.2015.02.029
[31] TZORTZAKIS N G. Impact of cinnamon oil-enrichment on microbial spoilage of fresh produce[J]. Innovative Food Science & Emerging Technologies,2009,10(1):97−102.





 下载:
下载:

 下载:
下载:



