Anti-lung Cancer Mechanism of Quercetin Based on Network Pharmacology and Experimental Validation
-
摘要: 目的:探究槲皮素治疗非小细胞肺癌(NSCLC)的潜在机制,并结合分子生物学实验验证。方法:通过SwisTargetPrediction和DrugBank数据库筛选槲皮素的靶点,通过GeneCards、TTD数据库收集NSCLC的疾病靶点,进行靶点映射获得槲皮素治疗NSCLC的靶点,应用STRING数据库获取蛋白-蛋白相互作用(PPI)网络并进行分析,使用Cytoscape 3.7.2进行可视化;利用DAVID数据库进行靶点富集,进行基因本体论分析(GO)和京都基因与基因组百科全书分析(KEGG)。采用分子对接对核心靶点进行验证,并使用PLIP平台分析结合位点力学数据。通过细胞实验评估槲皮素对A549细胞增殖的影响,并利用qRT-PCR和Western blot对核心靶点进行验证。结果:网络药理学研究显示,槲皮素能够调控126个靶点,潜在治疗NSCLC的靶点有49个,核心通路为PI3K-Akt信号通路,核心靶点为PI3K、Akt、GSK-3β。分子对接实验初步发现,槲皮素与3个核心靶点均能产生强烈结合力。细胞实验结果显示,槲皮素低、中、高剂量组干预72 h后均能够显著抑制A549细胞的增殖活力(P<0.01),并下调PI3K、Akt、GSK-3β的mRNA表达水平(P<0.05)以及蛋白表达趋势。结论:本研究分析预测了槲皮素治疗NSCLC的潜在活性机制,通过实验验证发现槲皮素可能通过抑制PI3K/Akt/GSK-3β信号通路发挥抗癌作用。
-
关键词:
- 槲皮素 /
- 非小细胞肺癌 /
- 网络药理学 /
- 分子对接 /
- PI3K/Akt/GSK-3β信号通路
Abstract: Objective: To investigate the potential mechanisms of quercetin in the treatment of non-small cell lung cancer (NSCLC) and validate them through molecular biology experiments. Methods: Target prediction for quercetin was performed using the SwissTargetPrediction and DrugBank databases, while NSCLC disease targets were collected from GeneCards and TTD databases. Target mapping was performed to identify the targets of quercetin in treating NSCLC. The protein-protein interaction (PPI) network was obtained from the STRING database and analyzed using Cytoscape 3.7.2 for visualization. Target enrichment analysis was carried out using the DAVID database, along with Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway analysis. Additionally, this study employed molecular docking to validate core targets and utilized the PLIP platform for combined analysis of binding site mechanics data. The impact of quercetin on the proliferation of A549 cells was assessed through cell experiments, and core targets were validated using qRT-PCR and Western blot. Results: Network pharmacology analysis revealed that quercetin could regulate 126 targets, with 49 potential targets for NSCLC treatment. The core pathway identified was the PI3K-Akt signaling pathway, with core targets being PI3K, Akt, and GSK-3β. Molecular docking experiments preliminarily demonstrated strong binding affinity between quercetin and the three core targets. Cellular experiments indicated that quercetin intervention in low, medium, and high doses significantly inhibited the proliferative activity of A549 cells after 72 hours (P<0.01) and downregulated the mRNA expression levels of PI3K, Akt, and GSK-3β (P<0.05), as well as protein expression trends. Conclusion: This study analyzed and predicted the potential active mechanisms of quercetin in treating NSCLC. Experimental validation suggested that quercetin might exert its anticancer effects by inhibiting the PI3K/Akt/GSK-3β signaling pathway. -
非小细胞肺癌(Non-small cell lung cancer,NSCLC)是临床上最常见、死亡率最高的呼吸系统肿瘤,占所有肺癌病例的近85%,每年导致全球170万人死亡,成为世界第五大常见死因[1−2]。大多数患者确诊时已处于晚期,预计到2030年将会造成每年1000万人死亡[3]。目前主流治疗方案为顺铂、卡铂等经典药物与吉西他滨、长春瑞滨、紫杉醇或多西他赛等新药的联合疗法[4]。然而,长时间使用这些药物会引起化疗耐药,并且伴随一系列副作用,如脱发、神经损伤、听力损失、肾脏损伤或过敏反应等,因此迫切需要开发高效、低毒的辅助防治药物[5]。
天然植物来源的抗癌药物在癌症的治疗中发挥极其重要的地位,以紫杉醇、喜树碱为代表的药物已经成为部分肿瘤治疗的首选用药。槲皮素(3,5,7,3',4'-五羟基黄酮)是一种天然黄酮醇类多酚化合物,广泛存在于苹果、葡萄等多种水果,洋葱、西蓝花等蔬菜及茶叶等食品中,是常见的膳食黄酮醇之一[6]。槲皮素具有广泛的生物活性,如抗氧化[7]、抗炎[8]、抗感染[9]、提升免疫力[10]、降血压[11]等,近年来因发现具有良好的抗癌活性而被广泛关注[12]。目前,槲皮素已在国外广泛作为防癌防衰老的膳食补充剂使用,国内也开始探索其作为天然抗氧化剂延长食品保质期[13]、改善农副产品质量[14]、抗衰老化妆品[15]及无抗饲料添加剂[16]等方面的应用。研究发现,槲皮素能够抑制结肠癌、乳腺癌、卵巢癌等多种癌细胞系的体外增殖,可能是调节PI3K/Akt/mTOR、Wnt/β-catenin、VEGF等信号通路、抑制糖摄取和酵解的关键酶以及诱导多种癌细胞凋亡等过程发挥作用[17]。此外,槲皮素也对健康细胞起到保护作用,因此辅以食用也能应对放化疗引起的正常细胞损伤[18]。在国外,已有槲皮素抗鳞状细胞癌、前列腺癌的相关研究进入临床试验,但抗NSCLC的研究仍在实验室阶段[19];国内相关研究大多停留在对于其机制的预测,鲜有对其效果机制进行深入验证的高质量研究。
网络药理学是一门融合了生物信息学、系统生物学、数据库技术等的交叉学科,打破了既往西方研究单一靶点的桎梏,更能深刻探究药物对于疾病网络的整体调节作用[20]。在本研究中,选取槲皮素治疗NSCLC的潜在作用靶点,构建蛋白质-蛋白质相互作用网络(Protein-protein interaction,PPI),随后进行基因本体论(Gene Ontology,GO)分析与京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析,获取干预后的关键通路,采用分子对接、qRT-PCR与Western blot对PI3K/Akt/GSK-3β信号轴相关靶点情况进行检测,旨在为槲皮素治疗NSCLC的有效性和机制提供依据与参考,为进一步开发抗癌药物提供研究基础。
1. 材料与方法
1.1 材料与仪器
槲皮素(纯度:95%) 购自上海阿拉丁生化科技股份有限公司;注射用顺铂 购自齐鲁制药有限公司;胎牛血清(FBS) 购自上海逍鹏生物科技有限公司;DMEM高糖培养基 购自美国Gibco公司;青霉素-链霉素双抗溶液 购自上海中韬生物科技有限公司;0.25%胰蛋白酶消化液、RIPA裂解液 购自北京索莱宝科技有限公司;PBS缓冲液 购自武汉赛维尔生物科技有限公司;CCK8试剂盒、RNA提取试剂盒、聚合酶链反应检测试剂盒、BCA蛋白浓度测定试剂盒、蛋白上样缓冲液 均购自上海碧云天生物技术有限公司;PVDF膜 购自Millipore公司;磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)抗体、p-PI3K抗体、蛋白激酶B(protein kinase B,Akt)兔多克隆抗体、p-Akt、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)兔多克隆抗体、p-GSK-3β抗体 均购自武汉三鹰生物技术有限公司;β-肌动蛋白(β-actin)一抗、HRP二抗 购自武汉赛维尔生物科技有限公司;人非小细胞肺癌A549细胞株 中科院细胞库。
BP310P型分析天平 德国赛多利斯公司;CKX53倒置相差显微镜 日本奥林巴斯株式会社;CO2细胞培养箱 美国赛默飞公司;iMark型酶标仪 美国伯乐生命医学产品有限公司;JY92-11N型超声波细胞破碎仪 宁波新芝生物科技股份有限公司;ProFlex PCR系统 美国赛默飞公司;SVE-2垂直电泳仪、SVT-2转印电泳仪、6100型凝胶成像分析系统 武汉赛维尔生物科技有限公司。
1.2 实验方法
1.2.1 槲皮素靶点及非小细胞肺癌潜在靶点预测
分别在SwisTargetPrediction平台[21](http://www.swistargetprediction.ch/)和DrugBank数据库[22](https://go.drugbank.com/)检索槲皮素,进行化合物靶点预测,整理数据合并、去重后构建槲皮素靶点数据库。分别在GeneCards数据库(http://www.genecards.org/)和TTD数据库[23](http://db.idr-blab.net/td/),以“Non small cell lung cancer”为检索词,对NSCLC的疾病靶点进行检索,以Relevance score>50为条件进行筛选,去重,获得NSCLC疾病靶点数据库。使用jvenn平台(https://jvenn.toulouse.inrae.fr/app/example.html)构建维恩图,获取交集靶点。
1.2.2 构建PPI网络
将1.2.1获得的槲皮素治疗NSCLC靶点导入STRING数据库[24](https://cn.string-db.org/cgi/input)设置物种为Homo sapiens,相互作用阈值设置为中等置信度(medium confidence=0.4),导出.tsv格式文件。数据文件导入Cytoscape 3.7.2[25]中,使用NetworkAnalyzer插件分析网络,并根据参数给网络节点赋值,构建PPI网络。
1.2.3 富集分析
将槲皮素治疗NSCLC的靶点导入DAVID平台[26],选择物种为Homo sapiens,进行基因本体(GO)功能及京都基因与基因组百科全书(KEGG)通路[27]富集分析,以校正P值(P<0.05)进行筛选。
1.2.4 分子对接
在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取槲皮素的.sdf格式文件,通过Chem3D进行力的最小化处理,导出为.mol2格式文件,并使用AutoDock Tools转为.pdbqt格式文件。从RCSB PDB数据库[28](https://www.rcsb.org/)中下载槲皮素调控NSCLC潜在核心靶点蛋白PI3K(6M8A)、Akt(1YI3)、GSK-3β(5HLP)的3D晶体结构,选取依据为:分辨率<2 Å、含有共结晶配体、有文献已报道该结构的活性位点。使用PyMOL对蛋白结构除杂,导出为.pdbqt格式,使用AutoDock Tools对蛋白进行除水、加氢、计算电荷处理,并根据报道文献设置对接盒子参数如下:PI3K[29](center_x=−19.312,center_y=36.692,center_z=−0.9;size_x、y、z=16.08);AKT[30](center_x=5.334,center_y=27.079,center_z=25.511;size_x、y、z=15.102);GSK-3β[31](center_x=9.495,center_y=25.789,center_z=−19.304;size_x、y、z=14.181)。采用Python调用Vina[32]对处理好的槲皮素和蛋白进行高精分子对接,对接结果采用PLIP(https://plip-tool.biotec.tu-dresden.de/plip-web/)平台[33]进行受体-配体相互作用二次分析。
1.2.5 细胞培养
采用DMEM完全培养基(10%FBS+1%双抗)复苏及培养,在5%CO2、37 ℃培养箱中传代3次,取第4代状态良好的对数期细胞进行后续实验。
1.2.6 细胞增殖检测
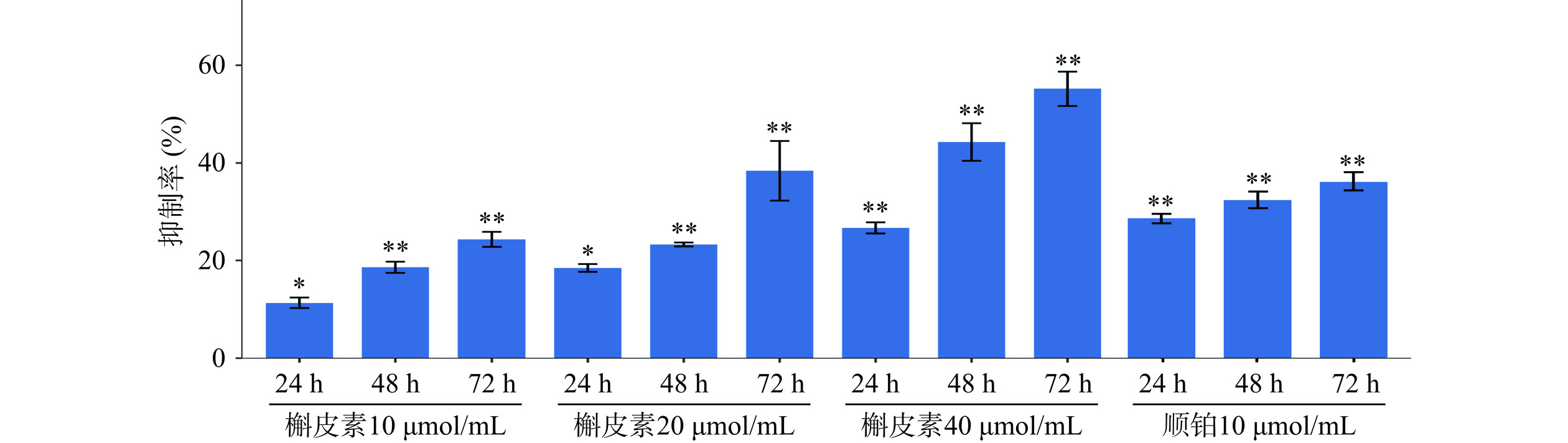
A549细胞使用胰酶消化为细胞悬液,使用完全培养基稀释悬液浓度为1×105 个/mL,均匀铺接种于96孔板,每孔100 μL,分别在24、48、72 h采用不同浓度的含槲皮素(10、20、40 μmol/mL)以及顺铂10 μmol/mL的培养基培养,每组5个复孔。加入CCK-8试剂,共培养2 h,于450 nm测定每孔OD值,计算生长抑制率,公式如下:
1.2.7 实时荧光定量(qRT)-PCR检测核心靶点基因表达
将细胞分为对照组、顺铂组、槲皮素不同剂量组。细胞贴壁后,换用不同浓度的含药培养基继续培养48 h。使用RNA提取试剂盒抽提细胞总RNA,进行反转录得到cDNA,以此为模板进行qRT-PCR目的基因扩增,以β-actin为内参,分别检测PI3K、AKT、GSK-3β的mRNA表达水平。引物序列:PI3K正向:5'-TGGGACCTTTTTGGTACGAGA-3',反向:5'-AGCTAAAGACTCATTCCGGTAGT-3';Akt正向:5'-CCTTTATTGGCTACAAGGAACGG-3',反向:5'-GAAGGTGCGCTCAATGACTG-3';GSK-3β正向:5'-CTTGGACAAAGGTCTTCCGGCC-3',反向:5'-GTTGGCAGGCGGTGAAGCAG-3';β-actin正向:5'-GCATCCTGCACCACCAACT-3',反向:5'-GCAGTGATGGCATGGACTGT-3'。采用2−△△Ct法计算目标基因mRNA表达水平。
1.2.8 Western blot
收集1.2.6项下药物共培养的细胞,加入裂解液,提取细胞总蛋白,并使用BCA试剂盒测定蛋白浓度,随后进行上胶、凝胶电泳检测、样品转印PVDF膜、BSA封闭、一抗孵育过夜、二抗孵育、洗膜、显影,以β-actin作为内参蛋白,并采用Image J分析条带灰度值,记录其相对表达量。
1.3 数据处理
用SPSS 22.0软件进行统计分析。所有数据采用平均值±标准差(x±s)表示,各组数据符合正态分布,多组间比较采用单因素方差分析,两组间的比较用t检验,P<0.05表示具有统计学差异。
2. 结果与分析
2.1 槲皮素治疗非小细胞肺癌靶点
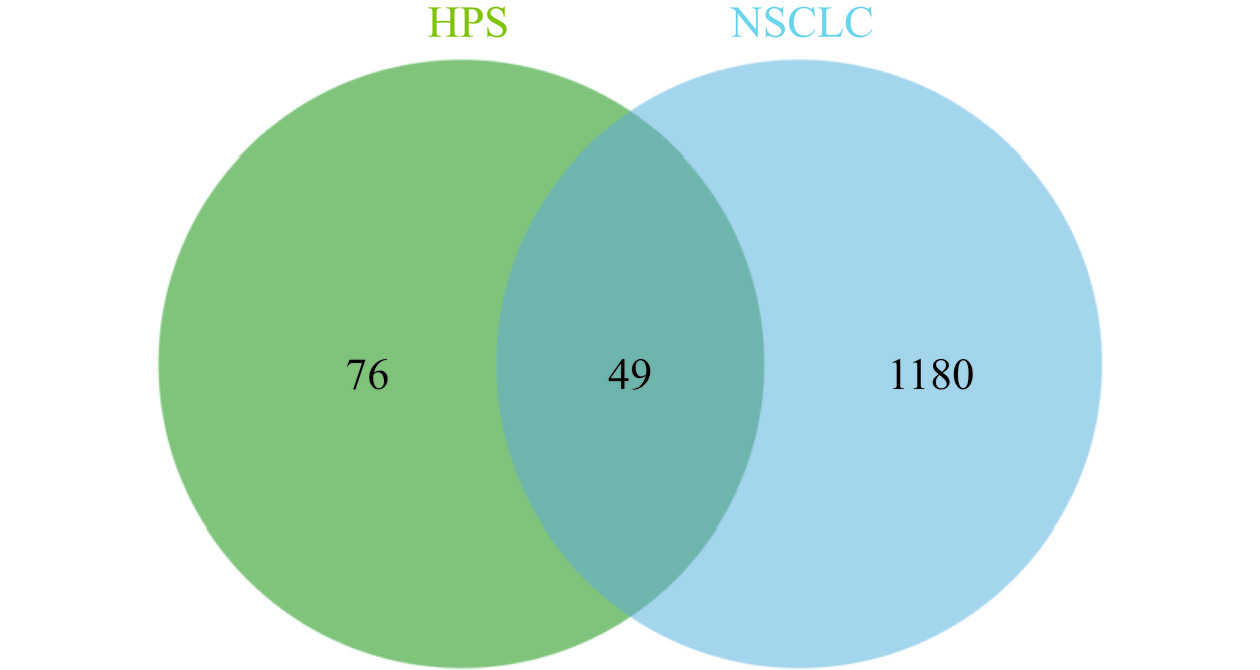
借助SwisTargetPrediction平台与DrugBank数据库,经筛选、合并、去重后得到槲皮素的相关作用靶点126个。通过整合GeneCards数据库和TTD数据库,经筛选、合并、去重后获得NSCLC相关疾病靶点1229个。通过jvenn平台构建韦恩图(图1),获得交集靶点49个。
2.2 PPI网络构建
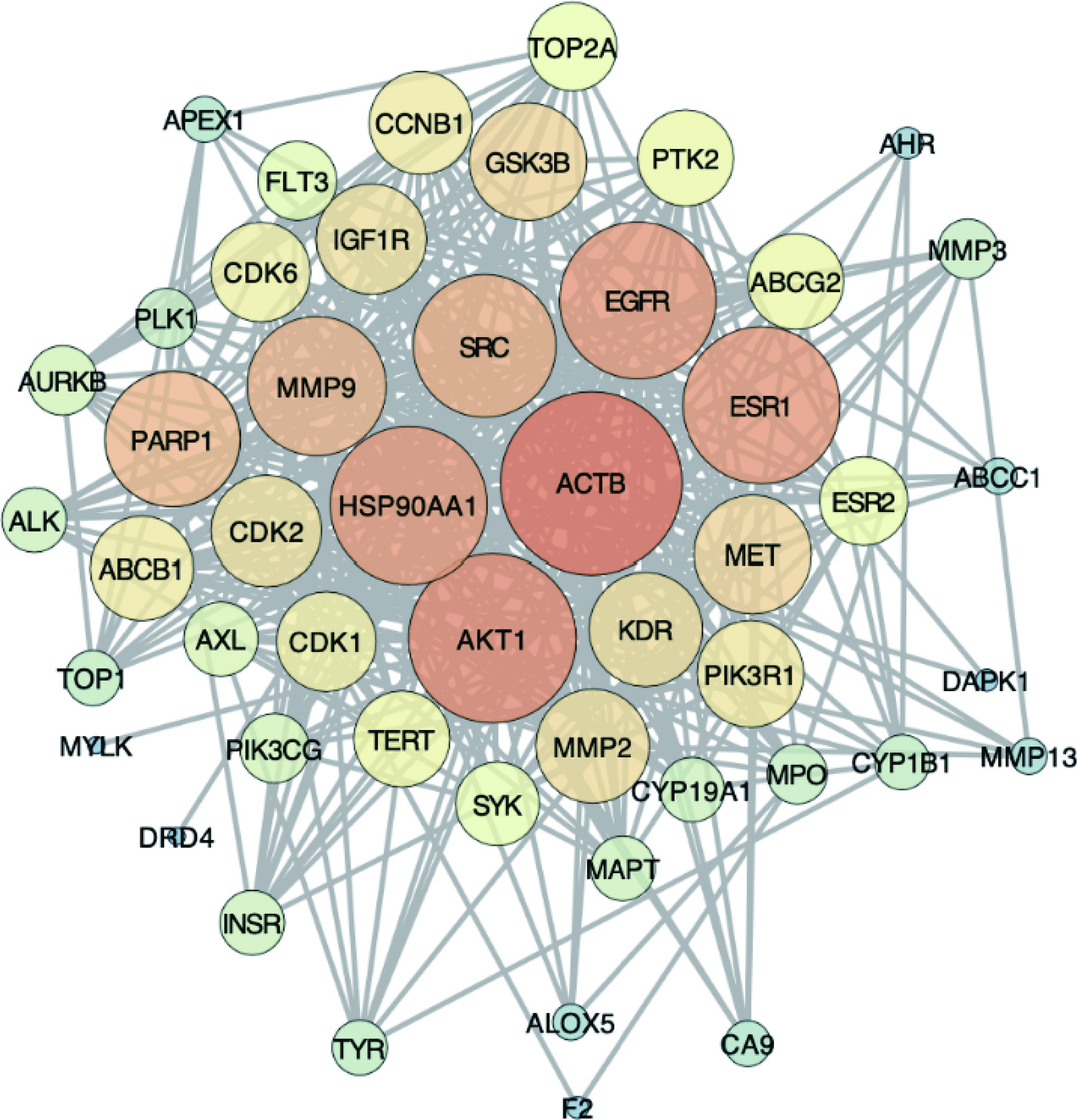
使用STRING数据库探究槲皮素治疗NSCLC的蛋白互作数据,共计402条相互作用。使用Cytoscape 3.7.2将PPI网络可视化(图2),位置居中、节点越大说明该靶点在相互作用网络中越重要。经拓扑学分析计算得该网络有49个节点,402条边;平均相邻系数为16.408,表明网络中的蛋白质平均与许多其他蛋白质相互作用,网络连通性较好;聚类系数为0.685,表明PPI网络中的蛋白质倾向于以紧密的集团形式相互作用;网络密度0.342,表明网络是相对密集的,多种蛋白质之间存在相互作用;网络集中度为0.556,表明网络有一定的中心性,可能存在一些关键的蛋白质(中心节点)在网络中起着特别重要的作用。
2.3 GO富集分析结果
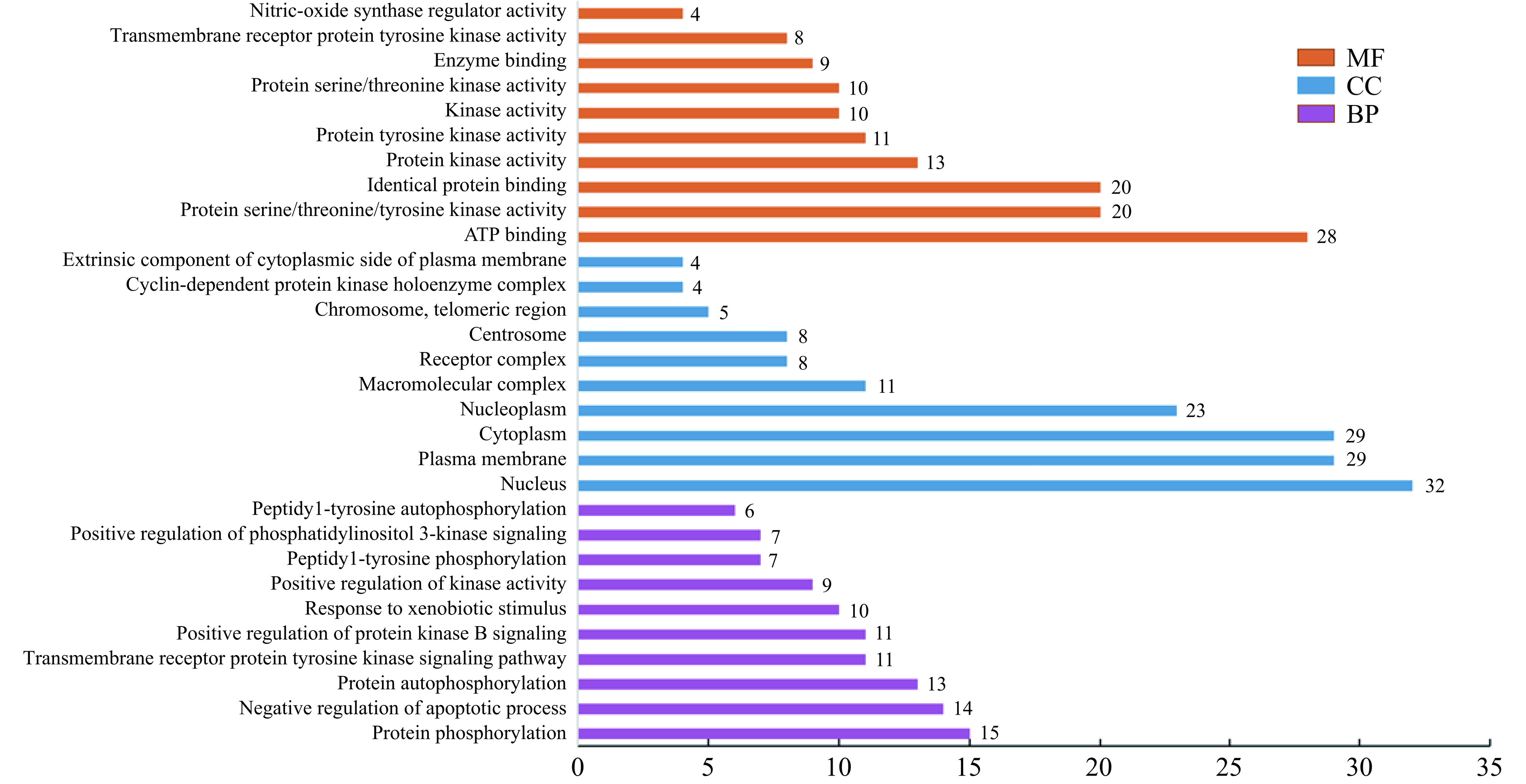
将交集靶点提交至DAVID数据库进行分析。根据P<0.05,筛选出354个生物学功能,其中包括223个细胞生物过程(Biological Process,BP),76个分子功能(Molecular Function,MF)和55个细胞成分(Cellular Component,CC)。按照P值由小到大分别筛选出BP、MF和CC类别中显著富集前10的生物学功能进行可视化处理(图3)。结果显示,BP主要与蛋白磷酸化(protein phosphorylation)、凋亡过程的负调控(negative regulation of apoptotic process)和蛋白自磷酸化(protein autophosphorylation)等有关,可能与调控癌细胞的蛋白磷酸化、凋亡等过程有关。CC主要与细胞核(nucleus)、质膜(plasma membrane)和细胞质(cytoplasm)等有关,可能调控反应发生在胞内这些区域。MF主要与ATP结合(ATP binding)、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)和相同的蛋白质结合(identical protein binding)等有关,可能与胞内发生的这些反应相关。综上所述,槲皮素在多个层面上与NSCLC的关键过程相互作用,这些相互作用可能对癌细胞的生长、存活和信号传导产生重要影响。
2.4 KEGG富集分析结果
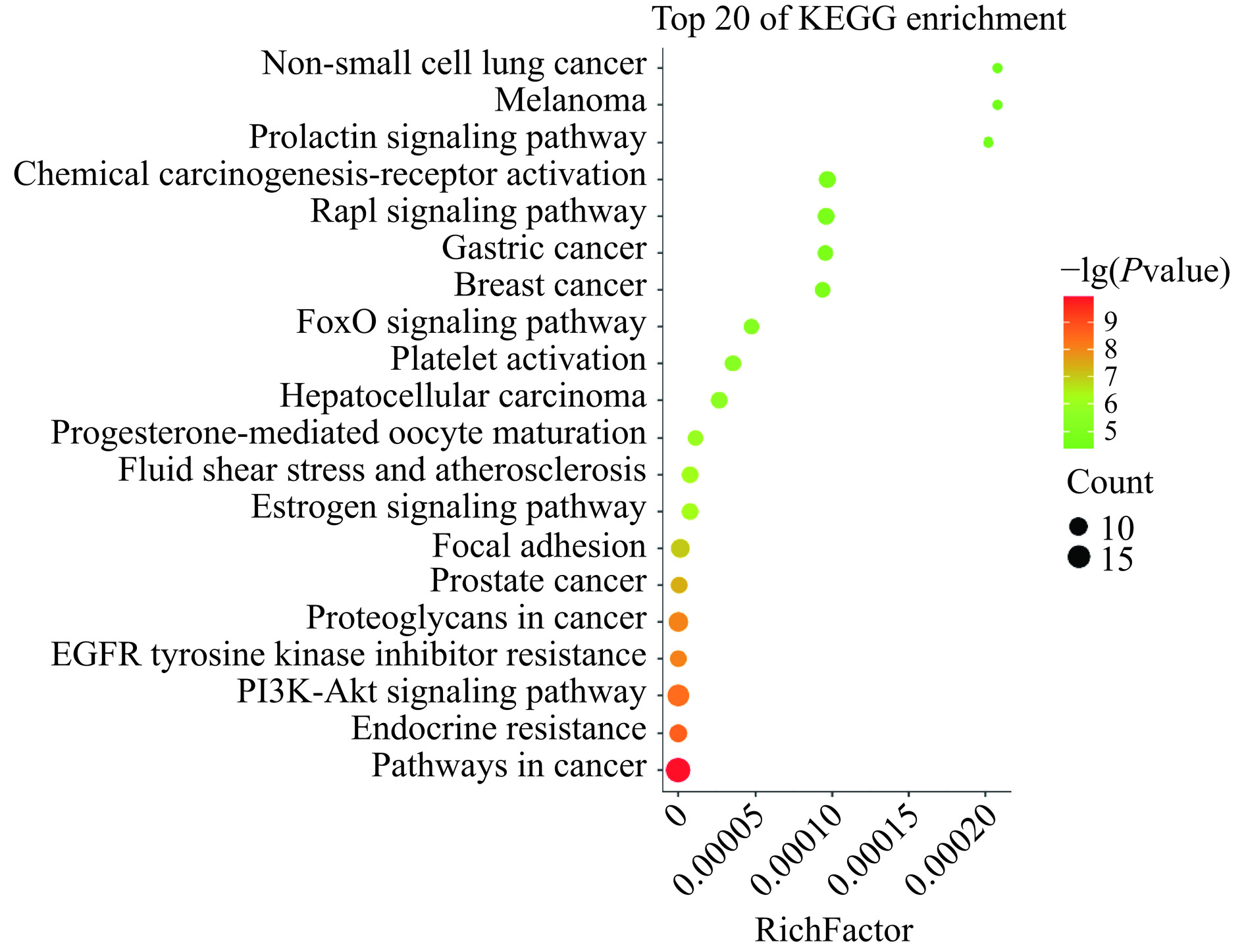
经DAVID平台富集分析共检索到96条KEGG通路,根据P<0.05筛选出前20条通路运用微生信平台进行可视化处理(图4)。气泡的大小表示富集通路的数量,颜色表示P值的大小。由图4可见,KEGG通路多涉及信号通路(PI3K-Akt、Rap1、FoxO等)、癌症的途径(前列腺癌、肝癌、乳腺癌等)和内分泌抵抗途径等。经汇总后发现PI3K-Akt信号通路为富集靶点最多的信号通路,通过与KEGG数据库通路的靶点信息进行比对,发现PI3K、Akt、GSK-3β存在明显的上下游线性关系,可能是槲皮素发挥抗NSCLC作用的主要靶点,因此后续实验验证选择该靶点进行验证。
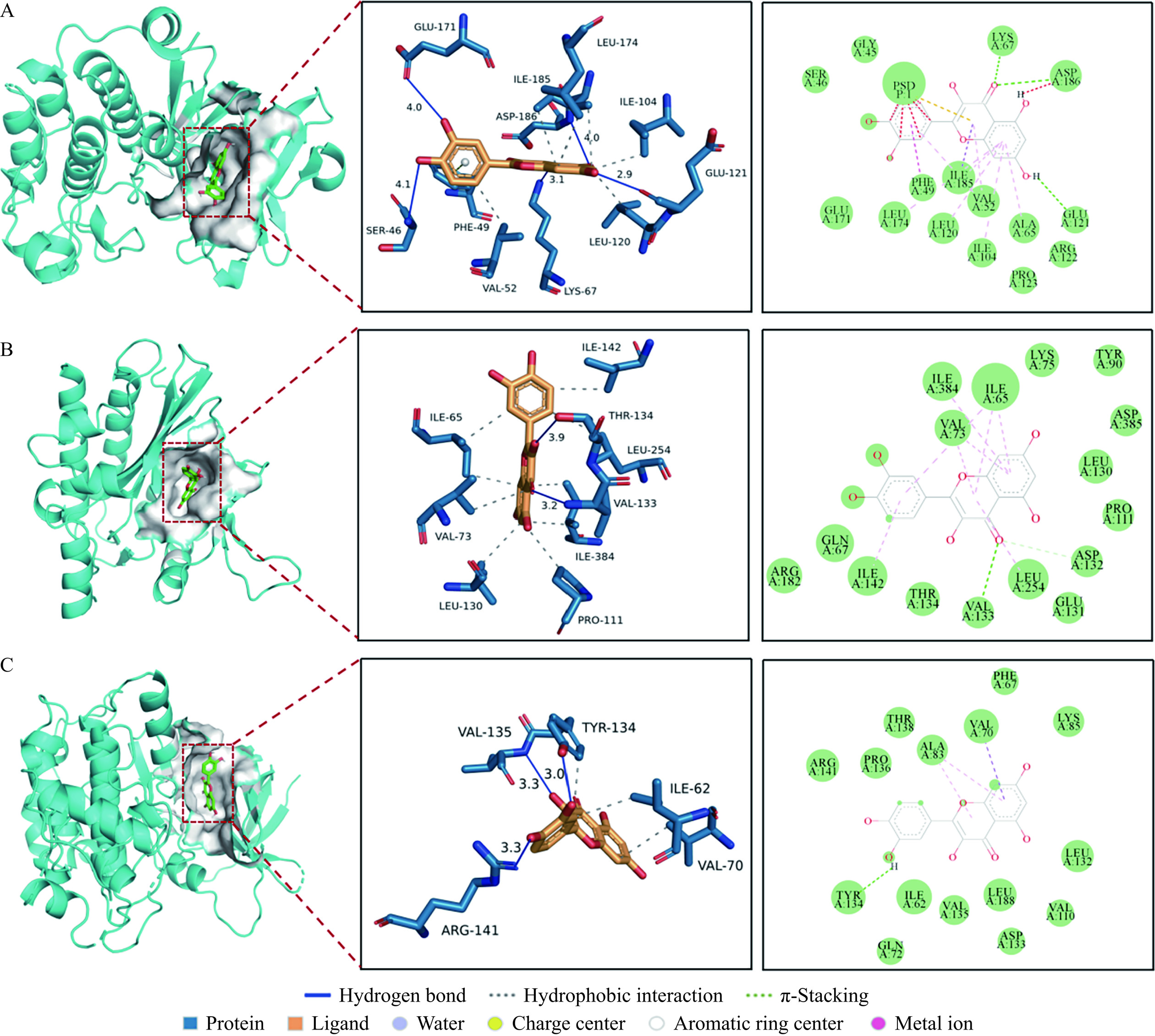
2.5 分子对接结果
为进一步确认槲皮素与关键靶点PI3K、Akt、GSK-3β的潜在调控作用,采用AutoDock Vina对药物与靶蛋白进行了分子对接,并标注了对接的活性口袋、相互作用的氨基酸残基、氢键键长等信息(图5)。并借助PLIP平台对每一组对接做了精细力学分析(表1)。一般来说,对接结合能低于−5 kcal·mol−1则表示该成分与对接靶点具有良好的结合活性,低于−7 kcal·mol−1则表示产生了强烈的结合力[32]。由图5可见槲皮素可通过氢键、疏水相互作用和π堆叠作用准确嵌合入PI3K(A)、Akt(B)、GSK3-β(C)的活性口袋位置,并与口袋位置多个氨基酸残基产生多重相互作用其中,槲皮素与PI3K的GLU-121、ASP-186、GLU-171、LYS-67、SER-46残基通过氢键结合,与LEU-174、ILE-185、ILE-104、LEU-120、VAL-52残基通过疏水键结合,与PHE-49残基形成Π键。与AKT的THR-134、VAL-133残基通过氢键结合,与ILE-142、ILE-65、LEU-254、ILE-384、PRO-111、LEU-130、VAL-73残基通过疏水键结合。与GSK-3β的ARG-141、VAL-135、TYR-134残基通过氢键结合,与ILE-62、TYR-134、VAL-70残基通过疏水键结合。
表 1 分子对接结合能分析结果Table 1. Binding energy results from molecular docking靶点 相互作用力
类型氨基酸残基 结合能
(kcal·mol−1)PI3K 氢键 GLU-121、ASP-186、GLU-171、
LYS-67、SER-46−8.5 疏水 LEU-174、ILE-185、ILE-104、
LEU-120、VAL-52π堆叠 PHE-49 AKT 氢键 THR-134、VAL-133 −7.7 疏水 ILE-142、ILE-65、LEU-254、ILE-384、
PRO-111、LEU-130、VAL-73GSK-3β 氢键 ARG-141、VAL-135、TYR-134 −7.3 疏水 ILE-62、TYR-134、VAL-70 2.6 槲皮素对A549细胞增殖的影响
槲皮素、顺铂给药后,A549细胞经过24~72 h的作用,抑制率逐渐升高,差异具有统计学意义(P<0.05);与A549对照组对比,槲皮素在不同时间点、不同剂量呈现依赖性关系,作用浓度越高、作用时间越久,抑制细胞增殖效果越好,提示槲皮素能够呈时间-剂量依赖性抑制A549的细胞增殖(图6)。
2.7 槲皮素对A549细胞中核心靶点的mRNA表达水平的影响
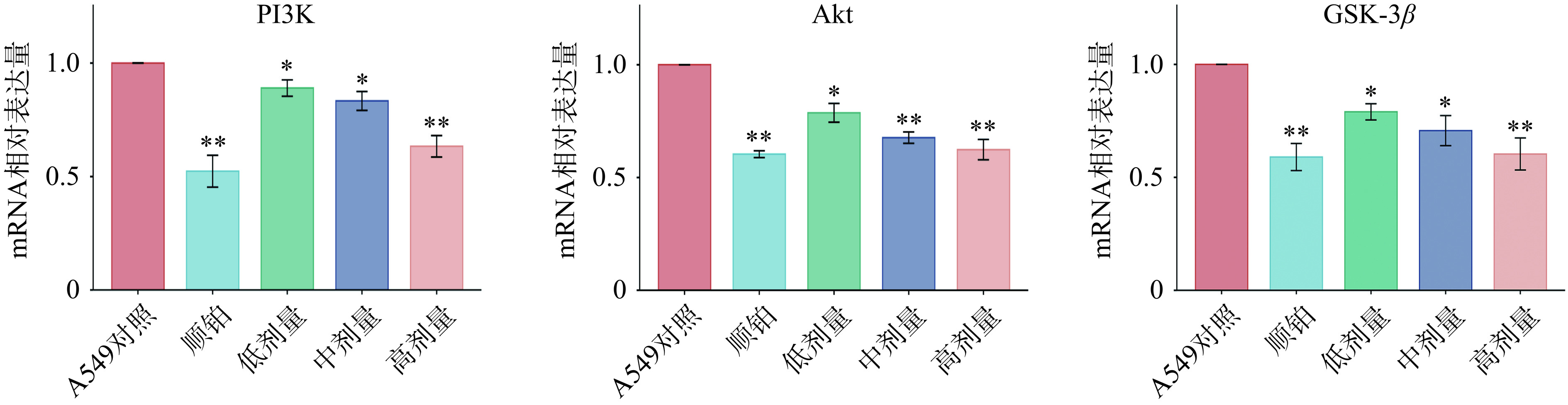
qRT-PCR实验结果如图7,与A549对照组相比,各给药组细胞中PI3K、Akt、GSK-3β的mRNA表达水平均显著降低。顺铂、槲皮素高剂量组的PI3K mRNA水平与对照组相比呈现及其显著降低(P<0.01),槲皮素低中剂量组也呈现出统计学差异(P<0.05);顺铂、槲皮素中高剂量组的Akt mRNA水平与对照组相比呈现及其显著降低(P<0.01),槲皮素低剂量组呈现出统计学差异(P<0.05);顺铂、槲皮素低剂量组的GSK-3β mRNA水平与对照组相比呈现及其显著降低(P<0.01),槲皮素中高剂量组也呈现出统计学差异(P<0.05)。槲皮素的干预效果能呈现剂量依赖性的效果,在一定剂量范围内给药越高,抑制效果越好。
2.8 槲皮素对A549细胞中核心靶点的蛋白表达水平的影响
磷酸化和去磷酸化是生物体内常见的蛋白质翻译后修饰方式,可以动态地调节蛋白质的功能和活性。因此,即使原蛋白的表达量没有变化,其磷酸化状态的改变对细胞内的信号转导、代谢调控等生物学过程将产生更加深远影响。WB实验结果表明,与A549对照组相比较,给药组的PI3K、Akt、GSK-3β的表达无明显差异,而p-PI3K、p-Akt、p-GSK-3β的表达水平均降低。各给药组中,顺铂给药能下调p-PI3K、p-Akt、p-GSK-3β的表达水平,槲皮素不同剂量给药也呈现剂量依赖性下调对应蛋白水平,且给浓度越高,抑制效果越明显,具体如图8。
3. 讨论与结论
本研究通过数据库检索,采用网络药理学方法探究槲皮素治疗NSCLC的核心靶点、通路,并采用分子对接、qRT-PCR和Western blot进行验证。网络药理学研究结果显示,槲皮素的预测靶点有126个。成分-疾病靶点映射结果显示,槲皮素治疗NSCLC交集靶点有49个,PPI及富集分析结果显示槲皮素的治疗作用可以通过多种机制发挥作用,核心通路为PI3K-Akt信号通路,重点关注靶点为PI3K、Akt、GSK-3β。通过分子对接初步发现,槲皮素与3个核心靶点均能产生强烈结合力,主要产生氢键相互作用、疏水相互作用。多项研究发现,在NSCLC的肺组织细胞中,PI3K/Akt/GSK-3β信号轴被异常、频繁激活,对于肿瘤的发生发展与耐药性产生深远影响[34−36]。受癌细胞过度生长因子的影响,PI3K被过度激活,将PIP2转化为PIP3,进而招募并激活Akt,促使其磷酸化,进一步调节细胞的生长、凋亡、代谢等功能[37]。GSK-3β能够被磷酸化的Akt调节,主要控制癌细胞调节糖代谢、细胞周期等。通过抑制PI3K/Akt/GSK-3β能降低A549细胞生长所需的能量和生物分子,同时抑制细胞的过度生长增殖,促进凋亡过程[38]。朱冬菊等[39]发现固本解毒方可以抑制A549的细胞生长增殖,其机制与给药干预抑制PI3K、Akt的表达有关。Kim等[40]发现隐丹参酮通过抑制PI3K/Akt/GSK-3β途径引发A549细胞发生周期停滞、激活细胞凋亡发挥抗癌作用。本研究发现槲皮素能够显著抑制A549的增殖活力,显著下调PI3K、Akt、GSK-3β的mRNA表达水平及蛋白表达水平,因此可能与抑制PI3K/Akt/GSK-3β信号轴的表达水平相关。
综上所述,本研究基于网络药理学的研究方法,较为系统地分析预测了槲皮素治疗NSCLC的潜在活性机制。通过富集分析发现槲皮素主要通过PI3K/Akt/GSK-3β信号通路发挥作用,并通过分子对接、qRT-PCR与Western blot实验进行了验证。通过以上结果表明,槲皮素治疗NSCLC可能与PI3K/Akt/GSK-3β信号通路相关,为槲皮素抗癌的分子生物学机制提供了进一步的理论依据。
-
表 1 分子对接结合能分析结果
Table 1 Binding energy results from molecular docking
靶点 相互作用力
类型氨基酸残基 结合能
(kcal·mol−1)PI3K 氢键 GLU-121、ASP-186、GLU-171、
LYS-67、SER-46−8.5 疏水 LEU-174、ILE-185、ILE-104、
LEU-120、VAL-52π堆叠 PHE-49 AKT 氢键 THR-134、VAL-133 −7.7 疏水 ILE-142、ILE-65、LEU-254、ILE-384、
PRO-111、LEU-130、VAL-73GSK-3β 氢键 ARG-141、VAL-135、TYR-134 −7.3 疏水 ILE-62、TYR-134、VAL-70 -
[1] MEGYESFALVI Z, GAY C M, POPPER H, et al. Clinical insights into small cell lung cancer:Tumor heterogeneity, diagnosis, therapy, and future directions[J]. CA:A Cancer Journal for Clinicians,2023,73(6):620−652.
[2] DE JONG D, DAS J P, MA H, et al. Novel targets, novel treatments:The changing landscape of non-small cell lung cancer[J]. Cancers,2023,15(10):2855. doi: 10.3390/cancers15102855
[3] BAJBOUJ K, AL-ALI A, RAMAKRISHNAN R K, et al. Histone modification in NSCLC:Molecular mechanisms and therapeutic targets[J]. International Journal of Molecular Sciences,2021,22(21):11701. doi: 10.3390/ijms222111701
[4] GUO H Y, ZHANG J, QIN C, et al. Biomarker-targeted therapies in non–small cell lung cancer:Current status and perspectives[J]. Cells,2022,11(20):3200. doi: 10.3390/cells11203200
[5] ZHANG Y L, ZHANG R, XU H L, et al. Anticancer drug resistance:An update and perspective[J]. Drug Resistance Updates,2021,59:100796. doi: 10.1016/j.drup.2021.100796
[6] UNGURIANU A, ZANFIRESCU A, MARGINĂ D. Exploring the therapeutic potential of quercetin:A focus on its sirtuin-mediated benefits[J]. Phytotherapy Research, 2024.
[7] WANG T, LÜ L X, FENG H, et al. Unlocking the potential:Quercetin and its natural derivatives as promising therapeutics for sepsis[J]. Biomedicines,2024,12(2):444. doi: 10.3390/biomedicines12020444
[8] LÜ P J, HAN P L, CUI Y B, et al. Quercetin attenuates inflammation in LPS-induced lung epithelial cells via the Nrf2 signaling pathway[J]. Immunity, Inflammation and Disease,2024,12(2):e1185. doi: 10.1002/iid3.1185
[9] ROY A V, CHAN M, BANADYGA L, et al. Quercetin inhibits SARS-CoV-2 infection and prevents syncytium formation by cells co-expressing the viral spike protein and human ACE2[J]. Virology Journal,2024,21(1):29. doi: 10.1186/s12985-024-02299-w
[10] DAS D, BANERJEE A, MANNA K, et al. Quercetin counteracts monosodium glutamate to mitigate immunosuppression in the thymus and spleen via redox-guided cellular signaling[J]. Phytomedicine,2024,126:155226. doi: 10.1016/j.phymed.2023.155226
[11] WU G J, LIU F Q, CUI Q, et al. Quercetin prevents hspertension in dahl salt-sensitive rats fed a high-salt diet thro ugh balancing endothelial nitric oxide synthase and sirtuin 1[J]. Combinatorial Chemistry & High Throughput Screening, 2024, 27.
[12] BABA R A, MIR H A, MOKHDOMI T A, et al. Quercetin suppresses ROS production and migration by specifically targeting Rac1 activation in gliomas[J]. Frontiers in Pharmacology,2024,15:1318797.
[13] 刘俊新. 生姜提取物和洋葱槲皮素结合对哈尔滨风干肠抑菌保鲜作用的研究[J]. 中国食品添加剂,2018(9):178−182. [LIU J X. Study on antibacterial effects of ginger extracts and onion quercetin on air - dried sausage in Harbin[J]. China Food Additives,2018(9):178−182.] LIU J X. Study on antibacterial effects of ginger extracts and onion quercetin on air - dried sausage in Harbin[J]. China Food Additives, 2018(9): 178−182.
[14] 杨庆林, 吴昊, 刘家言, 等. 槲皮素饲料添加剂延长鸡蛋贮存时间的研究[J]. 中国畜牧兽医,2023,50(6):2342−2353. [YANG Q L, WU H, LIU J Y, et al. Study of quercetin feed additives on prolonging storage time of eggs[J]. China Animal Husbandry & Veterinary Medicine,2023,50(6):2342−2353.] YANG Q L, WU H, LIU J Y, et al. Study of quercetin feed additives on prolonging storage time of eggs[J]. China Animal Husbandry & Veterinary Medicine, 2023, 50(6): 2342−2353.
[15] 徐梦雨. 槲皮素保护皮肤抵抗阳光紫外线损伤的作用及其分子机制[D]. 上海:华东师范大学, 2019. [XU M Y. The mechanism of Quercetin protecting skin from UV damage[D]. Shanghai:East China Normal University, 2019.] XU M Y. The mechanism of Quercetin protecting skin from UV damage[D]. Shanghai: East China Normal University, 2019.
[16] 郝铁兵, 项东, 项颖, 等. 槲皮素在畜牧养殖中应用研究进展[J]. 吉林畜牧兽医,2023,44(10):167−168. [HAO T B, XIANG D, XIANG Y, et al. Research progress on the application of quercetin in animal husbandry[J]. Jilin Animal Husbandry and Veterinary Medicine,2023,44(10):167−168.] HAO T B, XIANG D, XIANG Y, et al. Research progress on the application of quercetin in animal husbandry[J]. Jilin Animal Husbandry and Veterinary Medicine, 2023, 44(10): 167−168.
[17] TANG S M, DENG X T, ZHOU J, et al. Pharmacological basis and new insights of quercetin action in respect to its anti-cancer effects[J]. Klinicka Onkologie,2020,121:109604.
[18] JANA N, BŘETISLAV G, PAVEL S, et al. Potential of the flavonoid quercetin to prevent and treat cancer–current status of research[J]. Klinicka Onkologie:Casopis Ceske a Slovenske Onkologicke Spolecnosti,2018,31(3):184−190.
[19] REYES-FARIAS M, CARRASCO-POZO C. The anti-cancer effect of quercetin:Molecular implications in cancer metabolism[J]. International Journal of Molecular Sciences,2019,20(13):3177.
[20] NOGALES C, MAMDOUH Z M, LIST M, et al. Network pharmacology:Curing causal mechanisms instead of treating symptoms[J]. Trends in Pharmacological Sciences,2022,43(2):136−150. doi: 10.1016/j.tips.2021.11.004
[21] DAINA A, MICHIELIN O, ZOETE V. SwissTargetPrediction:Updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Research,2019,47(W1):W357−W364. doi: 10.1093/nar/gkz382
[22] WISHART D S, KNOX C, GUO A C, et al. DrugBank:A comprehensive resource for in silico drug discovery and exploration[J]. Nucleic Acids Research, 2006, 34(Database issue):668−672.
[23] ZHOU Y, ZHANG Y T, LIAN X C, et al. Therapeutic target database update 2022:facilitating drug discovery with enriched comparative data of targeted agents[J]. Nucleic Acids Research,2022,50(D1):D1398−D1407. doi: 10.1093/nar/gkab953
[24] SZKLARCZYK D, GABLE A L, NASTOU K C, et al. The STRING database in 2021:customizable protein-protein networks, and functional characterization of user-uploaded gene/measurement sets[J]. Nucleic Acids Research,2021,49(D1):D605−D612.
[25] SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape:A software environment for integrated models of biomolecular interaction networks[J]. Genome Research,2003,13(11):2498−2504. doi: 10.1101/gr.1239303
[26] HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nature Protocols,2009,4(1):44−57. doi: 10.1038/nprot.2008.211
[27] KANEHISA M, GOTO S, FURUMICHI M, et al. KEGG for representation and analysis of molecular networks involving diseases and drugs[J]. Nucleic Acids Research,2010,38(suppl_1):D355−D360. doi: 10.1093/nar/gkp896
[28] BURLEY S K, BHIKADIYA C, BI C, et al. RCSB protein data bank:Powerful new tools for exploring 3D structures of biological macromolecules for basic and applied research and education in fundamental biology, biomedicine, biotechnology, bioengineering and energy sciences[J]. Nucleic Acids Research,2021,49(D1):D437−D451. doi: 10.1093/nar/gkaa1038
[29] GU C, STASHKO M A, PUHL-RUBIO A C, et al. Inhibition of inositol polyphosphate kinases by quercetin and related flavonoids:A structure-activity analysis[J]. Journal of Medicinal Chemistry,2019,62(3):1443−1454. doi: 10.1021/acs.jmedchem.8b01593
[30] JACOBS M D, BLACK J, FUTER O, et al. Pim-1 ligand-bound structures reveal the mechanism of serine/threonine kinase inhibition by LY294002[J]. The Journal of Biological Chemistry,2005,280(14):13728−13734. doi: 10.1074/jbc.M413155200
[31] WAGNER F F, BISHOP J A, GALE J P, et al. Inhibitors of glycogen synthase kinase 3 with exquisite kinome-wide selectivity and their functional effects[J]. ACS Chemical Biology,2016,11(7):1952−1963. doi: 10.1021/acschembio.6b00306
[32] TROTT O, OLSON A J. AutoDock Vina:improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. Journal of Computational Chemistry,2010,31(2):455−461.
[33] ADASME M F, LINNEMANN K L, BOLZ S N, et al. PLIP 2021:expanding the scope of the protein–ligand interaction profiler to DNA and RNA[J]. Nucleic Acids Research,2021,49(W1):W530−W534. doi: 10.1093/nar/gkab294
[34] 穆春青, 周磊, 赵楠, 等. 二甲双胍通过PI3K/AKT/GSK3β信号通路对肺癌A549细胞增殖的影响[J]. 吉林大学学报(医学版),2021,47(3):637−643. [MU C Q, ZHOU L, ZHAO N, et al. Effect of metformin on proliferation of lung cancer A549 cells through PI3K/AKT/GSK3β signaling pathway[J]. Journal of Jilin University (Medicine Edition),2021,47(3):637−643.] MU C Q, ZHOU L, ZHAO N, et al. Effect of metformin on proliferation of lung cancer A549 cells through PI3K/AKT/GSK3β signaling pathway[J]. Journal of Jilin University (Medicine Edition), 2021, 47(3): 637−643.
[35] 吴爱兵, 黎明春, 麦宗炯, 等. CK2α通过PI3K/Akt/GSK-3β信号通路调控肺腺癌A549细胞的侵袭及迁移[J]. 中国肺癌杂志,2017,20(4):233−238. [WU A B, LI M C, MAI Z J, et al. CK2α regulates the metastases and migration of lung adenocarcinoma A549 cell line through PI3K/Akt/GSK-3β signal pathway[J]. Chinese Journal of Lung Cancer,2017,20(4):233−238.] WU A B, LI M C, MAI Z J, et al. CK2α regulates the metastases and migration of lung adenocarcinoma A549 cell line through PI3K/Akt/GSK-3β signal pathway[J]. Chinese Journal of Lung Cancer, 2017, 20(4): 233−238.
[36] 袁亚男, 严晓丽, 黄艳洁, 等. PI3K/Akt/GSK-3β通路介导ABC转运蛋白调控人结肠癌HCT-15细胞多药耐药[J]. 中国病理生理杂志,2019,35(12):2201−2207. [YUAN Y N, YAN X L, HUANG Y J, et al. PI3K/Akt/GSK-3β pathway mediates ABC transporter regulating multidrug resistance in human colon cancer HCT-15 cells[J]. Chinese Journal of Pathophysiology,2019,35(12):2201−2207.] YUAN Y N, YAN X L, HUANG Y J, et al. PI3K/Akt/GSK-3β pathway mediates ABC transporter regulating multidrug resistance in human colon cancer HCT-15 cells[J]. Chinese Journal of Pathophysiology, 2019, 35(12): 2201−2207.
[37] HE Y, SUN M M, ZHANG G G, et al. Targeting PI3K/Akt signal transduction for cancer therapy[J]. Signal Transduction and Targeted Therapy,2021,6(1):425. doi: 10.1038/s41392-021-00828-5
[38] 孙嘉玲, 文彬, 杨雪梅, 等. 基于PI3K/AKT/GSK-3β信号通路探讨鳖甲煎丸调控肝癌细胞Hep3B增殖转移的机制[J]. 中华中医药杂志,2021,36(3):1361−1365. [SUN J L, WEN B, YANG X M, et al. Mechanism research of regulation of proliferation and metastasis of hepatoma cells Hep3B by Biejiajian Pill based on PI3K/AKT/GSK-3β signaling pathway[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2021,36(3):1361−1365.] SUN J L, WEN B, YANG X M, et al. Mechanism research of regulation of proliferation and metastasis of hepatoma cells Hep3B by Biejiajian Pill based on PI3K/AKT/GSK-3β signaling pathway[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(3): 1361−1365.
[39] 朱冬菊, 朴炳奎, 秦腾腾, 等. 基于PI3K/Akt信号通路探讨固本解毒方含药血清对肺癌A549细胞EMT的影响[J]. 中国实验方剂学杂志,2022,28(22):93−99. [ZHU D J, PIAO B K, QIN T T, et al. Effect of guben jiedu prescription-medicated serum on epithelial-mesenchymal transition of lung cancer A549 cells:Based on PI3K/Akt signaling pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae,2022,28(22):93−99.] ZHU D J, PIAO B K, QIN T T, et al. Effect of guben jiedu prescription-medicated serum on epithelial-mesenchymal transition of lung cancer A549 cells: Based on PI3K/Akt signaling pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(22): 93−99.
[40] KIM S A, KANG O H, KWON D Y. Cryptotanshinone induces cell cycle arrest and apoptosis of NSCLC cells through the PI3K/Akt/GSK-3β pathway[J]. International Journal of Molecular Sciences,2018,19(9):2739. doi: 10.3390/ijms19092739
-
期刊类型引用(13)
1. 谢耀慧,李成义,冯慧敏,贾妙婷,魏小成. 中药活性成分微生物发酵研究进展. 中成药. 2025(01): 182-187 .  百度学术
百度学术
2. 李萌,曾婷婷,杨金初,徐永明,李欢,马林,饶智. 冠突散囊菌GT-1固态发酵对低次烟叶品质的影响. 陕西科技大学学报. 2024(03): 38-45 .  百度学术
百度学术
3. 赵千慧,周慧玲,秦洋. 冠突散囊菌对高粱酒酿造过程糖化效率的促进作用与原理. 食品与发酵工业. 2024(15): 72-78 .  百度学术
百度学术
4. 吴云迪,刘谢缘,李利君,倪辉. 过氧化氢酶对白芽奇兰茶叶香气成分转化的影响. 食品科学. 2024(22): 164-172 .  百度学术
百度学术
5. 王莹,贾敏,程文婷,袁亚娟. 不同均质时间和稀释液对茯砖茶中冠突散囊菌计数的影响研究. 中外食品工业. 2024(14): 37-39 .  百度学术
百度学术
6. 谢宁轩,张文刚,党斌,郑万财,杨希娟. 冠突散囊菌发酵对青稞多酚组成及其体外抗氧化及糖脂代谢酶抑制活性的影响. 食品与发酵工业. 2024(23): 87-94 .  百度学术
百度学术
7. 冯璞阳,白亚妮,冯志珍,秦涛,陈卫锋. 冠突散囊菌散茶发花工艺提高茯茶品质研究进展. 茶叶. 2023(01): 9-12 .  百度学术
百度学术
8. 尹家全,刘歆旖,王兰,刘素纯. 冠突散囊菌发酵罗汉果渣过程中功能性成分及抗氧化活性的变化. 现代食品科技. 2023(04): 88-95 .  百度学术
百度学术
9. 肖咪,刘利敏,李鹏程,薛宏坤,邹先伟,唐劲天,苏彦奇,蔡旭. 冠突散囊菌发酵湖北海棠茶过程中主要成分及活性研究. 食品科技. 2022(01): 79-86 .  百度学术
百度学术
10. 吉巧琳,陈鑫,莫海英,蔡国磊,杨海英,杜刚. 茯茶中冠突曲霉的分离及比较基因组研究. 食品科技. 2022(05): 21-26 .  百度学术
百度学术
11. 刘璐,袁亚宏,岳田利. 葛根降血压茶的制备及对自发性高血压大鼠的降压作用. 食品与机械. 2022(07): 213-219 .  百度学术
百度学术
12. 党旭辉,周秦羽,刘梦圆,甘汉文,张犇,刘锦,李敏,覃丽,肖文军. 黑茶金花体外抗氧化及降血脂活性研究. 食品安全质量检测学报. 2022(24): 7927-7933 .  百度学术
百度学术
13. 赵敏晶. 茯茶品牌的发展路径探索. 炎黄地理. 2022(11): 53-55 .  百度学术
百度学术
其他类型引用(10)





 下载:
下载:

 下载:
下载:



