Formulation for Muscle Building and Mobility Improvement
-
摘要: 以维生素D(Vitamin D,VD)、β-羟基-β-甲基丁酸钙(Calcium beta-hydroxy-beta-methylbutyrate,HMBCa)和中长链脂肪酸油(Medium-and long-chain triacylglycerols,MLCT)3种原料按1:350000:200000比例组成组合配方,研究其增肌及提高行动力功效。通过地塞米松诱导在斑马鱼幼鱼中建立肌少症模型,测定其肌肉组织形态、髓鞘的荧光强度及肌肉萎缩相关基因表达水平,评价配方对斑马鱼的增肌作用及机制。通过无水亚硫酸钠诱导斑马鱼疲劳模型,测定其活动量及三磷酸腺苷(Adenosine 5'-triphosphate,ATP)、乳酸和活性氧(Reactive oxygen species,ROS)水平,评价配方对斑马鱼运动行为的改善作用及机制。结果表明:配方能够提高肌少症模型斑马鱼肌纤维质量并改善肌肉组织结构。进一步机制研究发现,配方能够促进髓鞘再生,下调肌肉萎缩相关基因(mstnb、myod1、trim63a和fbxo32)的表达。此外,配方能够提高疲劳模型斑马鱼的活动量。进一步机制研究发现,配方在斑马鱼体内具有增加ATP生成、减少乳酸堆积和促进ROS清除作用。综上,配方具有增肌功效和提高行动力功效。
-
关键词:
- 肌少症 /
- 维生素D(VD) /
- β-羟基-β-甲基丁酸钙(HMBCa) /
- 中长链脂肪酸油(MLCT) /
- 斑马鱼肌少症模型 /
- 斑马鱼疲劳模型
Abstract: A formulation composed of vitamin D (VD), calcium β-hydroxy-β-methylbutyrate (HMBCa), and medium-and long-chain triacylglycerols (MLCT) in a precise ratio of 1:350000:200000 was examined for its potential impacts on muscle development and enhancement of mobility. A zebrafish larval model of dexamethasone-induced sarcopenia was used to evaluate the formula's influence on muscle tissue morphology, myelin sheath fluorescence intensity, and the expression of muscle atrophy-related genes. Furthermore, a zebrafish fatigue model induced by sodium sulfite was utilized to assess the formula's effects on mobility, as well as levels of adenosine 5'-triphosphate (ATP), lactate, and reactive oxygen species (ROS) levels, thereby elucidating its impact on zebrafish locomotor behavior and underlying mechanisms. The results indicated that the formulation enhanced muscle fiber quality and improved muscle tissue structure in the zebrafish sarcopenia model. Further detailed studies uncovered that the formulation could stimulate myelin regeneration and suppress the expression of muscle atrophy-related genes (mstnb, myod1, trim63a, and fbxo32). Additionally, the concoction increased the activity level of zebrafish in a fatigue model. More detailed investigations revealed that the formulation could boost ATP production, reduce lactate accumulation, and enhance ROS scavenging in zebrafish. In conclusion, the formula demonstrates significant effects in fostering muscle development and enhancing mobility. -
肌肉减少症(肌少症)是一种进行性和全身性骨骼肌疾病,涉及肌肉质量和功能的加速丧失,与不良后果有关,包括虚弱、跌倒、功能下降和死亡。这种疾病通常在老年人中发生,与年龄相关,不仅受到同时期风险因素的影响,还受到贯穿整个生命过程的遗传和生活方式因素的影响[1]。此外,肌少症也常见于中年人和某些疾病患者,例如癌症[2]、慢性阻塞性肺病、糖尿病和代谢紊乱等[3]。肌少症已成为研究的焦点,旨在将目前有关其病理生理学的知识转化为改进诊断和治疗手段,特别是生物标志物、营养干预和药物的开发,以增强肌肉在运动中的有益作用[4]。
肌少症治疗的目的是逆转或减缓肌肉力量和功能的减退、减少并发症发生,并提高患者的生活质量。现阶段尚缺乏用于治疗肌少症的成熟药物,营养治疗仍是肌少症的主要干预措施之一[5−6]。VD是一种人类必须的脂溶性维生素,通过维生素D受体(Vitamin D receptor,VDR)发挥激素作用。VD/VDR轴在调节肌肉减少性肌肉萎缩的核心生物过程中起关键作用,低的VD水平会导致肌肉蛋白分解增加、线粒体功能受损和肌肉肥胖增加等[7],然而,单独补充VD的疗效有限,且VD不能快速通过尿液排泄,过量补充可能导致蓄积性毒性[8]。HMBCa是由亮氨酸的代谢产物β-羟基-β-甲基丁酸酯(β-Hydroxy-β-methylbutyric acid,HMB)与钙盐组合形成的合成化合物。HMB被认为可以通过减弱蛋白质降解和上调蛋白质合成来减轻衰老,疾病或运动压力引起的肌肉损失[9−11]。补充HMBCa可以有效预防肌肉蛋白质分解代谢,提高整体运动表现,增强耐力并防止疲劳或疲惫[12]。omega-3多不饱和脂肪酸(ω-3 Polyunsaturated fatty acid,ω-3 PUFA)及高热量营养物质,对改善肌少症具有积极作用[13]。研究表明,许多慢性疾病患者的血清炎症因子水平升高,导致其活动能力受限和握力下降。ω-3 PUFA可降低炎症基因的表达,具有抗炎活性,对整体肌肉质量和力量有积极影响[14−15]。中长链脂肪酸油(Medium-and long-chain triacylglycerols,MLCT)在医药和食品领域得到了广泛的应用,包含大量ω-3 PUFA,且具有较高的氧化稳定性和能量产生效率[16]。单一的营养素疗效有限,合理的配方和用量有助于减少副作用,并提高改善效果。
目前,尚无针对肌少症的特效药物上市,营养干预措施对于预防和改善肌少症具有重要的临床意义。本研究通过VD、HMBCa及MLCT组成配方,并通过斑马鱼作为模型研究其增肌及改善运动行为功效。
1. 材料与方法
1.1 材料与仪器
野生型AB品系斑马鱼 杭州环特生物科技股份有限公司;VD、HMBCa、MLCT 瑞哺恩(上海)科技有限公司;乳清蛋白粉 西安百川生物科技有限公司;红景天苷 华中海威(北京)基因科技有限公司;地塞米松、无水亚硫酸钠 上海阿拉丁生化科技股份有限公司;绿色荧光髓鞘染色液(FluoroMyelin Green fluorescent myelin stain,F34651)、活性氧荧光探针(CM-H2DCFDA,C6827) 美国赛默飞世尔科技公司;Mayer苏木素染色液、伊红染色液 上海依赫生物科技有限公司;荧光定量PCR预混液(iTaq Universal SYBR Green Supermix,1725121) 伯乐生命医学产品公司;FastKing cDNA第一链合成试剂盒(去基因组)(KR116) 天根生化科技(北京)有限公司;ATP检测试剂盒(CellTiter-Glo® Luminescent Cell Viability Assay,G7572) 美国普洛麦格公司;乳酸测定试剂盒(A019-2-1) 南京建成生物工程研究所。
SZX7解剖显微镜、X71-F22PH光学显微镜 日本奥林巴斯公司;AZ100电动聚焦连续变倍荧光显微镜 日本尼康公司;Auto-Pure32A全自动核酸提取仪 杭州奥盛仪器有限公司;CFX Connect荧光定量PCR仪 伯乐生命医学产品公司;Zebra Lab 3.22.3.31斑马鱼行为分析系统 ViewPoint(中国)公司。
1.2 实验方法
1.2.1 配方配制
根据前期实验,VD、HMBCa和MLCT按照实际含量比1:350000:200000配制。VD用标准稀释水配制成2.00 mg/mL母液、HMBCa和MLCT分别用标准稀释水配制成20.0 mg/mL母液。用标准稀释水配制成含VD 1.96 μg/mL、HMBCa 1250 μg/mL和MLCT 1000 μg/mL的配方。
1.2.2 斑马鱼喂养及胚胎收集
成年斑马鱼饲养于28 ℃的养鱼用水中(水质:每1 L反渗透水中加入200 mg速溶海盐,电导率为450~550 μS/cm;pH为6.5~8.5;硬度为50~100 mg/L CaCO3),光照周期为14/10 h(光/暗),每日早晚各喂食丰年虾一次。产卵前一天,将雌性和雄鱼(1:2)进行交配,收集鱼卵并及时清理干净,置于28.5±1 ℃培养箱培养。实验动物使用许可证号为:SYXK(浙)2022-0004,饲养管理符合国际AAALAC认证(认证编号:001458)的要求。
1.2.3 配方在斑马鱼肌少症模型中的增肌作用
1.2.3.1 斑马鱼造模、分组及给药
根据文献报道方法进行了改进[17−19]。随机选取3 dpf野生型AB品系斑马鱼于6孔板中,每孔均30尾斑马鱼,标准稀释水定容至3 mL。分别水溶给予配方和乳清蛋白粉125 μg/mL(阳性对照),同时设置正常对照组和模型对照组。除正常对照组外,其余各实验组均在给药同时水溶给予2.00 μmol/L地塞米松,28 ℃处理96 h(48 h换液),建立斑马鱼肌少症模型。
1.2.3.2 检测指标
HE染色:将各组暴露完成后的斑马鱼用4% PFA在4 ℃下固定过夜。固定后,用70%乙醇清洗斑马鱼样本,然后分别经70%乙醇/0.5 h、85%乙醇/0.5 h、95%乙醇/0.5 h、100%乙醇/0.5 h、100%乙醇/0.5 h脱水处理,再用石蜡包埋。将石蜡包埋的组织按5 μm厚度连续切片,并用苏木精和伊红(H&E)染色,对H&E染色的肌肉部位进行盲法观察,用Image Pro plus 6.0软件分析斑马鱼体节间肌纤维面积和间质占比。
髓鞘损伤测定:将各组暴露结束的斑马鱼,立即采用FluoroMyelin Green fluorescent myelin stain对斑马鱼进行活体髓鞘染色。染色结束后,每个实验组随机选取10尾斑马鱼置于荧光显微镜下拍照,用ImageJ v1.53k软件分析并采集数据,分析斑马鱼全身髓鞘荧光强度。
增肌相关基因表达变化(RT-qPCR):根据参考文献报道方法进行[20]。收集各组暴露结束的斑马鱼置于1.5 mL EP管中,液氮速冻,提取各组斑马鱼总RNA,按照Universal RNA Extraction TL Kit C试剂盒说明操作。利用紫外-可见光分光光度计对总RNA浓度和纯度进行测定。取2.00 μg斑马鱼样品总RNA,按照cDNA第一链合成试剂盒说明操作,合成20.0 μL cDNA。在CFX96实时荧光定量PCR仪中使用iTaq Universal SYBR Green Supermix进行qPCR。qPCR反应条件如下:在95 ℃下预变性5 min,然后进行40个循环,其中95 ℃变性5 s,60 ℃退火30 s。平行设置3次生物学重复试验。各基因引物序列如表1所示。
表 1 引物序列信息Table 1. Primer sequence information基因 引物序列 β-actin 前引 5’-TCGAGCAGGAGATGGGAACC-3’ 后引 5’-CTCGTGGATACCGCAAGATTC-3’ mstnb 前引 5’-AGCAGCTGTTACCCAAAGCA-3’ 后引 5’-ACAATGGGGTCAGGTTCTGTG-3’ myod1 前引 5’-AGTCCGAGATCCAACTGCTC-3’ 后引 5’-ATTATTCCGTGCGTCAGCATT-3’ fbxo32 前引 5’-GTCGCTCGTTTTCGGTTCTT-3’ 后引 5’-CTTCCTTGCAGTAGCTCTTCCT-3’ trim63a 前引 5’-GCCCATGTGTGATGTTCACG-3’ 后引 5’-GTTGCTGGCGCCTAGTAGAT-3’ 1.2.4 配方在斑马鱼疲劳模型中的提高行动力作用
1.2.4.1 斑马鱼造模、分组及给药
根据文献报道方法进行了改进[21−22]。随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔均处理30尾斑马鱼,标准稀释水定容至3 mL。分别水溶给予配方,阳性对照红景天苷浓度4000 μg/mL,同时设置正常对照组和模型对照组。28 ℃处理1 d后,除正常对照组外,其余各实验组均水溶给予8.00 mg/mL无水亚硫酸钠,28 ℃继续处理2 h,建立斑马鱼疲劳模型。
1.2.4.2 检测指标
运动行为检测:经配方和无水亚硫酸钠暴露处理后斑马鱼,每个实验组随机选取10尾斑马鱼用行为分析仪检测斑马鱼1 h内的总运动距离。
ATP含量测定:经配方和无水亚硫酸钠暴露处理后斑马鱼,每个实验组随机选取10尾斑马鱼于1.5 mL离心管中,加入裂解液匀浆,按ATP含量测定试剂盒操作检测斑马鱼体内的ATP含量。
乳酸含量测定:经配方和无水亚硫酸钠暴露处理后斑马鱼,加入Lactate Assay Buffer后冰浴匀浆,按照乳酸测定试剂盒说明书检测斑马鱼体内乳酸含量,利用多功能酶标仪采集数据。
斑马鱼体内活性氧(ROS)水平检测[23]:4 dpf野生型AB品系斑马鱼经各样品组28 ℃处理1 d后,每个实验组均加入CM-H2DCFDA,此外,除正常对照组外其余各实验组均水溶给予8.00 mg/mL无水亚硫酸钠,立即将斑马鱼转移至96孔酶标板中,样品及配方与无水亚硫酸钠共同处理2 h后,用多功能酶标仪检测各实验组斑马鱼ROS荧光值。
1.3 数据处理
实验数据分析使用GraphPad Prism 8.0软件,统计学处理结果采用平均数±标准误(mean±SE)表示。用SPSS 26.0软件进行统计学分析。使用柯尔莫戈洛夫-斯米诺夫检验(K-S)进行正态性和方差检验,若服从正态性和方差齐,采用独立样本T检验(二组间)和单因素ANOVA分析(多组间);若不服从正态性或方差不齐,均采用非参数检验进行统计分析。全文中的P值定义如下:P<0.05为有显著统计学差异;P<0.01为有高度显著统计学差异;P<0.001为有极其显著统计学差异。
2. 结果与分析
2.1 配方对斑马鱼肌肉组织结构的影响
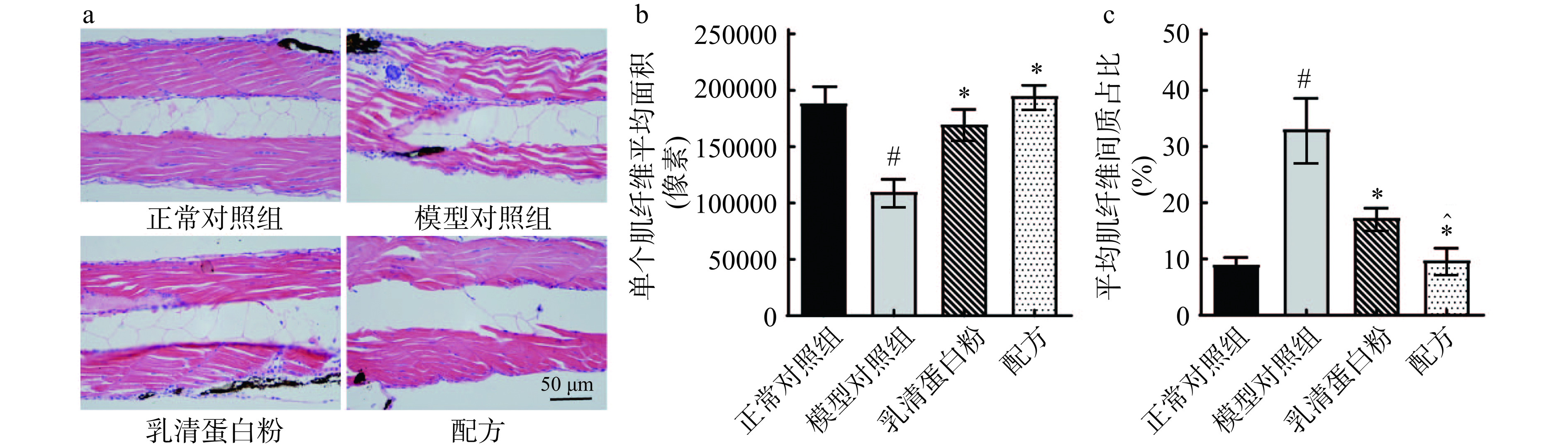
肌肉萎缩过程中肌纤维的丢失会影响个体的功能和生活质量。地塞米松是骨骼肌纤维快速萎缩的诱导剂,利用地塞米松诱导斑马鱼肌少症模型。通过H&E染色对斑马鱼肌肉组织结构进行分析。如图1a所示,对斑马鱼肌肉结构和肌节间肌纤维形态分析。在正常对照组中,肌肉组织形态正常,肌纤维细长,肌节间排列规则且紧密。而模型对照组中,肌纤维结构松散,肌节间排列不整齐,肌纤维间质变宽,肌肉结构发生严重损伤。阳性对照组(乳清蛋白粉)中,斑马鱼肌节间肌纤维排列稍微规律,肌肉组织松散程度减小。通过配方处理后,斑马鱼肌节间肌纤维结构排列较模型对照组紧密有规律,肌肉组织形态得到显著改善。进一步通过对肌节间肌纤维平均面积和肌纤维间质占比进行统计分析,结果表明(图1b和1c),正常对照组中肌节间肌纤维平均面积为188839像素,肌纤维间质占比为9.86%。而模型对照组肌节间单个肌纤维平均面积显著降低(P<0.05)至110322像素,间质占比达到33.1%。与模型对照组相比,阳性对照组肌节间肌纤维平均面积增加至170299像素,间质占比缩小至17.4%。通过配方处理后,肌节间单个肌纤维平均面积为195451像素,间质占比9.86%与正常组相当,增肌作用显著优于乳清蛋白粉(P<0.05)。综上所述,该配方能提高肌纤维质量,改善肌肉组织结构。
2.2 配方对髓鞘的促再生作用
进一步检测地塞米松诱导后,斑马鱼髓鞘的损伤程度,如图2所示,与正常对照组相比,地塞米松处理后斑马鱼髓鞘荧光强度由21759像素极显著减少至3571像素(P<0.001),减少了6倍;乳清蛋白粉和配方处理后,斑马鱼髓鞘荧光强度分别为19957像素和25181像素,髓鞘荧光强度极显著增加(P<0.001),且配方促进髓鞘再生作用极显著优于乳清蛋白粉(P<0.001)。实验结果表明,该配方对地塞米松诱导髓鞘的损伤具有促再生作用。
2.3 配方对肌肉相关基因表达的影响
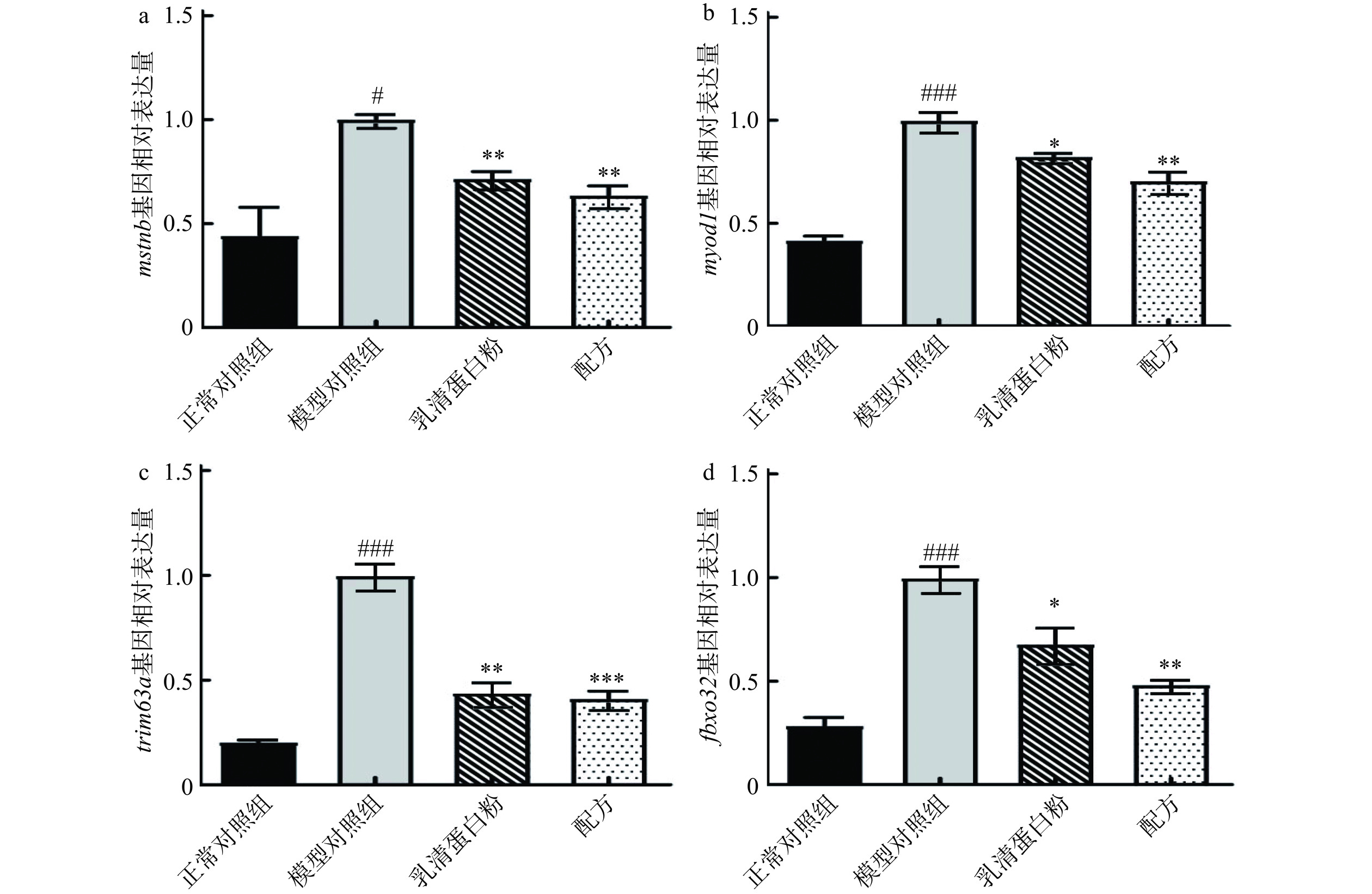
为了探索该配方改善肌肉损伤的机制,进一步检测了斑马鱼中参与肌肉萎缩的关键基因。mstnb是一种促进骨骼肌蛋白降解的因子,能够迅速减少骨骼肌质量并引发肌肉萎缩。myod1与人基因(MYOD1)同源,参与骨骼肌和横纹肌发育过程。糖皮质激素通过在肌纤维中与糖皮质激素受体(GR)的相互作用,限制肌纤维大小,对成年小鼠的快肌质量和力量产生了负面影响。抑制myod1表达可以减少其与GR相互作用,刺激合成代谢途径,从而改善肌肉质量和力量[24]。trim63a(MuRF1)和fbxo32(Atrogin-1)被认为是肌肉萎缩信号传导标志基因,在地塞米松诱导的肌萎缩模型中,它们的表达显著增加[25]。实验结果如图3所示,与正常对照组相比,地塞米松诱导的模型组中,mstnb(P<0.05)、myod1(P<0.001)、trim63a(P<0.001)和fbxo32(P<0.001)表达均显著升高,表明地塞米松可促进骨骼肌蛋白降解,迅速减少骨骼肌质量,并引发骨骼肌萎缩。与模型对照组相比,配方显著下调了mstnb(P<0.01)、myod1(P<0.01)、trim63a(P<0.001)和fbxo32(P<0.01)基因相对表达水平,表明该配方是通过抑制骨骼肌蛋白降解来改善骨骼肌萎缩。
2.4 配方对疲劳斑马鱼运动行为的影响
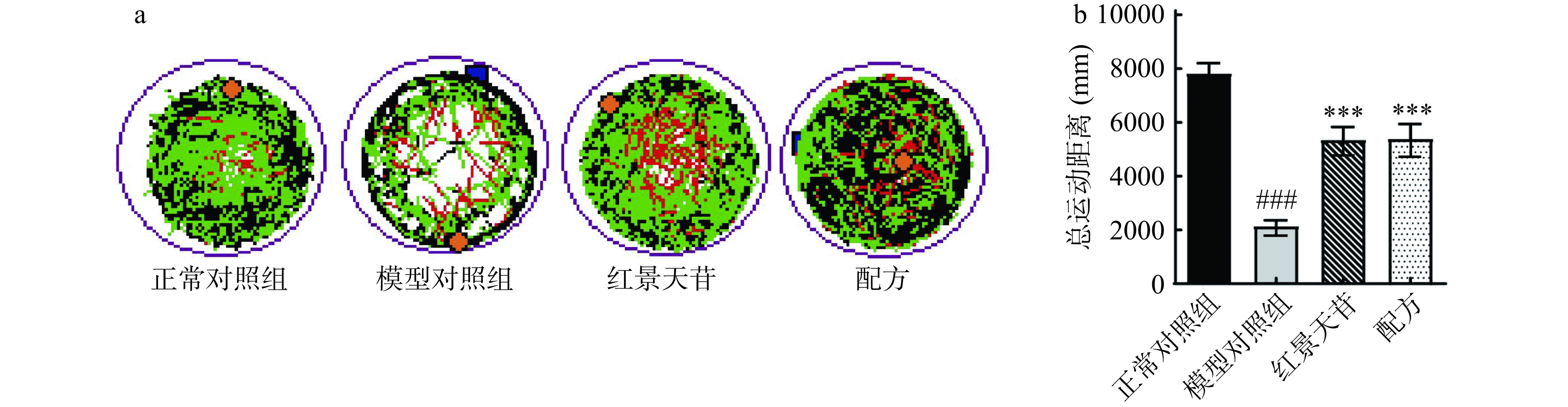
为研究斑马鱼增肌作用是否能促进运动行为,通过无水亚硫酸钠诱导斑马鱼疲劳模型检测配方对斑马鱼运动行为的改善作用。实验结果表明(图4),与正常对照组相比,无水亚硫酸钠诱导(模型组)斑马鱼运动状态极显著减弱(P<0.001),1 h内的总活动距离由7828 mm减少至2153 mm。与模型对照组相比,红景天苷极显著增加了斑马鱼活动量(P<0.001),总活动距离为5361 mm;配方处理后,斑马鱼活动量有极显著提高(P<0.001),总活动距离为5400 mm,与红景天苷效果相当。实验结果表明,配方能有效提高疲劳斑马鱼的行动力。
2.5 配方改善斑马鱼运动行为的调控机制
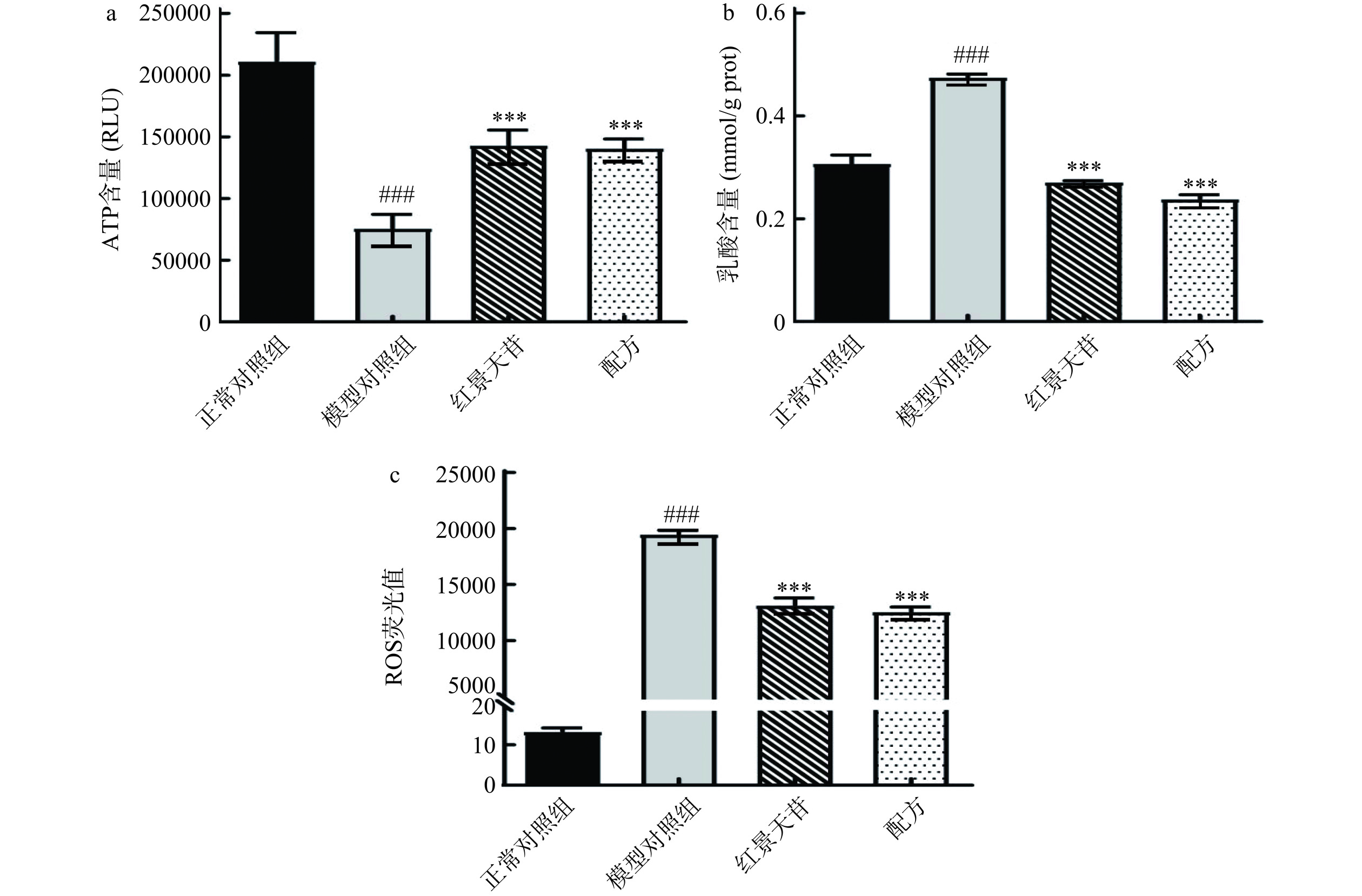
在缺氧状态下,没有足够的氧气参与细胞氧化磷酸化和能量产生(ATP)的过程,机体自发运动将会减弱[26]。进一步检测斑马鱼ATP含量,实验结果见图5a,正常对照组斑马鱼ATP含量211617 RLU。模型对照组斑马鱼ATP含量极显著下降至76206 RLU(P<0.001)。与模型对照组相比,红景天苷和配方处理后,ATP含量分别为143396 RLU(P<0.001)和141003 RLU(P<0.001),均极显著增加了ATP的含量。
此外在缺氧状态下,肌肉储备糖原通过无氧酵解途径生成乳酸,乳酸堆积可使局部H+浓度升高,过量H+直接作用于肌原纤维,抑制肌动蛋白和肌球蛋白的结合,导致肌肉收缩能力下降,机体运动能力减弱[27]。通过试剂盒检测斑马鱼体内乳酸含量,实验结果如图5b所示,正常对照组斑马鱼乳酸含量0.308 mmol/g prot。模型对照组斑马鱼乳酸含量极显著增加至0.476 mmol/g prot(P<0.001),出现乳酸堆积。与模型对照组相比,红景天苷和配方处理后,乳酸含量分别为0.359 mmol/g prot(P<0.001)和0.239 mmol/g prot(P<0.001),极显著减少了乳酸堆积。
氧供应减少,细胞内氧化还原平衡被打破,导致ROS生成增加。过度积累的ROS可能对肌肉细胞造成损伤,导致细胞膜的氧化损伤、蛋白质的氧化修饰和DNA的氧化损伤等。这可能导致肌肉细胞的结构和功能受到损害,进而影响肌肉的正常运动和力量[27]。通过检测斑马鱼体内ROS含量,实验结果如图5c所示,模型对照组斑马鱼ROS大量生成。与模型对照组相比,红景天苷和配方处理后,ROS含量极显著下降(P<0.001),表明二者均具有ROS清除作用。
综上所述,配方可通过促进ATP生成、减少乳酸堆积和促进ROS清除改善斑马鱼运动。
3. 讨论与结论
肌少症的动物模型包括大小鼠、斑马鱼、果蝇及秀丽隐杆线虫等[26]。大小鼠肌少症模型需要特定的仪器(如握力仪、疲劳仪等),实验周期较长(1~10个月),成本相对较高[27]。斑马鱼是一种成熟的模型系统,肌肉发育比哺乳动物更快。在受精后17 h,斑马鱼骨骼肌就会自发收缩,并在48 hpf完成肌肉分化[28]。在时间、成本和实验操作的便利性以及用于肌肉研究的病理学体内跟踪方面具有许多优势。在整个进化过程中,肌肉发育过程和肌肉功能都是高度保守的,同时其骨骼肌占躯干的相当大一部分且在细胞和分子水平、肌纤维和肌节超微结构水平以及收缩特性上与人类肌肉高度相似,是研究调节骨骼肌发育和体内平衡机制的理想模型[29−30]。地塞米松已在大小鼠、体外模型和斑马鱼中用于探索肌肉萎缩的潜在机制[31−32]。由于斑马鱼肌肉功能的变化会引起探索行为、耐力和速度以及代谢和内分泌系统的相关变化,因此斑马鱼非常适合于模拟肌肉萎缩的组织学和行为影响[17]。本研究通过将斑马鱼幼鱼浸泡在地塞米松水溶液中,通过皮肤和鱼鳃的吸收,快速诱导骨骼肌萎缩表型。该模型可在孔板中进行,4 d内即可完成实验,实现了快速大量筛选的需求。
肌肉质量下降主要是由于骨骼肌肌纤维数量和肌纤维横截面积减少造成,根据肌细胞代谢方式不同可将骨骼肌分为慢肌纤维(有氧代谢为主)和快肌纤维(无氧代谢为主)。在肌少症患者中,两种肌纤维的数量和横截面积均明显下降[1,29,33]。哺乳动物的肌肉类型大多数是混合型的,一块肌肉中既包括慢肌纤维,也包括快肌纤维。斑马鱼肌肉和哺乳动物具有相似的解剖学和生理学特征,完全发育的斑马鱼躯干肌肉是圆柱形的多核肌肉纤维,由慢肌纤维(红色肌肉)和快肌纤维(白色肌肉)组成[34]。但与哺乳动物不同的是,斑马鱼骨骼肌的红色肌肉和白色肌肉是分散分布在不同的解剖位置[35]。在斑马鱼肌节内,可以区分出两种类型的肌纤维:位于皮肤下面的红色(慢)肌和位于内部的白色(快)肌。在本研究中,通过HE染色,分析了配方对于肌少症斑马鱼肌肉组织结构的影响,配方处理后斑马鱼整个肌节(包含快肌和慢肌)的肌纤维质量增加,肌肉结构排列恢复。进一步,检测肌肉分解相关基因的表达水平变化,结果表明,配方显著下调肌肉了分解相关基因(mstnb、myod1、fbxo32和trim63a)的表达,说明配方是抑制肌肉分解来发挥减少肌纤维萎缩作用。此外,有文献报道,过量的糖皮质激素增加了海马体的脆弱性,并可能加重运动神经退行性变[31,36],本研究利用神经元转基因荧光斑马鱼及髓鞘荧光染色检测了肌少症斑马鱼的神经损伤,发现肌少症斑马鱼模型的髓鞘荧光强度减弱,说明肌少症斑马鱼出现了髓鞘损伤。本文首次在斑马鱼肌少症模型中,发现并可视化的展示了髓鞘损伤。此外,经验证配方能够促进髓鞘再生,减少运动神经元的损伤。进一步,推测配方可能改善斑马鱼的行动力。利用亚硫酸钠诱导的斑马鱼疲劳模型,进一步验证了配方能有效提高斑马鱼的运动能力,并可增加疲劳斑马鱼体内ATP含量、减少乳酸堆积和增加ROS清除。
综上,VD、HMBCa和MLCT三种营养素组成的配方,有利于减少肌少症的肌肉萎缩,提高疲劳模型中提高斑马鱼的活动量和能量代谢,具有增肌和提高行动力方面的潜力。表明该配方有望成为肌少症患者预防和治疗的选择。
-
表 1 引物序列信息
Table 1 Primer sequence information
基因 引物序列 β-actin 前引 5’-TCGAGCAGGAGATGGGAACC-3’ 后引 5’-CTCGTGGATACCGCAAGATTC-3’ mstnb 前引 5’-AGCAGCTGTTACCCAAAGCA-3’ 后引 5’-ACAATGGGGTCAGGTTCTGTG-3’ myod1 前引 5’-AGTCCGAGATCCAACTGCTC-3’ 后引 5’-ATTATTCCGTGCGTCAGCATT-3’ fbxo32 前引 5’-GTCGCTCGTTTTCGGTTCTT-3’ 后引 5’-CTTCCTTGCAGTAGCTCTTCCT-3’ trim63a 前引 5’-GCCCATGTGTGATGTTCACG-3’ 后引 5’-GTTGCTGGCGCCTAGTAGAT-3’ -
[1] CRUZ-JENTOFT A J, SAYER A A. Sarcopenia[J]. The Lancet,2019,393(10191):2636−2646. doi: 10.1016/S0140-6736(19)31138-9
[2] TANG R, DENG J P, ZHANG L, et al. Prognostic significance of the skeletal muscle index and systemic inflammatory index in patients with lymph node-positive breast cancer after radical mastectomy[J]. BMC Cancer,2022,22(1):234−243. doi: 10.1186/s12885-022-09312-x
[3] TANTAI X, LIU Y, YEO Y H, et al. Effect of sarcopenia on survival in patients with cirrhosis:A meta-analysis[J]. Journal of Hepatology,2022,76(3):588−599. doi: 10.1016/j.jhep.2021.11.006
[4] 裴泽华, 蔡轶男, 王乐兵, 等. 肌少症现状及蛋白质对其预防作用的研究进展[J]. 食品工业科技,2022,43(24):469−477. [PEI Z H, CAI Y N, WANG L B, et al. Research progress of current situation of sarcopenia and the preventive effect of protein on it[J]. Science and Technology of Food Industry,2022,43(24):469−477.] PEI Z H, CAI Y N, WANG L B, et al. Research progress of current situation of sarcopenia and the preventive effect of protein on it[J]. Science and Technology of Food Industry, 2022, 43(24): 469−477.
[5] 郭宇, 赵前程, 李莹, 等. 老年肌少症及其营养干预研究进展[J]. 食品工业科技,2024,45(7):1−13. [GUO Y, ZHAO Q C, LI Y, et al. Research progress on senile sarcopenia and its sutritional intervention[J]. Science and Technology of Food Industry,2024,45(7):1−13.] GUO Y, ZHAO Q C, LI Y, et al. Research progress on senile sarcopenia and its sutritional intervention[J]. Science and Technology of Food Industry, 2024, 45(7): 1−13.
[6] LIU S, ZHANG L, LI S. Advances in nutritional supplementation for sarcopenia management[J]. Frontiers in Nutrition,2023,10:1189522−1189536. doi: 10.3389/fnut.2023.1189522
[7] BOLLEN S E, BASS J J, FUJITA S, et al. The vitamin D/vitamin D receptor (VDR) axis in muscle atrophy and sarcopenia[J]. Cellular Signalling,2022,96:110355. doi: 10.1016/j.cellsig.2022.110355
[8] HATHCOCK J N, SHAO A, VIETH R, et al. Risk assessment for vitamin D[J]. The American Journal of Clinical Nutrition,2007,85(1):6−18. doi: 10.1093/ajcn/85.1.6
[9] CONDE MALDONADO E, MARQUÉS-JIMÉNEZ D, CASAS-AGUSTENCH P, et al. Effect of supplementation with leucine alone, with other nutrients or with physical exercise in older people with sarcopenia:A systematic review[J]. Endocrinologia Diabetesy Nutricion,2022,69(8):601−613. doi: 10.1016/j.endinu.2021.10.006
[10] WILSON G J, WILSON J M, MANNINEN A H. Effects of beta-hydroxy-beta-methylbutyrate (HMB) on exercise performance and body composition across varying levels of age, sex, and training experience:A review[J]. Nutrition & Metabolism,2008,5:1−17.
[11] YANG C, SONG Y, LI T, et al. Effects of beta-hydroxy-beta-methylbutyrate supplementation on older adults with sarcopenia:A randomized, double-blind, placebo-controlled study[J]. Journal of Nutrition Health & Aging,2023,27(5):329−339.
[12] 田林, 陈锦瑶. β-羟基-β-甲基丁酸钙安全性和有效性研究进展[J]. 食品安全质量检测学报,2021,12(16):6565−6572. [TIAN L, CHEN J Y. Research progress on the safety and effectiveness of calcium β-hydroxy-β-methyl butyrate[J]. Journal of Food Safety and Quality,2021,12(16):6565−6572.] TIAN L, CHEN J Y. Research progress on the safety and effectiveness of calcium β-hydroxy-β-methyl butyrate[J]. Journal of Food Safety and Quality, 2021, 12(16): 6565−6572.
[13] VON HAEHLING S, EBNER N, DOS SANTOS M R, et al. Muscle wasting and cachexia in heart failure:Mechanisms and therapies[J]. Nature Reviews Cardiology,2017,14(6):323−341. doi: 10.1038/nrcardio.2017.51
[14] CALDER P C. Omega-3 fatty acids and inflammatory processes:from molecules to man[J]. Biochemical Society Transactions,2017,45(5):1105−1115. doi: 10.1042/BST20160474
[15] BIRD J K, TROESCH B, WARNKE I, et al. The effect of long chain omega-3 polyunsaturated fatty acids on muscle mass and function in sarcopenia:A scoping systematic review and meta-analysis[J]. Clinical Nutrition ESPEN,2021,46:73−86. doi: 10.1016/j.clnesp.2021.10.011
[16] WANG Y, ZHANG T, LIU R, et al. Reviews of medium- and long-chain triglyceride with respect to nutritional benefits and digestion and absorption behavior[J]. Food Research International ,2022,155:111058. doi: 10.1016/j.foodres.2022.111058
[17] RYU B, JE J G, JEON Y J, et al. Zebrafish model for studying dexamethasone-induced muscle atrophy and preventive effect of maca (Lepidium meyenii)[J]. Cells,2021,10(11):2879−2890. doi: 10.3390/cells10112879
[18] CAMPOS L M, RIOS E A, GUAPYASSU L, et al. Alterations in zebrafish development induced by simvastatin:Comprehensive morphological and physiological study, focusing on muscle[J]. Experimental Biology and Medicine,2016,241(17):1950−1960. doi: 10.1177/1535370216659944
[19] HUANG S H, HSIAO C D, LIN D S, et al. Imaging of zebrafish in vivo with second-harmonic generation reveals shortened sarcomeres associated with myopathy induced by statin[J]. PLoS One,2011,6(9):e24764. doi: 10.1371/journal.pone.0024764
[20] OUYANG T, YIN H, YANG J, et al. Tissue regeneration effect of betulin via inhibition of ROS/MAPKs/NF-κB axis using zebrafish model[J]. Biomedecine & Pharmacotherapy,2022,153:113420.
[21] MARINO K M, SILVA E R, WINDELBORN J A. A comparison between chemical and gas hypoxia as models of global ischemia in zebrafish (Danio rerio)[J]. Animal Models and Experimental Medicine,2020,3(3):256−263. doi: 10.1002/ame2.12132
[22] ABDALLAH S J, THOMAS B S, JONZ M G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia[J]. The Journal of Experimental Biology,2015,218(Pt 11):1777−1786.
[23] 李美娟, 劳乔聪, 姜永新, 等. 几种植物原花青素及其片段化产物的抗ROS活性评价[J]. 西部林业科学,2014,43(1):99−103. [LI M J, LAO Q C, JIANG Y X. In vivo anti-ROS activities of the fragmentive products of several proanthocyanidins[J]. Journal of West China Forestry Science,2014,43(1):99−103.] LI M J, LAO Q C, JIANG Y X. In vivo anti-ROS activities of the fragmentive products of several proanthocyanidins[J]. Journal of West China Forestry Science, 2014, 43(1): 99−103.
[24] WANG B Y, HSIAO A W, WONG N, et al. Is dexamethasone-induced muscle atrophy an alternative model for naturally aged sarcopenia model?[J]. Journal of Orthopaedic Translation,2023,39:12−20. doi: 10.1016/j.jot.2022.11.005
[25] CHEN Q, LI C, GONG Z, et al. Common deregulated gene expression profiles and morphological changes in developing zebrafish larvae exposed to environmental-relevant high to low concentrations of glucocorticoids[J]. Chemosphere,2017,172:429−439. doi: 10.1016/j.chemosphere.2017.01.036
[26] 王岩, 马剑雄, 董本超, 等. 肌肉减少症动物模型的研究进展[J]. 中华老年医学杂志,2021,40(8):962−966. [WANG Y, MA J X, DONG B C, et al. Research progress in animal models of sarcopenia[J]. Chinese Journal of Geriatrics,2021,40(8):962−966.] doi: 10.3760/cma.j.issn.0254-9026.2021.08.005 WANG Y, MA J X, DONG B C, et al. Research progress in animal models of sarcopenia[J]. Chinese Journal of Geriatrics, 2021, 40(8): 962−966. doi: 10.3760/cma.j.issn.0254-9026.2021.08.005
[27] 王维, 杨艳, 张伊祎, 等. 肌肉减少症动物模型造模方法研究进展[J]. 成都医学院学报,2023,18(5):658−663,674. [WANG W, YANG Y, ZHANG Y W, et al. Advances in modeling methods for animal models of sarcopenia[J]. Journal of Chengdu Medical College,2023,18(5):658−663,674.] doi: 10.3969/j.issn.1674-2257.2023.05.024 WANG W, YANG Y, ZHANG Y W, et al. Advances in modeling methods for animal models of sarcopenia[J]. Journal of Chengdu Medical College, 2023, 18(5): 658−663,674. doi: 10.3969/j.issn.1674-2257.2023.05.024
[28] BAXTER E C, BRYSON-RICHARDSON R J. Advances in the understanding of skeletal myopathies from zebrafish models[M]. Springer Singapore:Singapore, 2018:151−183.
[29] DAYA A, DONAKA R, KARASIK D. Zebrafish models of sarcopenia[J]. Disease Models & Mechanisms,2020,13(3):dmm042689.
[30] GOODY M F, CARTER E V, KILROY E A, et al. "Muscling" throughout life:Integrating studies of muscle development, homeostasis, and disease in zebrafish[J]. Current Topics in Developmental Biology,2017,124:197−234.
[31] MEYER M, GONZALEZ DENISELLE M C, HUNT H, et al. The selective glucocorticoid receptor modulator CORT108297 restores faulty hippocampal parameters in Wobbler and corticosterone-treated mice[J]. The Journal of Steroid Biochemistry and Molecular Biology,2014,143:40−48. doi: 10.1016/j.jsbmb.2014.02.007
[32] ANDRES-MATEOS E, BRINKMEIER H, BURKS T N, et al. Activation of serum/glucocorticoid-induced kinase 1 (SGK1) is important to maintain skeletal muscle homeostasis and prevent atrophy[J]. EMBO Molecular Medicine,2013,5(1):80−91. doi: 10.1002/emmm.201201443
[33] CHRISTIAN C J, BENIAN G M. Animal models of sarcopenia[J]. Aging Cell,2020,19(10):e13223. doi: 10.1111/acel.13223
[34] MAVES L. Recent advances using zebrafish animal models for muscle disease drug discovery[J]. Expert Opinion on Drug Discovery,2014,9(9):1033−45. doi: 10.1517/17460441.2014.927435
[35] LI S, WEN H, DU S. Defective sarcomere organization and reduced larval locomotion and fish survival in slow muscle heavy chain 1 (smyhc1) mutants[J]. The FASEB Journal,2020,34:1378−1397. doi: 10.1096/fj.201900935RR
[36] ANACKER C, CATTANEO A, LUONI A, et al. Glucocorticoid-related molecular signaling pathways regulating hippocampal neurogenesis[J]. Neuropsychopharmacology,2013,38(5):872−883. doi: 10.1038/npp.2012.253





 下载:
下载:

 下载:
下载:



