Protective Effect of Rosa roxburghii Compound Plant Beverage on Acute Alcohol-induced Liver Injury in Mice
-
摘要: 本实验以刺梨复合植物饮料(Rosa roxburghii Tratt Compound Plant Beverage,RTCPB)为材料,研究了RTCPB对急性酒精性肝损伤小鼠的保护作用。通过53%的食用酒精灌胃诱导雄性ICR小鼠建立急性肝损伤模型。连续给药21 d,通过测定小鼠肝脏指数、甘油三酯(Triglycerides,TG)的含量、血清谷草转氨酶(Aspartate Aminotransferase,AST)、谷丙转氨酶(Alanine Aminotransferase,ALT)以及肝组织中过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)活性、丙二醛(Malondialdehyde,MDA)的含量及肝组织切片病理情况等生理生化指标来评价RTCPB对急性酒精性肝损伤小鼠的保护作用。结果显示,与模型组相比,水飞蓟宾组和RTCPB给药组小鼠肝脏指数显著下降(P<0.05),RTCPB给药组最大降幅为11.78%,RTCPB高剂量组血清中AST、ALT和TG水平分别显著降低50.70%、40.43%、24.64%;肝组织中CAT、SOD、GSH-Px活性分别显著增加33.14%、24.87%、135.04%,MDA含量显著降低29.90%,且肝组织病理切片显示RTCPB给药组小鼠肝损伤情况均有不同程度的改善,尤以RTCPB高剂量组效果最佳。所以,RTCPB对酒精诱导的急性肝损伤具有明显的保护作用。
-
关键词:
- 刺梨复合植物饮料(RTCPB) /
- 急性酒精肝损伤 /
- 保护作用 /
- 抗氧化
Abstract: To study the protective effect of Rosa roxburghii Tratt compound plant beverage (RTCPB) against the acute alcoholic liver injury in mice, alcoholic liver injury models were established with 53% alcohol in male ICR mice using oral gavage. The drug was administered continuously for 21 days, the liver index, the content of triglyceride (TG), the activities of aspartate aminotransferase (AST), alanine aminotransferase (ALT), catalase (CAT), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and malondialdehyde (MDA) contents were determined to evaluate the potential protective effect of RTCPB on acute alcohol-induced liver injury in mice. Meanwhile, the pathology analysis was performed on liver tissue to determine pathological changes. The results showed that the liver indices of mice in silymarin control and RTCPB groups were significantly decreased (P<0.05) compared with the model group. Moreover, the RTCPB group showed the largest decrease of 11.78%, and the levels of AST, ALT, and TG in RTCPB high-dose group were significantly reduced by 50.70%, 40.43%, and 24.64% in serum, respectively. The activities of CAT, SOD and the content of GSH-Px in liver tissues were significantly increased by 33.14%, 24.87%, 135.04%, and MDA content was significantly reduced by 29.90%. The liver pathological section indicated that the RTCPB groups could alleviate the liver injury, especially for high dose group of RTCPB. Therefore, RTCPB possessed the protective effects on alcohol-induced acute liver injury. -
短期或长期过量饮酒是肝脏损伤的主要危险因素之一。酒精性肝损伤(Alcoholic Liver Injury,ALI)是世界范围内,特别是中国总体发病率和死亡率高的主要原因[1−2]。过量饮酒与ALI发展为酒精性肝炎、肝硬化、肝癌密切相关,严重时可导致急性肝衰竭甚至死亡[3−4]。过量饮酒会超过肝脏的解毒能力,会导致乙醛在血液和肝脏[5]中的积累,而乙醛是一种剧毒物质,可激活微粒体乙醇氧化酶系统(Microsomal Ethanol Oxidizing System,MEOS)通路并产生大量活性氧(Reactive Oxygen Species,ROS)[6]。在乙醇的代谢过程中,氧化代谢物乙醛、自由基和丙二醛(Malondialdehyde,MDA)一起产生,而MDA可能与邻近的蛋白质结合产生MDA-乙醛加合物,通过上调细胞因子加剧炎症反应。因此,具有抗氧化活性的物质能够减轻酒精引起的肝脏损伤。
刺梨(Rose roxburghii Tratt)为蔷薇科多年生落叶灌木缫丝花的果实,是贵州省十二大农业特色优势产业之一和药食两用的植物资源[7]。刺梨的抗氧化活性是其较为突出的生物活性之一,且当前的研究中针对其抗氧化活性的研究也较为丰富,如Chen等[8]的研究显示,刺梨水溶性多糖可以明显增强衰老小鼠血清和肝脏中总抗氧化能力(Total Antioxidant Capacity,T-AOC)、提高机体中超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)的水平,并且降低脂质过氧化物(Lipid Peroxidation,LPO)和MDA的水平;李美东等[9]采用超声波辅助提取刺梨籽黄酮并进行工艺优化,通过活性实验评估确定刺梨籽黄酮提取物具有一定的抗氧化性能;Zhan等[10]的研究显示,刺梨冻干粉干预后可有效防止单侧输尿管梗阻大鼠肾脏的氧化应激损伤。相关研究表明,葛根[11−13](Pueraria)、拐枣[14−15](Hovenia acerba)、藤茶[16−17](Ampelopsis grossedentata,AG)在解酒和保护肝脏方面具有良好的活性。葛根和拐枣是中国传统医学中最经典的解酒古方,作为解酒毒的常用药流传至今;藤茶是一种在中国民间流传的古茶,可缓解酒精的毒副作用。当前,对于刺梨解酒保肝作用的研究较多,且葛根、拐枣、藤茶三者单一及联合应用于酒精性肝损伤方面的研究也不少,但目前为止,尚未见对刺梨联合葛根、拐枣、藤茶三者应用于急性酒精性肝损伤防治的研究方面的报道,缺乏全面系统的研究。
基于此,本研究通过动物实验,探究以刺梨为主复合葛根、拐枣、藤茶提取物制成的刺梨复合植物饮料(Rosa roxburghii Tratt Compound Plant Beverage,RTCPB)对急性ALI是否具有预防和改善作用,以期为刺梨解酒护肝产品的开发提供理论和实验依据,也为刺梨这一地方优势资源与其他解酒资源的高值化联合应用拓宽途径,实现资源的优势互补。
1. 材料与方法
1.1 材料与仪器
刺梨复合植物饮料 实验室自制;刺梨原汁、刺梨冻干粉 国药集团贵州大健康产业发展有限公司;葛根(主要成分葛根素)、拐枣(主要成分黄酮)、藤茶(主要成分二氢杨梅素)提取物 陕西慧科植物开发有限公司;水飞蓟宾胶囊(国药准字H20040299) 天津天士力圣特制药有限公司;75%(V/V)食用酒精(批号:20230103) 河南汉永酒精有限公司;甘油三酯(Triglycerides,TG)、MDA、谷丙转氨酶(Alanine Aminotransferase,ALT)、过氧化氢酶(Catalase,CAT)、GSH-Px、谷草转氨酶(Aspartate Aminotransferase,AST)、SOD试剂盒、总蛋白定量试剂盒 南京建成生物工程有限公司;其他实验中所用到的试剂均为分析纯;水为去离子水;60只SPF级雄性ICR小鼠 斯贝福(北京)生物技术有限公司,质量为20±2 g,许可证号:SCXK(京)2019-0010,质量合格证号:110324231106020414,动物实验条件获得贵州医科大学动物实验伦理的认可,且符合所制定的伦理学要求,动物实验单位使用许可证编号:SYXK(贵)2023-0002,饲养温度22±2 ℃,相对湿度55%±5%;每天光照12 h;自由进食和饮水。
FA2004N型电子天平 上海菁海仪器有限公司;SCI-VS可调式混匀仪 济南博航生物技术有限公司;UV-1800紫外可见分光光度计 岛津仪器(苏州)有限公司;VICTOR Nivo酶标仪 珀金埃尔默企业管理有限公司;5427R高速冷离心机 德国Eppendor公司;GZX-9420 MBE电热恒温鼓风干燥箱 上海博迅实业有限公司医疗设备厂;SWE-FP低温冷冻研磨仪 武汉塞维尔生物科技有限公司;RM2016病理切片机 上海徕卡仪器有限公司。
1.2 实验方法
1.2.1 刺梨复合植物饮料制备
新鲜刺梨洗净后控干水分,榨汁,过滤备用;用17%的热水溶解5%刺梨冻干粉、0.8%葛根、0.8%拐枣和2%藤茶提取物后与70%刺梨原汁混合均匀,加入4.5%木糖醇调味,罐装、85~95 ℃热水循环式杀菌30 min,即得刺梨复合植物饮料,主要成分为:70%刺梨原汁、5%刺梨汁冻干粉、0.8%葛根提取物、0.8%拐枣提取物、2%藤茶提取物。
1.2.2 实验动物分组
实验小鼠适应性喂养7 d后,采用随机分组方法,每组10只,分别为RTCPB低(RTCPB-L)、中(RTCPB-M)、高剂量(RTCPB-H)组、空白(NC)组、模型(MC)组、阳性(PC)组。
1.2.3 急性ALI小鼠模型建立及给药
试验期间NC与MC组每天按照10 mL/kg灌胃去离子水;PC组每天按照54 mg/kg浓度灌胃阳性药(水飞蓟宾胶囊);RTCPB-L组灌胃刺梨复合植物饮料稀释2倍后的液体、RTCPB-M组灌胃刺梨复合植物饮料原液、RTCPB-H组灌胃刺梨复合植物饮料浓缩2倍后的液体;NC、MC、PC及各RTCPB各组均按10 mL/kg的灌胃体积提前预防性给予相应药物。连续给药21 d,从第19 d开始,每天灌胃结束3 h后,除正常组外,其余按12 mL/kg灌胃53%的食用酒精,连续3 d,参考Song等[18]和Li等[19]的造模方法并稍加修改,建立小鼠急性ALI模型。
1.2.4 小鼠醉酒与醒酒时间测定
第21 d,给药3 h后给小鼠灌酒结束立即开始计时,将小鼠腹部向上,若半分钟内小鼠没有调转姿势,则可以说明此时小鼠已经醉酒,即翻正反射消失,这段时间称为醉酒时间;若半分钟内小鼠调转姿势,则说明醒酒,这段时间称为醒酒时间[20]。在这过程中做好两个时间的记录。
1.2.5 小鼠血清标本制备
末次灌胃体积分数为53%(V/V)的食用酒精后,禁食不禁水12 h。将小鼠麻醉并摘眼球取血,取好的血液放置于室温下静置2 h,高速冷冻离心机提前预冷并于4 ℃条件下,3500 r/min离心10 min,取上层血清,分装为每管50 µL置于−80 ℃冰箱中保存备用。
1.2.6 小鼠肝组织标本制备
将1.2.5中取血完成后的小鼠处死,取出肝组织,将表面多余的血渍拭干,将肝组织分装成试剂盒测定所需质量,于−80 ℃冰箱中保存备用。
1.2.7 小鼠肝脏指数计算
参照文献[21],采用颈椎脱臼法处死小鼠,将完整的小鼠肝脏取出,放入预冷的生理盐水中漂洗两到三遍,用滤纸将肝脏表面的血渍和生理盐水擦拭干净,称量并记录肝脏质量。按如下公式计算小鼠肝脏指数:
W(%)=aA×100 式中:W表示肝脏指数,%;a表示小鼠肝脏质量,g;A表示小鼠体重,g。
1.2.8 小鼠生理生化指标测定
为避免反复冻融使血清和肝组织中的活性成分降解,按试剂盒要求用量,从−80 ℃冰箱中取出分装好的血清和肝脏组织,按试剂盒使用方法依次测定血清中的TG含量,AST、ALT酶活和肝组织中的GSH-Px、CAT、SOD、MDA水平。
1.2.9 小鼠肝组织病理学观察与评分
参照文献[22],稍加修改,用生理盐水洗净表面血渍,取各组小鼠肝组织的同一部分,放入4%多聚甲醛组织固定液固定24 h以上,进行染色,切片和光学显微镜观察,参考温萍等[23]的方法评分,1分:肝细胞未出现明显变性或坏死,未发生细胞肿胀及炎性细胞浸润等现象,肝索排列整齐;2分:肝细胞发现有肿胀现象,且呈局限性变性或坏死,偶尔可见炎性细胞浸润,肝小叶组织结构有一定改变;3分:肝细胞呈弥散性变性及肿胀表现,可发现有炎性细胞局限性浸润现象,肝索排列不齐;4分:肝细胞出现脂滴且呈水样变性,细胞核固缩,细胞间隙变大,肝小叶组织结构破坏严重。
1.3 数据处理
采用SPSS 26.0分析数据并用GraphPad Prism 8.0.2软件作图,结果均以“mean±SD”表示。采用单因素方差分析评估两组间的均数差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2. 结果与分析
2.1 RTCPB对急性ALI小鼠醉酒与醒酒时间的影响
研究中常以翻正反射的发生和消失来判断小鼠是否酒精中毒[24]。如表1所示,与MC组翻正反射消失与恢复的时间相比,PC和RTCPB组都能极显著延长翻正反射消失的时间(除RTCPB-L组外)和缩短翻正反射恢复的时间(P<0.01),说明刺梨复合植物饮料能够起解酒作用,延长小鼠未醉酒时间并且发挥其醒酒功能缩短醒酒时间,来缓解和改善小鼠急性酒精中毒情况。
表 1 RTCPB对急性ALI小鼠翻正反射的影响Table 1. Effect of RTCPB on righting reaction time in mice with acute ALI组别 翻正反射消失时间(min) 翻正反射恢复时间(min) MC 20.42±10.33 68.23±17.38 PC 36.8±9.19** 33.88±7.10** RTCPB-L 20.63±8.99 58.33±5.85** RTCPB-M 41.83±7.55** 47.9±9.48** RTCPB-H 47.86±13.67** 34.14±5.61** 注:**表示与模型组相比差异极显著,P<0.01。 2.2 RTCPB对急性ALI小鼠肝脏指数的影响
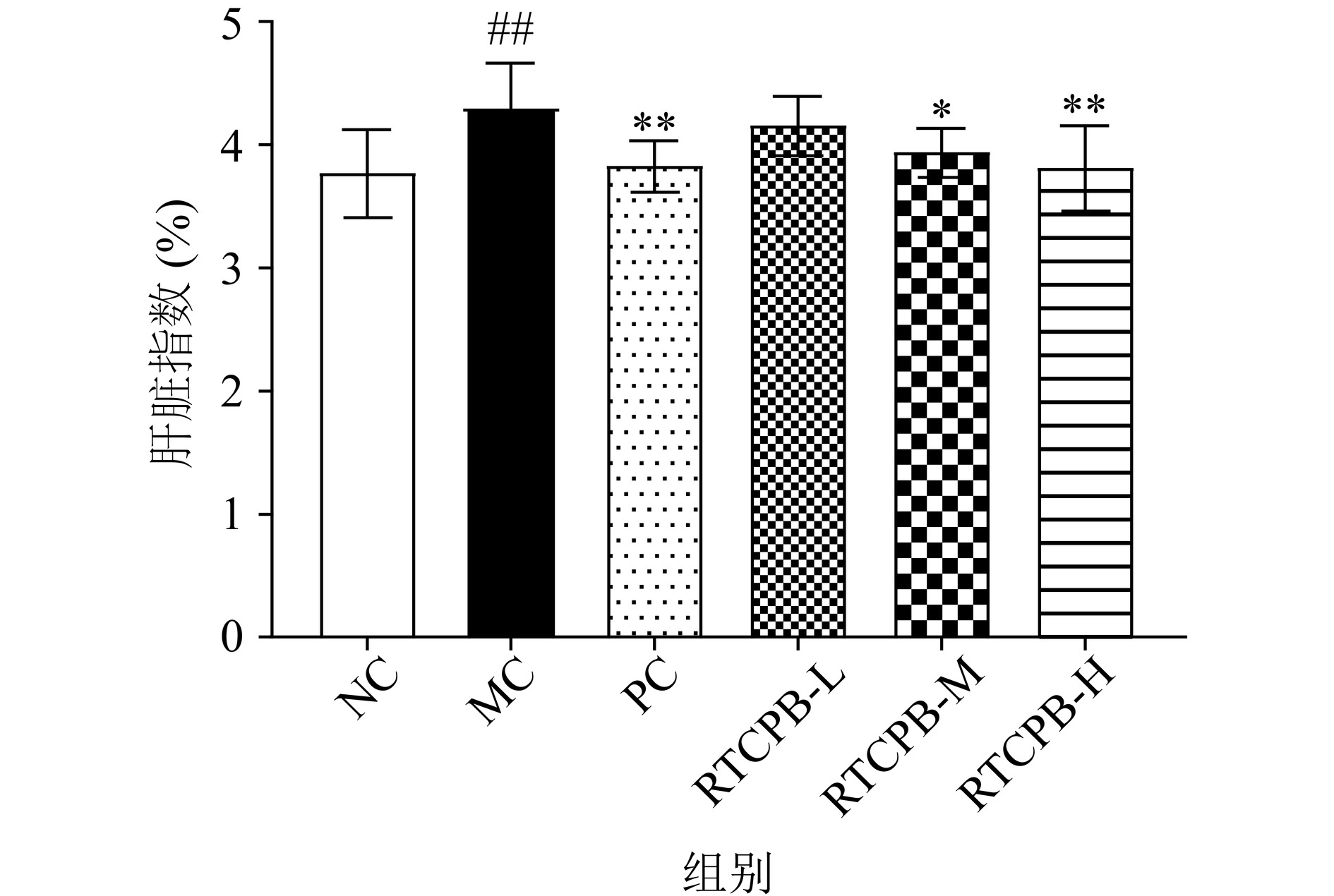
酒精摄入过多时会使机体代谢酒精的能力不足,从而代谢不畅对肝脏造成损伤,使肝脏呈现肿大的情况,造成肝脏整体质量和体积的增加,而肝脏肿大是酒精性肝病临床上常见的症状[25],肝脏的肿大程度常以肝脏指数来衡量[26]。由图1可知,与NC组相比,MC组小鼠的肝脏指数上调了14.85%,上调的原因可能是连续灌胃过量的酒精,在机体内无法及时代谢,使小鼠的肝脏发生了肝肿胀现象,可以初步表明此次造模成功。而与MC相比,PC对照组和RTCPB中、高剂量组的小鼠肝脏指数均有显著性下调(P<0.05),分别下调了8.78%、11.78%,其中肝脏指数下调效果最显著的是RTCPB高剂量组,且下调后接近正常组。
2.3 RTCPB对急性ALI小鼠血清中TG含量、AST和ALT酶活的影响
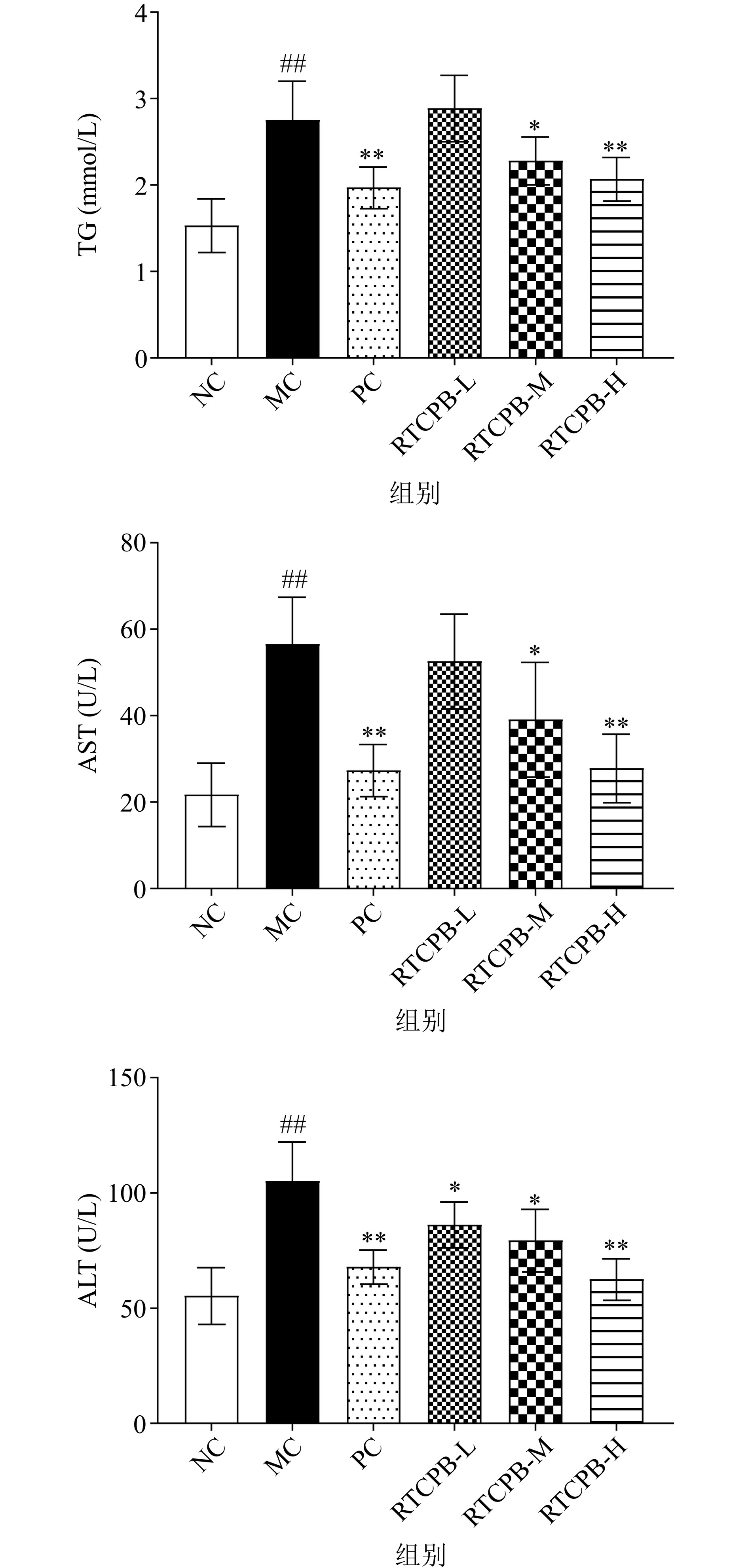
脂质代谢紊乱是ALI的常见症状,原因主要是由于机体摄入的酒精不能被及时代谢或清除使脂质代谢紊乱,诱导脂肪变性,导致血脂转运受阻进而沉积在肝细胞中使TG等相应指标含量升高[27]。AST、ALT分别存在于生物体肝细胞的胞浆和线粒体中,生理状态下,其含量极低,但当细胞膜受损后AST和ALT就会被释放入血液,使血清中AST和ALT水平显著提高[28],所以AST、ALT是临床上常用于评估肝功能的特征性指标[29]。如图2所示,与NC组相比,MC组的TG、AST、ALT水平显极著升高79.22%、160.19%、89.19%(P<0.01),这与Chen等[30]的结果的趋势一致,表示造模成功;与MC组相比,RTCPB中、高剂量组能够显著降低TG、AST、ALT水平(P<0.05),其中PC组和RTCPB-H剂量组效果最好,分别使TG、AST、ALT水平显著降低28.26%、51.58%、35.34%和24.64%、50.70%、40.43%。
2.4 RTCPB对急性ALI小鼠肝组织中SOD、MDA、CAT、GSH-Px水平的影响
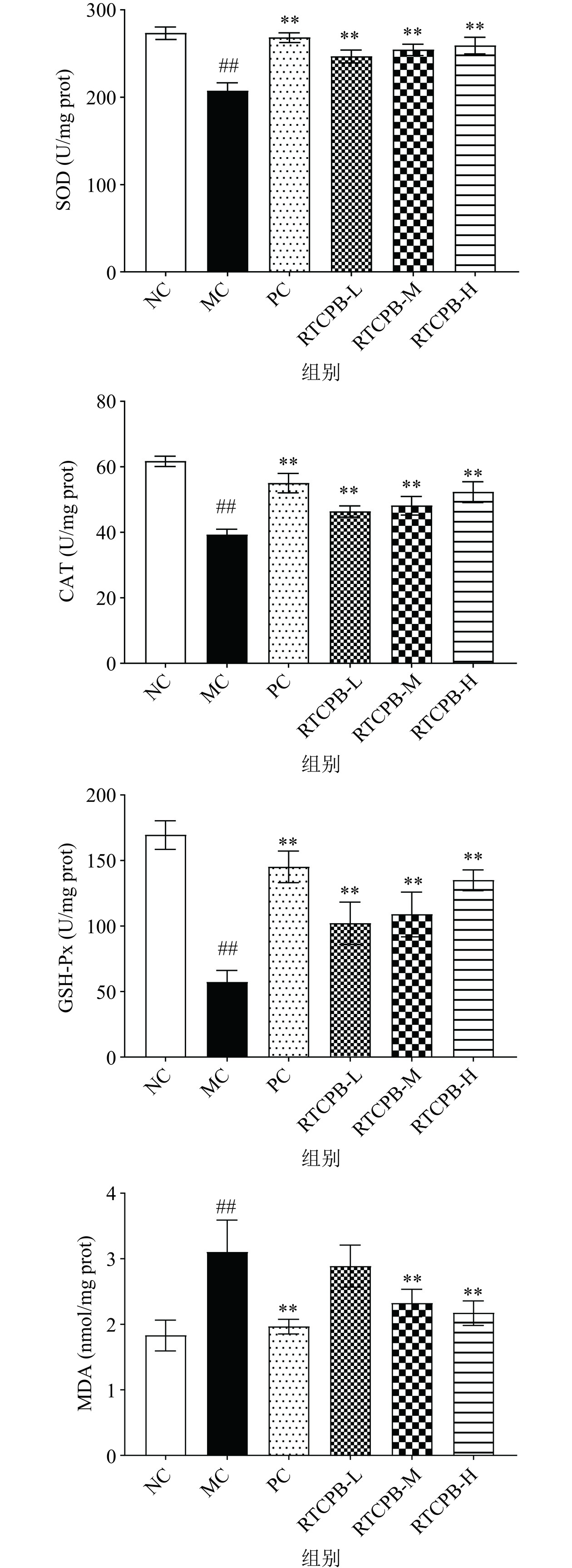
酒精口服进入体内主要在肝脏中进行代谢,当短期内摄入过多的酒精时,其在体内代谢不充分便会产生大量有害的活性氧,进而破坏机体的抗氧化防御系统,从而导致氧化应激,产生有害自由基[31]。CAT、GSH-Px和SOD是机体主要的抗氧化酶,能够维持机体的氧化还原平衡,将机体有害的自由基清除[32]。MDA是机体中重要的脂质过氧化产物之一[33],可以反映机体的脂质过氧化水平,而肝细胞膜的过氧化程度和肝细胞的受损程度可以通过检测MAD的含量间接评估[34−35]。如图3可知,与空白组相比,模型组的SOD、CAT活性和GSH-Px含量极显著降低24.09%、36.26%、66.09%(P<0.01),MDA含量极显著升高69.02%(P<0.01),提示酒精的暴露使小鼠肝脏发生氧化应激,导致肝细胞受损,进一步证明了模型建立成功;与模型组相比,阳性组和RTCPB各给药剂量组对肝组织中的生化指标都有不同程度的改善,表明RTCPB作为一种抗氧化剂可以降低酒精引起的氧化应激,平衡机体的氧化还原系统。RTCPB低、中、高剂量组使SOD的活性极显著升高18.88%、22.64%、24.87%(P<0.01),CAT活性极显著升高18.08%、22.52%、33.14%(P<0.01),GSH-Px酶活力极显著升高77.78%、89.87%、135.04%(P<0.01);RTCPB中、高剂量组使MDA含量极显著降低25.08%、29.90%(P<0.01),且随着RTCPB剂量的增加肝组织的保护和改善效果也发生相应的改变,呈现一定的量效关系。
2.5 RTCPB对急性ALI小鼠肝脏病理变化的影响
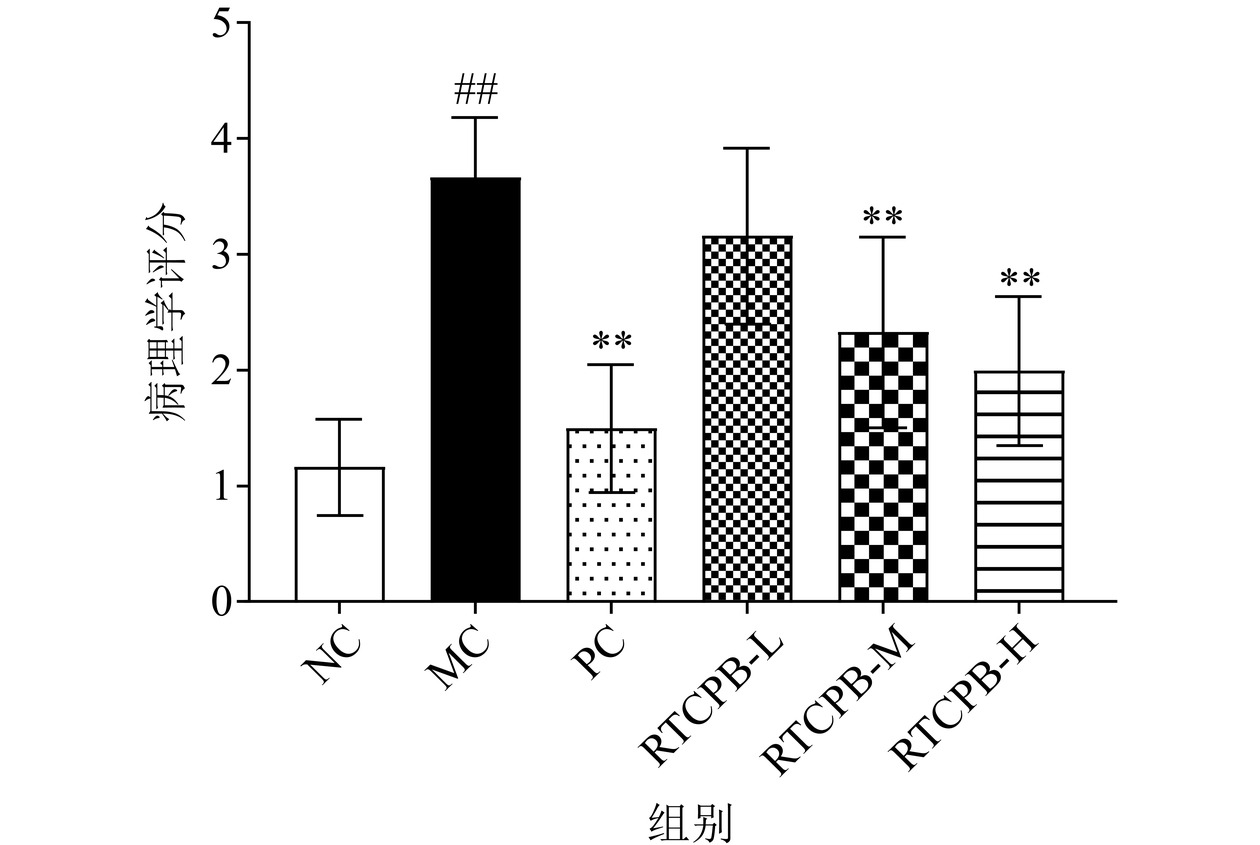
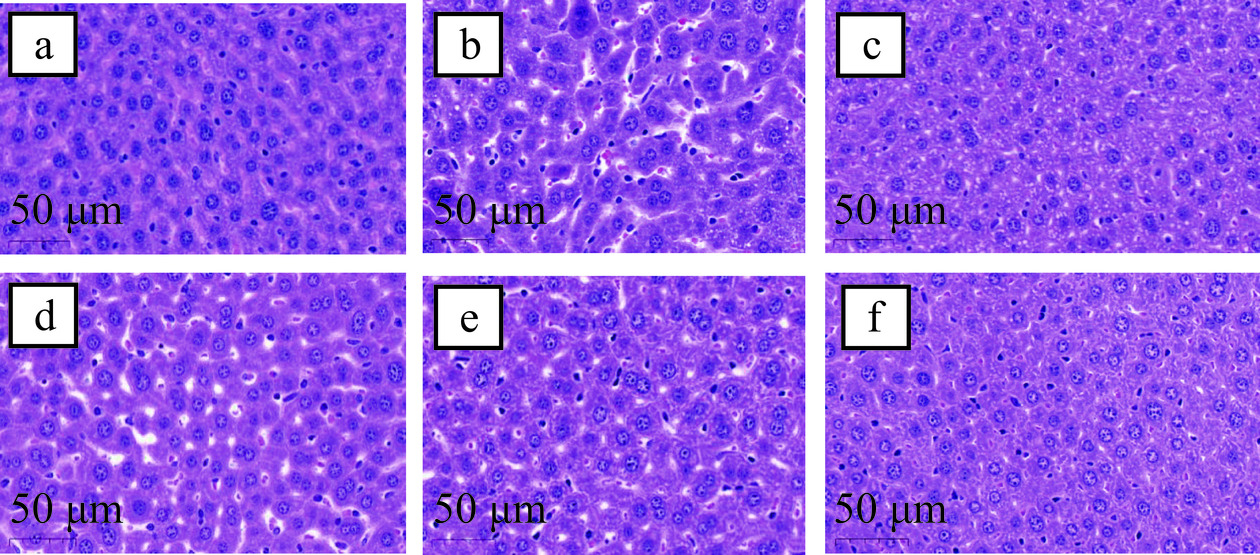
肝脏组织病理学是判断肝脏受损程度的金标准,在各类肝损伤模型中被广泛运用[36]。肝组织HE染色病理切片可以直接观察肝组织受损情况,是评估肝脏受损的有力证据。如图4~图5所示,空白对照组(图5a)细胞核结构清晰,肝细胞成放射状且排列整齐,小鼠的肝小叶构造清晰,界板整齐,肝窦无充血现象,病理学评分最低(1.17±0.41);而模型组(图5b)细胞核发生固缩,细胞之间的间隙变大,细胞索排列零乱,发生点状坏死和炎性浸润,出现脂滴现象,小鼠肝小叶的界线变得模糊,病理学评分最高(3.67±0.52),说明通过一次性灌胃大量的酒精使得小鼠的肝脏发生明显的损伤;与模型组相比,阳性对照组和RTCPB给药低、中、高剂量组的肝组织病理损伤情况都有不同程度的减轻和改善,病理学评分分别为1.50±0.55、3.17±0.75、2.33±0.82、2.00±0.63,呈明显下降趋势,且RTCPB低剂量组(图5d)和RTCPB中剂量组(图5e)肝细胞排列逐渐趋于整齐,但还可见少数炎症细胞,而RTCPB高剂量组(图5f)和阳性组(图5c),肝细胞排列整齐,细胞间的间隙已恢复,细胞点状坏死和炎性浸润大大减少,细胞核形态趋于完善。
3. 讨论与结论
刺梨作为药食两用的天然产物,具有优良的抗氧化能力,能够平衡机体代谢乙醇时发生的氧化还原系统的失衡,降低氧化应激水平,减轻肝脏所受损害。本实验选用刺梨作为主要原料,制成实验室用刺梨复合植物饮料(RTCPB),通过建立小鼠急性酒精性肝损伤模型,从解酒功能行为学实验和体内生理生化指标测定以及病理学形态变化等方面分析RTCPB的解酒保肝作用。结果表明,造模后模型组各项生理生化指标与空白组差异显著(P<0.05),表明连续灌胃大量酒精后,小鼠机体发生了急性酒精性肝损伤。而与模型组相比,从解酒功能行为学观察可猜测RTCPB能够通过发挥解酒作用来缓解和改善酒精对小鼠的急性中毒情况,且RTCPB中、高剂量组小鼠肝脏指数显著降低(P<0.05),肝脏中的抗氧化酶(SOD、CAT、GSH-Px)活力显著升高(P<0.05),血液中的AST、ALT、TG和肝组织中MDA的含量显著降低(P<0.05)。
有研究表明氧化应激是急性ALI中毒和机体发生损伤的主要原因,其使肝细胞中的抗氧化酶系统(如SOD和GSH-Px等)水平下降,发生氧化损伤,破坏肝细胞的膜结构和改变其通透性[37],使转氨酶(ALT和AST)从细胞破损逸出,进入血液循环,导致血清中ALT、AST水平升高[38],本实验的研究结果与丁荣荣等[21]的研究结果相似,提示RTCPB能够在急性ALI状态下有效维持体内的氧化还原平衡,抑制酒精代谢过程中的脂质过氧化和氧化损伤产物的增加,进而发挥解酒保肝作用。一次性摄入机体的酒精过多,超过机体分解酒精的能力,则会导致急性醉酒并引起一些列损害机体的反应,如分解酒精相关的酶失去活性、机体氧化还原系统被打破发生氧化应激、脂质的合成与转运受阻等[39],而本研究中刺梨复合植物饮料发挥解酒保肝作用的原因可能在于保护细胞膜完整,阻碍转氨酶入血、提高机体的抗氧化酶系统的水平、恢复脂质的合成与转运等。
综上所述,刺梨复合植物饮料能够通过降低肝脏指数、TG、MDA含量、转氨酶水平(AST、ALT)及提高SOD、CAT、GSH-Px的水平来改善和保护受损的肝细胞和肝组织,对酒精诱导的急性肝损伤小鼠具有明显的保护作用,随着剂量的升高,保护作用也更加明显;并且通过延长小鼠未醉酒时间和缩短醒酒时间来发挥解酒保肝作用,相较于人工合成的药物具有一定的优势,未来在功能性食品、保健品以及医药领域将具有广阔的发展前景,也为刺梨解酒护肝产品的开发提供了一定的理论和实验基础。
-
表 1 RTCPB对急性ALI小鼠翻正反射的影响
Table 1 Effect of RTCPB on righting reaction time in mice with acute ALI
组别 翻正反射消失时间(min) 翻正反射恢复时间(min) MC 20.42±10.33 68.23±17.38 PC 36.8±9.19** 33.88±7.10** RTCPB-L 20.63±8.99 58.33±5.85** RTCPB-M 41.83±7.55** 47.9±9.48** RTCPB-H 47.86±13.67** 34.14±5.61** 注:**表示与模型组相比差异极显著,P<0.01。 -
[1] DING R B, TIAN K, HUANG L L, et al. Herbal medicines for the prevention of alcoholic liver disease:A review[J]. Journal of Ethnopharmacology,2012,144(3):457−465. doi: 10.1016/j.jep.2012.09.044
[2] MATHURIN P, BATALLER R. Trends in the management and burden of alcoholic liver disease[J]. Journal of Hepatology,2015,62(1):S38−S46. doi: 10.1016/j.jhep.2015.03.006
[3] MENG B, ZHANG Y Z, WANG Z Q, et al. Hepatoprotective effects of Morchella esculenta against alcohol-induced acute liver injury in the C57BL/6 mouse related to Nrf-2 and NF-kappa B signaling[J]. Oxidative Medicine and Cellular Longevity,2019,2019:6029876.
[4] ZHONG F, HU Z, JIANG K, et al. Complement C3 activation regulates the production of tRNA-derived fragments Gly-tRFs and promotes alcohol-induced liver injury and steatosis[J]. Cell Research,2019,29(Suppl 3):548−561.
[5] QU L, ZHU Y, LIU Y, et al. Protective effects of ginsenoside Rk3 against chronic alcohol-induced liver injury in mice through inhibition of inflammation, oxidative stress, and apoptosis[J]. Food and Chemical Toxicology,2019,126:277−284. doi: 10.1016/j.fct.2019.02.032
[6] ZHOU Y, TAN F, LI C, et al. White peony (fermented Camellia sinensis) polyphenols help prevent alcoholic liver injury via antioxidation[J]. Antioxidants,2019,8(11):524. doi: 10.3390/antiox8110524
[7] 吕佳敏, 刘同亭, 田瑛. 刺梨的主要医学功效及应用研究进展[J]. 实用医药杂志,2018,35(4):370−372. [LÜ J M, LIU T T, TIAN Y. Research progress on main medical effect and application of Cili[J]. Practical Journal of Medicine Pharmacy,2018,35(4):370−372.] LÜ J M, LIU T T, TIAN Y. Research progress on main medical effect and application of Cili[J]. Practical Journal of Medicine Pharmacy, 2018, 35(4): 370−372.
[8] CHEN G J, KAN J Q. Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J]. International Journal of Biological Macromolecules,2018,107(Pt A):166−174.
[9] 李美东, 罗凯, 黄秀芳. 超声波辅助提取刺梨籽黄酮工艺优化及其体外抗氧化活性研究[J]. 湖北民族大学学报(自然科学版),2020,38(1):7−12,63. [LI M D, LUO K, HUANG X F. Ultrasonic-assisted extraction of flavone from Rosa roxbunghii seeds and lts antioxidant activity in vitro[J]. Journal of Hubei Minzu University (Natural Science Edition),2020,38(1):7−12,63.] LI M D, LUO K, HUANG X F. Ultrasonic-assisted extraction of flavone from Rosa roxbunghii seeds and lts antioxidant activity in vitro[J]. Journal of Hubei Minzu University (Natural Science Edition), 2020, 38(1): 7−12,63.
[10] ZHAN J, LIU M , PAN L, et al. Oxidative stress and TGF-β1/smads signaling are involved in Rosa roxburghii fruit extract alleviating renal fibrosis[J]. Evidence-based Complementary and Alternative Medicine,2019,2019(5):1−11.
[11] CHEN X, LI R, LIANG T, et al. Puerarin improves metabolic function leading to hepatoprotective effects in chronic alcohol- induced liver injury in rats[J]. Phytomedicine,2013,20(10):849−852. doi: 10.1016/j.phymed.2013.04.001
[12] FENG R B, HUA J, LIU C H, et al. A combination of Pueraria lobata and Silybum marianum protects against alcoholic liver disease in mice[J]. Phytomedicine International Journal of Phytotherapy & Phytopharmacology,2019,58:152824.
[13] 朱振元, 薛婧, 刘晓翠, 等. 葛根素及葛根异黄酮对小鼠急性醉酒预防和解酒效果的研究[J]. 食品科学,2014,35(15):247−250. [ZHU Z Y, XUE J, LIU X C, et al. Puerarin and isoflavones from kudzu root (Pueraria lobata Ohwi) prevent acute drunkenness and relieve alcoholism in mice[J]. Food Science,2014,35(15):247−250.] doi: 10.7506/spkx1002-6630-201415050 ZHU Z Y, XUE J, LIU X C, et al. Puerarin and isoflavones from kudzu root (Pueraria lobata Ohwi) prevent acute drunkenness and relieve alcoholism in mice[J]. Food Science, 2014, 35(15): 247−250. doi: 10.7506/spkx1002-6630-201415050
[14] 李志满, 邵紫君, 李珊珊, 等. 人参枳椇子提取物对小鼠酒精性肝损伤的保护作用[J]. 食品工业科技,2019,40(14):302−306, 313. [LI Z M, SHAO Z J, LI S S, et al. Protective effect of extract from Panax ginsen and Hovenia dulcis Thunb against alcohol-induced liver injury in mice[J]. Science and Technology of Food Industry,2019,40(14):302−306, 313.] LI Z M, SHAO Z J, LI S S, et al. Protective effect of extract from Panax ginsen and Hovenia dulcis Thunb against alcohol-induced liver injury in mice[J]. Science and Technology of Food Industry, 2019, 40(14): 302−306, 313.
[15] XU F, GAO M, LI H, et al. Three new bisflavonols from the seeds of Hovenia dulcis Thunb. and their anti RSV activities[J]. Fitoterapia,2020,143:104587. doi: 10.1016/j.fitote.2020.104587
[16] QIU P, DONG Y, LI B, et al. Dihydromyricetin modulates p62 and autophagy crosstalk with the Keap-1/Nrf2 pathway to alleviate ethanol-induced hepatic injury[J]. Toxicology Letters,2017,274:31−41. doi: 10.1016/j.toxlet.2017.04.009
[17] LI H, LI Q, LIU Z, et al. The versatile effects of dihydromyricetin in health[J]. Evidence-based Complementary and Alternative Medicine,2017,6:1−10.
[18] SONG X H, YIN S T, HUO Y Z, et al. Glycycoumarin ameliorates alcohol- induced hepatotoxicity via activation of Nrf2 and autophagy[J]. Free Radical Biology and Medicine,2015,89:135−146. doi: 10.1016/j.freeradbiomed.2015.07.006
[19] LI X J, MU Y M, LI T T, et al. Gynura procumbens reverses acute and chronic ethanol-induced liver steatosis through MAPK/SREBP-1c-dependent and independent pathways[J]. Journal of Agricultural and Food Chemistry,2015,63(38):8460−8471. doi: 10.1021/acs.jafc.5b03504
[20] 王晶, 李洪敏, 艾芳, 等. 葛根素的提取及对小鼠解酒护肝功能的鉴定[J]. 局解手术学杂志,2015,24(4):358−361. [WANG J, LI H M, AI F, et al. Puerarin extraction and identification of solution wine to protect liver function in mice[J]. Journal of Regional Anatomy and Operative Surgery,2015,24(4):358−361.] doi: 10.11659/jjssx.12E014060 WANG J, LI H M, AI F, et al. Puerarin extraction and identification of solution wine to protect liver function in mice[J]. Journal of Regional Anatomy and Operative Surgery, 2015, 24(4): 358−361. doi: 10.11659/jjssx.12E014060
[21] 丁荣荣, 姜启兴, 王斌, 等. 壳寡糖对小鼠急性酒精性肝损伤的保护作用[J]. 食品科学,2019,40(13):161−165. [DING R R, JIANG Q X, WANG B, et al. Protective effects of chitooligosaccharides on acute alcohol-induced liver injury in mice[J]. Food Science,2019,40(13):161−165.] doi: 10.7506/spkx1002-6630-20180601-006 DING R R, JIANG Q X, WANG B, et al. Protective effects of chitooligosaccharides on acute alcohol-induced liver injury in mice[J]. Food Science, 2019, 40(13): 161−165. doi: 10.7506/spkx1002-6630-20180601-006
[22] ZOU S P, WANG Y F, ZHOU Q, et al. Protective effect of Kinsenoside on acute alcohol-induced liver injury in mice[J]. Revista Brasileira de Farmacognosia,2019,29(5):637−643. doi: 10.1016/j.bjp.2019.06.006
[23] 温萍, 陈盛铎, 郑兵, 等. 金蝉花多糖对D-GlaN致小鼠急性肝损伤的保护作用及机制[J]. 中国实验方剂学杂志,2018,24(6):108−113. [WEN P, CHEN S D, ZHENG B, et al. Protective effect and mechanism of polysaccharides from Cordyceps cicadae on acute liver injury induced by D-GlaN in mice[J]. Chinese Journal of Experimental Traditional Medical Formulae,2018,24(6):108−113.] WEN P, CHEN S D, ZHENG B, et al. Protective effect and mechanism of polysaccharides from Cordyceps cicadae on acute liver injury induced by D-GlaN in mice[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(6): 108−113.
[24] 叶丽云, 程冰, 马水丽, 等. 赤芝多糖对小鼠急性酒精性肝损伤的保护效果和作用机制[J]. 食品科学,2022,43(5):103−110. [YE L Y, CHENG B, MA S L, et al. Preventive effect and mechanism of ganoderma lingzhi polysaccharides on acute alcoholic liver injury in mice[J]. Food Science,2022,43(5):103−110.] doi: 10.7506/spkx1002-6630-20210320-254 YE L Y, CHENG B, MA S L, et al. Preventive effect and mechanism of ganoderma lingzhi polysaccharides on acute alcoholic liver injury in mice[J]. Food Science, 2022, 43(5): 103−110. doi: 10.7506/spkx1002-6630-20210320-254
[25] ZHOU C Y, LAI Y L, HUANG P, et al. Naringin attenuates alcoholic liver injury by reducing lipid accumulation and oxidative stress[J]. Life Sciences,2019,216:305−312. doi: 10.1016/j.lfs.2018.07.031
[26] WU D F, CEDERBAUM A I. Oxidative stress and alcoholic liver disease[J]. Seminars in Liver Disease,2009,29(2):141−154. doi: 10.1055/s-0029-1214370
[27] TESCHKE R. Alcoholic liver disease:Alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects[J]. Biomedicines,2018,6(4):106. doi: 10.3390/biomedicines6040106
[28] TORRUELLAS C, FRENCH S W, MEDICI V. Diagnosis of alcoholic liver disease[J]. World Journal of Gastroenterology,2014,20(33):11684−11699. doi: 10.3748/wjg.v20.i33.11684
[29] DASGUPTA A . Liver enzymes as alcohol biomarkers[J]. Alcohol, 2015:121−137.
[30] CHEN J C, ZHANG Q, WANG R H, et al. Preliminary study on the effective site and mechanism of action of Meconopsis quintuplinervia Regel in alleviating acute alcoholic liver injury in mice[J]. Journal of Ethnopharmacology,2023,308:116230. doi: 10.1016/j.jep.2023.116230
[31] CICHOZ-LACH H , MICHALAK A. Oxidative stress as a crucial factor in liver diseases[J]. World Journal of Gastroenterology,2014,20(25):8082−8091.
[32] YANG X S, DONG C, REN G X. Effect of soyasaponins-rich extract from soybean on acute alcohol-induced hepatotoxicity in mice[J]. Journal of Agricultural & Food Chemistry,2011,59(4):1138.
[33] ZHAO M, DU Y Q, YUAN L, et al. Protective effect of puerarin on acute alcoholic liver injury[J]. The American Journal of Chinese Medicine,2010,38(2):241−249. doi: 10.1142/S0192415X10007816
[34] LIANG H W, YANG T Y, TENG C S, et al. Mulberry leaves extract ameliorates alcohol- induced liver damages through reduction of acetaldehyde toxicity and inhibition of apoptosis caused by oxidative stress signals[J]. International Journal of Medical Sciences,2021,18(1):53−64. doi: 10.7150/ijms.50174
[35] 黄小莉, 朱培欣, 胡远亮, 等. 蛹虫草多糖对急性酒精性肝损伤改善作用的研究[J]. 菌物学报,2017,36(2):242−250. [HUANG X L, ZHU P X, HU Y L, et al. The improvement of Cordyceps militaris polysaccharides on acute liver injuried mice model induced by alcohol[J]. Mycosystema,2017,36(2):242−250.] HUANG X L, ZHU P X, HU Y L, et al. The improvement of Cordyceps militaris polysaccharides on acute liver injuried mice model induced by alcohol[J]. Mycosystema, 2017, 36(2): 242−250.
[36] 李园园, 郝海波, 刘加洪, 等. 益生菌补充改善吡嗪酰胺致大鼠肝损伤及肠道菌群紊乱的效果[J]. 食品科学,2018,39(13):159−165. [LI Y Y, HAO H B, LIU J H, et al. Probiotics improve pyrazinamide-induced liver injury and intestinal flora disturbance in rats[J]. Food Science,2018,39(13):159−165.] doi: 10.7506/spkx1002-6630-201813024 LI Y Y, HAO H B, LIU J H, et al. Probiotics improve pyrazinamide-induced liver injury and intestinal flora disturbance in rats[J]. Food Science, 2018, 39(13): 159−165. doi: 10.7506/spkx1002-6630-201813024
[37] CAO Y W, JIANG Y, ZHANG D Y, et al. Protective effects of Penthorum chinense Pursh against chronic ethanol-induced liver injury in mice[J]. Journal of Ethnopharmacology,2015,161:92−98. doi: 10.1016/j.jep.2014.12.013
[38] SU L L, HUANG Y Y, FENG D S, et al. Protective effects of areca inflorescence tea on alcohol-induced hepatic injury in rats[J]. Modern Food Science & Technology,2017,33(6):15−18,8.
[39] 张玲, 李俊, 黄艳, 等. 野菊花总黄酮对酒精致急性肝损伤小鼠的保护作用[J]. 安徽医药,2011,15(10):1197−1199. [ZHANG L, LI J, HUANG Y, et al. Protective effects of TFC on alcohol-induced acute liver injury in mice and its mechanisms[J]. Anhui Medical and Pharmaceutical Journal,2011,15(10):1197−1199.] doi: 10.3969/j.issn.1009-6469.2011.10.004 ZHANG L, LI J, HUANG Y, et al. Protective effects of TFC on alcohol-induced acute liver injury in mice and its mechanisms[J]. Anhui Medical and Pharmaceutical Journal, 2011, 15(10): 1197−1199. doi: 10.3969/j.issn.1009-6469.2011.10.004





 下载:
下载:
 下载:
下载:
