Modulation of the Formation Mechanism of Thermally Induced Gels Containing Whole Oyster-Soybean Isolate Proteins by Hydrophilic Colloids
-
摘要: 为了更有效地利用牡蛎资源,并为牡蛎凝胶制品提供新的可行途径,本文系统分析了全牡蛎-大豆分离蛋白(SPI)复合凝胶的凝胶机理,梳理了亲水胶体调控热诱导凝胶形成的关键因素及其对热不可逆复合凝胶形成机制的影响。研究了不同比例的魔芋葡甘聚糖(KGM)/κ-卡拉胶(κ-C)(0:5、2:3、1:1、3:2、4:1、5:0)和不同添加量的Ca(OH)2(0.4%、0.6%、0.8%、0.9%、1.0%)制备的全牡蛎-大豆分离蛋白(SPI)复合凝胶的流变特性、凝胶强度、红外光谱、分子相互作用力和微观结构等。结果表明,随着KGM/κ-C比例和Ca(OH)2添加量的增加,复合凝胶的凝胶特性显著改善,表现为胶凝点升高及固态属性增强。这种改善主要归因于分子间氢键作用力的增强,使复合凝胶的微观结构变得更加致密。在不同条件下,以KGM/κ-C比例为3:2(m/m)和Ca(OH)2添加量为0.8%(m/v)时制备的凝胶性能表现最佳。Abstract: This study aimed to utilize oyster resources more effectively and provide novel feasible methods for the production of oyster gel products. In this study, the gelation mechanism of whole oyster-soybean isolate protein composite gels was systematically analyzed. Moreover, the key factors of hydrophilic colloids that regulate thermally induced gel formation and their effects on the gel properties of thermally irreversible composite gels were determined. The rheological properties, gel strength, infrared spectroscopy, interaction force, and microstructure of whole oyster-soybean protein isolate composite gels prepared with different konjac glucan (KGM)/κ-carrageenan (κ-C) ratios (0:5, 2:3, 1:1, 3:2, 4:1, 5:0)and different amounts of Ca(OH)2 (0.4%, 0.6%, 0.8%, 0.9%, 1.0%) added were investigated. The results indicated that as the KGM/κ-C ratio and the amount of Ca(OH)2 increase, the gel properties of the composite gel were significantly improved, characterized by a higher gelation point and enhanced solid-like attributes. This improvement was primarily attributed to the strengthened intermolecular hydrogen bonding, which leaded to a more compact microstructure of the composite gel. The best performance under different conditions was observed when the gels were prepared with a KGM/κ-C ratio of 3:2 (m/m) and Ca(OH)2 addition of 0.8% (m/v).
-
Keywords:
- hydrophilic colloids /
- thermally induced gels /
- oysters /
- gel properties /
- microstructure
-
牡蛎(Ostreidae)是中国最大的养殖贝类,富含蛋白质、糖原、活性肽、牛磺酸及多种矿物质元素等[1]。它还具有抗氧化、抗肿瘤和降血压的作用,是我国卫生部批准的首批药食两用的食品,具有重要的营养价值和经济价值[2]。然而,现阶段我国牡蛎资源的精深加工开发利用程度还比较低,一方面,牡蛎主要以生鲜销售为主,缺乏高附加值产品的研发与应用,加上牡蛎深加工比例较低,导致废弃物的综合利用能力不足,制约了牡蛎养殖和加工业的进一步发展[3]。近年来,凝胶因其独特的结构和功能在食品、医药等领域得到广泛应用[4]。为了更好地利用牡蛎资源,尝试将全牡蛎制成凝胶制品。这种牡蛎凝胶制品具有延长牡蛎保鲜期、提高利用率、丰富口感和品质、提升营养价值等优势,为消费者提供了更多选择,并促进了健康饮食的推广。然而,全牡蛎无法形成稳定的热诱导凝胶,因此需要借助凝胶增强剂制备全营养牡蛎凝胶制品。
大豆分离蛋白(SPI)是一种优质植物蛋白,含有近20种氨基酸,其中包括8种必需氨基酸,具有凝胶、吸水和乳化等多种功能特性[5]。SPI因其具备降低胆固醇水平、减少心血管疾病等多种营养功能 [6]被广泛应用于食品工业。例如在肉制品中添加SPI不仅能提升口感,还能增加蛋白质含量,补充膳食纤维[7]。因此,添加SPI有望改善牡蛎产品的胶凝特性。
卡拉胶(κ-C)是从红藻中提取的一种亲水性胶体,在食品工业中广泛用作胶凝剂、乳化剂和稳定剂等[8]。然而,κ-C凝胶食品存在一些局限性,如脆性大、柔韧性低、易脱水收缩等[9]。魔芋葡甘聚糖(KGM)是一种非离子型水溶性多糖[10],只有在高浓度或碱性条件下才能形成凝胶[11],且其味道较差,限制了其在食品工业中的应用。为克服单一胶体的缺陷,物理混合被认为是一种有效且安全的方法,多糖之间的相互作用可以改善凝胶的物理性质[12]。因此,通过不同食品胶体的复配协同效应,可以显著增强水产品的凝胶性、乳化性、保水性和弹性[13],得到口感细腻嫩滑的复合凝胶制品,从而提高产品质量并降低生产成本。
本研究的创新点在于采用“海洋动物(全牡蛎)+植物(SPI)”的模式,以期实现海陆资源的优势互补,充分发挥两者的经济和营养价值。通过与卡拉胶、魔芋葡甘聚糖等多糖结合,促进全牡蛎-SPI复合凝胶的形成,这为全牡蛎凝胶产品的开发提供了新的理论和技术基础。同时,这一研究也为牡蛎资源的开发利用开辟了新的途径,为海洋资源的高效利用和产业化发展提供了有益探索。
1. 材料与方法
1.1 材料与仪器
新鲜牡蛎(Crassostrea gigas) 青岛水产品市场;大豆分离蛋白 食品级,临沂山松生物制品有限公司;κ-卡拉胶、魔芋葡甘聚糖 食品级,肇庆海星生物科技有限公司;氢氧化钙 食品级,江西明远高新材料有限公司;尿素、氯化钠、β-巯基乙醇、福林酚等其他化学试剂 分析纯,山东泰安鼎力橡胶有限公司。
IKA T18basic高速均质分散器 德国艾卡仪器设备有限公司;CV-600电热恒温水浴锅 上海福马实验设备有限公司;MCR-101旋转流变仪 德国安东帕尔公司;JSM-5800 LV扫描电子显微镜 日本东京JEOL公司;MR25核磁共振成像分析仪 上海纽麦电子科技有限公司;Nicolet 470红外光谱仪 美国赛默飞世尔科技有限公司;TMS-TOUCH质构仪 美国 FTC公司;GL-21M冷冻离心机 湘仪离心机仪器有限公司;Scientz-10ND真空冷冻干燥机 宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 全牡蛎-SPI复合溶胶的制备
取新鲜牡蛎清洗后去壳取肉,将牡蛎肉研磨成原浆,加水制成牡蛎匀浆(原浆和水的体积比为2:3),通过高速均质分散器以10000 r/min的速度均质2 min后倒入锅中,将牡蛎匀浆加热至沸腾,保持沸腾状态3~5 min,煮浆期间不断搅拌;煮沸后的浆液放置冷却至40~50 ℃,再用80目的滤布过滤一遍,除去滤渣后冷却至室温后,分别同时添加2.0%(m/v)SPI、2.0%(m/v)不同复配比的KGM/κ-C(0:5、2:3、1:1、3:2、4:1、5:0),此时Ca(OH)2添加量为0.6%,以及不同添加量的Ca(OH)2(0.4%、0.6%、0.8%、0.9%、1.0%(m/v)),此时KGM/κ-C的复配比为3:2,搅拌均匀后在4 ℃下保存备用。
1.2.2 全牡蛎-SPI复合凝胶的制备
分别量取20 mL 1.2.1中配制好的溶胶放入25 mL的烧杯中,并用保鲜膜密封,以避免在加热过程中样品蒸发。然后将装有溶胶的烧杯在90 ℃的水浴中加热25 min。加热后的溶胶在室温下冷却后形成凝胶,并在4 ℃下保存过夜(约12 h)。
1.2.3 流变学特性的测定
采用MCR-101旋转流变仪测定各混合样品的黏度η随剪切速率的变化及储能模量G'随温度和频率的变化。根据ZHANG等[14]的研究方法稍作修改。具体仪器参数为:型号PP50(直径50 mm,间隙1.0 mm)的转子,根据样品应力扫描设定0.5%的应变值,以确保所有测量都在样品的线性粘弹性范围内进行。
1.2.3.1 静态剪切流变测试
25 ℃下样品黏度η与剪切速率之间的相关性(剪切速率扫描范围0~100 s−1)。
1.2.3.2 频率扫描
25 ℃下样品的储能模量G'和损耗模量G"与频率之间的相关性(频率扫描范围 0.1~10 Hz,试验在已经设定的温度下两个模量值达到稳定后进行),实验点被拟合到以下幂律方程中:
G′(f)=K′⋅(2πf)n′ (1) 式中,G'为储能模量(Pa),f为频率(Hz),K'和n'为实验确定的常数。
1.2.3.3 温度扫描
观察各样品在30 ℃至90 ℃的加热过程和90 ℃至30 ℃的冷却过程中的温度扫描情况。首先在30 ℃下平衡1 min,然后以10 ℃/min的升温速度从30 ℃升至90 ℃,在90 ℃下平衡10 min,再以10 ℃/min的速度从90 ℃冷至30 ℃。
1.2.4 持水性
持水性测定是根据QIN等[15]的研究方法稍作修改。将3 g的复合凝胶(W1)用两层滤纸包裹后置于50 mL离心管的底部,在4 ℃下以4000 r/min的转速离心15 min后称量混合凝胶(W2)的质量。持水性按以下公式计算:
持水性(\%) =W2 W1×100 (2) 式中,W1表示初始重量,W2表示离心后的重量。
1.2.5 水分分布
复合凝胶的水分分布由低场核磁共振(LF-NMR)分析仪测定,根据钱书意等[16]的研究并略做修改。通过反演指数衰减曲线获得弛豫时间(T2)对应的宽度和面积。切取高度不超过3 cm的混合凝胶,用保鲜膜包裹放入核磁管中,选用分析仪中的CPMG序列测定横向弛豫时间(T2)和强度。测试参数为:共振频率22 Hz,温度32 ℃,τ值200 s。每次扫描32次,每个样品至少测定5次。
1.2.6 凝胶强度
将各混合凝胶切割成边长约为3 cm的正方体,放置于质构仪测试平板上。根据CHEN等[17]的研究并略作修改,设置固定触发力0.02 N,使用P/0.5探头(直径5 mm)以6 mm/s的速度向下穿刺混合凝胶1.5 cm。凝胶强度由TMS-TOUCH质构仪直接测定计算得到,单位为N。
1.2.7 红外光谱扫描
全牡蛎-SPI复合凝胶的红外光谱由傅里叶变换红外光谱仪测量。经真空冷冻干燥机冻干的样品在溴化钾压片机下制备成片状,各个凝胶样品与溴化钾的质量比约为1:100。为避免溴化钾吸湿,整个实验在红外灯下进行。红外线参数光谱波数范围4000~400 cm−1,分辨率2 cm−1,扫描64次。
1.2.8 分子间相互作用力
根据MA等[18]的研究方法略做修改,测量了全牡蛎-SPI混合凝胶中的离子键、氢键、疏水相互作用和二硫键。将2 g样品分别放入种溶液中:0.05 mol/L NaCl(A)、0.6 mol/L NaCl(B)、1.5 mol/L尿素+0.6 mol/L NaCl(C)、8.0 mol/L 尿素+0.6 mol/L NaCl(D)和8.0 mol/L尿素+0.6 mol/L NaCl+0.5 mol/L β-巯基乙醇(E)。将混合凝胶均质(10000 r/min)30 s,连续搅拌1 h(4 ℃)。根据福林酚法测定蛋白质含量,经过编号为A、B、C、D、E溶液处理过的样品依次为样品A、B、C、D、E。样品B和样品A之间蛋白质浓度的差异用来表征离子键的含量。样品C和样品B之间蛋白质浓度的差异用来表征氢键的含量,样品D和样品C之间蛋白质浓度的差异用来表征疏水相互作用的含量,样品E和样品D之间蛋白质浓度的差异用来表征二硫键的含量。每个样品重复测量3次。
1.2.9 扫描电子显微镜(SEM)
将适量冻干的混合凝胶粉末粘在观察台上,在样品的薄层上喷金,然后置于扫描电子显微镜下,以20 μm的均匀放大倍率观察样品的形态。
1.3 数据处理
使用 Origin Pro 2022 软件进行数据图像处理。每个实验至少重复三次,结果以平均值±标准差表示。数据分析采用SPSS 22.0软件进行,以单因素ANOVA法和Duncan检验比较组间差异和显著性分析,P<0.05表示差异性显著。
2. 结果与分析
2.1 流变特性
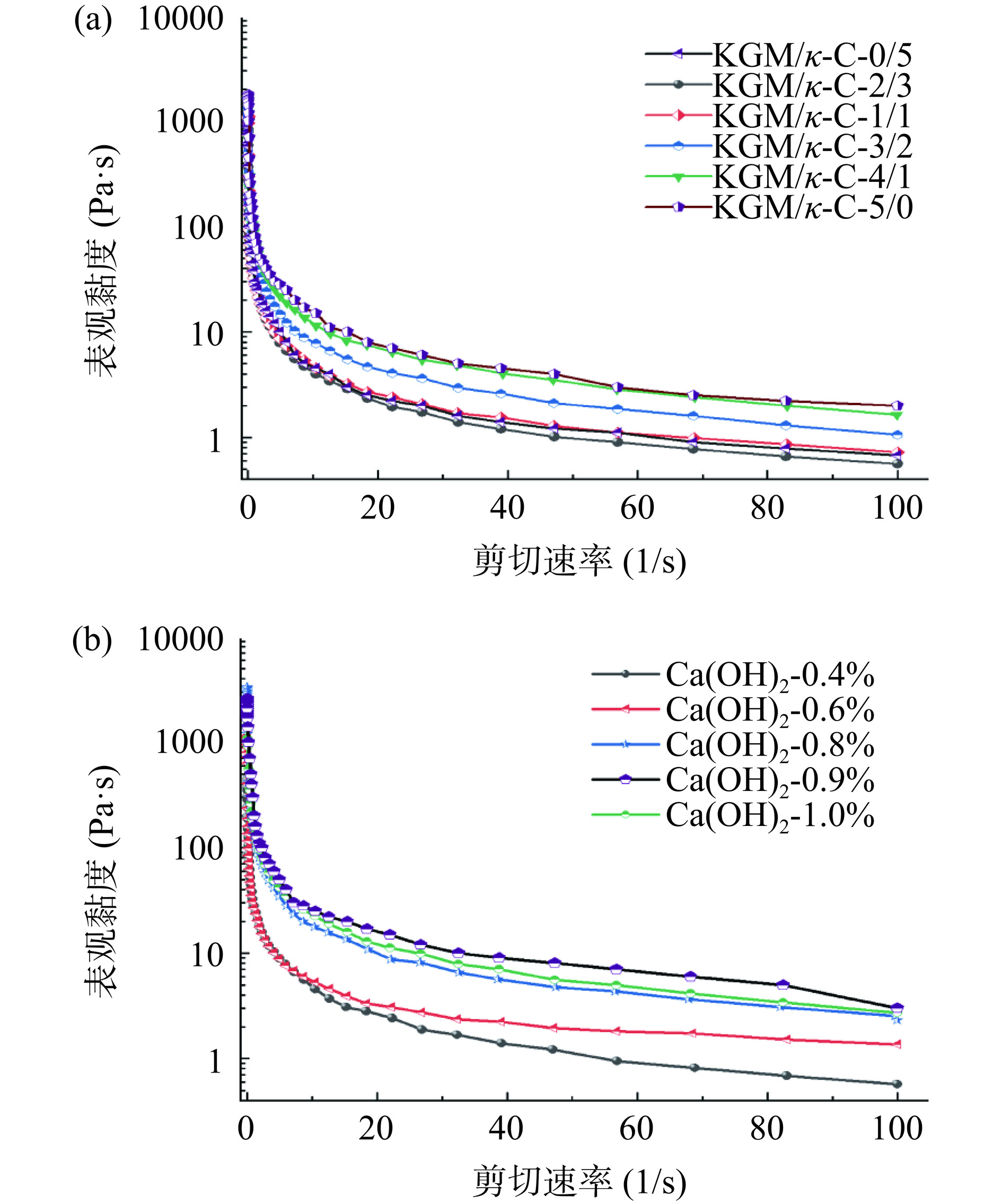
2.1.1 复合凝胶黏度随剪切速率的变化
如图1a和图1b展示了在剪切速率范围从0~100 s−1内,所有样品表观黏度的变化情况。在稳态剪切试验中,外部环境对样品施加的剪切力逐渐增加,影响了体系的内部结构。根据RONG等[19]的研究可知,剪切速率与剪切应力之间出现非线性关系表明混合系统具有剪切稀化的假塑性流体特性。这可能是因为亲水胶体能够削弱水分子之间的氢键,从而在高剪切速率下产生剪切稀化特性,氢键断裂可能导致分子链之间的作用力减小,系统的流动性增加,同时导致黏度降低[20]。此外,黏度表现出不同的变化趋势,即在Ca(OH)2添加量为0.6%(m/v)时,随着KGM/κ-C复配比的增加而增加;在KGM/κ-C复配比3:2时,随着Ca(OH)2添加量的增加而先增加后下降。这可能由于一定比例的魔芋胶和卡拉胶复配可以提高凝胶的稳定性,使其更加抗剪切。因为两种多糖的复配可以增加凝胶网络的交联点和分子间相互作用,使得凝胶结构更为牢固,又因为卡拉胶可独自形成热可逆凝胶,而魔芋胶本身不能形成凝胶,在碱性条件下可以形成不可逆凝胶[21],在相同浓度下,分子结构更为复杂的魔芋胶和卡拉胶复配凝胶在较高浓度碱中的剪切稀化阈值会更高[22]。然而,随着Ca(OH)2添加量继续增加,黏度开始下降。这可能是因为过量的Ca(OH)2导致凝胶网络中的交联点过于密集,反而使网络结构变得僵硬,从而削弱了凝胶的弹性和剪切强度。此外,过高的碱浓度可能会破坏多糖分子间的氢键和其他非共价作用力,导致凝胶网络的破裂或变形,进而影响凝胶的整体稳定性和强度[20]。这与下文中提到的凝胶强度结果是一致的。
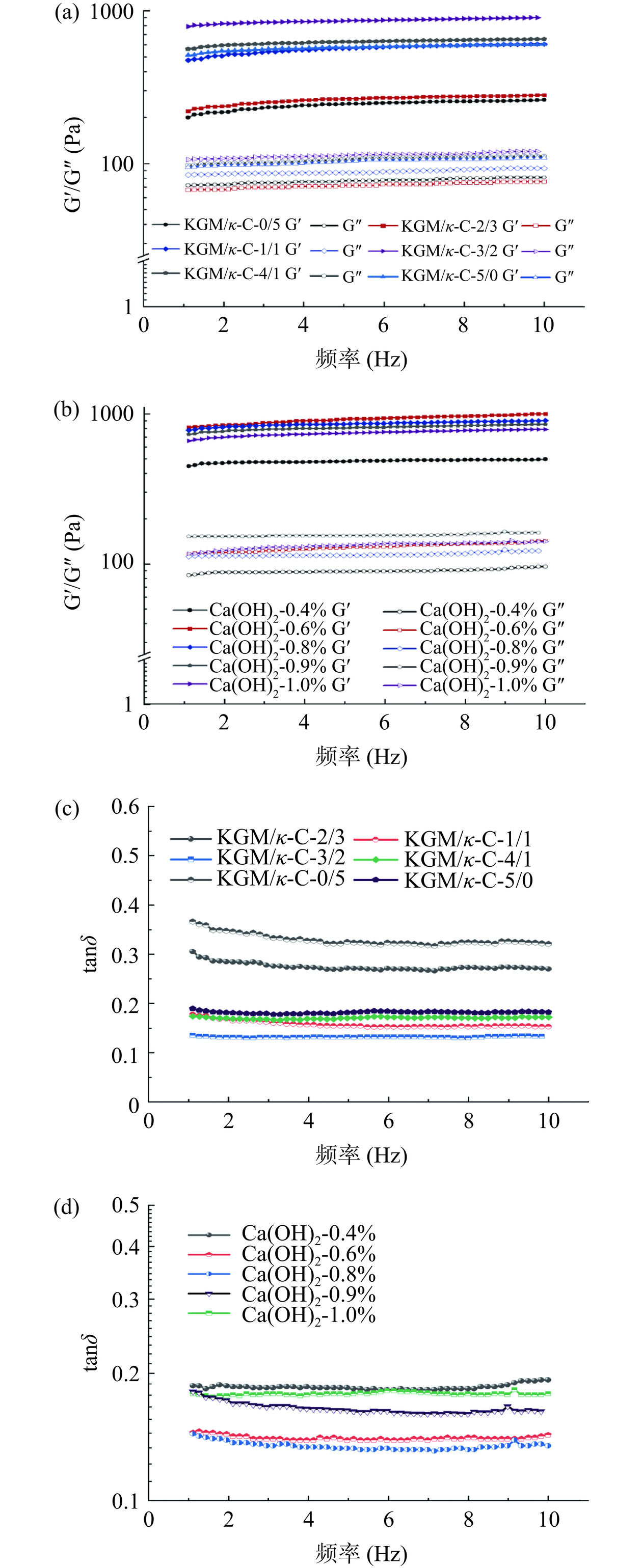
2.1.2 流变频率扫描和拟合
通过记录各个复合凝胶样品在不同频率下的储能模量G'、损耗模量G"和正切值tanδ的变化,对其粘弹性能进行评估。如图2a和图2b所示,所有样品的G'值都远大于G"值,表明凝胶具有弹性特性。G'和G"值基本上都随着频率的增加而增加,显示出一定的频率依赖性。从图2c和图2d中可以看出,所有样品的tanδ值在测试期间都小于1,表明这些凝胶具有固体特性。然而,随着KGM比例的增加,tanδ值先减小后增大,当KGM/κ-C的比例为3:2时,tanδ值达最低值0.133。结果表明,一定质量比的魔芋胶和卡拉胶可增加混合凝胶之间的交联,从而有助于增强样品的粘弹性并稳定凝胶结构。在Ca(OH)2添加量为0.8%(m/v)时,混合凝胶体系的tanδ达到最低值0.135,表明经过碱处理得到一定程度的脱乙酰化KGM可以增强混合体系之间的网络结构,这与之前的研究结果一致[23]。有研究表明碱对KGM凝胶化至关重要,因为它有助于脱乙酰化并减少KGM链的溶剂化[24]。据推测,凝胶的形成与连接区KGM的脱乙酰基延伸的缔合有关[25]。
频率扫描曲线的幂律拟合结果见表1和表2。K′通常代表储能模量,表示材料对应力的储能能力;n′通常代表损耗模量,表示材料对应变的吸能能力;R2通常被称为决定系数,用于衡量拟合模型与实际数据之间的拟合程度。随着KGM/κ-C比例的增加,复合凝胶的K′值首先增加到815.25,表明其凝胶结构具有更高的刚性[26]。然而,当KGM/κ-C的比例增加到4:1和5:0时,K′值呈下降趋势,分别降低至600.05和516.71,证明过高浓度的KGM不利于凝胶弹性结构的形成。同时,随着KGM/κ-C比例的增加,复合凝胶的n′值先减小后增加,几乎接近0,这表明更多的共价键参与了凝胶网络的形成,当复合比例达到一定程度后,复配产生的交联作用达到最大,继续增加KGM/κ-C比例可能导致网络结构的饱和,从而n'值开始增加。此时,凝胶结构中自由运动的分子减少,更多的共价键逐渐固定网络,最终表现为更加固态的特性[27−28]。
表 1 不同比例KGM/κ-C复合凝胶的频率扫描拟合Table 1. Frequency scan fitting of KGM/κ-C composite gels with different ratios样品 K′ n′ R2 KGM/κ-C-0/5 204.07±0.67e 0.07±0.02a 0.985 KGM/κ-C-2/3 250.40±1.00d 0.06±0.02a 0.987 KGM/κ-C-1/1 529.66±1.00c 0.05±0.01b 0.989 KGM/κ-C-3/2 815.25±2.91a 0.04±0.01b 0.995 KGM/κ-C-4/1 600.05±1.72b 0.04±0.01b 0.988 KGM/κ-C-5/0 516.71±0.92c 0.06±0.01a 0.987 注:同一列不同字母代表有显著性差异(P<0.05),表2同。 表 2 不同添加量的Ca(OH)2复合凝胶的频率扫描拟合Table 2. Frequency scan fitting of composite gels with different Ca(OH)2 contents样品 K′ n′ R2 Ca(OH)2-0.4% 465.32±3.83d 0.13±0.03a 0.985 Ca(OH)2-0.6% 815.85±1.00a 0.07±0.02b 0.988 Ca(OH)2-0.8% 822.70±1.00a 0.05±0.01c 0.995 Ca(OH)2-0.9% 731.82±1.20b 0.06±0.01b 0.991 Ca(OH)2-1.0% 684.86±1.00c 0.07±0.01b 0.989 在不同Ca(OH)2添加量的影响下,复合凝胶的n′值先显著降低后显著升高(P<0.05),而K′值先显著增加后显著降低(P<0.05)。Ca(OH)2的添加量超过一定范围后,过多的Ca2+会干扰凝胶网络的形成和稳定性,导致凝胶特性的下降。
这些拟合结果验证了频率扫描的结论,表明一定比例的KGM/κ-C和Ca(OH)2可以增强凝胶的弹性和结构的硬度。
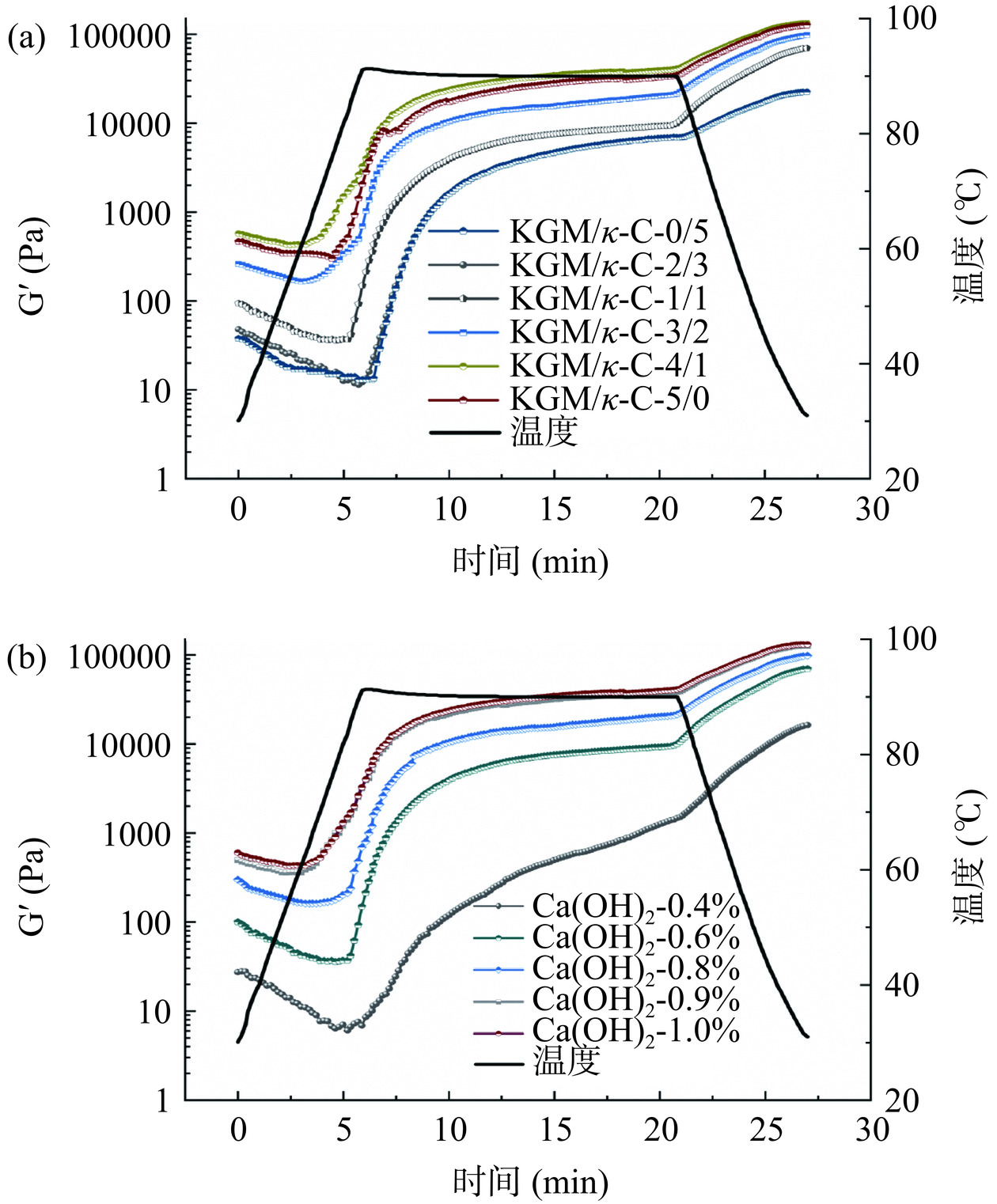
2.1.3 流变温度扫描
通过记录加热、恒温和冷却过程中储能模量G′的变化,探索了复合凝胶的形成过程,升温程序如1.2.3.3中所述。如图3所示,在加热过程中,复合凝胶的G′先减小后增大。可能是由于SPI在提取和干燥过程中受热形成了一部分聚集体,当温度逐渐升高时,这部分预先形成的聚集体发生解离,导致G′值下降[29]。另外,牡蛎肌球蛋白尾部的逐渐解离增强了溶液的流动性,导致早期形成的弱凝胶被破坏[30],这也导致了G′值的降低。在90 ℃的恒温阶段,所有样品的G′值都持续上升。可能是因为SPI中的11S在此时开始变性,原先的二硫键和巯基受热开始氧化,新形成的二硫键增强了蛋白质分子间的共价作用,凝胶网络结构进一步加固,弹性模量增强[31]。在冷却阶段,复合凝胶的G′值继续增加,蛋白质分子通过非共价相互作用相互交联,形成丰富的疏水相互作用和氢键,从而逐步建立起凝胶网络结构,使得凝胶的粘弹性逐渐增强[32]。随着KGM/κ-C比例和Ca(OH)2添加量的增加,胶凝点先升高后降低。研究发现,在碱性条件下,KGM受热脱去乙酰基,可产生强度更高的不可逆凝胶,形成凝胶的速率与魔芋胶添加量、碱添加量、魔芋胶与碱添加量之比有关[33]。魔芋胶所占比例越高,碱添加量越多,魔芋胶去乙酰化速率就会越快,凝胶化速率也会提升。KGM/κ-C比例和Ca(OH)2的增加会在初期加速凝胶的形成,提升胶凝点,但当Ca2+离子达到一定阈值后,过量的Ca2+反而干扰了凝胶网络的稳定性,导致胶凝点出现下降。因此,当增加一定比例的KGM和Ca(OH)2时,混合凝胶的胶凝点会提前。
2.2 持水性分析
图4显示了KGM/κ-C和碱处理对牡蛎-SPI复合凝胶持水性(WHC)的影响。单独添加KGM或者κ-C的复合凝胶的持水性较低,复配使用效果最佳。随着KGM/κ-C比例的增加,复合凝胶的持水量显著增加(P<0.05),当KGM/κ-C为3:2时,持水性达到 73.17%。随着Ca(OH)2添加量的增加,复合凝胶的WHC也显著增加(P<0.05),当Ca(OH)2 添加量为0.8%(m/v)时,持水性达到75.91%。研究表明,一定添加量的KGM和Ca(OH)2可以提高凝胶的持水性[34]。由于KGM存在羟基,它可以捕获大量的水,在碱性条件下,KGM的部分脱乙酰化可以缩短分子之间的距离并形成致密的凝胶网络结构[35]。然而,当KGM/κ-C的比例达到4:1时,复合凝胶的持水能力下降,可能是由于过量添加KGM会产生空腔大、内聚力低和频率依赖性高的凝胶网络[36]。在Ca(OH)2添加量为0.9%(m/v)时,乙酰基几乎完全脱除(这一点在后续的红外结果中得到了证实),导致持水性下降。尽管乙酰基赋予了KGM水溶性,其空间位阻效应限制了KGM分子间的作用力。在碱性条件下,KGM逐渐失去乙酰基,部分乙酰基仍存留于KGM分子中,增强了其与水的结合能力,进一步加强了氢键作用,从而使复合凝胶具有更强的保水性[37]。然而,过量的Ca(OH)2可能会过度脱除KGM的乙酰基,导致KGM更容易自聚集,无法与κ-C发生协同作用,因此产生相反的稀疏网络结构[38]。
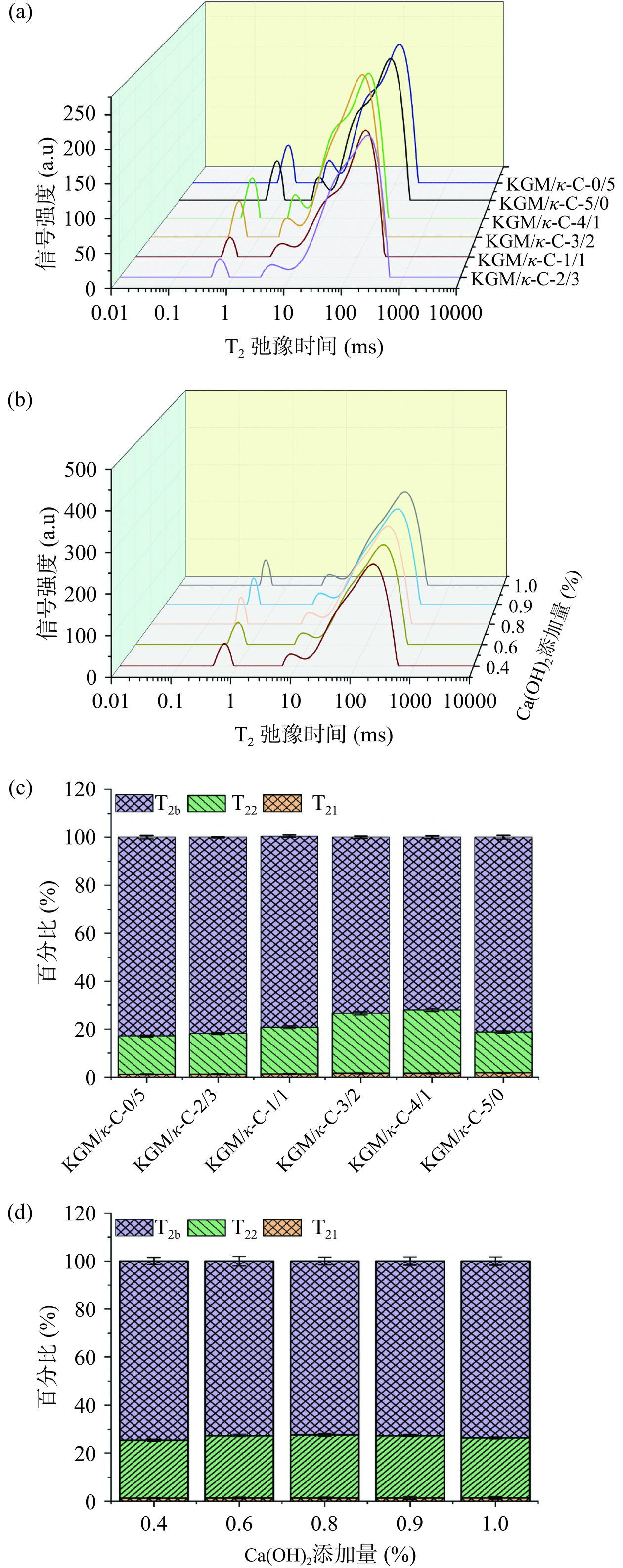
2.3 水分分布
如图5所示,三种横向弛豫时间对应于复合凝胶的三种水状态。其中,T21一般代表结合水,一般分布在0.1~10 ms,T22和T2b分别代表固定水和自由水,峰值分别在10~100 ms和100~1000 ms。在本研究中,这两者占90%以上。如图5a所示,随着KGM/κ-C比例的增加,T21和T2b整体向左移动,其中在KGM/κ-C比例为3:2时最为明显,说明凝胶中水分子发生了转变,一般来说,具有较短弛豫时间的水分子与大分子的结合会更紧密,说明复合凝胶的保水性更好[39]。为了具体评估每种状态下水分子的变化,图5c显示了复合凝胶中各组分的比例。T21的比例都相对较小,而且基本保持稳定,KGM/κ-C比例的增加对其没有明显影响,但确实有助于固定水比例的增加。这是因为KGM本身具有很强的水合和持水能力,因此增加KGM的比例会使复合凝胶具有更强的水结合力。但当KGM/κ-C比例增加到5:0时,固定水比例下降的原因可能是因为失去了κ-C的协同作用,导致凝胶网络结构过于紧密,无法有效保留固定水。同时,KGM的水合能力在过高比例时可能反而减弱了水的结合效果。此外,研究表明,κ-C链上的硫酸基能与KGM链上的羟基相互作用形成氢键,从而增强分子间的作用力,提高体系的持水能力[40]。
如图5b和图5d所示,随着碱添加量的增加,T21和T2b向左移动,T21的比例相对较小且基本稳定,表明碱添加量的增加对其影响不大。T22的比例有所增加,固定水的比例略微增加,这可能是由于钙离子与KGM分子有架桥作用,有助于分子间的相互缠绕,形成蜂窝状网络结构的凝胶[41]。因此,它具有良好的保水性能和较强的凝胶强度。但是与添加0.8%(m/v)的Ca(OH)2相比,添加0.9%(m/v)和1.0%(m/v)的Ca(OH)2对水的固定化能力要弱一些,杨贞[42]的研究表明,添加过多的碱后凝胶空腔会略微变大且基质更加松散,这种结构不利于水分的保留。此结果与持水力检测结果一致。
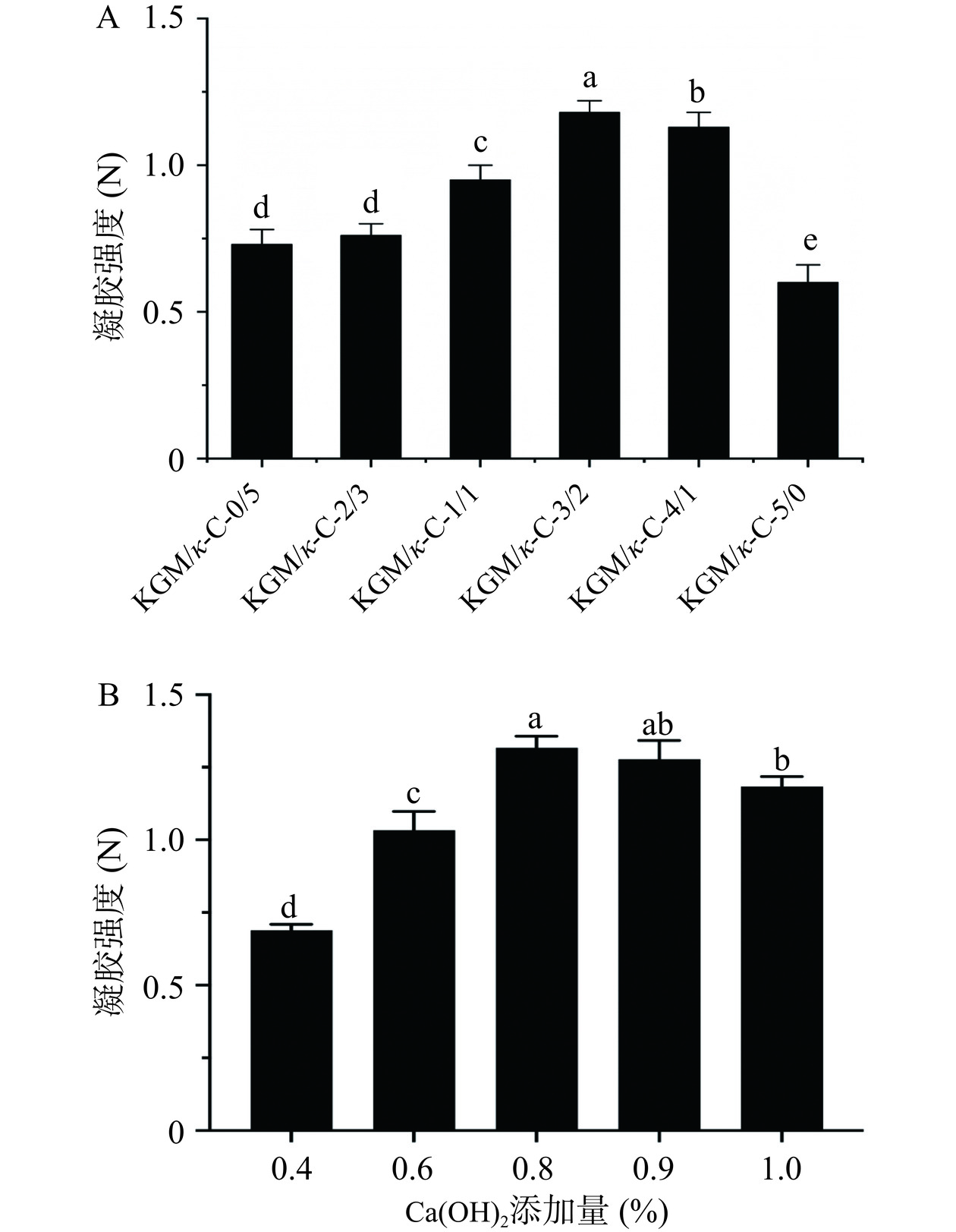
2.4 凝胶强度
凝胶强度代表组织间的紧密程度,可反映微观结构的变化。如图6A和图6B所示,随着KGM/κ-C比例和Ca(OH)2添加量的增加,凝胶强度先增大后显著减小(P<0.05),当KGM/κ-C比例为3:2,Ca(OH)2添加量为0.8%(m/v)时达到最大值。也就是说,适量的KGM比例和脱乙酰度适中的KGM更有可能与κ-C复配,从而形成更好的复合凝胶。研究表明,当魔芋胶与卡拉胶复配时,多糖分子通过分子间相互作用形成以卡拉胶为主体、魔芋胶穿插其中的三维网络结构。这种结构与SPI相互作用,形成了双网络凝胶结构,从而协同增强了复合凝胶的凝胶特性[43]。另外,在碱性条件下,部分脱乙酰化的KGM以与κ-C、SPI更好地结合,也使得蛋白质与水分子的结合更加紧密[44]。该结果与上述复合凝胶的持水性和水分分布结果一致。
2.5 红外光谱扫描
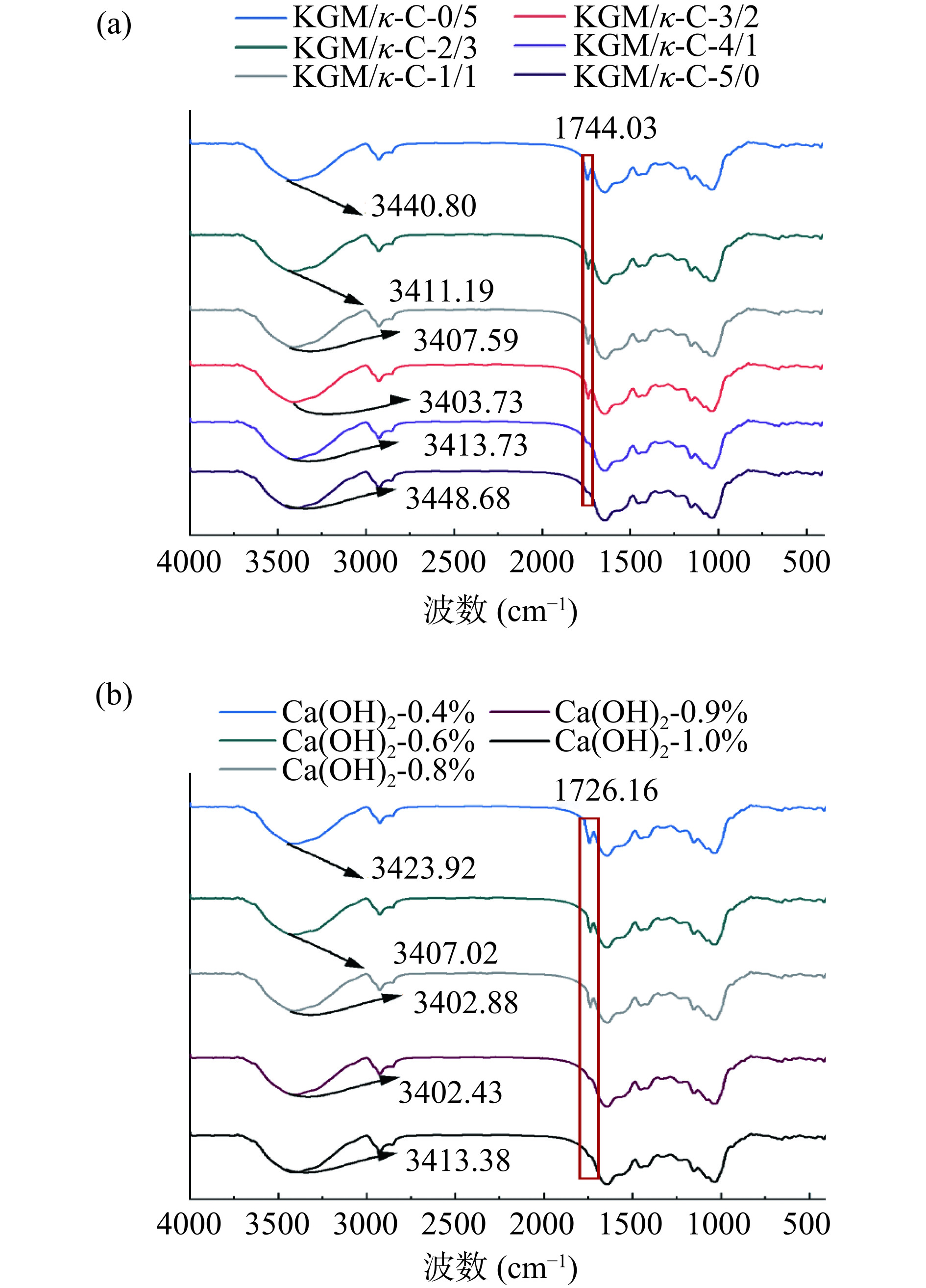
通过红外光谱研究了不同复配比KGM/κ-C和不同添加量的Ca(OH)2对混合凝胶中官能团的影响,根据它们的位移、伸缩或者振动强度的改变来明确在混合凝胶之间的一些反应情况。如图7a所示,所有凝胶样品的红外光谱骨架基本相同,但乙酰基的吸收强度(1744. 03 cm−1)随着KGM比例的增加而逐渐增加。这种变化可能是由于在碱性条件下加热时,部分碱中和了混合凝胶体系的酸性环境。因此,只有一部分碱能够诱导KGM发生脱乙酰化,这意味着在这个混合凝胶体系中,有效的碱浓度降低了,从而降低了诱导魔芋胶分子凝胶化的能力。当KGM/κ-C的比例增加时(0:5~3:2),羟基的吸收峰(3440.80~3403.73 cm−1)略微向低波段带移动,可能是由于KGM与κ-C形成交联,并与SPI分子间形成氢键,从而增加了分子间的相互作用力[22]。然而,KGM的比例过高会削弱凝胶强度,只能起到填充凝胶的作用,当KGM/κ-C的比例为3:2时,凝胶网络结构更加稳定,这与凝胶强度测试结果一致。
如图7b所示,随着Ca(OH)2添加量的增加,乙酰基的吸收强度(1726.16 cm−1)逐渐降低直至消失。KGM碱化后分子链上脱去部分乙酰基,其分子间形成氢键,增强分子间的作用力[16]。此时复合凝胶体系中羟基(3423.92~3402.43 cm−1)的吸收峰向低波段移动。这可能是基团间通过氢键的缔合作用引起的基团振动频率下降的原因[44]。因而推测KGM/κ-C/SPI复配后体系中氢键作用增强。研究表明,pH的改变会影响蛋白质分子的净电荷值及离子化作用,改变蛋白质分子间的吸引力、与水分子间的结合能力以及KGM/κ-C/SPI之间的相互作用[45]。因此随着碱添加量的增加,混合体系的pH上升,凝胶形成和维持凝胶网状结构的氢键增加,进而羟基的吸收峰也会向低段移动。后续羟基吸收峰的右移,通常意味着吸收峰向高波数方向移动,这可能是由于在碱添加量较高的条件下,溶液的pH过高会导致氢键作用减弱。碱性环境中的大量氢氧离子(OH–)会与凝胶中的羟基(–OH)竞争形成氢键,这会削弱凝胶网络内部羟基之间的氢键强度,从而导致吸收峰右移。
2.6 分子间相互作用力
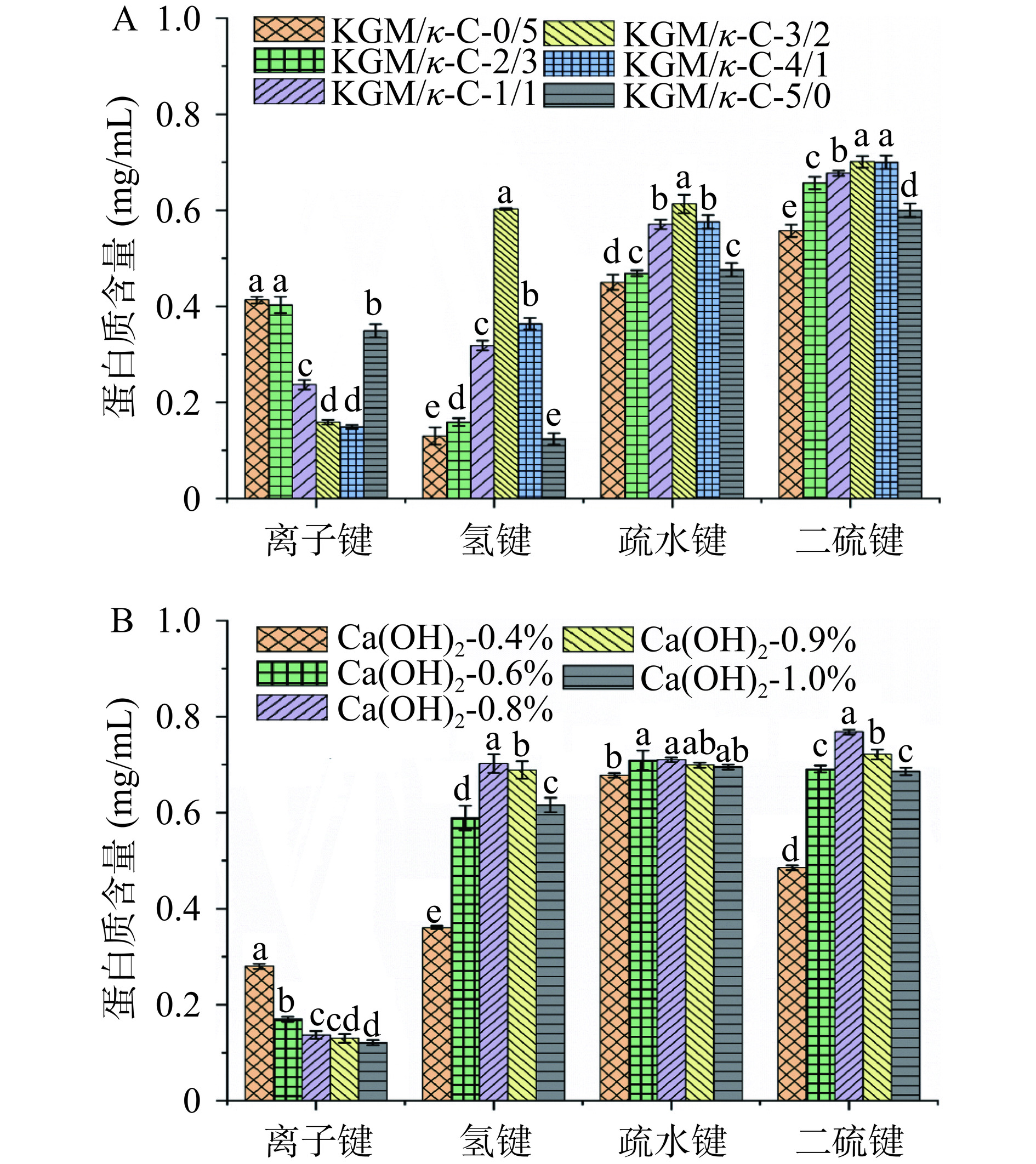
蛋白质在各种溶剂中的溶解度被用来表征凝胶中的分子力。从图8中可以看出,当KGM/κ-C的比例从0:5增加到5:0,Ca(OH)2的添加量从0.4%增加到1.0%时,复合凝胶之间的离子键含量先减少后增加,疏水相互作用、二硫键和氢键含量却呈现出先上升后下降的趋势。可能是由于多糖分子阻止了全牡蛎-SPI复合凝胶内部离子键的形成,当加入Ca(OH)2时,pH的差异可能会改变氨基酸的电荷分布位点,导致离子键含量减少。另外,蛋白质热变性后,增加了蛋白质氨基酸侧链中的疏水作用和功能基团(如巯基)的暴露,蛋白质在受热时会通过二硫键形成交联[46]。此外,在红外图谱中发现羟基出现的较大位移是由于复合凝胶分子间形成了较弱氢键。据报道,KGM/κ-C通过氢键形成了空间网络结构,疏水相互作用促进了复合凝胶的形成[47]。而当KGM/κ-C的比例为4:1和5:0时,疏水相互作用和氢键含量减少,可能是由于过量的KGM和碱与蛋白质分子竞争水分子,使蛋白质与水分子间的作用减弱[30]。研究表明,疏水相互作用是复合凝胶的主要作用力,这种弱交联结构是复合凝胶强度低、持水性差的直接原因[31]。上述结果表明,一定比例的KGM/κ-C和Ca(OH)2与全牡蛎-SPI复合凝胶具有协同胶凝作用,当KGM/κ-C比例为3:2(m/m),Ca(OH)2添加量为0.8%(m/v)时,复合凝胶的胶凝效果最佳,所形成的凝胶结构的分子作用力主要是疏水相互作用、氢键和二硫键。这与上述凝胶强度结果一致。
2.7 微观结构
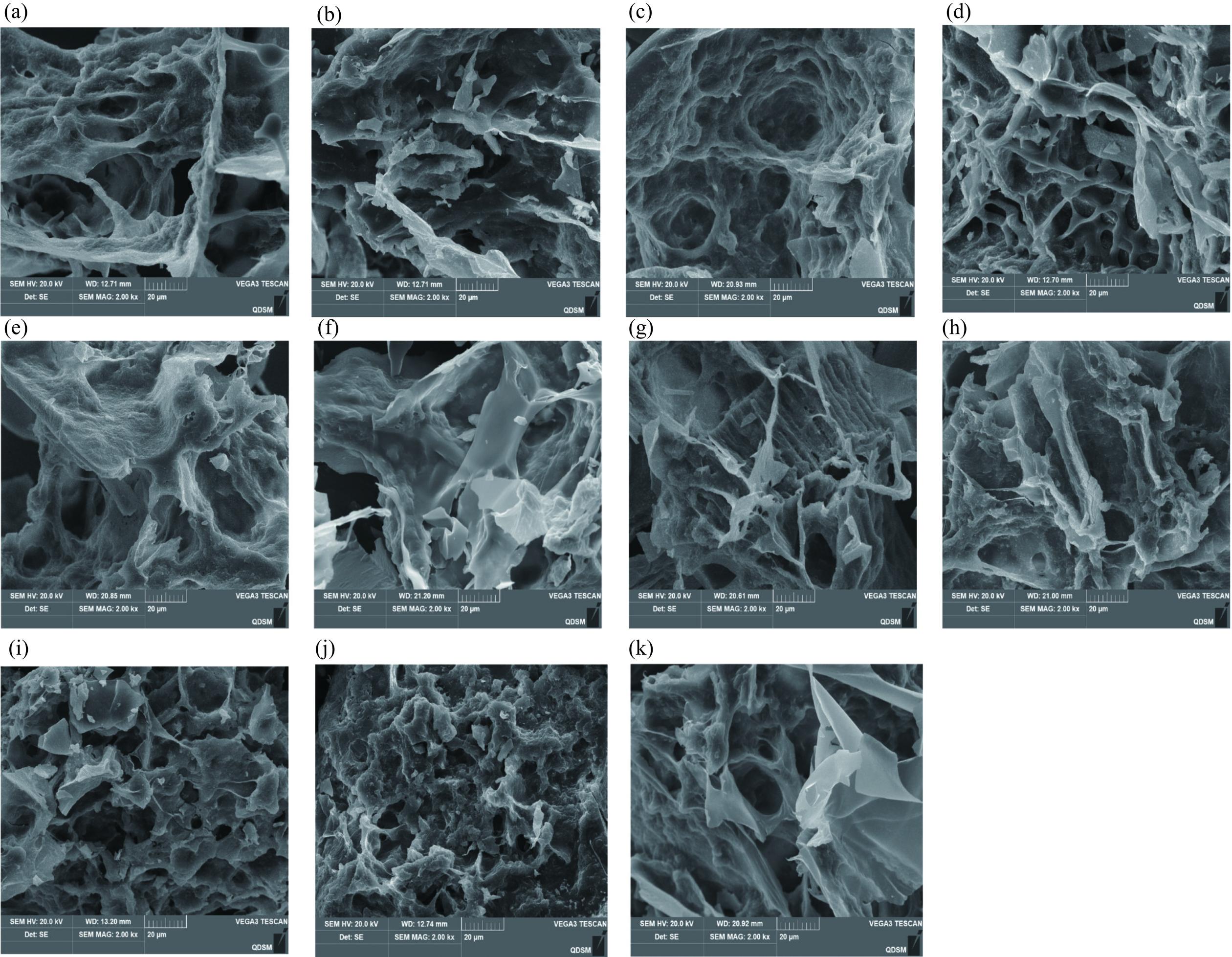
使用扫描电子显微镜(SEM)观察了不同复配比KGM/κ-C和不同添加量Ca(OH)2的全牡蛎-SPI混合凝胶的微观结构。如图9a至图9k所示,所有凝胶都呈现出三维网络结构。如图9a和图9f所示,单独的KGM和κ-C的孔洞较大,随着KGM浓度的增加,观察到凝胶结构更加紧凑和均匀。其中KGM/κ-C复配比为3:2时,凝胶的孔状结构整体细密且均匀,对提高持水性,增强凝胶强度有一定的改善作用。当KGM/κ-C复配比为2:3时,混合凝胶中孔隙较大且存在一个不均匀的网络,一部分致密,另一部分疏松,可能是因为KGM浓度太低,无法形成均匀的不可逆凝胶[23]。这种形态不利于水分的保留,因此对应了较低的持水性。
当Ca(OH)2的添加量为0.4%(m/v)时,混合凝胶中的孔隙更大且不均匀。这种形态不利于水分保持,因此保水能力较低。随着Ca(OH)2添加量的增加,观察到凝胶结构更加紧凑和均匀。当Ca(OH)2的添加量为0.8%(m/v)时,凝胶的整体孔状结构变得更致密、更均匀,对提高凝胶的保水性和强度有更好的效果。
3. 结论
本文研究结果表明,全牡蛎-大豆分离蛋白(SPI)复合凝胶特性受KGM/κ-C比例和Ca(OH)2添加量的影响。当KGM/κ-C比例为3:2(m/m),Ca(OH)2添加量为0.8%(m/v)时,复合凝胶的胶凝效果最佳。高浓度的KGM和Ca(OH)2提高了复合凝胶的持水性,促进了向固定化水的转变,形成的凝胶具有更高的G'和G"(G'>G"),并且胶凝点提前。增加KGM/κ-C比例和Ca(OH)2添加量后,复合凝胶整体变得更加致密且均匀,持水力也有一定提升。分子力结果表明,疏水相互作用、氢键和二硫键是复合凝胶的主要作用力。此外,适当增加KGM/κ-C比例和Ca(OH)2添加量能够显著促进二硫键的形成和疏水相互作用,形成的凝胶性能更好。本研究通过探究了全牡蛎-大豆分离蛋白复合凝胶的形成机制和最佳参数,对于拓宽牡蛎的应用范围,为新型食品凝胶的制备提供了一定的指导意义。
-
表 1 不同比例KGM/κ-C复合凝胶的频率扫描拟合
Table 1 Frequency scan fitting of KGM/κ-C composite gels with different ratios
样品 K′ n′ R2 KGM/κ-C-0/5 204.07±0.67e 0.07±0.02a 0.985 KGM/κ-C-2/3 250.40±1.00d 0.06±0.02a 0.987 KGM/κ-C-1/1 529.66±1.00c 0.05±0.01b 0.989 KGM/κ-C-3/2 815.25±2.91a 0.04±0.01b 0.995 KGM/κ-C-4/1 600.05±1.72b 0.04±0.01b 0.988 KGM/κ-C-5/0 516.71±0.92c 0.06±0.01a 0.987 注:同一列不同字母代表有显著性差异(P<0.05),表2同。 表 2 不同添加量的Ca(OH)2复合凝胶的频率扫描拟合
Table 2 Frequency scan fitting of composite gels with different Ca(OH)2 contents
样品 K′ n′ R2 Ca(OH)2-0.4% 465.32±3.83d 0.13±0.03a 0.985 Ca(OH)2-0.6% 815.85±1.00a 0.07±0.02b 0.988 Ca(OH)2-0.8% 822.70±1.00a 0.05±0.01c 0.995 Ca(OH)2-0.9% 731.82±1.20b 0.06±0.01b 0.991 Ca(OH)2-1.0% 684.86±1.00c 0.07±0.01b 0.989 -
[1] JIANG S, LIU L, XU J, et al. Amino acid composition and digestibility of Pacific oyster (Crassostrea gigas) proteins isolated from different parts[J]. LWT,2019,116(2):108591−108591.
[2] 赵强, 魏祥玲, 孙建安, 等. 牡蛎资源的综合开发利用研究进展[J]. 中国食品添加剂,2021,32(7):150−159. [ZHAO Q, WEI X L, SUN J A, et al. Progress of comprehensive development and utilization of oyster resources[J]. China Food Additives,2021,32(7):150−159.] ZHAO Q, WEI X L, SUN J A, et al. Progress of comprehensive development and utilization of oyster resources[J]. China Food Additives, 2021, 32(7): 150−159.
[3] 曾静, 方伟, 周天琼. 牡蛎肽生物活性最新研究进展[J]. 药学实践与服务,2023,41(7):403−407. [ZENG J, FANG W, ZHOU T Q. Recent advances in the bioactivity of oyster peptides[J]. Pharmacy Practice and Service,2023,41(7):403−407.] ZENG J, FANG W, ZHOU T Q. Recent advances in the bioactivity of oyster peptides[J]. Pharmacy Practice and Service, 2023, 41(7): 403−407.
[4] 王冲, 王俏君, 马国丽, 等. 油凝胶替代固体脂肪在食品中应用研究进展[J]. 粮食与油脂,2023,36(1):12−16. [WANG C, WANG P J, MA G L, et al. Progress of research on the application of oleogel as a substitute for solid fat in food[J]. Grain and Fats,2023,36(1):12−16.] WANG C, WANG P J, MA G L, et al. Progress of research on the application of oleogel as a substitute for solid fat in food[J]. Grain and Fats, 2023, 36(1): 12−16.
[5] 薛山, 罗娟. 多糖添加对兔肌原纤维蛋白Pickering乳液稳定性及凝胶特性的影响[J]. 食品工业科技,2023,44(13):21−29. [XUE S, LUO J. Effects of polysaccharide addition on the stability and gel properties of rabbit myofibrillar protein Pickering emulsion[J]. Food Industry Science and Technology,2023,44(13):21−29.] XUE S, LUO J. Effects of polysaccharide addition on the stability and gel properties of rabbit myofibrillar protein Pickering emulsion[J]. Food Industry Science and Technology, 2023, 44(13): 21−29.
[6] 马骏骅, 颜金鑫, 樊炯, 等. 亲水多糖对谷氨酰胺转氨酶交联大豆分离蛋白凝胶特性的影响[J]. 食品安全质量检测学报,2023,14(15):20−32. [MA J H, YAN J X, FAN J, et al. Effect of hydrophilic polysaccharides on the gel properties of glutamine aminotransferase cross-linked soybean isolate proteins[J]. Journal of Food Safety and Quality Testing,2023,14(15):20−32.] MA J H, YAN J X, FAN J, et al. Effect of hydrophilic polysaccharides on the gel properties of glutamine aminotransferase cross-linked soybean isolate proteins[J]. Journal of Food Safety and Quality Testing, 2023, 14(15): 20−32.
[7] 雷仪灿, 任仙娥, 陶雨. 不同淀粉对大豆分离蛋白流变学及钙促凝胶特性的影响[J]. 中国调味品,2023,48(5):37−43. [LEI Y C, REN X E, TAO Y. Effects of different starches on the rheology and calcium-promoted gel properties of soybean isolates[J]. China Flavorings,2023,48(5):37−43.] doi: 10.3969/j.issn.1000-9973.2023.05.006 LEI Y C, REN X E, TAO Y. Effects of different starches on the rheology and calcium-promoted gel properties of soybean isolates[J]. China Flavorings, 2023, 48(5): 37−43. doi: 10.3969/j.issn.1000-9973.2023.05.006
[8] 李杨, 满慧, 贾亦佳, 等. 不同多糖条件下大豆蛋白-绿原酸凝胶特性研究[J]. 农业机械学报,2023,54(5):387−395. [LI Y, MAN H, JIA Y J, et al. Characterization of soybean protein-chlorogenic acid gels under different polysaccharide conditions[J]. Journal of Agricultural Machinery,2023,54(5):387−395.] LI Y, MAN H, JIA Y J, et al. Characterization of soybean protein-chlorogenic acid gels under different polysaccharide conditions[J]. Journal of Agricultural Machinery, 2023, 54(5): 387−395.
[9] 孙泽坤, 谢云飞, 于航, 等. 魔芋胶与卡拉胶复配优化驴头骨肉冻凝胶特性[J]. 食品与发酵工业,2022,48(1):146−152. [SUN Z K, XIE Y F, YU H, et al. Optimization of gel properties of donkey skull jelly by compounding konjac gum with carrageenan[J]. Food and Fermentation Industry,2022,48(1):146−152.] SUN Z K, XIE Y F, YU H, et al. Optimization of gel properties of donkey skull jelly by compounding konjac gum with carrageenan[J]. Food and Fermentation Industry, 2022, 48(1): 146−152.
[10] 官孝瑶, 谢勇, 陈朝军, 等. 不同脱乙酰度魔芋葡甘露聚糖对面团特性和面包品质的影响[J]. 食品与发酵工业,2023,49(9):221−228. [GUAN X Y, XIE Y, CHEN Z J, et al. Effects of different degrees of deacetylation of konjac glucomannan on dough properties and bread quality[J]. Food and Fermentation Industry,2023,49(9):221−228.] GUAN X Y, XIE Y, CHEN Z J, et al. Effects of different degrees of deacetylation of konjac glucomannan on dough properties and bread quality[J]. Food and Fermentation Industry, 2023, 49(9): 221−228.
[11] 杨悦, 任元元, 邓利玲, 等. 基于碱性电解水形成的魔芋热不可逆凝胶性质研究[J]. 食品与发酵工业,2022,48(18):149−154. [YANG Y, REN Y Y, DANG L L, et al. Study on the thermally irreversible gel properties of konjac based on alkaline electrolyzed water formation[J]. Food and Fermentation Industry,2022,48(18):149−154.] YANG Y, REN Y Y, DANG L L, et al. Study on the thermally irreversible gel properties of konjac based on alkaline electrolyzed water formation[J]. Food and Fermentation Industry, 2022, 48(18): 149−154.
[12] TIAN L, ZHANG S, YI J, et al. The impact of konjac glucomannan on the physical and chemical stability of walnut oil-in-water emulsions coated by whey proteins[J]. Journal of the Science of Food and Agriculture,2022,102(10):4003−4011. doi: 10.1002/jsfa.11748
[13] 薛山, 庄凌凌. 大豆分离蛋白-卡拉胶-黄原胶三元复合Pickering乳液的制备与特性分析[J]. 食品工业科技,2023,44(15):16−24. [XUE S, ZHUANG L L. Preparation and characterization of ternary composite Pickering emulsion of soybean isolate protein-carrageenan-xanthan gum[J]. Food Industry Science and Technology,2023,44(15):16−24.] XUE S, ZHUANG L L. Preparation and characterization of ternary composite Pickering emulsion of soybean isolate protein-carrageenan-xanthan gum[J]. Food Industry Science and Technology, 2023, 44(15): 16−24.
[14] ZHANG M, LI J, SU Y, et al. Preparation and characterization of hen egg proteins-soybean protein isolate composite gels[J]. Food Hydrocolloids,2019,9(7):105191.
[15] QIN X S, LUO S Z, CAI J, et al. Effects of microwave pretreatment and transglutaminase crosslinking on the gelation properties of soybean protein isolate and wheat gluten mixtures[J]. Journal of the Science of Food & Agriculture,2016,96(10):3559−3566.
[16] 钱书意, 李侠, 孙圳, 等. 不同冻结温度下牛肉的肌原纤维蛋白变性与肌肉持水性[J]. 食品科学,2018,39(15):24−30. [QIAN S Y, LI M, SUN Z, et al. Myofibrillar protein denaturation and muscle water holding capacity of beef at different freezing temperatures[J]. Food Science,2018,39(15):24−30.] doi: 10.7506/spkx1002-6630-201815004 QIAN S Y, LI M, SUN Z, et al. Myofibrillar protein denaturation and muscle water holding capacity of beef at different freezing temperatures[J]. Food Science, 2018, 39(15): 24−30. doi: 10.7506/spkx1002-6630-201815004
[17] CHEN X, LI P J, NISHIUMI T, et al. Effects of high-pressure processing on the cooking loss and gel strength of chicken breast actomyosin containing sodium alginate[J]. Food & Bioprocess Technology,2014,7(12):3608−3617.
[18] MA Y Y, WANG Y W, JIN S S, et al. Effect of gelatin on gelation properties of oyster (Crassostrea gigas) protein[J]. LWT,2022,158−165.
[19] RONG L, SHEN M, WEN H, et al. Effects of xanthan, guar and Mesona chinensis Benth gums on the pasting, rheological, texture properties and microstructure of pea starch gels[J]. Food Hydrocolloids,2022(8):125−130.
[20] YANG K, WANG Z, NAKAJIMA T, et al. The effect of degradation on κ-carrageenan/locust bean gum/konjac glucomannan gels at acidic pH[J]. Carbohydrate Polymers,2013,98(1):744−749. doi: 10.1016/j.carbpol.2013.04.024
[21] 茹昂. 亲水胶体对乳化牛肉糜流变性和凝胶性作用规律研究[D]. 郑州:河南农业大学, 2023. [RU A. Study on the effect of hydrocolloids on the rheology and gelation of emulsified ground beef[D]. Zhengzhou:Henan Agricultural University, 2023.] RU A. Study on the effect of hydrocolloids on the rheology and gelation of emulsified ground beef[D]. Zhengzhou: Henan Agricultural University, 2023.
[22] DONG L, QIAO H, CHEN B J. et al. Incorporation of κ-carrageenan improves the practical features of agar/konjac glucomannan/κ-carrageenan ternary system[J]. Food Science and Human Health,2023,12(2):512−519.
[23] WU D, YU S, LIANG H, et al. The influence of deacetylation degree of konjac glucomannan on rheological and gel properties of konjac glucomannan/κ-carrageenan mixed system[J]. Food Hydrocolloids,2020,101:105523 . doi: 10.1016/j.foodhyd.2019.105523
[24] LIU Z J, REN X, CHENG Y Q, et al. Gelation mechanism of alkali induced heat-set konjac glucomannan gel[J]. Trends in Food Science & Technology,2021,116(7):244−254.
[25] KOU D, WANG X, WEI X, et al. The rheological properties of the konjac glucomannan and pullulan system[J]. Journal of the Chinese Cereals and Oils Association,2014,29(12):37−42.
[26] GUINEE T P, BRENDAN T. The effect of calcium content of Cheddar-style cheese on the biochemical and rheological properties of processed cheese[J]. Dairy Science & Technology,2009,89(3):317−333.
[27] UR A, SHEVKANI K , SINGH N, et al. Effect of guar gum and xanthan gum on pasting and noodle-making properties of potato, n and mung bean starches[J]. Journal of Food Science & Technology,2015,52(12):8113−8121.
[28] WANG Y, CHANG Y, XUE Y, et al. Rheology and microstructure of heat-induced fluid gels from Antarctic krill (Euphausia superba) protein:Effect of pH[J]. Food Hydrocolloids,2016,52(6):510−519.
[29] 简华君, 张海瑞, 黄小林, 等. 碱溶热处理对大豆分离蛋白溶解度、热聚集和流变性质的影响[J]. 食品工业科技,2014,35(16):101−104. [JIAN H J, ZHANG H R, HUANG X L, et al. Effects of alkali solubilization heat treatment on solubility, thermal aggregation and rheological properties of soybean isolate proteins[J]. Food Industry Science and Technology,2014,35(16):101−104.] JIAN H J, ZHANG H R, HUANG X L, et al. Effects of alkali solubilization heat treatment on solubility, thermal aggregation and rheological properties of soybean isolate proteins[J]. Food Industry Science and Technology, 2014, 35(16): 101−104.
[30] BUAMARD N, BENJAKUL S, KONNO K. Improvement of gel quality of sardine surimi with low setting phenomenon by ethanolic coconut husk extract[J]. Journal of Texture Studies,2017,48(1):47−56. doi: 10.1111/jtxs.12207
[31] 尚旭珂, 朱斯亮, 郑宝东, 等. 体外模拟消化环境中消化酶对κ-卡拉胶/酪蛋白复合体系流变学特性及微观结构的影响[J]. 食品工业科技,2024,45(4):33−41. [SHANG X K, ZHU S L, ZHENG B D, et al. Effects of digestive enzymes on rheological properties and microstructure of κ-carrageenan/casein composite system in an in vitro simulated digestion environment[J]. Food Industry Science and Technology,2024,45(4):33−41.] SHANG X K, ZHU S L, ZHENG B D, et al. Effects of digestive enzymes on rheological properties and microstructure of κ-carrageenan/casein composite system in an in vitro simulated digestion environment[J]. Food Industry Science and Technology, 2024, 45(4): 33−41.
[32] WANG L, DA M, et al. Protein structural development of threadfin bream ( Nemipterus spp.) surimi gels induced by glucose oxidase[J]. Food Science and Technology International,2018,24(7):598−606. doi: 10.1177/1082013218779239
[33] KIM, SUNG G, YOO B. Rheological characteristics of cold thickened beverages containing xanthan gum–based food thickeners used for dysphagia diets[J]. Journal of the Academy of Nutrition & Dietetics,2015,115(1):106−111.
[34] 陈瑞瑞, 苗佳鑫, 关玉婷, 等. 脱乙酰改性对魔芋葡甘聚糖/黑米膳食纤维复合膜特性的影响[J]. 食品安全质量检测学报,2023,14(8):245−254. [CHEN R R, MIAO J X, GUAN Y T, et al. Effect of deacetylation modification on the properties of konjac glucan/black rice dietary fiber composite membrane[J]. Journal of Food Safety and Quality Testing,2023,14(8):245−254.] CHEN R R, MIAO J X, GUAN Y T, et al. Effect of deacetylation modification on the properties of konjac glucan/black rice dietary fiber composite membrane[J]. Journal of Food Safety and Quality Testing, 2023, 14(8): 245−254.
[35] 杜童申, 刘悦, 马骏骅, 等. 超声预处理对亚麻籽胶-大豆分离蛋白复合凝胶凝胶特性及结构的影响[J]. 食品工业科技,2024,45(13):83−90. [DU T S, LIU Y, MA J H, et al. Effect of ultrasonic pretreatment on gel properties and structure of linseed gum-soybean isolate protein composite gels[J]. Food Industry Science and Technology,2024,45(13):83−90.] DU T S, LIU Y, MA J H, et al. Effect of ultrasonic pretreatment on gel properties and structure of linseed gum-soybean isolate protein composite gels[J]. Food Industry Science and Technology, 2024, 45(13): 83−90.
[36] FENG G P, LI M Y, LIN H Y, et al. Study on the physicochemical properties and lipid adsorption capacity of deacetylated konjac glucomannan[J]. Modern Food Science and Technology,2017,33(2):35−40.
[37] 李晓飞, 李培源, 李安琪, 等. 黄原胶添加对碱法诱导魔芋胶凝胶特性及凝胶机制的影响[J]. 中国农业科学,2020,53(14):2941−2955. [LI X F, LI P Y, LI A Q, et al. Effects of xanthan gum addition on the gel characteristics and gelation mechanism of alkaline-induced konjac gum[J]. Chinese Agricultural Science,2020,53(14):2941−2955.] LI X F, LI P Y, LI A Q, et al. Effects of xanthan gum addition on the gel characteristics and gelation mechanism of alkaline-induced konjac gum[J]. Chinese Agricultural Science, 2020, 53(14): 2941−2955.
[38] 刘得福, 曾名湧. 紫贻贝(Mytilus edulis)蛋白与κ-卡拉胶复合凝胶性质研究[J]. 食品科技,2023,48(5):245−253. [LIU D F, ZENG M Y. Properties of a composite gel of purple mussel (Mytilus edulis) protein and κ-carrageenan[J]. Food Science and Technology,2023,48(5):245−253.] LIU D F, ZENG M Y. Properties of a composite gel of purple mussel (Mytilus edulis) protein and κ-carrageenan[J]. Food Science and Technology, 2023, 48(5): 245−253.
[39] HAN M, WANG P, XU X, et al. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J]. Food Research International,2014,62:1175−1182. doi: 10.1016/j.foodres.2014.05.062
[40] LIU C, CHEN Y, CHEN J. Synthesis and characteristics of pH-sensitive semi-interpenetrating polymer network hydrogels based on konjac glucomannan and poly (aspartic acid) for in vitro drug delivery[J]. Carbohydrate Polymers,2010,79(3):500−506. doi: 10.1016/j.carbpol.2009.08.024
[41] KHANNA S, TESTER R F. Influence of purified konjac glucomannan on the gelatinisation and retrogradation properties of maize and potato starches[J]. Food Hydrocolloids,2006,20(5):567−576. doi: 10.1016/j.foodhyd.2005.05.004
[42] 杨贞. 碱性条件下魔芋胶对小麦淀粉凝胶流变和质构特性的影响[D]. 郑州:河南农业大学, 2019. [YANG Z. Effect of konjac gum on rheological and textural properties of wheat starch gel under alkaline conditions[D]. Zhengzhou:Henan Agricultural University, 2019.] YANG Z. Effect of konjac gum on rheological and textural properties of wheat starch gel under alkaline conditions[D]. Zhengzhou: Henan Agricultural University, 2019.
[43] 王元兰, 黄寿恩, 魏玉. κ-卡拉胶与魔芋胶复配胶的流变性能及其微观结构研究[J]. 中国食品学报,2012,12(7):49−54. [WANG Y L, HUANG S E, WEI Y. Rheological properties and microstructure of κ-carrageenan compounded with konjac gum[J]. Chinese Journal of Food,2012,12(7):49−54.] doi: 10.3969/j.issn.1009-7848.2012.07.008 WANG Y L, HUANG S E, WEI Y. Rheological properties and microstructure of κ-carrageenan compounded with konjac gum[J]. Chinese Journal of Food, 2012, 12(7): 49−54. doi: 10.3969/j.issn.1009-7848.2012.07.008
[44] 杨铎平, 孙爱静, 朱彬玲, 等. κ-卡拉胶和魔芋胶复合凝胶的制备及吸附亚甲基蓝综合实验[J]. 山东化工,2022,51(13):48−51. [YANG D P, SUN A J, ZHU B L, et al. Preparation of composite gel with κ-carrageenan and konjac gum and comprehensive experiment on adsorption of methylene blue[J]. Shandong Chemical Industry,2022,51(13):48−51.] YANG D P, SUN A J, ZHU B L, et al. Preparation of composite gel with κ-carrageenan and konjac gum and comprehensive experiment on adsorption of methylene blue[J]. Shandong Chemical Industry, 2022, 51(13): 48−51.
[45] 庄远红, 刘静娜, 潘裕添, 等. pH对魔芋胶复配体系凝胶特性及色泽的影响[J]. 生物加工过程,2014,12(3):58−61. [ZHANG Y H, LIU J N, PAN Y T, et al. Effect of pH on gel characteristics and color of konjac gum compounding system[J]. Bioprocessing,2014,12(3):58−61.] ZHANG Y H, LIU J N, PAN Y T, et al. Effect of pH on gel characteristics and color of konjac gum compounding system[J]. Bioprocessing, 2014, 12(3): 58−61.
[46] 潘丽华. 不同理化条件下亚麻籽胶对肌原纤维蛋白凝胶特性的影响[D]. 南京:南京农业大学, 2016. [PAN L H. Effects of flaxseed gum on myofibrillar protein gel properties under different physicochemical conditions[D]. Nanjing:Nanjing Agricultural University, 2016.] PAN L H. Effects of flaxseed gum on myofibrillar protein gel properties under different physicochemical conditions[D]. Nanjing: Nanjing Agricultural University, 2016.
[47] BRENNER T, TUVIKENE R, FANG Y, et al. Rheology of highly elastic iota-carrageenan/kappa-carrageenan/xanthan/konjac glucomannan gels[J]. Food Hydrocolloids,2015,44(2):136−144.





 下载:
下载:

 下载:
下载:



