Antibacterial Activity and Mechanism of Hydrogen Peroxide against the Dominant Strain Bacillus aryabhattai in Fresh and Wet Vermicelli
-
摘要: 为抑制鲜湿粉条中微生物的腐败变质以及探索绿色高效的保鲜剂,本研究系统探究了过氧化氢(H2O2)作为一种绿色保鲜剂对鲜湿粉条的优势腐败菌的抑菌机制。首先通过高通量测序确定鲜湿粉条中的优势腐败菌为阿氏芽孢杆菌(Bacillus aryabhattai),再采用抑菌活性实验对H2O2对B. aryabhattai的抑菌圈直径(Inhibition zone diameter,IZD)、最小抑菌浓度(Minimum inhibitory concentration,MIC)、最小杀菌浓度(Minimum bactericidal concentration,MBC)和生长曲线的影响进行分析;同时进行抑菌机制实验观察H2O2对B. aryabhattai的细胞膜、细胞壁的破坏作用及胞内功能成分的外泄。结果表明,当H2O2浓度由250 μg/mL提高至1000 μg/mL,IZD增大了8 mm,H2O2的MIC和MBC均为250 μg/mL。通过生长曲线发现当H2O2浓度高于250 μg/mL时能在24 h内完全抑制住细菌的生长。抑菌机制实验表明H2O2的浓度增加会显著提高菌液上清液中核酸、蛋白质的含量(P<0.05),同时破坏了B. aryabhattai的细胞壁和细胞膜结构,导致碱性磷酸酶(Alkaline phosphatase,AKP)和β-半乳糖苷酶(β-Galactosidase,β-GAL)泄露到细胞外,且与H2O2呈浓度依赖性。因此,250 μg/mL H2O2能够有效抑制鲜湿粉条中的优势腐败菌B. aryabhattai。本研究可为鲜湿粉条的货架期延长、市值提升提供一定的理论依据和生产指导。Abstract: To inhibit microbial spoilage in fresh and wet vermicelli and explore green and efficient preservatives, this study systematically investigated the antibacterial mechanism of hydrogen peroxide (H2O2), a green preservative, against the predominant spoilage bacteria in fresh and wet vermicelli. Firstly, the predominant spoilage bacteria in fresh and wet vermicelli were identified as Bacillus aryabhattai through high-throughput sequencing. Then, the influence of H2O2 on the inhibition zone diameter (IZD), the minimum inhibitory concentration (MIC), the minimum bactericidal concentration (MBC) and the growth curve of B. aryabhattai were analyzed through antibacterial activity assays. Simultaneously, the mechanism of antibacterial action experiments was conducted to observe the effects of H2O2 on the disruption of cell membrane and cell wall of B. aryabhattai, as well as the leakage of intracellular functional components. The results showed that increasing the concentration of H2O2 from 250 μg/mL to 1000 μg/mL resulted in an 8 mm increased IZD. Additionally, MIC and MBC of H2O2 were both 250 μg/mL. The growth curve analysis revealed that bacterial growth was completely inhibited within 24 hours when the concentration of H2O2 was higher than 250 μg/mL. The mechanism of antibacterial action experiments indicated that increasing concentrations of H2O2 significantly raised the concentrations of nucleic acids and proteins in the supernatant of the bacterial liquid (P<0.05), while also disrupting the cell wall and membrane structure of B. aryabhattai, leading to the leakage of alkaline phosphatase (AKP) and β-galactosidase (β-GAL) outside the cells, and it exhibited a concentration-dependent relationship with H2O2. Therefore, H2O2 at 250 μg/mL effectively inhibited the activity of B. aryabhattai in fresh and wet vermicelli. This study provides a theoretical basis and production guidance for extending the shelf life and increasing the market value of fresh and wet vermicelli.
-
鲜湿粉条能快速复水,方便食用,且口感爽滑细腻,适配多种调味料,受到亚洲广大食客的青睐[1−2],其生产无需耗能干燥,节省约70%能源,符合食品绿色生产[3−5]。同时,新型的铺浆式生产方式无需添加硫酸铝铵、硫酸铝钾等含铝添加剂[6],从原料处把控食品安全,生产绿色食品。
过氧化氢(H2O2)是一种高效、可降解的抑菌剂[7],GB 2760-2014《食品添加剂使用标准》规定其可以作为食品加工助剂添加到食品中,但在使用时需严格注意添加剂量及残留量,GB 5009.226-2016《食品中过氧化氢残留量的测定》规定其在食品中的残留量应小于3 mg/kg[8−9]。H2O2具有广谱高效的灭菌活性,在食品中使用后会降解成H2O和O2,对环境无害,是一种“绿色”的灭菌剂[10−11]。H2O2无色无味,目前其在食品中的使用主要集中在果蔬保鲜[11]、食品表面杀菌[12]、食品冰微生物控制[13]和食品的改性上[14]。虽然目前H2O2已经使用在很多领域中,如食品、化妆品、医疗器械中[15],但是关于H2O2对微生物的具体作用机理仍较为模糊。目前H2O2的研究机理主要在生物体外,如H2O2会使核酸的磷酸二酯键断裂[16],氧化蛋白质[17],而关于H2O2对细胞的生物灭活性的影响鲜少报道。
鲜湿粉条因水分含量高,故易发生腐败变质,而芽孢杆菌属(Bacillus)是鲜湿粉条中的主要微生物[18],其易在各类含有大量淀粉基质的谷物上生长,如红薯、玉米、水稻等。该菌的肆虐生长会造成大量的粮食损失,不仅降低粮食的营养价值也会导致巨大的经济损失,同时也会损害人体健康[19]。阿氏芽孢杆菌(Bacillus aryabhattai)属于芽孢杆菌属,其在全球均有分布,在我国主要在农田和森林中被发现。B. aryabhattai有很强的抗逆性,且部分菌株自己形成了一系列的活性氧防御系统[20]。目前,关于鲜湿粉条优势腐败菌鉴定及抑菌鲜有研究,通过高通量测序可以对鲜湿粉条优势腐败菌群进行分析汇总,帮助科研人员筛选出样品中的优势菌株,从而为H2O2在鲜湿粉条中的保鲜应用提供理论指导。
本研究以鲜湿粉条为研究对象,对比未添加H2O2组和添加0.25‰、0.5‰、1‰(w/w)H2O2组的高通量测序结果,筛选到一株优势菌株B. aryabhattai,进一步用该菌株作为指示菌进行H2O2的抑菌活性和抑菌机制的研究。并进一步通过抑菌圈直径(Inhibition zone diameter,IZD)、最小抑菌浓度(Minimum inhibitory concentration,MIC)、最小杀菌浓度(Minimum bactericidal concentration,MBC)、抑菌生长曲线来判断H2O2对目标菌株的抑菌活性;再对其核酸、蛋白质、碱性磷酸酶(Alkaline phosphatase,AKP)和β-半乳糖苷酶(β-Galactosidase,β-GAL)泄露量进行测定,通过扫描电镜(Scanning electron microscope,SEM)和透射电镜(Transmission electron microscope,TEM)观察不同浓度的H2O2对B. aryabhattai的细胞壁和细胞膜结构的影响。本研究对H2O2对湿态粉条中优势菌株的抑菌机理进行了较为全面的研究,有望为H2O2延长湿态淀粉类制品货架期和市值提供一定理论依据和生产指导。
1. 材料与方法
1.1 材料与仪器
阿氏芽孢杆菌 由本课题组在河南省盛田农业有限公司生产的湿态粉条中分离筛选获得,经鉴定为阿氏芽孢杆菌,与甘油1:1(v/v)混合保存于−80 ℃超低温冰箱中;甘薯淀粉(水分13.51%,灰分0.15%,蛋白质0.10%,直链淀粉25.2%) 秦皇岛十八里食品有限公司;食盐(NaCl) 中国盐业集团有限公司;过氧化氢(35%) 食品级,河南亿丰化工有限公司;过氧化氢标准溶液(1000 μg/mL) 北京迈瑞达科技有限公司;氨苄青霉素溶液(100 mg/mL) 上海玻尔化学试剂有限公司;碱性磷酸酶试剂盒、总蛋白定量测定试剂盒 南京建成生物工程研究所;β-半乳糖苷酶活性测定试剂盒 上海百生跃生物科技有限公司;营养琼脂(Nutrient agar,NA)、营养肉汤(Nutrient broth,NB)、平板计数琼脂(Plate count agar,PCA) 海博生物。
SU8010扫描电子显微镜 日本日立公司;DW-HL678超低温冰箱 美菱生物医疗;LCSH-150C恒温培养箱 南京联泽科学仪器有限公司;H1650-W台式微量高速离心机 长沙湘仪离心机仪器有限公司;BioscreenC全自动细菌生长仪 上海谓载商贸发展有限公司;H7650透射电子显微镜 日本日立公司;SHZ-82A气浴恒温振荡器 金坛市科析仪器有限公司;NanoDrop2000紫外可见分光光度计 美国赛默飞世尔科技公司;SW-CJ-ID单人净化工作台 苏州净化公司;SHX-250B生化培养箱 常州冠军仪器制造有限公司。
1.2 实验方法
1.2.1 鲜湿粉条的制备
本文所用的粉条通过铺浆式生产,由河南省盛田农业有限公司协助生产,每次生产原料红薯淀粉75 kg。工厂生产工艺[18]:原料热水制芡→打粉团→调成匀浆→抽真空→蒸熟→冷却、脱离→室温老化→低温老化→定长切丝→包装。具体步骤见图1。
对照组样品(CK)在制作过程中仅加5‰(w/w,下同)食盐,H2O2组加5‰食盐和0.25‰、0.5‰、1‰ H2O2。处理后,将样品在28±1 °C的培养箱中贮藏90 d。
1.2.2 总菌落数分析
在样品贮藏前一周内及之后90 d内每隔一周对总菌落计数,按微生物检验标准(GB 4789.2-2022)测定[21]。将鲜湿红薯淀粉样品(25 g)加入0.85%(w/w)无菌生理盐水(225 mL)中,混合均匀。在无菌生理盐水中连续稀释(10−1~10−5)后,每1 mL稀释液接种到PCA培养基中。平板在37 ℃孵育48±2 h以测定总有氧活菌计数(Total aerobic viable count,TAVC)。
1.2.3 高通量测序
当对照组样品细菌超过5 lg CFU/g(根据粉条的微生物标准GB 2713-2015)[22],经液氮冷冻磨后将样品委托给上海美吉生物医药科技有限公司进行其DNA的提取及高通量测序工作。采用16S rRNA 基因V3-V4高变区合成引物,338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)进行PCR扩增;20 μL反应体系:Mix 10 μL、引物各0.8 μL、模板0.8 μL,dd H2O补足20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃延伸10 min。PCR产物于2%琼脂糖凝胶电泳检测,PCR产物目的条带大小正确,浓度合适后使用NEXTFLEX Rapid DNA-Seq Kit进行建库,利用Illumina公司Miseq PE300平台测序[23]。
1.2.4 H2O2残留量的测定
根据《食品安全国家标准 食品中过氧化氢残留量的测定》(GB 5009.226-2016)中的钛盐比色法测定鲜湿粉条中H2O2的残留量[9]。
1.2.5 活化菌株及菌悬液的制备
根据1.2.3确定后续抑菌实验中使用的目标菌株为B. aryabhattai,将分离纯化筛选出的菌株28 ℃培养24 h后接种到营养肉汤中扩大培养,取菌悬液与甘油1:1(v/v)保存在−80 ℃冰箱中。为了后续实验的使用,将菌种保藏液按1‰(v/v)加入NB培养基中以28 ℃,180 r/min振荡培养18~24 h获得对数生长期的菌悬液。
1.2.6 H2O2对B. aryabhattai的抑菌效果
1.2.6.1 MIC和MBC的测定
根据Cui等[24]的方法进行MIC的测定。取1.2.5的菌悬液,采用倍比微量稀释法在96孔板中进行MIC的测定,封盖后于28 ℃静置培养1 d,取出后观察每孔中液体的澄清度,浓度最大的澄清液体孔所对应的抑菌液浓度为MIC。阳性对照只加菌液,阴性对照只加NB培养基。
将浓度大于等于MIC的孔洞吸出100 μL吹打均匀的液体涂布在NA平板上,在28 ℃孵育24 h后,没有细菌生长的浓度定义为MBC[25]。
1.2.6.2 抑菌圈测定
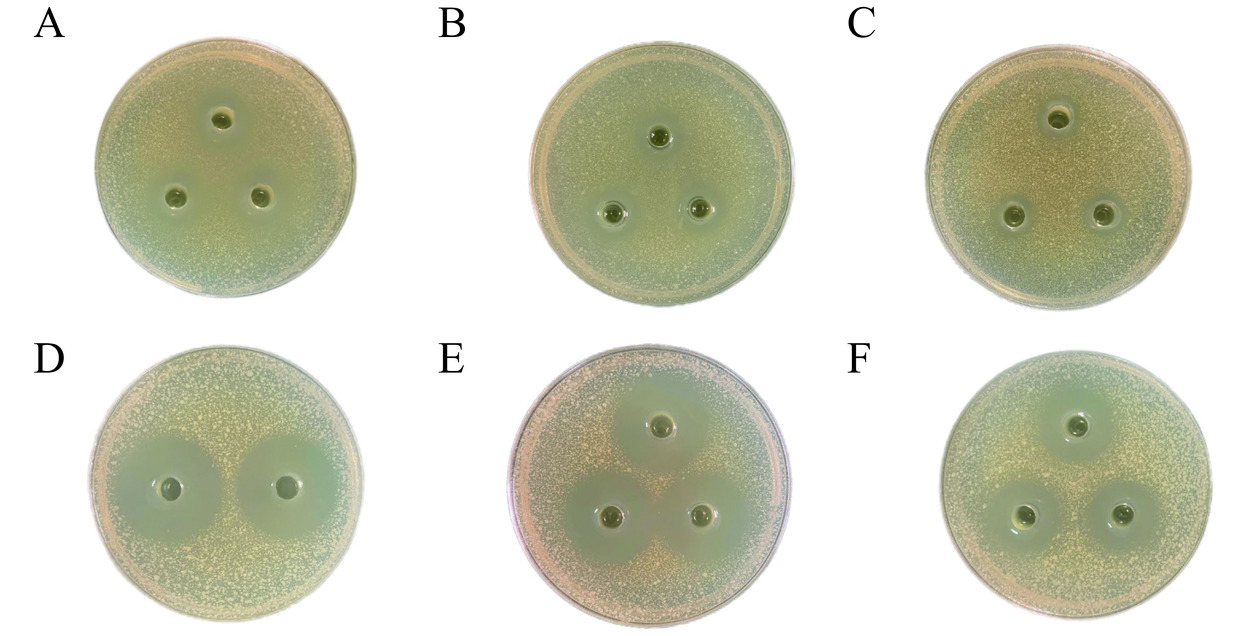
采用双层琼脂打孔法评估H2O2对B. aryabhattai的抑菌圈大小的影响[26]。将1.2.5的菌悬液稀释到吸光度在600 nm处为0.5左右时按1‰加进NB固体培养基中(加入2%琼脂的NB液体培养基)。在平板上铺一层琼脂培养基,凝固后放置牛津杯,然后将加入菌液的NB固体培养基避开牛津杯倾注在平板上。凝固后取出牛津杯,向形成的孔洞中添加200 µL抑菌液,之后置于4 ℃冰箱4 h扩散抑菌液,然后再放置于28 ℃培养箱18~24 h后用游标卡尺量取抑菌圈大小(重复3次均有抑菌作用,视为对该病原菌有抑制作用)。阴性对照组为无菌生理盐水,阳性对照组为氨苄青霉素。抑菌圈大小代表的抗菌效果参考表1[27]。
表 1 抑菌作用判断标准Table 1. Antibacterial judgment criteria抑菌圈直径 IZD(mm) 判定结果 ≤7 无抑菌作用 >7 有抑菌作用 7<IZD<10 钝敏 10<IZD<20 中敏 >20 高敏 1.2.6.3 生长曲线测定
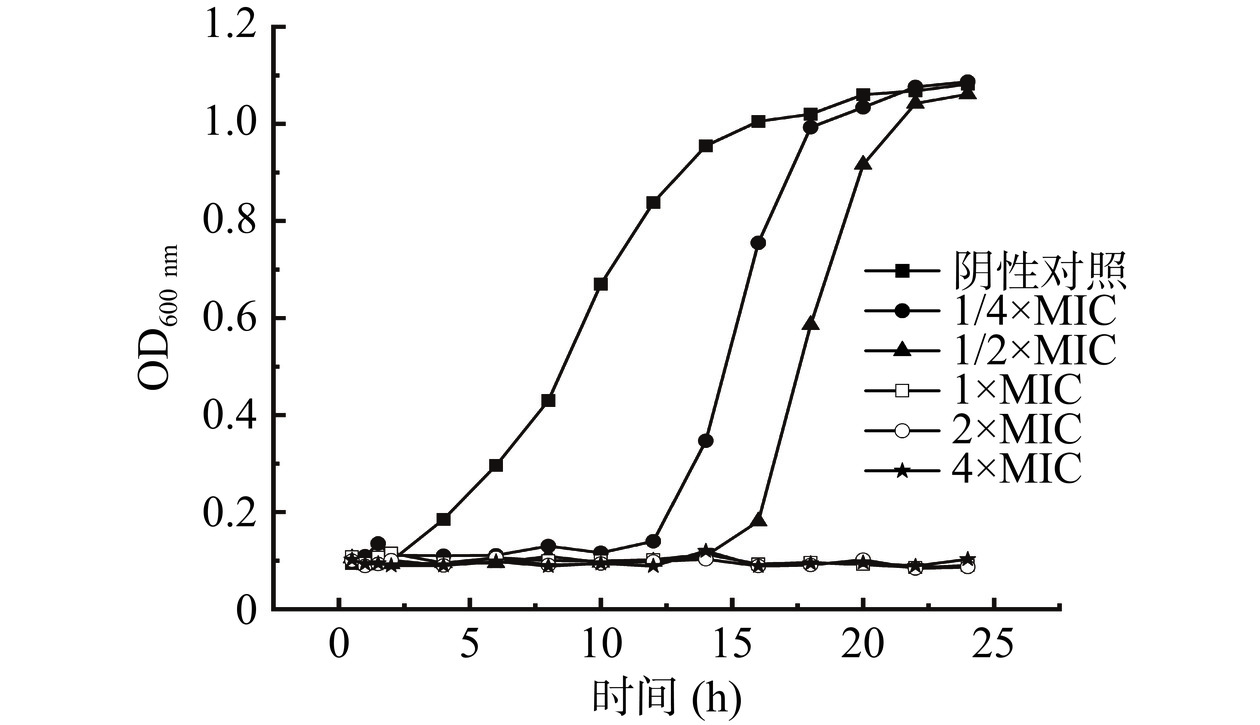
本实验使用全自动生长曲线仪测定浓度为4×MIC、2×MIC、1×MIC、1/2×MIC、1/4×MIC的H2O2抑菌液对筛选出菌株的生长曲线的影响,仪器设定每次测定间隔30 min,培养时间24 h,温度28 ℃,振荡速度为一般,振荡完成后静置10 s并测定600 nm处的吸光度值。每个样品设置三个平行,阴性对照组仅加NB。根据吸光度值随时间变化作图判断菌株生长情况[28]。
1.2.7 H2O2对B. aryabhattai的抑菌机制
1.2.7.1 碱性磷酸酶的测定
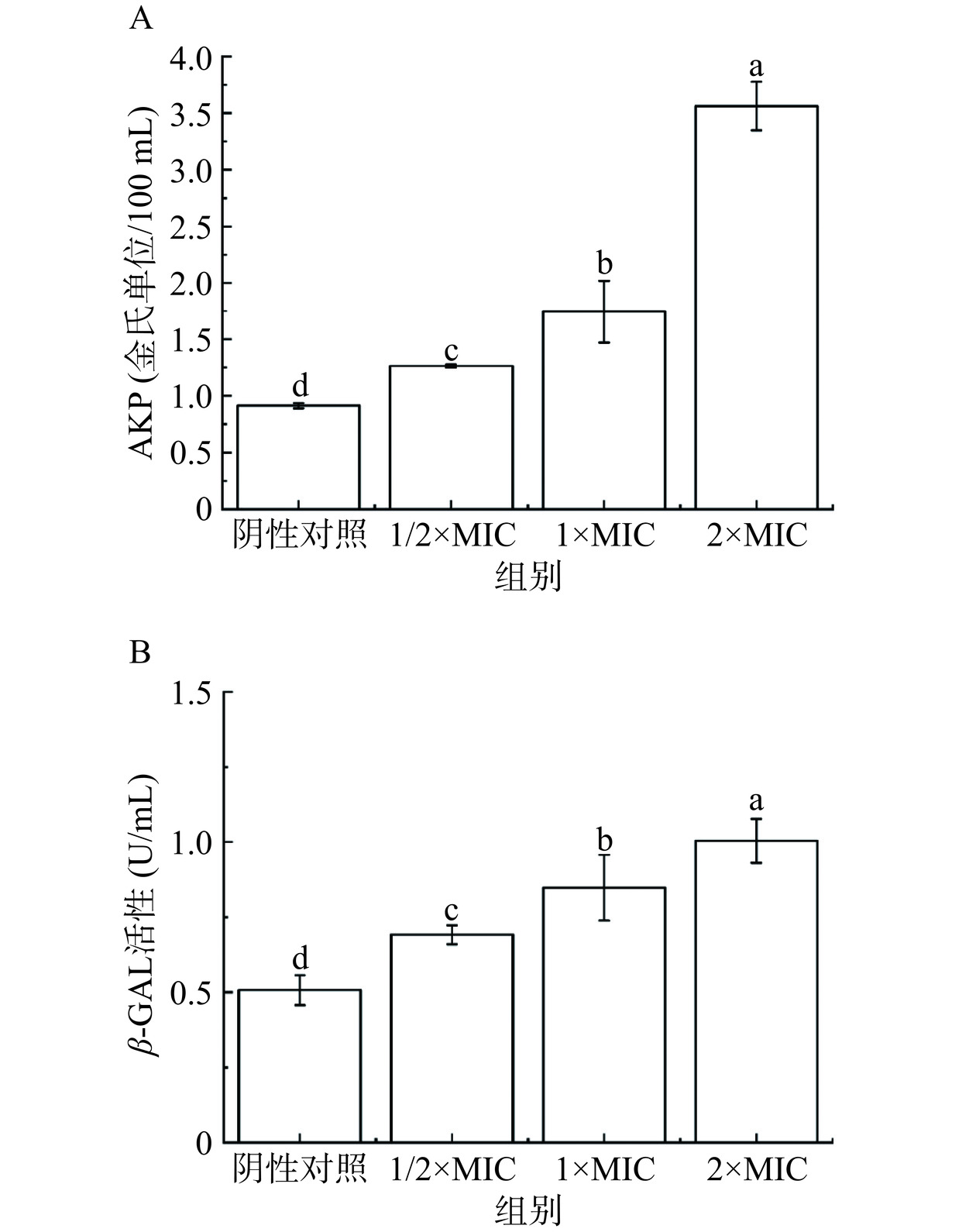
使用AKP试剂盒测定B. aryabhattai在经2×MIC、1×MIC、1/2×MIC的H2O2处理8 h后破损释放在菌液上清液中的AKP的活性。单位定义:每克酶蛋白在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位,即7.14 U/L。
1.2.7.2 β-半乳糖苷酶的测定
β-GAL作为细胞膜完整性的一个检测指标,使用β-GAL活性测定试剂盒对B. aryabhattai在经2×MIC、1×MIC、1/2×MIC的H2O2处理8 h后细胞破损释放到上清液中的β-GAL浓度变化进行检测。1个酶活性单位(U)定义为37 ℃、pH7.0的条件下,每分钟生成1 μmol对硝基苯酚所需要的酶量。
1.2.7.3 胞内核酸外泄测定
每隔2 h取样离心(3000 r/min,10 min),取出上清液后,用0.22 µm的针头式过滤器过滤后用紫外分光光度计测定其在260 nm处的吸光度值,重复三次取平均值。
1.2.7.4 胞内蛋白质外泄测定
每隔2 h取样离心后获得上清液,用总蛋白定量测定试剂盒测定其蛋白质含量,取10 μL样品液和标准液,加入250 μL的工作液,混匀后于37 ℃水浴加热30 min,在562 nm处测定其吸光度值,之后按照试剂盒说明书计算得到上清液中的总蛋白浓度(μg/mL)。
1.2.7.5 B. aryabhattai的微观结构测定
将1.2.5的菌悬液离心得到菌体,加入终浓度为0×MIC和1×MIC的H2O2,在28 ℃,180 r/min条件下处理4 h后,4 ℃、5000 r/min条件下离心10 min,之后再用磷酸盐缓冲液清洗三次,一部分用2.5%的戊二醛固定,经乙醇梯度洗脱后,离心取沉淀的菌体加入一定的醋酸异戊酯,液体混匀后沾取少许菌液滴在特定金属上,晾干喷金后用扫描电镜观察其表面结构。另一部分样品收集完菌体沉淀后加入2.5%戊二醛固定过夜后,经过脱水、渗透、包埋、切片及染色处理,通过透射电镜观测其内部结构[29]。
1.3 数据处理
所有实验均设置3个重复,数据用SPSS 18.0进行显著性分析(One-way ANOVA),以P<0.05作为差异显著性的判断标准,数据结果以均值±标准差(Standard deviation,SD)表示。使用Origin 2021进行作图。
2. 结果与分析
2.1 不同浓度H2O2对鲜湿粉条的影响
未添加和添加H2O2的鲜湿粉条分别进行贮藏期实验,细菌生长情况及H2O2残留量结果见表2。对照组在3 d内发生腐败变质,而H2O2组在90 d的贮藏期内未检测出腐败微生物的生长。同时对照组和H2O2组的粉条形态进行对比(图2A~2D),可以看到1‰ H2O2组孔洞较多(图2D),而0.25‰和0.5‰ H2O2组表面光滑无明显孔洞。在后续贮藏中发现1‰ H2O2组鲜湿粉条出现裂纹,组织结构逐渐被破坏,故建议在使用H2O2对鲜湿粉条进行保鲜时选择0.25‰和0.5‰的浓度,但出于对大生产这种较复杂环境的保证[30],建议采取0.5‰的H2O2。同时基于GB 5009.226-2016[9]对H2O2组的H2O2残留量进行测定,发现残留量均未检出,符合GB 2760-2014对其残留量的尽量去除的要求[8]。说明H2O2对鲜湿粉条有很好的延长货架期的效果,且无添加残留。
表 2 不同浓度H2O2对鲜湿粉条储藏期内细菌生长的影响(lg CFU/g)及其残留量Table 2. Effects of different concentrations of H2O2 on bacterial growth during the storage period of fresh and wet vermicelli ( lg CFU/g) and its residual levels处理 贮藏时间(d) H2O2残留量(mg/kg) 3 90 CK 5.56±0.05 − <3 0.25‰ H2O2 <1 <1 <3 0.50‰ H2O2 <1 <1 <3 1.00‰ H2O2 <1 <1 <3 注:“<1”表明该次测定所统计样品中未检测到菌落;“−”表明超出测定范围,多不可计;“<3”依据GB 5009.226-2016的钛盐比色法的定量限为3 mg/kg。 2.2 鲜湿粉条中细菌群落的分布
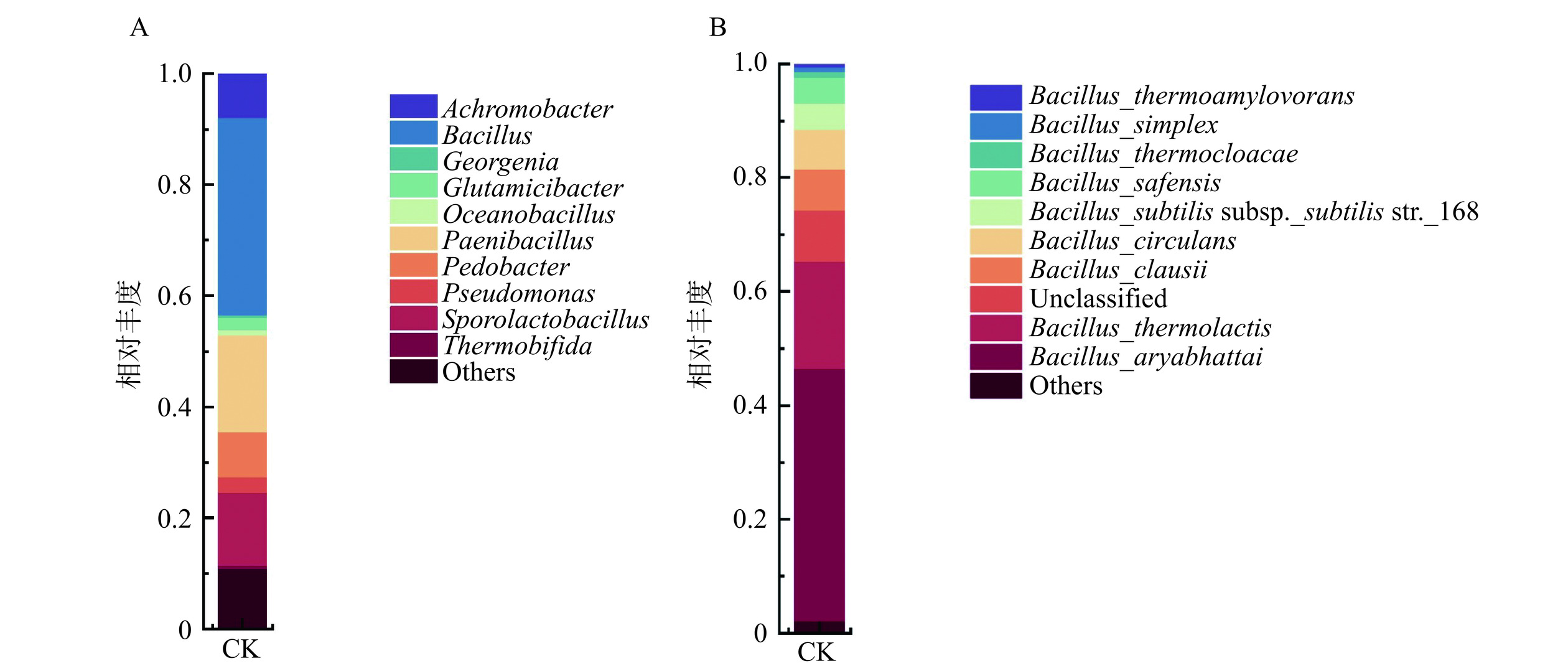
对鲜湿粉条的对照组进行细菌的高通量测序,结果如图3A、3B所示。对照组细菌在属水平上的样本群落组成结构结果如图3A所示,芽孢杆菌属(Bacillus)是对照组的主要优势菌,其次为类芽胞杆菌属(Paenibacillus)、芽孢乳杆菌属(Sporolactobacillus)、鞘脂杆菌属(Pedobacter)、无色杆菌属(Achromobacter)。Bacillus会在含有大量淀粉的经济作物上生长[19],而阿氏芽孢杆菌(Bacillus aryabhattai)则是芽孢杆菌属中优势菌株中丰度最高的菌株(图3B),故考虑选择B. aryabhattai作为抑菌机理的研究菌株。B. aryabhattai分布较广,在我国主要存在于农田和森林中[31],其来源可能是红薯淀粉原料的污染。基于以上因素,本研究筛选出B. aryabhattai为指示菌进行H2O2的抑菌机理的研究。
2.3 H2O2对B. aryabhattai的抑菌效果
最小抑菌浓度是反映抗菌药物抑菌活性的重要指标[32]。不同浓度的H2O2作用于B. aryabhattai培养物的浑浊度如表3所示,当H2O2的浓度在250 μg/mL及以上时能完全抑制B. aryabhattai的生长,孔洞非常澄清,而浓度在125 μg/mL时,孔洞开始浑浊,并在之后更低的浓度保持着浑浊的孔洞。由于MIC测定是根据孔洞在18~24 h后的浑浊度决定的,所以根据表3结果可以判定250 μg/mL为H2O2的MIC。而在之后将1×MIC浓度及以上浓度的孔洞中的液体进行涂布计数,发现均没有菌落生长,故MIC浓度即为MBC浓度,即250 μg/mL是H2O2对B. aryabhattai的MIC的同时也是MBC,高于Cui等[33]关于H2O2对金黄色葡萄球菌和大肠杆菌的MIC分别是50 μg/mL和100 μg/mL的结论。B. aryabhattai本身可能具有较高的抗氧化应激的能力[20],故这可能是导致H2O2对B. aryabhattai的MIC高于金黄色葡萄球菌和大肠杆菌的原因。
表 3 不同浓度H2O2对B. aryabhattai的MICTable 3. MIC of different concentrations of H2O2 against B. aryabhattaiH2O2浓度(μg/mL) B. aryabhattai H2O2浓度(μg/mL) B. aryabhattai 1000.00 − 31.25 + 500.00 − 15.63 + 250.00 − 7.81 + 125.00 + 阳性对照 + 62.50 + 阴性对照 − 注:“−”培养基清澈,B. aryabhattai未生长;“+”B. aryabhattai生长正常,培养基浑浊;阳性对照组为含菌NB培养基,阴性对照组为无菌培养基。 抑菌剂在琼脂平板上会均匀扩散,从而抑制细菌的生长产生透明的圆圈,通过此来直观地体现H2O2的抑菌活性[34]。从表4中可以看出阴性对照组抑菌圈直径为0 mm,而经MIC浓度的H2O2处理的B. aryabhattai的抑菌圈直径为13.73±0.47 mm,呈中度敏感,且当H2O2浓度不断上升时,抑菌圈直径也随之增长(图4),说明H2O2的抑菌活性是随着浓度的上升而不断提高的,呈浓度依赖性,直到浓度为1000 μg/mL时B. aryabhattai高度敏感。而阳性对照氨苄青霉素组的浓度在0.25~1 mg/mL之间的抑菌圈直径均大于20 mm,呈高度敏感,透明圈的直径越大,则该抑菌剂对该菌株的抑制作用就越强[26],说明B. aryabhattai对氨苄青霉素更为敏感。产生这个结果有两个原因,一是因为研究表明革兰氏阳性菌对青霉素的敏感程度高于革兰氏阴性菌[35],二是因为芽孢杆菌属于过氧化氢酶阳性菌,过氧化氢酶阳性细菌释放的胞内过氧化氢酶催化了H2O2的水解[36],细菌产生的过氧化氢酶被认为是影响H2O2功效的最主要因素之一[7]。综上所述,H2O2对B. aryabhattai的抑菌效果是有效的。
表 4 不同浓度的H2O2及氨苄青霉素对B. aryabhattai的抑菌圈大小Table 4. IZD of different concentrations of H2O2 and ampicillin against B. aryabhattai菌株 H2O2浓度(μg/mL) IZD(mm) 氨苄青霉素浓度(μg/mL) IZD(mm) B. aryabhattai 0 0a 0 0A 250 13.73±0.47b 250 21.72±0.68B 500 18.53±0.44c 500 28.66±0.39C 1000 21.73±0.70d 1000 31.70±0.63D 注:IZD 表示抑菌圈直径;小写字母表示过氧化氢组各浓度之间的显著性差异(P<0.05),大写字母表示氨苄青霉素组各浓度之间的显著性差异(P<0.05)。 2.4 不同浓度H2O2对B. aryabhattai的生长曲线影响
生长曲线可用于展示微生物生长情况和新陈代谢规律,因此不同H2O2添加量下B. aryabhattai的生长曲线可反映其抑菌动力学[37]。为了初步了解H2O2对B. aryabhattai生长情况的影响,测定了该菌株24 h内的生长情况,结果如图5所示。未加H2O2的对照组在24 h内的生长遵循S型生长曲线,说明未被H2O2处理的B. aryabhattai的生长情况正常,其在大约4 h后进入对数生长期,14 h后开始进入细菌生长平稳期。从图5中可以看出在生长14 h时,对照组OD600 nm值分别是H2O2终浓度为1/4×MIC(62.5 μg/mL)和1/2×MIC(125 μg/mL)的OD600 nm值的2.75倍和8.68倍,说明细菌早期生长阶段被不同程度抑制,对数生长期延后,当生长达到稳定期时与对照组没有显著区别(P>0.05),说明低浓度H2O2的抑制作用主要作用于细菌的前期生长,从而推迟细菌快速生长的时间。然而,观察H2O2终浓度为1×MIC(250 μg/mL),2×MIC(500 μg/mL)和4×MIC(1000 μg/mL)的生长曲线可知,在当前H2O2浓度下的B. aryabhattai在24 h内没有生长,表明细菌的生长完全被抑制。
2.5 不同浓度H2O2对B. aryabhattai细胞壁及细胞膜的影响
AKP是一种存在于细胞壁、细胞膜之间的酶,细菌的细胞壁因物理或化学因素被破坏时,其就会通过破损的细胞壁泄露到外面[38],本研究通过检测AKP泄漏量来探索H2O2对B. aryabhattai细胞壁的破坏程度,AKP含量越高表明细胞壁被破坏的越严重。由图6A可知,对照组的AKP含量很低,泄漏量是可以忽略不计。与对照组相比,当实验组浓度为1×MIC、2×MIC时,B. aryabhattai胞外AKP活性显著增加(P<0.05),分别增加到1.75、3.56金氏单位/100 mL。实验组浓度为2×MIC时,B. aryabhattai胞外AKP活性显著大于1/2×MIC处理组1.27 金氏单位/100 mL(P<0.05),几乎是其的三倍。说明H2O2浓度越高,B. aryabhattai胞外AKP活性越大,这表明B. aryabhattai细胞壁的破坏程度与H2O2浓度呈正相关,且呈现浓度依赖性。已经有研究证明H2O2能够穿透细胞壁,导致细胞死亡[39]。基于以上结果可以得出结论,H2O2会增加细菌细胞壁的通透性,H2O2的抑菌机制有一部分是通过破坏B. aryabhattai的细胞壁实现的。
β-GAL在细胞内膜遭受损伤时,会外溢到细胞外,故可以用该酶的含量上的变化来推算细菌细胞膜的受损状况[40]。由图6B可知,经过8 h的作用后,β-GAL在对照组中的泄漏量依然很微小,而实验组(1/2×MIC、1×MIC、2×MIC组)上清液中β-GAL的含量均显著高于对照组(P<0.05),说明H2O2会影响B. aryabhattai内膜的完整性,可能是由于H2O2产生的羟基自由基会攻击膜中的多不饱和脂肪酸,并引发脂质过氧化[41]。同时,随着H2O2浓度的提升,β-GAL的泄漏量也在逐渐增大,说明B. aryabhattai的β-GAL的泄露对H2O2呈浓度依赖性。
2.6 胞内核酸、蛋白质外泄的测定
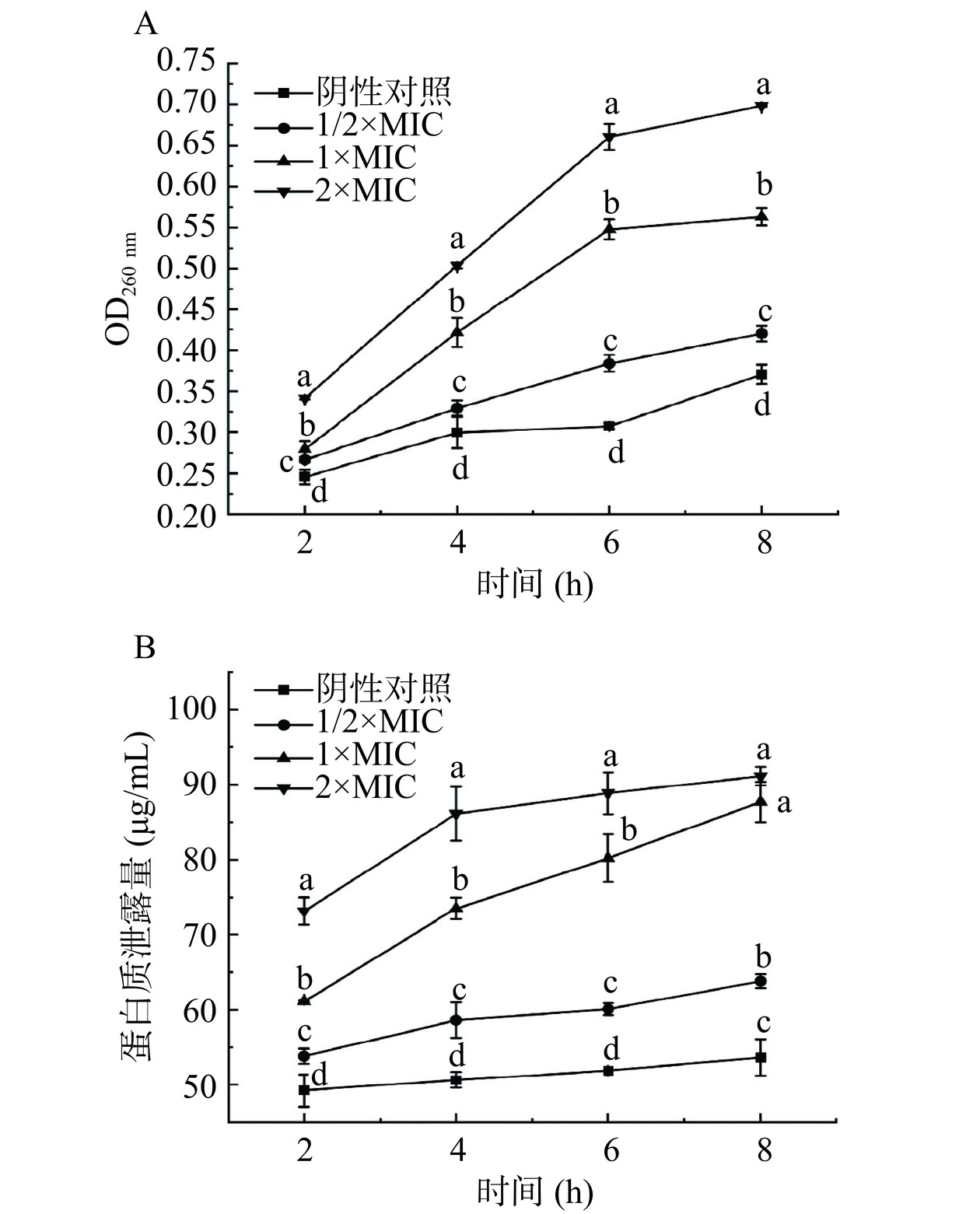
核酸和蛋白质是细菌细胞膜和细胞质中的基础物质,是重要的单元结构物质,菌体内核酸、蛋白质等内容物的泄露可反映细胞膜的完整性[42]。为了阐述H2O2对B. aryabhattai的抑制作用,研究了H2O2对B. aryabhattai的细胞膜通透性和完整性的影响。图7A为细胞内核酸泄漏到胞外的浓度变化情况,2 h时各处理组与对照组差异较小,说明细胞膜损伤不严重,核酸泄漏不明显。各处理组菌体在8 h内核酸泄漏量均随着时间的增长而不断增加,说明H2O2对细胞膜有持续的破坏作用(图7A)。核酸泄漏量也随着H2O2浓度的提升而显著增加(P<0.05),说明H2O2使细胞膜结构发生改变,增强其通透性,导致功能成分外泄,从而抑制菌体生长。
从图7B中可以看出,未添加H2O2的菌悬液中可溶性蛋白含量极低,且在8 h内维持在一个较低的水平,这些微量蛋白很可能是B. aryabhattai正常生理活动产生的外分泌蛋白[43],说明B. aryabhattai细胞膜在较长时间内具有良好的完整性,胞内蛋白没有发生明显的泄露。所有加入H2O2的实验组2 h后的胞外蛋白质含量均显著增加,与对照组相比差异显著(P<0.05),并且增加量与H2O2浓度呈浓度依赖性,随着浓度的增大而增加(图7B)。同时,由图7B可知,随着H2O2作用时间延长,细胞蛋白质泄露量增加,说明添加H2O2对B. aryabhattai的蛋白质泄漏量也呈时间依赖性。研究表明H2O2可能对细胞膜上的蛋白质发生选择性氧化,H2O2作用会导致产生羟基自由基的芬顿反应,从而使体内的DNA、蛋白质和膜脂氧化[44]。综上所述,H2O2可导致细胞内蛋白质和核酸的明显渗漏,破坏细胞结构,引起细胞功能紊乱。
2.7 不同浓度H2O2对B. aryabhattai的微观结构影响
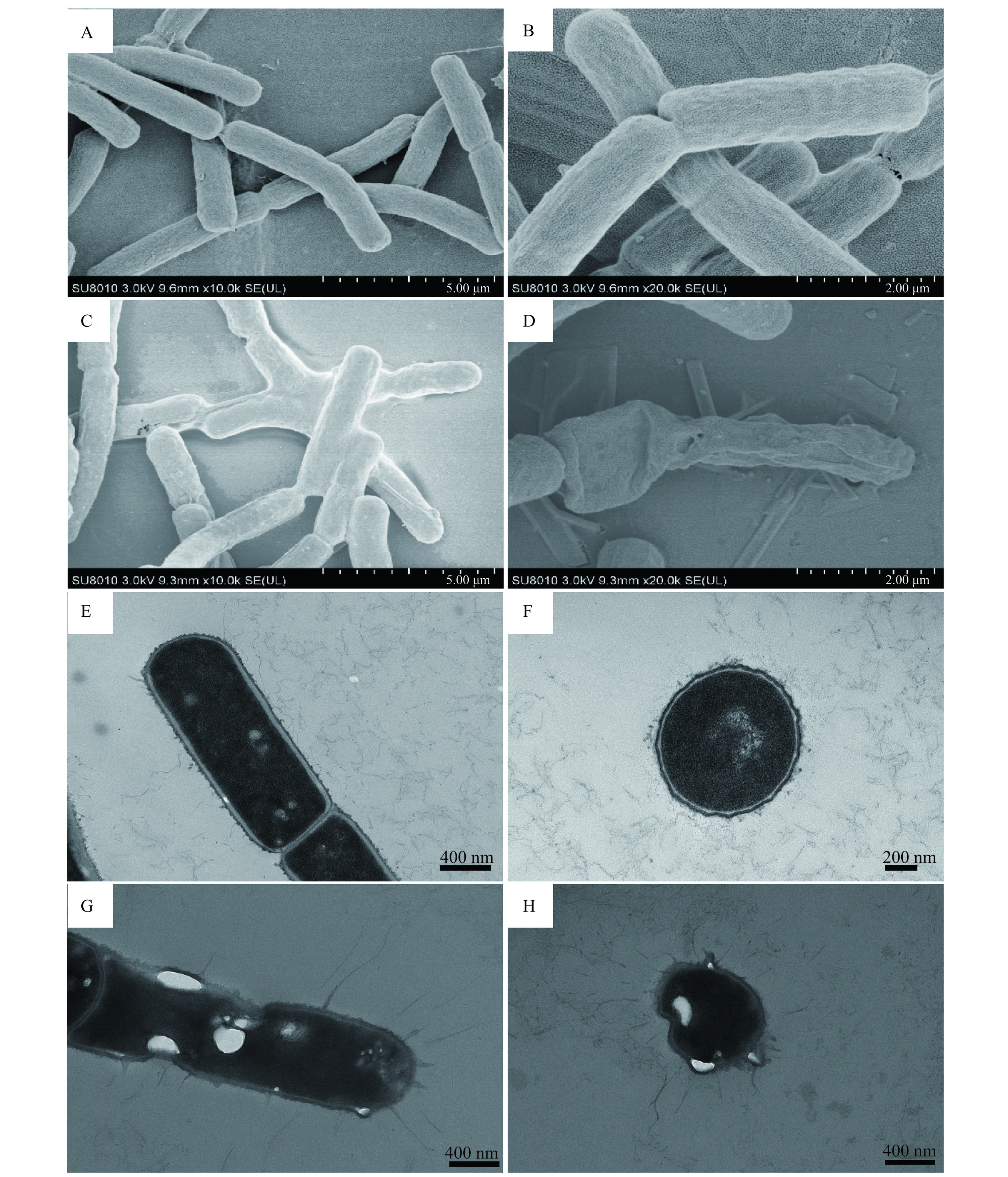
图8A~D是用扫描电镜拍摄的B. aryabhattai的细菌形态,从图8A、8B可以看出,对照组B. aryabhattai的菌体形态饱满正常,杆状结构清晰,边界光滑,细胞间无粘附,而在B. aryabhattai被1×MIC(250 μg/mL)的H2O2处理后菌体形态发生肉眼可见的异变,细胞完全变形,表面崎岖不平,边界不清晰且细胞相互粘附,细胞壁和细胞膜有所缺失(图8C)。再放大倍数至20000倍后(图8D)观察到了菌体表面塌陷破碎,部分出现孔洞,说明B. aryabhattai的完整度遭到了严重破坏。这与李靖[45]研究发现H2O2会导致大肠杆菌细胞壁暂时性孔隙样病变或塌陷的结论一致。总的来说,1×MIC(250 μg/mL)的H2O2通过破坏B. aryabhattai细胞壁、细胞膜结构,达到抑菌效果。
![]() 图 8 SEM和TEM观察B. aryabhattai形态及内部结构注:A、B:阴性对照下B. aryabhattai的外部形态(10000×、20000×);C、D:1×MIC H2O2处理4 h的B. aryabhattai外部形态(10000×、20000×);E、F:阴性对照下B. aryabhattai的内部结构(12000×、20000×);G、H:B. aryabhattai被H2O2处理4 h后的内部结构(15000×)。Figure 8. Morphology and internal structure of B. aryabhattai observed by SEM and TEM
图 8 SEM和TEM观察B. aryabhattai形态及内部结构注:A、B:阴性对照下B. aryabhattai的外部形态(10000×、20000×);C、D:1×MIC H2O2处理4 h的B. aryabhattai外部形态(10000×、20000×);E、F:阴性对照下B. aryabhattai的内部结构(12000×、20000×);G、H:B. aryabhattai被H2O2处理4 h后的内部结构(15000×)。Figure 8. Morphology and internal structure of B. aryabhattai observed by SEM and TEM采用透射电镜分别对0×MIC(0 μg/mL)和1×MIC(250 μg/mL)浓度的H2O2处理4 h的B. aryabhattai超薄切片进行观察。如图8E、8F所示,未经H2O2作用的B. aryabhattai细胞整体结构相对正常,切面结构清晰,胞质均匀;细胞壁完整,厚度均一;细胞膜结构正常,未见明显质壁分离,细胞未出现破损现象。而在1×MIC(250 μg/mL)H2O2处理4 h后,B. aryabhattai与外界环境的边界变得模糊;细胞壁完整,局部结构模糊,轻微凹陷厚薄不均匀;细胞膜结构模糊,局部明显质壁分离,形成较大的空洞;细胞质的分布不再均匀,部分细胞质与细胞膜出现分离现象(图8G、8H),可能是因为H2O2导致了物质泄露[46]。这表明1×MIC的H2O2可对B. aryabhattai的细胞壁、细胞膜造成一定破坏,并且导致细胞质内部形成较大空洞。
3. 结论
本研究对铺浆式生产的鲜湿粉条添加0.25‰、0.5‰、1‰的H2O2并贮藏90 d,发现所有H2O2组未发生腐败且无H2O2残留,其中0.5‰的H2O2鲜湿粉条没有产生裂纹和孔洞,且能适应工厂大生产的环境,达到保鲜要求。同时对对照组的腐败细菌进行高通量测序发现,芽孢杆菌属为优势属,B. aryabhattai是芽孢杆菌属中物种丰富度最高的菌种,故选用筛选出的B. aryabhattai为抑菌机理实验的指示菌进行H2O2抑菌实验。结果表明,H2O2对B. aryabhattai的最小抑菌浓度是250 μg/mL,且该浓度下,B. aryabhattai对H2O2呈中度敏感,生长曲线实验表明1×MIC的H2O2在24 h内能完全抑制住B. aryabhattai的生长。此外,H2O2能通过影响细胞壁、细胞膜的通透性,破坏膜蛋白,导致细胞结构损伤和蛋白质、核酸和各种酶(AKP、β-GAL)等功能成分的释放,这些变化均与H2O2呈浓度依赖性,且SEM和TEM观察发现在1×MIC的H2O2处理后细胞出现黏连、孔洞和质壁分离现象。因此,本研究表明H2O2可以作为鲜湿粉条中优势腐败菌B. aryabhattai的有效抑制剂,为其在鲜湿粉条的工厂大生产中的应用及绿色保鲜方面提供一定的理论基础。
-
图 8 SEM和TEM观察B. aryabhattai形态及内部结构
注:A、B:阴性对照下B. aryabhattai的外部形态(10000×、20000×);C、D:1×MIC H2O2处理4 h的B. aryabhattai外部形态(10000×、20000×);E、F:阴性对照下B. aryabhattai的内部结构(12000×、20000×);G、H:B. aryabhattai被H2O2处理4 h后的内部结构(15000×)。
Figure 8. Morphology and internal structure of B. aryabhattai observed by SEM and TEM
表 1 抑菌作用判断标准
Table 1 Antibacterial judgment criteria
抑菌圈直径 IZD(mm) 判定结果 ≤7 无抑菌作用 >7 有抑菌作用 7<IZD<10 钝敏 10<IZD<20 中敏 >20 高敏 表 2 不同浓度H2O2对鲜湿粉条储藏期内细菌生长的影响(lg CFU/g)及其残留量
Table 2 Effects of different concentrations of H2O2 on bacterial growth during the storage period of fresh and wet vermicelli ( lg CFU/g) and its residual levels
处理 贮藏时间(d) H2O2残留量(mg/kg) 3 90 CK 5.56±0.05 − <3 0.25‰ H2O2 <1 <1 <3 0.50‰ H2O2 <1 <1 <3 1.00‰ H2O2 <1 <1 <3 注:“<1”表明该次测定所统计样品中未检测到菌落;“−”表明超出测定范围,多不可计;“<3”依据GB 5009.226-2016的钛盐比色法的定量限为3 mg/kg。 表 3 不同浓度H2O2对B. aryabhattai的MIC
Table 3 MIC of different concentrations of H2O2 against B. aryabhattai
H2O2浓度(μg/mL) B. aryabhattai H2O2浓度(μg/mL) B. aryabhattai 1000.00 − 31.25 + 500.00 − 15.63 + 250.00 − 7.81 + 125.00 + 阳性对照 + 62.50 + 阴性对照 − 注:“−”培养基清澈,B. aryabhattai未生长;“+”B. aryabhattai生长正常,培养基浑浊;阳性对照组为含菌NB培养基,阴性对照组为无菌培养基。 表 4 不同浓度的H2O2及氨苄青霉素对B. aryabhattai的抑菌圈大小
Table 4 IZD of different concentrations of H2O2 and ampicillin against B. aryabhattai
菌株 H2O2浓度(μg/mL) IZD(mm) 氨苄青霉素浓度(μg/mL) IZD(mm) B. aryabhattai 0 0a 0 0A 250 13.73±0.47b 250 21.72±0.68B 500 18.53±0.44c 500 28.66±0.39C 1000 21.73±0.70d 1000 31.70±0.63D 注:IZD 表示抑菌圈直径;小写字母表示过氧化氢组各浓度之间的显著性差异(P<0.05),大写字母表示氨苄青霉素组各浓度之间的显著性差异(P<0.05)。 -
[1] FENG Y Y, MU T H, ZHANG M, et al. Effects of different polysaccharides and proteins on dough rheological properties, texture, structure and in vitro starch digestibility of wet sweet potato vermicelli[J]. International Journal of Biological Macromolecules,2020,148:1−10. doi: 10.1016/j.ijbiomac.2019.12.225
[2] XIE L H, TANG S Q, LUO J, et al. Physiochemical properties of rice starch for production of vermicelli with premium quality[J]. Journal of Food Science and Technology,2017,54:3928−3935. doi: 10.1007/s13197-017-2852-9
[3] CAI H L, YANG S, JIN L, et al. A cost-effective method for wet potato starch preservation based on hurdle technology[J]. LWT-Food Science and Technology,2020,121:108958. doi: 10.1016/j.lwt.2019.108958
[4] KUMAR M, SHIMPY, SAHDEV R K, et al. Natural convective greenhouse vermicelli drying:Thermo-environ-econo-kinetic analyses[J]. Sustainable Energy Technologies and Assessments,2023,55:103002. doi: 10.1016/j.seta.2022.103002
[5] YANG S, ZHANG M N, SHAN C S, et al. Evaluation of cooking performance, structural properties, storage stability and shelf life prediction of high-moisture wet starch noodles[J]. Food Chemistry,2021,357:129744. doi: 10.1016/j.foodchem.2021.129744
[6] YANG S, JIN L, XU X H, et al. Long-term storage and temperature induced quality changes of industrial-scale wet starch noodles[J]. LWT-Food Science and Technology,2022,153:112504. doi: 10.1016/j.lwt.2021.112504
[7] ABDELSHAFY A M, HU Q N, LUO Z S, et al. Hydrogen peroxide from traditional sanitizer to promising disinfection agent in food industry[J]. Food Reviews International,2023,33:2191690.
[8] 中华人民共和国国家卫生和计划生育委员会. GB 2760-2014 食品安全国家标准 食品添加剂使用标准[S]. 北京:中国标准出版社, 2014. [National Health and Family Planning Commission of the People's Republic of China. GB 2760-2014 National food safety standard, standard for the use of food additives[S]. Beijing:China Standard Press, 2014.] National Health and Family Planning Commission of the People's Republic of China. GB 2760-2014 National food safety standard, standard for the use of food additives[S]. Beijing: China Standard Press, 2014.
[9] 中华人民共和国国家卫生和计划生育委员会. GB 5009.226-2016 食品安全国家标准 食品中过氧化氢残留量的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission of the People's Republic of China. GB 5009.226-2016 National food safety standard, the determination of hydrogen peroxide residue in food[S]. Beijing:China Standard Press, 2016.] National Health and Family Planning Commission of the People's Republic of China. GB 5009.226-2016 National food safety standard, the determination of hydrogen peroxide residue in food[S]. Beijing: China Standard Press, 2016.
[10] MCEVOY B, ROWAN N J. Terminal sterilization of medical devices using vaporized hydrogen peroxide:A review of current methods and emerging opportunities[J]. Journal of Applied Microbiology,2019,127(5):1403−1420. doi: 10.1111/jam.14412
[11] BAYOUMI Y A. Improvement of postharvest keeping quality of white pepper fruits (Capsicum annuum, L.) by hydrogen peroxide treatment under storage conditions[J]. Acta Biologica Szegediensis,2008,52(1):7−15.
[12] KURE C F, LANGSRUD S, MORETRO T. Efficient reduction of food related mould spores on surfaces by hydrogen peroxide mist[J]. Foods,2021,10(1):55.
[13] BARBACCIA P, LIPOCELLI L, MOSCHETTI G, et al. Application of hydrogen peroxide to improve the microbiological stability of food ice produced in industrial facilities[J]. Applied Sciences-Basel,2022,12(1):210.
[14] WANG H O, LIU S H, ZHOU X J, et al. Treatment with hydrogen peroxide improves the physicochemical properties of dietary fibres from Chinese yam peel[J]. International Journal of Food Science and Technology,2020,55(3):1289−1297. doi: 10.1111/ijfs.14405
[15] MCEVOY B, EVELAND R. Vaporized hydrogen peroxide:A well-known technology with a new application[J]. Biomedical Instrumentation & Technology,2020,54(s1):74−79.
[16] BRUDZYNSKI K, ABUBAKER K, ST-MARTIN L, et al. Re-examining the role of hydrogen peroxide in bacteriostatic and bactericidal activities of honey[J]. Frontiers in Microbiology,2011,2(213):1−9.
[17] GREEN M C, DUBNICKA L J, DAVIS A C, et al. Thermodynamics and kinetics for the free radical oxygen protein oxidation pathway in a model for β-structured peptides[J]. Journal of Physical Chemistry A,2016,120(16):2493−2503. doi: 10.1021/acs.jpca.5b12549
[18] YANG S, SHAN C S, XU Y Q, et al. Dissimilarity in sensory attributes, shelf life and spoilage bacterial and fungal microbiota of industrial-scale wet starch noodles induced by different preservatives and temperature[J]. Food Research International,2021,140:109980. doi: 10.1016/j.foodres.2020.109980
[19] JANISZEWSKA D, ZLOCH M, POMASTOWSKI P, et al. Implications of sample preparation methods on the MALDI-TOF MS identification of spore-forming bacillus species from food samples:A closer look at Bacillus licheniformis, Peribacillus simplex, Lysinibacillus fusiformis, Bacillus flexus, and Bacillus marisflavi[J]. ACS Omega,2023,8(38):34982−34994. doi: 10.1021/acsomega.3c04354
[20] PARK Y G, MUN B G, KANG S M, et al. Bacillus aryabhattai SRB02 tolerates oxidative and nitrosative stress and promotes the growth of soybean by modulating the production of phytohormones[J]. PLOS ONE,2017,12(3):173203.
[21] 中华人民共和国国家卫生健康委员会国家市场监督管理总局. GB 4789.2-2022 食品安全国家标准 食品微生物学检验 菌落总数测定[S]. 北京:中国标准出版社, 2022. [National Health Commission of the People's Republic of China, State Administration for Market Regulation. GB 4789.2-2022 National food safety standard, food microbiology examination, determination of total colony count[S]. Beijing:China Standard Press, 2022.] National Health Commission of the People's Republic of China, State Administration for Market Regulation. GB 4789.2-2022 National food safety standard, food microbiology examination, determination of total colony count[S]. Beijing: China Standard Press, 2022.
[22] 中华人民共和国国家卫生和计划生育委员会. GB 2713-2015 食品安全国家标准 淀粉制品[S]. 北京:中国标准出版社, 2015. [National Health and Family Planning Commission of the People's Republic of China. GB 2713-2015 National food safety standard, starch products[S]. Beijing:China Standard Press, 2015.] National Health and Family Planning Commission of the People's Republic of China. GB 2713-2015 National food safety standard, starch products[S]. Beijing: China Standard Press, 2015.
[23] HE F, LI C, LIU L. Effect of continuous cropping of konjac (Amorphophallus konjac) on soil bacterial communities as evaluated by Illumina high-throughput sequencing[J]. Archives of Agronomy and Soil Science,2023,69(10):1878−1892. doi: 10.1080/03650340.2022.2124405
[24] CUI H, WU J, LI C, et al. Improving anti-listeria activity of cheese packaging via nanofiber containing nisin-loaded nanoparticles[J]. LWT-Food Science and Technology,2017,81:233−242. doi: 10.1016/j.lwt.2017.04.003
[25] CHEN Y N, LI H-L, HUANG J J, et al. Antimicrobial activities and mechanism of sturgeon spermary protein extracts against Escherichia coli[J]. Frontiers in Nutrition,2022,9:1021338. doi: 10.3389/fnut.2022.1021338
[26] FAN Y, LI J, REN X, et al. Preparation, characterization, bacteriostatic efficacy, and mechanism of zinc/selenium-loaded sodium humate[J]. Applied Microbiology and Biotechnology,2023,107(24):7417−7425. doi: 10.1007/s00253-023-12803-x
[27] 陈曦, 李欣翼, 陈发顺, 等. 5株解淀粉芽孢杆菌的益生特性及抑菌活性研究[J]. 中国畜牧兽医,2023,50(5):2082−2091. [CHEN X, LI X Y, CHEN F S, et al. Probiotic characteristics and antibacterial activity study of five strains of Amylolytic bacillus[J]. Chinese Animal Husbandry and Veterinary,2023,50(5):2082−2091.] CHEN X, LI X Y, CHEN F S, et al. Probiotic characteristics and antibacterial activity study of five strains of Amylolytic bacillus[J]. Chinese Animal Husbandry and Veterinary, 2023, 50(5): 2082−2091.
[28] 杨瑞冬, 李伯海, 王元弛, 等. Lactobacillus buchneri IMAU80233高密度发酵工艺优化[J]. 食品科学,2019,40(22):147−154. [YANG R D, LI B H, WANG Y C, et al. Optimization of high-density fermentation process for Lactobacillus buchneri IMAU80233[J]. Food Science,2019,40(22):147−154.] doi: 10.7506/spkx1002-6630-20181019-218 YANG R D, LI B H, WANG Y C, et al. Optimization of high-density fermentation process for Lactobacillus buchneri IMAU80233[J]. Food Science, 2019, 40(22): 147−154. doi: 10.7506/spkx1002-6630-20181019-218
[29] WIJESUNDARA N M, RUPASINGHE H P V. Bactericidal and anti-biofilm activity of ethanol extracts derived from selected medicinal plants against streptococcus pyogenes[J]. Molecules,2019,24(6):1165. doi: 10.3390/molecules24061165
[30] 何江燕. 紫菜鲜粉条贮藏过程中品质劣变规律研究及年产1500吨紫菜鲜粉条工厂设计[D]. 南京:南京农业大学, 2023. [HE J Y. Quality deterioration of wet Porphyra yezoensis vermicelli and factory design of 1500-ton annual production[D]. Nanjing:Nanjing Agricultural University, 2020.] HE J Y. Quality deterioration of wet Porphyra yezoensis vermicelli and factory design of 1500-ton annual production[D]. Nanjing: Nanjing Agricultural University, 2020.
[31] 吴昕尧. 阿氏芽孢杆菌(Bacillus aryabhatta )普鲁兰酶异源表达、酶学性质研究[D]. 昆明:昆明理工大学, 2022. [WU X Y. Heterologous expression and enzymatic properties study of prulansin from Bacillus aryabhattai[D]. Kunming:Kunming University of Science and Technology, 2022.] WU X Y. Heterologous expression and enzymatic properties study of prulansin from Bacillus aryabhattai[D]. Kunming: Kunming University of Science and Technology, 2022.
[32] YANG D, ZHU R, XU H X, et al. Antibacterial mechanism of taxifolin and its application in milk preservation[J]. Food Bioscience,2023,53:102811. doi: 10.1016/j.fbio.2023.102811
[33] CUI Y, OH Y J, LIM J, et al. AFM study of the differential inhibitory effects of the green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG) against Gram-positive and Gram-negative bacteria[J]. Food Microbiology,2012,29(1):80−87. doi: 10.1016/j.fm.2011.08.019
[34] ASHOKA G B, SHIVANNA M B. Metabolite profiling, in vitro and in silico assessment of antibacterial and anticancer activities of Alternaria alternata endophytic in Jatropha heynei[J]. Archives of Microbiology,2023,205(2):61. doi: 10.1007/s00203-022-03388-6
[35] SHUKLA A, KHAN E, TANDON P, et al. Study of vibrational spectra and hydrogen bonding network in dimeric and tetrameric model of ampicillin using DFT and AIM approach[J]. Journal of Molecular Structure,2017,1131:225−235. doi: 10.1016/j.molstruc.2016.11.057
[36] WU Y, JIANG S, FU Z. Employment of teicoplanin-coated magnetic particles for quantifying gram-positive bacteria via catalase-catalyzed hydrolysis reaction of H2O2[J]. Talanta,2020,211:120728. doi: 10.1016/j.talanta.2020.120728
[37] ZHOU Q, HU Z, DU L, et al. Inhibition of Enterococcus faecalis growth and cell membrane integrity by Perilla frutescens essential oil[J]. Foodborne Pathogens and Disease,2020,17(9):547−554. doi: 10.1089/fpd.2019.2771
[38] WANG F, WEI F, SONG C, et al. Dodartia orientalis L. essential oil exerts antibacterial activity by mechanisms of disrupting cell structure and resisting biofilm[J]. Industrial Crops and Products,2017,109:358−366. doi: 10.1016/j.indcrop.2017.08.058
[39] MILLS J, HORVATH K M, BRIGHTWELL G. Antimicrobial effect of different peroxyacetic acid and hydrogen peroxide formats against spores of Clostridium estertheticum[J]. Meat Science,2018,143:69−73. doi: 10.1016/j.meatsci.2018.04.020
[40] SHI C, CHE M, ZHANG X, et al. Antibacterial activity and mode of action of totarol against Staphylococcus aureus in carrot juice[J]. Journal of Food Science and Technology,2018,55:924−934. doi: 10.1007/s13197-017-3000-2
[41] LAPORTE A, LORTZ S, SCHAAL C, et al. Hydrogen peroxide permeability of cellular membranes in insulin-producing cells[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes,2020,1862(2):183096. doi: 10.1016/j.bbamem.2019.183096
[42] KOHANSKI M A, DWYER D J, COLLINS J J. How antibiotics kill bacteria:From targets to networks[J]. Nature Reviews Microbiology,2010,8(6):423−435. doi: 10.1038/nrmicro2333
[43] BERGER E, CRAMPTON M C, NXUMALO N P, et al. Extracellular secretion of a recombinant therapeutic peptide by Bacillus halodurans utilizing a modified flagellin type III secretion system[J]. Microbial Cell Factories,2011,10:62. doi: 10.1186/1475-2859-10-62
[44] SAMANTHA L S, LUCY O, KATIE L, et al. Heterogeneous Fenton’s-like catalyst potentiation of hydrogen peroxide disinfection:An investigation into mechanisms of action[J]. Journal of Applied Microbiology,2023,134(3):17.
[45] 李靖. EGCG消毒剂对枯草芽孢杆菌的抑制效果及作用机理研究[D]. 北京:北京建筑大学, 2023. [LI J. Study on the inhibitory effect and mechanism of EGCG disinfectant on Bacillus subtilis[D]. Beijing:Beijing University of Civil Engineering and Architecture, 2023.] LI J. Study on the inhibitory effect and mechanism of EGCG disinfectant on Bacillus subtilis[D]. Beijing: Beijing University of Civil Engineering and Architecture, 2023.
[46] LIN L, ZHANG X, ZHAO C, et al. Liposome containing nutmeg oil as the targeted preservative against Listeria monocytogenes in dumplings[J]. RSC Advances,2016,6(2):978−986. doi: 10.1039/C5RA22098J
-
期刊类型引用(3)
1. 樊洁,孙红男,张苗,木泰华. 高通量测序分析腐败湿粉条菌群结构及优势菌. 食品科技. 2025(01): 327-336 .  百度学术
百度学术
2. 唐基涛,帅良,廖玲燕,曲德智,殷菲胧,何妹英,刘云芬. α-熊果苷处理对采后龙眼果皮褐变及活性氧代谢的影响. 核农学报. 2025(04): 784-792 .  百度学术
百度学术
3. 周彦兵,贾鸿震,李维维,张晓雪,张小燕,洪宾,彭涛,张金虎. 定西真空包装宽粉(湿粉)中污染微生物分离鉴定及大蒜素对其抑菌作用研究. 现代食品. 2024(16): 160-163 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:

 下载:
下载:



