Research Progress of Fucoidan in Improving Obesity and Complications
-
摘要: 肥胖问题日益严重,伴随而来的肥胖并发症如血脂异常、非酒精性脂肪肝、氧化损伤、全身性炎症严重威胁着人类健康。褐藻多糖是从棕色海藻以及部分海洋无脊椎动物中提取的生物活性多糖,具有改善肥胖及其并发症等疾病的功效,逐渐成为当前的研究热点。本文举例介绍了当前国内外褐藻多糖在食品、药品和医学方面的部分应用,并讨论了当前的不足,为进一步研究褐藻多糖功效和开发新产品提供参考。Abstract: Obesity, a serious and growing issue, is associated with metabolic complications like dyslipidemia, non-alcoholic fatty liver disease, oxidative stress, and systemic inflammation. These complications pose a severe threat to human health. Fucoidan, a bioactive polysaccharide extracted from brown algae and certain marine invertebrates, holds the potential to ameliorate obesity and its associated diseases, thus becoming a current research hotspot. As a dietary supplement, fucoidan enhances obesity by modulating fat synthesis and breakdown, adipocyte differentiation and basal energy metabolism, as well as the abundance and beneficial bacteria ratio of intestinal microbiota. Additionally, fucoidan alleviates obesity-related diseases by reducing liver fat accumulation and lipotoxicity, lowering blood lipid levels and insulin resistance, promoting macrophage M1 to M2 polarization and the release of anti-inflammatory cytokines, and eliminating reactive oxygen species and lipid peroxidation products. This article presents some of the current applications of fucoidan in the food, medicine, and medical fields, and discusses the existing limitations, providing references for further research on fucoidan efficacy and new product development.
-
Keywords:
- fucoidan /
- seaweed /
- obesity /
- dietary supplement /
- complication
-
肥胖,是指体内脂肪积聚过多的状态。当身体长期保持肥胖状态,会显著增加其他疾病,包括非酒精性脂肪肝、血脂异常、2型糖尿病等的患病几率,使之成为肥胖的并发症,故肥胖症则被称为“万症之源”。根据世界卫生组织(WHO)的评定标准,体重指数(BMI)超过30被认为是肥胖,我国定义肥胖患者的BMI≥28。WHO在2022年的报告称,截止于2020年,全球有超过10亿人患有肥胖症,其中包括6.5亿成年人、3.4亿青少年和3900万儿童,而根据2020年《中国居民营养与慢性病状况报告》,肥胖患者在中国成年人中的比例更是超过了一半[1]。因此,肥胖问题已经成为21世纪世界卫生最严峻挑战之一。
褐藻多糖(Fucoidan)是一种水溶性的天然硫化物多糖,来源广泛,1913年首次从褐色海藻中被分离出来。但是直到最近二十年,褐藻多糖才成为研究热点。研究者通过总结前期的研究成果,逐步将褐藻多糖与人类疾病相联系,探究褐藻多糖对各种疾病的作用机理。到目前为止,越来越多的研究结果表明,褐藻多糖具有抗肥胖、抗病毒、抗氧化、增强神经保护等生物活性能力[2]。在抗肥胖及并发症方面,褐藻多糖能够通过调节脂质的合成与分解[3]和脂肪细胞的分化形成[4]来抑制肥胖,同样,褐藻多糖还能够调节肠道微生物[5]来影响机体的能量代谢、食欲、免疫系统以抑制肥胖。此外,褐藻多糖能够显著改善血脂异常、非酒精性脂肪肝病、炎症和氧化损伤等肥胖导致的并发症[6−8]。
因此,本文阐述了褐藻多糖改善肥胖及并发症的作用机制,并探讨了褐藻多糖在食品、制药、生物医学等行业的现代化应用,旨在为褐藻多糖改善肥胖及并发症等相关疾病等方面的应用提供理论参考。
1. 褐藻多糖的结构
褐藻多糖,也称岩藻多糖。我国褐藻产量丰富,约占世界总产值的80%,其广泛来源于各种棕色海藻如:墨角藻、马尾藻、石莼,以及部分海洋无脊椎动物如:海参、海胆等,是以L-岩藻糖为核心单体的聚合物,包含小比例的半乳糖,甘露糖,木糖和糖醛酸等糖残基[9−10]。褐藻多糖的化学成分和结构并不固定、非常复杂,它会因物种、年龄、地区、提取方式的不同而具有不同结构[11]。
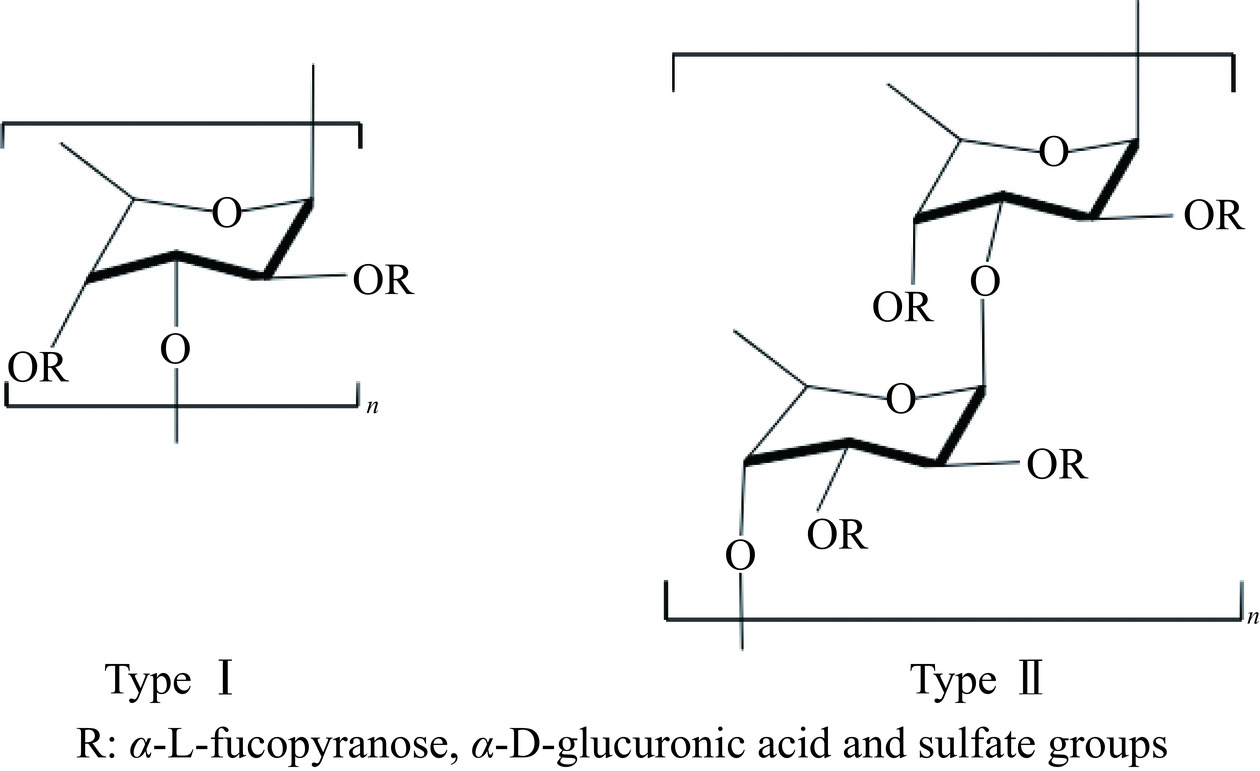
时至今日,虽然褐藻多糖没有通用的结构式,但是,研究人员总结出大部分褐藻多糖都适用的两种骨架模型[12],如图1所示:第一种是(1,3)-α-L-岩藻糖残基聚合物,第二种则是(1,3)-α-L-岩藻糖残基。并且,其骨架可以携带其他单糖,如糖醛酸、半乳糖、甘露糖和木糖等,导致褐藻多糖的结构和组成复杂多变,对疾病的作用机制繁多,并且疾病之间存在协同、拮抗的作用,构成一张繁杂的机制网络[13]。许多研究报告证明褐藻多糖具有显著的抗肥胖及并发症的功效[14−15],其具有的生物活性在食品、保健品、药品行业拥有潜在的应用基础[16]。
2. 褐藻多糖对肥胖的调节作用
肥胖作为脂肪积累过多形成的疾病,会造成机体代谢紊乱,显著增加其他疾病如非酒精性脂肪肝、三高、糖尿病、全身性炎症的患病风险。褐藻多糖作为一种活性多糖,已经被证实在调节肥胖中发挥显著的功效,如表1所示。褐藻多糖对肥胖的调节主要从脂肪、脂肪细胞以及肠道微生物三方面着手:研究发现不同来源的褐藻多糖长期干预均能显著改善体重和BMI指数,减轻对细胞的损伤程度[6−8,17−18]。其中,有研究表明褐藻多糖能够通过调控NF-κB和瘦素-脂联素等通路降低脂质的合成和促进其分解来减轻肥胖[7,18],还能通过调控过氧化物酶体增值受体-γ(PPAR-γ)等蛋白的表达来限制脂肪细胞的分化形成[6]。同时,作为膳食干预的手段,褐藻多糖对肠道微生物的调控十分显著,能够提高双歧杆菌、厚壁菌等有益菌和减低链球菌、幽门螺旋杆菌等有害菌的数量[17],以提升短链脂肪酸水平和维持肠道屏障稳态等方式改善肥胖[19]。
表 1 褐藻多糖调节肥胖和并发症的研究Table 1. Research on regulating obesity and complications by fucoidan来源 体系 研究条件 研究结果 参考文献 研究对象 剂量 持续时间 墨角藻 纳米乳液 SD大鼠 50 mg/kg 灌胃7周 改善体重和BMI指数,
降低肝酶含量[8] 海参 冻干粉 C57BL/6J小鼠 80 mg/kg 灌胃8周 抑制脂肪细胞分化,增加基础能量代谢,降低血脂水平 [6] C57BL/6J小鼠 60 mg/kg 灌胃16周 抑制脂肪细胞分化、巨噬细胞M1表型极化,减弱
炎症细胞因子的形成以及脂肪组织炎症浸润[7] 海带 低分子褐藻多糖粉末 C57BL/6J小鼠 0.6 mg/kg 自由喂养12周 降低血脂水平,改善葡萄糖耐量,提高有益菌的占比,
降低有害菌的数量[17] 马尾藻 低分子聚糖胶囊 脂肪肝患者;
C57BL/6J小鼠6 粒/d;
400 mg/kg24周;
灌胃16周降低血脂,改善了炎症和胰岛素抵抗,减少患者的
肝纤维化、肝脂毒性[18] 褐藻多糖粉末 ICR小鼠 200 mg/kg 灌胃8周 提高短链脂肪酸水平,抑制神经酰胺生物合成以
减轻胰岛素抵抗[19] 灌胃6周 逆转了肝脏氧化应激和Nrf2,抑制并清除ROS,
调控氧化平衡以改善小鼠的炎症[20] 2.1 褐藻多糖对体内脂肪的调节作用
造成肥胖的原因是在长期生活中,每日机体摄入的能量大于机体消耗的能量,调控机体能量代谢水平是一种潜在的治疗方式。而从微观上来看,体内脂肪,尤其是甘油三酯不断堆积,会造成机体超重以及脂肪层过厚。越来越多研究证明褐藻多糖能够通过调节体内脂肪的合成与分解,减少体内脂肪的堆积以发挥其抗肥胖作用[8,15,21]。
Oliveira等[22]从墨角藻中提取褐藻多糖对肥胖小鼠进行干预,研究表明其具有增强肾上腺素刺激的脂解作用,并能够一定程度地降低成脂关键蛋白(C/EBP-α、C/EBP-β和PPAR-γ)的表达来抑制脂肪的合成。同时,Lee等[23]和Sim等[24]研究发现褐藻多糖以剂量依赖性方式,显著提高了小鼠附睾脂肪组织(EAT)中的脂解蛋白(ATGL、p-HSL和p-ACC)水平,从而抑制脂质的积累。此外,还有研究表明褐藻多糖[7]能够通过抑制TLR4/NF-κB依赖性途径促进共培养的脂肪细胞进行脂解作用,提高脂肪分解效率。因此,褐藻多糖能够通过调节成脂和脂解蛋白以及关键通路来控制体内脂肪水平,发挥抗肥胖作用。
2.2 褐藻多糖对脂肪细胞的调节作用
肥胖往往伴随着脂肪组织量的增加,而脂肪组织量的增加包括脂肪细胞的变大和新脂肪细胞的分化形成[25]。长期摄入褐藻多糖,能够有效抑制脂肪细胞的生长和分化形成,导致脂肪组织量的减少从而抑制肥胖。其中,C/EBP和PPAR-γ是脂肪细胞形成、分化的关键蛋白,调控脂肪细胞分化过程中的复杂转录级联反应[26]。有研究表明褐藻多糖能够显著降低C/EBP和PPAR-γ蛋白的表达来抑制脂肪细胞分化[3,22,24]。此外,前文提到提高能量消耗是一种潜在的治疗肥胖的方式,研究发现长期摄入褐藻多糖,能够显著上调,介导调节产热质子的运输和参与机体的能量代谢[27]的解偶联蛋白UCP1和UCP3的表达,以提高脂肪细胞的产热,增加基础能量代谢水平,从而改善肥胖状况[3,28−29]。综上,褐藻多糖能够有效抑制脂肪细胞的生长与分化,并提高机体基础能量代谢发挥抗肥胖功效。
2.3 褐藻多糖对肠道微生物的调节作用
肠道微生物在人体肠道中起着非常重要的作用,能够发酵难以消化的食物成分,生成能源物质、维生素和其他必需微量营养素,比如把膳食植物多糖分解为单糖、短链脂肪酸(SCFAs)等,不仅为机体提供日常所需的营养物质,还能作为信号分子参与机体代谢调控[30]。肥胖会改变肠道微生物组群有益菌与有害菌的比例、导致菌群丰富度下降与肠道生态失调,从而导致代谢紊乱如高血脂、高血压、胰岛素抵抗等[31]。许多研究表明,褐藻多糖能够提高HFD诱导小鼠肠道菌群的多样性与丰富度[28,32],提高肠道生态的稳定性;并能提高拟杆菌、厚壁菌、双歧杆菌等有益菌的占比[17],还能降低链球菌、幽门螺旋杆菌等有害菌的数量[15,17,20];有益菌能通过降低肠道通透性[33]、调节重要脂肪生成调节因子的表达[34]以及降低NF-κB和IL-1β水平减少肠道炎症[35]等方式减轻体重;此外,褐藻多糖能够促进肠道微生物产生SCFAs[14],据研究SCFAS能通过增强生长素释放肽信号传导、释放胰岛素和瘦素等神经递质来影响饥饿与饱腹感[35]。
3. 褐藻多糖对肥胖并发症的调节作用
3.1 褐藻多糖对非酒精性脂肪肝的调节作用
非酒精性脂肪肝(NAFLD)是指在未受到酒精和病毒影响的条件下,单纯由以甘油三酯为主的脂质过度积累在肝脏中而导致的一系列疾病的统称[36]。它的发病过程是:当机体处于肥胖状态时,脂肪在肝脏中过度堆积,促使脂质毒性和氧化应激等[37]现象的产生,持续一段时间后会引起免疫细胞浸润从而导致炎症引发非酒精性脂肪性肝炎(NASH),在时间的推移下,肝脏损伤促进成纤维化细胞分化形成,导致机体进一步形成肝硬化、肝纤维化等病症[38]。
许多研究表明,摄入褐藻多糖能够有效改善HFD肥胖小鼠脂质的过度累积,和肝脏的损伤[29,32,39]。Oliyaei等[8]发现褐藻多糖能够抑制肝脏脂肪的积累,并通过观察病理学切片,证明褐藻多糖能够缓解NAFLD中肝细胞的膨胀变性。同时,Lee等[29]研究发现褐藻多糖能够改善作为衡量肝脏毒性和变性程度的丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的水平。此外,Shih等[18]将59名NAFLD患者随机分为两组,治疗组和安慰剂组。受试者每天服用褐藻多糖和褐藻素混合物(LMF-HSFx)或者是安慰剂,研究表明LMF-HSFx不仅能够减少NAFLD患者的肝脂毒性,还能通过减少促炎细胞因子(IL-6、INF-γ)水平来改善炎症以及进一步的肝纤维化。因此,褐藻多糖能够通过改善肝脏脂肪的累积、降低肝脏脂肪毒性和减少促炎因子来改善肝脏炎症等方面来调节NAFLD。
3.2 褐藻多糖对血糖、血脂和胰岛素抵抗的调节作用
肥胖能够降低机体对胰岛素的反应,促进促炎脂肪因子的释放,使机体逐渐形成胰岛素抵抗,并影响甘油三酯的合成与消耗,导致血糖、血脂含量异常,从而造成脂质代谢紊乱[40]。许多研究表明,褐藻多糖能够显著抑制异常血糖、脂多糖含量以及胰岛素抵抗指数(IR指数)[20,32],并降低HFD诱导小鼠跨膜受体(sCD36)、载脂蛋白(ApoB)水平,以及血液中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL)水平[7−8,23,29]。而对于高脂蛋白胆固醇,研究结果呈现出升高和降低两种趋势[32,41]。褐藻多糖还能够降低HFD诱导小鼠空腹胰岛素水平,提高胰岛素的敏感性,从而降低胰岛素抵抗。成纤维细胞生长因子-21(FGF-21)是一种分解代谢因子,调节脂质和能量代谢,脂联素则可以促进脂肪分解,增加能量消耗。马尾藻提取物褐藻多糖[23]通过增加FGF-21和脂联素的水平,提高机体对胰岛素的敏感度,同时降低血清胰岛素水平,改善高胰岛素血症。它还能显著增强脂肪组织中蛋白激酶AKT(Ser473)的磷酸化水平提高胰岛素信号传导,改善葡萄糖耐量和胰岛素敏感性[28]。此外,褐藻多糖也可以通过刺激代谢传感器sirtuin-1的过表达,激活蛋白激酶AMPK并减轻胰岛素抵抗[4]。
当研究联系到临床试验时,Sakai等[42]从门诊招募30名超重的2型糖尿病患者,分为2组:第1组每日服用60 mL(含有1620 mg褐藻糖胶)的测试饮料,持续12周,并在随后的12周期间,每日服用60 mL安慰剂;而第2组的服用顺序与第一组相反。结果表明患者在服用褐藻糖胶期间,大便频率增加、味觉敏感性增强以及胰高血糖素样肽-1的降低,证明褐藻糖胶对糖尿病的控制有一定积极作用。然而,Wright等[43]挑选符合肥胖但没有糖尿病的受试者,服用褐藻多糖,2 次/d,每次500 mg共90 d,研究对胰岛素抵抗和其他心脏代谢标志物的影响。结果显示褐藻多糖并没有显著影响胰岛素抵抗或其他测量的心脏代谢健康参数,说明褐藻多糖在临床上的作用机制值得进一步的研究。
3.3 褐藻多糖对炎症的调节作用
炎症是一种基本的防御机制,在发生机体损伤时触发,旨在根除损伤源并恢复组织功能[44]。当机体处于肥胖的状态时,它会通过各种机制持续引发炎症信号,最终导致各种慢性疾病[45]。比如,肥胖会促进巨噬细胞促炎表型M1的分化并分泌促炎细胞因子;肥胖还会导致肠道通透性增加,提高革兰氏阳性菌LPS水平,激活模式识别受体PRR启动炎症级联反应;肥胖伴随着脂肪组织扩张,造成细胞缺氧,进而诱导HIFI基因表达引发炎症等。
褐藻多糖能够降低促炎因子的分泌,下调炎症反应。研究表明,褐藻多糖能显著降低HFD诱导小鼠血清促炎细胞因子和趋化因子(CCL3、IL-2、IL-IF1、INF-γ等)的释放[39,46],并能降低炎性标志物cd68、Emr1的表达水平[47]。促炎因子的减少,会导致炎症信号减弱从而限制炎症反应。进一步深入研究发现,褐藻多糖提取物不仅能够降低炎性因子的分泌,还可以通过激活PPARγ信号通路,促进巨噬细胞M2表型极化,释放抗炎因子来限制炎症反应,减轻脂肪组织炎症浸润[7]。此外,TLR/NF-κB信号通路调节着巨噬细胞M1活化,有研究表明海参提取物-褐藻多糖[3]能够破坏TLR/NF-κB信号通路,促使巨噬细胞M2表型极化,抑制炎症基因表达。综上,褐藻多糖能够抑制TLR/NF-κB信号通路,激活PPAR-γ信号通路,促使巨噬细胞M1向M2型极化,并通过减少促炎脂肪因子的分泌,最终下调炎症反应。
3.4 褐藻多糖对氧化损伤的调节作用
肥胖能够诱发全身氧化应激,其生化机制多种多样,如线粒体损伤[48]、NOX活化、氧化磷酸化、餐后ROS生成等[49]。其中氧化应激会导致细胞功能异常或死亡,促进炎症相关基因的表达,增加炎性细胞因子的产生,并影响血管系统的稳态,进而对机体造成氧化损伤[50]。研究表明褐藻多糖能够有效地改善氧化应激导致的氧化损伤。Ahn等[51]利用褐藻多糖干预HFD诱导的肥胖沙鼠,研究发现褐藻多糖能够减轻CA1-3区中短暂性全面脑缺血(tGCI)诱导的神经元死亡,并能显著降低过氧化物MDA含量,增加抗氧化酶SOD活性和自由基DPPH清除能力。深入研究发现,褐藻多糖能够从三个途径来改善氧化损伤。首先是褐藻多糖能够通过与内皮细胞上的P-选择蛋白相互作用,适当调控巨噬细胞进入大脑的通路,防止机体炎症的产生,从而阻止氧化损伤[4]。其次,褐藻多糖能够上调sirtuin含量,用以抑制线粒体通透性过渡孔(mPTP)的开放来减少活性氧(ROS)过量产生,并通过刺激ATP合成恢复正常线粒体功能[52]。此外,褐藻多糖能够通过激活Nrf2通路,增强SOD和CAT的表达来清除ROS[20],还可以增加细胞内谷胱甘肽(GSH)的水平,从而消除脂质过氧化产物,如MDA和4-HNE修饰的蛋白[53]。
4. 褐藻多糖改善肥胖及并发症方面的产业化应用
随着多糖功能机制研究的深入以及相关技术的发展,褐藻多糖已经广泛地应用于食品、制药、医学等行业中。在食品行业中,褐藻多糖能够作为膳食补充剂添加到食品原料中,或者作为主要原料成分制成功能性食品,通过其本身的生物活性,在人类的营养与健康中发挥重要的作用。目前,市场上已经开发出不少声称具有降血糖、降血压、阻碍动脉硬化等功效的功能食品[54],对肥胖及并发症有着预防和改善作用。比如,在国内,有清幽乐植物饮品、褐藻植物饮品、岩藻宝压片糖果等产品,能够发挥调节肠道菌群、抗肥胖的作用[55];在国外,有许多天然褐藻多糖提取物产品(粉末或胶囊),经美国食品药品监督管理局通过,具有抗肥胖、抗氧化和增强免疫力等功效[56]。
同样,褐藻多糖在制药与生物医学行业有着广阔前景。比如:一种临床中药制剂-海藻复合物制剂,是由包括海藻的七种中草药制成的复合物制剂,具有抗肿瘤、免疫调节以及自由基清除能力[57]。国家中药二类新药海昆肾喜胶囊,其有效成分是海带中的褐藻多糖,被中国食品药品监管总局批准,应用于临床慢性肾功能衰竭的治疗等[58]。
此外,当褐藻多糖单独或者构成复合物合成纳米颗粒和复合水凝胶后,其显现出较原有生物活性如抗凝活性、自由基清除能力等更高的效果[59],参与烧伤愈合、伤口敷料和软骨形成[60]。而当褐藻多糖作为纳米药物递送载体,实现药物输送与目标靶向等目的时,其不仅能够提高药物利用率、充分发挥其功效,并且能够发挥褐藻多糖本身生物活性如抑菌活性、抗炎性等[61]。例如:Lai等[62]开发基于褐藻多糖制备的干细胞-纳米颗粒系统,通过双靶向递送,可以用于癌症的治疗。Jeon等[63]开发了一种基于岩藻多糖的复合物凝聚物,能够以持续的方式递送目标蛋白,以促进和稳定骨头的再生。
5. 结论与展望
褐藻多糖是一种功能丰富的生物活性物质,已经成为调节肥胖及并发症研究方向的研究热点。在抗肥胖方面,褐藻多糖能够通过调节体内脂肪的合成与分解,并提高脂肪分解效率来减少体内的脂肪。同时,褐藻多糖能够抑制脂肪细胞分化,并提高脂肪细胞中解偶联蛋白UCP1和UCP3的表达来提高机体基础能量代谢水平。此外,褐藻多糖能够从肠道菌群入手,提高肠道菌群的多样性与丰富度和提高肠道生态的稳定性、并通过提高有益菌的占比来降低肠道通透性、降低NF-κB和IL-1β水平减少肠道炎症等方式减轻体重,褐藻多糖还能够促进肠道微生物产生SCFAs来影响饥饿与饱腹感从中枢神经层面调控肥胖。
作为膳食补充剂,褐藻多糖还能对肥胖的并发症产生显著调节作用。褐藻多糖能够通过改善肝脏脂肪的累积、降低肝脏脂肪毒性和减少IL-6、INF-γ的分泌水平改善肝脏炎症来减少肝纤维化等方面来调节NAFLD。对于高脂血症,褐藻多糖能够降低血液中血脂水平,抑制脂质运输,还可以通过增加FGF-21、脂联素、Ser473磷酸化水平以及AMPK水平提高机体对胰岛素的敏感度,减轻胰岛素抵抗。而对于肥胖导致的炎症,褐藻多糖能够抑制TLR/NF-κB信号通路,激活PPAR-γ信号通路,促使巨噬细胞M1向M2型极化,并通过减少促炎脂肪因子的分泌,最终下调炎症反应。此外,褐藻多糖拥有显著的抗氧化损伤能力。首先,褐藻多糖能够通过与内皮细胞上的P-选择蛋白相互作用,调控巨噬细胞进入大脑,然后通过上调sirtuin含量,和激活Nrf2通路,来增强SOD和CAT的表达来清除ROS,最后还可以增加细胞内GSH的水平,消除脂质过氧化产物,如MDA和4-HNE修饰的蛋白。
然而,关于褐藻多糖,国内尚缺少结构与功能对应、剂量和喂养方式与功效对应的研究。同时,体内实验动物模型局限于高脂饮食诱导的动物模型,未来可以基于不同原理构建下丘脑摄食中枢损伤肥胖、遗传性肥胖、双侧卵巢切除肥胖雌鼠等模型,来研究褐藻多糖的功效,以丰富其作用机理。
褐藻多糖在食品、制药、生物医学行业有着广阔的应用,已经开发出如岩藻宝压片糖果、褐藻多糖提取物胶囊等功能食品、海昆肾喜等中西药等产品,或者经开发作为纳米聚合物材料参与再生医学治疗,药物输送以及组织工程等项目。但是,功能性食品种类不多、通过临床试验的药品数目稀少,纳米技术的应用比较局限,而实验动物并不能完全模拟人类肥胖状况。因此,仍需加大临床试验的比例,解决样本量少、研究方法与内容简单、研究结果不理想以及可信度低等问题,更加系统且深入地研究临床试验中褐藻多糖改善肥胖及并发症的机制与功效,将研究结论转化成成果。因此,褐藻多糖的开发具有广阔的前景。
-
表 1 褐藻多糖调节肥胖和并发症的研究
Table 1 Research on regulating obesity and complications by fucoidan
来源 体系 研究条件 研究结果 参考文献 研究对象 剂量 持续时间 墨角藻 纳米乳液 SD大鼠 50 mg/kg 灌胃7周 改善体重和BMI指数,
降低肝酶含量[8] 海参 冻干粉 C57BL/6J小鼠 80 mg/kg 灌胃8周 抑制脂肪细胞分化,增加基础能量代谢,降低血脂水平 [6] C57BL/6J小鼠 60 mg/kg 灌胃16周 抑制脂肪细胞分化、巨噬细胞M1表型极化,减弱
炎症细胞因子的形成以及脂肪组织炎症浸润[7] 海带 低分子褐藻多糖粉末 C57BL/6J小鼠 0.6 mg/kg 自由喂养12周 降低血脂水平,改善葡萄糖耐量,提高有益菌的占比,
降低有害菌的数量[17] 马尾藻 低分子聚糖胶囊 脂肪肝患者;
C57BL/6J小鼠6 粒/d;
400 mg/kg24周;
灌胃16周降低血脂,改善了炎症和胰岛素抵抗,减少患者的
肝纤维化、肝脂毒性[18] 褐藻多糖粉末 ICR小鼠 200 mg/kg 灌胃8周 提高短链脂肪酸水平,抑制神经酰胺生物合成以
减轻胰岛素抵抗[19] 灌胃6周 逆转了肝脏氧化应激和Nrf2,抑制并清除ROS,
调控氧化平衡以改善小鼠的炎症[20] -
[1] World Health Organization. Obesity and overweight[R]. Geneva:WHO, 2021.
[2] LI B, LU F, WEI X J, et al. Fucoidan:structure and bioactivity[J]. Molecules,2008,13(8):1671−1695. doi: 10.3390/molecules13081671
[3] LI S, LI M L, GUO R H, et al. Fucoidans from Pearsonothuria graeffei prevent obesity by regulating intestinal lipid metabolism and inflammation related signalling pathways[J]. Food Funct,2022,13(23):12234−12245. doi: 10.1039/D2FO02588D
[4] DIMITROVA-SHUMKOVSKA J, KRSTANOSKI L, VEENMAN L. Potential beneficial actions of fucoidan in brain and liver injury, disease, and intoxication-potential implication of sirtuins[J]. Mar Drugs,2020,18(5):242. doi: 10.3390/md18050242
[5] HUEBBE P, NIKOLAI S, SCHLOESSER A, et al. An extract from the Atlantic brown algae Saccorhiza polyschides counteracts diet-induced obesity in mice via a gut related multi-factorial mechanisms[J]. Oncotarget,2017,8(43):73501−73515. doi: 10.18632/oncotarget.18113
[6] LOSSO J N. The potential of dietary bioactive compounds against SARS-CoV-2 and COVID-19-induced endothelial dysfunction[J]. Molecules,2022,27(5):1623. doi: 10.3390/molecules27051623
[7] ZHU Y J, TIAN Y Y, WANG N, et al. Structure-function relationship analysis of fucoidan from sea cucumber (Holothuria tubulosa) on ameliorating metabolic inflammation[J]. J Food Biochem,2021,45(1):e13500.
[8] OLIYAEI N, TANIDEH N, MOOSAVI-NASAB M, et al. Development and characterization of a fucoidan-based nanoemulsion using Nigella sativa oil for improvement of anti-obesity activity of fucoxanthin in an obese rat model[J]. Int J Biol Macromol,2023(235):123867.
[9] JAYAWARDENA T U, NAGAHAWATTA D P, FERNANDO I P S, et al. A review on fucoidan structure, extraction techniques, and its role as an immunomodulatory agent[J]. Mar Drugs,2022,20(12):755. doi: 10.3390/md20120755
[10] ZHANG X M, WEI Z H, XUE C H. Physicochemical properties of fucoidan and its applications as building blocks of nutraceutical delivery systems[J]. Crit Rev Food Sci Nutr,2022,62(32):8935−8953. doi: 10.1080/10408398.2021.1937042
[11] ZAYED A, EL-AASR M, IBRAHIM A S, et al. Fucoidan characterization:determination of purity and physicochemical and chemical properties[J]. Mar Drugs,2020,18(11):571. doi: 10.3390/md18110571
[12] ANISHA G S, PADMAKUMARI S, PATEL A K, et al. Fucoidan from marine Macroalgae:Biological actions and applications in regenerative medicine, drug delivery systems and food industry[J]. Bioengineering (Basel),2022,9(9):472. doi: 10.3390/bioengineering9090472
[13] PRADHAN B, PATRA S, NAYAK R, et al. Multifunctional role of fucoidan, sulfated polysaccharides in human health and disease:A journey under the sea in pursuit of potent therapeutic agents[J]. Int J Biol Macromol,2020,164:4263−4278. doi: 10.1016/j.ijbiomac.2020.09.019
[14] SUN T, XUE M L, YANG J, et al. Metabolic regulation mechanism of fucoidan via intestinal microecology in diseases[J]. J Sci Food Agric,2021,101(11):4456−4463. doi: 10.1002/jsfa.11202
[15] YANG Z Z, WANG H Y, LIU N, et al. Algal polysaccharides and derivatives as potential therapeutics for obesity and related metabolic diseases[J]. Food Funct,2022,13(22):11387−11409. doi: 10.1039/D2FO02185D
[16] TAVARES J O, COTAS J, VALADO A, et al. Algae food products as a healthcare solution[J]. Mar Drugs,2023,21(11):578. doi: 10.3390/md21110578
[17] WEI B, ZHANG B, DU A Q, et al. Saccharina japonica fucan suppresses high fat diet-induced obesity and enriches fucoidan-degrading gut bacteria[J]. Carbohydrate polymers,2022,290:119411. doi: 10.1016/j.carbpol.2022.119411
[18] SHIH P H, SHIUE S J, CHEN C N, et al. Fucoidan and fucoxanthin attenuate hepatic steatosis and inflammation of NAFLD through modulation of Leptin/Adiponectin Axis[J]. Mar Drugs,2021,19(3):148. doi: 10.3390/md19030148
[19] ZHANG Y, LIU J, MAO G X, et al. Sargassum fusiforme fucoidan alleviates diet-induced insulin resistance by inhibiting colon-derived ceramide biosynthesis[J]. Food Funct,2021,12(18):8440−8453. doi: 10.1039/D1FO01272J
[20] ZHANG Y, ZUO J H, YAN L P, et al. Sargassum fusiforme Fucoidan alleviates High-Fat Diet-Induced obesity and insulin resistance associated with the improvement of hepatic oxidative stress and gut microbiota profile[J]. J Agric Food Chem,2020,68(39):10626−10638. doi: 10.1021/acs.jafc.0c02555
[21] ZHANG X Q, YOU Y, WANG L L, et al. Anti-obesity effects of Laminaria japonica fucoidan in high-fat diet-fed mice vary with the gut microbiota structure[J]. Food Funct,2022,13(11):6259−6270. doi: 10.1039/D2FO00480A
[22] OLIVEIRA R M, CâMARA R B G, MONTE J F S, et al. Commercial fucoidans from fucus vesiculosus can be grouped into antiadipogenic and adipogenic agents[J]. Mar Drugs,2018,16(6):193. doi: 10.3390/md16060193
[23] LEE H G, JEON Y J, KANG M C. Fucoidan from Sargassum thunbergii obtained via step gradient ethanol precipitation indicate potential anti-obesity and anti-hepatic steatosis in vitro 3T3-L1 and HepG2 cells and in vivo high-fat diet-induced obesity mice[J]. Food Chem Toxicol,2023,174:113686. doi: 10.1016/j.fct.2023.113686
[24] SIM S Y, SHIN Y E, KIM H K. Fucoidan from Undaria pinnatifida has anti-diabetic effects by stimulation of glucose uptake and reduction of basal lipolysis in 3T3-L1 adipocytes[J]. Nutr Res,2019,65:54−62. doi: 10.1016/j.nutres.2019.02.002
[25] GHABEN A L, SCHERER P E. Adipogenesis and metabolic health[J]. Nat Rev Mol Cell Biol,2019,20(4):242−258. doi: 10.1038/s41580-018-0093-z
[26] GREGOIRE F M, SMAS C M, SUL H S. Understanding adipocyte differentiation[J]. Physiol Rev,1998,78(3):783−809. doi: 10.1152/physrev.1998.78.3.783
[27] KRAUSS S, ZHANG C Y, LOWELL B B. The mitochondrial uncoupling-protein homologues[J]. Nat Rev Mol Cell Biol,2005,6(3):248−261. doi: 10.1038/nrm1592
[28] ZUO J H, ZHANG Y, WU Y, et al. Sargassum fusiforme fucoidan ameliorates diet-induced obesity through enhancing thermogenesis of adipose tissues and modulating gut microbiota[J]. Int J Biol Macromol,2022,216:728−740. doi: 10.1016/j.ijbiomac.2022.07.184
[29] LEE H G, JAYAWARDENA T U, SONG K M, et al. Dietary fucoidan from a brown marine algae (Ecklonia cava) attenuates lipid accumulation in differentiated 3T3-L1 cells and alleviates high-fat diet-induced obesity in mice[J]. Food Chem Toxicol,2022,162:112862. doi: 10.1016/j.fct.2022.112862
[30] GÉRARD P. Gut microbiota and obesity[J]. Cell Mol Life Sci,2016,73(1):147−162. doi: 10.1007/s00018-015-2061-5
[31] DEVOS W M, TILG H, VANHUL M, et al. Gut microbiome and health:mechanistic insights[J]. Gut,2022,71(5):1020−1032. doi: 10.1136/gutjnl-2021-326789
[32] HUANG J L, HUANG J, LI Y, et al. Fucoidan protects against high-fat diet-induced obesity and modulates gut microbiota in institute of cancer research mice[J]. J Med Food,2021,24(10):1058−1067. doi: 10.1089/jmf.2021.K.0030
[33] CHELAKKOT C, CHOI Y, KIM D K, et al. Akkermansia muciniphila-derived extracellular vesicles influence gut permeability through the regulation of tight junctions[J]. Exp Mol Med,2018,50(2):e450. doi: 10.1038/emm.2017.282
[34] MOYA-PÉREZ A, ROMO-VAQUERO M, TOMÁS-BARBERÁN F, et al. Hepatic molecular responses to Bifidobacterium pseudocatenulatum CECT 7765 in a mouse model of diet-induced obesity[J]. Nutr Metab Cardiovasc Dis,2014,24(1):57−64. doi: 10.1016/j.numecd.2013.04.011
[35] LIM S M, KIM D H. Bifidobacterium adolescentis IM38 ameliorates high-fat diet-induced colitis in mice by inhibiting NF-κB activation and lipopolysaccharide production by gut microbiota[J]. Nutr Res,2017,41:86−96. doi: 10.1016/j.nutres.2017.04.003
[36] 王祎. STEAP4介导NAMPT对肥胖型非酒精性脂肪肝引起的氧化应激的调节机制[D]. 华中农业大学, 2023. [WANG W. Regulatory mechanism of STEAP4 mediated NAMPT on oxidative stress induced by obese non-alcoholic fatty liver disease[D]. Huazhong Agricultural University, 2023.] WANG W. Regulatory mechanism of STEAP4 mediated NAMPT on oxidative stress induced by obese non-alcoholic fatty liver disease[D]. Huazhong Agricultural University, 2023.
[37] TAMAKI N, IMAJO K, SHARPTON S R, et al. Two-step strategy, FIB-4 followed by magnetic resonance elastography, for detecting advanced fibrosis in NAFLD[J]. Clin Gastroenterol Hepatol, 2023, 21(2):380−387. e383.
[38] POLYZOS S A, KOUNTOURAS J, MANTZOROS C S. Obesity and nonalcoholic fatty liver disease:From pathophysiology to therapeutics[J]. Metabolism,2019,92:82−97. doi: 10.1016/j.metabol.2018.11.014
[39] URASAKI Y, LE T T. Functional complementation of anti-adipogenic phytonutrients for obesity prevention and management[J]. Nutrients,2022,14(20):4325. doi: 10.3390/nu14204325
[40] VEKIC J, ZELJKOVIC A, STEFANOVIC A, et al. Obesity and dyslipidemia[J]. Metabolism,2019,92:71−81. doi: 10.1016/j.metabol.2018.11.005
[41] SUDIRMAN S, ONG A D, CHANG H W, et al. Effect of fucoidan on anterior cruciate Ligament transection and medial meniscectomy induced osteoarthritis in high-fat diet-induced obese rats[J]. Nutrients,2018,10(6):686. doi: 10.3390/nu10060686
[42] SAKAI C, ABE S, KOUZUKI M, et al. A randomized placebo-controlled trial of an oral preparation of high molecular weight Fucoidan in patients with type 2 diabetes with evaluation of taste sensitivity[J]. Yonago Acta Med,2019,62(1):14−23. doi: 10.33160/yam.2019.03.003
[43] WRIGHT C M, BEZABHE W, FITTON J H, et al. Effect of a Fucoidan extract on insulin resistance and cardiometabolic markers in obese, nondiabetic subjects:A randomized, controlled trial[J]. J Altern Complement Med,2019,25(3):346−352. doi: 10.1089/acm.2018.0189
[44] LEUTI A, FAZIO D, FAVA M, et al. Bioactive lipids, inflammation and chronic diseases[J]. Adv Drug Deliv Rev,2020,159:133−169. doi: 10.1016/j.addr.2020.06.028
[45] SALTIEL A R, OLEFSKY J M. Inflammatory mechanisms linking obesity and metabolic disease[J]. J Clin Invest,2017,127(1):1−4. doi: 10.1172/JCI92035
[46] SANJEEWA K K A, HERATH K, YANG H W, et al. Anti-inflammatory mechanisms of Fucoidans to treat inflammatory diseases:A review[J]. Mar Drugs,2021,19(12):678. doi: 10.3390/md19120678
[47] WANG L, ZHANG K, DING X, et al. Fucoidan antagonizes diet-induced obesity and inflammation in mice[J]. J Biomed Res,2020,35(3):197−205.
[48] ACÍN-PÉREZ R, IBORRA S, MARTÍ-MATEOS Y, et al. Fgr kinase is required for proinflammatory macrophage activation during diet-induced obesity[J]. Nat Metab,2020,2(9):974−988. doi: 10.1038/s42255-020-00273-8
[49] MANNA P, JAIN S K. Obesity, oxidative stress, adipose tissue dysfunction, and the associated health risks:Causes and therapeutic strategies[J]. Metab Syndr Relat Disord,2015,13(10):423−444. doi: 10.1089/met.2015.0095
[50] MCGARRY T, BINIECKA M, VEALE D J, et al. Hypoxia, oxidative stress and inflammation[J]. Free Radic Biol Med,2018,125:15−24. doi: 10.1016/j.freeradbiomed.2018.03.042
[51] AHN J H, SHIN M C, KIM D W, et al. Antioxidant properties of Fucoidan alleviate acceleration and exacerbation of hippocampal neuronal death following transient global cerebral ischemia in High-Fat Diet-Induced obese gerbils[J]. Int J Mol Sci,2019,20(3):554. doi: 10.3390/ijms20030554
[52] ONYANGO P, CELIC I, MCCAFFERY J M, et al. SIRT3, a human SIR2 homologue, is an NAD-dependent deacetylase localized to mitochondria[J]. Proc Natl Acad Sci USA,2002,99(21):13653−13658. doi: 10.1073/pnas.222538099
[53] WANG Y Q, WEI J G, TU M J, et al. Fucoidan alleviates acetaminophen-induced hepatotoxicity via oxidative stress inhibition and Nrf2 translocation[J]. Int J Mol Sci,2018,19(12):4050. doi: 10.3390/ijms19124050
[54] ZHAO Y, ZHENG Y Z, WANG J, et al. Fucoidan extracted from Undaria pinnatifida:Source for Nutraceuticals/Functional foods[J]. Mar Drugs,2018,16(9):321. doi: 10.3390/md16090321
[55] 明月海藻集团. 海藻+健康食品[EB/OL]. (2019-10-19) [2023-10-11]. http://bmscn.com/seaweed1. [Mingyue Seaweed Group. Seaweed+Health Food[EB/OL]. (2019-10-19) [2023-10-11]. http://bmscn.com/seaweed1.] Mingyue Seaweed Group. Seaweed+Health Food[EB/OL]. (2019-10-19) [2023-10-11]. http://bmscn.com/seaweed1.
[56] AMAZON. Diet & sports nutrition[EB/OL]. (2020-4-8) [2023-10-12]. https://www.amazon.com/Fucoidan/s?k=Fucoidan&rh=n%3A3764441&dc&ds=v1%3ARlLngqE0iffiZ8%2BG6Ld4HTiA5F3YyXH87ZjmlYwILGM&qid=1707801593&rnid=2941120011&ref=sr_nr_n_5.
[57] SALEHI B, SHARIFI-RAD J, SECA A M L, et al. Current trends on seaweeds:Looking at chemical composition, phytopharmacology, and cosmetic applications[J]. Molecules,2019,24(22):4182. doi: 10.3390/molecules24224182
[58] WANG J, GENG L H, YUE Y, et al. Use of Fucoidan to treat renal diseases:A review of 15 years of clinic studies[J]. Prog Mol Biol Transl Sci,2019,163:95−111.
[59] ETMAN S M, ELNAGGAR Y S R, ABDALLAH O Y. "Fucoidan, a natural biopolymer in cancer combating:From edible algae to nanocarrier tailoring"[J]. Int J Biol Macromol,2020,147:799−808. doi: 10.1016/j.ijbiomac.2019.11.191
[60] IQBAL M W, RIAZ T, MAHMOOD S, et al. Fucoidan-based nanomaterial and its multifunctional role for pharmaceutical and biomedical applications[J]. Crit Rev Food Sci Nutr,2024,64(2):354−380. doi: 10.1080/10408398.2022.2106182
[61] CITKOWSKA A, SZEKALSKA M, WINNICKA K. Possibilities of Fucoidan utilization in the development of pharmaceutical dosage forms[J]. Mar Drugs,2019,17(8):458. doi: 10.3390/md17080458
[62] LAI Y H, SU C Y, CHENG H W, et al. Stem cell-nanomedicine system as a theranostic bio-gadolinium agent for targeted neutron capture cancer therapy[J]. Nature Communications,2023,14(1):285. doi: 10.1038/s41467-023-35935-0
[63] JEON E Y, UM S H, PARK J, et al. Precisely localized bone regeneration mediated by marine-derived microdroplets with superior BMP-2 binding affinity[J]. Small (Weinheim an der Bergstrasse, Germany),2022,18(24):e2200416. doi: 10.1002/smll.202200416





 下载:
下载:
 下载:
下载:



