Effect of Heat Moisture Treatment on the Rheological, in Vitro Digestive Properties and Structure of Quinoa Starch
-
摘要: 湿热处理因其安全、绿色、环保、高效的特点被广泛应用于淀粉的改性。本研究采用不同含水量的湿热处理(分别为20%、25%和30%,处理温度为120 ℃,处理时间为10 h)对藜麦淀粉进行改性并对其流变性质、体外消化性质和结构进行了测定。结果表明:所有样品均为剪切变稀型非牛顿流体,湿热处理后藜麦淀粉的表观粘度均显著降低,且随着湿热处理含水量的增加而降低。频率扫描实验结果表明随着湿热处理含水量的增加,藜麦淀粉的储能模量G'呈不断降低趋势,而损耗模量G''和损耗因子呈不断增加的趋势。触变实验表明,随着湿热处理含水量的增加样品的触变环面积不断降低。体外消化结果表明,湿热处理能够显著降低藜麦淀粉中的快速消化淀粉含量(P<0.05),且藜麦淀粉中的慢性消化淀粉含量随着湿热处理含水量的增加而显著增加(P<0.05)。在30%含水量下,湿热处理后淀粉所含慢性消化淀粉含量最高,为24.93%,相较原淀粉提高了31.42%。X-衍射结果表明湿热处理后藜麦淀粉的晶型未发生变化,均为A型结晶,但处理后淀粉的相对结晶度显著降低(P<0.05)。傅里叶红外结果表明湿热处理会降低淀粉的整体有序性,但会增加藜麦淀粉中双螺旋结构含量。扫描电镜下观察到相较于原淀粉,改性后的藜麦淀粉出现粘结团聚,部分颗粒表面会出现部分塌陷的现象。本研究结果表明,湿热处理能够显著改变藜麦淀粉的流变学性质,提高藜麦淀粉的慢消化淀粉含量。淀粉的含水量是影响湿热处理改性效果的主要因素。相关结果将为藜麦淀粉的应用提供理论依据。Abstract: Heat moisture treatment (HMT) is a widely used method for starch modification due to its safe, green, environmentally friendly, and efficient characteristics. In this study, quinoa starch was modified by HMT with varying moisture contents (20%, 25%, and 30%) at a temperature of 120 °C for 10 hours, and its rheological properties, in vitro digestive properties, and structure were further evaluated. The steady rheology results indicated that all the samples were shear-thinning non-Newtonian fluids. After undergoing HMT, the apparent viscosity of quinoa starch decreased significantly. Additionally, the samples' apparent viscosity decreased as the moisture content of HMT increased. The results of frequency sweep showed that the storage modulus G' of quinoa starch decreased with the increase of moisture content of HMT, while the loss modulus G'', and loss factor increased with the increase of moisture content of HMT. The thixotropic results showed that the thixotropic ring area of quinoa starch decreased with the increase of the moisture content of HMT. Additionally, the results of in vitro digestion showed that the content of rapidly digestible starch in quinoa starch decreased significantly after HMT (P<0.05), while the content of slowly digestible starch (SDS) in modified quinoa starch increased significantly with the increase of moisture content of HMT (P<0.05). Notably, at a moisture content of 30%, the highest content of SDS in the modified starch was 24.93%, which was 31.42% higher than that of the native starch. XRD results indicated that the crystal form of quinoa starch remained unchanged after HMT, with all crystals being A-type. However, the relative crystallinity of quinoa starch decreased significantly after HMT (P<0.05). The Fourier transform infrared spectroscopy results showed that the overall order of quinoa starch decreased, while the content of double helix structure in quinoa starch increased after HMT. SEM observations revealed that the modified quinoa starch tended to agglomerate, and some of the particle surfaces collapsed compared to native quinoa starch. The study results suggested that HMT could significantly alter the rheological properties of quinoa starch and increase its SDS content. The study found that the modification effect was primarily affected by the moisture content of the starch. These findings provided a theoretical basis for the application of quinoa starch.
-
淀粉是一种广泛存在于自然界中的半结晶均质多糖,由直链淀粉和支链淀粉构成,是人类的主要供能物质。淀粉在食品、生物医药、农业纺织业等多个领域有广泛的应用。然而天然淀粉存在诸多缺点例如冻融稳定性差、难溶于水、易老化等,因此难以满足食品加工工业上的需求。为了克服天然淀粉的这些缺点,满足不同食品加工的需求,各种淀粉改性研究被广泛开展。根据改性方法原理的不同,淀粉的改性方法可以分为物理改性、化学改性、生物改性三种以及三者的组合形式即复合改性[1]。其中物理改性因其天然、高效、绿色、安全的特点被广泛使用[2]。湿热处理(Heat moisture treatment,HMT)是在高于淀粉糊化温度,但淀粉含水量不足以导致淀粉糊化的条件下对淀粉进行处理的一种改性方式。该方法具有操作简单、安全、高效的特点,已被广泛应用于各类淀粉的改性研究中。研究表明湿热处理能够通过重新排列晶体和双螺旋结构来改变淀粉的结构,例如结晶结构、双螺旋比例、长短程结构、微观样貌等,进而显著影响淀粉的理化性质如糊化性质、冻融稳定性、流变学性质等,以及淀粉的消化性质等。因此,在食品工业中有广泛的应用,例如罐头和冷冻食品工业、面条制造等领域[3−5]。
藜麦(Chenopodium quinoa Willd.),属一年生苋科藜属双子叶草本植物,具有高营养、高生物活性特点,被联合国粮食及农业组织誉为21世纪粮食安全和人类营养最具前途的作物之一,具有“超级谷物”和“全营养食品”美誉[6−8]。藜麦淀粉是藜麦中含量最高的组分,占藜麦干重50%以上,藜麦淀粉具有高水溶性指数、高溶胀力、耐老化的特点,且这些性质要优于传统的谷类淀粉[9]。藜麦淀粉的理化性质对于藜麦粉和藜麦淀粉制品的品质有着重要的影响,因此藜麦淀粉的性质对于藜麦的营养功能及加工特性有重要作用[10]。目前关于藜麦淀粉的物理改性已报道手段有湿热处理、干热处理、高静水压处理[11−12]等,其中关于藜麦淀粉湿热处理的研究相对较少。湿热处理条件是影响湿热改性效果的重要因素,主要包括湿热处理温度、淀粉含水量、湿热处理次数。Almeida等[13]研究20%含水量110 ℃下处理1~3 h对藜麦淀粉的改性研究,结果表明处理3 h条件下对藜麦淀粉的热力学性质、结构和微观样貌改变最为明显。Liu等[14]研究微波介导的湿热处理对藜麦淀粉的理化和消化性质的影响,研究表明微波加热功率与湿热处理含水量是影响改性效果的主要影响因素,发现微波介导的湿热处理能够显著降低藜麦淀粉的消化速率。从以上报道可知目前关于藜麦淀粉的湿热处理条件主要考察了不同处理时间和淀粉含水量对改性的影响。其中Liu等[14]的研究属于不同含水量的湿热处理对藜麦淀粉的改性研究,然而该研究通过控制微波功率实现加热,处理过程中淀粉的实际处理温度无法获知。
为此本研究考察固定温度下(120 ℃)不同含水量(20%,25%,30%)的湿热处理对藜麦淀粉的流变学性质、体外消化性质以及结构的影响。本研究将为藜麦淀粉的进一步开发和应用提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
实验所用藜麦 属于白藜麦,产地为山西省忻州市繁峙县;猪胰腺α-淀粉酶(50 U/mg,EC 3.2.1.1,Sigma 10080)、淀粉葡萄糖苷酶(70 U/mg,EC 3.2.1.3,Sigma 10115) 购自Sigma Chemical Company(St.Louis,MO,USA);葡萄糖氧化酶-过氧化物酶(Glucose oxidase-peroxidase,GOPOD)测定试剂盒 购自爱尔兰Megazyme公司;石油醚 色谱级试剂,购自上海阿拉丁生化科技股份有限公司。
Perten RVA-TM标准型快速粘度分析仪 瑞典珀金埃尔默公司;Eppendorp 5804R离心机 德国艾本德公司;MCR302e流变仪 奥地利Anton paar公司;Ultima IV X-射线粉末衍射仪 日本理学;Nicolet6700 FTIR 美国赛默飞;JSM-7500F冷场发射扫描电镜 日本电子公司。
1.2 实验方法
1.2.1 藜麦淀粉的提取
脱脂藜麦粉制备:采用冰水对藜麦进行浸提冲洗,然后在40 ℃下烘干,粉碎过100目筛。藜麦粉与石油醚按照1:10(m/v)料液比混合,洗涤3次后,4000×g下离心15 min,移去石油醚部分,将藜麦粉置于40 ℃烘箱干燥,得到脱脂藜麦粉备用[15]。藜麦淀粉提取:参考实验室已建立的方法对藜麦进行淀粉提取[16]。采用0.3% NaOH溶液浸泡藜麦粉,过200目筛除杂后,采用蒸馏水对沉淀进行至少4次清洗,直至上清液清澈无黄色为止,使用1 mol/L的HCl调节pH至7.0,40 ℃烘箱干燥36 h、粉碎过100目筛后得到藜麦淀粉,置于自封袋中,放置在4 ℃下储藏备用。
1.2.2 藜麦淀粉的湿热处理
湿热处理的方法参考Wang等[17]的研究,并做适当的修改。准确称取一定量的藜麦淀粉,根据藜麦淀粉初始含水量(根据GB 5009.3-2016中直接干燥法测定)添加适量的蒸馏水使藜麦淀粉的含水量分别为20%、25%、30%,密封后置于4 ℃冰箱平衡24 h。将平衡好的藜麦粉放入提前预热至120 ℃的烘箱中处理10 h,待处理完毕取出样品,40 ℃烘干36 h,粉碎后过筛100目,放入自封袋中备用。其中未经湿热处理的藜麦淀粉用NS表示,20%含水量处理组的样品用HMT1表示,25%含水量处理组的样品用HMT2表示,30%含水量处理组的样品用HMT3表示。
1.2.3 流变学性质的测定
1.2.3.1 样品处理
样品流变学性质的测定参考Xu等[18]的方法并做适当修改。使用快速粘度分析仪(Rapid viscosity analyzer,RVA)制备8%的淀粉糊,冷却后用于后续流变学实验测定。其中RVA糊化样品的条件为将8%的淀粉浆置于RVA铝罐中,搅拌速度960 r/min保持10 s,之后保持为160 r/min。50 ℃保持 1 min,以12 ℃/min 速率匀速升温至95 ℃,95 ℃保温2 min 30 s,然后再以相同速率降温至50 ℃,保温2 min得到糊化的样品。采用安东帕MCR302e流变仪测定样品的流变特性。使用平板系统测试,使用直径为60 mm的夹具测量,间距1 mm。淀粉凝胶冷却至室温后,将其平铺在平板夹具上并进行刮样处理。
1.2.3.2 表观粘度测定
测试温度为25 ℃,剪切速率为0.100~300.000 s−1下,测定淀粉糊的表观粘度(η)随剪切速率变化的规律。
1.2.3.3 振幅扫描
测定温度为25 ℃,固定扫描频率为10 Hz,测定剪切应变从0.01%~100%变化时储能模量(G')、损耗模量(G'')随剪切应变(γ)变化的关系曲线。
1.2.3.4 动态流变特性-频率扫描
测定温度为25 ℃,根据线性粘弹区范围的实验结果将测量的应变固定为1%,固定扫描频率范围0.01~100.00 Hz,测定样品的储能模量G'、损耗模量G''、损耗因子(tanδ)随扫描频率变化的情况。
1.2.3.5 触变实验
固定测定温度为25 ℃,设定剪切速率从0.100~300.000 s−1递增,保持50 s,再从300.000~0.100 s−1递减,测定样品的触变性。
1.2.4 体外消化实验
根据Ye等[19]的方法测定样品的体外消化率,并进行了轻微修改。准确称取200 mg样品于50 mL离心管中,并分散在10.0 mL浓度为0.2 mol/L的乙酸钠缓冲液(pH5.2;内含1.0 mmol/L CaCl2)中并在37 ℃下水浴平衡10 min。然后将1.5 mL混酶溶液(混酶中α-淀粉酶和葡萄糖苷酶的酶活分别为100 U/ mL和200 U/mL)加入至混合体系中,并在180 r/min下持续磁力搅拌。分别在0、5、10、15、20、30、60、90、120、150、180、210和240 min的时间点取出500 μL水解溶液,并将其移入装有4.0 mL无水乙醇的离心管中以使酶迅速失活,然后在3500×g下离心10 min。上清液中葡萄糖浓度用GOPOD试剂在510 nm下测定。使用下列公式计算快速消化淀粉(Rapidly digestible starch,RDS)、慢消化淀粉(Slowly digestible starch,SDS)、抗性消化淀粉(Resistant starch,RS)的含量:
RDS(%)=G20−FGTS×0.9×100 (1) SDS(%)=G120−G20TS×0.9×100 (2) RS(%)=TG−FGTS×0.9×100−(RDS+SDS) (3) 式中:0.9为葡萄糖转化为淀粉的因子;FG为样品中本身的葡萄糖含量(mg);G20为水解20 min时产生的葡萄糖含量(mg);G120为水解120 min时产生的葡萄糖含量(mg);TG为样品完全水解时产生的葡萄糖含量(mg);TS为总淀粉含量(mg)。
1.2.5 结构测定
1.2.5.1 X射线衍射(X-ray diffraction,XRD)
原淀粉与湿热处理的淀粉样品的长程结构通过XRD测定[17,20]。采用Cu–Kα射线,40 kV,100 mA,扫描速度为4°/min,步长为0.02°,扫描区域2θ=5°~40°。结果由Origin软件进行分析,淀粉颗粒的相对结晶度(Relative crystallinity,RC):
RC(%)=AcAc+Aa×100 (4) 式中,RC、Ac、Aa分别是相对结晶度、结晶区面积和无定形区面积。
1.2.5.2 傅里叶变换红外光谱(Fourier transform infrared spectrum,FTIR)
FTIR可以表征淀粉颗粒表面附近的淀粉链的结构顺序信息[16]。4 cm−1分辨率下扫描样品64次,并在透射模式记录样品4000~800 cm−1范围内的光谱。通过Omnic 8.2软件解析光谱图先对1200~800 cm−1范围内的光谱进行基线校正,转换成吸光度模式,然后去卷积。假定线形为洛伦兹,峰宽为41 cm−1,分辨率增强因子设为1.9。记录去卷积谱图中1047 、1022和995 cm−1位置的峰高,1047 cm−1与1022 cm−1的峰高比值代表淀粉结晶区和无定形区的比值。
1.2.5.3 扫描电子显微镜(Scanning electron microscope,SEM)
采用SEM观察样品的微观样貌。将样品置于附着有双面胶的金属桩上并在真空下进行喷金处理,然后在10.0 kV加速电压下观察样品,观察的放大倍数为20000倍。
1.3 数据处理
本文实验结果使用统计软件SPSS 17.0进行统计分析。通过Duncan多重范围检验进行单因素方差分析(ANOVA),P<0.05为显著水平。所有实验均平行测定至少三次,结果表示为平均值±标准偏差。
2. 结果与分析
2.1 湿热处理对藜麦淀粉流变学性质的影响
2.1.1 表观粘度分析
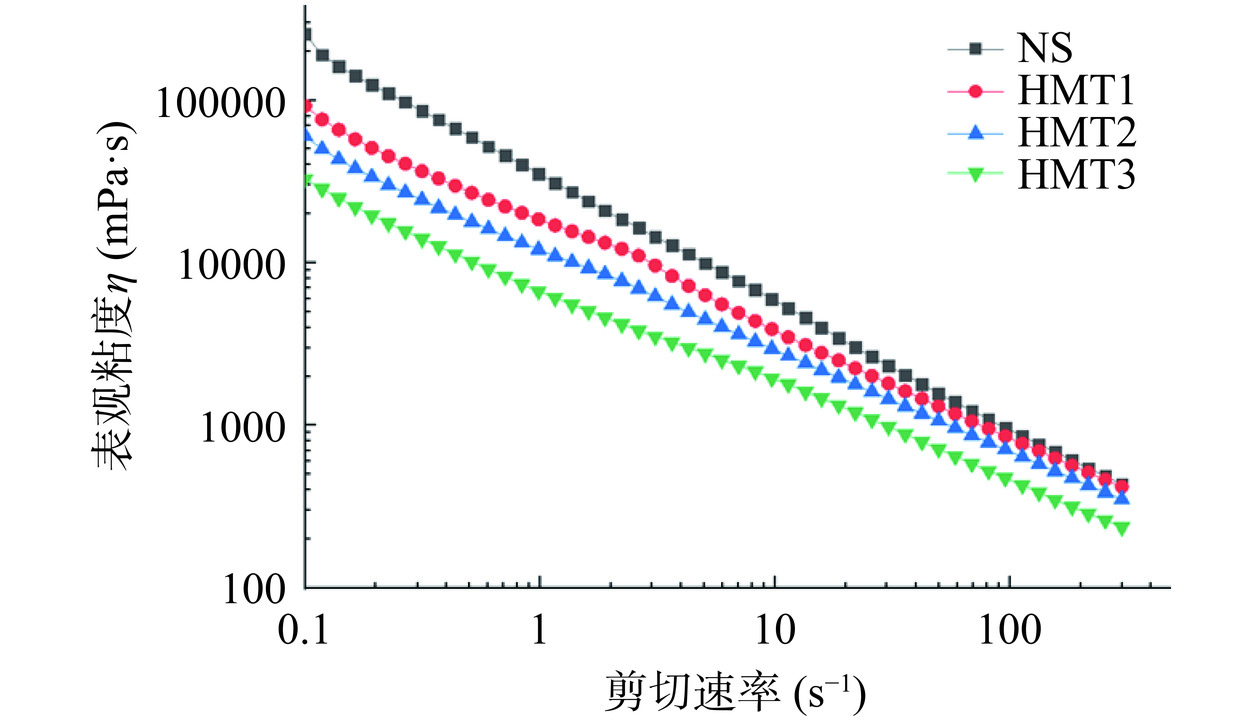
湿热处理前后的藜麦淀粉的稳态剪切流动曲线如图1所示。由图1可知,所有的样品呈现出剪切变稀的非牛顿流体性质,为典型的假塑性流体[21]。在淀粉的糊化体系中,淀粉分子链相互缠绕,然而随着剪切速率的增加淀粉分子缠结点减少,因而呈现出剪切变稀的现象。湿热处理后的样品HMT1~HMT3相同剪切速率下的表观粘度均明显低于原淀粉的表观粘度。这表明经过HMT处理后的藜麦淀粉的抗剪切能力明显降低。这可能是因为在湿热处理过程中淀粉分子量发生降低或直链淀粉渗出减少,从而导致淀粉的抗剪切能力降低,类似的结果在过热蒸汽改性小麦淀粉的研究中报道过[22]。HMT处理后淀粉的表观粘度随HMT初始含水量的增加而递减,这可能是因为随着HMT初始含水量的增加,湿热处理过程中将拥有更多高活性的水分子,淀粉分子量发生更严重的降解,淀粉链变短,分子链之间相互缠结减少,从而导致更低的粘度[23]。
2.1.2 振幅扫描分析
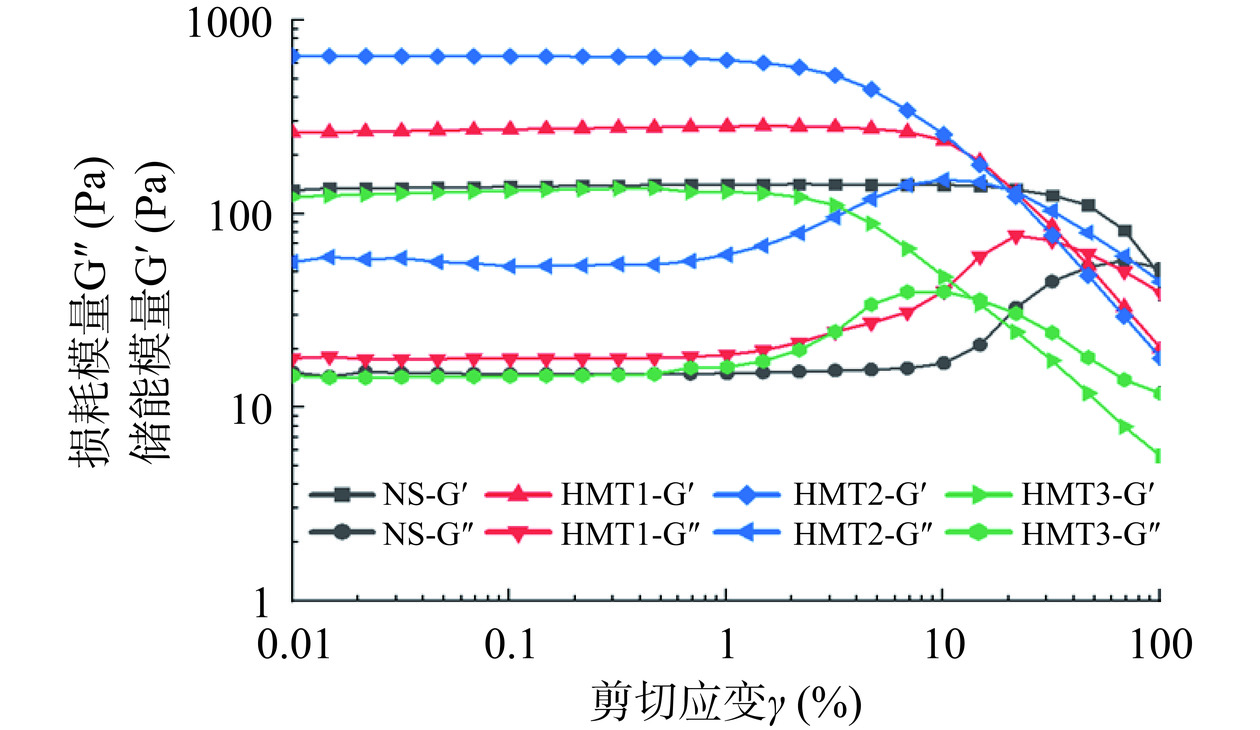
振幅扫描主要通过破坏样品的原始流动状态来研究样品的内部结构和特性。因此样品的线性粘弹性范围可以通过动态振幅扫描来确定。由图2可以看出,NS样品的线性粘弹区介于0.01%~10%,且当剪切应变小于1%时,所有的样品的G'和G''基本不随剪切应变发生变化,然而当剪切应变大于1%时,随剪切应变的增加HMT3样品的G'开始逐渐降低,G''开始逐渐增加,这是因为随着剪切应变的增加淀粉凝胶的结构开始破坏,凝胶刚性逐渐减弱而粘性开始增加,表明HMT3的线性粘弹区间为0.01%~1%,因此后续动态流变和触变实验中选择1%的剪切应变时所对应的剪切应力τ作为频率扫描的初始条件。另外从图中也可看出经过湿热处理后,藜麦淀粉凝胶的线性粘弹区均介于0.01%~1%左右的剪切应变范围,显著小于NS样品的线性粘弹区范围(0.01%~10%剪切应变),由此可见湿热处理后的藜麦淀粉耐剪切的能力明显降低,这与2.1.1结果一致。
2.1.3 频率扫描分析
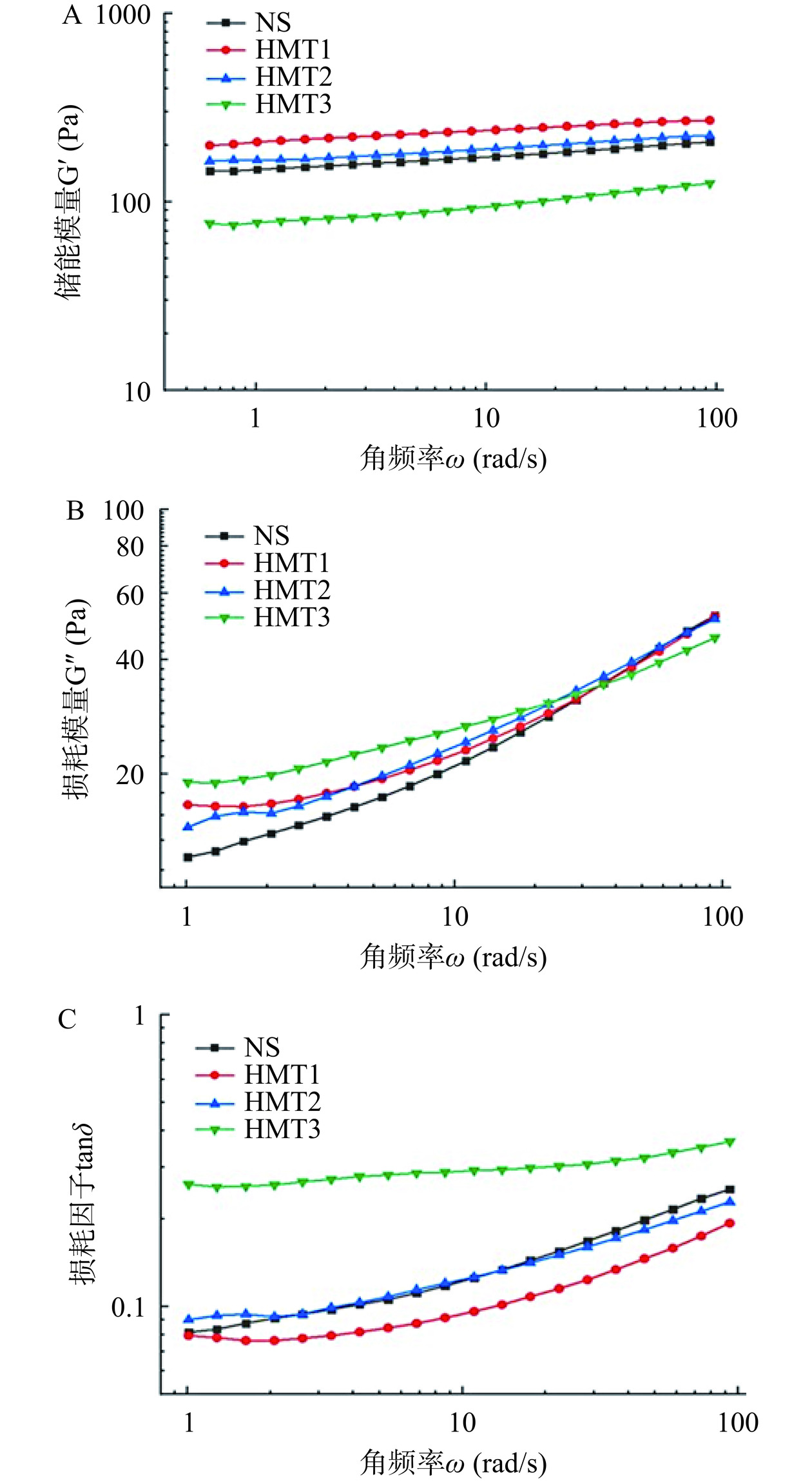
湿热处理对藜麦淀粉的动态流变学性质的影响如图3所示。图3 A、B、C的曲线分别为角频率ω与G'、G''、tanδ的关系图。从图3A、3B可以看出,随着角频率的增加G'和G''均呈增加趋势,且G'明显高于G'',所有样品的凝胶体系展示出典型的高分子凝胶行为,且随着湿热处理含水量的增加G'与G''分别呈递减与递增的趋势。这可能是因为湿热处理含水量增加会导致淀粉湿热处理过程中分子链降解更显著,形成的凝胶网络结构更弱,而凝胶结构的减弱往往会导致G'的降低和G''的增加。由图3C可以看出样品的损耗因子均小于1,说明样品凝胶均为弱凝胶体系[24],且随着湿热处理含水量的增加,凝胶的损耗因子不断增加,凝胶体系粘弹性增加,这可能是因为湿热处理高温条件下导致淀粉分子链的部分降解,且含水量越高淀粉分子链更加活跃,更有利于淀粉分子链降解的发生[25−26],降解的淀粉分子可能更容易取向,有可能会提高双螺旋结构的含量。
2.1.4 触变性分析
触变性是水溶性聚合物溶液的一种重要流变特性,可以用来反映凝胶在剪切过程中的稳定性强弱[20]。湿热处理后对藜麦淀粉触变性影响如图4所示。触变环的面积是滞后面积,代表破坏系统结构所需要的能量,且滞后面积越大,恢复到原始状态所需的能量和时间就越多,稳定性越强[18,27]。由图4可以看出湿热处理后藜麦淀粉凝胶的滞后面积明显减小,且初始含水量越高湿热处理后样品的滞后面积越小,这表明随着含水量的增加湿热处理后的淀粉分子链降解更加明显,凝胶强度降低,这一结果与2.1.3动态流变学实验结果相一致。
2.2 湿热处理对藜麦淀粉体外消化性质的影响
湿热处理前后藜麦淀粉的水解曲线如图5所示,所有的样品均表现出典型的淀粉水解曲线,在反应初始阶段淀粉被快速水解,随着反应的进行水解产物逐渐积累抑制反应的进行,反应开始逐渐趋于平缓。淀粉水解曲线遵循一级反应方程,采用Origin软件对消化水解曲线拟合,得方程动力学参数(如表1)。由表1可知,HMT1与NS水解的平衡浓度均比较低,这可能与NS和HMT1样品高含量的RS有关;反应速率常数b结果表明, HMT3与HMT2样品的反应速率常数均低于NS与HMT1样品,这可能归因于HTM2与HMT3样品高含量的慢消化淀粉。湿热处理前后藜麦淀粉的快速消化淀粉(Rapidly digestible starch,RDS)、慢消化淀粉(Slowly digestible starch,SDS)、抗性消化淀粉(Resistant starch,RS)的含量如表2所示。由表2可知,湿热处理后淀粉所含RDS含量显著降低(P<0.05)。随着湿热处理含水量的不断增加,改性后的藜麦淀粉所含SDS含量不断增加(HMT3的SDS含量最高,为24.93%),RS含量不断降低(HMT3的RS含量最低,为12.27%),这与淀粉水解动力学参数结果一致,这可能是因为一方面高温高湿条件下淀粉分子链活动性及分子重排能力增强,另一方面高温高湿下淀粉分子链会发生部分降解,降解的分子链分子取向更容易[3]。HMT3样品所含的SDS含量最高,这可能是因为30%含水量湿热处理下淀粉分子通过逐渐成核和繁殖来促进晶体区域的生长和晶体区域的完善,从而在晶体基质中形成更不完美的晶体,从而形成更多的SDS[16],这也表明HMT3样品可能在血糖缓释方面具有潜力。
表 1 湿热处理前后藜麦淀粉体外模拟水解动力学参数Table 1. Parameters of in vitro simulated hydrolysis kinetics equation of quinoa starch before and after HMT参数 NS HMT1 HMT2 HMT3 a 87.5±0.6b 85.9±0.9b 88.6±0.8a 89.4±0.6a b 0.075±0.002a 0.072±0.003a 0.071±0.003ab 0.068±0.002b 注:a,平衡浓度(%);b,一级反应动力学速率(min−1);同一行中含有不同字母的均值之间具有显著性差异(P<0.05)。 表 2 湿热处理前后藜麦淀粉各组分含量Table 2. Content of each component of quinoa starch before and after HMT样品 RDS (%) SDS (%) RS (%) NS 64.52±0.18a 18.97±0.89c 16.49±0.75a HMT1 62.82±0.65b 22.02±0.55b 15.15±0.10b HMT2 63.34±0.70b 23.06±0.90ab 13.58±0.63c HMT3 62.79±0.42b 24.93±0.72a 12.27±0.41c 注:同一列中含有不同字母的均值之间具有显著性差异(P<0.05);表3同。 2.3 湿热处理对藜麦淀粉结构影响
2.3.1 长程结构分析(XRD)
淀粉颗粒是由结晶区和无定形区组成的半结晶体系,它们的晶体结构可以通过X射线衍射图案来表征。X射线曲线中尖锐的衍射峰可以反映晶体类型、晶体尺寸和晶体区域的长程有序性。淀粉的无定形区域可以通过X射线曲线上的分散衍射来反映[28]。
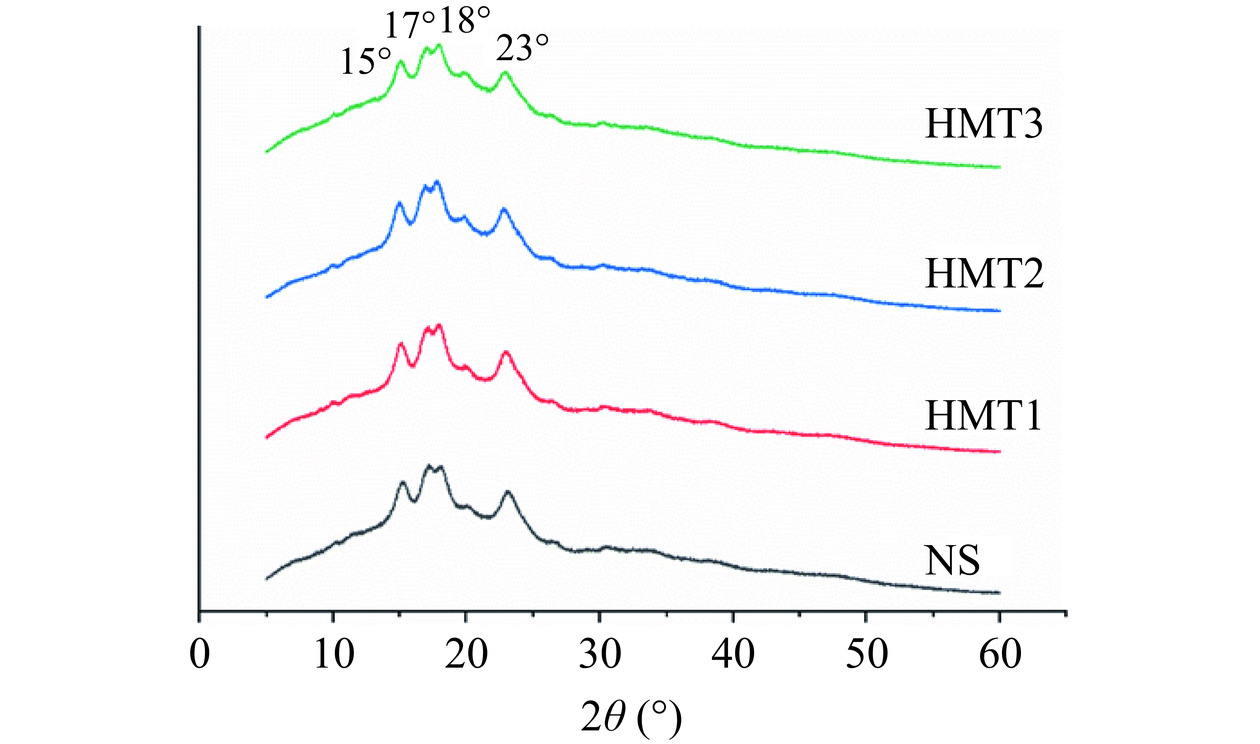
湿热处理前后藜麦淀粉的X-射线衍射图如图6所示。天然藜麦淀粉在15°、17°、18° 和23°处具有强衍射峰, 说明藜麦淀粉为A型结晶结构[11−12,29]。湿热处理后,其特征衍射峰仍然保留,表明HMT没有改变藜麦淀粉的晶体类型。湿热处理前后藜麦淀粉的相对结晶度如表3所示。从表3可以看出,随着湿热处理水分含量的升高,藜麦淀粉的相对结晶度逐渐下降。这可能是因为湿热处理过程中的水、热的传递,导致淀粉颗粒中分子链之间氢键的断裂,破坏了淀粉的结晶结构,从而降低藜麦淀粉的相对结晶度,且含水量越高这种破坏作用越强[3]。
表 3 湿热处理前后藜麦淀粉的长短程结构参数Table 3. Parameters of the long- and short-range structure of quinoa starch before and after HMT样品 R1047/1022 R995/1022 RC(%) NS 0.111±0.003a 0.242±0.003d 17.47±0.17a HMT1 0.091±0.003b 0.289±0.004c 14.95±0.15b HMT2 0.088±0.002b 0.403±0.002b 14.44±0.06c HMT3 0.079±0.003c 0.470±0.004a 13.21±0.11d 2.3.2 短程结构分析(FTIR)
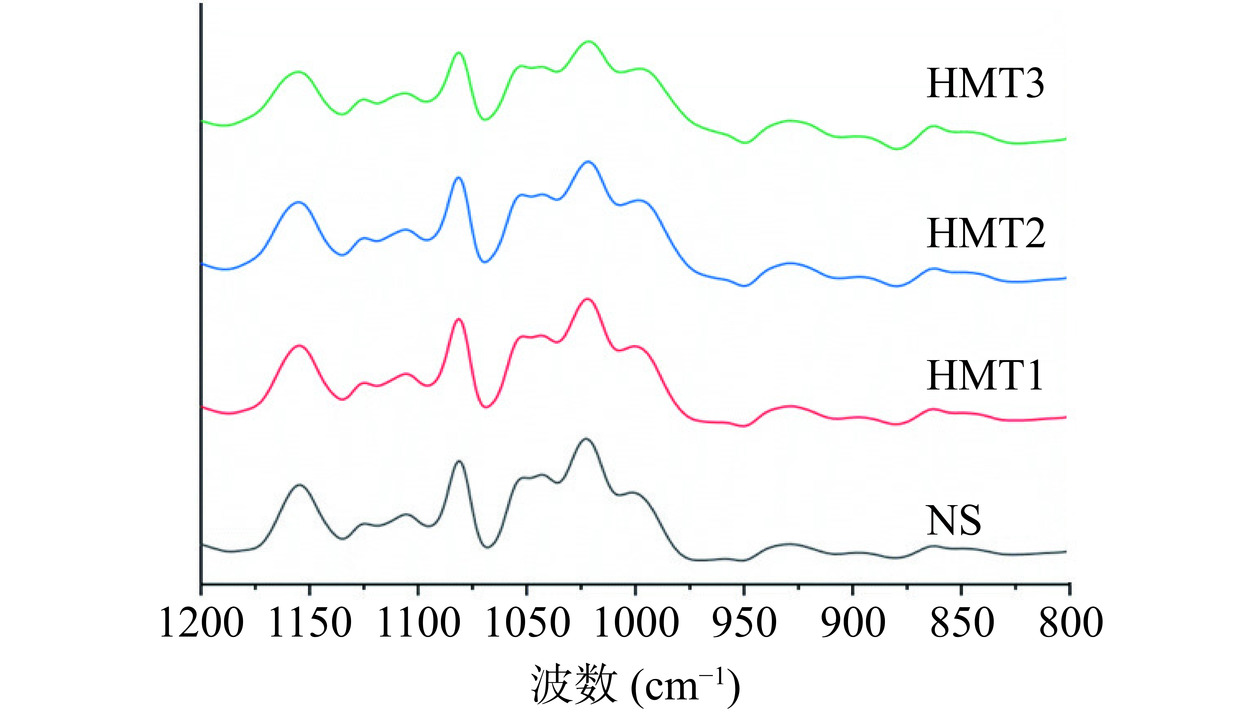
淀粉的FTIR光谱反映了分子水平上的结构变化,包括结晶度、凝沉和淀粉链构象[30]。淀粉的特征光谱特征在800~1200 cm−1范围内,其中1047 cm−1和1022 cm−1处的吸收分别与淀粉的有序结构和无定形结构有关。995 cm−1处的吸收峰反映淀粉分子之间氢键的结构。1047 cm−1/1022 cm−1和995 cm−1/1022 cm−1的比例分别代表淀粉的有序结构和双螺旋度[31]。
湿热处理前后的藜麦淀粉在1200到800 cm−1的FTIR吸收光谱如图7所示。由图可知湿热处理后,吸收光谱中没有新的吸收峰的出现或原吸收峰的消失,表明湿热处理后藜麦淀粉没有产生新的官能团。从表3可知,相较于NS,湿热处理后藜麦淀粉的R1047/1022均显著降低(P<0.05),且该比值随湿热处理水分含量的增加而降低,这表明湿热处理后淀粉的整体有序性降低,这与XRD的结果一致。HMT1~HMT3样品的R995/1022比值均显著大于湿热处理前藜麦淀粉的比值(P<0.05),且该比值随水分含量的增加而增加,表明湿热处理后藜麦淀粉的双螺旋结构含量增加,双螺旋结构的增加通常会导致淀粉非RDS含量的增加,且HMT2与HMT3样品的R995/1022比值显著高于NS与HMT1的R995/1022比值(P<0.05),这表明HMT2~HMT3样品所含SDS含量较高,这与2.2结果一致。这可能是因为HMT条件下淀粉分子链活动性及重排能力增强,因而相比NS整体形成更高含量的双螺旋结构,随着含水量的增加虽然淀粉的整体结晶度会降低,但会形成更多不完美晶型,从而形成更多含量的SDS。
2.3.3 微观结构分析(SEM)
湿热处理前后藜麦淀粉在SEM观察下的微观样貌如图8所示。由图8可知,NS淀粉的颗粒呈不规则的多边形,平均粒径在2 μm左右,属于小颗粒淀粉。湿热处理后,藜麦淀粉颗粒的表面表现出不同程度的凹陷,且颗粒之间有部分聚集现象。这可能是因为随着湿热处理水分含量的升高,藜麦淀粉颗粒有可能发生微弱的糊化,含水量越高高温下水分子对淀粉链的作用越明显,分子重排,从而出现表面凹陷的现象,HMT3淀粉颗粒之间出现了聚集现象,颗粒间相互连接,形成团聚体,Suriya等[32]的研究中也观察到类似的现象。
3. 结论
本研究考察了不同含水量的湿热处理对藜麦淀粉流变学、体外消化性质及其结构的影响。结果表明,湿热处理能够显著改变藜麦淀粉的流变学性质,湿热处理能够降低藜麦淀粉凝胶体系的表观粘度,且随着湿热处理含水量的增加表观粘度降低更加明显,频率扫描实验结果表明随着湿热处理含水量的增加湿热处理后淀粉凝胶的储能模量逐渐降低而损耗模量逐渐增加,触变实验结果表明湿热处理后藜麦淀粉凝胶的触变环面积显著降低。体外消化结果表明湿热处理后藜麦淀粉整体抗消化酶能力增强,其中30%含水量下湿热处理条件下藜麦淀粉的慢消化淀粉含量最高。湿热处理后淀粉的结构发生显著改变,湿热处理能够通过促进淀粉分子之间的相互作用,促进分子重排,形成更高含量的双螺旋结构,但随着含水量的增加淀粉的长程有序结构遭受破坏。本研究结果表明湿热处理的初始含水量是影响藜麦淀粉改性效果的主要影响因素,其中30%含水量下湿热处理的藜麦淀粉拥有最高含量的慢性消化淀粉,这也为藜麦淀粉在血糖控制方面提供了新的可能。相关的研究成果将为藜麦淀粉的改性提供理论依据,为其应用提供新思路。
-
表 1 湿热处理前后藜麦淀粉体外模拟水解动力学参数
Table 1 Parameters of in vitro simulated hydrolysis kinetics equation of quinoa starch before and after HMT
参数 NS HMT1 HMT2 HMT3 a 87.5±0.6b 85.9±0.9b 88.6±0.8a 89.4±0.6a b 0.075±0.002a 0.072±0.003a 0.071±0.003ab 0.068±0.002b 注:a,平衡浓度(%);b,一级反应动力学速率(min−1);同一行中含有不同字母的均值之间具有显著性差异(P<0.05)。 表 2 湿热处理前后藜麦淀粉各组分含量
Table 2 Content of each component of quinoa starch before and after HMT
样品 RDS (%) SDS (%) RS (%) NS 64.52±0.18a 18.97±0.89c 16.49±0.75a HMT1 62.82±0.65b 22.02±0.55b 15.15±0.10b HMT2 63.34±0.70b 23.06±0.90ab 13.58±0.63c HMT3 62.79±0.42b 24.93±0.72a 12.27±0.41c 注:同一列中含有不同字母的均值之间具有显著性差异(P<0.05);表3同。 表 3 湿热处理前后藜麦淀粉的长短程结构参数
Table 3 Parameters of the long- and short-range structure of quinoa starch before and after HMT
样品 R1047/1022 R995/1022 RC(%) NS 0.111±0.003a 0.242±0.003d 17.47±0.17a HMT1 0.091±0.003b 0.289±0.004c 14.95±0.15b HMT2 0.088±0.002b 0.403±0.002b 14.44±0.06c HMT3 0.079±0.003c 0.470±0.004a 13.21±0.11d -
[1] ZIA UD D, XIONG H G, FEI P. Physical and chemical modification of starches:A review[J]. Critical Reviews in Food Science and Nutrition,2017,57(12):2691−2705. doi: 10.1080/10408398.2015.1087379
[2] MANIGLIA B C, CASTANHA N, LE-BAIL P, et al. Starch modification through environmentally friendly alternatives:A review[J]. Critical Reviews in Food Science and Nutrition,2021,61(15):2482−2505.
[3] ZAVAREZE E D R, DIAS A R G. Impact of heat-moisture treatment and annealing in starches:A review[J]. Carbohydrate Polymers,2011,83(2):317−328. doi: 10.1016/j.carbpol.2010.08.064
[4] FONSECA L M, EL HALAL S L M, DIAS A R G, et al. Physical modification of starch by heat-moisture treatment and annealing and their applications:A review[J]. Carbohydrate Polymers,2021,274:118665. doi: 10.1016/j.carbpol.2021.118665
[5] LI H, WANG R R, LIU J, et al. Effects of heat-moisture and acid treatments on the structural, physicochemical, and in vitro digestibility properties of lily starch[J]. International Journal of Biological Macromolecules,2020,148:956−968. doi: 10.1016/j.ijbiomac.2020.01.181
[6] VILLACRÉS E, QUELAL M, GALARZA S et al. Nutritional and health benefits of quinoa (Chenopodium quinoa Willd.)[J]. Journal of Cereal Science,2016,69:371−376. doi: 10.1016/j.jcs.2016.05.004
[7] 杨积鹏, 刘建福. 假谷物的营养及加工应用研究进展[J]. 食品与发酵工业,2022,48(10):284−289,298. [YANG J P, LIU J F. Research progress of pseudo cereal nutrition and processing application[J]. Food and Fermentation Industries,2022,48(10):284−289,298.] YANG J P, LIU J F. Research progress of pseudo cereal nutrition and processing application[J]. Food and Fermentation Industries, 2022, 48(10): 284−289,298.
[8] LI G T, ZHU F. Amylopectin molecular structure in relation to physicochemical properties of quinoa starch[J]. Carbohydrate Polymers,2017,164(15):396−402.
[9] 陈茜, 王振兴, 孙健, 等. 藜麦的营养成分、生物活性及加工利用[J]. 生物加工过程,2023,21(3):292−300. [CHEN X, WANG Z X, SUN J, et al. Research progress on nutritional components, functional activities, and processing and utilization of quinoa[J]. Chinese Journal of Bioprocess Engineering,2023,21(3):292−300.] CHEN X, WANG Z X, SUN J, et al. Research progress on nutritional components, functional activities, and processing and utilization of quinoa[J]. Chinese Journal of Bioprocess Engineering, 2023, 21(3): 292−300.
[10] 牛海力, 卢柏志, 马朗天, 等. 藜麦淀粉和藜麦抗性淀粉的理化性质[J]. 食品研究与开发,2023,44(18):45−52. [NIU H L, LU B Z, MA L T, et al. Physicochemical properties of quinoa starch and quinoa resistant starch[J]. Food Research and Development,2023,44(18):45−52.] doi: 10.12161/j.issn.1005-6521.2023.18.006 NIU H L, LU B Z, MA L T, et al. Physicochemical properties of quinoa starch and quinoa resistant starch[J]. Food Research and Development, 2023, 44(18): 45−52. doi: 10.12161/j.issn.1005-6521.2023.18.006
[11] LI G T, ZHU F. Quinoa starch:Structure, properties, and applications[J]. Carbohydrate Polymers,2018,181:851−861. doi: 10.1016/j.carbpol.2017.11.067
[12] ZHOU Y L, CUI L H, YOU X Y, et al. Effects of repeated and continuous dry heat treatments on the physicochemical and structural properties of quinoa starch[J]. Food Hydrocolloids,2021,113:106532. doi: 10.1016/j.foodhyd.2020.106532
[13] ALMEIDA R L J, SANTOS N C, FEITOZA J V F, et al. Effect of heat-moisture treatment on the thermal, structural and morphological properties of quinoa starch[J]. Carbohydrate Polymer Technologies and Applications,2022,3:100192. doi: 10.1016/j.carpta.2022.100192
[14] LIU G X, ZHANG R, HUO S, et al. Insights into the changes of structure and digestibility of microwave and heat moisture treated quinoa starch[J]. International Journal of Biological Macromolecules,2023,246:125681. doi: 10.1016/j.ijbiomac.2023.125681
[15] 王天, 江含秀, 路丽妮, 等. 藜麦可溶性膳食纤维提取工艺优化及其抗氧化活性研究[J]. 中国食品添加剂,2022,33(2):137−146. [WANG T, JIANG H X, LU L N, et al. Optimization of extraction process of quinoa soluble dietary fiber and its antioxidant activity[J]. China Food Additives,2022,33(2):137−146.] WANG T, JIANG H X, LU L N, et al. Optimization of extraction process of quinoa soluble dietary fiber and its antioxidant activity[J]. China Food Additives, 2022, 33(2): 137−146.
[16] WU X J, LIANG X M, DONG X X, et al. Physical modification on the in vitro digestibility of tartary buckwheat starch:Repeated retrogradation under isothermal and non-isothermal conditions[J]. International Journal of Biological Macromolecules,2021,184:1026−1034. doi: 10.1016/j.ijbiomac.2021.06.117
[17] WANG H W, WANG Z Y, LI X X, et al. Multi-scale structure, pasting and digestibility of heat moisture treated red adzuki bean starch[J]. International Journal of Biological Macromolecules,2017,102:162−169. doi: 10.1016/j.ijbiomac.2017.03.144
[18] XU N, ZHANG Y, ZHANG G Z, et al. Effects of insoluble dietary fiber and ferulic acid on rheological and thermal properties of rice starch[J]. International Journal of Biological Macromolecules,2021,193:2260−2270. doi: 10.1016/j.ijbiomac.2021.11.058
[19] YE J P, HU X T, LUO S J, et al. Effect of endogenous proteins and lipids on starch digestibility in rice flour[J]. Food Research International,2018,106:404−409. doi: 10.1016/j.foodres.2018.01.008
[20] WU X J, FU G M, LI R Y, et al. Effect of thermal processing for rutin preservation on the properties of phenolics & starch in tartary buckwheat achenes[J]. International Journal of Biological Macromolecules,2020,164:1275−1283. doi: 10.1016/j.ijbiomac.2020.07.135
[21] WANG N, WU L R, ZHANG F S, et al. Modifying the rheological properties, in vitro digestion, and structure of rice starch by extrusion assisted addition with bamboo shoot dietary fiber[J]. Food Chemistry,2022,375:131900. doi: 10.1016/j.foodchem.2021.131900
[22] MA Y S, ZHANG H, JIN Y M, et al. Impact of superheated steam on the moisture transfer, structural characteristics and rheological properties of wheat starch[J]. Food Hydrocolloids,2022,122:107089. doi: 10.1016/j.foodhyd.2021.107089
[23] TAN X Y, LI X X, CHEN L, et al. Effect of heat-moisture treatment on multi-scale structures and physicochemical properties of breadfruit starch[J]. Carbohydrate Polymers,2017,161:286−294. doi: 10.1016/j.carbpol.2017.01.029
[24] HEYMAN B, DE VOS W H, VAN DER MEEREN P, et al. Gums tuning the rheological properties of modified maize starch pastes:Differences between guar and xanthan[J]. Food Hydrocolloids,2014,39:85−94. doi: 10.1016/j.foodhyd.2013.12.024
[25] YANG X J, CHI C D, LIU X L, et al. Understanding the structural and digestion changes of starch in heat-moisture treated polished rice grains with varying amylose content[J]. International Journal of Biological Macromolecules,2019,139:785−792. doi: 10.1016/j.ijbiomac.2019.08.051
[26] 刘晓媛, 熊旭红, 曾洁, 等. 湿热处理对甘薯淀粉流变特性的影响[J]. 食品工业科技,2019,40(10):78−86,92. [LIU X Y, XIONG X H, ZENG J, et al. Effects of heat-moisture treatment on rheological properties of sweet potato starch[J]. Science and Technology of Food Industry,2019,40(10):78−86,92.] LIU X Y, XIONG X H, ZENG J, et al. Effects of heat-moisture treatment on rheological properties of sweet potato starch[J]. Science and Technology of Food Industry, 2019, 40(10): 78−86,92.
[27] ACHAYUTHAKAN P, SUPHANTHARIKA M. Pasting and rheological properties of waxy corn starch as affected by guar gum and xanthan gum[J]. Carbohydrate Polymers,2008,71(1):9−17. doi: 10.1016/j.carbpol.2007.05.006
[28] ZHANG B, HUANG Q, LUO F X, et al. Structural characterizations and digestibility of debranched high-amylose maize starch complexed with lauric acid[J]. Food Hydrocolloids,2012,28(1):174−181. doi: 10.1016/j.foodhyd.2011.12.020
[29] ZHU S, LIU B, WANG F, et al. Characterization and in vitro digestion properties of cassava starch and epigallocatechin-3-gallate (EGCG) blend[J]. LWT,2021,137:110398. doi: 10.1016/j.lwt.2020.110398
[30] HU X P, HUANG T T, MEI J Q, et al. Effects of continuous and intermittent retrogradation treatments on in vitro digestibility and structural properties of waxy wheat starch[J]. Food Chemistry,2015,174:31−36. doi: 10.1016/j.foodchem.2014.11.026
[31] ZHANG Y F, CHEN C, CHEN Y, et al. Effect of rice protein on the water mobility, water migration and microstructure of rice starch during retrogradation[J]. Food Hydrocolloids,2019,91:136−142. doi: 10.1016/j.foodhyd.2019.01.015
[32] SURIYA M, REDDY C K, HARIPRIYA S. Functional and thermal behaviors of heat-moisture treated elephant foot yam starch[J]. International Journal of Biological Macromolecules,2019,137:783−789. doi: 10.1016/j.ijbiomac.2019.06.228





 下载:
下载:



 下载:
下载:
