Optimization of the Ultrasonic-assisted Aqueous Two-phase Extraction of Lycium ruthenicum Polysaccharides and Its Monosaccharide Composition and Pancreatic Lipase Inhibitory Activity
-
摘要: 目的:优化黑果枸杞果实多糖的制备工艺,分析单糖组成,并对其体外胰脂肪酶抑制活性进行评价。方法:采用超声辅助双水相萃取法,以多糖回收率和提取率的总评值为评价指标,在单因素实验基础上,通过响应面试验优化黑果枸杞果实多糖提取工艺;采用柱前衍生化高效液相色谱法研究其单糖组成;通过棕榈酸对硝基苯酯法测定黑果枸杞果实多糖的体外胰脂肪酶抑制活性。结果:黑果枸杞果实多糖的最佳提取工艺为:乙醇-硫酸铵体系,乙醇质量分数30.89%,硫酸铵质量分数17.00%,提取温度49.05 ℃,提取时间81.85 min,液料比29.80 g/g,预测总评值为0.9242,多糖提取率为104.76 mg/g,回收率为96.96%;黑果枸杞果实多糖由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成,相对摩尔比分别为4.92:0.29:4.80:0.40:9.69:44.79:17.04:18.06;黑果枸杞果实多糖抑制胰脂肪酶活力的IC50值为1.51 mg/mL。结论:响应面试验优化得到的黑果枸杞果实多糖制备工艺稳定,单糖组成检测方法准确可靠,制备所得多糖具有良好的体外胰脂肪酶抑制活性,为黑果枸杞果实多糖的进一步开发利用提供了依据。Abstract: Objective: To optimize the preparation process of polysaccharides from Lycium ruthenicum, analyze the monosaccharide composition and evaluate its pancreatic lipase inhibitory activity in vitro. Methods: Ultrasound-assisted aqueous two-phase extraction method was employed. Taking the overall evaluation value of polysaccharide recovery and extraction rate as the evaluation index, on the basis of single factor experiment, response surface analysis was conducted to optimize the extraction process. The composition of monosaccharides was studied by high performance liquid chromatography with pre-column derivatization. The pancreatic lipase inhibitory activity of Lycium ruthenicum polysaccharides was evaluated by p-nitrophenyl palmitate method. Results: The optimum extraction conditions: Ethanol-ammonium sulfate system, ethanol concentration 30.89%, ammonium sulfate concentration 17.00%, extraction temperature 49.05 ℃, extraction time 81.85 min, liquid to material ratio 29.80 g/g. At this time, the predicted total evaluation value was 0.9242, and the extraction and recovery rates were 104.76 mg/g and 96.96%, respectively. Lycium ruthenicum polysaccharides were composed of monosaccharides such as mannose, ribose, rhamnose, glucuronic acid, galacturonic acid, glucose, galactose and arabinose, with the relative molar ratios of 4.92:0.29:4.80:0.40:9.69:44.79:17.04:18.06, respectively. The IC50 value of Lycium ruthenicum polysaccharides inhibiting pancreatic lipase was 1.51 mg/mL. Conclusion: The preparation process of Lycium ruthenicum polysaccharides optimized by response surface methodology was stable. The detection method of monosaccharide composition was accurate and reliable. Lycium ruthenicum polysaccharides had good pancreatic lipase inhibitory activity in vitro. The results would provide a basis for the further development and utilization of Lycium ruthenicum polysaccharides.
-
黑果枸杞(Lycium ruthenicum Murr.)为茄科枸杞属多年生灌木,广泛分布于中国西北部的盐碱化沙漠地区。其果实味甜多汁,民间常生食、榨汁或泡茶饮,具有很高的营养价值和药用价值。黑果枸杞果实化学成分主要包括花青素[1]、多糖[2]和苯丙素[3]等,其中多糖是黑果枸杞果实的重要活性成分之一。研究表明,黑果枸杞果实多糖具有抗衰老[4]、提高免疫力[5]、调节血糖[6]和抗缺氧[7]等多重功效。
多糖的传统提取方法包括加热溶剂提取[8]、超声波辅助提取[9]、微波辅助提取[10]、酶辅助提取[11]等。双水相萃取是一种新型的提取和纯化方法,可以在保证产品高纯度和高产率的同时,保持分子的生物活性,尤其适用于多糖、蛋白质等生物大分子的分离[12−13]。将双水相萃取与超声波、微波等传统技术联用,可以更为快速、简便、高效地实现K植物多糖的提取[14−15]。但是,黑果枸杞活性成分的分离制备研究目前主要集中在其花青素类成分[16−18],将双水相萃取法用于黑果枸杞果实多糖制备的相关报道较为少见。黑果枸杞果实多糖的高值化利用亟待建立高效的制备工艺。
多糖的药理活性与其单糖组成密切相关[19−20]。对黑果枸杞果实多糖进行单糖组成分析,是实现其多糖产品质量控制的重要依据[21]。胰脂肪酶在人体脂质代谢中起到重要的作用,通过抑制胰脂肪酶活性,能够降低人体对脂质的吸收,从而起到减肥降脂效果[22−23]。目前美国食品药品监督管理局(Food and Drug Administration,FDA)批准的此类药物有奥利司他,但其存在肝损伤的风险并可能使胃肠道产生不良症状[24]。近年来,天然产物的胰脂肪酶抑制剂由于其结构多样性,低毒性和广泛的来源而备受关注[25−26]。多项研究表明多糖类成分可以作为胰脂肪酶的有效抑制剂[27−28]。
在此背景下,本研究拟通过响应面法优化黑果枸杞果实多糖的超声辅助双水相萃取制备工艺,利用柱前衍生高效液相色谱法(High performance liquid chromatography,HPLC)分析其单糖组成,通过体外实验评价黑果枸杞果实多糖对胰脂肪酶的抑制活性,为黑果枸杞果实多糖的研究开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
黑果枸杞 青海诺木洪农场提供,河西学院农业与生态工程学院王进教授鉴定为茄科枸杞属植物黑果枸杞(Lycium ruthenicum Murr.)的干燥果实;对照品甘露糖、核糖、鼠李糖、葡萄糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸 纯度≥98%,德国Ruibio公司;半乳糖 纯度≥99%,美国Sigma公司;乙腈、甲酸 色谱纯,天津福晨化学试剂有限公司;三氟乙酸、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、棕榈酸对硝基苯酯(p-Nitrophenylpalmitate,p-NPP)(纯度≥98%)、胰脂肪酶(15~35 U/mg);其他试剂均为国产分析纯。
DZF-6020真空干燥箱 上海博迅实业有限公司;KQ250B超声波清洁仪 昆山市超声仪器有限公司;V-1200可见分光光度计 上海精密科学仪器有限公司;AUW120D电子分析天平 日本岛津公司;Sorvall LYNX 6000离心机、Multiskan FC酶标仪 美国赛默飞世尔科技有限公司;N-1001旋转蒸发仪 日本东京理化EYELA公司;Agilent 1260高效液相色谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 黑果枸杞果实多糖的制备工艺
黑果枸杞果实于40 ℃真空干燥24 h,粉碎过40目筛。加入10倍石油醚(30~60 ℃)浸泡24 h除色素后,挥干溶剂备用。加入一定比例的某双水相萃取体系,一定温度下超声(250 W)提取一定时间,分别收集上相和下相,多糖样品一般在下相中得到富集。在富集样品中加入Sevage溶液(正丁醇:氯仿=1:4,v/v)萃取多次去除蛋白,直到两相间不再有白色絮状物产生。取上层清液加入15% H2O2脱色后,将溶液置于4 ℃冰箱中12 h除去大部分盐。然后用透析袋(截留分子量200 Da)去除盐和一些小分子。将纯化后的样品溶液减压浓缩,冷冻干燥备用。
1.2.2 多糖得率的计算
1.2.2.1 葡萄糖标准曲线的制作
采用硫酸-苯酚法[29]测定多糖总糖含量,绘制葡萄糖浓度(X1)与吸光度(Y1)的标准曲线:Y1=7.3285X1+0.1311(R2=0.9959)。
1.2.2.2 多糖提取指标的计算
多糖提取效果采用提取率(Extraction yield,Y)和回收率(Recovery rate,R)两个指标来评价。提取率(Y,mg/g)通过公式(1)计算:
Y(mg/g)=m1m2=Cb×Vb+Ct×Vtm2 (1) 式中:m1表示提取多糖的质量,等于上相和下相中多糖的总和,mg;m2表示用于提取的黑果枸杞果实的质量,g;Cb表示下相中多糖的浓度,mg/mL;Ct表示上相中多糖的浓度,mg/mL;Vb表示下相的体积,mL;Vt表示上相的体积,mL。
回收率(R,%)通过公式(2)计算:
R(%)=Cb×VbCb×Vb+Ct×Vt×100 (2) 1.2.3 双水相萃取体系的选择
选择三种无机盐(硫酸铵、碳酸钠、磷酸氢二钾)和五种有机溶剂(乙醇、丙醇、异丙醇、聚乙二醇-4000、聚乙二醇-6000)组成不同的双水相体系(表1)。当使用聚乙二醇-4000或聚乙二醇-6000时,无机盐和醇的质量分数均保持在15%左右[30]。当使用乙醇、丙醇或异丙醇时,无机盐和醇的质量分数分别保持在20%和25%左右[31]。将组成双水相体系的两相充分混合,加入0.5 g样品,控制体系总重量8.0 g,超声提取。按照公式(1)和(2)计算黑果枸杞果实多糖在不同双水相体系中的提取率和回收率,选择最佳的双水相萃取体系。
表 1 双水相体系的组成及比例Table 1. Composition and proportion of different aqueous two-phase systems编号 组成及比例(%) 硫酸铵 碳酸钠 磷酸氢二钾 乙醇 丙醇 异丙醇 聚乙二醇-4000 聚乙二醇-6000 1 15 0 0 0 0 0 15 0 2 15 0 0 0 0 0 0 15 3 20 0 0 0 25 0 0 0 4 20 0 0 0 0 25 0 0 5 20 0 0 25 0 0 0 0 6 0 0 15 0 0 0 15 0 7 0 0 15 0 0 0 0 15 8 0 0 20 0 25 0 0 0 9 0 0 20 0 0 25 0 0 10 0 0 20 25 0 0 0 0 11 0 15 0 0 0 0 15 0 12 0 15 0 0 0 0 0 15 13 0 20 0 0 25 0 0 0 14 0 20 0 0 0 25 0 0 15 0 20 0 25 0 0 0 0 1.2.4 乙醇-硫酸铵双水相体系相图的绘制
使用浊点滴定法[32]绘制乙醇-硫酸铵双水相体系的相图。使用式(3)和式(4)计算每个浊点处的乙醇和硫酸铵浓度:
G(%)=EN+E+W×100 (3) L(%)=NN+E+W×100 (4) 式中:G表示乙醇的质量分数,%;L表示硫酸铵的质量分数,%;E表示乙醇的添加量,g;N表示硫酸铵的添加量,g;W表示纯水的添加量,g。
1.2.5 单因素实验
为了确定超声波辅助双水相萃取黑果枸杞多糖的工艺参数,选择影响双水相体系稳定性的乙醇质量分数、硫酸铵质量分数以及超声提取过程中的液料比、提取温度、提取时间为主要工艺参数进行优化。
1.2.5.1 乙醇质量分数对提取率和回收率的影响
将硫酸铵质量分数、液料比、提取温度和提取时间分别固定在20%、30 g/g、45 ℃和60 min,考察乙醇质量分数(20%、25%、30%、35%、40%)对多糖提取率和回收率的影响。
1.2.5.2 硫酸铵质量分数对提取率和回收率的影响
将乙醇质量分数、液料比、提取温度和提取时间分别固定在30%、30 g/g、45 ℃和60 min,考察硫酸铵质量分数(15%、17%、19%、21%、23%)对多糖提取率和回收率的影响。
1.2.5.3 液料比对提取率和回收率的影响
将乙醇质量分数、硫酸铵质量分数、提取温度和提取时间分别固定在30%、17%、45 ℃和60 min,考察液料比(10、20、30、40、50 g/g)对多糖提取率和回收率的影响。
1.2.5.4 提取温度对提取率和回收率的影响
将乙醇质量分数、硫酸铵质量分数、液料比和提取时间分别固定在30%、17%、30 g/g和60 min,考察提取温度(35、45、55、65、75 ℃)对多糖提取率和回收率的影响。
1.2.5.5 提取时间对提取率和回收率的影响
将乙醇质量分数、硫酸铵质量分数、液料比、提取温度分别固定在30%、17%、30 g/g和45 ℃,考察提取时间(30、60、90、120、150 min)对多糖提取率和回收率的影响。
1.2.6 响应面试验
在单因素实验基础上,进一步选取乙醇质量分数(A)、提取温度(B)、提取时间(C)和液料比(D)作为优化指标,以提取率和回收率的总评值为响应值,设计4因素3水平的响应面试验,试验设计的因素编码及水平见表2。
表 2 响应面试验中变量的编码和水平Table 2. Codes and levels of the variables in response surface experiment变量 水平 −1 0 1 A乙醇质量分数(%) 25 30 35 B提取温度(℃) 35 50 65 C提取时间(min) 40 80 120 D液料比(g/g) 20 30 40 总评值的计算[33]:首先采用式(5)和式(6)将提取率和回收率分别标准化为0~1之间的“归一值”,然后采用式(7)对提取率和回收率的“归一值”求算几何平均数,得到总评值。
di=Yi−YminYmax−Ymin (5) gi=Ri−RminRmax−Rmin (6) TEi=√digi (7) 式中:di和gi分别表示第i组提取率和回收率的归一化值;Yi和Ri分别表示第i组的提取率平均值和回收率平均值,mg/g和%;Ymin和Rmin分别表示所有实验组别中最小的提取率平均值和最小的回收率平均值,mg/g和%;Ymax和Rmax分别表示所有实验组别中最大的提取率平均值和最大的回收率平均值,mg/g和%;TEi表示第i组的总评值。
1.2.7 柱前衍生HPLC法分析单糖组成
1.2.7.1 多糖水解及衍生化
准确称取多糖样品50 mg于刻度试管中,加入2 mol/L三氟乙酸5 mL,110 ℃水解6 h。冷却后用3 mol/L NaOH溶液调节pH至7.0,超纯水定容至10 mL。精密移取上清液0.2 mL,依次加入0.3 mol/L NaOH溶液和0.5 mol/L PMP甲醇溶液各0.2 mL,混匀后70 ℃水浴60 min,不时振摇。冷却后加入0.3 mol/L HCl溶液0.2 mL中和,用水补充至2 mL,加入氯仿5 mL,充分萃取后弃去氯仿层,重复3次。取上清液(相当于多糖浓度为0.5 mg/mL)过0.45 μm微孔滤膜后备用。
1.2.7.2 混合对照品溶液的配制及衍生化
配制甘露糖、核糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、葡萄糖醛酸和半乳糖醛酸8个对照品的系列浓度混合对照溶液,其质量浓度分别为5、10、50、100、500 μg/mL,按照“1.2.7.1”方法衍生化。
1.2.7.3 HPLC分析条件
Thermo AcclaimTM 120 C18色谱柱(4.6×250 mm,5 μm),柱温30 ℃;乙腈(A)-磷酸盐缓冲溶液(B,pH6.8)等度洗脱(18:82,v/v),流速0.8 mL/min,检测波长254 nm,进样量10 μL[34]。
1.2.7.4 方法学考察
a. 线性关系考察。分别精密吸取经衍生化的系列浓度的混合对照品溶液10 μL,按“1.2.7.3”项下色谱条件测定,以单糖的质量浓度为横坐标,峰面积为纵坐标,进行线性回归分析;b. 精密度实验。分别精密吸取经衍生化的质量浓度100 μg/mL的混合对照品溶液10 μL,按“1.2.7.3”项下色谱条件测定,连续进样6次,测得其相对标准偏差(Relative standard deviations,RSDs);c. 重复性实验。按照“1.2.7.1”和“1.2.7.2”项下方法,制备6份黑果枸杞果实水解多糖的PMP衍生供试品溶液,按“1.2.7.3”项下色谱条件进样,测定RSDs;d. 加样回收率实验。取已知含量的黑果枸杞果实多糖50 mg,平行6份,分别加入一定量的对照品,按照“1.2.7.1”和“1.2.7.2”项下方法,平行制备供试品溶液,按“1.2.7.3”项下色谱条件进样,计算8个单糖成分的平均加样回收率及RSDs。
1.2.8 胰脂肪酶抑制实验
采用p-NPP法[35]测定黑果枸杞果实多糖的体外胰脂肪酶抑制活性。将p-NPP用乙腈溶解,配制成10 mmol/L储备液,临用前用无水乙醇稀释成浓度3.33 mmol/L的溶液备用。样品采用Tris-HCl缓冲液(75 mmol/L,pH7.5)配制成10 mg/mL储备液,临用前稀释成不同浓度。在96孔板中依次加入20 μL样品溶液,10 μL 3.33 mmol/L p-NPP溶液,20 μL 5 mg/mL胰脂肪酶溶液和150 μL Tris-HCl缓冲液。样品反应终浓度分别为:0.125、0.5、1.0、2.0和4.0 mg/mL。37 ℃孵育60 min后测定405 nm的吸光度值。阳性对照采用奥利司他,同时设置空白组(不加样加酶,样品用同体积Tris-HCl缓冲液代替)、空白对照组(不加样不加酶,样品和酶均用同体积Tris-HCl缓冲液代替)和样品对照组(加样不加酶,酶用同体积Tris-HCl缓冲液代替)。使用公式(8)计算样品对胰脂肪酶的抑制率。
抑制率(%)=ODs−ODs0ODb−ODb0×100 (8) 式中:ODs表示样品组的吸光度值;ODs0表示样品对照组的吸光度值;ODb表示空白组的吸光度值;ODb0表示空白对照组的吸光度值。
1.3 数据处理
HPLC方法学考察实验每组重复6次;其他实验每组重复3次,结果用平均值±标准差表示,组间通过SPSS 20.0软件进行单因素方差分析比较;利用Origin8.0软件进行绘图;采用Design Expert 10.0.3.1软件进行响应面分析;采用GraphPad Prism 5.00软件进行IC50的拟合。
2. 结果与分析
2.1 双水相体系的筛选和相图制作
2.1.1 双水相体系的筛选
由醇(乙醇、丙醇、异丙醇、聚乙二醇-4000、聚乙二醇-6000)和无机盐(硫酸铵、碳酸钠、磷酸氢二钾)组成的15种双水相体系(表1)的提取效果如图1所示,其中,由乙醇和硫酸铵组成的体系5取得了较佳的萃取效果,多糖提取率和回收率分别为89.4±0.65 mg/g和94.9%±1.33%。因此,后续选择乙醇-硫酸铵体系进一步研究。
2.1.2 乙醇-硫酸铵双水相相图
如图2所示,在曲线下方,系统是稳定的均相区,而在曲线上方,系统是两相区。乙醇和硫酸铵可以在较大质量分数范围内形成双水相体系。在两相区,上相为富含乙醇相,下相为富含硫酸铵相。极性较小的物质易富集于上相,而多糖类物质极性较大,易富集于下相而得到分离[36]。因此,在实验中,乙醇和硫酸铵的质量分数的选取应落于曲线之上的区域。
2.2 单因素实验结果
2.2.1 双水相体系中乙醇质量分数对多糖提取效果的影响
如图3所示,固定硫酸铵质量分数为20%,当乙醇质量分数由20%增加至30%时,多糖的提取率和回收率均显著增加(P<0.05)。当乙醇质量分数由30%增加至35%时,多糖的提取率略有降低(P<0.05),回收率无明显变化(P>0.05)。当乙醇质量分数由35%增加至40%时,多糖的提取率和回收率均明显降低(P<0.05)。这可能是因为较高浓度的乙醇导致硫酸铵盐和多糖均发生了沉淀。因此,后续选择25%、30%和35%作为乙醇质量分数响应面法优化的三个水平。
2.2.2 双水相体系中硫酸铵质量分数对多糖提取效果的影响
如图4所示,固定乙醇质量分数30%,当硫酸铵质量分数从15%增加至17%时,提取率和回收率值均显著增加(P<0.05)。继续加大硫酸铵质量分数,提取率和回收率值无明显改变(P>0.05),这可能是因为随着硫酸铵质量分数的增加,下相中的多糖含量已接近饱和点。因此,后续选择质量分数17%的硫酸铵来提取黑果枸杞果实多糖。
2.2.3 液料比对黑果枸杞果实多糖提取效果的影响
如图5所示,随着液料比的增加,提取率和回收率均出现先增加后降低的趋势。当液料比为30 g/g时,提取率和回收率均达到最大值(102.2±2.30 mg/g和93.5%±2.36%)。适当增加液料比可使多糖得到更为充分的提取和分离,但液料比过高又会给样品回收带来困难,导致提取率和回收率降低。此外,液料比过高也会造成资源浪费。因此,后续选择20、30和40 g/g作为液料比的三个水平,进一步利用响应面法进行优化。
2.2.4 提取温度对黑果枸杞果实多糖提取效果的影响
如图6所示,当温度为55 ℃,可以实现较高的提取率,当温度为45 ℃时,可以实现较高的回收率。适当增加提取温度有利于多糖的提取,但提取温度过高可能导致乙醇的挥发和多糖的变性。因此,根据提取率和回收率随提取温度变化的趋势,后续选择35、50和65 ℃作为提取温度的三个水平进行响应面法优化。
2.2.5 提取时间对黑果枸杞果实多糖提取效果的影响
如图7所示,当超声时间为60 min时,可以实现多糖较高的回收率,当超声时间为90 min时,可以实现多糖较高的提取率。因此,根据提取率和回收率随提取时间变化的趋势,后续选择40、80和120 min作为提取时间的三个水平进行响应面法优化。
2.3 超声辅助双水相萃取条件的响应面法优化结果
响应面法实验方案和结果如表3所示。采用Design Expert 10.0.3.1软件对表3数据进行处理,得到提取率和回收率的总评值与乙醇质量分数(A)、提取温度(B)、提取时间(C)、液料比(D)之间的二次回归方程:总评值=−11.53+0.50A+0.20B+3.50×10−2C+2.34×10−2D+1.29×10−3AB+3.51×10−3AC–4.06×10−4AD–1.27×10−3BC+1.30×10−4BD+2.73×10−4CD–1.10×10−2A2–3.17×10−2B2–1.26×10−3C2–1.82×10−4D2
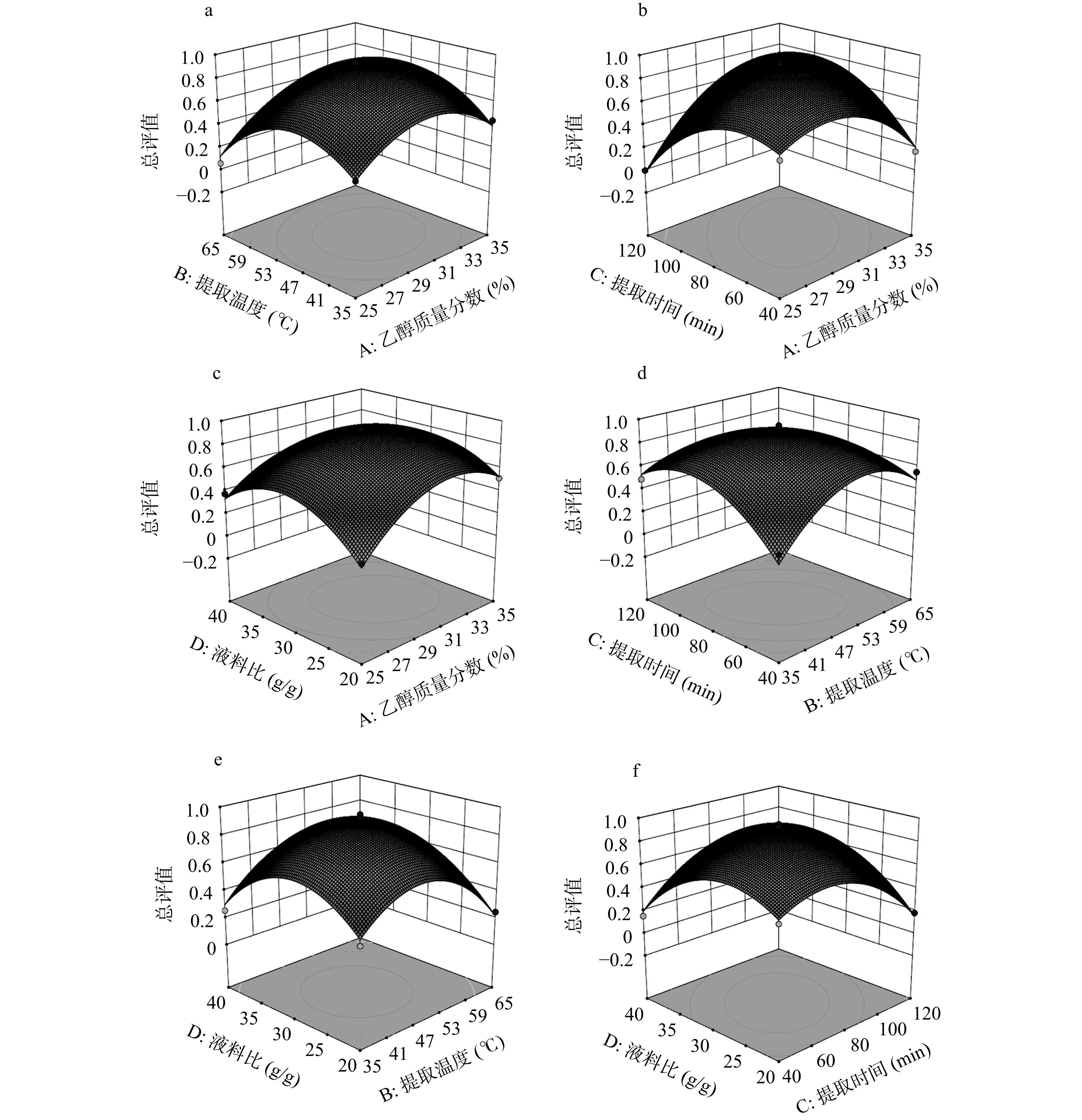
表 3 Box-Behnken响应面试验设计方案及结果Table 3. Design and results of Box-Behnken experimental实验号 A:乙醇质量分数 B:提取温度 C:提取时间 D:液料比 回收率(R,%) 提取率(Y,mg/g) 总评值 1 1 0 −1 0 69.2±0.57 86.4±2.15 0.1706 2 −1 0 0 −1 69.9±1.07 89.5±1.56 0.2231 3 0 0 −1 1 81.2±0.95 81.0±0.62 0.1548 4 −1 0 −1 0 76.0±2.15 102.8±1.91 0.5177 5 1 0 0 1 82.6±2.79 85.8±1.86 0.3397 6 −1 0 0 1 76.6±2.02 91.2±2.47 0.3761 7 0 1 1 0 67.4±1.09 79.6±1.07 0.0000 8 0 −1 1 0 78.7±2.06 96.2±1.34 0.4896 9 0 0 0 0 96.4±1.71 103.3±2.91 0.8893 10 0 −1 −1 0 71.2±0.66 91.9±1.63 0.2809 11 1 0 1 0 85.2±1.60 102.8±2.04 0.7045 12 1 −1 0 0 75.8±2.50 96.5±1.15 0.4377 13 0 0 1 1 84.7±1.72 90.7±0.48 0.4811 14 −1 0 1 0 65.2±2.31 80.3±1.19 0.0000 15 1 1 0 0 88.9±0.74 86.0±0.64 0.4028 16 0 0 0 0 96.1±1.49 103.2±0.78 0.8831 17 0 0 0 0 99.2±1.05 103.7±2.07 0.9361 18 0 −1 0 1 78.3±0.88 84.2±1.82 0.2539 19 0 0 −1 −1 83.1±2.24 93.3±1.55 0.5121 20 0 1 0 −1 73.0±2.32 86.7±1.39 0.2434 21 0 −1 0 −1 74.4±0.85 94.1±1.68 0.3777 22 0 1 0 1 90.9±1.96 83.5±2.31 0.3274 23 0 0 1 −1 67.5±2.38 93.2±0.73 0.1829 24 −1 1 0 0 66.1±0.92 83.2±1.99 0.0589 25 0 0 0 0 95.7±2.12 107.1±2.87 0.9471 26 0 1 −1 0 88.3±1.11 91.9±0.64 0.5513 27 −1 −1 0 0 77.4±2.73 89.1±1.04 0.3521 28 1 0 0 −1 85.1±1.59 91.9±1.41 0.5117 29 0 0 0 0 96.5±2.10 104.9±2.11 0.9203 根据表4的方差分析结果,该模型P<0.0001,表明该模型不同因素间差异高度显著;决定系数R2=0.9818,校正决定系数R2Adj=0.9635,失拟项不显著(P>0.05),表明该模型拟合度好,误差小,可以用于实验预测。F值体现了各因素对实验结果的重要性,F值越大,表明该因素对实验结果的影响越大。因此,各因素对提取率和回收率的总评值的影响:乙醇质量分数(A)>提取温度(B)>提取时间(C)>液料比(D),最相关的变量是乙醇质量分数,其次是提取温度,而液料比和提取时间对总评值影响不显著(P>0.05)。相互作用项中,AB、AC、AD、BC、CD之间相互作用显著(P<0.05,P<0.01),二次项中,A2、B2、C2、D2对总评值影响显著(P<0.01)。黑果枸杞果实多糖提取率和回收率的总评值的三维响应面分析图如图8a~图8f所示,最佳点均落在实验考察区域内。
表 4 总评值的ANOVA回归分析结果Table 4. ANOVA results of the overall evaluation values项目 平方和 自由度 均方 F值 P值 显著性 模型 2.13 14 0.15 53.83 <0.0001 ** A 0.090 1 0.090 31.81 <0.0001 ** B 0.031 1 0.031 10.90 0.0052 ** C 9.04×10−3 1 9.04×10−3 3.19 0.0956 D 1.16×10−3 1 1.16×10−3 0.41 0.5325 AB 0.017 1 0.017 5.90 0.0293 * AC 0.28 1 0.28 97.74 <0.0001 ** AD 0.026 1 0.026 9.33 0.0086 ** BC 0.14 1 0.14 51.04 <0.0001 ** BD 0.011 1 0.011 3.82 0.0709 CD 0.11 1 0.11 37.99 <0.0001 ** A2 0.50 1 0.50 175.98 <0.0001 ** B2 0.65 1 0.65 230.29 <0.0001 ** C2 0.52 1 0.52 183.88 <0.0001 ** D2 0.55 1 0.55 194.01 <0.0001 ** 残差 0.040 14 2.83×10−3 失拟项 0.036 10 3.64×10−3 4.58 0.0780 净误差 3.18×10−3 4 7.96×10−4 总离差 2.17 28 R2 0.9818 R2Adj 0.9635 R2Pred 0.9011 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 响应面法分析得到的最佳提取条件为:乙醇质量分数30.89%,提取温度49.05 ℃,提取时间81.85 min,液料比29.80 g/g,此时预测总评值为0.9242,该预测值低于第17和25次实验的总评值(0.9361和0.9471),但这是综合考虑以同时获得较高回收率和提取率的结果。根据实际情况,确定了最佳提取条件为:乙醇质量分数30.9%,提取温度49.0 ℃,提取时间为81.9 min,液料比为29.8 g/g。使用调整后的条件进行了三次平行测试,其回收率为97.04%±1.49%,提取率为105.2±1.88 mg/g,证明该模型预测结果可行。
2.4 黑果枸杞果实多糖单糖组成分析结果
2.4.1 方法学考察
如图9所示,8种单糖对照品和黑果枸杞果实多糖样品水解产物的PMP衍生溶液在“1.2.7.3”色谱条件下取得了较好的分离效果。
2.4.2 线性关系考察
如表5所示,在5~500 μg/mL的浓度范围内,该方法具有较好的线性关系。
表 5 不同对照品的标准曲线、检测限和定量限Table 5. Linear regression, LODs and LOQs of different references对照品 线性回归方程 R2 线性范围(μg/mL) 检测限(μg/mL) 定量限(μg/mL) 甘露糖 Y2=17127X2+87.83 0.9991 5~500 2.5 5.0 核糖 Y3=14732X3+21.42 0.9997 5~500 0.5 1.3 鼠李糖 Y4=15954X4+2.33 0.9995 5~500 0.5 1.3 葡萄糖醛酸 Y5=12428X5+103.5 0.9993 5~500 1.0 2.5 半乳糖醛酸 Y6=13777X6+61.53 0.9996 5~500 2.5 5.0 葡萄糖 Y7=13085X7+40.92 0.9992 5~500 2.5 5.0 半乳糖 Y8=12424X8+18.76 0.9994 5~500 0.5 1.3 阿拉伯糖 Y9=22626X9+46.99 0.9995 5~500 2.5 5.0 2.4.3 精密度实验
根据精密度实验结果,甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的RSD分别为0.36%、0.44%、1.18%、1.11%、2.12%、0.65%、0.66%和0.44%,表明仪器精密度良好[37]。
2.4.4 重复性实验
根据重复性实验结果,样品中所含甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的RSD分别为1.15%、2.23%、2.10%、1.94%、1.88%、1.85%、1.76%和1.08%,表明该方法重复性良好[37]。
2.4.5 加样回收率实验
根据加样回收率实验结果,样品中所含甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的加样回收率分别为101.3%、100.0%、99.0%、99.9%、99.6%、98.8%、102.7%和97.1%,RSD分别为2.84%、3.04%、3.35%、2.17%、2.43%、1.80%、1.88%、2.01%,均小于3.5%,表明该方法回收率良好[37]。
2.4.6 黑果枸杞果实多糖中单糖含量的测定
如图9所示,通过HPLC分析,黑果枸杞果实多糖水解产物中甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的摩尔比为4.92:0.29:4.80:0.40:9.69:44.79:17.04:18.06。结果表明,黑果枸杞果实多糖可以水解产生多种单糖,主要由葡萄糖、阿拉伯糖和半乳糖等组成。
2.5 黑果枸杞果实多糖的体外胰脂肪酶抑制活力
如图10所示,在浓度0.125~4.00 mg/mL范围时,黑果枸杞多糖对胰脂肪酶的抑制作用随着浓度的增高呈上升趋势,但整体抑制率远远低于阳性药奥利司他。黑果枸杞多糖对胰脂肪酶抑制的IC50值为1.51 mg/mL。当黑果枸杞果实多糖浓度为4.00 mg/mL时,黑果枸杞多糖对胰脂肪酶活性的抑制率达到76.42%±1.22%,奥利司他对胰脂肪酶的抑制率达到99.88%±0.58%,表明黑果枸杞多糖对胰脂肪酶有一定的抑制活力。有文献表明多糖可以与胰脂肪酶的不同位点发生作用,发挥非竞争性抑制作用,其抑制活力的强弱取决于多糖的浓度和结构特征[38]。
3. 结论
本研究采用响应面法优化了黑果枸杞果实多糖的超声辅助双水相萃取制备工艺,根据实际情况调整后的最佳工艺为:采用乙醇-硫酸铵双水相体系,乙醇浓度30.9%,硫酸铵浓度17.0%,提取温度49.0 ℃,提取时间为81.9 min,溶剂比为29.8 g/g,此时黑果枸杞果实多糖的回收率为97.04%±1.49%,提取率为105.2±1.88 mg/g,可实现黑果枸杞果实多糖的高效制备。通过柱前衍生HPLC分析发现,水解得到的甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖的摩尔比为4.92:0.29:4.80:0.40:9.69:44.79:17.04:18.06,提示黑果枸杞果实多糖主要是由葡萄糖、阿拉伯糖和半乳糖等组成的杂多糖。体外胰脂肪酶抑制活性实验结果表明,在检测浓度范围内,黑果枸杞果实多糖对胰脂肪酶抑制率达到76.42%±1.22%,拟合的IC50值为1.51 mg/mL,具有一定的胰脂肪酶抑制效果。本研究为黑果枸杞果实多糖的进一步开发利用提供了依据。
-
表 1 双水相体系的组成及比例
Table 1 Composition and proportion of different aqueous two-phase systems
编号 组成及比例(%) 硫酸铵 碳酸钠 磷酸氢二钾 乙醇 丙醇 异丙醇 聚乙二醇-4000 聚乙二醇-6000 1 15 0 0 0 0 0 15 0 2 15 0 0 0 0 0 0 15 3 20 0 0 0 25 0 0 0 4 20 0 0 0 0 25 0 0 5 20 0 0 25 0 0 0 0 6 0 0 15 0 0 0 15 0 7 0 0 15 0 0 0 0 15 8 0 0 20 0 25 0 0 0 9 0 0 20 0 0 25 0 0 10 0 0 20 25 0 0 0 0 11 0 15 0 0 0 0 15 0 12 0 15 0 0 0 0 0 15 13 0 20 0 0 25 0 0 0 14 0 20 0 0 0 25 0 0 15 0 20 0 25 0 0 0 0 表 2 响应面试验中变量的编码和水平
Table 2 Codes and levels of the variables in response surface experiment
变量 水平 −1 0 1 A乙醇质量分数(%) 25 30 35 B提取温度(℃) 35 50 65 C提取时间(min) 40 80 120 D液料比(g/g) 20 30 40 表 3 Box-Behnken响应面试验设计方案及结果
Table 3 Design and results of Box-Behnken experimental
实验号 A:乙醇质量分数 B:提取温度 C:提取时间 D:液料比 回收率(R,%) 提取率(Y,mg/g) 总评值 1 1 0 −1 0 69.2±0.57 86.4±2.15 0.1706 2 −1 0 0 −1 69.9±1.07 89.5±1.56 0.2231 3 0 0 −1 1 81.2±0.95 81.0±0.62 0.1548 4 −1 0 −1 0 76.0±2.15 102.8±1.91 0.5177 5 1 0 0 1 82.6±2.79 85.8±1.86 0.3397 6 −1 0 0 1 76.6±2.02 91.2±2.47 0.3761 7 0 1 1 0 67.4±1.09 79.6±1.07 0.0000 8 0 −1 1 0 78.7±2.06 96.2±1.34 0.4896 9 0 0 0 0 96.4±1.71 103.3±2.91 0.8893 10 0 −1 −1 0 71.2±0.66 91.9±1.63 0.2809 11 1 0 1 0 85.2±1.60 102.8±2.04 0.7045 12 1 −1 0 0 75.8±2.50 96.5±1.15 0.4377 13 0 0 1 1 84.7±1.72 90.7±0.48 0.4811 14 −1 0 1 0 65.2±2.31 80.3±1.19 0.0000 15 1 1 0 0 88.9±0.74 86.0±0.64 0.4028 16 0 0 0 0 96.1±1.49 103.2±0.78 0.8831 17 0 0 0 0 99.2±1.05 103.7±2.07 0.9361 18 0 −1 0 1 78.3±0.88 84.2±1.82 0.2539 19 0 0 −1 −1 83.1±2.24 93.3±1.55 0.5121 20 0 1 0 −1 73.0±2.32 86.7±1.39 0.2434 21 0 −1 0 −1 74.4±0.85 94.1±1.68 0.3777 22 0 1 0 1 90.9±1.96 83.5±2.31 0.3274 23 0 0 1 −1 67.5±2.38 93.2±0.73 0.1829 24 −1 1 0 0 66.1±0.92 83.2±1.99 0.0589 25 0 0 0 0 95.7±2.12 107.1±2.87 0.9471 26 0 1 −1 0 88.3±1.11 91.9±0.64 0.5513 27 −1 −1 0 0 77.4±2.73 89.1±1.04 0.3521 28 1 0 0 −1 85.1±1.59 91.9±1.41 0.5117 29 0 0 0 0 96.5±2.10 104.9±2.11 0.9203 表 4 总评值的ANOVA回归分析结果
Table 4 ANOVA results of the overall evaluation values
项目 平方和 自由度 均方 F值 P值 显著性 模型 2.13 14 0.15 53.83 <0.0001 ** A 0.090 1 0.090 31.81 <0.0001 ** B 0.031 1 0.031 10.90 0.0052 ** C 9.04×10−3 1 9.04×10−3 3.19 0.0956 D 1.16×10−3 1 1.16×10−3 0.41 0.5325 AB 0.017 1 0.017 5.90 0.0293 * AC 0.28 1 0.28 97.74 <0.0001 ** AD 0.026 1 0.026 9.33 0.0086 ** BC 0.14 1 0.14 51.04 <0.0001 ** BD 0.011 1 0.011 3.82 0.0709 CD 0.11 1 0.11 37.99 <0.0001 ** A2 0.50 1 0.50 175.98 <0.0001 ** B2 0.65 1 0.65 230.29 <0.0001 ** C2 0.52 1 0.52 183.88 <0.0001 ** D2 0.55 1 0.55 194.01 <0.0001 ** 残差 0.040 14 2.83×10−3 失拟项 0.036 10 3.64×10−3 4.58 0.0780 净误差 3.18×10−3 4 7.96×10−4 总离差 2.17 28 R2 0.9818 R2Adj 0.9635 R2Pred 0.9011 注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。 表 5 不同对照品的标准曲线、检测限和定量限
Table 5 Linear regression, LODs and LOQs of different references
对照品 线性回归方程 R2 线性范围(μg/mL) 检测限(μg/mL) 定量限(μg/mL) 甘露糖 Y2=17127X2+87.83 0.9991 5~500 2.5 5.0 核糖 Y3=14732X3+21.42 0.9997 5~500 0.5 1.3 鼠李糖 Y4=15954X4+2.33 0.9995 5~500 0.5 1.3 葡萄糖醛酸 Y5=12428X5+103.5 0.9993 5~500 1.0 2.5 半乳糖醛酸 Y6=13777X6+61.53 0.9996 5~500 2.5 5.0 葡萄糖 Y7=13085X7+40.92 0.9992 5~500 2.5 5.0 半乳糖 Y8=12424X8+18.76 0.9994 5~500 0.5 1.3 阿拉伯糖 Y9=22626X9+46.99 0.9995 5~500 2.5 5.0 -
[1] KUMAR R, SHARMA R, THAKUR M S, et al. Comparative study of phytochemicals, antioxidant activities and chromatographic profiling of different parts of Lycium ruthenicum Murr. of Trans-Himalayan region[J]. Phytomedicine Plus,2022,2(4):100339. doi: 10.1016/j.phyplu.2022.100339
[2] YUN D W, YAN Y M, LIU J. Isolation, structure and biological activity of polysaccharides from the fruits of Lycium ruthenicum Murr.:A review[J]. Carbohydrate Polymers,2022,291(1):119618.
[3] ZHAO S S, LI S, LUO Z H, et al. Bioactive phenylpropanoid derivatives from the fruits of Lycium ruthenicum Murr.[J]. Bioorga-nic Chemistry,2021,116:105307. doi: 10.1016/j.bioorg.2021.105307
[4] WANG Z W, SUN Q R, FANG J X, et al. The anti-aging activity of Lycium barbarum polysaccharide extracted by yeast fermentation:In vivo and in vitro studies[J]. International Journal of Biological Macromolecules,2022,209:2032−2041.
[5] XIAO Z Y, DENG Q, ZHOU W X, et al. Immune activities of polysaccharides isolated from Lycium barbarum L. What do we know so far?[J]. Pharmacology & Therapeutics,2022,229:107921.
[6] ZHAO C, ZHAO H, ZHANG C C, et al. Impact of Lycium barbarum polysaccharide on the expression of glucagon-like peptide 1 in vitro and in vivo[J]. International Journal of Biological Macromolecules,2023,224(1):908−918.
[7] DENG K W, LI Y L, XIAO M, et al. Lycium ruthenicum Murr. polysaccharide protects cortical neurons against oxygen-glucose deprivation/reperfusion in neonatal hypoxic-ischemic encephalopathy[J]. International Journal of Biological Macromolecules,2020,158(1):562−568.
[8] SHANG H M, WU H Y, DONG X Q, et al. Effects of different extraction methods on the properties and activities of polysaccharides from Medicago sativa L. and extraction condition optimization using response surface methodology[J]. Process Biochemistry,2019,82:179−188. doi: 10.1016/j.procbio.2019.03.027
[9] GUO J Y, HU D Y, SHEN Y, et al. Optimization of ultrasonic-assisted polysaccharide extraction from Hyperici perforati Herba using response surface methodology and assessment of its antioxidant activity[J]. International Journal of Biological Macromolecules,2022,225(15):255−265.
[10] ZHANG Y L, LEI Y, QI S R, et al. Ultrasonic-microwave-assisted extraction for enhancing antioxidant activity of Dictyophora indusiata polysaccharides:The difference mechanisms between single and combined assisted extraction[J]. Ultrasonics Sonochemistry,2023,95:106356. doi: 10.1016/j.ultsonch.2023.106356
[11] 李晶, 王远, 罗瑞峰, 等. 不同提取工艺对黑果枸杞糖类物质的影响[J]. 食品科技,2021,46(9):175−182. [LI J, WANG Y, LUO R F, et al. Effect of different extraction technology on the sugars of Lycium ruthenicum Murr J]. Food Science and Technology,2021,46(9):175−182.
[12] LI G, MA X K, JIANG Y M, et al. Aqueous two-phase extraction of polysaccharides from Selaginella doederleinii and their bioactivity study[J]. Process Biochemistry,2022,118:274−282. doi: 10.1016/j.procbio.2022.04.024
[13] SANTHI V J, TAVANANDI A H, SHARMA R, et al. Differential partitioning of coconut whey proteins and fat using aqueous two phase extraction[J]. Fluid Phase Equilibria,2020,503:112314. doi: 10.1016/j.fluid.2019.112314
[14] YU J, CHEN Z H, ZHU J F, et al. Ultrasonic-assisted aqueous two-phase extraction of polysaccharides from the fruits of Ilex cornuta (Lindl. Et Paxt.):Process optimization, structural characterization and antioxidant activity study[J]. Microchemical Journal,2023,191:108885.
[15] YANG Y, LI M, SUN J W, et al. Microwave-assisted aqueous two-phase extraction of polysaccharides from Hippophae rhamnoide L.:Modeling, characterization and hypoglycemic activity[J]. International Journal of Biological Macromolecules,2024,254:127626.
[16] ZHOU X, WU Y T, WANG Y, et al. An efficient approach for the extraction of anthocyanins from Lycium ruthenicum using semi-continuous liquid phase pulsed electrical discharge system[J]. Innovative Food Science & Emerging Technologies,2022,80:103099.
[17] DENG K, OUYANG J, HU N, et al. Improved colorimetric analysis for subtle changes of powdered anthocyanins extracted from Lycium ruthenicum Murr.[J]. Food Chemistry,2022,371:131080. doi: 10.1016/j.foodchem.2021.131080
[18] CHEN S S, HU N, WANG H L, et al. The major anthocyanin of Lycium ruthenicum Murr. relieves cognitive deficits, oxidative stress, neuroinflammation, and hippocampal metabolome alterations in aging rats[J]. Journal of Functional Foods,2022,94:105104. doi: 10.1016/j.jff.2022.105104
[19] TAN J Q, CUI P S, GE S Q, et al. Ultrasound assisted aqueous two-phase extraction of polysaccharides from Cornus officinalis fruit:Modeling, optimization, purification, and characterization[J]. Ultrasonics Sonochemistry,2022,84:105966. doi: 10.1016/j.ultsonch.2022.105966
[20] ZENG P J, LI J, CHEN Y L, et al. Chapter seventeen-The structures and biological functions of polysaccharides from traditional Chinese herbs[J]. Progress in Molecular Biology and Translational Sciences,2019,163:423−444.
[21] 芦红云, 吴天祥, 汤庆莉, 等. 天麻醇提物对灰树花胞外多糖单糖组成和生物活性的影响[J]. 食品科学技术学报,2018,36(3):40−47. [LU H Y, WU T X, TANG Q L, et al. Effects and Rhizoma gastrodiae alcohol extract on monosaccharide composition and biological activity of Grifola frondosa exopolysaccharide[J]. Journal of Food Science and Technology,2018,36(3):40−47.] doi: 10.3969/j.issn.2095-6002.2018.03.006 LU H Y, WU T X, TANG Q L, et al. Effects and Rhizoma gastrodiae alcohol extract on monosaccharide composition and biological activity of Grifola frondosa exopolysaccharide[J]. Journal of Food Science and Technology, 2018, 36(3): 40−47. doi: 10.3969/j.issn.2095-6002.2018.03.006
[22] HE X, CHEN L Y, PU Y J, et al. Fruit and vegetable polyphenols as natural bioactive inhibitors of pancreatic lipase and cholesterol esterase:Inhibition mechanisms, polyphenol influences, application challenges[J]. Food Bioscience,2023,55:103054. doi: 10.1016/j.fbio.2023.103054
[23] ZUPANČIČ O, KUSHWAH V, PAUDEL A. Pancreatic lipase digestion:The forgotten barrier in oral administration of lipid-based delivery systems?[J]. Journal of Controlled Release,2023,362:381−395. doi: 10.1016/j.jconrel.2023.08.024
[24] LOGESH R, ARUN R, GOBI S, et al. Susceptible genetic polymorphisms and their association with adverse effects of orlistat therapy[J]. Obesity Medicine,2021,25:100360. doi: 10.1016/j.obmed.2021.100360
[25] CHANG Y H, HUNG H Y. Recent advances in natural anti-obesity compounds and derivatives based on in vivo evidence:A mini-review[J]. European Journal of Medicinal Chemistry,2022,237:114405. doi: 10.1016/j.ejmech.2022.114405
[26] MANISHA S, THILINI T, RAVI S, BENU A. Inhibition of enzymes associated with obesity by the polyphenol-rich extracts of Hibiscus sabdariffa[J]. Food Bioscience,2022,50:101992. doi: 10.1016/j.fbio.2022.101992
[27] AHMADI S, YU C X, ZAEIM D, et al. Increasing RG-I content and lipase inhibitory activity of pectic polysaccharides extracted from goji berry and raspberry by high-pressure processing[J]. Food Hydrocolloids,2022,126:107477. doi: 10.1016/j.foodhyd.2021.107477
[28] LI R L, XUE Z H, JIA Y A, et al. Polysaccharides from mulberry (Morus alba L.) leaf prevents obesity by inhibiting pancreatic lipase in high-fat diet induced mice[J]. Food Hydrocolloids,2021,192:452−460.
[29] 叶梦娟, 俞年军, 刘峻麟, 等. 基于柱前衍生化HPLC分析8种石斛精制多糖的单糖组成及含量[J]. 中华中医药杂志,2021,37(9):5126−5130. [YE M J, YU N J, LIU J L, et al. Analysis of monosaccharide composition and content of eight kinds of dendrobium refined polysaccharides based on pre-column derivatization HPLC[J]. Chinese Journal of Traditional Chinese Medicine and Pharmacy,2021,37(9):5126−5130.] YE M J, YU N J, LIU J L, et al. Analysis of monosaccharide composition and content of eight kinds of dendrobium refined polysaccharides based on pre-column derivatization HPLC[J]. Chinese Journal of Traditional Chinese Medicine and Pharmacy, 2021, 37(9): 5126−5130.
[30] CHEN Z, ZHANG W, TANG X Y, et al. Extraction and characterization of polysaccharides from Semen Cassiae by microwave-assisted aqueous two-phase extraction coupled with spectroscopy and HPLC[J]. Carbohydrate Polymers,2016,144:263−270. doi: 10.1016/j.carbpol.2016.02.063
[31] WYSOCZANSKA K, DO H T, HELD C, et al. Effect of different organic salts on amino acids partition behaviour in PEG-salt ATPS[J]. Fluid Phase Equilibria,2018,456:84−91. doi: 10.1016/j.fluid.2017.10.007
[32] WU X Y, LI R C, ZHAO Y J, et al. Separation of polysaccharides from Spirulina platensis by HSCCC with ethanol-ammonium sulfate ATPS and their antioxidant activities[J]. Carbohydrate Polymers,2017,173:465−472. doi: 10.1016/j.carbpol.2017.06.023
[33] 侯敏娜, 侯少平, 梁润丰, 等. 基于响应面法结合总评归一法多指标优选蜜黄芪微波炮制工艺[J]. 天然产物研究与开发,2023,35(3):467−476. [HOU M N, HOU S P, LIANG R F, et al. Optimization of microwave processing technology for honey roast Astragalus membranaceus by response surface method combined with overall desirability and normalization method with multi-index[J]. Natural Product Research and Development,2023,35(3):467−476.] HOU M N, HOU S P, LIANG R F, et al. Optimization of microwave processing technology for honey roast Astragalus membranaceus by response surface method combined with overall desirability and normalization method with multi-index[J]. Natural Product Research and Development, 2023, 35(3): 467−476.
[34] 卫阳飞, 宋海, 宗盈晓, 等. 分级醇沉柳茶多糖的含量与单糖组成及抗氧化性研究[J]. 华西药学杂志,2018,33(6):599−603. [WEI Y F, SONG H, ZONG Y X, et al. Study on the content, monosaccharide composition and antioxidant activity of the Sibiraea angustata polysaccharides precipitated by gradient ethanol[J]. West China Journal of Pharmaceutical Sciences,2018,33(6):599−603.] WEI Y F, SONG H, ZONG Y X, et al. Study on the content, monosaccharide composition and antioxidant activity of the Sibiraea angustata polysaccharides precipitated by gradient ethanol[J]. West China Journal of Pharmaceutical Sciences, 2018, 33(6): 599−603.
[35] SLANC P, DOLJAK B, MLINARIČ A, et al. Screening of wood damaging fungi and macrofungi for inhibitors of pancreatic lipase[J]. Phytotherapy Research,2004,18:758−762. doi: 10.1002/ptr.1548
[36] 俞耀文, 戴国庆, 华浩立, 等. 乙醇-硫酸铵双水相体系提取桃花总黄酮及其抗氧化性能[J]. 食品工业科技,2022,43(4):187−195. [YU Y W, DAI G Q, HUA H L, et al. Ethanol-ammonium sulfate aqueous two-phase extraction of total flavonoids from Peach Blossom and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(4):187−195.] YU Y W, DAI G Q, HUA H L, et al. Ethanol-ammonium sulfate aqueous two-phase extraction of total flavonoids from Peach Blossom and its antioxidant activity[J]. Science and Technology of Food Industry, 2022, 43(4): 187−195.
[37] VAKILI H, TALEBPOUR Z, HAGHIGHI F. Development, validation, and uncertainty measurement of HPLC-DAD method for determination of some free amino acids in infant formula and medical food products for inborn errors of metabolism[J]. Food Chemistry, 2022, 390:133204.
[38] AGUILERA-ANGEL E Y, ESPINAL-RUIZ M, NARVÁEZ-CUENCA C E. Pectic polysaccharides with different structural characteristics as inhibitors of pancreatic lipase[J]. Food Hydrocolloids,2018,83:229−238. doi: 10.1016/j.foodhyd.2018.05.009





 下载:
下载:









 下载:
下载:



