Flavanomarein Protects HT22 Cells by Inhibiting LPS-induced Inflammatory Activation of BV2 Cells
-
摘要: 目的:探讨黄诺玛苷通过抑制脂多糖(LPS)诱导的小鼠小胶质细胞(BV2)炎症反应,对小鼠海马神经元细胞(HT22)的保护作用以及相关机制。方法:BV2细胞分为正常组(Con),模型组(LPS 1 µg/mL),黄诺玛苷(flavanomarein,FL)低、中、高剂量组(50、100、200 µmol/L),TLR4抑制剂组(TAK,10 µmol/L),抑制剂+黄诺玛苷组(TAK+FL,10 µmol/L+200 µmol/L)。检测细胞存活率、细胞上清液中NO、肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)的含量,Western blot检测BV2细胞中TLR4、Myd88、NF-кB、p-NF-кB蛋白表达。各组BV2细胞上清作为条件培养基(CM)作用于HT22细胞,检测细胞活力并进行形态学观察,Western blot检测HT22细胞中Bax、Bcl-2、cleaved-Caspase-3、Caspase-3蛋白表达。结果表明,不同浓度的FL干预BV2细胞,与Con组相比,细胞存活率无显著性差异。与LPS组相比,FL(200 µmol/L)组NO释放量、TNF-α和IL-6分泌量均显著性降低(P<0.001)。Western blot结果表明,FL各组TLR4、Myd88、NF-κBp65、p-NF-κBp65的蛋白表达均降低。条件培养基(CM)处理后,与CM-Con组相比,CM-LPS组中HT22细胞存活率显著性降低(P<0.001),细胞皱缩,破裂较多;CM-FL的不同剂量组HT22细胞存活率逐渐恢复,呈现剂量依赖性,细胞形态逐渐恢复,呈现梭形。Western blot结果表明,与CM-Con组相比,CM-LPS中cleaved-Caspase3和Bax表达升高,Bcl-2表达降低,FL会逆转上述蛋白的表达情况。综上,黄诺玛苷可以通过抑制神经炎症,进而保护神经细胞。Abstract: Objective: To investigate the protective effects of flavonomaside on HT22 mouse hippocampal neuronal cells by inhibiting the inflammatory response induced by lipopolysaccharide (LPS) in mouse microglia (BV2) and elucidate the underlying mechanisms. Methods: BV2 cells were categorized into control (Con), LPS model (1 μg/mL), flavonomaside low, medium, and high dose groups (50, 100, 200 μmol/L respectively), TLR4 inhibitor group (TAK, 10 μmol/L), and TAK+flavonomaside group (10 μmol/L+200 μmol/L). Nitric oxide (NO), tumor necrosis factor-alpha (TNF-α), and interleukin-6 (IL-6) levels in supernatants and cell viability were quantified. Western blot assessed the protein levels of TLR4, Myd88, NF-κB p65, and phosphorylated NF-κB p65 in BV2 cells. The BV2 cell supernatant from each group acted as conditioned medium (CM) on HT22 cells to measure cell viability and observe morphological changes. Western blot also detected the protein levels of Bax, Bcl-2, cleaved Caspase-3, and Caspase-3 in HT22 cells. Results: No significant difference in BV2 cell viability was observed with varying flavonomaside concentrations compared to the Con group. The flavonomaside (200 μmol/L) group showed a significant reduction in NO, TNF-α, and IL-6 secretion compared to the LPS group (P<0.001). Western blot results indicated significant differences in TLR4, Myd88, NF-κB p65, and phosphorylated NF-κB p65 protein levels in the flavonomaside groups, respectively. Compared to the CM-Con group, HT22 cell viability significantly decreased in the CM-LPS group (P<0.001), with cells exhibiting more shrinkage and rupture. HT22 cell viability in the CM-flavonomaside groups gradually improved in a dose-dependent manner, with cell morphology progressively normalizing to a spindle shape. Western blot analysis revealed increased expression of cleaved Caspase-3 and Bax and decreased Bcl-2 expression in the CM-flavonomaside groups compared to the CM-Con group, indicating flavonomaside's reversal of protein expression changes. In conclusion, flavonomaside can protect nerve cells by inhibiting neuroinflammation.
-
Keywords:
- flavanomarein /
- neuroinflammation /
- conditioned medium /
- TLR4 /
- apoptosis
-
神经炎症是一种防御机制,通过去除或抑制各种病原体来保护大脑[1]。持续的炎症反应涉及小胶质细胞和星形胶质细胞,这些细胞激活后会产生大量的炎症细胞因子和活性氧(ROS),从而可能破坏血脑屏障(BBB),吸引一些外周免疫细胞如单核细胞、巨噬细胞、中性粒细胞和T细胞加入中枢神经系统,加重炎症反应[2−5]。白质神经炎症失调是痴呆患者神经病理学的关键特征[6],可以通过将培养细胞(如小胶质细胞)暴露于感染性刺激来模拟。作为一种配体[7],LPS通过结合并激活TLR4和CD14等受体,引起小胶质细胞的炎症反应,可以通过条件培养基处理或共培养系统来研究[3,8−9]。该信号通路主要包括MyD88和活化B细胞的核因子NF-κB,促进几种促炎细胞因子的产生,导致神经炎症[10−11]。
在炎症刺激的反应中,小胶质细胞产生促炎细胞因子,如TNF-α、IL-1β、IL-16和趋化因子[12]。此外,小胶质细胞中溶酶体酸化的缺陷通过各种细胞途径导致神经炎症和神经退行性病变[13]。具有溶酶体酸化缺陷的小胶质细胞产生更多的炎症性细胞因子,参与和星形胶质细胞的有害串扰,从而加剧神经炎症[14−16],并通过坏死等机制诱导神经元凋亡[17−18]。凋亡途径引起的信号会影响线粒体,因此细胞凋亡的内在途径被称为线粒体途径[19]。
促凋亡蛋白Bak、Bax和Bok发生异同源齐聚,导致大孔的形成,使来自线粒体膜间空间的蛋白质进入细胞底[19−22]。Bax和Bcl-2会激活Pro-caspase-3,转化为效应蛋白Caspase-3,Caspase-3的过度激活可能导致细胞过度凋亡,使神经元细胞发生级联Caspase凋亡反应机制[23]。
黄诺玛苷是两色金鸡菊总黄酮中的有效成分之一,能够改善胰岛素分泌,促进细胞增殖,通过Syk/TGF-β1/Smad细胞通路抑制上皮细胞间质转型[24],促进胰岛素瘤细胞增殖[25]。保护PC12细胞和降低神经元的神经毒性[26−27]。但对于黄诺玛苷研究抗炎活性机制研究还需更进一步。本研究通过LPS诱导建立BV2炎症细胞模型,黄诺玛苷处理后的条件培养基加入HT22细胞,模拟脑部小胶质细胞和神经细胞所处的神经炎症病理环境,探讨黄诺玛苷通过抑制胶质细胞炎症反应保护神经细胞的作用机制,为黄诺玛苷在抗炎方向的应用提供理论基础。
1. 材料和方法
1.1 材料与仪器
黄诺玛苷(flavanomarein,FL,批号:Y08D9H77234,HPLC≥98%) 上海源叶生物科技有限公司;临用前用二甲基亚砜配制成10 mg/mL的母液,−20 ℃冻存;BV2细胞(CL-0493)、HT22细胞(CL-0697) 均购自武汉普诺赛生命科技有限公司;试剂胎牛血清(批号:1205331) 美国Gibco公司;BV2细胞专用培养基(批号:WH2223C294)、DEME培养基(批号:8122691) 武汉普诺赛生命科技有限公司;LPS(批号:324T033) 北京索莱宝公司;MTS(批号:0000330384) 美国Promrga公司;Griess试剂盒(批号:060322220606) 碧云天生物技术有限公司;TLR4抑制剂(TAK-242,批号:66229) 美国MedChemExpress;TNF-α、IL-6试剂盒(批号:UX0386F45632、UX01RP223375)、ECL发光液(批号:AK10325)、CCK8(批号:E-CK-A362) 武汉伊莱瑞特生物科技有限公司;抗体Myd88、NF-κBp65、pNF-κBp65 美国CST公司;抗体TLR4、Bax、Bcl-2、cleaved-Caspase-3、Caspase-3 美国Affnitty抗体公司;抗体β-actin、羊抗兔HRP标记二抗、双抗(批号:Q20209)、胰酶(批号:#R81010) 北京全式金生物技术有限公司。
HERAcell 150i CO2培养箱 美国Thermo公司;Cytation3多功能酶标仪 美国伯腾公司;DSY2000X倒置荧光显微镜 重庆澳浦光电技术有限公司;TDZ5-WS多管架自动平衡离心机 上海卢湘仪离心机仪器有限公司;H1650R低温离心机 上海卢湘仪离心机仪器有限公司;041BR337465电泳仪 美国伯乐;AI085发光仪 美国GE healthcare。
1.2 实验方法
1.2.1 细胞培养
将购买的细胞进行传代、扩种之后,用BV2细胞专用培养基混悬BV2细胞,37 ℃、5% CO2培养箱培养,2~3 d换液和传代1次。用10% FBS、100 μg/mL青霉素和100 μg/mL链霉素修饰DMEM培养基混悬HT22细胞,37 ℃、5% CO2培养箱中培养,2~3 d换液和传代1次[28]。
1.2.2 FL对BV2细胞存活率的影响
观察BV2细胞长到80%或90%的密度时,以1.5×104个接种在96孔板中,培养24 h,实验分为对照组(Con,给予完全培养基)和FL不同浓度组(200、100、50、25、12.5、6.25 µmol/L),每组3个复孔,继续培养24 h。吸出培养液,加入100 μL的10% MTS,37 ℃孵育2 h,于490 nm处测定各孔吸光度值,计算各组细胞存活率[29]。
细胞存活率(%)=OD实验组−OD空白组OD对照组−OD空白组×100 1.2.3 FL对BV2细胞中NO生成量的影响
采用Griess法检测NO的生成,将BV2细胞以1.5×104个接种于96孔细胞培养板中,分别设立对照组(Con,给予完全培养基),模型组(LPS,1 μg/mL),TAK-242抑制剂组(TAK,10 µmol/mL),抑制剂+药组(TAK+FL,10 µmol/L+200 µmol/L),FL处理组(终浓度分别为200、100、50 µmol/L),每组设3个复孔,用FL和抑制剂预处理2 h后再加入LPS(1 μg/mL)刺激24 h。将相同体积的Griess试剂Ⅰ与Griess试剂Ⅱ按照顺序加入后,避光,于540 nm处检测吸光度[30]。
1.2.4 FL对BV2细胞中IL-6、TNF-α含量的影响
观察BV2细胞长到80%或90%的状态,以2×105个接种在6孔板中,培养24 h,实验分组同1.2.3,用FL和抑制剂预处理2 h后再加入LPS(1 μg/mL)刺激24 h,收集细胞培养基上清,按照酶联免疫吸附分析(ELISA)试剂盒测定IL-6、TNF-α含量水平。
1.2.5 FL对BV2细胞中TLR4\Myd88\NF-κB通路表达的影响
按照1.2.3实验分组进行实验,收集各组细胞进行裂解,裂解后的细胞组织于4 ℃,12000 r/min离心10 min,取上清,进行蛋白质BCA含量测定后,加入适量上样缓冲液,金属浴10 min后离心取上清上样,每孔上样量10 μg蛋白。将配制好的PAGE胶放入电泳槽中,加入一定量电泳缓冲液进行电泳,当染料达到胶底部时结束电泳。开始电转,分离转移到PVDF膜上后,用5%脱脂奶粉室温封闭1 h,根据相应条件稀释一级抗体(Myd88、NF-κBp65、p-NF-κBp65、TLR4、β-actin)和膜在4 ℃孵育过夜。与HRP标记的二抗在室温下孵育1 h后,加入ECL显色液,将其放入成像仪中进行成像。
1.2.6 FL对HT22细胞存活率的影响
CCK8法测定FL对HT22细胞的存活率影响。观察HT22细胞长到80%或90%的状态,以5×103个接种在96孔细胞培养板中,培养24 h,实验分为对照组(Con,给予完全培养基),FL(200、100、50 µmol/L),每组3个复孔,继续培养24 h,吸出培养液。加入100 μL的10% CCK8,37 ℃孵育30 min,于450 nm处测定各孔吸光度值,计算各组细胞存活率[31]。
1.2.7 各组条件培养基(conditioned medium,CM)处理后HT22细胞存活率测定
按照1.2.3实验方法处理BV2细胞,观察HT22细胞长到80%或90%的状态,以5×103个接种在96孔细胞培养板中,培养24 h后,设立条件培养基对照组(CM-Con,给予BV2细胞对照组培养基),模型组(CM-LPS给予BV2LPS组培养基),TAK-242抑制剂组(CM-TAK,给予BV2抑制剂组培养基),抑制剂和药组(CM-TAK+FL,给予BV2抑制剂+FL培养基),FL处理组(CM-FL200,CM-FL100,CM-FL50,给予BV2CM给药组培养基),每组设3个复孔,继续培养24 h。吸出培养液。加入100 μL的10% CCK8,37 ℃孵育30 min,于450 nm处测定各孔吸光度值,计算各组细胞存活率。
1.2.8 CM-FL处理对HT22细胞形态的影响
按照1.2.1实验方法处理BV2细胞,同时将HT22细胞以9×104个接种在6孔细胞培养板中,培养24 h后,将BV2细胞的条件培养基(CM)加入HT22细胞中,继续培养24 h后,用显微镜摄像头进行HT22细胞的形态学观察。
1.2.9 CM-FL处理对HT22细胞中Bax\Bcl-2\Caspase-3通路表达的影响
按照1.2.8的方法处理BV2细胞和HT22细胞后,收集各组HT22细胞进行裂解,裂解后的细胞组织于4 ℃,12000 r/min离心10 min,取上清,进行蛋白质BCA含量测定后,加入适量上样缓冲液,金属浴10 min后离心取上清上样每孔上样量6 μg蛋白。将配制好的PAGE胶放入电泳槽中,加入一定量电泳缓冲液进行电泳,当染料达到胶底部时结束电泳。开始电转,分离转移到PVDF膜上后,用5%脱脂奶粉室温封闭2 h,根据相应条件稀释一级抗体(Bax、Bcl-2、cleaved-Caspase-3、Caspase-3、β-actin)和膜在4 ℃孵育过夜。与HRP标记的二抗在室温下孵育1 h后,加入ECL显色液,将其放入成像仪中进行成像。
1.3 数据处理
本研究获得的所有数据均经统计学处理,数据结果以平均值±标准差表示。比较ANOVA单因素方差分析,统计软件采用SPSS26.0,P<0.05,数据结果有统计学意义,采用GraphPad Prism8.0软件绘图。
2. 结果与分析
2.1 FL对BV2细胞存活率的影响
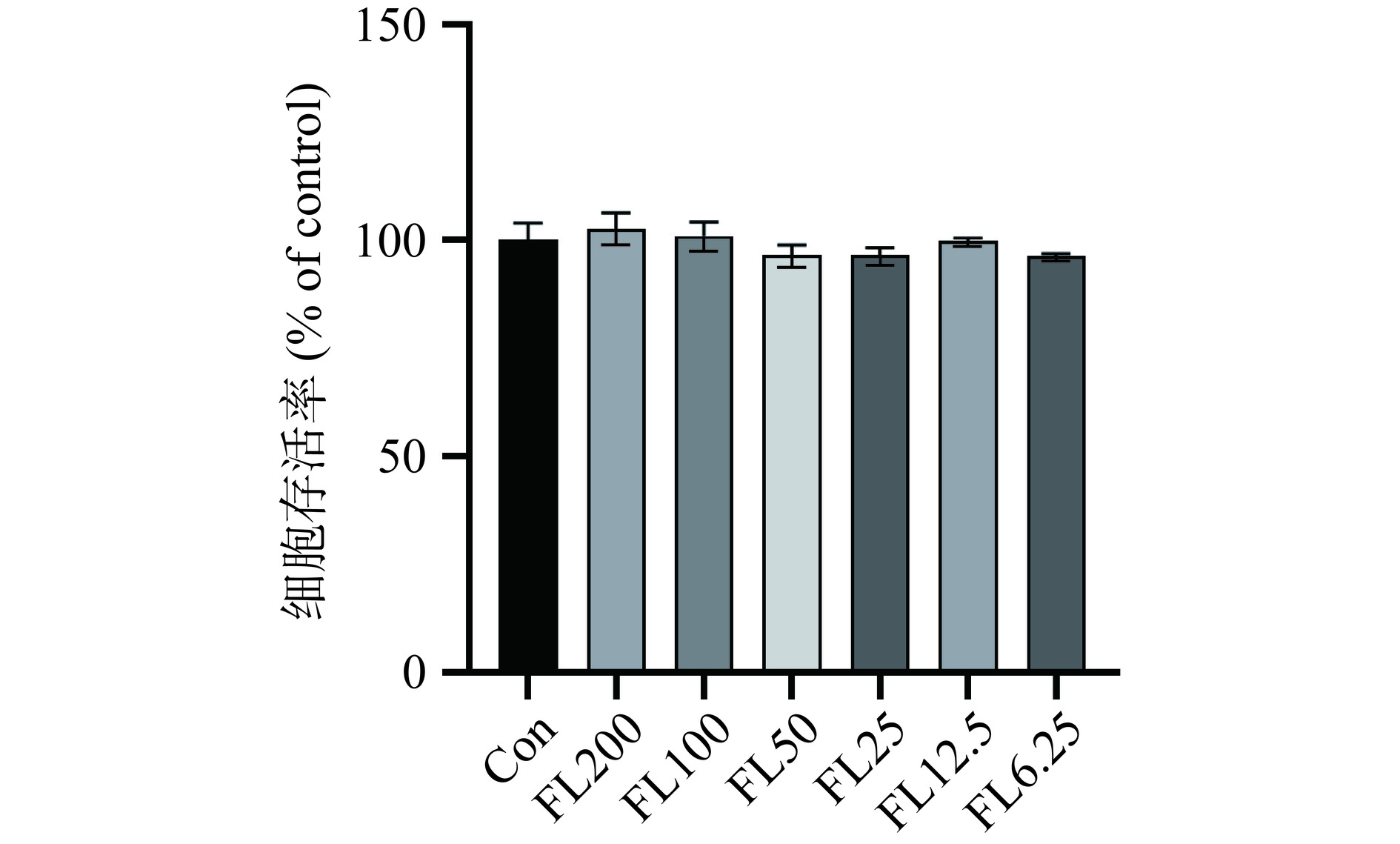
有研究表明,FL是两色金鸡菊总黄酮中的活性成分之一,具有一定的抗炎活性[32]。细胞存活率可以反应细胞在该条件下的存活状态,从而判断其药物对细胞存活率的影响。如图1所示,发现FL的不同剂量组与Con组相比无显著性差异(P>0.05),结果表明不同剂量的FL对BV2细胞无显著增殖作用。
2.2 FL对LPS诱导BV2细胞的NO释放量的影响
BV2细胞经过LPS诱导后,NO释放量增加,从而检测NO指标可作为判断BV2炎症细胞模型是否成功的指标。如图2所示,LPS组与Con组相比,具有极显著性差异(P<0.001),表明经LPS诱导BV2细胞后,形成神经炎症模型。与LPS组相比,TAK组、TAK+FL组、FL200组的NO释放量极显著降低(P<0.01,P<0.001),F100、F50剂量组与LPS组差异不显著。表明适宜剂量的FL能够降低BV2细胞炎症模型NO释放量。
2.3 FL对LPS诱导BV2细胞分泌IL-6和TNF-α的影响
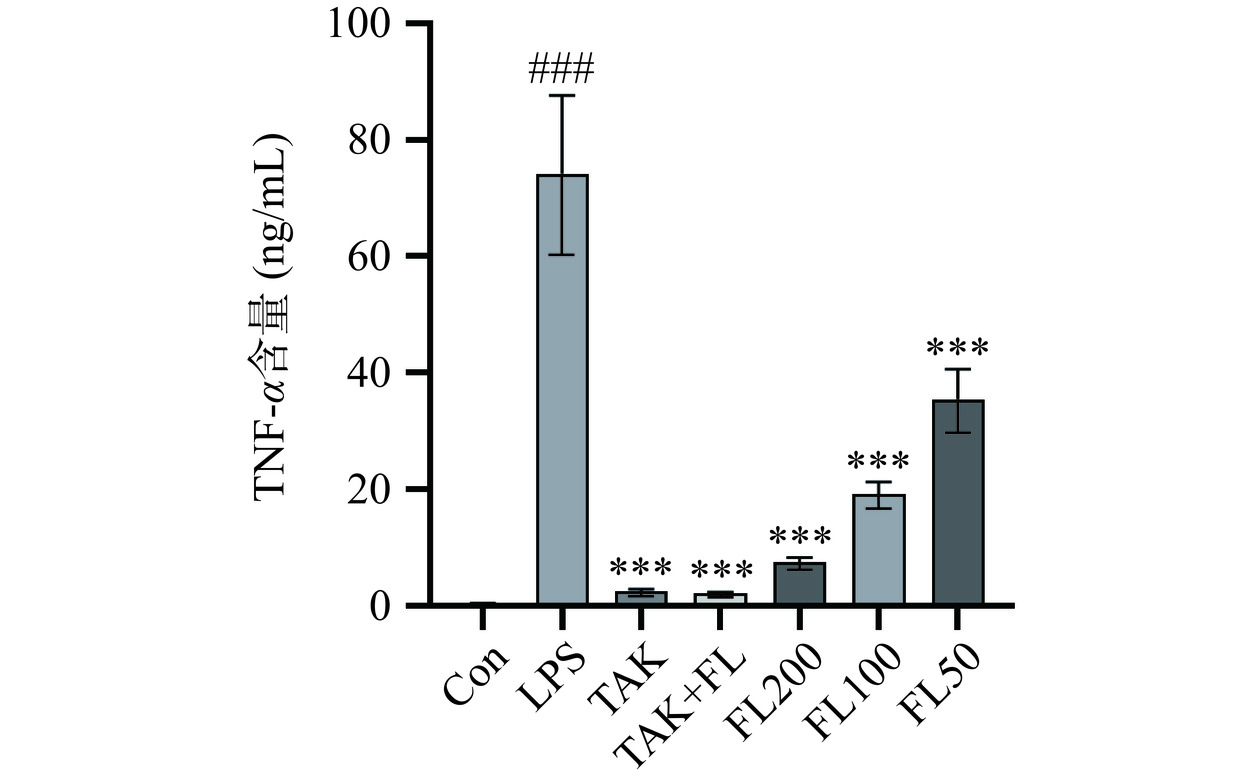
如图3~图4所示,与Con组相比,LPS组的TNF-α和IL-6含量显著增加(P<0.001),与LPS组相比,TAK、TAK+FL、FL高中低剂量组均能极显著降低IL-6和TNF-α分泌(P<0.001)。实验结果表明,不同浓度的FL能够有效降低LPS诱导BV2细胞分泌炎症因子。FL和TAK具有相同的效果,可能通过降低TLR4通路蛋白的表达,从而减少促炎因子的分泌[18]。
2.4 FL对LPS诱导的BV2细胞中TLR4/Myd88/NF-κB通路的影响
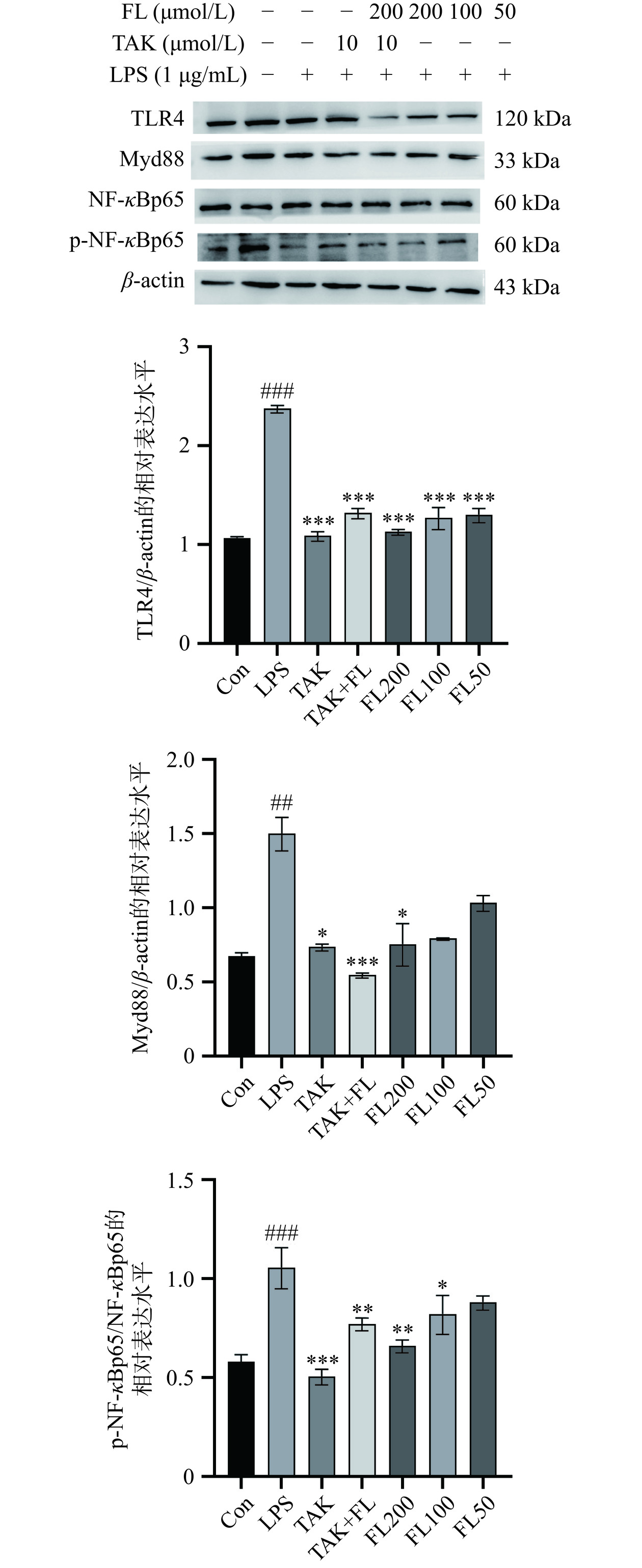
如图5所示,与Con组相比,LPS组中TLR4、Myd88和p-NF-κBp65表达水平显著升高(P<0.001,P<0.01),而与LPS组相比,TAK、TAK+FL、FL200、FL100和FL50能够极显著降低TLR4的表达水平(P<0.001),其中,TAK、TAK+FL和FL200可以显著降低TLR4下游的Myd88的表达(P<0.05,P<0.001,P<0.05),TAK、TAK+FL、FL200、F100显著抑制NF-κBp65的磷酸化(P<0.001,P<0.01,P<0.05)。实验结果表明,LPS处理的BV2细胞中TLR4、Myd88和p-NF-κBp65蛋白表达量较空白组升高,而TAK组、TAK+FL组和适宜剂量FL均可明显下调TLR4和Myd88的蛋白表达,并抑制NF-κBp65的磷酸化。推测FL能够影响TLR4/Myd88/NF-κB信号通路,发挥抗炎作用。
2.5 FL对HT22细胞存活率的影响
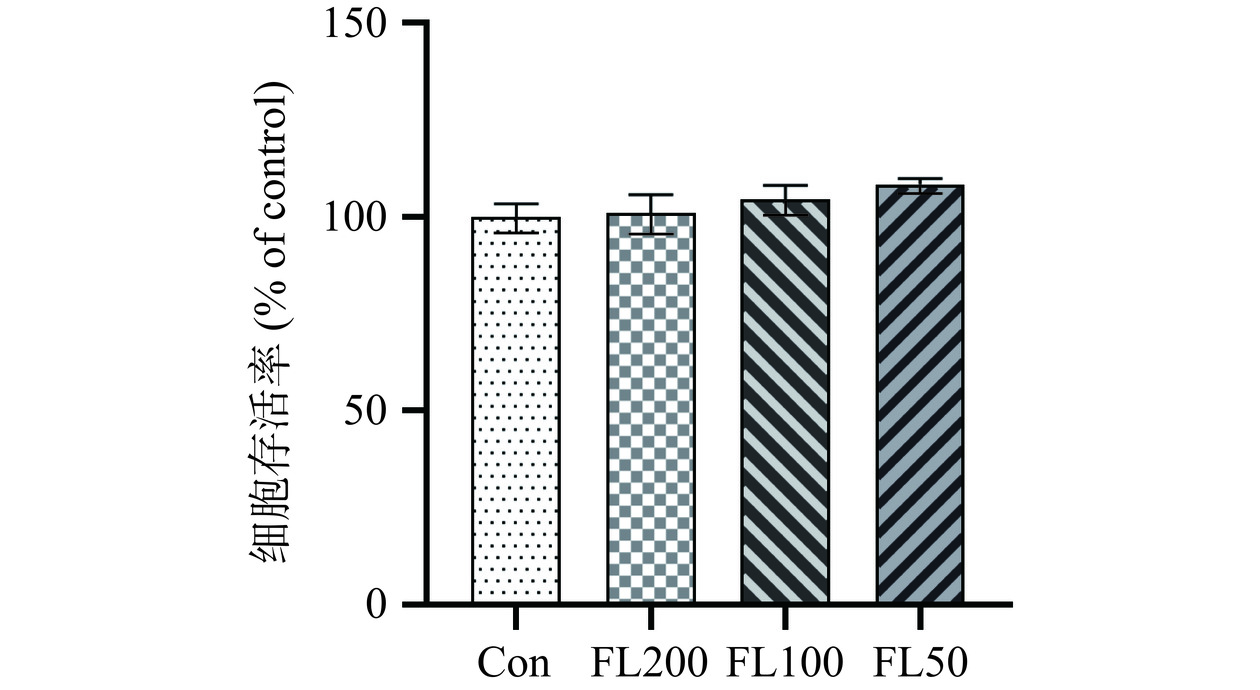
将FL(200、100、50 µmol/L)加入HT22细胞后,如图6所示,与Con组相比,FL各个剂量组的细胞存活率无显著性差异(P>0.05),表明FL不会促进HT22细胞的增殖。
2.6 CM-FL处理对HT22细胞存活率的影响
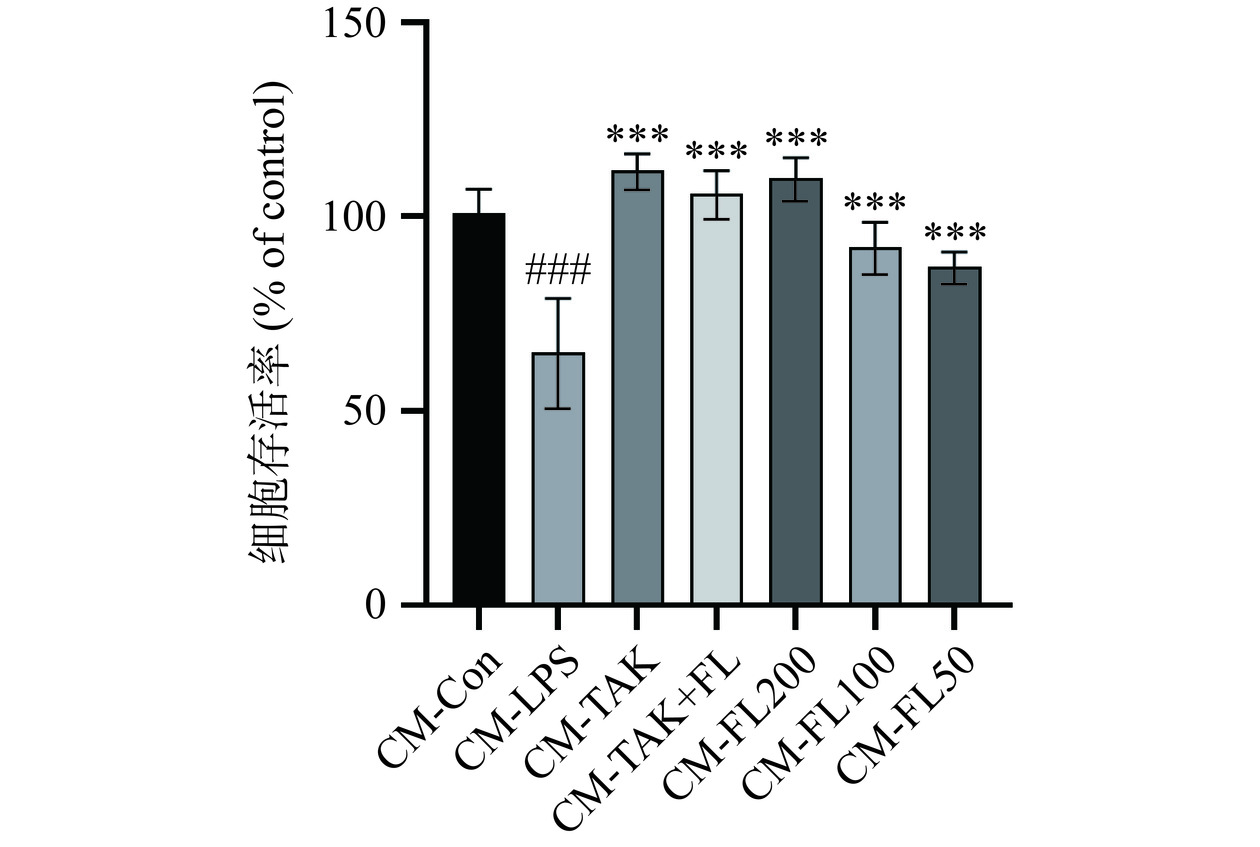
如图7所示,与CM-Con组相比,CM-LPS组的细胞存活率显著下降(P<0.001),推测LPS组的BV2细胞分泌的炎症因子降低了HT22细胞的存活率,而CM-TAK、CM-TAK+FL、CM-FL(200、100、50)与CM-LPS组相比细胞存活率显著上升(P<0.001),推测经过TAK和FL的干预,BV2细胞的炎症因子分泌降低,从而增加HT22细胞的存活率。
2.7 CM-FL处理对HT22细胞形态的影响
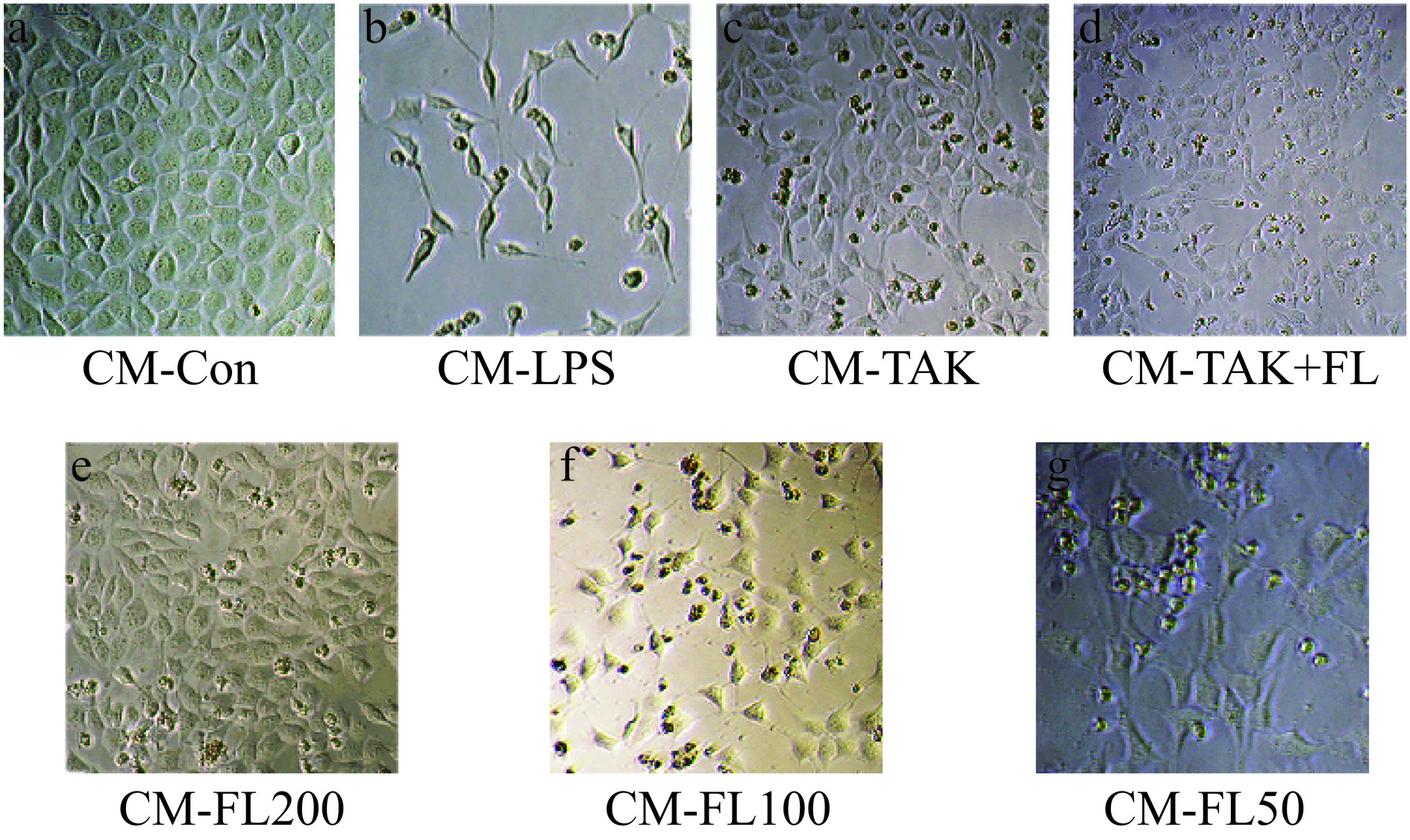
由图8可知,CM-Con组HT22细胞,贴壁生长,排列紧密,边界清晰,呈梭形;加入CM-LPS后HT22细胞形态产生皱缩破损,突触变长;CM-TAK组的细胞形态清晰,排列紧密。而CM-FL低、中、高剂量组中HT22形态逐渐清晰,细胞排列紧密,活力逐渐增加。实验结果推测FL通过抑制BV2细胞的TLR4/Myd88/NF-кB蛋白的表达,减少炎症因子的分泌,从而使在CM中的HT22细胞形态趋向于正常组。
2.8 CM-FL对HT22细胞Bax\Bcl-2\Caspase-3通路表达的影响
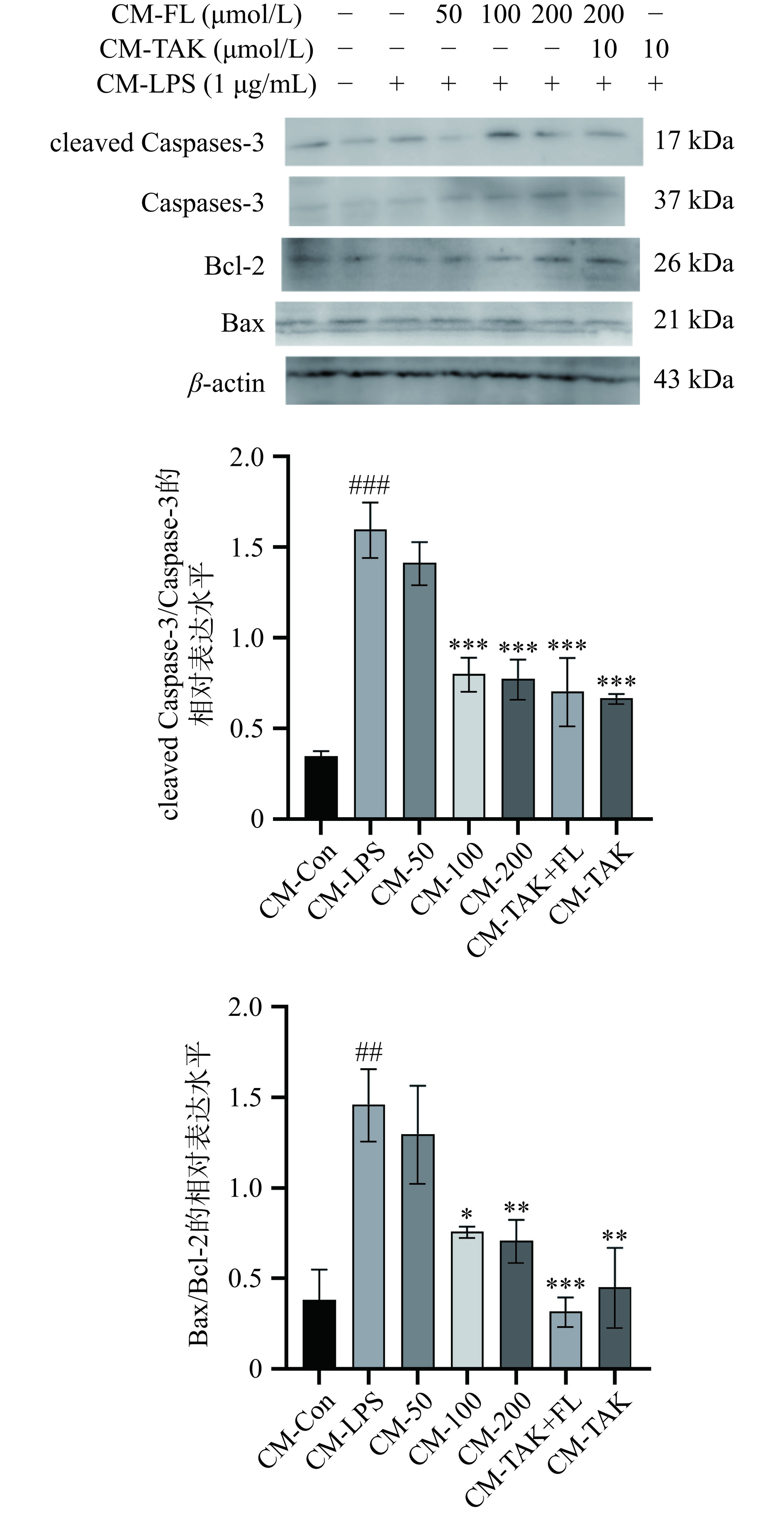
Bcl-2蛋白家族参与了细胞存活相关的各种胞内途径,最突出的功能是调节凋亡的内在(线粒体)途径的启动[33]。BV2细胞经LPS诱导后会持续释放NO,激活TLR4通路从而分泌促炎因子,进而对HT22细胞产生神经毒性,发生凋亡。如图9所示,与CM-Con组相比,CM-LPS组HT22中cleaved-Caspase-3、Caspase-3和Bax表达升高(P<0.001),以及Bcl-2表达降低(P<0.01),而与CM-LPS组相比,CM-FL(200、100 µmol/L)、CM-TAK组(10 µmol/L)和CM-TAK+FL组(10 µmol/L+200 µmol/L)可逆转上述蛋白的表达。表明FL的处理会抑制BV2细胞中NO的释放量,减少促炎因子的分泌,抑制TLR4/Myd88/NF-κB通路的表达,抑制HT22细胞在BV2细胞的条件培养基中Bax/Bcl-2/Caspase-3通路的表达,最终产生对HT22细胞的保护作用。
3. 讨论与结论
本研究使用1 µg/mL的LPS诱导小胶质BV2细胞,建立神经炎症模型,研究FL对神经炎症体外模型的保护作用,在考察BV2细胞条件培养基对HT22细胞的影响时,发现TAK+FL组与TAK组相比,药效略低,和理想化结果有差别。当加入TAK后与TLR4结合后,阻断TLR4通路下游蛋白的表达,产生抗炎作用。推测同时加入TAK和FL后,部分TAK与部分FL与TLR4结合,未完全阻断TLR4通路下游蛋白的表达,抗炎作用与TAK组相比降低。
综上所述,FL能够抑制LPS诱导BV2细胞的过度炎症反应,保护HT22细胞凋亡,其作用机制为:FL能够调节TLR4/Myd88/NF-κB信号通路,降低BV2细胞的促炎因子分泌,使HT22细胞在BV2细胞的条件培养基中,活力增强,细胞形态逐渐清晰,抑制线粒体Bax/Bcl-2/Caspase-3通路表达,从而对HT22细胞起到保护作用。本研究为天然产物抗神经炎症的应用提供了支持,其作用途径的初步阐述为将来针对神经炎症的新药研发提供了可选的靶标蛋白。完全阐明FL抗神经炎症的作用机制,仍然需要深入而系统的工作。通过科学手段进一步剖析FL与TLR4的相互作用,以参与小胶质细胞炎性活化为调控点,可以通过分子对接等对FL与TLR4的直接结合进行预测,也可以探讨FL对其他抗炎通路的影响,为抗神经炎症新药的研发奠定理论基础。
-
-
[1] LENG F D, HINZ R, GENTLEMAN S, et al. Neuroinflammation is independently associated with brain network dysfunction in Alzheimer's disease[J]. Molecular Psychiatry,2023,28(3):1303−1311. doi: 10.1038/s41380-022-01878-z
[2] TING Y, RAVIKANTH V, NICCOLÒ T. Neuroinflammation after surgery:From mechanisms to therapeutic targets[J]. Nature Immunology,2020,21(11):1319−1326. doi: 10.1038/s41590-020-00812-1
[3] QUICK J D, SILVA C, WONG J H, et al. Lysosomal acidification dysfunction in microglia:An emerging pathogenic mechanism of neuroinflammation and neurodegeneration[J]. Journal of Neuroinflammation,2023,20(1):185−190. doi: 10.1186/s12974-023-02866-y
[4] ZHANG W F, XIAO D, MAO Q W, et al. Role of neuroinflammation in neurodegeneration development[J]. Signal Transduction and Targeted Therapy,2023,8(1):267−273. doi: 10.1038/s41392-023-01486-5
[5] LEE E C, HONG D Y, LEE D H, et al. Inflammation and rho-associated protein kinase-induced brain changes in vascular dementia[J]. Biomedicines,2022,10(2):446. doi: 10.3390/biomedicines10020446
[6] DU Y Y, YAN T X, WU B, et al. Research on the mechanism of antidepressive effect of suanzaoren decoction through TLR4/MyD88/NF-κB pathway and Wnt/β-catenin pathway[J]. Journal of Ethnopharmacology,2024,319:117190. doi: 10.1016/j.jep.2023.117190
[7] ROMAIN B, JOHANA B, JULIE D, et al. Drug interactions with dementia-related pathophysiological pathways worsen or prevent dementia[J]. Br J Pharmacol,2019,176(18):3413−3434. doi: 10.1111/bph.14607
[8] SAGGU R, SCHUMACHER T, GERICH F, et al. Astroglial NF-κB contributes to white matter damage and cognitive impairment in a mouse model of vascular dementia[J]. Acta Neuropathologica Communications,2016,4:1−10. doi: 10.1186/s40478-015-0269-0
[9] SONG Q, GOU W L, ZHANG R. FAM3A Protects HT22 cells against hydrogen peroxide-induced oxidative stress through activation of PI3K/Akt but not MEK/ERK pathway[J]. Cell Physiol Biochem,2015,37(4):1431−1441. doi: 10.1159/000438512
[10] CHEN Y J, YU Y. Tau and neuroinflammation in Alzheimer's disease:Interplay mechanisms and clinical translation[J]. Journal of Neuroinflammation,2023,20(1):165. doi: 10.1186/s12974-023-02853-3
[11] CANDELARIO-JALILl E, DIJKHUIZEN R M, MAGNUS T. Neuroinflammation, stroke, blood-brain barrier dysfunction, and imaging modalities[J]. Stroke,2022,53(5):1473−1486. doi: 10.1161/STROKEAHA.122.036946
[12] DIANA L A, MARIO D N, KUNAL B, et al. Neuroinflammation in acute ischemic and hemorrhagic stroke[J]. Current Neurology and Neuroscience Reports,2023,23(8):407−431. doi: 10.1007/s11910-023-01282-2
[13] YUN H S, OH J, LIM J S, et al. Anti-inflammatory effect of wasp venom in BV-2 microglial cells in comparison with bee venom[J]. Insects,2021,12(4):297. doi: 10.3390/insects12040297
[14] JACQUES M T, SASO L, FARINA M. LPS-activated microglial cell-derived conditioned medium protects HT22 neuronal cells against glutamate-induced ferroptosis[J]. International Journal of Molecular Sciences,2023,24(3):2910. doi: 10.3390/ijms24032910
[15] HUANG J, ZHOU L, CHEN J L, et al. Hyperoside attenuate inflammation in HT22 cells via upregulating SIRT1 to activities Wnt/β-catenin and sonic hedgehog pathways[J]. Neural Plasticity,2021,2021(1):123−128.
[16] KIM K Y, HWANG S K, PARK S Y, et al. L-Serine protects mouse hippocampal neuronal HT22 cells against oxidative stress-mediated mitochondrial damage and apoptotic cell death[J]. Free Radical Biology and Medicine,2019,141:447−460. doi: 10.1016/j.freeradbiomed.2019.07.018
[17] DU D, YAO L B, ZHANG R, et al. Protective effects of flavonoids from Coreopsis tinctoria Nutt. on experimental acute pancreatitis via Nrf-2/ARE-mediated antioxidant pathways[J]. Journal of Ethnopharmacology,2018,224:261−272. doi: 10.1016/j.jep.2018.06.003
[18] HOU Y, LI G X, WANG J, et al. Okanin, effective constituent of the flower tea Coreopsis tinctoria, attenuates LPS-induced microglial activation through inhibition of the TLR4/NF-κB signaling pathways[J]. Scientific Reports,2017,7(1):45705. doi: 10.1038/srep45705
[19] MOHANY M, AHMED M M, AI-REJAIE S S. The role of NF-κB and Bax/Bcl-2/Caspase-3 signaling pathways in the protective effects of sacubitril/Valsartan (Entresto) against HFD/STZ-Induced diabetic kidney disease[J]. Biomedicines,2022,10(11):2863. doi: 10.3390/biomedicines10112863
[20] GAO L W, GUO X, LIU S, et al. Neuroprotective role of DL-3-n-butylphthalide via the Nrf2/SIRT3 pathway in a mouse model of vascular dementia[J]. Brain Research,2022,1779(7):147785.
[21] CHANG S Q, LI X, ZHENG Y C, et al. Kaempferol exerts a neuroprotective effect to reduce neuropathic pain through TLR4/NF-κB signaling pathway[J]. Phytotherapy Research,2022,36(4):1678−1691. doi: 10.1002/ptr.7396
[22] BAI Y, LIU Y H, LIN L H, et al. Ginsenoside CK induces the mitochondrial apoptosis in glioma cells through the activation of the p53-Bax-caspase pathway[J]. Pharmacognosy Magazine,2024,20(2):505−515. doi: 10.1177/09731296231203457
[23] YANG J L, JIA Z X, XIAO Z G, et al. Baicalin rescues cognitive dysfunction, mitigates neurodegeneration, and exerts anti-epileptic effects through activating TLR4/MYD88/Caspase-3 pathway in rats[J]. Drug Design, Development and Therapy,2021,3(8):3163−3180.
[24] ZHANG N, KANG J, LIU S S, et al. Flavanomarein inhibits high glucose-stimulated epithelial-mesenchymal transition in HK-2 cells via targeting spleen tyrosine kinase[J]. Scientific Reports,2020,10(1):439. doi: 10.1038/s41598-019-57360-4
[25] DIAS T, LIU B, JONES P, et al. Cytoprotective effect of Coreopsis tinctoria extracts and flavonoids on tBHP and cytokine-induced cell injury in pancreatic MIN6 cells[J]. Journal of Ethnopharmacology,2012,139(2):485−492. doi: 10.1016/j.jep.2011.11.038
[26] LE L, FU H, LÜ Q Y, et al. The protective effects of the native flavanone flavanomarein on neuronal cells damaged by 6-OHDA[J]. Phytomedicine,2019,53:193−204. doi: 10.1016/j.phymed.2018.09.005
[27] 颜仁杰, 乐心逸, 于安伟, 等. 基于血清药物化学研究两色金鸡菊活性部位的降血脂活性成分[J]. 中国医药工业杂志,2016,47(11):1383−1387. [YAN R J, LE X Y, YU A W, et al. Based on serum pharmacochemistry, the active components of the active part of the two-color cinchilla were studied[J]. Chinese Journal of Pharmaceutical Industry,2016,47(11):1383−1387.] YAN R J, LE X Y, YU A W, et al. Based on serum pharmacochemistry, the active components of the active part of the two-color cinchilla were studied[J]. Chinese Journal of Pharmaceutical Industry, 2016, 47(11): 1383−1387.
[28] HEUMOS L, SCHAAR A C, LANCE C, et al. Best practices for single-cell analysis across modalities[J]. Nature Reviews Genetics,2023,24(8):550−572. doi: 10.1038/s41576-023-00586-w
[29] TANG J, CHEN R, WANG L L, et al. Melatonin attenuates thrombin-induced inflammation in BV2 cells and then protects HT22 cells from apoptosis[J]. Inflammation,2020,43(5):1959−1970. doi: 10.1007/s10753-020-01270-5
[30] JEONG Y H, OH Y C, KIM T I, et al. Neuroprotective and anti-neuroinflammatory properties of Vignae radiatae Semen in neuronal HT22 and microglial BV2 cell lines[J]. Nutrients,2022,14(24):52−65.
[31] KO W, YOON C S, KIM K W, et al. Neuroprotective and anti-inflammatory effects of Kuwanon C from Cudrania tricuspidata are mediated by heme oxygenase-1 in HT22 hippocampal cells, RAW264.7 macrophage, and BV2 microglia[J]. International Journal of Molecular Sciences,2020,21(14):4839. doi: 10.3390/ijms21144839
[32] MI Y, XU J K, SHI R J, et al. Okanin from Coreopsis tinctoria Nutt. alleviates cognitive impairment in bilateral common carotid artery occlusion mice by regulating the miR-7/NLRP3 axis in microglia[J]. Food & Function,2023,14(1):369−387.
[33] PETER E C, ANA J G-S. Mechanisms of BCL-2 family proteins in mitochondrial apoptosis[J]. Nature Reviews Molecular Cell Biology,2023,24(10):732−748. doi: 10.1038/s41580-023-00629-4
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:


 下载:
下载:



