Application of Gas Chromatography-Ion Mobility Spectroscopy for Honey Quality Evaluation
-
摘要: 蜂蜜具有丰富的营养成分和广泛的生物活性,但由于蜂蜜植物来源、地理来源、昆虫来源、成熟程度等的不同,蜂蜜在其内源成分和营养价值上表现出显著差异。挥发性有机化合物(volatile organic compounds,VOCs)与蜂蜜的特征属性密切相关,可用于表征蜂蜜间的差异。气相色谱-离子迁移谱联用技术(gas chromatography-ion mobility spectroscopy,GC-IMS)是一种将气相色谱技术与离子迁移谱技术相结合用于VOCs测定的新技术。近年来,GC-IMS被逐步应用于蜂蜜蜂种鉴定、产地溯源、植物来源区分、掺假鉴别、成熟度区分等方面,并均取得了较好的效果,在蜂蜜品质鉴评方面表现出了较大的应用潜力。本文收集了目前的文献资料,综述了GC-IMS在蜂蜜品质分析鉴别方面的应用研究进展,提出未来可考虑从建立蜂蜜GC-IMS数据库、研发融合定量功能的GC-IMS设备、开发基于GC-IMS的质量评价技术标准以及GC-IMS与其他风味检测技术联用等方面进行深入研究,以期为GC-IMS技术在蜂蜜的品质控制、风味研究、产品开发等方面提供参考。
-
关键词:
- 气相色谱-离子迁移谱 /
- 蜂蜜 /
- 品质鉴评 /
- 挥发性有机化合物
Abstract: Honey is rich in nutrients and has a wide range of biological activities. However, due to the different botanical origins, geographical origins, entomological origins, and maturity, honey shows significant differences in their endogenous compositions and nutritional values. Volatile organic compounds (VOCs) are closely related to the characteristic properties of honey, and can be used to characterize the differences between honey. Gas chromatography-ion mobility spectroscopy (GC-IMS) is a new technology which combines gas chromatography with ion mobility spectroscopy for the determination of VOCs. In recent years, GC-IMS has been gradually applied to entomological origins identification, geographical origin tracing, botanical origin differentiation, adulteration identification and maturity evaluation of honey, and has achieved good results, showing great application potential in honey quality evaluation. In this paper, the application research progress of GC-IMS for honey quality evaluation is summarized. It is suggested that future research should be carried out from the aspects of establishing honey GC-IMS database, developing GC-IMS equipment with fusion quantitative function, developing the technical standard of quality evaluation based on GC-IMS, and using GC-IMS in combination with other detection technologies, in order to provide reference for the application of GC-IMS for honey quality control, flavor research and product development. -
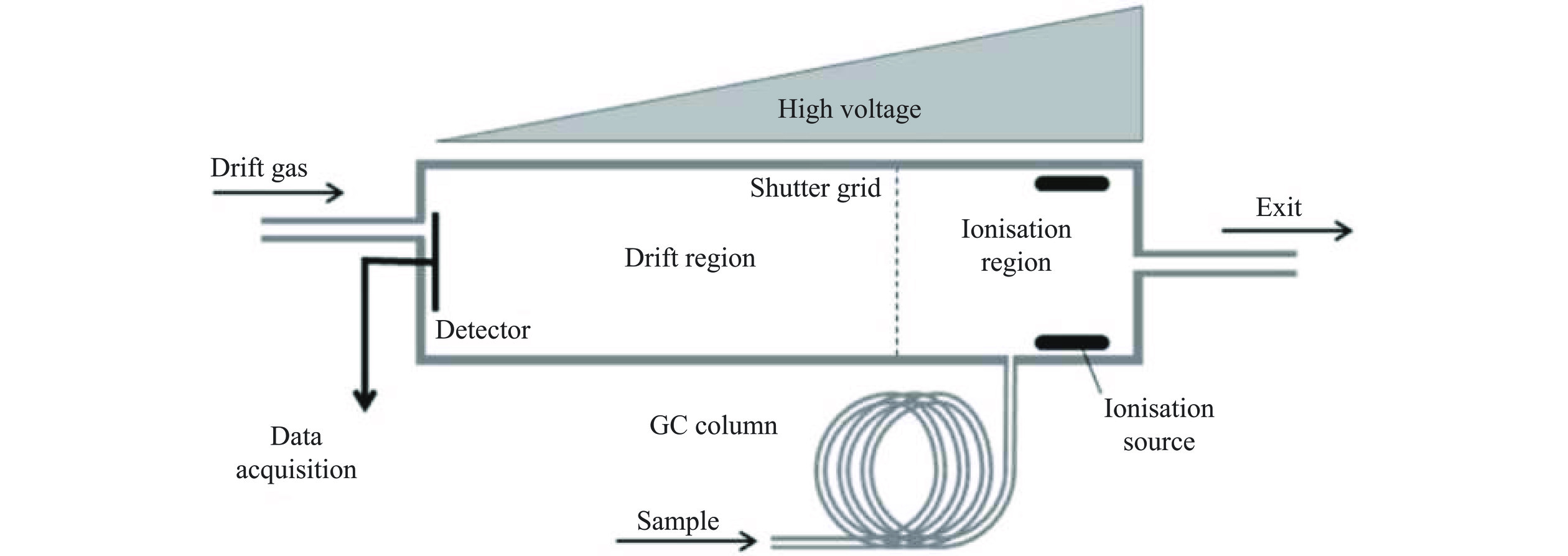
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质。蜂蜜化学成分复杂,营养丰富,含有糖类、有机酸、蛋白质、氨基酸、维生素、矿物质、类黄酮、酚酸和酶等[1−2],具有抗氧化、抗菌、抗炎等广泛的生物活性,是一种有益于健康的功能性天然食品[3−5]。值得注意的是,由于蜂蜜植物来源[6−7]、地理来源[8]、昆虫来源[9]、成熟程度[10]等的不同,蜂蜜在其内源成分和营养价值上表现出较大的差异,是影响蜂蜜质量的重要因素。挥发性有机化合物(volatile organic compounds,VOCs)构成蜂蜜的风味特征,反映了蜂蜜的感官品质,用于评估蜂蜜特性,与蜂蜜质量密切相关。据报道,蜂蜜中VOCs主要由醛类、醇类、醚类、酯类、酮类、呋喃类、烷烃类、羧酸类、萜烯类、非异戊二烯类等成分组成[11]。气相色谱-离子迁移谱联用技术(gas chromatography-ion mobility spectroscopy,GC-IMS)是一种将气相色谱技术与离子迁移谱技术联用的新技术[12],被应用于食品中VOCs的鉴定,其工作原理如图1所示。样品随载气进入仪器,首先经过气相色谱柱的初次分离,随后进入电离区,待测分子在电离区电离后,在电场和逆向漂移气的作用下迁移实现二次分离,到达检测器进行检测,无需任何特殊的样品前处理即可快速检测样品中的痕量VOCs[13−14],使得分离后所检测到的物质的化学信息更加丰富[15]。GC-IMS兼具了气相色谱和离子迁移谱的优势,与GC-MS侧重于定性和定量的准确性相比,GC-IMS更侧重于不同样本的差异性鉴别,同时,GC-IMS不需要真空条件,在常压下即可达到待测组分的高效分离[16],为便携性、高通量、低成本和易于操作的应用开发提供更多可能[17]。另外,GC-IMS与GC-MS技术对不同VOCs检出的灵敏度有所差异,GC-MS对分子量较大的化合物响应更高,而GC-IMS技术产生信号响应的多为小分子量化合物,其可视化的指纹图谱可更快速地筛选出特异性物质。两种技术结合,能够扩大样品中挥发性物质的检测范围,实现对样品中VOCs更加全面的解析[18−19]。
目前,GC-IMS广泛应用于肉蛋及其制品、水产品、果蔬制品、粮食及其制品、酒类、植物油等多类食品的真伪鉴别、品质鉴定、加工储藏控制、新鲜度检测等食品质量安全控制领域[20−21]。GC-IMS在蜂蜜中的应用主要集中在蜂种鉴定、产地溯源、植物来源、掺伪鉴别、成熟度区分等方面(表1),在对蜂蜜样品中VOCs进行测定的基础上,筛选出组间差异化的信号数据,运用化学计量学分析的相关方法进行样品组间的分类鉴别,部分研究还对实现组间有效鉴别贡献较大的特征VOCs成分作为标志物进行了鉴定分析。本文重点综述了GC-IMS在蜂蜜中的应用研究现状,以期为GC-IMS技术在蜂蜜的品质控制、风味研究、产品开发等方面提供参考。
表 1 气相色谱-离子迁移谱技术在蜂蜜分析中的应用Table 1. Application for honey analysis of GC-IMS序号 应用 化学计量学方法 应用成果 应用方式 文献 1 昆虫学来源鉴定 PCA,OPLS-DA 实现了基于非靶向分析(HS-GC-IMS)对不同昆虫来源的荔枝蜜的分类鉴别 HS-GC-IMS、
HS-SPME-GC-MS[22] 2 产地溯源 PCA,PLS-DA 建立了有效的PLS-DA蜂蜜产地溯源模型,实现了不同产地油菜花蜂蜜的有效鉴别 GC-IMS [23] 3 植物来源区分 PCA,PLS-DA 实现了基于挥发性化合物成像、化学计量学分析和标记鉴定的三锁策略对冬蜜和乌桕蜜的鉴别 HS-GC-IMS [24] 4 植物来源区分 PCA 建立了茴香蜂蜜、藿香蜂蜜、石榴蜂蜜和麦卢卡蜂蜜的香气指纹图谱,其挥发性成分差异显著 HS-GC-IMS [25] 5 植物来源区分 OPLS-DA 建立了不同植物来源蜂蜜的判别模型,有效区分千盏花蜂蜜、迷迭香蜂蜜、albaida蜂蜜、橙花蜂蜜和其它蜂蜜 HS-GC-IMS [26] 6 植物来源区分 PCA,LDA 成功地区分了6种不同植物来源的蜂蜜样品(菩提树蜂蜜、麦卢卡蜂蜜、金合欢蜂蜜、油菜籽蜂蜜、栗子蜂蜜和银杉蜂蜜),鉴定了15种蜂蜜典型化合物 HS-GC-IMS [27] 7 植物来源区分 PCA,LDA,kNN 建立了基于HS-GC-IMS的PCA-LDA模型对金合欢蜂蜜、油菜籽蜂蜜、甘露蜜的判别,预测准确率为98.6% HS-GC-IMS、1H NMR [28] 8 植物来源区分 PCA-LDA,PLS-DA 展示了一种用于三维HS-GC-IMS数据阵列和二维FT-IR数据块的低级数据融合策略,对于蜂蜜样品(金合欢蜂蜜、油菜籽蜂蜜、甘露蜜),交叉验证错误率降低,模型鲁棒性增强 HS-GC-IMS、
ATR/FT-IR[29] 9 植物来源区分 PCA,LDA 建立不同植物来源中蜂蜜的判别模型,实现了准确地区分重庆三峡库区的油菜花、五倍子花、枇杷花和柑橘花等中蜂蜜样品。 GC-IMS [13] 10 植物来源区分 PCA 对100%洋槐蜜、100%油菜蜜及不同比例油菜蜜混合洋槐蜜样品挥发性组分进行测定与分析,结合多元统计建立了可以区分不同混合比例油菜蜜混合洋槐蜜的有效模型 GC-IMS、三点检验 [30] 11 掺假鉴别 OPLS-DA 实现了纯蜂蜜和掺入玉米或甘蔗糖浆的蜂蜜有效鉴别,验证率为97.4%。对甘蔗或玉米糖浆的掺假百分比进行可靠分类,正确率为93.8% HS-GC-IMS、UV SCALE预处理 [2] 12 掺假鉴别 HCA,LDA,PLS 采用优化后的HS-GC-IMS对蜂蜜中不同物质(大米糖浆、红糖糖浆、转化糖浆、果葡糖浆、高果玉米糖浆)的掺假进行检测和鉴别,实现了是否掺假和掺假类型的准确分类(100%) HS-GC-IMS [31] 13 成熟度鉴别 PCA 采用抗氧化参数和挥发性成分结合化学计量学的方法对不同成熟期的油菜蜜进行了有效鉴别 HS-GC-IMS [32] 14 成熟度鉴别 PLS-DA 从整体VOCs分布轮廓的非靶向角度对5个不同成熟度的五倍子中蜂蜜进行了区分并建立稳健有效的鉴别模型,实现了对不同成熟度的五倍子蜂蜜的有效鉴别 GC-IMS [10] 1. GC-IMS在蜂蜜蜂种鉴别中的应用
中华蜜蜂(中蜂)和意大利蜜蜂(意蜂)是蜂蜜生产中的两个优势品种[33],中蜂具有较强的物种优势,能够利用不同的花蜜来源,特别是野生植物或传统药物的花蜜,表现出很强的抗病能力,且生产的蜂蜜酿造时间长、成熟度高。中蜂在中国养蜂业中被广泛饲养,占中国蜂群总数的33%[34]。意蜂是中国养蜂业的主要蜜蜂种类,自20世纪90年代以来,由于其较长的产蜜期和适合现代育种,占中国所有蜂群的三分之二[35]。由于较低的产量和较高的生物活性,中蜂蜂蜜价格一般比意蜂蜂蜜高3~10倍。一些蜂蜜贸易商以意蜂蜂蜜冒充中蜂蜂蜜,非法获取暴利,给中蜂养蜂人及相关蜂产品企业造成了严重的经济损失。基于内源蛋白质[36]和DNA[37]的方法用于鉴定蜂蜜的昆虫学来源被认为是可靠的方法,但较高成本和严格的实验条件,不适合常规筛选分析。
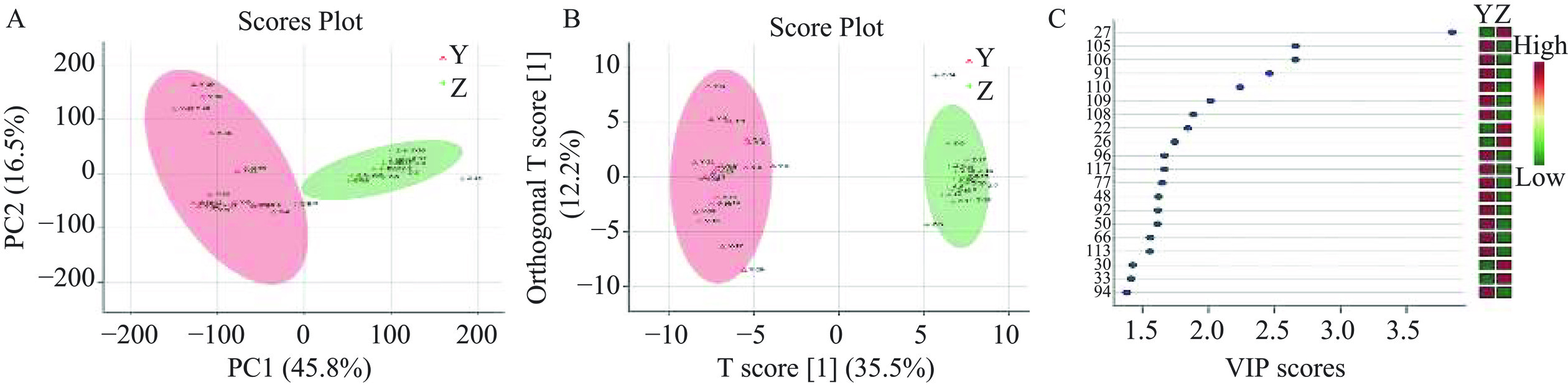
GC-IMS在蜂蜜峰种鉴别中有初步应用,但相关报道较少。Wang等[22]采用顶空气相色谱-离子迁移谱分析(HS-GC-IMS)对中蜂蜂蜜和意蜂蜂蜜中的挥发性组分进行了非靶向代谢组学分析,结合主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA)对中蜂蜂蜜和意蜂蜂蜜进行鉴别(图2)。结果表明,基于HS-GC-IMS的非靶向分析促进了暂定标记物的鉴定和蜂种间的整体区分,为不同昆虫来源的蜂蜜鉴别提供了一种快速有效的方法。
2. GC-IMS在蜂蜜产地溯源中的应用
由于蜂蜜的天然属性,不同产地蜂蜜的口感、风味、营养和药用价值均有差异,对此不同消费者的偏好不同,正宗的产地来源是消费者关注的重点。蜂蜜的内源成分和活性与地理因素如土壤、气候等密切相关,优势产地的蜂蜜更受到消费者欢迎,准确的地理来源标识是维护消费者权益和养蜂业良性发展的重要因素[38]。近年来,多种方法被用于蜂蜜的产地溯源,如稳定同位素质谱法[39]、电感耦合等离子体质谱法[40]、高效液相色谱示差折光检测器法[41]等。
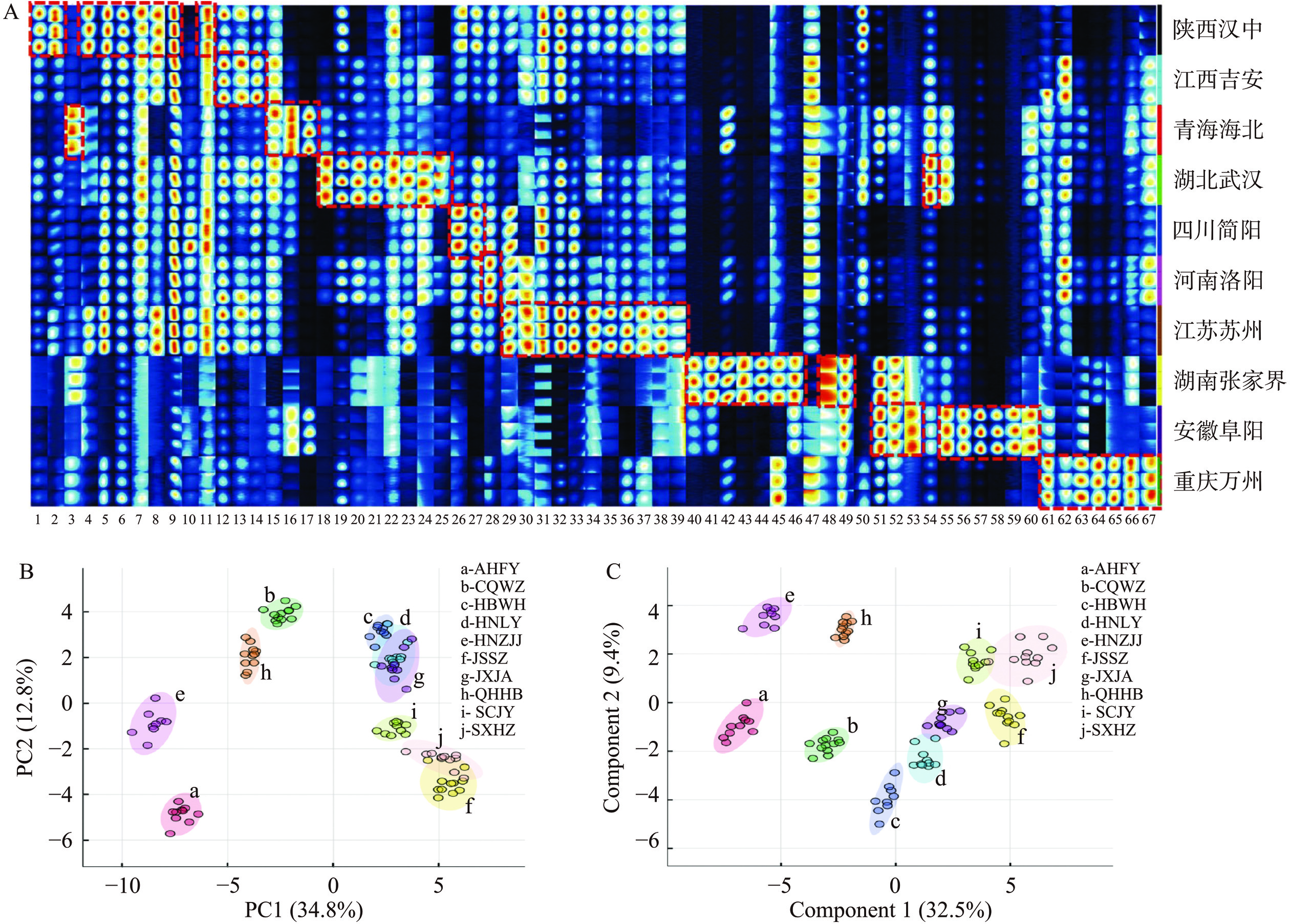
采用GC-IMS并结合化学计量学工具,根据挥发性有机化合物的指纹图谱,可以实现蜂蜜的产地鉴定,有助于地理标志产品的保护及推广。本团队[23]运用GC-IMS测定全国10个产地油菜花蜂蜜的VOCs,通过二维差谱法从广泛的VOCs信号数据中筛选出67个有效表征油菜花蜂蜜产地差异的特征成分(图3A),从差异化的VOCs分布轮廓的非靶向角度对10个产地油菜花蜂蜜进行PCA(图3B)和偏最小二乘判别分析(PLS-DA)(图3C)。结果显示,PCA并不能将10个产地的油菜花蜂蜜完全区分,但进一步的有监督的PLS-DA鉴别模型能够对10个产地的油菜花蜂蜜有效鉴别,实现准确的产地溯源。GC-IMS等在聚类、多元、指纹图谱或建模分析中表现出很大的潜力,但相关研究有待拓展。
3. GC-IMS在蜂蜜植物来源区分中的应用
不同植物来源的蜂蜜具有不同的香气特征,这是对风味进行感官评价和仪器分析的基础。蜂蜜可由单一花种花蜜酿造而来,也可由多花种的混合花蜜酿造而来。单花蜜和多花蜜在物理、化学和感官特性上存在很大差异。由于特定的挥发有机物的存在,单花蜜具有特征香气,受到消费者的青睐。
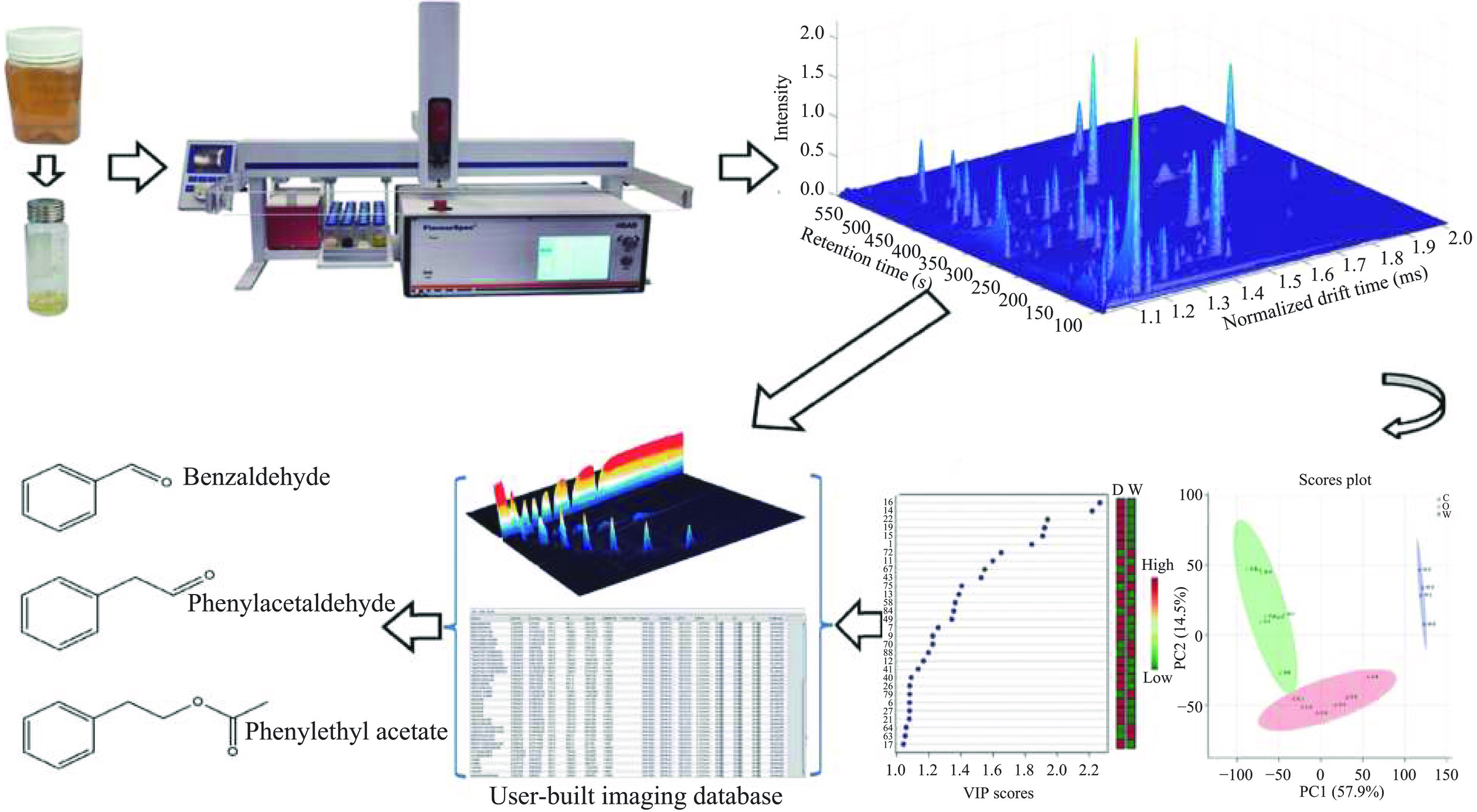
GC-IMS分析可以产生高分辨率的香气指纹图谱,并可通过化学计量学技术进行评价,从而可以区分蜂蜜的植物来源。Wang等[24]运用HS-GC-IMS针对不同花源的蜂蜜(冬蜜、乌桕蜜)的区分作了研究,并提出了基于挥发性化合物成像、化学计量学分析和标记鉴定的用于冬蜜和乌桕蜜鉴定的三锁策略,如图4所示。首先,通过HS-GC-IMS获得蜂蜜样品的三维成像阵列数据筛选出冬蜜和乌桕蜜特征信号,实现初步鉴别;其次,运用化学计量学方法(PCA和PLS-DA)建立冬蜜和乌桕蜜鉴别模型,实现准确鉴别;最后,通过PLS-DA模型中的VIP值筛选出对于鉴别冬蜜和乌桕蜜贡献较大的成分作为标记物,并对标记物进行鉴定和确认,苯甲醛二聚体和苯乙醛二聚体是冬蜜的可靠标记物,乙酸苯乙酯二聚体是乌桕蜜的可靠标记物。上述基于HS-GC-IMS“三锁策略”用于蜂蜜植物来源鉴别是首次报道。
近年来,GC-IMS广泛应用于蜂蜜植物来源的鉴别。Hu等[25]用HS-GC-IMS技术结合PCA对不同植物来源蜂蜜的特征风味成分进行分析,结果表明茴香蜂蜜、藿香蜂蜜、石榴蜂蜜和麦卢卡蜂蜜的挥发性成分差异显著。庚醇和己醛二聚体分别是石榴蜂蜜和茴香蜂蜜的特征成分,3-甲基戊酸和2-甲基丁酸乙酯是藿香蜜的特有成分。麦卢卡蜂蜜含有的挥发性成分最多,柠檬醛、1-苯乙醇、(E)-3-辛烷-2-酮、(Z)-2-辛烯醛、γ-辛内酯和香茅醇可作为麦卢卡蜂蜜区分于其他三种蜂蜜的特征性成分。Arroyo-Manzanares等[26]采用HS-GC-IMS对10种不同植物来源的89份蜂蜜样品挥发性特征化合物进行了鉴定和定量,共鉴定出15种挥发性化合物。利用OPLS-DA建立了不同植物来源蜂蜜的判别模型,可以有效区分千盏花蜂蜜、迷迭香蜂蜜、albaida蜂蜜、橙花蜂蜜和其它蜂蜜,验证成功率为100%。Schanzmann等[27]采用GC-IMS对58份蜂蜜样品进行顶空分析,利用PCA和线性判别分析(linear discriminant analysis,LDA)相结合的特异性标记,成功地区分了6种不同植物来源的蜂蜜样品,并鉴定了15种蜂蜜典型化合物。Gerhardt等[28]采用HS-GC-IMS结合优化的化学计量方法(PCA、LDA和kNN(k-Nearest Neighbors))对油菜籽蜂蜜、金合欢蜂蜜和甘露蜜进行了判别,预测准确率为98.6%。直接比较HS-GC-IMS和1H NMR数据之间的PCA-LDA模型,HS-GC-IMS分析可以作为基于NMR的蜂蜜样品分析的补充工具,因完全自动化、成本效益高、高灵敏度等特点,HS-GC-IMS 被认为是一种有潜力的替代方法。Schwolow等[29]采用衰减全反射红外光谱法(ATR/FT-IR)和HS-GC-IMS分析了3个不同植物来源(金合欢蜂蜜、油菜籽蜂蜜、甘露蜜)的64份蜂蜜样品。获得的数据集以低水平数据融合方法合并,随后通过主成分分析-线性判别分析(PCA-LDA)或偏最小二乘-判别分析(PLS-DA)进行多元分类,结果表明数据融合是提高分类性能的有效策略。龙门等[30]利用感官分析方法和GC-IMS对100%洋槐蜜、100%油菜蜜及不同比例油菜蜜混合洋槐蜜样品挥发性组分进行测定与分析,结合PCA和聚类分析建立了油菜蜜混合洋槐蜜的快速鉴别方法。本研究团队采用GC-IMS对来源于重庆三峡库区的油菜花、五倍子花、枇杷花和柑橘花的4种特色中蜂蜜的VOCs进行测定和分析,利用PCA和LDA的方法建立不同植物来源中蜂蜜的判别模型,实现了对重庆三峡库区4种不同蜜源植物特色的中蜂蜜样品的准确鉴别[13]。GC-IMS分析结合化学计量学方法在蜂蜜不同植物来源鉴别领域不断发展完善,可以实现对蜂蜜植物来源的高效准确分析。
4. GC-IMS在蜂蜜掺假鉴别中的应用
蜂蜜是仅有的可以直接被人类食用的天然有机甜味剂[42],基于蜂蜜的特殊风味和营养保健价值,其价格比蔗糖、果葡糖浆等其他甜味剂高出很多。由于商业利益驱使,蜂蜜是市场上常见的掺假食品之一,掺假的方式除了错误地标注其植物和地理来源外,还包括添加各种便宜的甜味剂(直接掺假),如精制蔗糖、甜菜糖、高果糖玉米糖浆和麦芽糖糖浆等,或给蜜蜂喂食蔗糖或糖浆(间接掺假)[43−44]。虽然人类健康一般不会受到这些掺假的影响,但掺假改变了蜂蜜的化学成分,降低了其生物活性,严重影响蜂蜜产品的质量和价值[45−46]。根据现有的研究成果,目前掺假蜂蜜的检测方法有:薄层色谱法、碳同位素法、气相色谱法、高效液相色谱法、红外光谱法、核磁共振法、超高效液相色谱-串联四极杆飞行时间质谱等[44−46]。
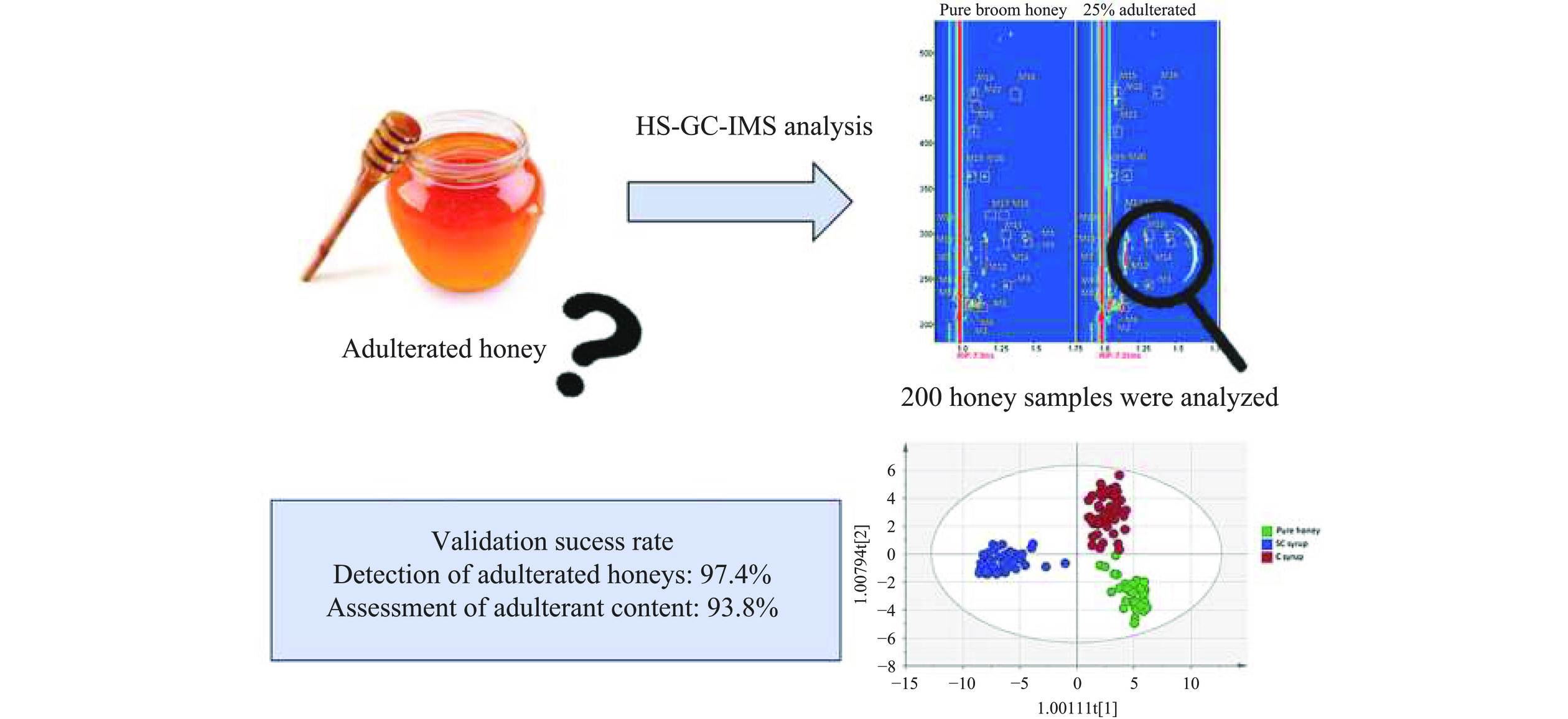
近年来,GC-IMS被广泛用于包括酒类、植物油、肉制品、蛋乳制品在内的多种食品的掺假检测[47−51],也有应用于蜂蜜掺假研究的报道。GC-IMS因不需要样品预处理、分析时间短、实验成本低等特点,近年来已经在蜂蜜质量控制方面成为有用的分析工具。Arroyo-Manzanares等[2]采用HS-GC-IMS,针对蜂蜜的纯度和甘蔗或玉米糖浆的掺假程度进行了鉴别研究,建立了一种快速简单的样品处理方法。采用HS-GC-IMS、UV SCALE预处理和OPLS-DA模型进行分类,将纯蜂蜜与掺入玉米或甘蔗糖浆的蜂蜜进行区分,并计算掺假百分比。结果表明,构建的OPLS-DA模型实现了纯蜂蜜和掺假蜂蜜的有效鉴别,验证成功率为97.4%,对两种掺假剂进行掺假含量评估的验证成功率为93.8%(图5)。Aliaño-González等[31]采用响应面优化后的顶空进样参数应用于不同百分比(5%~50%)掺假的蜂蜜鉴别,实现了HS-GC-IMS对蜂蜜中多种物质(大米糖浆、红糖糖浆、转化糖浆、果葡糖浆、高果玉米糖浆)的掺假检测和鉴别。
综上所述,GC-IMS与化学计量学工具结合使用,可以确定每个样品的特征指纹,可用于快速简便地检测和鉴别掺假蜂蜜。与其他方法相比,GC-IMS灵敏度高、更环保,在常压下即可实现实时快速监测分析,使其在常规反欺诈分析应用中有广阔前景。
5. GC-IMS在蜂蜜成熟度评价中的应用
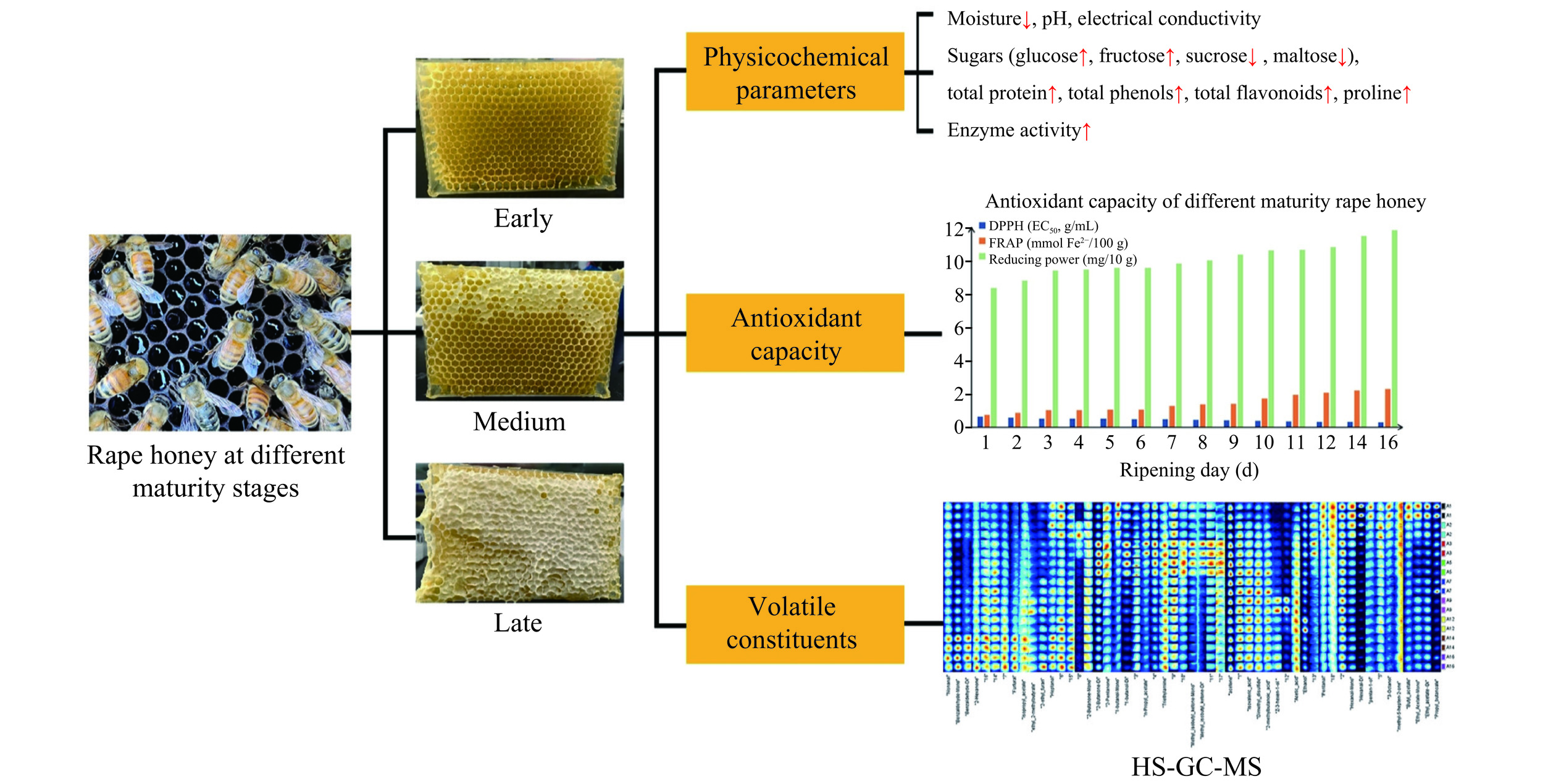
成熟蜂蜜是指蜜蜂采集植物的花蜜、蜜露,与蜜蜂自身分泌物混合后,经蜜蜂充分酿造,并用蜂蜡将其密封于蜂巢中的蜂蜜。成熟蜂蜜一般水分含量达到18%以下、蔗糖含量5%以下、葡萄糖和果糖总量70%以上,在常温、避光、干燥环境及密封容器中长期存放不易发酵变质的纯天然蜂蜜[52]。在蜂蜜成熟过程中,水分挥发,蔗糖分解生成果糖和葡萄糖,蛋白质含量升高,淀粉酶活性、体外抑菌活性和抗氧化活性显著增强,蜂蜜品质不断提升[53]。蜂蜜的成熟度是表征蜂蜜质量的重要指标,成熟蜂蜜在营养成分、功能因子及保健价值等方面均优于未成熟蜂蜜[53−54]。部分蜂农或商贩为降低成本而收集未成熟蜂蜜,并辅以高温浓缩操作,将加工成的“指标蜜”推向市场,降低了蜂蜜品质,增加了安全风险[55]。因此,对蜂蜜成熟度进行有效鉴别并由此评价蜂蜜的质量具有重要意义。
蜂蜜中含有大量的VOCs与其成熟度密切相关,利用GC-IMS对蜂蜜中VOCs进行测定和分析,能实现蜂蜜成熟度的鉴别。Zhang等[32]用HS-GC-IMS方法表征油菜蜂蜜的成熟度(图6),鉴定出35种挥发性成分。结果表明,壬醛、苯甲醛单体和苯甲醛二聚体可作为鉴定蜂蜜成熟期的潜在指标。它们在完全封盖的油菜蜜样品中的含量明显高于未成熟样品,基于抗氧化参数和挥发性成分的PCA可以实现蜂蜜成熟度的识别。刘振平等[10]采用GC-IMS对重庆三峡库区5个不同成熟度的五倍子花中蜂蜂蜜的挥发性有机化合物进行测定和分析,并建立稳健有效的PLS-DA鉴别模型,实现了不同成熟度五倍子蜂蜜样品的准确鉴别。
综上所述,成熟蜂蜜在理化性质、抗氧化能力、挥发性成分等方面均区别于未成熟蜂蜜,且成熟蜂蜜的品质和功效与蜜蜂的酿造程度密切相关,基于蜂蜜中挥发性有机物的GC-IMS数据,可以实现蜂蜜成熟度的有效鉴别,但目前利用GC-IMS进行成熟度鉴别的蜂蜜种类有限,应开展多花种、多蜂种、大样本量的验证实验。
6. 总结与展望
近年来,GC-IMS作为一项新技术被用于蜂蜜中VOCs的测定和分析,在蜂蜜昆虫来源、植物来源、地理来源、掺假和成熟度鉴别等方面有了初步的研究报道,这些报道的研究方法集中在将GC-IMS测得的VOCs数据运用化学计量学方法进行建模分析,挖掘差异信息,进而实现不同蜂蜜样品的组间鉴别。由于GC-IMS对样品成分离子化后进行二次分离,进样前无需特殊的样品前处理过程,目前的报道中均使用顶空进样即可达到检测的目的。虽然报道数量有限,但为蜂蜜多角度的品质鉴评提供了重要的技术参考。本研究团队参与了基于GC-IMS技术在蜂蜜鉴别中的多项研究,在实践的基础上认为GC-IMS技术有潜力成为解决目前蜂蜜行业品质鉴评问题并进一步优化蜂蜜市场秩序的有效手段,但还需在以下方面进行完善和拓展:a.基于我国蜜蜂产业分布特点,建立蜂蜜正宗植物来源、产地来源、昆虫来源及成熟度的GC-IMS数据库;b.优化GC-IMS技术的设备成本,开发或融合定量检测功能;c.建立基于GC-IMS技术的关于蜂蜜具体质量评价方法的技术标准;d.GC-IMS与其他风味检测技术联用,取长补短,以实现对蜂蜜中VOCs更全面、多角度的解析。综上所述,GC-IMS 技术的高灵敏度、可视化等优势在应用中得到了充分的展现,在持续的成本、功能优化及蜂蜜品质评价数据积累的基础上,有潜力成为可靠的蜂蜜品质鉴评的重要技术手段,为规范蜂蜜市场秩序提供有力支撑。
-
表 1 气相色谱-离子迁移谱技术在蜂蜜分析中的应用
Table 1 Application for honey analysis of GC-IMS
序号 应用 化学计量学方法 应用成果 应用方式 文献 1 昆虫学来源鉴定 PCA,OPLS-DA 实现了基于非靶向分析(HS-GC-IMS)对不同昆虫来源的荔枝蜜的分类鉴别 HS-GC-IMS、
HS-SPME-GC-MS[22] 2 产地溯源 PCA,PLS-DA 建立了有效的PLS-DA蜂蜜产地溯源模型,实现了不同产地油菜花蜂蜜的有效鉴别 GC-IMS [23] 3 植物来源区分 PCA,PLS-DA 实现了基于挥发性化合物成像、化学计量学分析和标记鉴定的三锁策略对冬蜜和乌桕蜜的鉴别 HS-GC-IMS [24] 4 植物来源区分 PCA 建立了茴香蜂蜜、藿香蜂蜜、石榴蜂蜜和麦卢卡蜂蜜的香气指纹图谱,其挥发性成分差异显著 HS-GC-IMS [25] 5 植物来源区分 OPLS-DA 建立了不同植物来源蜂蜜的判别模型,有效区分千盏花蜂蜜、迷迭香蜂蜜、albaida蜂蜜、橙花蜂蜜和其它蜂蜜 HS-GC-IMS [26] 6 植物来源区分 PCA,LDA 成功地区分了6种不同植物来源的蜂蜜样品(菩提树蜂蜜、麦卢卡蜂蜜、金合欢蜂蜜、油菜籽蜂蜜、栗子蜂蜜和银杉蜂蜜),鉴定了15种蜂蜜典型化合物 HS-GC-IMS [27] 7 植物来源区分 PCA,LDA,kNN 建立了基于HS-GC-IMS的PCA-LDA模型对金合欢蜂蜜、油菜籽蜂蜜、甘露蜜的判别,预测准确率为98.6% HS-GC-IMS、1H NMR [28] 8 植物来源区分 PCA-LDA,PLS-DA 展示了一种用于三维HS-GC-IMS数据阵列和二维FT-IR数据块的低级数据融合策略,对于蜂蜜样品(金合欢蜂蜜、油菜籽蜂蜜、甘露蜜),交叉验证错误率降低,模型鲁棒性增强 HS-GC-IMS、
ATR/FT-IR[29] 9 植物来源区分 PCA,LDA 建立不同植物来源中蜂蜜的判别模型,实现了准确地区分重庆三峡库区的油菜花、五倍子花、枇杷花和柑橘花等中蜂蜜样品。 GC-IMS [13] 10 植物来源区分 PCA 对100%洋槐蜜、100%油菜蜜及不同比例油菜蜜混合洋槐蜜样品挥发性组分进行测定与分析,结合多元统计建立了可以区分不同混合比例油菜蜜混合洋槐蜜的有效模型 GC-IMS、三点检验 [30] 11 掺假鉴别 OPLS-DA 实现了纯蜂蜜和掺入玉米或甘蔗糖浆的蜂蜜有效鉴别,验证率为97.4%。对甘蔗或玉米糖浆的掺假百分比进行可靠分类,正确率为93.8% HS-GC-IMS、UV SCALE预处理 [2] 12 掺假鉴别 HCA,LDA,PLS 采用优化后的HS-GC-IMS对蜂蜜中不同物质(大米糖浆、红糖糖浆、转化糖浆、果葡糖浆、高果玉米糖浆)的掺假进行检测和鉴别,实现了是否掺假和掺假类型的准确分类(100%) HS-GC-IMS [31] 13 成熟度鉴别 PCA 采用抗氧化参数和挥发性成分结合化学计量学的方法对不同成熟期的油菜蜜进行了有效鉴别 HS-GC-IMS [32] 14 成熟度鉴别 PLS-DA 从整体VOCs分布轮廓的非靶向角度对5个不同成熟度的五倍子中蜂蜜进行了区分并建立稳健有效的鉴别模型,实现了对不同成熟度的五倍子蜂蜜的有效鉴别 GC-IMS [10] -
[1] SERAGLIO S K T, SCHULZ M, BRUGNEROTTO P, et al. Quality, composition and health-protective properties of citrus honey:A review[J]. Food Research International,2021,143:110268. doi: 10.1016/j.foodres.2021.110268
[2] ARROYO-MANZANARES N, GARCÍA-NICOLÁS M, CASTELL A, et al. Untargeted headspace gas chromatography-ion mobility spectrometry analysis for detection of adulterated honey[J]. [J]. Talanta,2019,205:120123. doi: 10.1016/j.talanta.2019.120123
[3] GKOUTZOUVELIDOU M, PANOS G, XANTHOU M N, et al. Comparing the antimicrobial actions of Greek honeys from the island of Lemnos and Manuka honey from New Zealand against clinically important bacteria[J]. Foods,2021,70(1):8.
[4] MAJTAN J, BUCEKOVA M, KAFANTARIS I, et al. Honey antibacterial activity:A neglected aspect of honey quality assurance as functional food[J]. Trends in Food Science & Technology,2021,118:870−886.
[5] TISCHER S S K, SILVA B, BERGAMO G, et al. An overview of physicochemical characteristics and health-promoting properties of honeydew honey[J]. Food Research International,2019,119:44−66. doi: 10.1016/j.foodres.2019.01.028
[6] MACHADO A M, MIGUEL M G, VILAS-BOAS M, et al. Honey volatiles as a fingerprint for botanical origin-A review on their occurrence on monofloral honeys[J]. Molecules,2020,25:374. doi: 10.3390/molecules25020374
[7] 张国志, 韩凌云, 李珊珊, 等. 三种药用植物来源的蜂蜜抗氧化和抗菌活性研究[J]. 食品与发酵工业,2024,50(6):100−108. [ZHANG Guozhi, HAN Lingyun, LI Shanshan, et al. Antioxidant and antimicrobial properties of three monofloral kinds of honey from medicinal plants[J]. Food and Fermentation Industries,2024,50(6):100−108.] ZHANG Guozhi, HAN Lingyun, LI Shanshan, et al. Antioxidant and antimicrobial properties of three monofloral kinds of honey from medicinal plants[J]. Food and Fermentation Industries, 2024, 50(6): 100−108.
[8] MARIE Y, MINLESHEWA A, ALEMU T, et al. Polyphenols, flavonoids, and antioxidant content of honey coupled with chemometric method:Geographical origin classification from Amhara region, Ethiopia[J]. International Journal of Food Properties,2022,25(1):76−92. doi: 10.1080/10942912.2021.2021940
[9] KEK S P, CHIN N L, YUSOF Y A, et al. Classification of entomological origin of honey based on its physicochemical and antioxidant properties[J]. International Journal of Food Properties,2017,20(3):2723−2738.
[10] 刘振平, 甘芳瑗, 刘国政, 等. 基于气相离子迁移谱技术的五倍子花中蜂蜜成熟度模型鉴别研究[J]. 食品与发酵工业,2023,49(8):265−271. [LIU Zhenping, GAN Fangyuan, LIU Guozheng, et al. Study of maturity identification model for gallnut flower Apis cerana honey based on gas chromatography-ion mobility spectrometry[J]. Food and Fermentation Industries,2023,49(8):265−271.] LIU Zhenping, GAN Fangyuan, LIU Guozheng, et al. Study of maturity identification model for gallnut flower Apis cerana honey based on gas chromatography-ion mobility spectrometry[J]. Food and Fermentation Industries, 2023, 49(8): 265−271.
[11] TSAGKARIS A S, KOULIS G A, DANEZIS G P, et al. Honey authenticity:Analytical techniques, state of the art and challenges[J]. RSC Advances,2021,11(19):11273−11294. doi: 10.1039/D1RA00069A
[12] 钱鑫, 李占明, 宋嘉慧, 等. 气相色谱-离子迁移谱法检测农产食品中挥发性有机化合物的研究进展[J]. 食品安全质量检测学报,2021,12(18):7184−7190. [QIAN Xin, LI Zhanming, SONG Jiahui, et al. Research progress on the determination of volatile organic compounds of agro-food by gas chromatography-ion mobility spectrometry[J]. Journal of Food Safety & Quality,2021,12(18):7184−7190.] QIAN Xin, LI Zhanming, SONG Jiahui, et al. Research progress on the determination of volatile organic compounds of agro-food by gas chromatography-ion mobility spectrometry[J]. Journal of Food Safety & Quality, 2021, 12(18): 7184−7190.
[13] 刘振平, 聂青玉, 庞钶靖, 等. 气相离子迁移谱技术鉴别重庆三峡库区特色中蜂蜜研究[J]. 食品与发酵工业,2021,47(22):273−278. [LIU Zhenping, NIE Qingyu, PANG Kejing, et al. Study on the identification of specialty honey of Apis cerana from the Three Gorges Reservoir area of Chongqing based on gas chromatography-ion mobility spectrometry[J]. Food and Fermentation Industries,2021,47(22):273−278.] LIU Zhenping, NIE Qingyu, PANG Kejing, et al. Study on the identification of specialty honey of Apis cerana from the Three Gorges Reservoir area of Chongqing based on gas chromatography-ion mobility spectrometry[J]. Food and Fermentation Industries, 2021, 47(22): 273−278.
[14] WANG S Q, CHEN H T, SUN B G. Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry (GC-IMS)[J]. Food Chemistry,2020,315:126158. doi: 10.1016/j.foodchem.2019.126158
[15] XIA A N, TANG X J, DONG G Z, et al. Quality assessment of fermented rose jams based on physicochemical properties, HS-GC-MS and HS-GC-IMS[J]. LWT-Food Science and Technology,2021,151:112153. doi: 10.1016/j.lwt.2021.112153
[16] HERNÁNDEZ-MESA M, ROPARTZ D, GARCÍA-CAMPAA A M, et al. Ion mobility spectrometry in food analysis:Principles, current applications and future trends[J]. Molecules,2019,24(15):2706−2733. doi: 10.3390/molecules24152706
[17] 陈鑫郁, 贺金娜, 陈通, 等. 气相色谱离子迁移谱联用技术在食用植物油品质检测中的应用[J]. 食品安全质量检测学报,2018,9(2):396−401. [CHEN Xinyu, HE Jinna, CHEN Tong, et al. Application of gas chromatography-ion mobility spectrometry in quality determination of edible vegetable oil[J]. Journal of Food Safety & Quality,2018,9(2):396−401.] CHEN Xinyu, HE Jinna, CHEN Tong, et al. Application of gas chromatography-ion mobility spectrometry in quality determination of edible vegetable oil[J]. Journal of Food Safety & Quality, 2018, 9(2): 396−401.
[18] 刘倩, 白艳龙, 贾建华, 等. 基于GC-MS和GC-IMS技术比较不同种类麦芽的挥发性物质[J/OL]. 食品工业科技, [2024-01-04]. https://doi.org/10.13386/j.issn1002-0306.2023070212. [LIU Qian, BAI Yanlong, JIA Jianhua, et al. Study about volatile organic compounds in malt based on GC-MS and GC-IMS technology[J/OL]. Science and Technology of Food Industry, [2024-01-04]. https://doi.org/10.13386/j.issn1002-0306.2023070212.] LIU Qian, BAI Yanlong, JIA Jianhua, et al. Study about volatile organic compounds in malt based on GC-MS and GC-IMS technology[J/OL]. Science and Technology of Food Industry, [2024-01-04]. https://doi.org/10.13386/j.issn1002-0306.2023070212.
[19] 张乐, 魏依馨, 史冠莹, 等. 基于GC-IMS和GC-MS技术结合化学计量法分析干燥方式对香椿挥发性成分的影响[J]. 食品工业科技,2024,45(11):222−234. [ZHANG Le, WEI Yixin, SHI Guanying, et al. Analysis of the effect of drying methods on volatile components of Toona sinensis based on GC-IMS and GC-MS combined with chemometrics[J]. Science and Technology of Food Industry,2024,45(11):222−234.] ZHANG Le, WEI Yixin, SHI Guanying, et al. Analysis of the effect of drying methods on volatile components of Toona sinensis based on GC-IMS and GC-MS combined with chemometrics[J]. Science and Technology of Food Industry, 2024, 45(11): 222−234.
[20] 王芳, 陈潘, 席斌, 等. 离子迁移谱技术在食品检测中的应用研究进展[J]. 食品研究与开发,2021,42(8):179−185. [WANG Fang, CHEN Pan, XI Bin, et al. Research progress on the application of ion mobility spectrometry techniques in food test[J]. Food Research and Development,2021,42(8):179−185.] WANG Fang, CHEN Pan, XI Bin, et al. Research progress on the application of ion mobility spectrometry techniques in food test[J]. Food Research and Development, 2021, 42(8): 179−185.
[21] 周晨曦, 郑福平, 孙宝国. 离子迁移谱技术在食品风味分析中的应用研究进展[J]. 食品工业科技,2019,40(18):309−318. [ZHOU Chenxi, ZHENG Fuping, SUN Baoguo. Research progress on the application of ion mobility spectrometry (IMS) in food flavor analysis[J]. Science and Technology of Food Industry,2019,40(18):309−318.] ZHOU Chenxi, ZHENG Fuping, SUN Baoguo. Research progress on the application of ion mobility spectrometry (IMS) in food flavor analysis[J]. Science and Technology of Food Industry, 2019, 40(18): 309−318.
[22] WANG X R, ROGERS K M, LI Y, et al. Untargeted and targeted discrimination of honey collected by Apis cerana and Apis mellifera based on volatiles using HS-GC-IMS and HS-SPME-GC-MS[J]. Journal of Agricultural and Food Chemistry,2019,67:12144−12152. doi: 10.1021/acs.jafc.9b04438
[23] 刘振平, 龙道崎, 甘芳瑗, 等. 基于GC-IMS技术的油菜花蜂蜜产地溯源模型鉴别[J]. 中国食品学报,2023(8):379−388. [LIU Zhenping, LONG Daoqi, GAN Fangyuan, et al. Identification model for rape flower honey geographical origin based on GC-IMS technology[J]. Journal of Chinese Institute of Food Science and Technology,2023(8):379−388.] LIU Zhenping, LONG Daoqi, GAN Fangyuan, et al. Identification model for rape flower honey geographical origin based on GC-IMS technology[J]. Journal of Chinese Institute of Food Science and Technology, 2023(8): 379−388.
[24] WANG X R, YANG S P, HE J N, et al. A green triple-locked strategy based on volatile-compound imaging, chemometrics, and markers to discriminate winter honey and sapium honey using headspace gas chromatography-ion mobility spectrometry[J]. Food Research International,2019,119(5):960−967.
[25] HU F L. Chemical analyses and antimicrobial activity of nine kinds of unifloral Chinese honeys compared to Manuka honey (12+and 20+)[J]. Molecules,2021,26(9):2778. doi: 10.3390/molecules26092778
[26] ARROYO-MANZANARES N, GARC´IA-NICOLAS M I, ZAFRA-NAVARRO F, et al. A non-targeted metabolomic strategy for characterization of the botanical origin of honey samples using headspace gas chromatography-ion mobility spectrometry[J]. Analytical Methods,2022,14:5047−5055. doi: 10.1039/D2AY01479C
[27] SCHANZMANN H, AUGUSTINI A L R M, SANDERS D, et al. Differentiation of monofloral honey using volatile organic compounds by HS-GC×IMS[J]. Molecules,2022,27:7554. doi: 10.3390/molecules27217554
[28] GERHARDT N, BIRKENMEIER M, SCHWOLOW S, et al. Volatile-compound fingerprinting by headspace-gas-chromatography ion-mobility spectrometry (HS-GC-IMS) as abenchtop alternative to 1H NMR profiling for assessment of the authenticity of honey[J]. Analytical Chemistry,2018,90(3):1777−1785. doi: 10.1021/acs.analchem.7b03748
[29] SCHWOLOW S, GERHARDT N, ROHN S, et al. Data fusion of GC-IMS data and FT-MIR spectra for the authentication of olive oils and honeys-is it worth to go the extra mile?[J]. Analytical and Bioanalytical Chemistry,2019,411(23):6005−6019. doi: 10.1007/s00216-019-01978-w
[30] 龙门, 李旺旺, 方志澳, 等. 基于气相色谱-离子迁移谱法快速鉴别油菜蜜混合洋槐蜜[J]. 食品安全质量检测学报,2023,14(21):201−209. [LONG Men, LI Wangwang, FANG Zhiao, et al. Identification of rape honey mixed with locust honey based on gas chromatography-ion mobility spectrometry[J]. Journal of Food Safety & Quality,2023,14(21):201−209.] LONG Men, LI Wangwang, FANG Zhiao, et al. Identification of rape honey mixed with locust honey based on gas chromatography-ion mobility spectrometry[J]. Journal of Food Safety & Quality, 2023, 14(21): 201−209.
[31] ALIAO-GONZÁLEZ M J, FERREIRO-GONZÁLEZ M, ESPADA-BELLIDO E, et al. Novel method based on ion mobility spectroscopy for the quantification of adulterants in honeys[J]. Food Control,2020,114:107236. doi: 10.1016/j.foodcont.2020.107236
[32] ZHANG G Z, TIAN J, ZHANG Y Z, et al. Investigation of the maturity evaluation indicator of honey in natural ripening process:The case of rape honey[J]. Foods,2021,10(11):2882. doi: 10.3390/foods10112882
[33] SONIA S, LILIANA G, ISABEL M, et al. Novel diagnostic tools for Asian (Apis cerana) and European (Apis mellifera) honey authentication[J]. Food Research International,2018,105:686−193. doi: 10.1016/j.foodres.2017.11.081
[34] ZHANG Y Z, CHEN Y F, WU Y Q, et al. Discrimination of the entomological origin of honey according to the secretions of the bee (Apis cerana or Apis mellifera)[J]. Food Research International,2019,116:362−369. doi: 10.1016/j.foodres.2018.08.049
[35] HE X J, WANG W X, QIN Q H, et al. Assessment of flight activity and homing ability in Asian and European honey bee species, Apis cerana and Apis mellifera, measured with radio frequency tags[J]. Apidologie,2013,44(1):38−51. doi: 10.1007/s13592-012-0156-7
[36] 蔡冬梅. 基于液相色谱串联质谱对蜂蜜中动物源蛋白质的鉴别和定量研究[D]. 北京:中国农业科学院, 2021. [CAI Dongmei. Identification and quantitative study of animal-derived proteins in honey based on liquid chromatography-tandem mass spectrometry[D]. Beijing:Chinese Academy of Agricultural Sciences, 2021.] CAI Dongmei. Identification and quantitative study of animal-derived proteins in honey based on liquid chromatography-tandem mass spectrometry[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021.
[37] UTZERI V J, RIBANI A, FONTANESI L. Authentication of honey based on a DNA method to differentiate Apis mellifera subspecies:Application to Sicilian honey bee (A. m. siciliana) and Iberian honey bee (A. m. iberiensis) honeys[J]. Food Control,2018,91:294−301. doi: 10.1016/j.foodcont.2018.04.010
[38] ADGABA N, AL-GHAMDI A A, GETACHEW A, et al. Characterization of honeys by their botanical and geographical origins based on physico-chemical properties and chemo-metrics analysis[J]. Journal of Food Measurement & Characterization,2017,11(3):1106−1117.
[39] 谭阳, 刘志, 韩燕, 等. 青海高原油菜蜜稳定同位素产地特征与环境响应机制研究[J]. 核农学报,2021,35(3):635−642. [TAN Yang, LIU Zhi, HAN Yan, et al. Stable isotope signatures of rape honey in Qinghai Province and their response mechanisms to environmental factors[J]. Journal of Nuclear Agricultural Sciences,2021,35(3):635−642.] TAN Yang, LIU Zhi, HAN Yan, et al. Stable isotope signatures of rape honey in Qinghai Province and their response mechanisms to environmental factors[J]. Journal of Nuclear Agricultural Sciences, 2021, 35(3): 635−642.
[40] WU F H, ZHAO H A, SUN J, et al. ICP-MS-based ionomics method for discriminating the geographical origin of honey of Apis cerana Fabricius[J]. Food Chemistry,2021,354:129568. doi: 10.1016/j.foodchem.2021.129568
[41] 张晓华. 蜂蜜中糖类的高效液相色谱测定及其在蜂蜜品质控制中的应用研究[J]. 食品研究与开发,2019,40(16):74−79. [ZHANG Xiaohua. Determination of sugars in honey by high performance liquid chromatography and its application in honey quality control[J]. Food Research and Development,2019,40(16):74−79.] ZHANG Xiaohua. Determination of sugars in honey by high performance liquid chromatography and its application in honey quality control[J]. Food Research and Development, 2019, 40(16): 74−79.
[42] YAACOB K W S A W N S. Detection techniques for adulterants in honey:Challenges and recent trends[J]. Journal of Food Composition and Analysis,2019,80:16−32. doi: 10.1016/j.jfca.2019.04.001
[43] CONSONNI R, CAGLIANI L R. Recent developments in honey characterization[J]. Rsc Advances,2015,5(73):59696−59714. doi: 10.1039/C5RA05828G
[44] 张一帆, 陈启, 崔宗岩, 等. 蜂蜜真伪鉴别和检测技术研究进展[J]. 浙江大学学报(农业与生命科学版),2018,44(6):649−658. [ZHANG Yifan, CHEN Qi, CUI Zongyan, et al. Research progress in authenticity identification and detection technology of honey[J]. Journal of Zhejiang University (Agriculture and Life Sciences),2018,44(6):649−658.] ZHANG Yifan, CHEN Qi, CUI Zongyan, et al. Research progress in authenticity identification and detection technology of honey[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2018, 44(6): 649−658.
[45] GEANA E I, CIUCURE C T. Establishing authenticity of honey via comprehensive Romanian honey analysis[J]. Food Chemistry,2019,306:125595.
[46] ZHANG G, ABDULLA W. On honey authentication and adulterant detection techniques[J]. Food Control,2022,138:108992. doi: 10.1016/j.foodcont.2022.108992
[47] CHEN T, QI X P, CHEN M J, et al. Discrimination of Chinese yellow wine from different origins based on flavor fingerprint[J]. Acta Chromatographica,2019,32(2):1−6.
[48] BRENDEL R, SCHWOLOW S, ROHN S, et al. Gas-phase volatilomic approaches for quality control of brewing hops based on simultaneous GC-MS-IMS and machine learning[J]. Analytical and Bioanalytical Chemistry,2020,412(26):7085−7097. doi: 10.1007/s00216-020-02842-y
[49] JING Q, HUANG X Y, LU C H, et al. Identification of characteristic flavour compounds and quality analysis in extra virgin olive oil based on HS-GC-IMS[J]. International Journal of Food Science & Technology,2022,57(9):6211−6225.
[50] ARROYO-MANZANARES N, MARTÍN-GÓMEZ A, JURADO-CAMPOS N, et al. Target vs spectral fingerprint data analysis of Iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J]. Food Chemistry,2018,246:65−73. doi: 10.1016/j.foodchem.2017.11.008
[51] 杜文博. 气相离子迁移谱在羊奶粉和驴肉鉴别分析中的应用[D]. 保定:河北农业大学, 2019. [DU Wenbo. Application of gas phase ion mobility spectrometry in the identification of goat milk powder and donkey meat[D]. Baoding:Hebei Agricultural University, 2019.] DU Wenbo. Application of gas phase ion mobility spectrometry in the identification of goat milk powder and donkey meat[D]. Baoding: Hebei Agricultural University, 2019.
[52] MONIRUZZAMAN M, KHALIL M I, SULAIMAN S A, et al. Physicochemical and antioxidant properties of Malaysian honeys produced by Apis cerana, Apis dorsata and Apis mellifera[J]. Bmc Complementary & Alternative Medicine,2013,13(1):43−43.
[53] 孙婧. 基于代谢组学技术的成熟蜂蜜与未成熟蜂蜜成分差异研究[D]. 西安:西北大学, 2022. [SUN Jing. The difference of components between mature honey and immature honey by metabolomics[D]. Xi'an:Northwest University, 2022.] SUN Jing. The difference of components between mature honey and immature honey by metabolomics[D]. Xi'an: Northwest University, 2022.
[54] 郭娜娜. 酿造成熟与未成熟油菜蜂蜜成分组成及生物学活性比较研究[D]. 北京:中国农业科学院, 2020. [GUO Nana. A comparative study on the composition and biological activity between naturally mature honey and immature honey from rape flower[D]. Beijing:Chinese Academy of Agricultural Sciences, 2020.] GUO Nana. A comparative study on the composition and biological activity between naturally mature honey and immature honey from rape flower[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020.
[55] 田静. 油菜蜂蜜自然酿造过程中成熟度的评价指标初探[D]. 杭州:浙江大学, 2020. [TIAN Jing. Preliminary study on the evaluation index of maturity in natural ripening process of rape honey[D]. Hangzhou:Zhejiang University, 2020.] TIAN Jing. Preliminary study on the evaluation index of maturity in natural ripening process of rape honey[D]. Hangzhou: Zhejiang University, 2020.
-
期刊类型引用(1)
1. 孙爱洁. 固相萃取-气相色谱法测定蜂蜜中氟胺氰菊酯残留量. 食品工业. 2024(11): 321-324 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



