Research Progress on the Formation Mechanism of Imidazoline Quinoline Heterocyclic Amines and the Inhibition Mechanism of Exogenous Substances on Them
-
摘要: 咪唑喹啉类(Imidazoquinoline,IQ型)杂环胺是目前已知的公认致突变活性最强的杂环胺(Heterocyclic Amines,HAs),其与多种癌症和神经退行性疾病密切相关。IQ型HAs形成的前体物质是游离氨基酸、还原糖和肌酸/肌酐,其在高温条件下发生一系列化学反应生成的自由基和活性羰基化合物等中间产物是IQ型HAs形成的基础。在肉制品热加工过程中,外源添加物质能够不同程度地影响IQ型HAs的形成,外源添加物质抑制IQ型HAs的作用机制主要包括前体物竞争性抑制机制、自由基清除机制和活性羰基化合物捕获机制3种。本文围绕IQ型HAs的形成过程以及外源物质抑制其形成的作用机制展开论述,明确了IQ型HAs生成的反应途径,详细阐述了外源物质抑制IQ型HAs形成的作用机制,为有效控制肉制品热加工过程中IQ型HAs的形成提供理论指导。Abstract: The imidazoquinoline type (IQ-type) is recognized as the most mutagenic activity in heterocyclic amines currently, and closely associated with a variety of cancers and neurodegenerative diseases of human. The precursors of IQ-type HAs are free amino acids, reducing sugars, and creatine/creatinine, and these precursors can undergo a series of chemical reactions at high temperature, and intermediate products such as free radicals and reactive carbonyl compounds are formed, which are the basis for the formation of IQ-type HAs. The exogenous substances added to the meat products during the thermal processing affected the IQ-type HAs formation to varying degrees. There are three main action mechanisms of the exogenous substances inhibiting IQ-type HAs, including competitive inhibition mechanism of precursors, free radical scavenging mechanisms, and active carbonyl compounds capturing mechanism. This article focuses on the formation process of IQ-type HAs and the inhibitory mechanism of exogenous substances, and clarified the reaction pathway of IQ-type HAs generation, and elaborated the action mechanism of exogenous substances inhibiting the formation of IQ-type HAs in detail. This paper provides theoretical guidance for effectively controlling the IQ-type HAs formation during the thermal processing of meat products.
-
2019年5月我国发布的《中共中央国务院关于深化改革加强食品安全工作的意见》明确指出,要将保障人民群众的食品安全放在首位。我国传统的肉制品热加工方式,如烧烤、油炸、油煎及酱卤等,赋予肉类食品独特的风味和口感,深受消费者青睐,然而在高温加工条件下,杂环胺(Heterocyclic Amines,HAs)也伴随产生。HAs是畜禽肉和鱼类等富含蛋白质类食物在热加工过程中产生的一大类具有致癌、致畸和致突变作用的多环芳香族化合物,长期摄入会对人体健康造成严重危害[1−2]。在已分离鉴定出的30种HAs中[3],咪唑喹啉类(Imidazoquinoline,IQ型)是公认致突变活性最强的HAs,早在1993年,世界卫生组织的国际癌症研究机构就将IQ认定为2A级致癌物,将MeIQ认定为2B级致癌物,美国国家毒理学计划也将IQ和MeIQ列为潜在的人类致癌物质[4]。有研究表明,IQ及MeIQ等HAs的摄入可能导致人体多种器官肿瘤的发生,乳腺、结肠、胃、肝脏、膀胱等均可能是其靶器官[5−6];同时,IQ的摄入还与原发性震颤、帕金森病和阿尔茨海默病等神经退行性疾病的发生密切相关[7−8],严重威胁人类健康[9]。当前,对于IQ型杂环胺的形成机制有多种猜想,但相关的具体研究较少。因此,本文围绕IQ型HAs的形成机制及外源添加物对IQ型HAs的抑制机理展开综述,从IQ的不同生成途径以及外源添加物对IQ型HAs的前体物竞争性抑制和中间产物抑制等多方面进行阐述,旨在为热加工肉制品中IQ型HAs的消减及控制提供参考依据。
1. IQ型HAs的形成机制
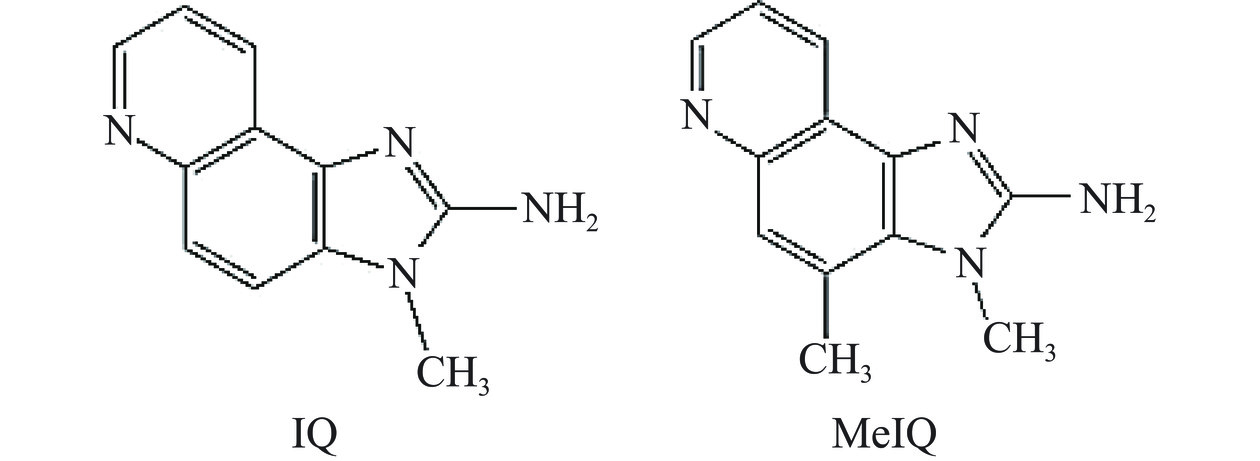
IQ型HAs主要包括2-氨基-3-甲基咪唑并[4,5-f]喹啉(2-amino-3-methyl-imidazo[4,5-f]quinoline,IQ)和2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(2-amino-3,4-dimethyl-imidazo[4,5-f]quinoline,MeIQ)两种,图1为IQ和MeIQ的化学结构式。通过对比两者的化学结构可以看出,其结构高度相似,主要区别在于MeIQ的咪唑并喹啉结构中比IQ多一个甲基[10]。
HAs主要在肉制品和高蛋白质食品的热加工过程产生,游离氨基酸、肌酸/肌酐和还原糖是其形成的主要前体物。游离氨基酸和还原糖通过美拉德反应和高温条件下的Strecker降解反应产生多种自由基和活性羰基化合物,它们在HAs的形成过程中发挥重要作用[11],并且反应体系中前体物的种类和浓度是影响HAs形成的重要因素[3]。
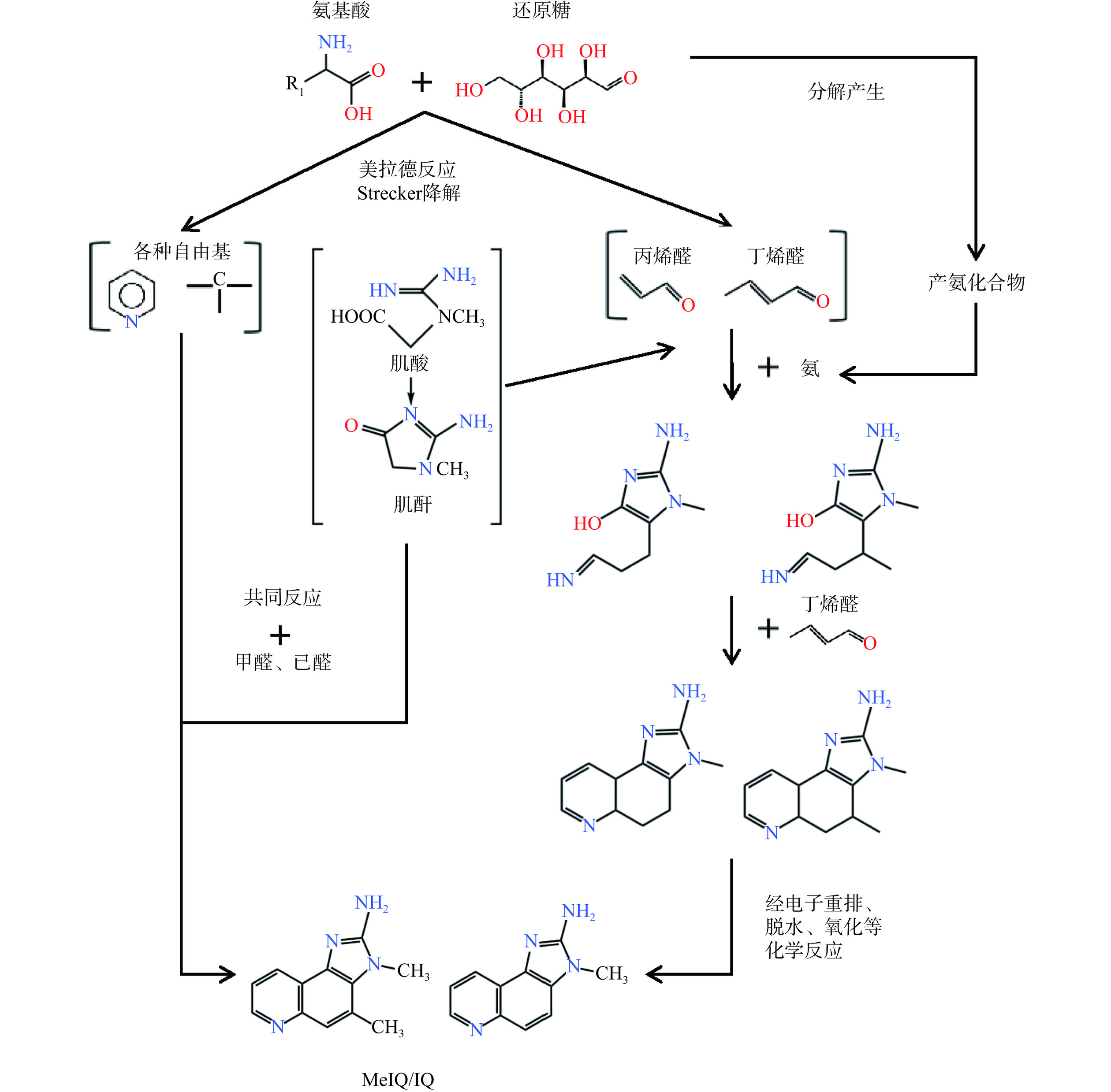
在IQ型HAs的形成过程中,还原糖和氨基酸发生美拉德反应产生的中间产物进一步与肌酐反应生成IQ和MeIQ[3],其形成涉及多种自由基和活性羰基化合物的参与(如图2)。有学者采用14C标记葡萄糖研究发现,IQ型HAs分子结构中的氨基咪唑部分来自肌酐,其余部分则由Strecker降解产物吡啶和吡嗪等构成[12−13]。Zamora等[14−15]认为IQ和MeIQ的形成过程可能类似于2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP),均需要活性羰基化合物、肌酐和产氨化合物的共同参与,通过将肌酐与24种不同的活性羰基化合物和产氨化合物(或其前体物)进行混合构建化学反应模型,在180 ℃反应1 h后测定IQ和MeIQ的生成情况,结果发现IQ和MeIQ是由丙烯醛、丁烯醛、肌酐和氨基酸共同反应生成,反应体系中丙烯醛和丁烯醛的不同比例决定了所生成IQ型HAs种类的差异;同时,在该体系中,产氨化合物为谷氨酰胺,其在加热时释放氨,易与羰基化合物反应发生低聚化和环化反应,进而促进IQ型HAs的形成。如图2所示,其具体途径为:肌酐的C-5位与丙烯醛的C-3位发生反应,产生的加合物与产氨化合物形成的氨反应生成相应的亚胺,再通过互变异构形成烯胺,烯胺与丁烯醛反应形成加合物,再经一系列的电子重排、脱水和氧化反应形成IQ;MeIQ的形成与IQ大致相同,其主要区别在于所结合的羰基化合物种类上,在IQ和MeIQ的形成过程中需要与活性羰基化合物进行两次反应,IQ生成所需的羰基化合物为丙烯醛和丁烯醛,而MeIQ形成过程中两次反应所需的羰基化合物均为丁烯醛[5,15]。
也有学者构建了以吡啶/吡嗪、肌酐和醛类为前体物的模型体系,发现在美拉德反应中,由脂质衍生的活性羰基参与羰-酰基胺反应产生吡啶/吡嗪,其后与肌酐/肌酸发生反应形成IQ型HAs[16];同时,肉制品中的部分物质和美拉德反应的中间产物,如三甲胺和苯乙醛等,在高温加工过程中会分解产生甲醛和乙醛,甲醛和乙醛会与自由基和肌酐发生反应,最终生成IQ型HAs[17−18]。IQ型HAs的形成除了与多种活性羰基化合物密切相关外,美拉德反应过程中产生的多种不稳定自由基也参与其形成。Pearson等[19]指出烷基吡啶自由基参与了IQ型HAs的形成,该类自由基与肌酐在加热条件下能够形成IQ和MeIQ。Kato等[20]在葡萄糖/甘氨酸/肌酐的模型体系中证实了自由基与HAs生成的关系,其采用电子自旋共振技术(Electron spin resonance,ESR)对模型体系中的自由基种类进行了分析,从中检测出不稳定美拉德中间产物自由基、吡嗪阳离子自由基和碳中心自由基等的存在,并证实这些自由基参与了反应体系中IQ型HAs的形成。Kikugawa等[21]在模型体系中也监测到吡嗪阳离子自由基和碳中心自由基的产生与IQ型HAs的形成有关。这些研究均证实了活性羰基化合物和自由基是IQ型HAs形成的必需条件。
游离氨基酸也在IQ型HAs的形成过程中发挥关键作用,并且不同种类的游离氨基酸产生的HAs种类不同。当甘氨酸、丙氨酸、赖氨酸、甲硫氨酸、苯丙氨酸和苏氨酸分别与葡萄糖和肌酐在模型体系中混合加热后,IQ和MeIQ均被检测到[22];Szterk等[23]发现丙氨酸、苯丙氨酸和赖氨酸参与了IQ型HAs的形成;本课题组前期研究发现,在烤羊肉饼中IQ型HAs的形成与其前体物之间存在显著的相关性,其中IQ的形成与丝氨酸、赖氨酸、精氨酸、肌酐呈极显著相关关系(P<0.01,R2=0.83~0.95),与苏氨酸、脯氨酸和葡萄糖呈显著相关(P<0.05,R2=0.72~0.79);MeIQ的形成则与苯丙氨酸、赖氨酸、组氨酸、精氨酸、葡萄糖和肌酐均存在极显著的相关性(P<0.01,R2=0.73~0.90),与丝氨酸和半胱氨酸呈显著相关关系(P<0.05,R2=0.78~0.81)[24]。
2. 外源添加物抑制热加工肉制品中IQ型HAs形成的作用机制
为了尽可能减少热加工肉制品中IQ型HAs的生成量,国内外研究人员开展了较为系统全面的研究和探索,发现通过添加外源物质能够在尽可能满足消费者对肉制品特色风味和口感需求的同时,有效降低HAs的生成[25]。针对不同种类外源添加物抑制IQ型HAs形成的作用机制,不同学者秉持的观点有较大差异,目前主要包括以下3种抑制机制观点:a.外源添加物能够通过与IQ型HAs的前体物形成竞争性抑制,进而阻断HAs的形成;b.外源添加物通过自身良好的抗氧化活性清除反应体系中的自由基,起到抑制IQ型HAs的形成;c.外源添加物能够通过捕获反应体系中的活性羰基化合物形成加合物,进而中断IQ型HAs的形成通路而抑制其形成。
2.1 前体物竞争性抑制/反应阻断机制
IQ型HAs通常由肌酸/酸酐、氨基酸和还原糖反应产生,其产生通常伴随前体物的不断消耗,因此前体物浓度是影响IQ型HAs形成的重要因素之一[26]。一些外源添加物可以通过与前体物发生反应进而降低反应体系中前体物的浓度而抑制IQ型HAs的形成(表1)。Teng等[26]研究发现,在IQ型HAs形成的化学模型体系中,添加未酰基化花青素的体系中葡萄糖含量为5.076±0.0061 mg/mL,而添加酰基化花青素的化学模型体系中葡萄糖含量显著降低至0.4592±0.0069 mg/mL,体系中的肌酸/肌酐含量也随着酰基化花青素的增加而显著降低,而此时体系中IQ型HAs的生成量也呈降低趋势,证实了酰基化花青素能够通过竞争性结合葡萄糖和肌酸/肌酐等物质,干扰体系中的醛醇反应,进而抑制IQ型HAs的形成。在Chu等[27]的研究中,也发现了与上述相似的结果。而且,部分多酚可以与蛋白质进行结合,通过抑制蛋白质的分解和降低其作为HAs前体物的可用性等作用来达到抑制HAs的目的。如Chen等[28]发现,四氢大麻酚可以通过与蛋白质结合形成加合物,减少蛋白质分解产生的氨基酸,从而使氨基酸浓度降低,最终抑制了IQ的生成。Ding等[29]也发现绿原酸与表儿茶素可以与还原糖和蛋白质结合,降低两种物质作为HAs前体物的可用性,进而抑制了IQ型HAs的形成。同时,有研究发现酰胺类化合物可以通过前体物竞争性抑制作用控制蛋白质与HAs前体物的结合,进而有效减少了IQ型HAs的形成[30]。除此以外,还有少部分文献发现某些传统药材提取物中的活性成分可以通过结合肌酐,降低肌酐的可用性来降低杂环胺的生成,如Cheng等[31]在显脉旋覆花提取物中检出了对香豆酸,其将对香豆酸添加在烤牛肉饼中,降低了IQ型HAs的含量,同时其通过制备肌酐探针并于对香豆酸反应证明该类活性成分可以通过亲电作用结合肌酐。
表 1 外源添加物通过竞争性抑制/中断前体物反应抑制杂环胺Table 1. Exogenous additives inhibit heterocyclic amines by competitive inhibition/interruption of precursor reactions此外,有研究表明天然植物多酚可以通过降低HAs前体物消耗或阻断HAs前体物的氧化反应等途径来抑制杂环胺。Xu等[32]使用包含多种多酚的桑叶提取物对油煎鸭肉中杂环胺进行了抑制能力的相关研究,发现该提取物可以有效减少IQ/MeIQ杂环胺前体物的消耗,同时表现出了较好的对杂环胺抑制能力。Zhang等[33]在胡萝卜、芹菜和山药三种蔬菜提取物中检出了一定含量的没食子酸,并发现得到的提取物可以有效抑制IQ/MeIQ杂环胺的生成,同时三种提取物还能有效降低葡萄糖消耗,三种蔬菜提取物抑制杂环胺的主要途径可能是通过阻断葡萄糖和某些杂环胺前体物/中间产物的氧化反应。
2.2 自由基清除机制
自由基是加工食品中普遍存在的一种中间产物,美拉德反应是其形成的重要途径[34],具有良好自由基清除活性的物质也表现出有效的 HAs 抑制作用。Balogh 等[35]研究发现 1% 浓度的维生素 E 对炸牛肉饼中 IQ 和 MelQ 的抑制率分别高达 85% 和 78.6%,其抑制活性可能是直接阻断自由基的产生而实现。也有学者指出,维生素E在高温加热条件下的分解产物能够与一些HAs的前体物质发生反应,可能也是抑制 HAs 形成的原因之一[3]。一些化学抗氧化剂也可以通过阻止某些阳离子自由基的形成、破坏阳离子自由基以及破坏中间产物等途径而抑制 IQ 型 HAs的形成。Kato 等[20]指出,含巯基类抗氧化剂是通过自由基清除机制而抑制 IQ 型 HAs 的形成,该类化合物可以向不稳定的吡嗪阳离子自由基提供氢原子,将其转化为非自由基的稳定化合物实现对自由基的清除,进而抑制 IQ 型 HAs 的产生。
多位学者研究发现许多天然物质具有良好的抗氧化活性,也对自由基表现出较强的清除能力,例如富含多酚类、生物碱类和萜类等抗氧化活性成分的香辛料提取物、果蔬提取物、中草药植物提取物等,被广泛应用于肉制品加工中以改善产品的风味和品质,同时也对IQ型HAs的形成有显著影响。Khan等[36]对紫苏籽提取物和多香果提取物抑制IQ型HAs的形成进行了研究,发现两种提取物对IQ均有一定的抑制作用,且混合提取物的抑制效果高于单一提取物,进一步分析可能是因为两种提取物中含有大量的多酚类化合物,其结构中的羟基能够提供电子,终止自由基的链式反应,抑制自由基的生成,进而抑制IQ型HAs的产生。Tengilimoglu-Metin等[37]发现山楂提取物中含有多种活性成分,尤其是含有大量的类黄酮化合物,其研究发现山楂提取物可以通过降低脂质氧化程度来降低自由基的生成,从而达到抑制IQ型HAs的产生。Teng等[38]对苦苣菜提取物抑制IQ型HAs的活性进行了研究,证实其含有的多酚类物质可以通过清除自由基抑制IQ的生成,抑制率为39%。Kilic等[39]发现使用0.5%的姜黄粉可以减少鸡肉丸中MeIQ的浓度,可能与姜黄粉中的主要成分姜黄素具有清除自由基、抗氧化的活性有关。Kikugawa等[21]在模型体系中发现表没食子儿茶素没食子酸酯(Epigallocatechin Gallate,EGCG)、芝麻醇、丁基羟基茴香醚能够显著降低吡嗪阳离子自由基和碳中心自由基的ESR信号强度,从而抑制IQ型HAs的产生。
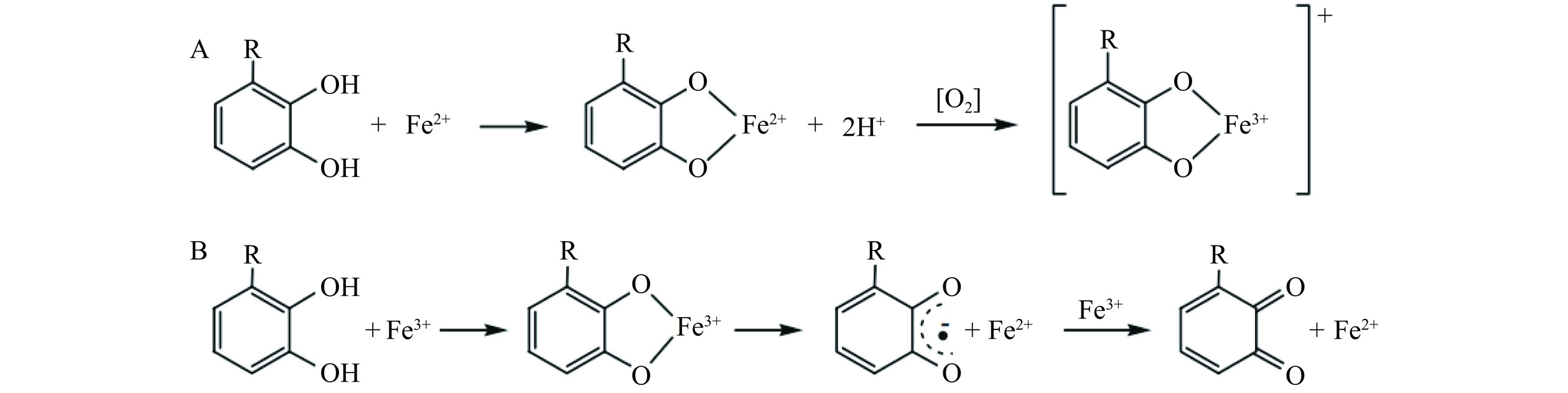
本课题组前期将红柳多酚添加至烤羊肉饼中,借助ESR分析发现红柳多酚的添加能够显著降低烤羊肉饼中自由基特征信号峰强度,并且发现红柳多酚对烤羊肉饼自由基的清除活性与其抑制IQ和MeIQ的形成之间呈极显著正相关关系[40]。此外,有学者报道,多酚类物质还可以通过螯合金属离子清除体系中的自由基[41],一些多酚类物质通过抑制Fenton反应阻止前体物的氧化进程,避免脂质过氧化,抑制自由基生成,进而抑制IQ型HAs的产生[42−43],图3即为多酚基团螯合铁离子和亚铁离子的反应过程图。
多酚类化合物对自由基清除能力的强弱与其化学结构密切相关,二者存在良好的构效关系,多酚化合物苯环结构上存在的邻苯二酚基结构和邻三羟基结构在清除自由基过程中起重要作用[43−44]。多酚化合物清除体系中自由基的机制是向自由基提供一个氢原子,使其成为相对稳定的化合物,同时形成了一个多酚自由基,而由于苯环本身具有的电子离域作用,多酚自由基的化学结构趋于稳定,反应活性降低,因此多酚自由基是一种能够独立存在于体系中的较为稳定的自由基[45]。根据自由基对细胞和DNA的破坏机理[46]可以推测,多酚自由基的毒性相对于常见的脂质自由基和活性氧自由基更低,因此对人体的毒害作用也更小。
2.3 活性羰基化合物捕获机制
活性羰基化合物是一类含有一个或多个羰基基团的、具有一定生物活性的小分子化合物,该类化合物极易与含有巯基或氨基的化合物发生加成反应,其来源广泛,如美拉德反应、脂质和糖类物质的氧化降解等,其中美拉德反应为活性羰基化合物的主要来源[47−48]。美拉德反应会产生Amadori或Heyns产物,这些产物经分子碎片化或修饰后可以生成活性羰基化合物[48−49]。低浓度的活性羰基化合物与食品的特征性风味紧密联系,而高浓度的活性羰基化合物会引起羰基应激反应,从而促进炎症的发生和糖尿病、癌症以及老年相关疾病的发展[47,50]。
活性羰基化合物参与多种HAs的形成,多位学者报道了多酚化合物能够捕获反应体系中的活性羰基化合物进而抑制HAs的形成。Cheng等[51]对12种多酚类化合物抑制HAs形成的能力研究发现,柚皮素对自由基的清除能力较差,但其对PhIP则表现出良好的抑制活性,推测该化合物对PhIP的抑制作用不是通过自由基清除机制,而是存在其他的抑制途径;其通过进一步研究发现,柚皮素能够与苯乙醛反应,生成柚皮素-苯乙醛加合物,从而抑制PhIP的形成[52];由此提出了多酚化合物通过捕获反应体系中的活性羰基化合物形成加合物而抑制HAs形成的作用机制。随后,国内外多位研究人员均在化学模型体系和真实肉品体系中验证了该作用机制的存在[6]。对于IQ型HAs,其形成过程中需要活性羰基化合物丙烯醛和丁烯醛的参与,多酚化合物可能也通过捕获这两种活性羰基化合物而抑制IQ型HAs的形成。
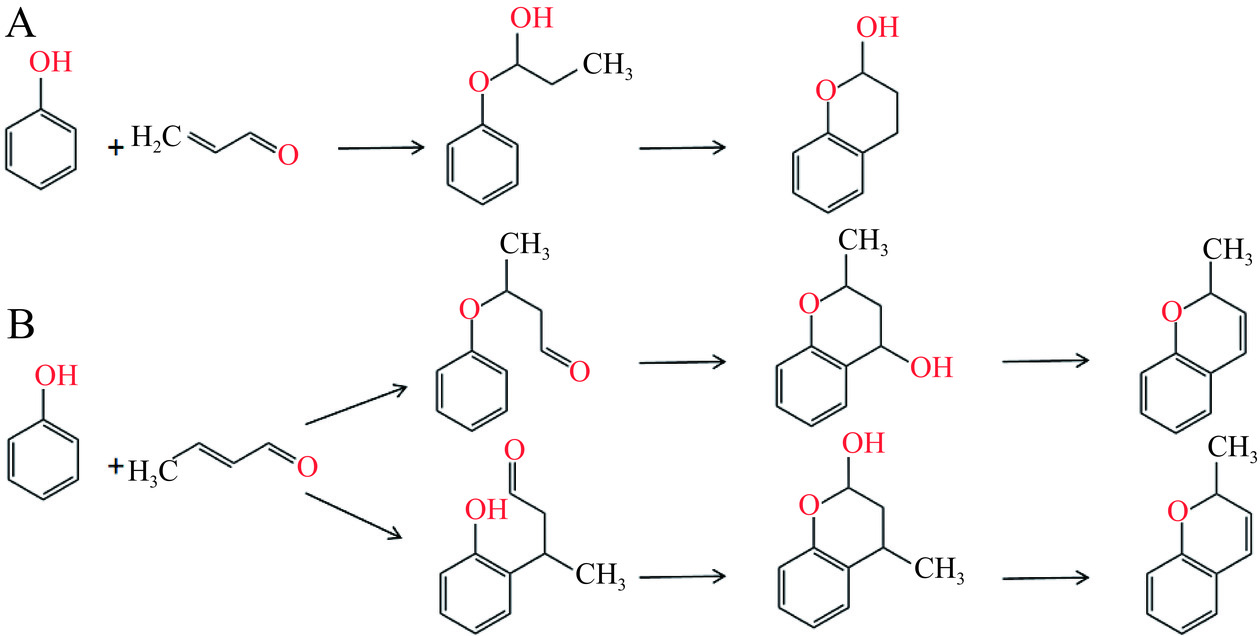
丙烯醛是IQ形成过程中的重要中间产物,在IQ的形成过程中发挥关键作用[5,15]。大量研究表明天然多酚类化合物能够捕获反应体系中产生的丙烯醛,进而形成相应的加合物[53−54]。多酚化合物结构中的间苯三酚基团是捕获丙烯醛的基础结构,部分多酚的活性位点主要是A环的C-6和C-8位,能够与丙烯醛发生Michael加成反应,随后C-5或C-7附近的羟基对末端醛进行亲核攻击,从而形成稳定的环状半缩醛结构[55−56],具体加成如图4所示。
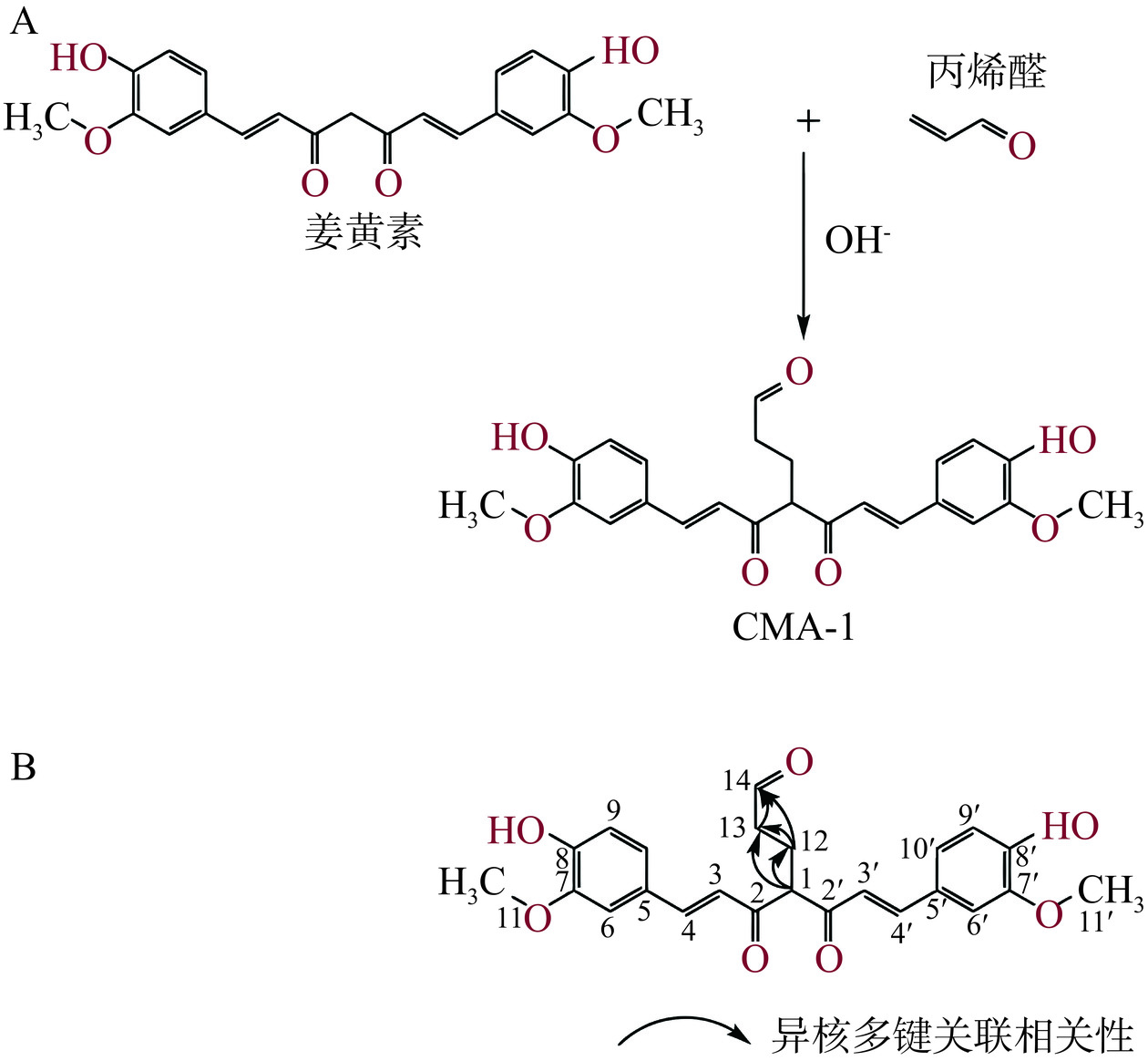
也有一些多酚的加合位点有所不同,如根皮素结合丙烯醛的活性位点位于C-3和C-5位[54],杨梅素[57]、白藜芦醇[55]和EGCG[53]等化合物B环的C-2位可以与丙烯醛发生Michael加成反应并与C-3位羟基成环,三者在模拟生理条件下,对丙烯醛的捕获率均达85%以上。Jiang等[58]研究发现姜黄素也可以捕获丙烯醛形成加合物,其在碱性条件下会被激活,并与丙烯醛发生Michael加成反应,在C-1位和丙烯醛结合,形成姜黄素-丙烯醛加合物(CMA-1),其结构如图5所示,当姜黄素(0.03%)与槲皮素(0.014%)联合添加时能够协同抑制烤鸡翅中的丙烯醛生成,且将抑制率提升到72%,远高于单一多酚的抑制活性。Fodor等[59]提出L-抗坏血酸是与丙烯醛反应的良好Michael供体,并且经过烯二醇介导的分子内环化能够形成抗坏血酸-丙烯醛加合物。Wang等[60]发现没食子酸丙酯在高温下能有效捕获丙烯醛,并利用蛋糕模型证实了其对真实食品体系中丙烯醛的捕获作用。Liu等[61]通过建立多酚-丙烯醛直接反应体系,对包括小豆蔻素、姜黄素、山姜素、乔松素等在内的数种多酚进行了实验,发现小豆蔻素、山姜素、姜黄素和乔松素几种多酚可以与丙烯醛反应形成多酚-丙烯醛加合物。
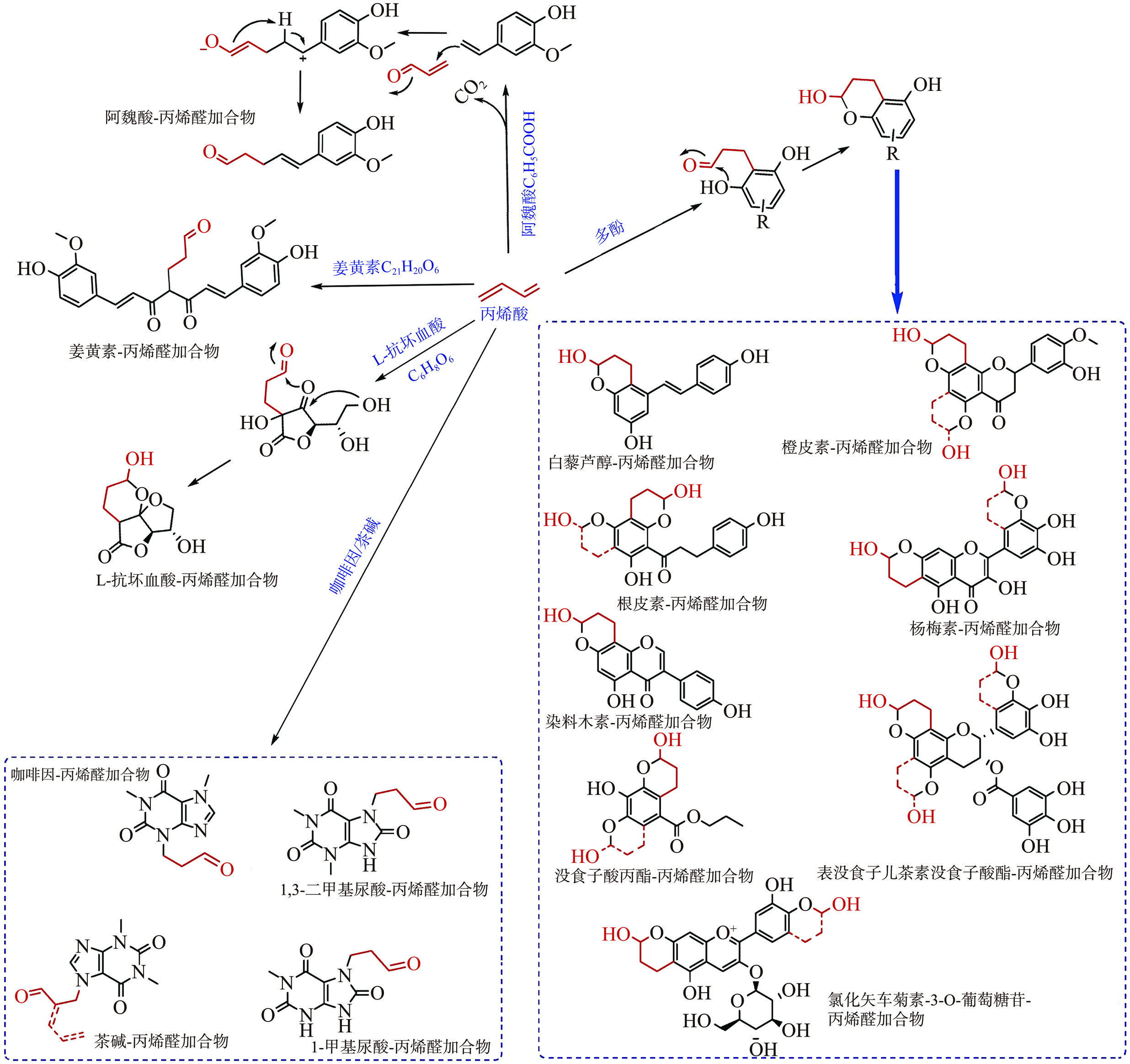
图6总结概括了当前已有报道的不同种类多酚化合物捕获丙烯醛形成相应加合物的结构[62]。此外,部分多酚化合物也能捕获丁烯醛生成加合物[54],但目前相关研究较少。上述研究表明,在IQ型HAs的反应体系中,外源添加物也可能通过捕获体系中的活性羰基化合物丙烯醛和丁烯醛,进而实现对IQ型HAs的抑制。
3. 总结与展望
本文系统分析了热加工肉制品中IQ型HAs的形成机理,并重点阐述了外源添加物对IQ型HAs形成的抑制机制,分别从前体物竞争性抑制机制、自由基清除机制和活性羰基化合物捕获机制3个方面进行了分析和讨论。在实际的肉制品热加工过程中,采用合适的热加工方式,配合合理的外源添加物,进而通过有效清除反应体系中的自由基,捕获活性羰基化合物,实现降低IQ型HAs的生成量,提升肉类食品加工的精细化水平,为肉类食品的可持续健康发展保驾护航。但与此同时,还有一些问题亟待进一步探讨,例如利用外源添加物清除自由基反应后,其可能形成的多酚自由基的去向尚缺乏更深层次的探究,外源添加物捕获活性羰基化合物后形成的新化合物的毒理学特性也尚不明晰,这些都是值得深究的科学问题。另外,HAs的种类繁多,而截止目前,仅有个别HAs的形成过程相对较为明确,对于其他种类HAs的形成机制,以及相应的抑制机制亟待探索研究。
此外,当前对于外源添加物抑制IQ型杂环胺的研究主要集中在添加植物基多酚这一范围内,对其他类型的外源添加物研究较少。在其他类型的HAs,如PhIP的研究中,国内外学者尝试使用包括特定种类氨基酸浸泡、添加亲水胶体等方法成功降低了PhIP的含量。在过往研究中,有学者提出IQ型HAs的形成路径与PhIP存在部分相似,且有少部分研究也发现亲水胶体、乳化剂和部分黄酮苷可以有效降低IQ型HAs含量,因此,未来研究中可以借鉴与IQ型HAs相似结构和形成途径的HAs的资料进行深入研究。同时,目前对于IQ型HAs的研究中,外源添加物的主要成分为多酚、黄酮和类黄酮这些植物基成分,对不同多酚间及不同外源性添加物间的协同作用研究相对较少。因此,多种同类外源物质或不同种类外源添加物间是否具有某种协同效应,其能否对HAs的生成产生较显著的影响可能是未来此类研究的重点。
-
表 1 外源添加物通过竞争性抑制/中断前体物反应抑制杂环胺
Table 1 Exogenous additives inhibit heterocyclic amines by competitive inhibition/interruption of precursor reactions
-
[1] BELLAMRI M, LE HEGARAT L, VERNHET L, et al. Human T lymphocytes bioactivate heterocyclic aromatic amines by forming DNA adducts[J]. Environmental and Molecular Mutagenesis,2016,57(9):656−667. doi: 10.1002/em.22059
[2] PATHAK K V, CHIU T L, AMIN E A, et al. Methemoglobin formation and characterization of hemoglobin adducts of carcinogenic aromatic amines and heterocyclic aromatic amines[J]. Chemical Research in Toxicology,2016,29(3):255−269. doi: 10.1021/acs.chemrestox.5b00418
[3] GIBIS M. Heterocyclic aromatic amines in cooked meat products:causes, formation, occurrence, and risk assessment[J]. Comprehensive Reviews in Food Science and Food Safety,2016,15(2):269−302. doi: 10.1111/1541-4337.12186
[4] 张世钰, 高萌, 王未, 等. 植物多酚抑制热加工肉制品中杂环胺形成机制研究进展[J]. 食品科学,2023,44(9):211−220. [ZHANG Shiyu, GAO Meng, WANG Wei, et al. Research prog-ress on the mechanism of plant polyphenols inhibiting the formation of heterocyclic amines in heat-processed meat products[J]. Food Science,2023,44(9):211−220.] doi: 10.7506/spkx1002-6630-20220414-165 ZHANG Shiyu, GAO Meng, WANG Wei, et al. Research prog-ress on the mechanism of plant polyphenols inhibiting the formation of heterocyclic amines in heat-processed meat products[J]. Food Science, 2023, 44(9): 211−220. doi: 10.7506/spkx1002-6630-20220414-165
[5] BARZEGAR F, KAMANKESH M, MOHAMMADI A. Heterocyclic aromatic amines in cooked food:A review on formation, health risk-toxicology and their analytical techniques[J]. Food Chemistry,2019,280:240−254. doi: 10.1016/j.foodchem.2018.12.058
[6] ZHAO L, PAN F, ZHOU N, et al. Quantitative proteomics and bioinformatics analyses reveal the protective effects of cyanidin-3-O-glucoside and its metabolite protocatechuic acid against 2-amino-3-methylimidazo[4,5-f]quinoline (IQ)-induced cytotoxicity in HepG2 cells via apoptosis-related pathways[J]. Food and Chemical Toxicology,2021,153:112256. doi: 10.1016/j.fct.2021.112256
[7] TAUQEERUNNISA S, JASON R C. Potential role of heterocyclic aromatic amines in neurodegeneration[J]. Chemical Rese-arch in Toxicology,2022,35:59−72. doi: 10.1021/acs.chemrestox.1c00274
[8] LI Z, CAO P, MENG H, et al. Long-term exposure to 2-amino-3-methylimidazo[4,5-f]quinoline can trigger a potential risk of Parkinson's disease[J]. Journal of Hazardous Materials,2021,412:125230. doi: 10.1016/j.jhazmat.2021.125230
[9] STAVRIC B. Biological significance of trace levels of mutagenic heterocyclic aromatic amines in human diet:A critical review[J]. Food and Chemical Toxicology,1994,32(10):977−994. doi: 10.1016/0278-6915(94)90093-0
[10] ZAMORA R, LAVADO-TENA C M, HIDALGO F J. Identification of precursors and formation pathway for the heterocyclic aromatic amine 2-amino-3-methylimidazo[4,5-f]quinoline(IQ)[J]. Journal of Agricultural and Food Chemistry,2020,68(28):7474−7481. doi: 10.1021/acs.jafc.0c02869
[11] SKOG K, JÄGERSTAD K, ARVIDSSON P, et al. Chemistry, formation and occurrence of genotoxic heterocyclic amines identified in model systems and cooked foods[J]. Zeitschrift für Lebensmitteluntersuchung und-Forschung A,1998,207(6):419−427.
[12] SKOG K, JAGERSTAD M. Incorporation of carbon atoms from glucose into the food mutagens MeIQx and 4, 8-DiMeIQx using 14C-labelled glucose in a model system[J]. Carcinogenesis,1993,14(10):2027−2031. doi: 10.1093/carcin/14.10.2027
[13] SKOG K, JAGERSTAD M. Incorporation of 14C-glucose into mutagenic heterocyclic amines[C]//Labuza T P, Reineccius G A, Monnier V M, et al. In:Woodhead publishing series in food science, technology and nutrition, maillard reactions in chemistry, food and health. Woodhead Publishing, 2005:147−152.
[14] ZAMORA R, HIDALGO F J. Formation of heterocyclic aromatic amines with the structure of aminoimidazoazarenes in food products[J]. Food Chemistry,2019,313:126128.
[15] ZAMORA R, LAVADOTENA C M, HIDALGO F J. Reactive carbonyls and the formation of the heterocyclic aromatic amine 2-amino-3, 4-dimethylimidazo(4,5-f)quinoline (MeIQ)[J]. Food Chemistry,2020,324:126898. doi: 10.1016/j.foodchem.2020.126898
[16] LEE H, LIN M Y, LIN S T. Characterization of the mutagen 2-amino-3-methylimidazo [4,5-f]quinoline prepared from a 2-methylpyridine/creatinine/acetylformaldehyde model system[J]. Mutagenesis,1994,9(2):157−162. doi: 10.1093/mutage/9.2.157
[17] 侯慧文. 不同烤制程度下羊肉中杂环胺生成规律的研究[D]. 锦州:渤海大学, 2021:15−68. [HOU Huiwen. Study on the formation of heterocyclic amines in mutton under different roasting degrees[D]. Jinzhou:Bohai University, 2021:15−68.] HOU Huiwen. Study on the formation of heterocyclic amines in mutton under different roasting degrees[D]. Jinzhou: Bohai University, 2021: 15−68.
[18] HAN T, WANG T, HOU H, et al. Raw to charred:Changes of precursors and intermediates and their correlation with heterocyclic amines formation in grilled lamb[J]. Meat Science,2023,195:108999. doi: 10.1016/j.meatsci.2022.108999
[19] PEARSON A M, CHEN C, GRAY J I, et al. Mechanism(s) involved in meat mutagen formation and inhibition[J]. Free Radical Biology and Medicine,1992,13(2):161−167. doi: 10.1016/0891-5849(92)90078-U
[20] KATO T, HARASHIMA T, MORIYA N, et al. Formation of the mutagenic/carcmogenic imidazoquinoxaline- type heterocyclic amines through the unstable free radical Maillard intermediates and its inhibition by phenolic antioxidants[J]. Carcinogenesis,1996,17(11):2469−2476. doi: 10.1093/carcin/17.11.2469
[21] KIKUGAWA K. Involvement of free radicals in the formation of heterocyclic amines and prevention by antioxidants[J]. Cancer Letters,1999,143(2):123−126. doi: 10.1016/S0304-3835(99)00140-8
[22] BORDAS M, MOYANO E, PUIGNOU L, et al. Formation and stability of heterocyclic amines in a meat flavour model system. Effect of temperature, time and precursors[J]. Journal of Chromatography B,2004,802(1):11−17. doi: 10.1016/j.jchromb.2003.09.024
[23] SZTERK A, WASZKIEWICZROBAK B. Influence of selected quality factors of beef on the profile and the quantity of heterocyclic aromatic amines during processing at high temperature[J]. Meat Science,2014,96(3):1177−1184. doi: 10.1016/j.meatsci.2013.11.019
[24] 任晓镤. 新疆多枝柽柳皮提取物对烤羊肉饼品质及杂环胺形成的影响[D]. 南京:南京农业大学, 2020:135−141. [REN Xiaopu. Effects of Xinjiang Tamarix ramosissima bark extract on the quality and heterocyclic amine formation of roast mutton patties[D]. Nanjing:Nanjing Agricultural University, 2020:135−141.] REN Xiaopu. Effects of Xinjiang Tamarix ramosissima bark extract on the quality and heterocyclic amine formation of roast mutton patties[D]. Nanjing: Nanjing Agricultural University, 2020: 135−141.
[25] ZENG M, LI Y, HE Z, et al. Discrimination and investigation of inhibitory patterns of flavonoids and phenolic acids on heterocyclic amine formation in chemical model systems by UPLC-MS profiling and chemometrics[J]. European Food Research and Technology,2016,242(3):313−319. doi: 10.1007/s00217-015-2541-8
[26] TENG H, MI Y N, DENG H T, et al. Acylated anthocyanin inhibited the formation of heterocyclic amines in hybrid chemical model system and its underlying mechanism[J]. Food Chemistry:X,2023,17:100559.
[27] CHU J, LIN S, YUAN Y, et al. Effects of quercetin and l-ascorbic acid on heterocyclic amines and advanced glycation end products production in roasted eel and lipid-mediated inhibition mechanism analysis[J]. Food Chemistry,2024,441:138394. doi: 10.1016/j.foodchem.2024.138394
[28] CHEN Y, XI J. Effects of the non-covalent interactions between polyphenols and proteins on the formations of the heterocyclic amines in dry heated soybean protein isolate[J]. Food Chemistry,2021,373:131557.
[29] DING X, ZHANG D, LIU H, et al. Chlorogenic acid and epicatechin:An efficient inhibitor of heterocyclic amines in charcoal roasted lamb meats[J]. Food Chemistry,2021,368:130865.
[30] XUE C Y, HE Z Y, QIN F, et al. Effects of amides from pungent spices on the free and protein-bound heterocyclic amine profiles of roast beef patties by UPLC-MS/MS and multivariate statistical analysis[J]. Food Research International,2020,135:109299. doi: 10.1016/j.foodres.2020.109299
[31] CHENG X R, MA J H, ISSOUFOU A , et al. Electrophilic components from Xiaoheiyao (rhizomes of Inula nervosa Wall.) alleviate the production of heterocyclic aromatic amines via creatinine inhibition[J]. Food Chemistry, 2023, 404:134561.
[32] XU Y, CHENG Y, ZHU Z, et al. Inhibitory effect of mulberry leaf (Morus alba L.) extract on the formation of free and bound heterocyclic amines in pan-fried muscovy duck (Cairina moschata) patties[J]. Food Control,2023,144:109359. doi: 10.1016/j.foodcont.2022.109359
[33] ZHANG S, WANG R, CHU J, et al. Vegetable extracts:Effective inhibitors of heterocyclic aromatic amines and advanced glycation end products in roasted mackerel[J]. Food Chemistry,2023,412:135559. doi: 10.1016/j.foodchem.2023.135559
[34] ALAEJOS M S, AFONSO A M. Factors that affect the content of heterocyclic aromatic amines in foods[J]. Comprehensive Reviews in Food Science & Food Safety,2011,10(2):52−108.
[35] BALOGH Z, GRAY J I, GOMAA E A, et al. Formation and inhibition of heterocyclic aromatic amines in fried ground beef patties[J]. Food and Chemical Toxicology,2000,38(5):395−401. doi: 10.1016/S0278-6915(00)00010-7
[36] KHAN I A, LUO J, SHI H B, et al. Mitigation of heterocyclic amines by phenolic compounds in allspice and perilla frutescens seed extract:The correlation between antioxidant capacities and mitigating activities[J]. Food Chemistry,2021,368:130845.
[37] TENGILIMOGLU-METIN M M, AYTUL H, VURAL G, et al. Inhibitory effect of hawthorn extract on heterocyclic aromatic amine formation in beef and chicken breast meat[J]. Food Research International,2017,99:586−595. doi: 10.1016/j.foodres.2017.06.044
[38] TENG H, CHEN Y, LIN X J, et al. Inhibitory effect of the extract from Sonchus olearleu on the formation of carcinogenic heterocyclic aromatic amines during the pork cooking[J]. Food and Chemical Toxicology,2019,129:138−143. doi: 10.1016/j.fct.2019.04.043
[39] KILIC S, OZ E, OZ F. Effect of turmeric on the reduction of heterocyclic aromatic amines and quality of chicken meatballs[J]. Food Control,2021,128:108189. doi: 10.1016/j.foodcont.2021.108189
[40] REN X, LI M, WANG W, et al. Inhibitory effect of Tamarix ramosissima extract on the formation of heterocyclic amines in roast lamb patties by retarding the consumption of precursors and preventing free radicals[J]. Foods,2022,11:1000. doi: 10.3390/foods11071000
[41] LOGANAYAKI N, SIDDHURAJU P, MANIAN S. Antioxidant activity and free radical scavenging capacity of phenolic extracts from Helicteres isora L. and Ceiba pentandra L[J]. Journal of Food Science and Technology,2013,50(4):687−695. doi: 10.1007/s13197-011-0389-x
[42] NATHAN R, PERRON JULIA L, BRUMAGHIM. A review of the antioxidant mechanisms of polyphenol compounds related to iron binding[J]. Cell Biochemistry and Biophysics,2009,53(2):75−100. doi: 10.1007/s12013-009-9043-x
[43] PAULINA M, ANNA S, MAGDALENA M, et al. Overview of the antioxidant and anti-inflammatory activities of selected plant compounds and their metal ions complexes[J]. Molecules,2021,26(16):4886. doi: 10.3390/molecules26164886
[44] KIYOMI K, KAZUYUKI H, KATO T, et al. Effect of food reductones on the generation of the pyrazine cation radical and on the formation of the mutagens in the reaction of glucose, glycine and creatinine[J]. Mutation Research:Genetic Toxicology and Environmental Mutagenesis,2000,465(1-2):183−190. doi: 10.1016/S1383-5718(99)00227-2
[45] T ANDZI BARHÉ, G R FEUYA TCHOUYA. Comparative study of the antioxidant activity of the total polyphenols extracted from Hibiscus Sabdariffa L., Glycine max L. Merr., yellow tea and red wine through reaction with DPPH free radicals[J]. Arabian Journal of Chemistry, 2016, 9(1):1−8.
[46] 石宝明, 迟子涵. 自由基对动物的危害及消除技术研究进展[J]. 饲料工业,2021,42(9):1−6. [SHI Baoming, CHI Zihan. Research progress on the harm of free radicals to animals and elimination technology[J]. Feed Industry,2021,42(9):1−6.] SHI Baoming, CHI Zihan. Research progress on the harm of free radicals to animals and elimination technology[J]. Feed Industry, 2021, 42(9): 1−6.
[47] 胡燕, 袁晓晴. 食品体系中活性羰基物质的研究进展[J]. 粮食与油脂,2017,30(5):1−3. [HU Yan, YUAN Xiaoqing. Research progress of active carbonyl compounds in food systems[J]. Cereals and Oils,2017,30(5):1−3.] doi: 10.3969/j.issn.1008-9578.2017.05.001 HU Yan, YUAN Xiaoqing. Research progress of active carbonyl compounds in food systems[J]. Cereals and Oils, 2017, 30(5): 1−3. doi: 10.3969/j.issn.1008-9578.2017.05.001
[48] 汤龙, 宋焕禄, 王丽金. 不同分子质量大豆蛋白和鸡肉酶解物的美拉德反应产物风味特征分析[J]. 食品科学技术学报,2023,41(3):148−162. [TANG Long, SONG Huanlu, WANG Lijin. Analysis of flavor characteristics of Maillard reaction products of soybean protein and chicken hydrolysates with different molecular weights[J]. Journal of Food Science and Technology,2023,41(3):148−162.] doi: 10.12301/spxb202200174 TANG Long, SONG Huanlu, WANG Lijin. Analysis of flavor characteristics of Maillard reaction products of soybean protein and chicken hydrolysates with different molecular weights[J]. Journal of Food Science and Technology, 2023, 41(3): 148−162. doi: 10.12301/spxb202200174
[49] LUND M N, RAY C. Control of Maillard reactions in foods:Strategies and chemical mechanisms[J]. Journal of Agricultural and Food Chemistiy,2017,65(23):4537−4552. doi: 10.1021/acs.jafc.7b00882
[50] ECHAVARRÍA A P, PAGÁN J, IBARZ A. Melanoidins formed by Maillard reaction in food and their biological activity[J]. Food Engineering Reviews,2012,4(4):203−223. doi: 10.1007/s12393-012-9057-9
[51] CHENG K W, CHEN F, WANG M. Inhibitory activities of dietary phenolic compounds on heterocyclic amine formation in both chemical model system and beef patties[J]. Molecular Nutrition and Food Research,2007,51(8):969−976. doi: 10.1002/mnfr.200700032
[52] CHENG K W, WONG C C, CHO C K, et al. Trapping of phenylacetaldehyde as a key mechanism responsible for naringenin's inhibitory activity in mutagenic 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine formation[J]. Chemical Research in Toxicology,2008,21(10):2026−2034. doi: 10.1021/tx800220h
[53] ZHU Q, ZHENG Z P, CHENG K W, et al. Natural polyphenols as direct trapping agents of lipid peroxidation-derived acrolein and 4-hydroxy-trans-2-nonenal[J]. Chemical Research in Toxicology,2009,22(10):1721−1727. doi: 10.1021/tx900221s
[54] ZAMORA R, AGUILAR I, GRANVOGL M, et al. Toxicologically relevant aldehydes produced during the frying process are trapped by food phenolics[J]. Journal of Agricultural and Food Chemistry,2016,64(27):5583−5589. doi: 10.1021/acs.jafc.6b02165
[55] HUANG Q J, ZHU Y D, SANG S M, et al. Translating in vitro acrolein-trapping capacities of tea polyphenol and soy genistein to in vivo situation is mediated by the bioavailability and biotransformation of individual polyphenols[J]. Molecular Nutrition & Food Research,2020,64(1):1900274.
[56] SONG X L, LU Y, LU Y L, et al. Adduct formation of acrolein with cyanidin-3-O-glucoside and its degradants/metabolites during thermal processing or in vivo after consumption of red bayberry[J]. Journal of Agricultural and Food Chemistry,2021,69(44):294−301.
[57] ZHANG D M, JIANG X Y, XIAO L H, et al. Mechanistic studies of inhibition on acrolein by myricetin[J]. Food Chemistry,2020,323:126788. doi: 10.1016/j.foodchem.2020.126788
[58] JIANG X Y, LU Y, LU Y L, et al. Trapping of acrolein by curcumin and the synergistic inhibition effect of curcumin combined with quercetin[J]. Journal of Agricultural and Food Chemistry,2020,69(1):294−301.
[59] FODOR G, ARNOLD R, MOHACSI T, et al. A new role for l-ascorbic acid:Michael donor to α,β-unsaturated carbonyl compounds[J]. Tetrahedron,1983,39(13):2137−2145. doi: 10.1016/S0040-4020(01)91929-5
[60] WANG J Q, LU Y L, ZHENG T S, et al. Scavenging of acrolein by food-grade antioxidant propyl gallate in a model reaction system and cakes[J]. Journal of Agricultural and Food Chemistry,2019,67(31):8520−8526. doi: 10.1021/acs.jafc.9b03486
[61] LIU J, LU Y, SI B, et al. Synergistic inhibitory effect of multiple polyphenols from spice on acrolein during high-temperature processing[J]. Foods,2023,12(12):2326. doi: 10.3390/foods12122326
[62] JIANG K, HUANG C H, LIU F, et al. Origin and fate of acrolein in foods[J]. Foods,2022,11(13):1976. doi: 10.3390/foods11131976





 下载:
下载:
 下载:
下载:



