Effect of Different Quick-freezing Temperatures on Quality Characteristics and Microstructure of Zigui Navel Orange Fruit Tissue
-
摘要: 为了提高速冻秭归脐橙的品质,分别在不同速冻温度下(−20、−30、−40、−50、−60、−70、−80 ℃)对秭归脐橙果肉和果皮进行加工,以评估对食用品质、维生素C、生物活性化合物、抗氧化特性、水分状态和分布以及微观结构的影响。结果表明:−60 ℃到−80 ℃速冻果肉具有较好的质地、生物活性和抗氧化活性,−80 ℃速冻果肉通过相变阶段的时间最短,水分状态和分布与新鲜果肉最接近。−40 ℃和−50 ℃速冻能够很好地保留果肉的维生素C含量、色泽和滋味。−70 ℃和−80 ℃速冻果皮的维生素C含量、色泽、质地、生物活性化合物和抗氧化活性均较高。此外,−80 ℃速冻果皮的冻结时间最短,微观结构最接近对照组。综上,秭归脐橙果肉的最适速冻温度范围为−40~−80 ℃;果皮的最适速冻温度范围为−70~80 ℃,这些发现对速冻脐橙类水果的综合评价和进一步研究开发具有重要意义。Abstract: In this study, in order to improve the quality of quick-frozen Zigui navel oranges, they were processed at varying quick-freezing temperatures (−20, −30, −40, −50, −60, −70 and −80 ℃). On the flesh and peel of Zigui navel orange to assess the influence on edible quality, vitamin C, bioactive compounds, antioxidant properties, water status and distribution, and microstructure. The results indicated that flesh frozen quickly between −60 ℃ and −80 ℃ exhibited enhanced texture, bioactivity, and antioxidant activity. Additionally, flesh frozen at −80 ℃ experienced the shortest phase transition period and maintained a moisture state and distribution most similar to fresh flesh. Quick freezing at −40 ℃ and −50 ℃ could well preserve the flesh's vitamin C content, color, and flavor. The peel with quick freezing at −70 ℃ and −80 ℃ had higher vitamin C content, color, texture, antioxidant activity and bioactive compounds. Furthermore, the peel that was quickly frozen at −80 ℃ showed the shortest freezing time and the closest microstructure to the control group. In summary, the optimal quick-freezing temperature range for Zigui navel orange flesh is from −40 ℃ to −80 ℃, and for the peel, it is from −70 ℃ to −80 ℃. These findings are crucial for the comprehensive assessment, further investigation, and advancement of quick-frozen navel orange fruit products.
-
Keywords:
- Zigui navel orange /
- flesh and peel /
- quick-freezing /
- quality preservation
-
脐橙因其独特的色香味、丰富的营养价值而成为人们喜爱的水果[1]。脐橙类果实富含有机酸、维生素、多糖等物质。果皮提取物具有抗氧化、清除自由基、抗癌、抗衰老、降血糖、降血压等多种功能[2−3]。脐橙类果肉不仅可用作食品,果皮还可用作传统药物。然而,大多数脐橙品种都是中晚熟品种,加工期短,供过于求。新鲜脐橙类果实的保质期较短,在储存过程中若果皮受损,容易造成果实腐烂变质,品质和风味也会发生劣变,这会严重制约脐橙果实产业的发展。
速冻可以降低催化生化反应的酶活性,减缓各种生化反应的速度,抑制大部分微生物的生长[4],在细胞内外形成更小、分布更均匀的冰晶,微观结构与新鲜状态最接近。以往的研究表明,冻结速率是影响速冻果蔬品质的一个关键因素[5],其影响着细胞结构中水态的变化,从而保持产品的硬度和脆度,维持膜的完整性。Dawson等[6]研究了冻结温度对桃子品质的影响,结果表明桃子的重量损失和表面冰晶孔径随着冻结温度的降低而显著减小。刘艳春等[7]研究了冻结温度对番木瓜品质变化的影响,结果表明冻结温度低有利于保持木瓜的食用品质和营养品质。李镜浩等[8]研究了不同冷冻方式对芒果块冻结特性和质量变化的影响,结果表明低冻结温度能够最大程度地降低芒果块在冷冻过程中的质量劣化。目前,脐橙果实采收后去皮,果肉和果皮分开冷冻,可以更长久地保持其色泽、风味及营养价值,分别开发柑橘果肉和果皮深加工产品,实现全年供应。因此选择合适的冻结温度对速冻脐橙果实加工制品的品质至关重要。
本研究以秭归脐橙为原料,比较不同速冻温度对秭归脐橙果肉和果皮质量和结构方面的影响。探究秭归脐橙不同组织在颜色、质地、滋味、维生素C、生物活性化合物、抗氧化特性、水分状态和分布、微观结构等方面的品质变化,以确定其合适的速冻温度区间。
1. 材料与方法
1.1 材料与仪器
秭归脐橙(Citrus sinensis Osbeck) 11月上旬新鲜采摘,中国湖北省宜昌市果园;氢氧化钠、酚酞、抗坏血酸(标准品)、草酸、2,6-二氯靛酚、酒石酸钾钠、福林酚、无水碳酸钠、亚硝酸钠、硝酸铝 分析纯,国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazy,DPPH)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2′-azino-bis-(3-ethylbenzthiazoline-6-sulfonic acid)diammonium salt,ABTS)、2,4,6-三吡啶基三嗪(2,4,6-three pyridyl three-triazine,TPTZ)、芦丁 标准品,上海源叶生物科技有限公司;3,5-二硝基水杨酸、没食子酸 标准品,上海麦克林生化科技有限公司。
MDC-SCE10低温速冻柜 东莞市华道节能科技有限公司;AR522CN温养破壁料理机(搅拌机) 苏泊尔有限公司;手持糖度计 上海力辰邦西仪器科技有限公司;ULTRASCAN PRO色差仪 美国HUNTERLAB公司;UV-1800紫外分光光度计 Shimadzu;XHF-DY高速分散器 宁波新芝生物科技股份有限公司;ASTREE Ⅱ电子舌 法国Alpha MOS公司;NMI20-015V-I 核磁共振成像分析仪 浪潮电子信息产业股份有限公司;NIB610倒置显微镜 宁波永新光学股份有限公司;JSM-6390LV生物扫描电子显微镜 日本NTC公司;TA. XT. plus质构仪 美国PERVICEL;Tlog100EC温湿度记录仪 江苏省精创电气股份有限公司。
1.2 实验方法
1.2.1 速冻脐橙果实样品制备
冷冻时间是指将样品中心温度从4 ℃降到−18 ℃所需的时间。新鲜脐橙果实分析前在4 ℃冰箱预冷过夜,进行手工剥皮,将大小一致的果肉和果皮均匀放置在不锈钢托盘上,以便从托盘周围传热。将果肉和果皮在不同温度(−20~−80 ℃)的速冻机中冻结以获得适当的脐橙产品,待样品中心温度达到−18 ℃时将其密封于保鲜袋中,在−18 ℃的温度下冻藏一周。速冻脐橙样品在检测前被转移到室温下自然解冻,新鲜的果肉和果皮用作对照。
1.2.2 冻结曲线的测定
将温湿度记录仪插入橙瓣的几何中心和橙皮表面测定温度,将其分别放入−20~−80 ℃的速冻机中,每10 s记录一次样品的温度,直至温度达到−18 ℃后取出,以速冻时间为横坐标,温度为纵坐标绘制冻结曲线图。
1.2.3 冷冻特性的测定
果肉的冷冻过程一般分为三个阶段:冷却、相变和回火。冷却阶段是从初始温度4 ℃(T0)到成核温度(T1)。相变阶段经过最大冰晶生成区。从最大冰晶生成区的拐点温度到最终温度−18 ℃为回火阶段。冷却时间、相变时间和回火时间分别定义为成核时间(Tn)、相变时间(Tp)和回火时间(Tt)。冷冻速率(V)根据Jiang等[9]的方法计算,计算公式如下:
T(min)=Tn+Tp+Tt (1) V(∘C/min)=T0−(−18)T (2) 式中,T为冻结总时间(min),T0为初始温度(℃),V为平均冻结速率(℃/min)。
由于秭归脐橙皮厚度较小,不易测量中心温度,因此冻结速率用秭归脐橙果皮表面温度从4 ℃至−18 ℃的冷冻时间(FT)表示。
1.2.4 色泽的测定
使用色度计分别测量果肉和果皮外表面在不同速冻条件下的颜色变化,分别用L*(亮度)、a*(红度)和 b*(黄度)表示[10]。以新鲜果肉和果皮为对照,分别测得L0、a0、b0。总色差(ΔE)根据以下公式计算。
ΔE=√(L∗−L0)2+(a∗−a0)2+(b∗−b0)2 (3) 1.2.5 质构的测定
参考赵金红等[11]的试验参数,使用TA. XT. plus 质构仪测定,果肉配备P/36R探头进行两轮压缩测试,测试条件:测试前速度为2 mm/s,测试速度为1 mm/s,测试后速度为4 mm/s,测试距离为5 mm。果皮配备P/2N探头进行压缩测试,测试条件:测试前速度为2 mm/s,测试速度为1 mm/s,测试后速度为1 mm/s,测试距离为5 mm。每个处理重复9次。
1.2.6 电子舌和感官评价
将不同速冻处理温度的果肉匀浆,离心后取滤液进行电子舌测试。参比电极和七个传感器的测量时间为120 s,冲洗时间为60 s[12]。对每个样品连续测量8次,记录其中五个稳定平衡数据点。
选取10位(5名女性、5名男性)经过培训的评估人员,年龄均为25周岁,分别从色泽、香味、质地和口感四个方面对解冻的脐橙果肉进行感官评价,评分标准如表1所示。
表 1 感官评价标准Table 1. Sensory evaluation standard评价指标 感官描述 分值(分) 色泽(25) 呈鲜艳的橘黄色,能充分体现应有的色泽 20~25 颜色较鲜艳,偏淡或者偏黄 15~19 颜色严重偏移柑橘本身的颜色 1~14 香味(25) 有柑橘特有的浓郁香气 20~25 有柑橘特有的香味,但比较淡,无异味 15~19 有令人不悦的异味,失去柑橘的气味 1~14 质地(25) 质地软硬适中,囊衣完整,无汁液流出 20~25 质地较硬,囊衣完整,无汁液流出 15~19 质地很软或囊衣破裂,有汁液流出 1~14 口感(25) 口感清脆,易咀嚼,无脱水现象 20~25 口感粗糙,有轻度脱水 15~19 口感粗糙,严重脱水 1~14 1.2.7 维生素C含量的测定
采用2,6−二氯靛酚测定法[13]测定。称取10 g匀浆样品(精确到0.01 g)于烧杯中,用草酸溶液将样品转移至100 mL容量瓶,稀释至刻度,过滤后的样品溶液用2,6-二氯靛酚溶液滴定至淡粉色,并保持15 s不褪色。
1.2.8 总酚含量的测定
参考文献[14]使用福林酚试剂比色法测定总酚含量。取3 g匀浆加入6 mL 80%甲醇,至60 ℃水浴中超声60 min,取出冷却,在4 ℃、10000 r/min下离心15 min,残渣再提取两次,合并滤液。上清液混合定容于10 mL容量瓶中。在25 mL容量瓶中加9 mL水和1 mL上述上清液,混匀,将1 mL的Folin–Ciocalteu试剂加入其中,暗处静置5 min,并加入2 mL的20%碳酸钠溶液。在25 ℃放置60 min后,在750 nm处测量溶液的总酚含量,结果以样品中含有的没食子酸毫克当量(mg GAE/100 g)表示。
1.2.9 抗氧化活性的测定
ABTS+·清除能力的测定:参考Zlabur等[15]的方法,将7 mmol/L ABTS与2.5 mmol/L过硫酸钾混合制备ABTS溶液,暗处静置16 h,分析时用纯水稀释ABTS溶液,在734 nm波长处获得的吸光度值(0.70±0.02)。取0.05 mL果肉和果皮上清液于试管中,加入3.6 mL ABTS溶液,将试管置于黑暗处30 min,使用全波长酶标仪在734 nm处测定吸光度,ABTS+·清除能力以样品中含有的Trolox当量(mg TE/g)表示。
DPPH·清除能力的测定:参考Blois[16]的方法,取0.1 mL果肉和果皮上清液于试管中,溶液于试管中,加入2.5 mL DPPH溶液,将试管置于黑暗处30 min,在517 nm处测量吸光度,结果以样品中含有的Trolox当量(mg TE/g)表示。
FRAP的测定:参考Tlili等[17]的方法,取0.05 mL果肉和果皮上清液于试管中,溶液于试管中,加入4.0 mL FRAP反应液,在室温下反应10 min,于593 nm处测定吸光度,结果以样品中含有的Trolox当量(mg TE/g)表示。
1.2.10 低频-核磁水分分布的测定
使用低场核磁共振分析仪对脐橙果肉样品进行LF-NMR测量,以检测不同样品的水分状态。横向弛豫时间采用CPMG脉冲序列,回波时间为0.5 ms,回波次数为12000次,等待时间为10000 ms。信号为累积8次扫描的平均值。每次测量前,从样品中心切下约1.0 g果肉,用聚乙烯薄膜包裹,然后将其放入核磁共振管中,以防与周围环境交换水分[18]。
1.2.11 微观组织结构观察
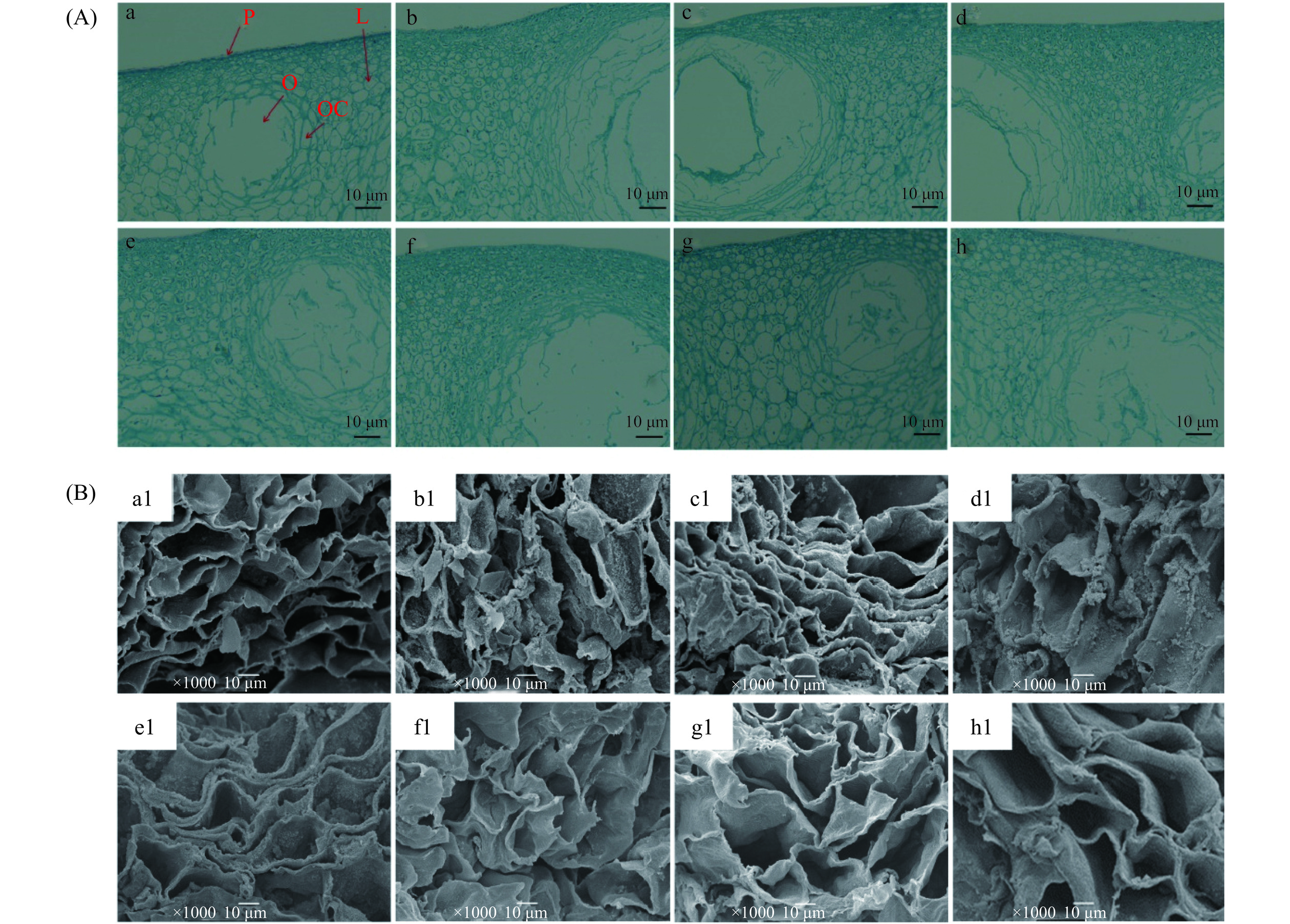
根据Ignat等[19]的方法并略有改动。将解冻的果皮样本快速放入FAA中固定24 h,并通过梯度乙醇洗脱。将组织包埋在石蜡中,然后用切片机切片,厚度为10 μm,用番红固绿染色,最后密封在载玻片中进行光学显微镜观察,观察倍数为100倍。使用扫描电子显微镜分析脐橙果皮横截面的结构变化,样品按照Pietrysiak等[20]的方法制备。新鲜对照和冷冻解冻样品经固定、水洗、乙醇梯度洗脱和冷冻干燥后,最后喷金并固定在用于观察的仪器上,观察倍数为1000倍。
1.3 数据处理
结果以“平均值±标准差”表示,除特殊标注外,每组试验均重复三次。使用Microsoft Office Excel 2021进行数据处理,使用Origin 2023处理图表。IBM SPSS 26.0用于方差分析,Duncan’s多重比较用于均值差异的显著性分析。P<0.05表示差异显著。
2. 结果与分析
2.1 不同速冻温度对脐橙果实冻结曲线和冷冻参数的影响
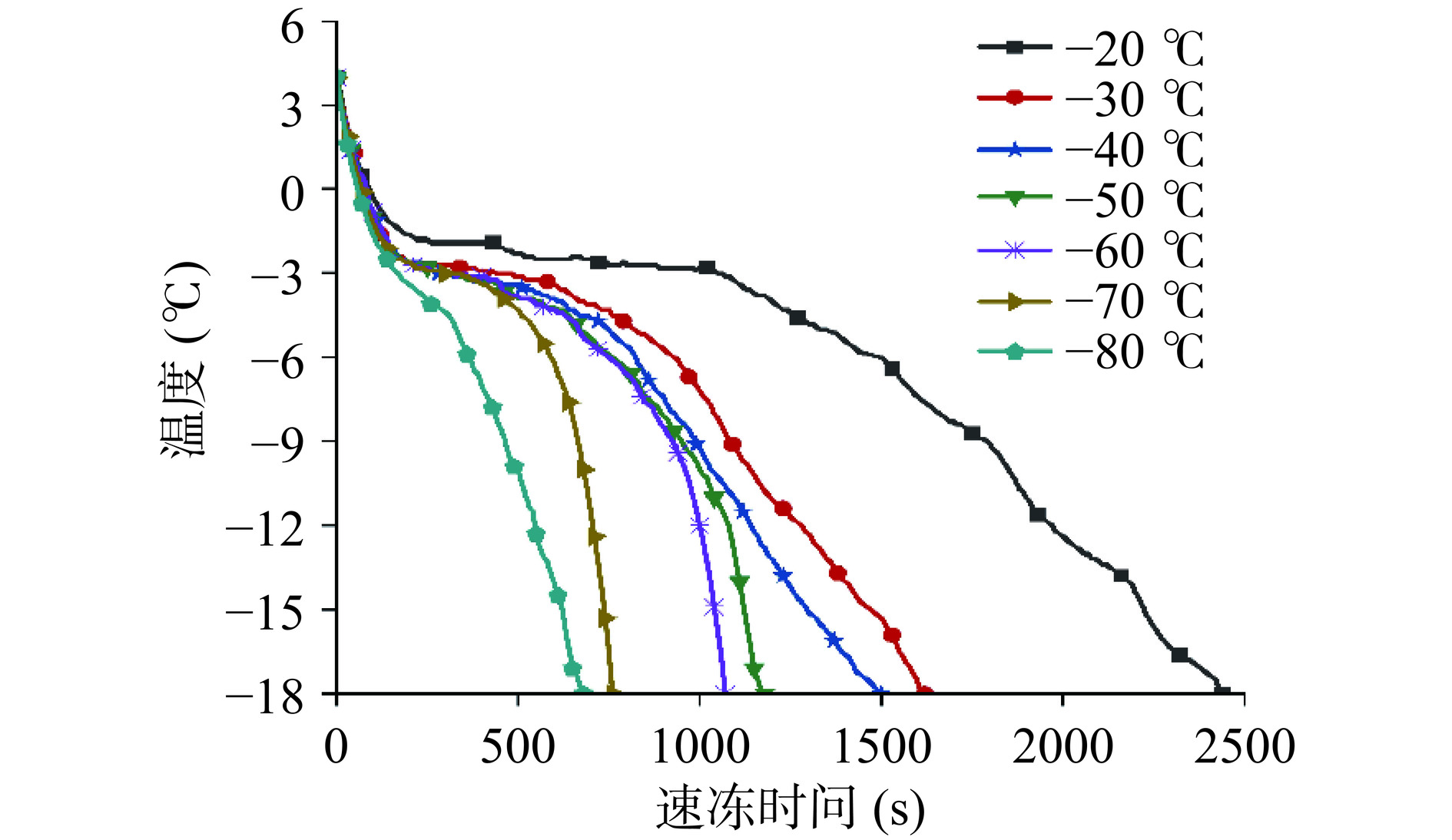
图1显示了脐橙果肉在不同速冻温度下的冻结曲线,均符合一般食品的冷冻曲线。在冷冻初期温度迅速下降;中期经过冰晶形成最大的区域,温度缓慢下降;但在冻结后期,残余水分继续冻结,部分显热和残余潜热的存在使这一阶段的降温速度减慢[21]。在−20 ℃速冻时,从4 ℃降至−18 ℃的时间为40.82 min,而在其余6种速冻温度下的时间均低于30 min。
由表2可知,随着速冻温度的降低,脐橙果肉的成核时间、相变时间和回火时间逐渐降低,平均冻结速率逐渐增大,−30 ℃到−80 ℃果肉的冻结点无显著差异(P>0.05)。与−20 ℃相比,−30 ℃到−80 ℃样品在冻结点、成核时间、相变时间、回火时间和平均冻结速率上存在显著差异(P<0.05),其中−80 ℃样品的冻结点降低了1.0 ℃,成核时间缩短了1.54 min,相变时间缩短了15.33 min,回火时间缩短了14.65 min,平均冻结速率提高了1.83 ℃/min。平均冻结速率值越大,相变时间越短。Jiang等[9]的研究证明,通过相变阶段的时间越短,样品中的成核率越高。这会导致在食物组织内形成更小、分布更均匀的冰晶。果皮的冻结速率用冷冻时间来表示,根据冷冻时间,速冻温度大致分为三类:−20~−30 ℃(10<FT<20)、−40~−50 ℃(5<FT<10)和−60~−80 ℃(FT<5)。表2显示,随着速冻温度的降低,冷冻时间逐渐减少,其中−70 ℃和−80 ℃果皮的冷冻时间无显著差异(P>0.05)。
表 2 不同速冻温度对脐橙果肉和果皮冷冻参数的影响Table 2. Effect of different quick-freezing temperatures on freezing parameters of navel orange fruit flesh and peel速冻温度(℃) 脐橙果肉 脐橙果皮 冻结点(℃) Tn(min) Tp(min) Tt(min) V(℃/min) FT(min) −20 −1.93±0.15a 4.23±0.07a 18.50±0.33a 18.10±0.61a 0.54±0.01f 16.06±0.92a −30 −2.70±0.10b 3.77±0.06b 10.39±0.42b 13.61±0.51b 0.79±0.03e 14.11±0.42b −40 −2.63±0.15b 3.69±0.13bc 8.89±0.26c 12.44±0.41c 0.88±0.02d 9.11±0.26c −50 −2.83±0.15b 3.51±0.33bc 7.25±0.38d 9.11±0.54d 1.11±0.01c 6.83±0.34d −60 −2.80±0.10b 3.43±0.07c 7.72±0.25d 7.83±0.17e 1.16±0.02c 3.89±0.26e −70 −2.73±0.21b 2.85±0.17d 4.44±0.34e 3.50±0.33f 2.04±0.08b 3.33±0.17ef −80 −2.93±0.25b 2.69±0.13d 3.17±0.17f 3.45±0.25f 2.37±0.06a 2.94±0.10f 注:同列中不同小写字母表示样品之间存在显著性差异(P<0.05),表3~表5同。 2.2 不同速冻温度对脐橙果实色泽的影响
表3列出了不同速冻温度下秭归脐橙果实的颜色参数。结果表明,经过速冻-解冻后,秭归脐橙果肉和果皮的L*显著降低(P<0.05),a*和b*也显著低于新鲜果实(P<0.05)。这是因为冷冻破坏了秭归脐橙细胞的完整结构,解冻后酶和褐变底物容易暴露,从而发生酶促褐变,果皮的褐变程度更大[22]。此外,冷冻会加快解冻过程中受损细胞色素的释放速度,水溶性色素随着果汁的流失而消失,这是冷冻脐橙类果实色差值变化的主要原因[22]。−20 ℃ 果肉的总色差 ΔE 值最大,其次是 −30 ℃;−60 ℃ 到 −80 ℃ 的 ΔE 值无显著差异(P>0.05);−40 ℃ 和 −50 ℃ 的 ΔE 值较小,显著低于其他速冻温度(P<0.05),这表明速冻温度适中有利于减少脐橙果肉的颜色变化,速冻温度过高不利于颜色的保留。−20 ℃ 果皮的 ΔE 值显著高于其他速冻温度(P<0.05);−30 ℃ 到 −60 ℃ 的 ΔE 值无显著差异(P>0.05);−80 ℃ 果皮的 ΔE 值最小,其次是 −70 ℃,这表明脐橙果皮的 ΔE 值随着冻结温度增大而逐渐变小。
表 3 不同速冻温度对脐橙果肉和果皮色差的影响Table 3. Effects of different quick-freezing temperatures on color of navel orange fruit flesh and peel速冻温度(℃) L* a* b* ΔE 脐橙果肉 新鲜对照 56.68±1.33a 3.94±0.11a 25.74±1.73a − −20 48.30±1.54e 3.21±0.05d 22.61±0.85cd 9.16±1.99a −30 50.43±1.18d 3.69±0.17b 21.84±1.10d 7.59±1.70b −40 52.40±1.35c 3.72±0.16b 23.40±1.02bc 5.08±1.59c −50 53.63±0.72b 3.30±0.19d 24.22±0.60b 3.72±1.04c −60 51.01±1.84d 3.24±0.11d 22.75±1.20cd 6.72±1.40b −70 51.21±0.91cd 3.57±0.15c 22.21±0.60d 6.65±1.61b −80 50.76±0.87d 3.31±0.08d 23.87±1.11b 6.65±1.24b 脐橙果皮 新鲜对照 58.85±0.65a 32.86±0.90a 61.49±1.02a − −20 52.28±1.70d 20.50±1.08d 50.58±0.73e 17.83±1.43a −30 53.49±1.05cd 23.26±1.07c 52.52±1.67cd 14.34±2.49b −40 54.05±1.89c 25.27±0.99b 51.63±0.68de 13.48±1.18b −50 55.57±1.25b 22.49±1.24c 53.54±1.91bc 13.67±2.27b −60 56.82±1.38b 22.18±1.95c 53.76±2.14bc 13.60±1.79b −70 56.07±1.70b 25.18±1.08b 52.09±2.21cde 12.71±2.83bc −80 56.96±1.21b 25.26±1.88b 54.35±2.47b 10.80±2.72c 2.3 不同速冻温度对脐橙果实质构的影响
由表4可知,速冻处理过的脐橙果肉硬度、胶着性和咀嚼性显著低于新鲜果肉(P<0.05),弹性高于新鲜果肉。速冻脐橙果皮的硬度显著低于新鲜果皮,脆性显著高于新鲜果皮(P<0.05)。−60 ℃ 至−80 ℃的果肉硬度无显著性差异(P>0.05),与新鲜果肉较接近。相比之下,−20 ℃ 果肉硬度下降幅度最大,显著低于其他速冻处理组(P<0.05)。这是因为最低的冻结速率导致形成了相对较多的细胞外冰晶,解冻后细胞结构破坏严重,从而硬度降低。胶着性和咀嚼性的变化趋势与硬度相同,而弹性值的变化趋势则相反。新鲜脐橙果皮的硬度显著高于经过速冻处理的样品(P<0.05)。−80 ℃的硬度最接近新鲜果皮的硬度,脆性的变化趋势与硬度相反。−20 ℃和−30 ℃果皮的硬度无显著差异(P>0.05),显著低于其他处理组的样品(P<0.05)。综上,缓慢冷冻会形成大尺寸的冰晶,导致严重的机械损伤,从而加剧软化[23−24],对脐橙类水果的组织结构造成不可逆的纹理损失,影响水果的质地和风味。
表 4 不同速冻温度对脐橙类果肉和果皮质构特性的影响Table 4. Effects of different quick-freezing temperatures on texture characteristics of navel orange fruit flesh and peel速冻温度(℃) 脐橙果肉 脐橙果皮 硬度(g) 胶着性 咀嚼性(g) 弹性 硬度(g) 脆性 新鲜对照 918.28±47.62a 526.19±16.89a 416.04±22.11a 0.89±0.03e 107.86±4.38a 0.84±0.04d −20 653.63±41.88e 371.05±13.76e 308.96±17.04e 0.97±0.01a 84.16±2.96c 1.30±0.13a −30 722.79±33.30d 376.67±18.39e 325.49±22.44e 0.95±0.01b 85.75±3.19c 1.25±0.12a −40 776.81±29.53c 399.91±12.17d 332.25±20.38d 0.93±0.01c 94.75±2.88b 1.13±0.06b −50 773.76±22.79c 402.15±18.21d 348.74±24.33cd 0.92±0.01cd 94.65±4.01b 1.13±0.07b −60 846.54±29.43b 457.72±23.82b 380.30±25.18b 0.90±0.02de 97.00±5.37b 1.08±0.37b −70 829.09±20.72b 428.98±17.58c 361.26±21.04bc 0.91±0.02de 96.47±4.34b 1.05±0.08c −80 841.08±30.42b 450.69±22.96b 378.86±17.88b 0.90±0.02e 98.12±5.37b 0.98±0.09c 2.4 不同速冻温度对脐橙果肉电子舌和感官评价的影响
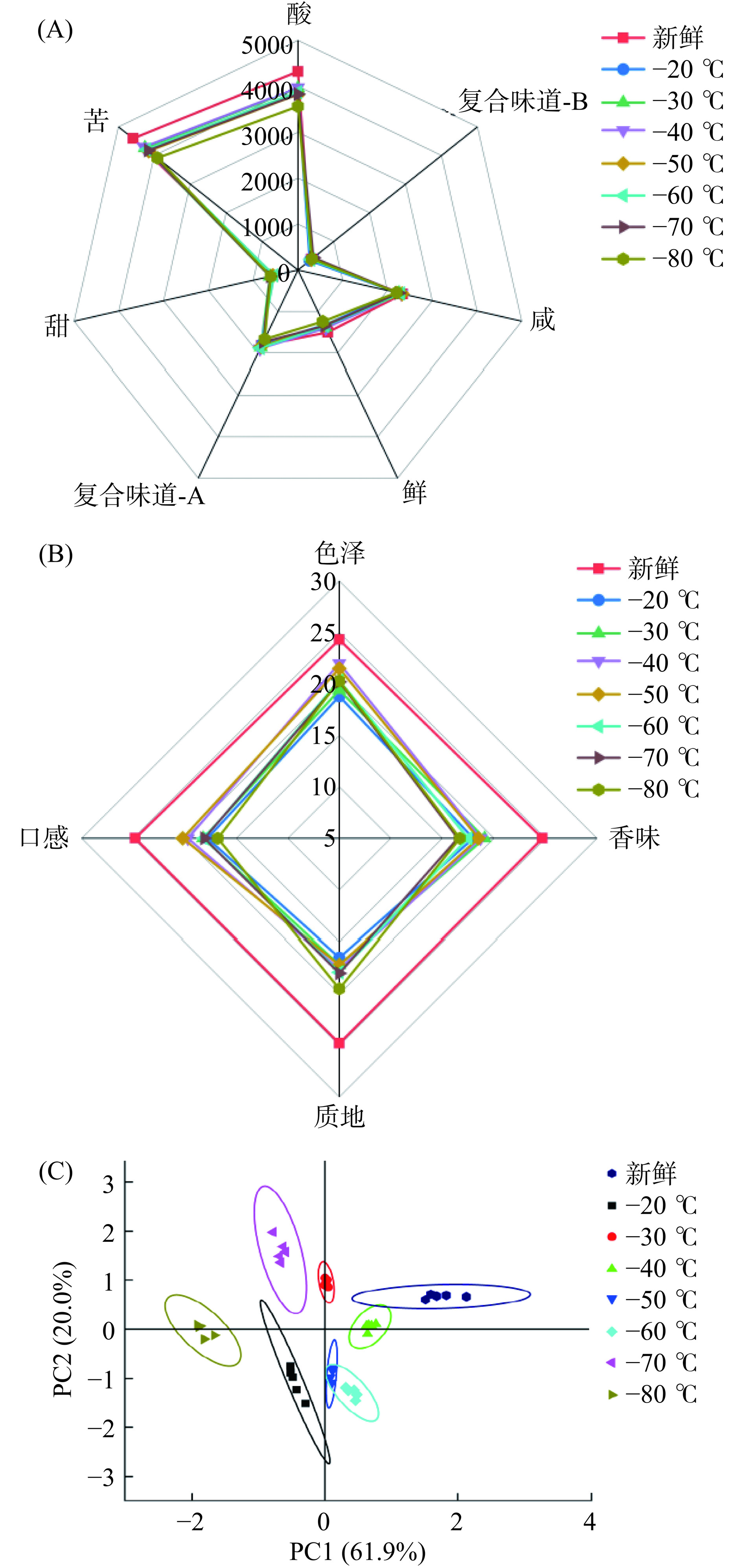
从图2(A)可以看出,解冻后所有脐橙果肉的酸味和苦味都明显减弱,这可能是由于有机酸随着果汁的流失而流失,导致解冻后脐橙果肉的酸度降低[22]。在所有速冻条件下,−80 ℃对脐橙果肉苦味降低的影响最为明显。总之,−20 ℃到−80 ℃七个处理组果肉的滋味都有所下降,这与感官评分一致。从图2(B)可以看出,速冻果肉解冻后的感官评分有所降低,但解冻后的果肉仍具有较好的色泽、香味、质地和口感。−40 ℃和−50 ℃果肉的感官评分较高,这是因为冻结温度适中,解冻后果肉汁液流失较少,口感更好。−20 ℃果肉的感官评分最低,这可能是由于冻结温度较高,解冻后细胞结构损伤较大,导致色泽、香味、质地和口感都不理想。
不同速冻温度下脐橙果肉电子舌的口感质量PCA分析见图2(C),结果显示八组样品之间有明显的区别。PC1和PC2两个主成分的得分率分别为61.9%和20.0%,主成分贡献率的累加值为81.9%,表明提取的两个主成分可以解释原始数据中的大部分信息。在PCA图中,新鲜果肉和−40 ℃果肉的分布比较接近,而其他样品的分布则相距较远。−50 ℃和−60 ℃果肉之间的交叉点表明两者滋味有相似之处。−80 ℃和−20 ℃果肉与新鲜样品相距远,表明它们与新鲜果肉的滋味特征存在很大差异,可能较高或较低的冻结速率均会明显影响脐橙果肉的口感。
2.5 不同速冻温度对脐橙果实维生素C和总酚含量的影响
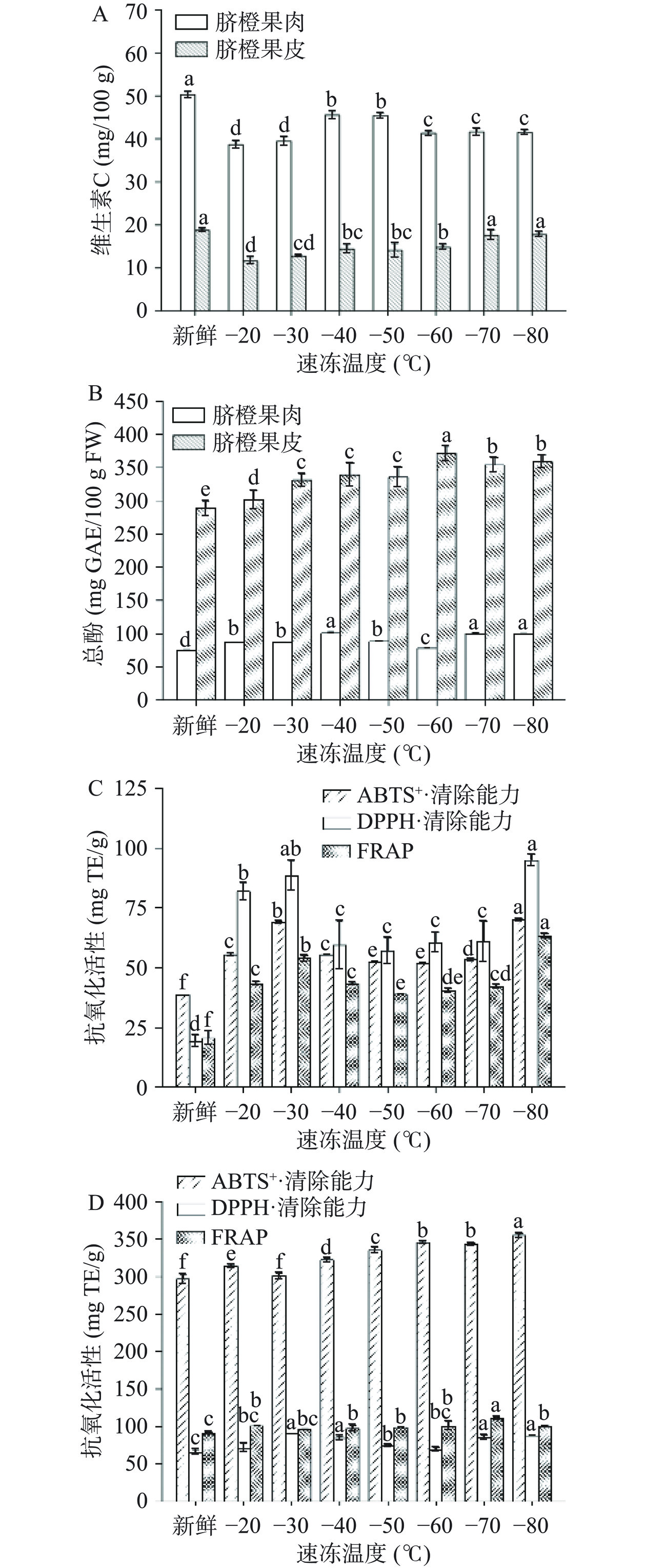
由图3A可知,速冻处理后,所有果肉和果皮的维生素C含量都有所下降,−20 ℃和−30 ℃果肉维生素C的损失更大。这可能是因为冻结速率过低,维生素C的稳定性变差,加速了维生素C的变化,导致解冻后营养成分损失过多。上述结果表明,冻结温度会改变脐橙果实的营养品质。大多数样品在速冻后维生素C含量损失较少,在冻藏条件下维生素C也得到了很好的保存,本研究结果与Goncalves等[25]对冷冻蔬菜的研究结果相似。
从图3B中可以看出,速冻后果肉和果皮总酚含量均显著高于新鲜样品(P<0.05),与Rickman等[26]报告的数据相似。这可能是因为速冻-解冻过程中导致细胞内酚类物质溶出较多,所以提高了总酚含量。之前的研究表明,脐橙果皮的酚类化合物含量高于脐橙果肉[27],与本研究结果一致。果肉中的总酚含量在74.82~100.88 mg GAE/100 g FW之间,−40、−70和−80 ℃果肉的总酚含量无显著差异(P>0.05),均显著高于其他处理样品(P<0.05)。果皮中的总酚含量介于288.38~371.4 mg GAE/100 g FW之间,−60 ℃果皮的总酚含量最高,−70 ℃和−80 ℃果皮的总酚含量无显著差异(P>0.05),−20 ℃果皮的总酚含量显著低于其他处理温度(P<0.05)。这些结果表明,速冻处理可以显著提高秭归脐橙果实中的总酚含量,但速冻温度对总酚含量的变化没有明显规律。
2.6 不同速冻温度对脐橙果实抗氧化活性的影响
如图3C、3D所示,与新鲜脐橙果肉和果皮相比,不同速冻温度处理后的ABTS+·清除能力、DPPH·清除能力和FRAP均有不同程度的增大,这表明速冻对脐橙类水果的抗氧化活性有积极影响。此前,Mullen等[28]报告称,冷冻过程后生物活性化合物含量增加,导致抗氧化活性提高,从而改善了最终产品的整体营养品质。在所有速冻温度下,−80 ℃果肉的ABTS+·清除能力和FRAP显著高于其他速冻温度(P<0.05);−30 ℃和−80 ℃果肉的DPPH·清除能力显著高于其他速冻温度(P<0.05)。−80 ℃果皮的ABTS+·清除能力显著高于其他速冻温度(P<0.05);−30、−40、−70和−80 ℃果皮的DPPH·清除能力显著高于其他速冻温度(P<0.05);−70 ℃果皮的FRAP显著高于其他速冻温度(P<0.05)。由此可见,速冻技术在生产食品方面具有一定优势,能显著增加脐橙类果实中生物活性化合物的含量,从而提高其抗氧化活性。
2.7 不同速冻温度对脐橙果肉水分分布的影响
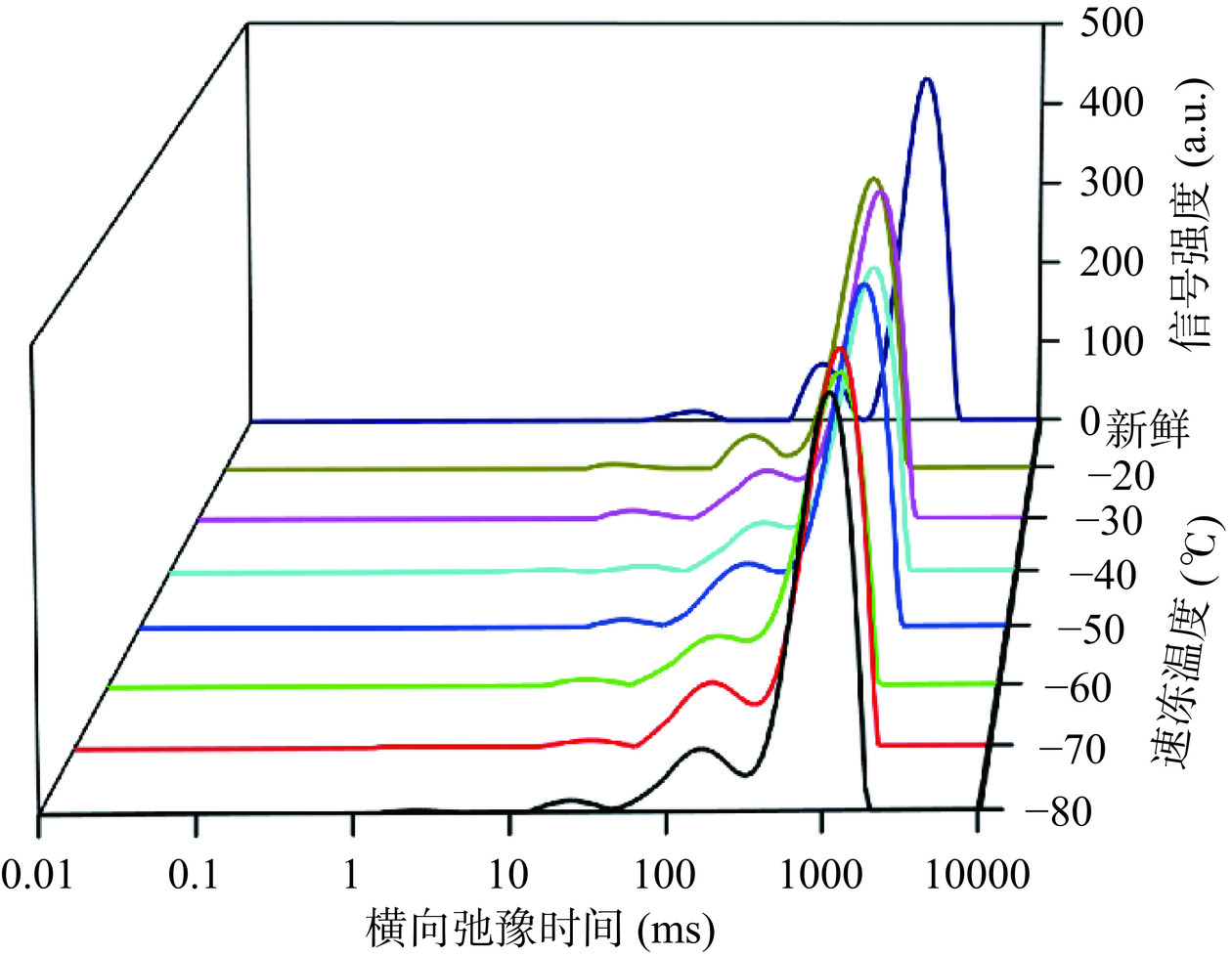
为了研究速冻温度对脐橙果肉中水分子的迁移和分布的影响,进行了LF-NMR分析以确定自旋-自旋弛豫时间(T2)。由图4可以看出,脐橙果肉的横向弛豫曲线由三个峰组成。最短的弛豫时间(T21)被定义为细胞壁质子,主要存在于细胞壁的纤维结构、多糖结构以及筛管和管孔中。中间弛豫时间(T22)被定义为细胞质水,这主要是因为细胞质溶液是一种不易流动的高粘性物质[29]。最长的弛豫时间(T23)被定义为囊泡水,它主要以自由形式存在于囊泡中,具有最大的流动性。此外,不同脐橙果肉的T2(T21、T22、T23)和峰面积百分比M2(M21、M22、M23)数据见表5。
表 5 速冻温度对脐橙果肉横向弛豫时间(T2)和峰面积(M2)的影响Table 5. Effect of quick-freezing temperatures on the lateral relaxation time (T2) and peak area (M2) of navel orange fruit flesh速冻温度(℃) T21(ms) T22(ms) T23(ms) M21(%) M22(%) M23(%) 新鲜对照 21.36±2.98ab 219.99±9.02a 1277.74±99.96a 1.93±0.31a 12.51±0.54d 85.56±0.56a −20 14.56±4.30c 109.00±42.62c 727.76±135.44d 0.99±0.23d 19.85±1.90a 79.98±1.03d −30 17.06±1.50bc 146.49±22.41bc 938.36±52.95c 1.71±0.07ab 15.16±1.89bcd 83.13±1.89bc −40 19.55±3.41bc 155.47±6.37bc 903.00±70.64c 1.28±0.14bcd 14.63±0.58cd 84.09±0.59ab −50 18.87±1.29bc 140.05±23.18bc 967.93±75.70bc 1.13±0.11cd 18.38±2.39ab 81.72±1.38cd −60 17.97±1.27bc 161.19±16.02bc 903.00±70.64c 1.36±0.05bcd 14.58±0.47cd 84.05±0.48ab −70 25.57±1.77a 175.50±20.13ab 1112.09±87.00b 1.49±0.18bc 15.66±0.69bc 82.85±0.75bc −80 21.49±4.03ab 155.95±6.02bc 1030.06±94.07bc 1.60±0.41ab 13.96±2.10cd 85.43±0.80a 由表5可知,冻结会破坏脐橙果肉的细胞屏障,使水分发生迁移,导致不同区室之间的水分交换。速冻处理改变了T2松弛时间和峰值面积大小,但没有改变T2水区域的数量。果肉中第2峰和第3峰之间的联系可能是由于细胞区室受损导致部分功能丧失所致[18]。与新鲜对照相比,除−70 ℃和−80 ℃外,其他速冻温度的T21值均下降;所有速冻温度的T22和T23值均下降,表明速冻处理导致果肉中剩余水的流动性降低。这可能是由于高流动的囊泡水在解冻后产生滴漏损失,而果肉中剩余水的流动性较低。与新鲜对照相比,所有冻结温度下的M21、M23值均减少;M22值均增加,说明速冻-解冻后果肉的水分发生迁移,细胞质中的水分增加,这可能是由于冰晶破坏了脐橙果肉组织细胞的囊泡膜和细胞膜,水分从囊泡中流失以及从细胞壁释放到了细胞质中。−80 ℃脐橙果肉的M23值的下降幅度要小得多,与新鲜样品没有显著差异(P>0.05)。相比之下,−20 ℃的M23值下降幅度更大,这可能与细胞破裂的程度有关。这些结果表明,速冻可能会使果肉细胞膜破裂,导致果汁流失,并降低果肉的总含水量。在冻融过程中,以较高冻结速率和解冻的果肉的细胞完整性高于以较低速率冷冻和解冻的果肉。
2.8 不同速冻温度对脐橙果皮微观结构的影响
光学显微镜和扫描电子显微镜结果分别见图5(A)和(B)。从图5(A)中可以看出,速冻果皮的细胞损伤与新鲜果皮不同。新鲜脐橙果皮各部分紧密,细胞大小均匀,排列整齐。相比之下,−80 ℃的果皮细胞排列更紧密,细胞结构较完整,受损部分最小。−20 ℃和−30 ℃果皮细胞的结构损伤最大,表皮层细胞轮廓明显缩小,薄壁细胞间隙有增大的趋势。此外,表皮层靠近油胞囊的部分向内凹陷。这可能是由于冻结速率较小,解冻后果皮质地软化严重,因此果皮质量显著下降。
从图5(B)中可以看出,在冷冻干燥过程中,由于冰的升华,新鲜脐橙果皮的细胞结构受到了部分破坏,但清晰有序的单个细胞基本保留了下来。在速冻过程后,细胞的破坏显而易见,呈现出卷曲和不规则的形状,细胞表面和细胞间隙破裂。在−20 ℃和−30 ℃观察到的细胞组织损伤最为严重,这是因为缓慢的冻结速率改变了细胞膜的渗透性,细胞间隙功能丧失,导致组织中的物质和水分流失。这支持了Sanz等[30]的说法,即冻结速率越低,通常形成的细胞外冰晶就越大,从而导致结构破坏。−40 ℃至−70 ℃果皮表面组织明显改善,表面更光滑,塌陷更小。−80 ℃果皮的外观与扫描电镜照片中观察到的非常相似,细胞略有收缩,孔隙分布均匀。正如Tu等[31]所报告的那样,冷冻速率高到足以产生小而均匀的冰晶,对细胞壁结构的破坏很小,其完整性得到了较好的保存。
3. 结论
本文研究了−20 ℃至−80 ℃速冻温度对秭归脐橙果肉和果皮的冻结特性和综合品质的影响。低场核磁共振结果表明,−80 ℃的游离水比率与新鲜果肉无明显差异。此外,−60 ℃到−80 ℃果肉的质地、生物活性化合物含量和抗氧化活性较高。这表明,高冻结速率有利于形成分布均匀的小冰晶,减少对细胞完整性的破坏。冷冻过程增加了生物活性化合物的含量,从而提高了抗氧化活性。−40 ℃和−50 ℃ 果肉的维生素C含量较高,风味宜人,色泽鲜艳。−70 ℃和−80 ℃果皮在硬度、维生素C含量、生物活性、抗氧化活性和色泽方面都表现出极佳的品质。微观组织结构观察表明,−80 ℃ 果皮的孔隙分布均匀,损伤最小。因此,−40 ℃到−80 ℃速冻能有效提高脐橙果肉产品的质量。此外,−70 ℃和−80 ℃速冻处理是保持冷冻脐橙果皮质量的有效方法。这些发现为选择适当的速冻技术生产优质速冻脐橙产品提供了支持。未来的研究可侧重于速冻脐橙产品的预处理技术,以进一步提高其品质。
-
表 1 感官评价标准
Table 1 Sensory evaluation standard
评价指标 感官描述 分值(分) 色泽(25) 呈鲜艳的橘黄色,能充分体现应有的色泽 20~25 颜色较鲜艳,偏淡或者偏黄 15~19 颜色严重偏移柑橘本身的颜色 1~14 香味(25) 有柑橘特有的浓郁香气 20~25 有柑橘特有的香味,但比较淡,无异味 15~19 有令人不悦的异味,失去柑橘的气味 1~14 质地(25) 质地软硬适中,囊衣完整,无汁液流出 20~25 质地较硬,囊衣完整,无汁液流出 15~19 质地很软或囊衣破裂,有汁液流出 1~14 口感(25) 口感清脆,易咀嚼,无脱水现象 20~25 口感粗糙,有轻度脱水 15~19 口感粗糙,严重脱水 1~14 表 2 不同速冻温度对脐橙果肉和果皮冷冻参数的影响
Table 2 Effect of different quick-freezing temperatures on freezing parameters of navel orange fruit flesh and peel
速冻温度(℃) 脐橙果肉 脐橙果皮 冻结点(℃) Tn(min) Tp(min) Tt(min) V(℃/min) FT(min) −20 −1.93±0.15a 4.23±0.07a 18.50±0.33a 18.10±0.61a 0.54±0.01f 16.06±0.92a −30 −2.70±0.10b 3.77±0.06b 10.39±0.42b 13.61±0.51b 0.79±0.03e 14.11±0.42b −40 −2.63±0.15b 3.69±0.13bc 8.89±0.26c 12.44±0.41c 0.88±0.02d 9.11±0.26c −50 −2.83±0.15b 3.51±0.33bc 7.25±0.38d 9.11±0.54d 1.11±0.01c 6.83±0.34d −60 −2.80±0.10b 3.43±0.07c 7.72±0.25d 7.83±0.17e 1.16±0.02c 3.89±0.26e −70 −2.73±0.21b 2.85±0.17d 4.44±0.34e 3.50±0.33f 2.04±0.08b 3.33±0.17ef −80 −2.93±0.25b 2.69±0.13d 3.17±0.17f 3.45±0.25f 2.37±0.06a 2.94±0.10f 注:同列中不同小写字母表示样品之间存在显著性差异(P<0.05),表3~表5同。 表 3 不同速冻温度对脐橙果肉和果皮色差的影响
Table 3 Effects of different quick-freezing temperatures on color of navel orange fruit flesh and peel
速冻温度(℃) L* a* b* ΔE 脐橙果肉 新鲜对照 56.68±1.33a 3.94±0.11a 25.74±1.73a − −20 48.30±1.54e 3.21±0.05d 22.61±0.85cd 9.16±1.99a −30 50.43±1.18d 3.69±0.17b 21.84±1.10d 7.59±1.70b −40 52.40±1.35c 3.72±0.16b 23.40±1.02bc 5.08±1.59c −50 53.63±0.72b 3.30±0.19d 24.22±0.60b 3.72±1.04c −60 51.01±1.84d 3.24±0.11d 22.75±1.20cd 6.72±1.40b −70 51.21±0.91cd 3.57±0.15c 22.21±0.60d 6.65±1.61b −80 50.76±0.87d 3.31±0.08d 23.87±1.11b 6.65±1.24b 脐橙果皮 新鲜对照 58.85±0.65a 32.86±0.90a 61.49±1.02a − −20 52.28±1.70d 20.50±1.08d 50.58±0.73e 17.83±1.43a −30 53.49±1.05cd 23.26±1.07c 52.52±1.67cd 14.34±2.49b −40 54.05±1.89c 25.27±0.99b 51.63±0.68de 13.48±1.18b −50 55.57±1.25b 22.49±1.24c 53.54±1.91bc 13.67±2.27b −60 56.82±1.38b 22.18±1.95c 53.76±2.14bc 13.60±1.79b −70 56.07±1.70b 25.18±1.08b 52.09±2.21cde 12.71±2.83bc −80 56.96±1.21b 25.26±1.88b 54.35±2.47b 10.80±2.72c 表 4 不同速冻温度对脐橙类果肉和果皮质构特性的影响
Table 4 Effects of different quick-freezing temperatures on texture characteristics of navel orange fruit flesh and peel
速冻温度(℃) 脐橙果肉 脐橙果皮 硬度(g) 胶着性 咀嚼性(g) 弹性 硬度(g) 脆性 新鲜对照 918.28±47.62a 526.19±16.89a 416.04±22.11a 0.89±0.03e 107.86±4.38a 0.84±0.04d −20 653.63±41.88e 371.05±13.76e 308.96±17.04e 0.97±0.01a 84.16±2.96c 1.30±0.13a −30 722.79±33.30d 376.67±18.39e 325.49±22.44e 0.95±0.01b 85.75±3.19c 1.25±0.12a −40 776.81±29.53c 399.91±12.17d 332.25±20.38d 0.93±0.01c 94.75±2.88b 1.13±0.06b −50 773.76±22.79c 402.15±18.21d 348.74±24.33cd 0.92±0.01cd 94.65±4.01b 1.13±0.07b −60 846.54±29.43b 457.72±23.82b 380.30±25.18b 0.90±0.02de 97.00±5.37b 1.08±0.37b −70 829.09±20.72b 428.98±17.58c 361.26±21.04bc 0.91±0.02de 96.47±4.34b 1.05±0.08c −80 841.08±30.42b 450.69±22.96b 378.86±17.88b 0.90±0.02e 98.12±5.37b 0.98±0.09c 表 5 速冻温度对脐橙果肉横向弛豫时间(T2)和峰面积(M2)的影响
Table 5 Effect of quick-freezing temperatures on the lateral relaxation time (T2) and peak area (M2) of navel orange fruit flesh
速冻温度(℃) T21(ms) T22(ms) T23(ms) M21(%) M22(%) M23(%) 新鲜对照 21.36±2.98ab 219.99±9.02a 1277.74±99.96a 1.93±0.31a 12.51±0.54d 85.56±0.56a −20 14.56±4.30c 109.00±42.62c 727.76±135.44d 0.99±0.23d 19.85±1.90a 79.98±1.03d −30 17.06±1.50bc 146.49±22.41bc 938.36±52.95c 1.71±0.07ab 15.16±1.89bcd 83.13±1.89bc −40 19.55±3.41bc 155.47±6.37bc 903.00±70.64c 1.28±0.14bcd 14.63±0.58cd 84.09±0.59ab −50 18.87±1.29bc 140.05±23.18bc 967.93±75.70bc 1.13±0.11cd 18.38±2.39ab 81.72±1.38cd −60 17.97±1.27bc 161.19±16.02bc 903.00±70.64c 1.36±0.05bcd 14.58±0.47cd 84.05±0.48ab −70 25.57±1.77a 175.50±20.13ab 1112.09±87.00b 1.49±0.18bc 15.66±0.69bc 82.85±0.75bc −80 21.49±4.03ab 155.95±6.02bc 1030.06±94.07bc 1.60±0.41ab 13.96±2.10cd 85.43±0.80a -
[1] 李勋兰, 洪林, 杨蕾, 等. 11个脐橙品种果实营养成分分析与品质综合评价[J]. 食品科学,2020,41(8):228−233. [LI X L, HONG L, YANG L, et al. Analysis of nutritional components and comprehensive quality evaluation of citrus fruit from eleven varieties[J]. Food Science,2020,41(8):228−233.] doi: 10.7506/spkx1002-6630-20190526-307 LI X L, HONG L, YANG L, et al. Analysis of nutritional components and comprehensive quality evaluation of citrus fruit from eleven varieties[J]. Food Science, 2020, 41(8): 228−233. doi: 10.7506/spkx1002-6630-20190526-307
[2] STINCO C M, LUISA ESCUDERO-GILETE M, HEREDIA F J, et al. Multivariate analyses of a wide selection of orange varieties based on carotenoid contents, color and in vitro antioxidant capacity[J]. Food Research International,2016,90:194−204. doi: 10.1016/j.foodres.2016.11.005
[3] KIM S S, PARK K J, AN H J, et al. Phytochemical, antioxidant, and antibacterial activities of fermented Citrus unshiu byproduct[J]. Food Science and Biotechnology,2017,26(2):461−466. doi: 10.1007/s10068-017-0063-9
[4] CHENG L N, WU W J, AN K J, et al. Advantages of liquid nitrogen quick freezing combine gradient slow thawing for quality preserving of blueberry[J]. Crystals,2020,10(5):368. doi: 10.3390/cryst10050368
[5] CHENG L N, SUN D W, ZHU Z W, et al. Emerging techniques for assisting and accelerating food freezing processes:A review of recent research progresses[J]. Critical Reviews in Food Science and Nutrition,2017,57(4):769−781. doi: 10.1080/10408398.2015.1004569
[6] DAWSON P, AL-JEDDAWI W, RIECK J. The effect of different freezing rates and long-term storage temperatures on the stability of sliced peaches[J]. International Journal of Food Science,2020,3:1−17. doi: 10.47604/ijf.1024
[7] 刘艳春, 王维民, 苏阳, 等. 不同冻结速率对冻后番木瓜品质的影响[J]. 食品工业科技,2015,36(14):335−339. [LIU Y C, WANG W M, SU Y, et al. Effect of different freezing rates on the quality change of Carica papaya L[J]. Science and Technology of Food Industry,2015,36(14):335−339.] LIU Y C, WANG W M, SU Y, et al. Effect of different freezing rates on the quality change of Carica papaya L[J]. Science and Technology of Food Industry, 2015, 36(14): 335−339.
[8] 李镜浩, 张诗颖, 程丽娜, 等. 不同冷冻方式对芒果块冻结特性和品质的影响[J]. 现代食品科技,2023,39(10):160−169. [LI J H, ZHANG S Y, CHENG L N, et al. Effects of different freezing methods on the freezing characteristics and quality of mango chunks[J]. Modern Food Science and Technology,2023,39(10):160−169.] LI J H, ZHANG S Y, CHENG L N, et al. Effects of different freezing methods on the freezing characteristics and quality of mango chunks[J]. Modern Food Science and Technology, 2023, 39(10): 160−169.
[9] JIANG Q Y, ZHANG M, MUJUMDAR A S, et al. Combination strategy of CO2 pressurization and ultrasound:To improve the freezing quality of fresh-cut honeydew melon[J]. Food Chemistry,2022,383:132327. doi: 10.1016/j.foodchem.2022.132327
[10] GU Y, SHI W, LIU R, et al. Cold plasma enzyme inactivation on dielectric properties and freshness quality in bananas[J]. Innovative Food Science & Emerging Technologies,2021,69(2):102649.
[11] 赵金红. 渗透脱水—冻结与玻璃化贮藏对芒果品质的影响及动力学模拟[D]. 北京:中国农业大学, 2014. [ZHAO J H. Effect of osmo-dehydrofreezing and glassy state storage on the quality attributes of frozen mango and dynamic simulation[D]. Beijing:China Agricultural University, 2014.] ZHAO J H. Effect of osmo-dehydrofreezing and glassy state storage on the quality attributes of frozen mango and dynamic simulation[D]. Beijing: China Agricultural University, 2014.
[12] REN T Y, LI B, XU F Y, et al. Research on the effect of oriental fruit moth feeding on the quality degradation of chestnut rose juice based on metabolomics[J]. Molecules,2023,28(20):1−22.
[13] GUO X, LI T, TANG K, et al. Effect of germination on phytochemical profiles and antioxidant activity of mung bean sprouts (Vigna radiata)[J]. Journal of Agricultural and Food Chemistry,2012,60(44):11050−11055. doi: 10.1021/jf304443u
[14] SALLEH R M, YING T L, MOUSAVI L. Development of fruit bar using sapodilla (Manilkara zapota L.)[J]. Journal of Food Processing and Preservation,2017,41(2):e12806. doi: 10.1111/jfpp.12806
[15] ZLABUR J S, MIKULEC N, DOZDOR L, et al. Preservation of biologically active compounds and nutritional potential of quick-frozen berry fruits of the genus rubus[J]. Processes,2021,9(11):1940. doi: 10.3390/pr9111940
[16] BLOIS M S. Antioxidant determinations by the use of a stable free radical[J]. Nature, 1958, 1199−1200.
[17] TLILI I, HDIDER C, LENUCCI M S, et al. Bioactive compounds and antioxidant activities of different watermelon (Citrullus lanatus (Thunb.) Mansfeld) cultivars as affected by fruit sampling area[J]. Journal of Food Composition and Analysis,2011,24(3):307−314. doi: 10.1016/j.jfca.2010.06.005
[18] FUNDO J F, AMARO A L, MADUREIRA A R, et al. Fresh-cut melon quality during storage:An NMR study of water transverse relaxation time[J]. Journal of Food Engineering,2015,167:71−76. doi: 10.1016/j.jfoodeng.2015.03.028
[19] IGNAT A, MANZOCCO L, MAIFRENI M, et al. Surface decontamination of fresh-cut apple by pulsed light:Effects on structure, colour and sensory properties[J]. Postharvest Biology and Technology,2014,91:122−127. doi: 10.1016/j.postharvbio.2014.01.005
[20] PIETRYSIAK E, GANJYAL G M. Apple peel morphology and attachment of Listeria innocua through aqueous environment as shown by scanning electron microscopy[J]. Food Control,2018,92:362−369. doi: 10.1016/j.foodcont.2018.04.049
[21] 吴锦涛, 陈永泉, 黄苇, 等. 板栗冻结规律及速冻加工技术研究[J]. 食品与发酵工业,2003,29(3):41−45. [WU J T, CHEN Y Q, HUANG W, et al. Study on the chestnut freezing law and fast freezing technology[J]. Food and Fermentation Industries,2003,29(3):41−45.] doi: 10.3321/j.issn:0253-990X.2003.03.010 WU J T, CHEN Y Q, HUANG W, et al. Study on the chestnut freezing law and fast freezing technology[J]. Food and Fermentation Industries, 2003, 29(3): 41−45. doi: 10.3321/j.issn:0253-990X.2003.03.010
[22] JHA P K, CHEVALLIER S, XANTHAKIS E, et al. Effect of innovative microwave assisted freezing (MAF) on the quality attributes of apples and potatoes[J]. Food Chemistry,2020,309:125594. doi: 10.1016/j.foodchem.2019.125594
[23] VAN BUGGENHOUT S, MESSAGIE I, MAES V, et al. Minimizing texture loss of frozen strawberries:Effect of infusion with pectinmethylesterase and calcium combined with different freezing conditions and effect of subsequent storage/thawing conditions[J]. European Food Research and Technology,2006,223(3):395−404. doi: 10.1007/s00217-005-0218-4
[24] SOAZO M, PEREZ L M, RUBIOLO A C, et al. Prefreezing application of whey protein-based edible coating to maintain quality attributes of strawberries[J]. International Journal of Food Science and Technology,2015,50(3):605−611. doi: 10.1111/ijfs.12667
[25] GONCALVES E M, ABREU M, BRANDAO T R S, et al. Degradation kinetics of colour, vitamin C and drip loss in frozen broccoli (Brassica oleracea L. ssp. Italica) during storage at isothermal and non-isothermal conditions[J]. International Journal of Refrigeration-Revue Internationale Du Froid,2011,34(8):2136−2144. doi: 10.1016/j.ijrefrig.2011.06.006
[26] RICKMAN J C, BARRETT D M, BRUHN C M. Nutritional comparison of fresh, frozen and canned fruits and vegetables. Part1. Vitamins C and B and phenolic compounds[J]. Journal of the Science of Food and Agriculture,2007,87(6):930−944. doi: 10.1002/jsfa.2825
[27] GORINSTEIN S, MARTIN-BELLOSO O, PARK Y S, et al. Comparison of some biochemical characteristics of different citrus fruits[J]. Food Chemistry,2001,74(3):309−315. doi: 10.1016/S0308-8146(01)00157-1
[28] MULLEN W, STEWART A J, LEAN M E J, et al. Effect of freezing and storage on the phenolics, ellagitannins, flavonoids, and antioxidant capacity of red raspberries[J]. Journal of Agricultural and Food Chemistry,2002,50(18):5197−5201. doi: 10.1021/jf020141f
[29] LAHAYE M, FALOURD X, LAILLET B, et al. Cellulose, pectin and water in cell walls determine apple flesh viscoelastic mechanical properties[J]. Carbohydrate Polymers,2020,232:115768. doi: 10.1016/j.carbpol.2019.115768
[30] SANZ P D, DE ELVIRA C, MARTINO M, et al. Freezing rate simulation as an aid to reducing crystallization damage in foods[J]. Meat Science,1999,52(3):275−278. doi: 10.1016/S0309-1740(99)00002-9
[31] TU J, ZHANG M, XU B, et al. Effects of different freezing methods on the quality and microstructure of lotus (Nelumbo nucifera) root[J]. International Journal of Refrigeration-Revue Internationale Du Froid,2015,52:59−65. doi: 10.1016/j.ijrefrig.2014.12.015
-
期刊类型引用(1)
1. 盛周杨,邹波,肖更生,徐玉娟,吴继军,余元善,程丽娜,温靖,安可婧. 超高压联合DMDC和Nisin处理对杨梅汁贮藏期间品质的影响. 食品工业科技. 2025(05): 296-308 .  本站查看
本站查看
其他类型引用(2)





 下载:
下载:
 下载:
下载:
