Effects of Extraction Temperature on Physicochemical Properties and Antioxidant and Immunomodulatory Activities of Polysaccharides from Lycium ruthenicum Murr.
-
摘要: 以提取温度(20、40、60、80、100 ℃)条件为变量,采用水提醇沉法提取得到黑果枸杞多糖(Lycium ruthenicum Murr. polysaccharides,LRPs);通过分析多糖得率、碳水化合物含量、糖醛酸含量、紫外光谱、特征性红外光谱、相对分子质量和单糖组成,研究提取温度对LRPs理化特性的影响;通过检测DPPH、ABTS+、羟基自由基、超氧阴离子自由基清除活性及铁氰化钾的还原能力,分析提取温度对LRPs抗氧化活性的影响;通过分析LRPs对RAW264.7细胞活力及细胞因子分泌的影响,研究提取温度对LRPs免疫调节活性影响。结果表明:不同提取温度可以影响LRPs的理化特性及其抗氧化和免疫调节活性。在60 ℃(LRP60,2.38%±0.11%)和80 ℃(LRP80,2.30%±0.25%)时,多糖的提取得率显著高于其他温度;LRP20、LRP40、LRP60、LRP80和LRP100的相对分子质量分别为293.34、227.94、233.45、273.53和233.66 kDa。LRPs单糖组成主要为L-Ara、D-Gal、D-Glc、D-Man、L-Rha和D-GlcA,并含有少量D-Xyl,其中LRP80和LRP100含有D-GalA;在60和80 ℃温度下提取得到的黑果枸杞多糖LRP60和LRP80具有良好的抗氧化活性和免疫调节活性,提取温度60 ℃时,黑果枸杞多糖单糖组成中D-Gal和L-Ara比例升高,抗氧化活性较好;提取温度80 ℃时,D-GlcA、D-Glc和D-GalA比例升高,黑果枸杞多糖免疫调节活性较好。黑果枸杞多糖LRP60和LRP80可作为潜在的天然抗氧剂或免疫调节剂。Abstract: Lycium ruthenicum Murr. polysaccharides (LRPs) were obtained by the water extraction-ethanol precipitation method using extraction temperature (20, 40, 60, 80, 100 ℃) as variables. The effects of extraction temperature on the physicochemical properties of LRPs were investigated by analyzing the yield of polysaccharides, carbohydrate content, glyoxylate content, UV spectra, FT-IR spectra, relative molecular mass and monosaccharide composition. The effect of extraction temperature on the antioxidant activity of LRPs was analyzed through the detection of DPPH, ABTS+, hydroxyl radicals, superoxide anion radical scavenging activity, and the reducing ability of potassium ferricyanide. The effect of extraction temperature on the immunomodulatory activity of LRPs was investigated by analyzing the effect of LRPs on RAW264.7 cell viability and cytokine secretion. Different extraction temperatures could affect the physicochemical properties of LRPs as well as their antioxidant and immunomodulatory activities. The extraction yields of polysaccharides at 60 ℃ (LRP60, 2.38%±0.11%) and 80 ℃ (LRP80, 2.30%±0.25%) were significantly higher than those of other polysaccharides. The relative molecular masses of LRP20, LRP40, LRP60, LRP80 and LRP100 were 293.34, 227.94, 233.45, 273.53 and 233.66 kDa, respectively. LRPs were mainly composed of L-Ara, D-Gal, D-Glc, D-Man, L-Rha and D-GlcA with a small amount of D-Xyl, of which LRP80 and LRP100 contained D-GalA. The Lycium ruthenicum Murr. polysaccharides obtained by extracting at 60 ℃ and 80 ℃ temperature had good antioxidant activity and immunomodulatory activity. At an extraction temperature of 60 ℃, the proportion of D-Gal and L-Ara in the monosaccharide composition of polysaccharides increased, and the antioxidant activity was better. While the ratio of D-GlcA, D-Glc and D-GalA increased at the extraction temperature of 80 ℃, the immunomodulatory activity of Lycium ruthenicum Murr. polysaccharides was better. Therefore, LRP60 and LRP80 from Lycium ruthenicum Murr. could serve as potential natural antioxidants or immunomodulators.
-
黑果枸杞(Lycium ruthenicum Murr.)系茄科(Solanaceae)枸杞属(Lycium L.)多年生灌木植物,主要生长在西北干旱和盐碱地区[1]。黑果枸杞中的活性成分主要有多糖、花青素、黄酮、酚酸、鞣质、脂肪酸、挥发油、蛋白质、氨基酸、维生素和矿物质元素等[2]。现代药理学研究表明黑果枸杞具有抗氧化[3]、抗辐射[4]、抗疲劳[5]、抗肿瘤[6]、降低血糖[7]、抗骨质疏松[2]、神经保护[8]、肝脏保护[9]和益生元[10]等生物活性。多糖是黑果枸杞发挥生物活性多样性的主要活性成分之一,研究发现,黑果枸杞多糖可以作为天然抗氧化剂清除自由基和螯合金属离子,并对细胞的氧化损伤具有修复作用[11]。此外,黑果枸杞多糖还具有良好的免疫调节活性[12]。
多糖常用的提取方法是热水提取,料液比、提取温度、提取时间等是影响多糖提取效率的主要因素,其中提取温度对多糖提取率的影响最为显著[13]。多糖的提取温度一般在60~90 ℃之间,多糖提取率随提取温度的升高而提高。文献研究报道了不同温度提取多糖的生物活性与提取温度之间并未呈现正相关的关系[14−15],不同提取温度也会对多糖的化学结构产生影响。因此,研究提取温度对多糖性质和活性的影响在多糖提取分离及开发利用过程中具有重要意义。目前,黑果枸杞多糖在较低提取温度(20 ℃和40 ℃)和较高提取温度(100 ℃)下的性质和活性尚不清晰,提取温度是否会对黑果枸杞多糖的理化特性与生物活性产生影响也鲜见报道。
本研究将于固定料液比、提取时间与提取次数条件下,对黑果枸杞多糖进行不同温度的提取,通过分析不同温度提取黑果枸杞多糖(Lycium ruthenicum Murr. polysaccharides,LRPs)的得率、碳水化合物含量、糖醛酸含量、紫外光谱、特征性红外光谱、相对分子质量、单糖组成以及抗氧化活性和免疫调节活性的变化,研究提取温度对黑果枸杞多糖理化特性和生物活性的影响,以期为黑果枸杞资源的进一步利用提供理论支持。
1. 材料与方法
1.1 材料与仪器
黑果枸杞果实 甘肃省酒泉市瓜州县,经兰州理工大学生命科学与工程学院张新国教授鉴定确系为该种植株果实;葡聚糖标准品(5000、25000、80000、150000、420000、670000 Da) 色谱纯,北京谱析标准技术有限公司;单糖标准品(葡萄糖D-Glc、鼠李糖L-Rha、阿拉伯糖L-Ara、半乳糖D-Gal、甘露糖D-Man、木糖D-Xyl、葡糖糖醛酸D-GlcA、半乳糖醛酸D-GalA) 色谱纯,斯坦福化学分析公司;1-苯基-3-甲基-5-P 吡唑啉酮(PMP) 上海麦克林生化科技有限公司;1,1-二苯基苦基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、3,5-二硝基水杨酸、铁氰化钾 分析纯,迈瑞尔(上海)化学技术有限公司;RAW264.7巨噬细胞 中国科学院细胞库;DMEM-H完全培养基 美国HyClone公司;ELISA试剂盒 上海源叶生物科技有限公司。
Cayy50紫外可见分光光度计 上海佑科仪器仪表有限公司;FT-Raman Module拉曼红外光谱仪 美国尼高力仪器公司;LC-20A-HPLC高效液相色谱仪 日本岛津公司;680 i-Mark酶标仪 美国伯乐公司。
1.2 实验方法
1.2.1 不同温度提取黑果枸杞多糖
黑果枸杞经过挑选除杂、干燥(60 ℃烘箱烘干至恒重)、粉碎(过60目筛)和脱脂(使用80%无水乙醇,料液比为1:20,60 ℃下搅拌脱脂4 h后,抽滤并收集滤渣,自然晾干)等处理过程。提取温度分别为20、40、60、80、100 ℃,固定料液比1:20 g/mL,提取2 h,提取3次[16]。提取液60 ℃减压浓缩后醇沉,真空冷冻干燥得到粗多糖。粗多糖采用Sevag法[17]脱蛋白后分别用流动水和蒸馏水透析(8000 Da)12 h,真空冷冻干燥后得不同温度提取的黑果枸杞多糖LRPs。按照公式(1)计算多糖得率:
LRPs得率(%)=多糖质量(g)处理后黑果枸杞质量(g)×100 (1) 1.2.2 不同温度提取黑果枸杞多糖的理化性质测定
1.2.2.1 碳水化合物含量的测定
采用苯酚-硫酸法[18]测定样品中的碳水化合物含量。取8支试管,分别加入0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL的葡萄糖标准溶液(100 μg/mL),补加蒸馏水至1 mL,向各管中加入25 μL 80%苯酚溶液,混匀后快速加入2.5 mL浓硫酸,静置反应10 min后,30 ℃水浴反应30 min,在490 nm处测定吸光度。以吸光度为纵坐标,葡萄糖含量(μg/mL)为横坐标建立标准曲线(y=9.9929x+0.0032,R2=0.9983)。同法测定样品中碳水化合物含量。
1.2.2.2 糖醛酸含量的测定
采用间羟基联苯法[19]测定样品中糖醛酸含量。取6支试管,分别加入0、0.05、0.10、0.15、0.20、0.25 mL半乳糖醛酸标准溶液(1 mg/mL),加蒸馏水补至0.25 mL,置冰浴中预冷,加1.5 mL四硼酸钠-硫酸溶液,振荡均匀,沸水浴5 min,之后冰浴至室温,加25 μL间羟基联苯溶液,混匀,在520 nm处测吸光度。以糖醛酸含量(μg/mL)为横坐标,吸光值为纵坐标绘制标准曲线(y=7.8443x+0.0193,R2=0.9976)。同法测定样品中糖醛酸含量。
1.2.2.3 紫外扫描分析
配制1 mg/mL的多糖水溶液,于紫外可见分光光度计上在190~400 nm波长范围扫描。
1.2.2.4 红外光谱检测
取少量干燥样品与KBr混合后压片,于4000~400 cm−1在红外光谱仪上进行傅里叶变换红外光谱分析。
1.2.2.5 相对分子质量测定
采用HPLC法[20]测定多糖的相对分子质量。精确称取5000、25000、80000、150000、420000、670000 Da的葡聚糖标准品分别配成2 mg/mL标准溶液,过0.22 μm滤膜。按分子量大小从小到大依次进样,以保留时间为横坐标,分子量对数值为纵坐标绘制分子量标准曲线(y=−0.3844t+9.0792,R2=0.9940)。配制5 mg/mL的多糖样品溶液,过0.22 μm滤膜,进样,记录保留时间,按照标准曲线计算样品的相对分子质量。色谱条件:LC-20A-HPLC高效液相色谱仪配备示差检测器,Ohpak SB-804 HQ色谱柱(8.0 mm×300 mm,Shodex),流动相为0.22 μm过膜超纯水,流速0.6 mL/min,柱温30 ℃。超纯水洗脱1 h至基线平衡,进行多糖样品检测,进样量20 μL (多糖浓度1 mg/mL)。
1.2.2.6 单糖组成分析
采用PMP柱前衍生-HPLC分析法测定样品单糖组成[21]。将8个单糖标品(D-Man、L-Rha、D-GlcA、D-GalA、D-Glc、D-Gal、D-Xyl和L-Ara)和单糖标品配制的混标进行PMP衍生,然后将黑果枸杞多糖样品以同样条件进行HPLC检测,根据出峰时间判断单糖组成。色谱条件:LC-20A-HPLC高效液相色谱仪,紫外检测器,C18色谱柱(250 mm×4.6 mm,TC-C18,Agilent),流动相为0.1 mol/L pH6.7的PBS与乙腈(83:17,v/v),流速1.0 mL/min,柱温30 ℃,检测波长245 nm,进样量20 μL。
1.2.3 LRPs抗氧化活性研究
1.2.3.1 DPPH自由基清除能力
将50 μL样品溶液加入96孔板,再加入25 μL 0.4 mmol/L的DPPH无水乙醇溶液,100 μL蒸馏水,振荡混匀,常温暗处反应30 min,以蒸馏水为空白对照,于波长517 nm处测样品溶液吸光度值A1;以80%乙醇代替上述DPPH无水乙醇溶液测得吸光度值A2,以80%乙醇代替样品溶液测得吸光度值A0[22]。DPPH自由基清除率按以下公式(2)计算:
DPPH自由基清除率(%)=(1−A1−A2A0)×100 (2) 1.2.3.2 ABTS+自由基清除能力
将20 μL样品溶液加入96孔板,再加入250 μL ABTS工作液,振荡混匀,室温暗处反应6 min,以蒸馏水为空白对照,于波长734 nm处测吸光值[23]。ABTS+自由基清除率计算同式(2),其中,样品和ABTS溶液混合物吸光值为A1,样品和80%乙醇混合物吸光值为A2,ABTS溶液和80%乙醇混合物吸光值为A0。
1.2.3.3 羟基自由基清除能力
将50 μL样品溶液加入96孔板,再加入50 μL FeSO4·7H2O溶液(9 mmol/L)和水杨酸乙醇溶液(9 mmol/L),振荡混匀,再加入50 μL H2O2溶液(0.1%,v/v)于37 ℃暗处反应30 min,以蒸馏水为空白对照[24],于波长510 nm处测吸光值。计算公式同式(2),其中,样品和反应体系混合物吸光值为A1;样品和反应体系(用80%乙醇代替H2O2溶液)混合物吸光值为A2,80%乙醇和反应体系混合物吸光值为A0。
1.2.3.4 超氧阴离子自由基清除活性
将20 μL样品溶液与180 μL Tris-HCl缓冲液(50 mmol/L,pH8.2)混合,于37 ℃条件下预热20 min,然后加入20 μL在37 ℃条件下预热的邻苯三酚溶液(3 mmol/L),混匀,以蒸馏水为空白对照,于波长325 nm处测吸光值[25]。计算公式同式(2),其中,样品和反应体系混合物吸光值为A1;样品和反应体系(用80%乙醇代替邻苯三酚溶液)混合物吸光值为A2,80%乙醇和反应体系混合物吸光值为A0。
1.2.3.5 还原力
样品溶液、K3Fe(CN)6溶液(10 mg/mL)和PBS缓冲液(0.2 mol/L,pH6.6)各取50 μL,加入96孔板,混匀后50 ℃水浴20 min,冷却至室温后,加入50 μL三氯乙酸溶液(100 mg/mL)和25 μL FeCl3溶液(10 mg/mL),以蒸馏水为空白对照,于波长700 nm处测吸光值[26]。还原力按以下公式(3)计算:
还原力=A1−A2 (3) 式中,A1为样品实验组的吸光值;A2为空白对照组的吸光值。
1.2.3.6 LRPs抗氧化活性相关性分析
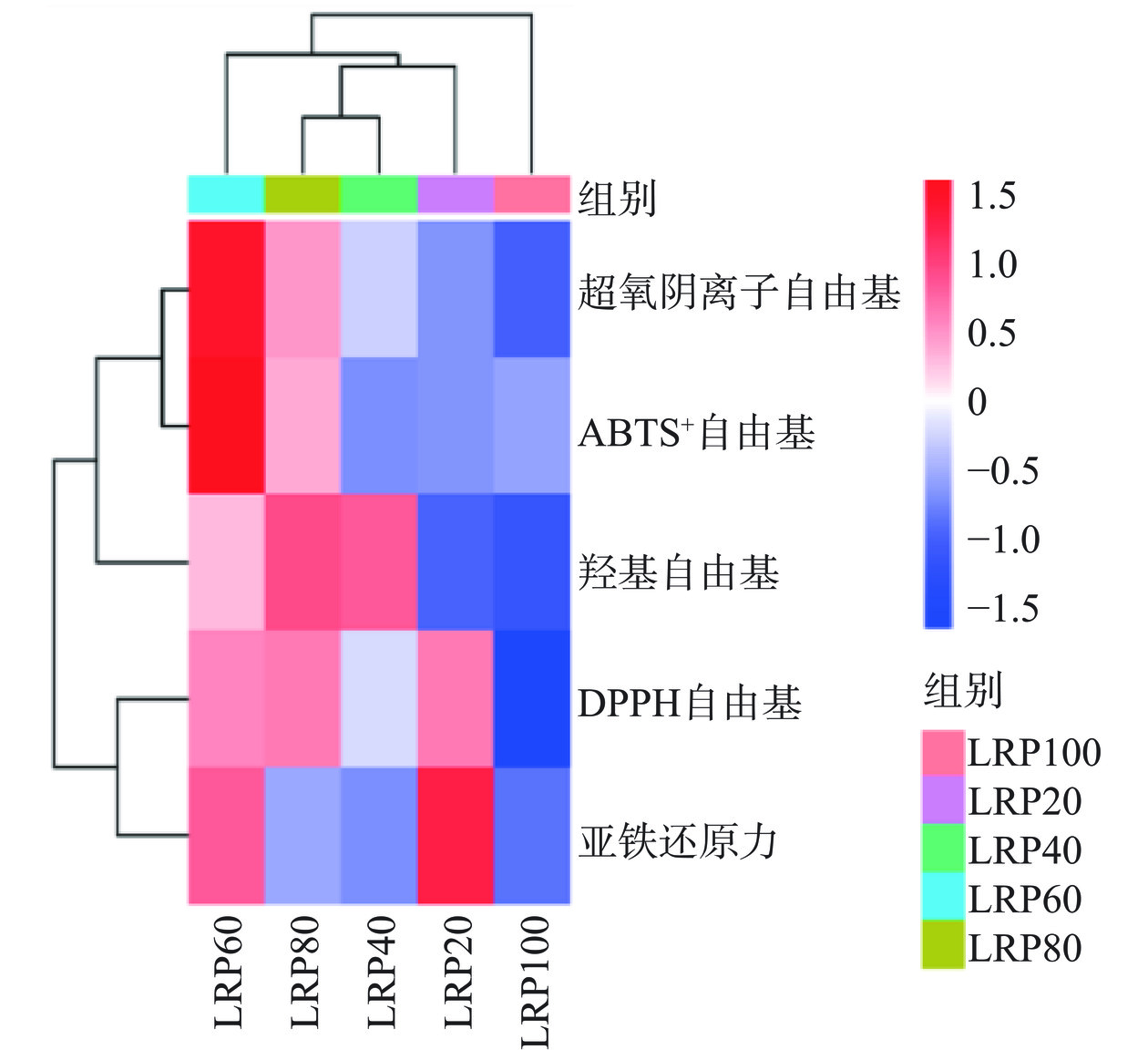
将不同温度提取多糖(浓度为10 mg/mL)的五种抗氧化活性绘制热图进行相关性分析。
1.2.4 LRPs免疫活性研究
1.2.4.1 LRPs对RAW264.7细胞活性的影响
不同提取温度黑果枸杞多糖对RAW264.7细胞活力的影响通过MTT试验进行测定[27]。将RAW264.7细胞以5×104个/孔的密度接种于96孔板,37 ℃、5% CO2培养箱中培养4 h,之后分别加入不同浓度的黑果枸杞多糖10 μL(终浓度为25、50、100、200、400 μg/mL),继续培养20 h。在培养结束时,移去培养基并加入10 μL MTT溶液(5 mg/mL)继续培养4 h。最后,在每孔中加入150 μL DMSO,避光振荡10 min,于490 nm处记录吸光度。同时设置实验空白组(CON,加入10 μL培养基)和LPS阳性对照组(LPS,加入10 μL浓度10 μg/mL的LPS)。细胞活力以OD样/OD空白值表示。
1.2.4.2 LRPs对RAW264.7细胞炎性因子IL-1β和TNF-α分泌的影响
通过酶联免疫吸附试验(ELISA)对RAW264.7细胞炎性因子IL-1β和TNF-α分泌水平进行检测[28]。将RAW264.7细胞以1×106个/孔的密度接种于96孔板培养4 h后,分别加入不同浓度的黑果枸杞多糖(终浓度为50、100、200 μg/mL)培养24 h。离心取细胞培养上清液,按照试剂盒说明书方法,对上清液中的IL-1β和TNF-α含量进行检测。同时设置实验空白对照组(CON)以及LPS阳性对照组(LPS,终浓度为5 μg/mL)。
1.3 数据处理
实验数据均以平均值±标准差(SD)值表示,采用SPSS Statistics 22进行统计分析,采用Duncan's新复极差法和最小显著性差异法(LSD)进行显著性分析,P<0.05表示差异有统计学意义。采用Origin 2021软件进行热图绘制。
2. 结果与分析
2.1 LRPs理化特性分析
2.1.1 LRPs理化性质分析
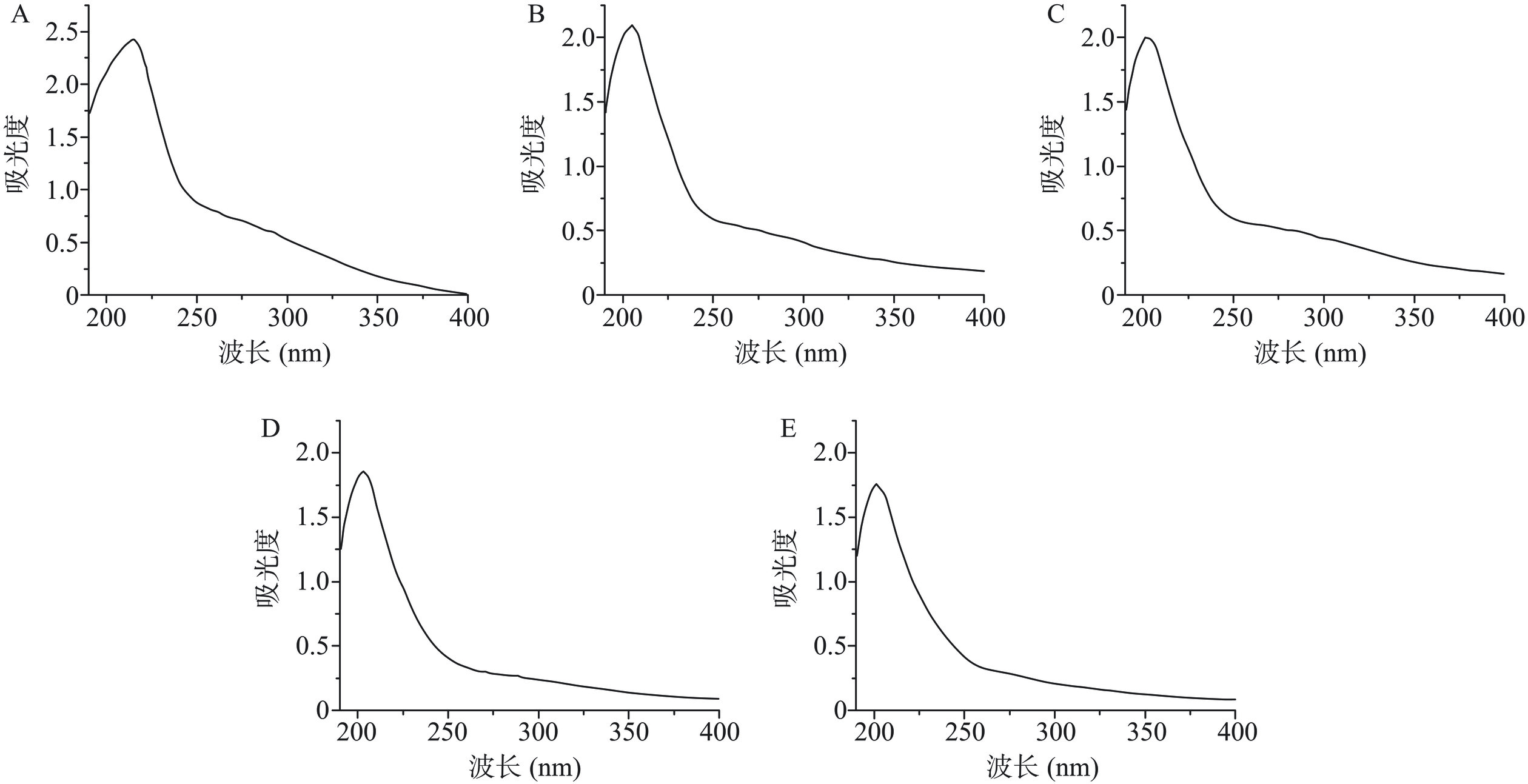
提取温度分别为20、40、60、80、100 ℃提取黑果枸杞多糖LRPs分别命名为LRP20、LRP40、LRP60、LRP80和LRP100。LRPs得率、碳水化合物含量和糖醛酸含量如表1所示,LRP60与LRP80得率显著高于其他组(P<0.05),但二者之间无显著性差异(P>0.05),LRP80和LRP100的糖醛酸含量显著高于其他多糖(P<0.05)。当提取温度达到100 ℃,多糖得率降低,可能是在高温下多糖的不稳定性造成的。碳水化合物含量与糖醛酸含量和多糖提取温度没有表现出线性相关性。LRPs紫外光谱检测如图1所示,在260、280 nm波长处均无吸收峰,说明不同温度提取黑果枸杞多糖不含核酸和蛋白。
表 1 LRPs理化特性分析Table 1. Physicochemical characterization of LRPs样品 得率(%) 碳水化合物含量(%) 糖醛酸含量(%) LRP20 1.51±0.21b 33.32±0.87d 15.91±0.36a LRP40 2.09±0.35c 35.71±0.48e 38.04±0.13c LRP60 2.38±0.11d 32.76±0.20c 34.63±0.42b LRP80 2.30±0.25cd 24.93±0.79a 42.68±0.33d LRP100 0.54±0.22a 26.14±0.25b 42.06±0.16d 注:同列不同字母表示差异显著(P<0.05)。 2.1.2 红外光谱检测分析
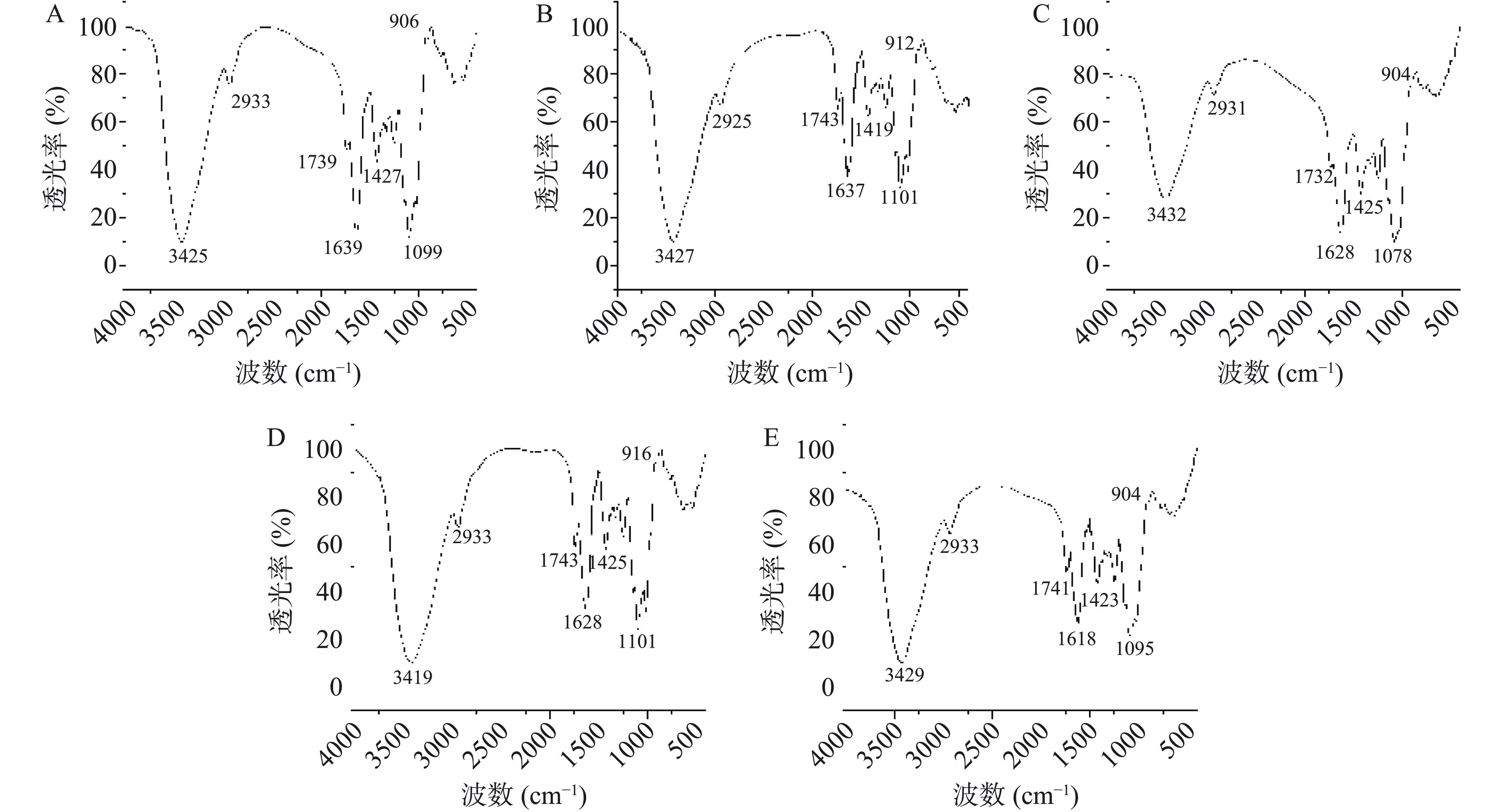
如图2所示,LRPs在3435~3210 cm−1和2935~2925 cm−1处有O-H伸缩振动和C-H伸缩振动的典型多糖特征峰,在1105~1070 cm−1附近的吸收峰表示C-O-C和C-O-H的伸缩振动,表明LRPs单糖残基均以吡喃糖形式存在[29]。在916~900 cm−1附近的吸收峰表示LRPs单糖主要以β-构型存在[30]。1750~1645、1650~1620、1430~1410 cm−1附近的吸收峰是糖醛酸的结构特征[31],但在LRPs之间也存在差异,LRP20和LRP60在1730 cm−1附近存在较弱的糖醛酸吸收峰(图2A、2C)。红外光谱分析表明,LRPs官能团几乎相同,只是键强度略有不同,表明提取温度几乎不会影响黑果枸杞多糖的官能团结构。
2.1.3 相对分子质量
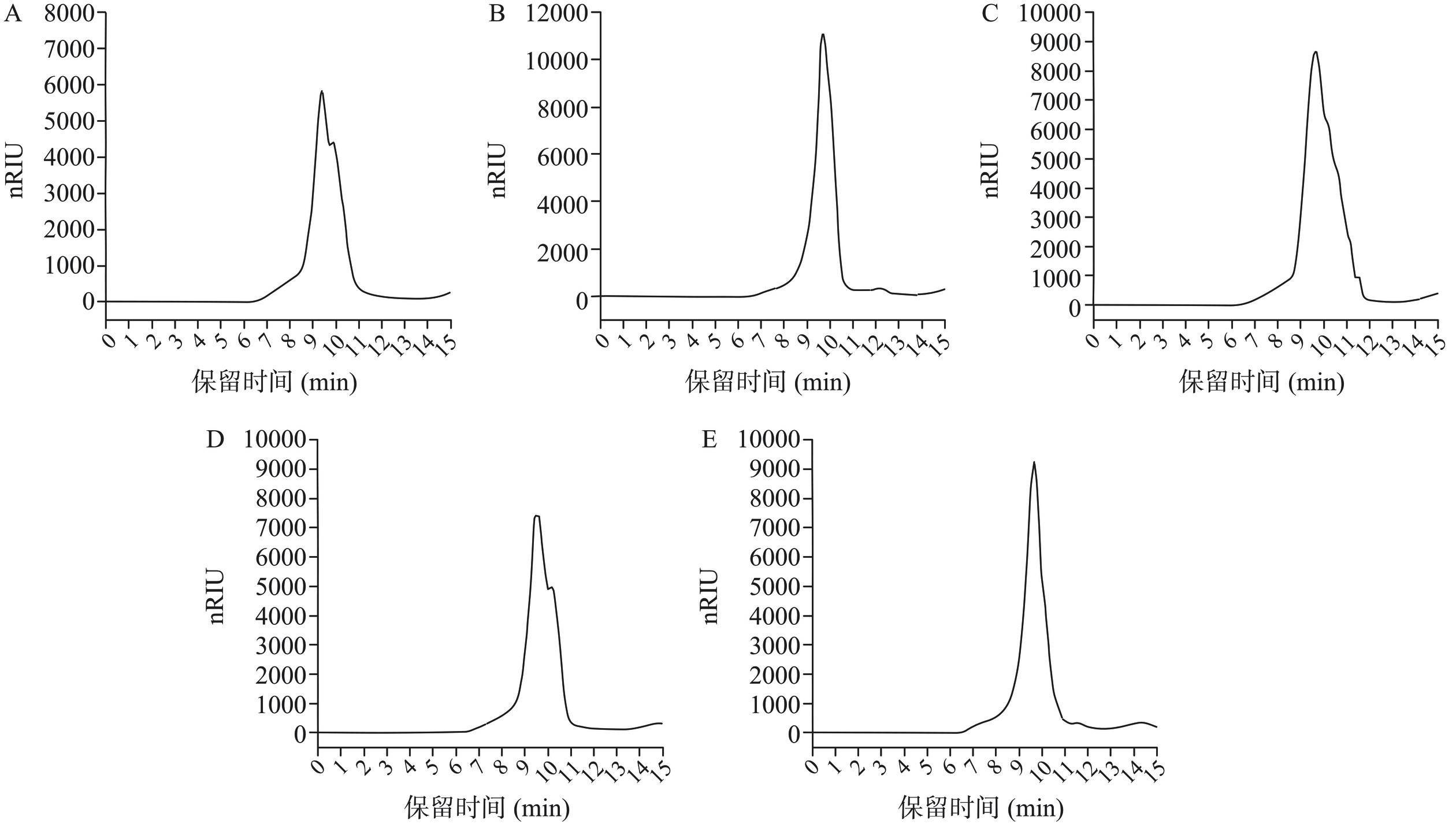
HPLC法测定多糖的相对分子质量结果如图3所示,LRP20、LRP40、LRP60、LRP80和LRP100的相对分子质量分别为293.34、227.94、233.45、273.53和233.66 kDa,LRPs的相对分子质量存在不同,表明提取温度会在一定程度上影响多糖的相对分子质量,但温度与这种影响的产生并无线性关系。
2.1.4 单糖组成分析
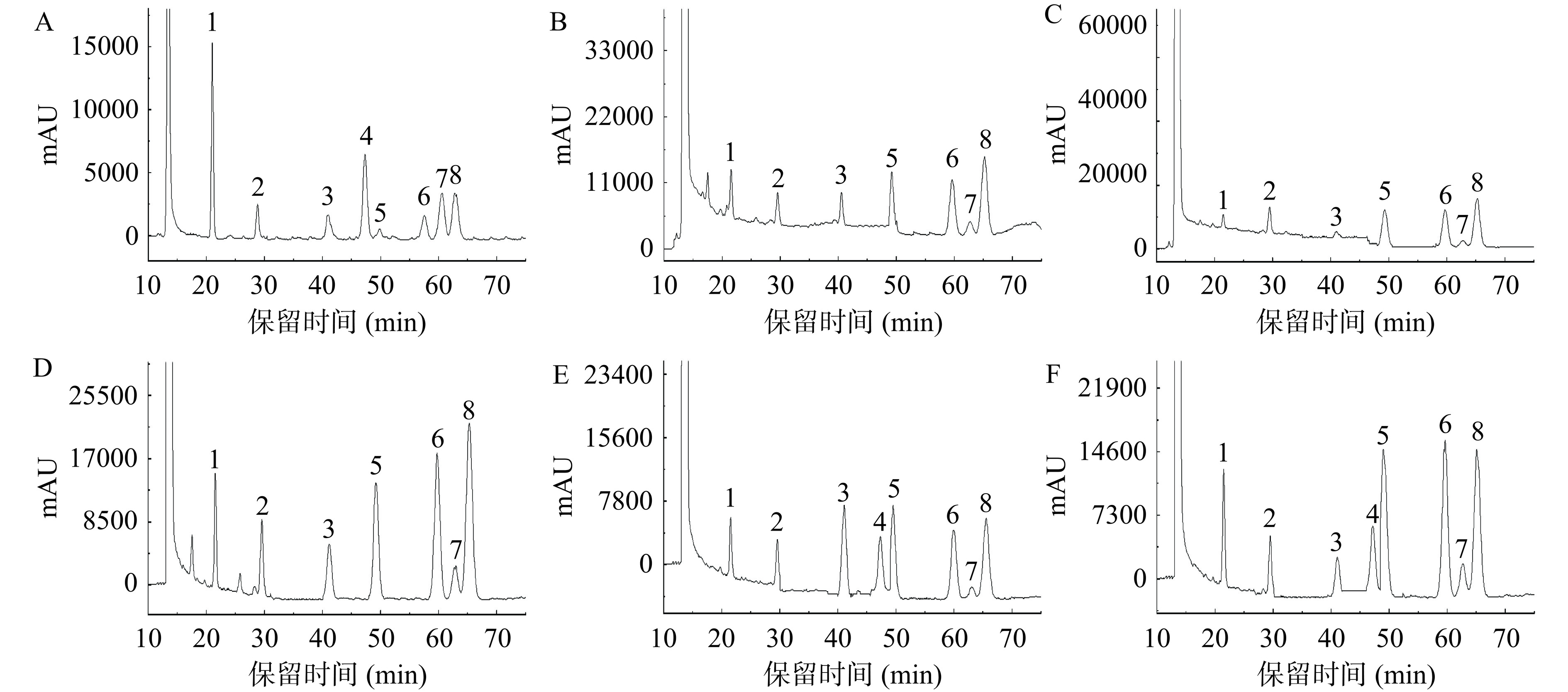
单糖高效液相色谱图如图4,不同温度提取多糖的单糖组成分析结果见表2。LRPs单糖组成主要为L-Ara、D-Gal、D-Glc、D-Man、L-Rha和D-GlcA,并含有少量的D-Xyl,其中LRP80和LRP100含有D-GalA。随着提取温度的升高,LRP80和LRP100中D-GalA比例骤增,可能是由于多糖在高温条件下发生了解聚,导致多糖降解而丢失了部分其他单糖,使得D-GalA含量升高。此外,还可能是由于低温条件下不易提取的D-GalA高含量多糖组分,在高温条件下加速了该类多糖组分的溶解与提取[32]。LRPs经PMP柱前衍生-HPLC分析结果表明不同温度提取黑果多糖的单糖组成存在差异。
表 2 LRPs单糖组成Table 2. Monosaccharide composition of LRPs保留时间(min) 单糖 分子量(kDa) 摩尔比 LRP20 LRP40 LRP60 LRP80 LRP100 21.032 D-Man 180.16 1.21 0.39 1.08 1.02 1.52 28.821 L-Rha 182.17 1.00 1.00 1.00 1.00 1.00 41.105 D-GlcA 194.14 1.48 0.49 1.08 3.15 1.84 47.334 D-GalA 194.14 − − − 2.80 4.07 49.858 D-Glc 180.16 2.84 2.49 2.57 3.28 5.76 57.568 D-Gal 180.16 3.17 2.60 3.64 2.94 3.06 60.642 D-Xyl 150.13 0.75 0.22 0.46 0.43 1.18 62.785 L-Ara 150.13 4.87 3.75 5.00 3.63 5.28 2.2 LRPs抗氧化活性分析
2.2.1 LRPs对DPPH自由基的清除活性
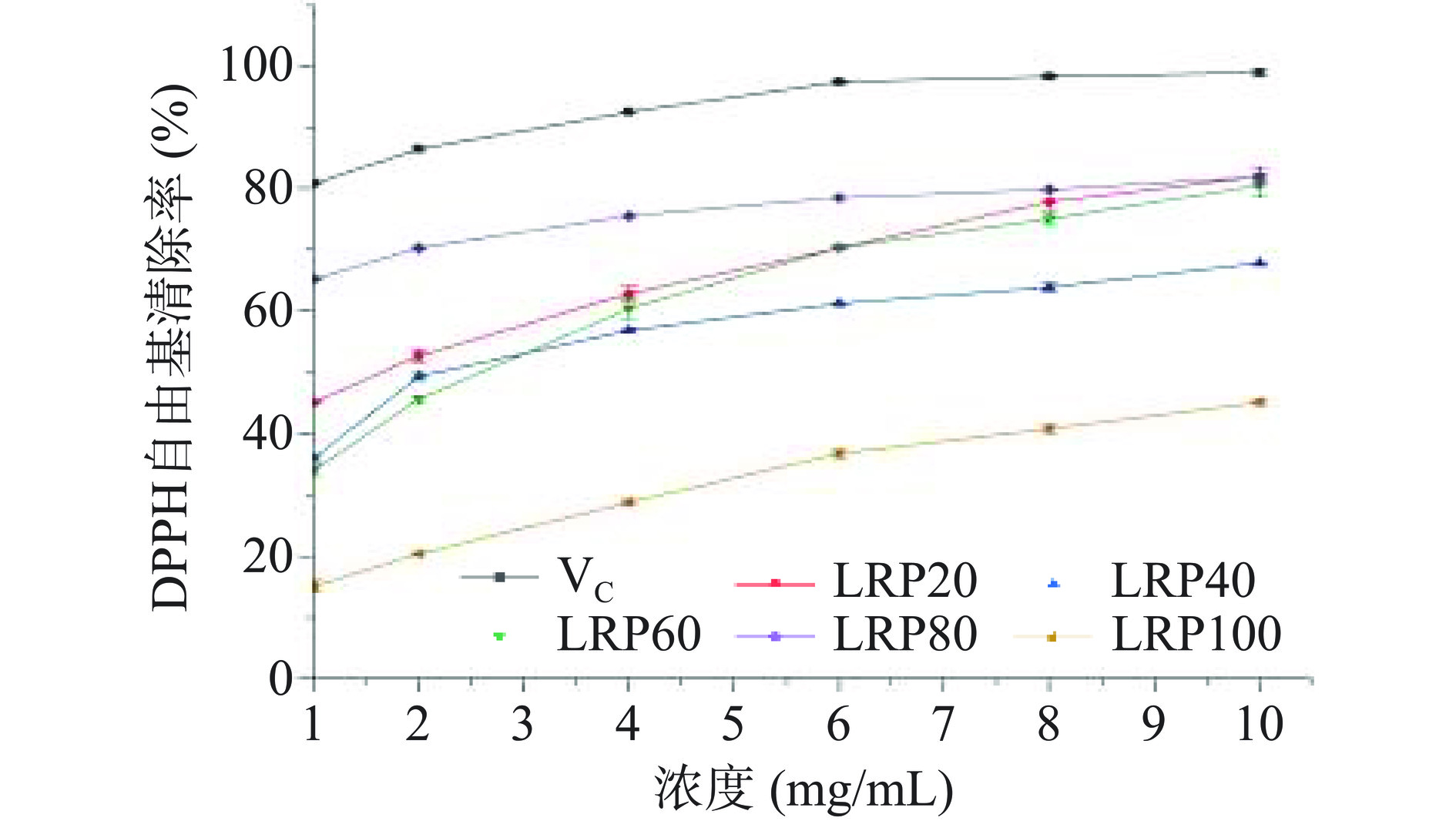
如图5所示,在1~10 mg/mL浓度范围内,不同提取温度黑果枸杞多糖和VC对DPPH自由基有一定的清除作用,随着浓度的增加,其清除能力逐渐增强。当浓度为6 mg/mL时,LRP20、LRP40、LRP60、LRP80和LRP100的DPPH自由基清除率趋于稳定,此时的清除率分别为70.32%±0.12%、61.19%±0.18%、70.39%±0.35%、78.49%±0.11%和32.76%±0.71%,VC的清除率为97.36%±0.24%。在1~10 mg/mL浓度范围内,除阳性对照VC外,LRP80自由基清除能力最强,可能是由于LRP80中D-GalA比例增加引起。而LRP100中D-GalA比例升高,但DPPH自由基的清除活性却最差,可能是由于提取温度过高,在D-GalA比例升高的同时破坏了多糖清除DPPH自由基的生物活性。除LRP100外,LRP40清除DPPH自由基的能力低于LRP20、LRP60和LRP80,可能与LRP40中D-Gal、D-Glc、D-Man和D-GlcA比例降低有关。
2.2.2 LRPs对ABTS+自由基的清除活性
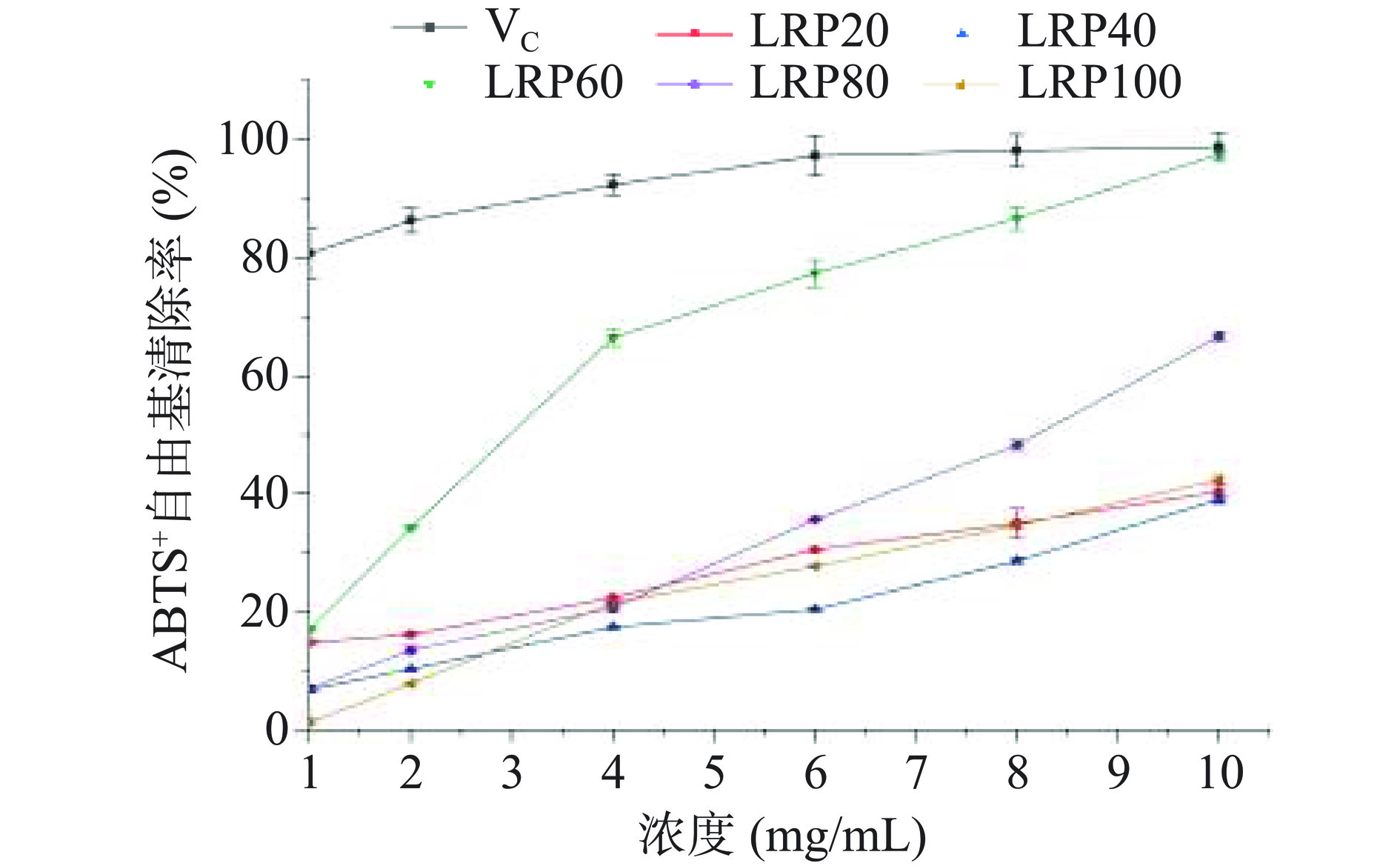
如图6所示,其中,LRP20、LRP40和LRP100的ABTS+自由基的清除率相似。当浓度为10 mg/mL时,LRP20、LRP40、LRP60、LRP80和LRP100的ABTS+自由基的清除率分别为40.39%±0.12%、39.10%±0.65%、97.60%±0.38%、66.74%±0.83%和42.41%±0.77%,其中,LRP60对ABTS+自由基的清除作用最强,其清除率略低于阳性对照VC,高于其他组分,可能与LRP60具有较低的分子量以及D-Gal比例升高有关。LRP40的ABTS+自由基清除率最低,可能与D-Man、D-GlcA、D-Glc、D-Gal和D-Xyl比例均较低有关。
2.2.3 LRPs对羟基自由基的清除活性
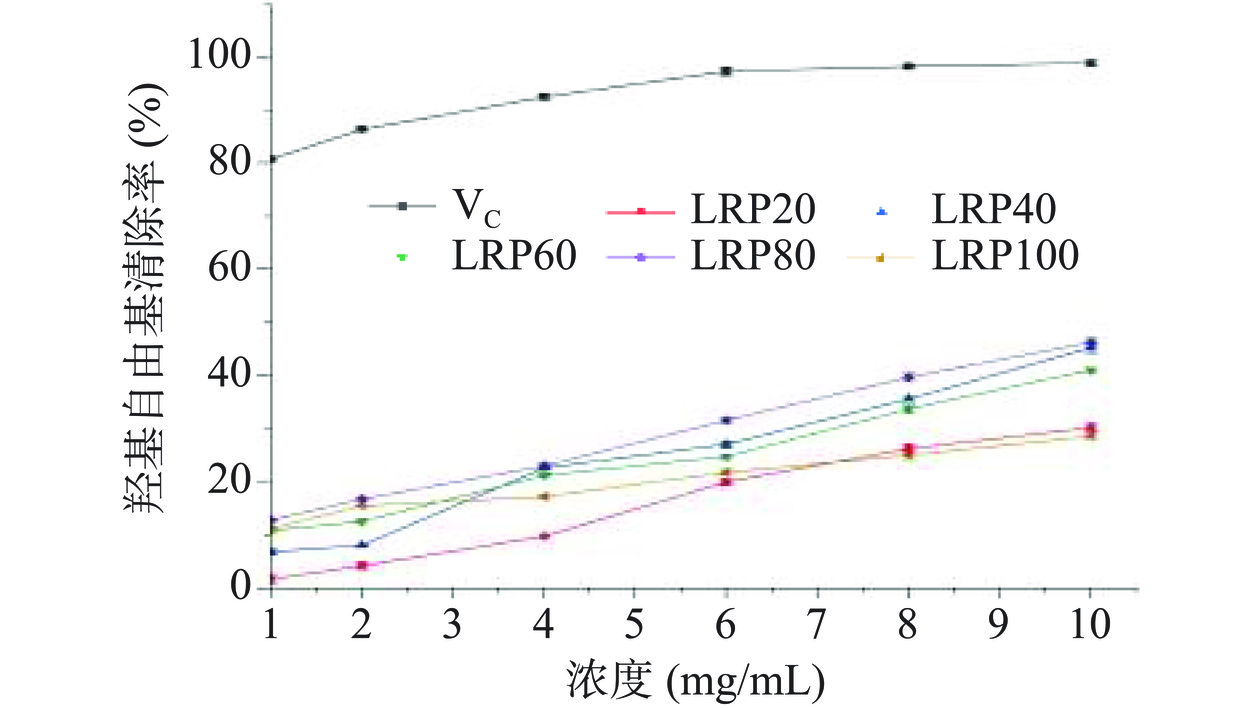
如图7所示,在1~10 mg/mL浓度范围内,LRPs清除能力随浓度升高逐渐增强,但均低于阳性对照VC。当浓度为10 mg/mL时,LRP20、LRP40、LRP60、LRP80和LRP100的羟基自由基清除率分别为30.28%±0.79%、45.27%±0.94%、41.06%±0.35%、46.29%±0.69%和28.63%±0.43%,其中LRP80对羟基自由基清除能力最高,与LRP80对DPPH自由基的清除活性最高的原因可能一致。
2.2.4 LRPs对超氧阴离子的清除活性
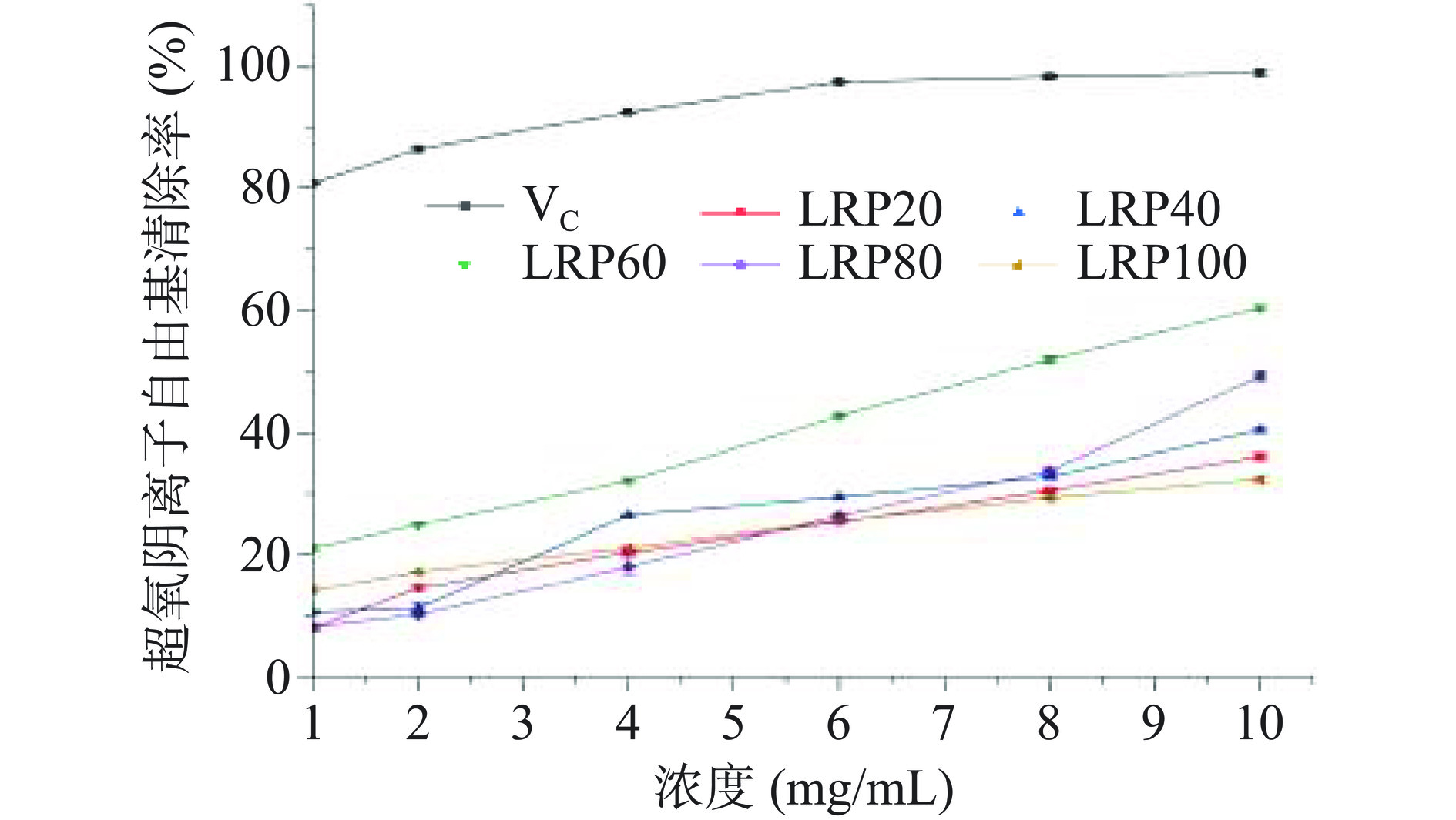
如图8所示,在1~10 mg/mL浓度范围内,LRP60的超氧阴离子清除率均高于其他黑果枸杞多糖组分,当浓度为10 mg/mL时,超氧阴离子清除活性为LRP60>LRP80>LRP40>LRP20>LRP100,清除率分别为60.51%±0.50%、49.05%±0.33%、41.13%±0.75%、36.51%±0.51%和32.42%±0.42%。LRP60较高的超氧阴离子清除活性可能与其分子量较低和D-Gal比例升高有关。
2.2.5 LRPs的亚铁还原力
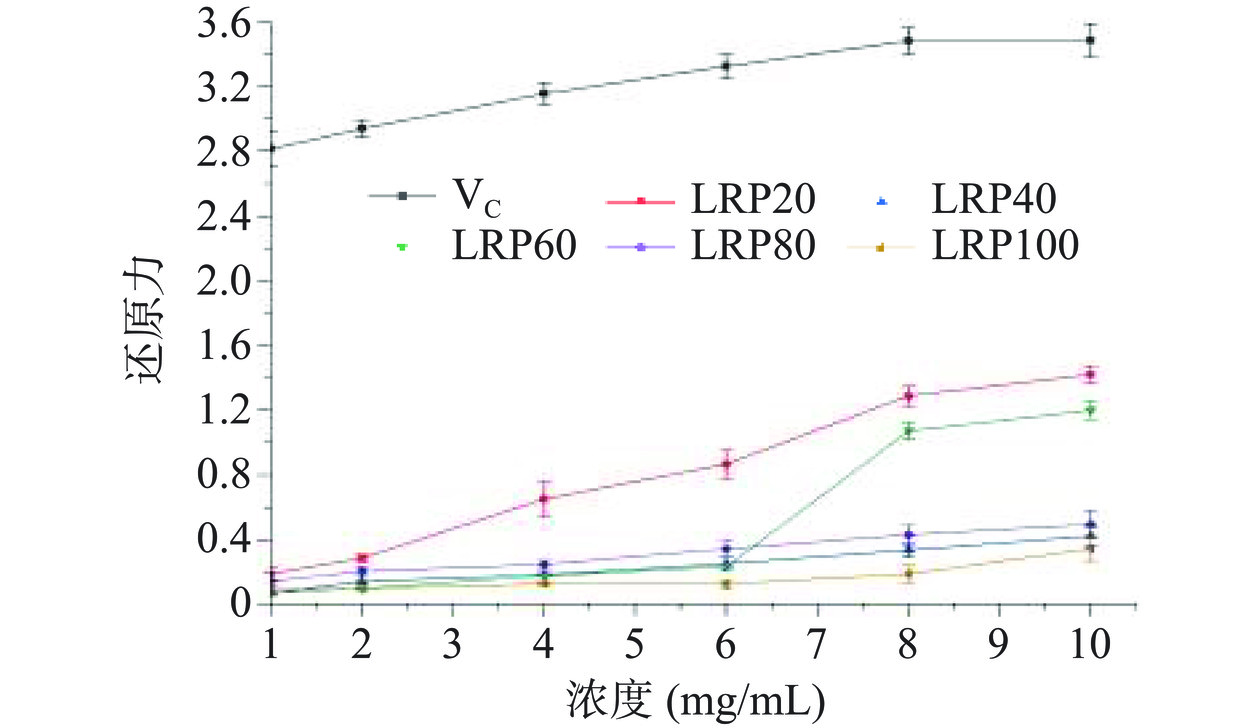
如图9所示,在1~10 mg/mL浓度范围内,黑果枸杞多糖的总还原力远低于VC,其中LRP20的亚铁还原力活性最强。当浓度低于6 mg/mL时,LRP40、LRP60、LRP80和LRP100的亚铁还原力相似,且均小于1,当浓度达到8 mg/mL和10 mg/mL时,LRP60的亚铁还原力骤升,高于LRP40、LRP80和LRP100,但仍低于LRP20。LRP20的亚铁还原力活性最强可能与其分子量最高有关。
2.2.6 LRPs抗氧化活性相关性分析
如图10所示,在实验浓度范围内,LRPs自由基清除能力及还原力随多糖浓度的增加而增加。而同一多糖组分对不同自由基的清除活性也不同,实验浓度条件下不同温度提取各组分黑果枸杞多糖对DPPH自由基的清除活性高于其他活性。由图10可知,多糖浓度为10 mg/mL时,LRP60与抗氧化活性呈强相关,其次为LRP80。综合分析可知LRP60抗氧化活性最高,这可能与LRP60具有较低的分子量以及D-Gal比例升高有关。进一步说明黑果枸杞在60 ℃条件下提取,多糖在低分子量及单糖组成中D-Gal比例较高时具有良好的抗氧化活性。
2.3 LRPs免疫调节活性分析
2.3.1 LRPs对RAW264.7细胞活力的影响
由表3可知,除LRP20和LRP40在25 μg/mL浓度外,LRPs在25~400 μg/mL浓度范围内对RAW264.7细胞活力均有促进作用(P<0.05或P<0.01),且在50~200 μg/mL浓度范围内呈现良好的量效关系。LRPs在50 μg/mL和100 μg/mL浓度时,对RAW264.7细胞活力影响为LRP100>LRP80>LRP60>LRP40>LRP20且呈显著性差异(P<0.05);在200 μg/mL和400 μg/mL时,LRP60、LRP80和LRP100对细胞活力的影响极显著高于LRP40和LRP20(P<0.01),在400 μg/mL时LRP80和LRP100二者之间没有显著差异(P>0.05),而在200 μg/mL时LRP80细胞活力极显著高于LRP100(P<0.01)。综合分析以上实验结果,后续选择50、100和200 μg/mL浓度进行实验。
表 3 不同剂量LRPs对RAW264.7细胞活力的影响Table 3. Effect of different doses of LRPs on the viability of RAW264.7 cells多糖样品 多糖浓度(μg/mL) 25 50 100 200 400 LRP20 0.5907±0.0345Aa 1.2567±0.0801Aa 1.8890±0.0334Aa 1.9975±0.0214Aa 2.0864±0.1660Aa LRP40 0.7360±0.0770Bb 1.6785±0.1009Bb 2.5422±0.0532Bb 2.3457±0.0653Bb 2.4097±0.0345Bb LRP60 1.4789±0.0910Cc 1.8976±0.0856Cc 2.6755±0.0756Cc 2.7896±0.1077Cc 2.6743±0.1009Cc LRP80 1.5097±0.0321Dd 1.9065±0.0756Dd 2.6997±0.0546Dc 2.8965±0.0997Dd 2.7854±0.1068Dd LRP100 1.5590±0.0421Dd 1.9087±0.0806Dd 2.7098±0.0330Ec 2.7770±0.0898Cc 2.7565±0.0876Dd 注:在同一浓度下,不同大写字母表示差异显著(P<0.05);不同小写字母表示差异极显著(P<0.01),表4~表5同。 2.3.2 LRPs对RAW264.7细胞因子IL-1β和TNF-α分泌的影响
多糖可以通过刺激RAW264.7细胞释放白细胞介素(IL)、肿瘤坏死因子(TNF)等细胞因子,从而在免疫调节中发挥作用。IL-1β(白细胞介素-1β)主要由单核细胞和巨噬细胞产生,可通过自分泌、旁分泌等多种方式发挥效应。TNF-α(肿瘤坏死因子α)主要由巨噬细胞和单核细胞产生,在炎症、细胞凋亡和免疫系统发育中起核心作用,是调节免疫细胞功能的关键细胞因子[33]。由图11A和表4可知,与空白组相比,当浓度为50 μg/mL时,LRP20不能显著促进RAW264.7细胞分泌IL-1β(P>0.05),而LRP40(P<0.05)、LRP60(P<0.01)、LRP80(P<0.01)和LRP100(P<0.05)均可显著促进RAW264.7细胞分泌IL-1β;浓度为100 μg/mL和200 μg/mL时,LRPs均能够极显著促进RAW264.7细胞分泌IL-1β(P<0.01),活性分别为LRP60>LRP80>LRP100>LRP40>LRP20和LRP80>LRP100>LRP60>LRP40>LRP20。由图11B和表5可知,与空白组相比,浓度为50 μg/mL的LRP20和LRP40不能显著促进RAW264.7细胞分泌TNF-α(P>0.05),LRP60、LRP80和LRP100均可极显著促进TNF-α分泌(P<0.01);当浓度为100 μg/mL和200 μg/mL时,LRPs均能够显著促进RAW264.7细胞分泌TNF-α(P<0.01或P<0.05),其活性分别为LRP80>LRP60>LRP100>LRP40>LRP20和LRP80>LRP60>LRP100>LRP40>LRP20,均呈现极显著性差异(P<0.01)。综上分析,在实验浓度范围内,LRPs促进RAW264.7细胞因子IL-1β和TNF-α分泌活性随多糖浓度的增加而增加,LRP80具有良好的促进RAW264.7细胞因子分泌的作用,其次为LRP60。这可能与LRP80较高的分子量以及其中两种糖醛酸比例较高有关。进一步说明黑果枸杞在80 ℃条件下提取,多糖在高分子量及D-GlcA和D-GalA比例较高时具有良好的免疫调节活性。
表 4 不同剂量LRPs对RAW264.7细胞因子IL-1β分泌的影响Table 4. Effect of different doses of LRPs on the IL-1β production of RAW264.7 cells多糖样品 多糖浓度(μg/mL) 50 100 200 LRP20 137.0053±2.7773Aa 456.3690±10.2556Aa 886.3487±19.5470Aa LRP40 243.1781±9.6830Cc 618.9001±15.3684Bb 1023.5800±19.5872Bb LRP60 556.6387±19.1979Ee 946.2131±14.3214Ee 1239.4874±6.3200Cc LRP80 436.6397±19.0664Dd 853.2425±18.0014Dd 1697.2210±25.3420Ee LRP100 238.7783±8.0366Bb 798.1250±14.3321Cc 1641.2249±12.3337Dd 表 5 不同剂量LRPs对RAW264.7细胞因子TNF-α分泌的影响Table 5. Effect of different doses of LRPs on the TNF-α production of RAW264.7 cells多糖样品 多糖浓度(μg/mL) 50 100 200 LRP20 70.8652±2.7773Aa 156.3690±10.2556Aa 386.3487±21.547Aa LRP40 123.1781±11.6830Bb 308.9001±15.3684Bb 623.5800±19.5872Bb LRP60 288.6387±19.1974Cc 546.2131±22.3214Dd 939.4874±16.3205Cc LRP80 336.6397±19.0664Ee 553.2425±18.0014Ee 997.2210±25.3420Ee LRP100 298.7783±8.0366Dd 508.1250±18.3321Cc 941.2249±12.33365Dd 3. 讨论与结论
提取温度不仅影响多糖的理化性质与化学结构,也会影响多糖的生物活性[32]。多糖复杂多样的化学结构决定了多糖生物活性的多样性。多糖分子量是多糖生物活性的重要结构指标。在不同温度提取多糖的分子量中LRP20分子量最高,在生物活性研究中LRP20除具有良好的亚铁还原力活性外,其他活性均较低,可能是由于LRP20分子量大导致多糖空间体积变大不利于多糖发挥生物活性。LRP40分子量最低,总体而言其生物活性低于LRP60和LRP80,可能由于低分子量使得能与生物活性位点结合的多糖活性结构单元不能完全形成发挥活性的聚合状态[34]。LRP100与LRP60分子量接近,但是在较高浓度时LRP100生物活性低于LRP60和LRP80,可能与提取温度过高对多糖生物活性产生影响有关。半乳糖和阿拉伯糖是黑果枸杞发挥功能活性的主要单糖[2]。与其他温度提取多糖的单糖组成相比较,LRP60中D-Gal和L-Ara比例均为最高,可能是60 ℃下提取的黑果枸杞多糖呈现较好抗氧化活性的主要原因。LRP80中D-GlcA占比最高,且D-Glc和D-GalA占比均高于LRP20、LRP40和LRP60,可能是其发挥良好免疫活性的物质基础[26]。而在LRP100中,D-GlcA、D-Glc和D-GalA均占比较高,而生物活性低于LRP60和LRP80,可能是由于提取温度过高对多糖生物活性造成影响。与之前的研究报道一致[35],本研究表明多糖的抗氧化活性、免疫活性与多糖分子量、单糖组成有关。
本研究在不同温度(20、40、60、80、100 ℃)条件下提取黑果枸杞多糖,经过Sevag法脱蛋白、透析制得LRP20、LRP40、LRP60、LRP80和LRP100。实验研究表明,LRP60与LRP80得率显著高于其他多糖;提取温度60 ℃时,黑果枸杞多糖单糖组成中D-Gal和L-Ara比例升高,抗氧化活性较好;提取温度80 ℃时,D-GlcA、D-Glc和D-GalA比例升高,黑果枸杞多糖免疫调节活性较好。因此,黑果枸杞多糖LRP60和LRP80可作为潜在的天然抗氧剂或免疫调节剂。后续可以从多糖糖苷键组成和链接方式等对LRPs生物活性的差异开展更为深入的研究,以期为黑果枸杞多糖的开发和应用提供理论基础。
-
表 1 LRPs理化特性分析
Table 1 Physicochemical characterization of LRPs
样品 得率(%) 碳水化合物含量(%) 糖醛酸含量(%) LRP20 1.51±0.21b 33.32±0.87d 15.91±0.36a LRP40 2.09±0.35c 35.71±0.48e 38.04±0.13c LRP60 2.38±0.11d 32.76±0.20c 34.63±0.42b LRP80 2.30±0.25cd 24.93±0.79a 42.68±0.33d LRP100 0.54±0.22a 26.14±0.25b 42.06±0.16d 注:同列不同字母表示差异显著(P<0.05)。 表 2 LRPs单糖组成
Table 2 Monosaccharide composition of LRPs
保留时间(min) 单糖 分子量(kDa) 摩尔比 LRP20 LRP40 LRP60 LRP80 LRP100 21.032 D-Man 180.16 1.21 0.39 1.08 1.02 1.52 28.821 L-Rha 182.17 1.00 1.00 1.00 1.00 1.00 41.105 D-GlcA 194.14 1.48 0.49 1.08 3.15 1.84 47.334 D-GalA 194.14 − − − 2.80 4.07 49.858 D-Glc 180.16 2.84 2.49 2.57 3.28 5.76 57.568 D-Gal 180.16 3.17 2.60 3.64 2.94 3.06 60.642 D-Xyl 150.13 0.75 0.22 0.46 0.43 1.18 62.785 L-Ara 150.13 4.87 3.75 5.00 3.63 5.28 表 3 不同剂量LRPs对RAW264.7细胞活力的影响
Table 3 Effect of different doses of LRPs on the viability of RAW264.7 cells
多糖样品 多糖浓度(μg/mL) 25 50 100 200 400 LRP20 0.5907±0.0345Aa 1.2567±0.0801Aa 1.8890±0.0334Aa 1.9975±0.0214Aa 2.0864±0.1660Aa LRP40 0.7360±0.0770Bb 1.6785±0.1009Bb 2.5422±0.0532Bb 2.3457±0.0653Bb 2.4097±0.0345Bb LRP60 1.4789±0.0910Cc 1.8976±0.0856Cc 2.6755±0.0756Cc 2.7896±0.1077Cc 2.6743±0.1009Cc LRP80 1.5097±0.0321Dd 1.9065±0.0756Dd 2.6997±0.0546Dc 2.8965±0.0997Dd 2.7854±0.1068Dd LRP100 1.5590±0.0421Dd 1.9087±0.0806Dd 2.7098±0.0330Ec 2.7770±0.0898Cc 2.7565±0.0876Dd 注:在同一浓度下,不同大写字母表示差异显著(P<0.05);不同小写字母表示差异极显著(P<0.01),表4~表5同。 表 4 不同剂量LRPs对RAW264.7细胞因子IL-1β分泌的影响
Table 4 Effect of different doses of LRPs on the IL-1β production of RAW264.7 cells
多糖样品 多糖浓度(μg/mL) 50 100 200 LRP20 137.0053±2.7773Aa 456.3690±10.2556Aa 886.3487±19.5470Aa LRP40 243.1781±9.6830Cc 618.9001±15.3684Bb 1023.5800±19.5872Bb LRP60 556.6387±19.1979Ee 946.2131±14.3214Ee 1239.4874±6.3200Cc LRP80 436.6397±19.0664Dd 853.2425±18.0014Dd 1697.2210±25.3420Ee LRP100 238.7783±8.0366Bb 798.1250±14.3321Cc 1641.2249±12.3337Dd 表 5 不同剂量LRPs对RAW264.7细胞因子TNF-α分泌的影响
Table 5 Effect of different doses of LRPs on the TNF-α production of RAW264.7 cells
多糖样品 多糖浓度(μg/mL) 50 100 200 LRP20 70.8652±2.7773Aa 156.3690±10.2556Aa 386.3487±21.547Aa LRP40 123.1781±11.6830Bb 308.9001±15.3684Bb 623.5800±19.5872Bb LRP60 288.6387±19.1974Cc 546.2131±22.3214Dd 939.4874±16.3205Cc LRP80 336.6397±19.0664Ee 553.2425±18.0014Ee 997.2210±25.3420Ee LRP100 298.7783±8.0366Dd 508.1250±18.3321Cc 941.2249±12.33365Dd -
[1] 邢丽杰, 王远, 刘帅光, 等. 黑果枸杞中活性成分的研究进展[J]. 农产品加工,2021(10):66−69,72. [XING L J, WANG Y, LIU S G, et al. Research progress of active ingredients in Lycium ruthenicum Murr J]. Farm Products Processing,2021(10):66−69,72.
[2] WANG S Q, LIU B, LIU S, et al. Structural features of an acidic polysaccharide with the potential of promoting osteoblast differentiation from Lycium ruthenicum Murr.[J]. Natural Product Research,2018,34(16):2249−2254.
[3] 谭扬扬, 艾克山·吾拉木, 伊再提古丽·外力, 等. 黑果枸杞多糖对H2O2诱导的ARPE-19细胞的保护作用[J]. 中华中医药杂志,2022,37(4):2289−2294. [TAN Y Y, EHSAN G, YIZATGUL W, et al. Protective effect of Lycium ruthenicum Murr. polysaccharides on ARPE-19 cells induced by H2O2[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2022,37(4):2289−2294.] TAN Y Y, EHSAN G, YIZATGUL W, et al. Protective effect of Lycium ruthenicum Murr. polysaccharides on ARPE-19 cells induced by H2O2[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2022, 37(4): 2289−2294.
[4] 王睿智, 任立汆, 加杨娥, 等. 黑果枸杞多糖对中波紫外线诱导HaCaT细胞增殖活性及P16蛋白表达的影响[J]. 中国高原医学与生物学杂志,2018,39(3):171−174. [WANG R, REN L G, JIA Y E, et al. The effect of Lycium ruthenicum Murr. polysaccharide on UVB irradiation induced HaCaT cells proliferative activity and P16 protein expression[J]. Chinses High Altitude Medicine and Biology,2018,39(3):171−174.] WANG R, REN L G, JIA Y E, et al. The effect of Lycium ruthenicum Murr. polysaccharide on UVB irradiation induced HaCaT cells proliferative activity and P16 protein expression[J]. Chinses High Altitude Medicine and Biology, 2018, 39(3): 171−174.
[5] 汪建红, 陈晓琴, 张蔚佼. 黑果枸杞果实多糖抗疲劳生物功效及其机制研究[J]. 食品科技,2009,34(2):203−207. [WANG J H, CHEN X Q, ZHANG W J. Study on biological effect and mechanism of antifatigue of polysaccharide from Lycium ruthenicum Murr. fruit[J]. Food Science and Technology,2009,34(2):203−207.] WANG J H, CHEN X Q, ZHANG W J. Study on biological effect and mechanism of antifatigue of polysaccharide from Lycium ruthenicum Murr. fruit[J]. Food Science and Technology, 2009, 34(2): 203−207.
[6] 邢丽杰, 张晓璐, 王远, 等. 黑果枸杞在抗肿瘤方面的研究进展[J]. 农产品加工,2022,545(3):73−76. [XING L J, ZHANG X L, WANG Y, et al. Research progress of Lycium ruthenicum Murry in anti-tumor[J]. Farm Products Processing,2022,545(3):73−76.] XING L J, ZHANG X L, WANG Y, et al. Research progress of Lycium ruthenicum Murry in anti-tumor[J]. Farm Products Processing, 2022, 545(3): 73−76.
[7] 汪建红, 陈晓琴, 张蔚佼. 黑果枸杞果实多糖降血糖生物功效及其机制研究[J]. 食品科学,2009,30(5):244−248. [WANG J H, CHEN X Q, ZHANG W J. Study on hypoglycemic function of polysaccharides from Lycium ruthenicum Murr. fruit and its mechanism[J]. Food Science,2009,30(5):244−248.] doi: 10.3321/j.issn:1002-6630.2009.05.056 WANG J H, CHEN X Q, ZHANG W J. Study on hypoglycemic function of polysaccharides from Lycium ruthenicum Murr. fruit and its mechanism[J]. Food Science, 2009, 30(5): 244−248. doi: 10.3321/j.issn:1002-6630.2009.05.056
[8] DENG K W, LI Y L, XIAO M, et al. Lycium ruthenicum Murr. polysaccharide protects cortical neurons against oxygen-glucose deprivation/reperfusion in neonatal hypoxic-ischemic encephalopathy[J]. International Journal of Biological Macromolecules,2020,158:562−568. doi: 10.1016/j.ijbiomac.2020.04.122
[9] 王莉, 叶维佳, 吴红静, 等. 黑果枸杞多糖对大鼠肝损伤的保护研究[J]. 食品工业科技,2020,41(14):287−290,296. [WANG L, YE W J, WU H J, et al. Protective effect of Lycium barbarum polysaccharide on hepatic injury by acrylamide in rats[J]. Science and Technology of Food Industry,2020,41(14):287−290,296.] WANG L, YE W J, WU H J, et al. Protective effect of Lycium barbarum polysaccharide on hepatic injury by acrylamide in rats[J]. Science and Technology of Food Industry, 2020, 41(14): 287−290,296.
[10] 王莉, 林芝雨, 庞旭涛, 等. 黑果枸杞多糖对菌群人源化小鼠肠道微生物调节研究[J]. 安徽农业科学,2020,48(1):178−180. [WANG L, LIN Z Y, PANG X T, et al. Regulation research of Lycium ruthenicum polysaccharide on gut microbes in HFA mice[J]. Journal of Anhui Agricultural Sciences,2020,48(1):178−180.] doi: 10.3969/j.issn.0517-6611.2020.01.054 WANG L, LIN Z Y, PANG X T, et al. Regulation research of Lycium ruthenicum polysaccharide on gut microbes in HFA mice[J]. Journal of Anhui Agricultural Sciences, 2020, 48(1): 178−180. doi: 10.3969/j.issn.0517-6611.2020.01.054
[11] ZHANG G, CHEN S, ZHOU W, et al. Rapid qualitative and quantitative analyses of eighteen phenolic compounds from Lycium ruthenicum Murray by UPLC-Q-Orbitrap MS and their antioxidant activity[J]. Food Chemistry,2018,269:150−156. doi: 10.1016/j.foodchem.2018.06.132
[12] YUN D, YAN Y, LIU J. Isolation, structure and biological activity of polysaccharides from the fruits of Lycium ruthenicum Murr:A review[J]. Carbohydrate Polymers,2022,291:119618. doi: 10.1016/j.carbpol.2022.119618
[13] 鲁小静, 冯艳波, 陈晓瑞, 等. 响应面法优化黑果枸杞多糖的提取工艺研究[J]. 中国酿造,2013,32(6):79−83. [LU X J, FENG Y B, CHEN X R, et al. Optimization for extraction technology of Lycium ruthenicum Murr. polysaccharides by response surface methodology[J]. China Brewing,2013,32(6):79−83.] doi: 10.3969/j.issn.0254-5071.2013.06.021 LU X J, FENG Y B, CHEN X R, et al. Optimization for extraction technology of Lycium ruthenicum Murr. polysaccharides by response surface methodology[J]. China Brewing, 2013, 32(6): 79−83. doi: 10.3969/j.issn.0254-5071.2013.06.021
[14] 吴永剑, 张超, 周丽娟, 等. 不同干燥温度对潞党参药材中游离糖及多糖的影响[J]. 时珍国医国药,2022,33(1):121−124. [WU Y J, ZHANG C, ZHOU L J, et al. Effects of different drying temperatures on the contents of free sugars and polysaccharides in Codonopsi[J]. Lishizhen Medicine and Materia Medica Research,2022,33(1):121−124.] doi: 10.3969/j.issn.1008-0805.2022.01.30 WU Y J, ZHANG C, ZHOU L J, et al. Effects of different drying temperatures on the contents of free sugars and polysaccharides in Codonopsi[J]. Lishizhen Medicine and Materia Medica Research, 2022, 33(1): 121−124. doi: 10.3969/j.issn.1008-0805.2022.01.30
[15] 韩明会, 刘彦涛, 朱妙馨, 等. 不同温度下分级水提罗望子多糖的结构与性质[J]. 林业工程学报,2018,3(5):71−77. [HAN M H, LIU Y T, ZHU M X, et al. Structure and solution properties of tamarind polysaccharide extracted at different temperatures[J]. Journal of Forestry Engineering,2018,3(5):71−77.] HAN M H, LIU Y T, ZHU M X, et al. Structure and solution properties of tamarind polysaccharide extracted at different temperatures[J]. Journal of Forestry Engineering, 2018, 3(5): 71−77.
[16] ZHANG S, HE F, CHEN X, et al. Isolation and structural characterization of a pectin from Lycium ruthenicum Murr. and its anti-pancreatic ductal adenocarcinoma cell activity[J]. Carbohydrate Polymers,2019,223:115104. doi: 10.1016/j.carbpol.2019.115104
[17] STAUB A M. Removal of proteins-Sevag method[J]. Methods Carbohydrate Chemistry,1965,5(2):5−6.
[18] BLUM ENKRANTZ N, ASBOE-HANSEN G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry,1973,54(2):484−489. doi: 10.1016/0003-2697(73)90377-1
[19] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350−356. doi: 10.1021/ac60111a017
[20] CHEN H, HUANGY, ZHOU C, et al. Effects of ultra-high pressure treatment on structure and bioactivity of polysaccharides from large leaf yellow tea[J]. Food Chemistry,2022,387:132862. doi: 10.1016/j.foodchem.2022.132862
[21] YUAN Q, ZHAO L, CHA Q, et al. Structural characterization and immunostimulatory activity of a homogeneous polysaccharide from Sinonovacula constricta[J]. Journal of Agricultural and Food Chemistry,2015,63(36):7986−7994. doi: 10.1021/acs.jafc.5b03306
[22] 沈佳琳. 黑果枸杞多糖的提取纯化、抗氧化活性及体外模拟消化和发酵研究[D]. 南京:南京农业大学, 2017. [SHEN J L. Isolation, purification, antioxidant bioactivity, stimulated digestion and fermentation of polysaccharides from Lycium ruthenicum Murr. [D]. Nanjing:Nanjing Agricultural University, 2017.] SHEN J L. Isolation, purification, antioxidant bioactivity, stimulated digestion and fermentation of polysaccharides from Lycium ruthenicum Murr. [D]. Nanjing: Nanjing Agricultural University, 2017.
[23] ZHANG X X, NI Z J, ZHANG F, et al. Physicochemical and antioxidant properties of Lycium barbarum seed dreg polysaccharides prepared by continuous extraction[J]. Food Chemistry:X,2022,14:100282.
[24] SMIRNOFF N, CUMBES Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989,28(4):1057−1060. doi: 10.1016/0031-9422(89)80182-7
[25] 秦丹丹, 曹慧馨, 白洋, 等. 黑木耳黑枸杞复合饮料研制及其体外抗氧化性[J]. 食品研究与开发,2020,41(3):108−116. [QIN D, CAO H X, BAI Y, et al. Study on preparation of Auricularia auricular and Lycium ruthenicum Murr. compound beverage and its antioxidant activity[J]. Food Research and Development,2020,41(3):108−116.] doi: 10.12161/j.issn.1005-6521.2020.03.019 QIN D, CAO H X, BAI Y, et al. Study on preparation of Auricularia auricular and Lycium ruthenicum Murr. compound beverage and its antioxidant activity[J]. Food Research and Development, 2020, 41(3): 108−116. doi: 10.12161/j.issn.1005-6521.2020.03.019
[26] LIANG J, ZHAO Y, YANG F, et al. Preparation and structure-activity relationship of highly active black garlic polysaccharides[J]. International Journal of Biological Macromolecules,2022,220:601−612. doi: 10.1016/j.ijbiomac.2022.08.115
[27] FANG Q, WANG J, ZHA X, et al. Immunomodulatory activity on macrophage of a purified polysaccharide extracted from Laminaria japonica[J]. Carbohydrate Polymers,2015,134:66−73. doi: 10.1016/j.carbpol.2015.07.070
[28] ZHANG D, LI H, ZHANG H, et al. Poria cocos water-soluble polysaccharide modulates anxiety-like behavior induced by sleep deprivation by regulating the gut dysbiosis, metabolic disorders and TNF-alpha/NF-kappa B signaling pathway[J]. Food & Function,2022(12):13.
[29] ZHONG C, LIU Z, ZHANG X, et al. Physicochemical properties of polysaccharides from Ligusticum Chuanxiong and analysis of their anti-tumor potential through immunoregulation[J]. Food & Function,2021,12(4):1719−1731.
[30] WU Y, LIU J, HAO H, et al. A new polysaccharide from Caulerpa chemnitzia induces molecular shifts of immunomodulation on macrophages RAW264.7[J]. Food Chemistry:X,2022,14:100313.
[31] CHEN F, HUANG G, HUANG H. Preparation, analysis, antioxidant activities in vivo of phosphorylated polysaccharide from Momordica charantia[J]. Carbohydrate Polymers,2021,252:117179. doi: 10.1016/j.carbpol.2020.117179
[32] 江贤敏, 王正明, 潘利华, 等. 提取温度对霍山石斛多糖理化性质及肠道黏膜免疫活性的影响[J]. 食品科学,2017,38(7):176−181. [JIANG X M, WANG Z M, PAN L H, et al. Effect of extraction temperature on physicochemical properties and intestinal mucosal immunomodulating activity of polysaccharides from Dendrobium huoshanense[J]. Food Science,2017,38(7):176−181.] doi: 10.7506/spkx1002-6630-201707028 JIANG X M, WANG Z M, PAN L H, et al. Effect of extraction temperature on physicochemical properties and intestinal mucosal immunomodulating activity of polysaccharides from Dendrobium huoshanense[J]. Food Science, 2017, 38(7): 176−181. doi: 10.7506/spkx1002-6630-201707028
[33] 梁姗, 王金凤, 杨诗艺, 等. 龙眼蛋白对C57BL/6小鼠及RAW264.7巨噬细胞的炎症因子的影响研究[J]. 食品安全质量检测学报,2023,14(23):124−131. [LIANG S, WANG J F, YANG S Y, et al. Effects of Dimocarpus longan Lour. protein on inflammatory factors in C57BL/6 mice and RAW264.7 macrophages[J]. Journal of Food Safety and Quality,2023,14(23):124−131.] LIANG S, WANG J F, YANG S Y, et al. Effects of Dimocarpus longan Lour. protein on inflammatory factors in C57BL/6 mice and RAW264.7 macrophages[J]. Journal of Food Safety and Quality, 2023, 14(23): 124−131.
[34] 刘冰. 霍山石斛(栽培)多糖化学结构系统解析及抗胃癌活性构效关系研究[D]. 合肥:合肥工业大学, 2019. [LIU B. Study on chemical structural characteristics and relationship between structure and anti-gastric cancer activity of polysaccharides from cultivated Dendrobium huoshanense[D]. Hefei:Hefei University of Technology, 2019.] LIU B. Study on chemical structural characteristics and relationship between structure and anti-gastric cancer activity of polysaccharides from cultivated Dendrobium huoshanense[D]. Hefei: Hefei University of Technology, 2019.
[35] YANG X, REN Y, ZHANG L, et al. Structural characteristics and antioxidant properties of exopolysaccharides isolated from soybean protein gel induced by lactic acid bacteria[J]. LWT,2021,150:111811. doi: 10.1016/j.lwt.2021.111811





 下载:
下载:

 下载:
下载:
