Grafting of Walnut Shell Hemicellulose B with Ferulic Acid and Its Effect on the Volatile Flavor Compounds of Pickles
-
摘要: 为了改变传统泡菜的风味物质,在泡菜发酵中加入阿魏酸化半纤维素B。以核桃壳为原料提取半纤维素B,利用紫外可见光谱仪检测其中的蛋白质与核酸含量。在无氧环境下对半纤维素B接枝阿魏酸,利用紫外可见光谱仪与傅里叶变换红外光谱对接枝化进行验证。以未添加的泡菜样品作为对照,分别将半纤维素B和阿魏酸接枝化半纤维素B加入到泡菜中,发酵所产生的香气物质利用气质联用色谱进行检测。结果表明,半纤维素B中的蛋白质与核酸基本被去除。经过紫外可见与傅里叶红外变换鉴定后,接枝反应成功获得阿魏酸半纤维素B。半纤维素B使得泡菜在发酵过程中的香气物质发生了较多的衍生化,而阿魏酸半纤维素B使得泡菜在发酵过程中产生了含硫类和酯类等独有的香气成分。该研究为泡菜风味物质的改善提供了一定的研究基础。Abstract: Ferulic acid hemicellulose B (FCB) was introduced into the pickle fermentation process to alter the flavor compounds of traditional pickles. Hemicellulose B was extracted from walnut shell raw materials and analyzed for protein and nucleic acid content using ultraviolet-visible (UV-Vis) spectroscopy. The grafting of ferulic acid on hemicellulose B in an anaerobic environment and verification of grafting using UV-Vis spectroscopy and Fourier transform infrared (FT-IR) spectroscopy. Hemicellulose B and ferulic-acid-grafted hemicellulose B were added to pickles, with unaltered pickles serving as the control, and the aroma compounds generated during fermentation were analyzed using gas chromatography-mass spectrometry (GC-MS). The results showed that the protein and nucleic acid in hemicellulose B were basically removed. UV-Vis and FT-IR spectroscopies confirmed that the grafting reaction produced FCB. Hemicellulose B led to an increase in the derivatization of aroma compounds in pickles during fermentation, whereas the FCB sample generated distinctive aroma components such as sulfur and esters. This study provides a foundation for improving the flavor substances of pickles.
-
Keywords:
- ferulic acid /
- walnut shell hemicellulose B /
- pickles /
- flavor
-
核桃产量高,核桃壳作为副产品,在加工过程中被大量废弃。核桃壳中富含半纤维素。通过特定的沉淀方法,半纤维素可被区分为半纤维素A和B。具体而言,通过酸沉淀法获得的部分称为半纤维素A,而剩余溶液通过醇沉淀法得到半纤维素B[1]。半纤维素B及其衍生物在医药领域具有广泛的应用价值[2]。半纤维素还具有提高乳酸菌活性、增加其产酸量[3]以及改善发酵品质的潜力[4]。因此,从核桃壳中提取半纤维素B具有很大的应用前景。
阿魏酸又称4-羟基-3-氧基肉桂酸,存在于植物细胞壁中[5],具有抗病毒、辐射、细胞凋亡和癌症等多种功能[6]。此外,阿魏酸还具有很好的抗氧化作用。在体内,阿魏酸的抗氧化能力较强,能有效猝灭自由基,调节多种酶的生物活性[7]。在食品方面,阿魏酸能够抑制脂肪酸的氧化,可作为天然食品防腐剂[8]。将阿魏酸添加到香肠中可有效降低亚硝酸盐残留量,并能与亚硝酸盐产生协同作用,达到较好的抑菌防腐目的[9]。阿魏酸还可用于果蔬的保鲜与贮藏,其可以降低损伤番茄的青霉菌发病率和病斑直径,并降低果实可溶性固形物含量,同时提高抗坏血酸和番茄红素的含量,是一种有效的果蔬保鲜贮藏方法[10]。因此,阿魏酸在食品行业中具有很广阔的应用,在美国、欧洲和日本已经被批准作为添加剂应用于食品、医药和化妆品等领域,而在国内的应用和研究则相对较少。
阿魏酸在细胞壁中很少以游离形式存在[11],经常以侧链形式与半纤维素共价结合[12−13]。并且,阿魏酸修饰的半纤维素具有更好的生物活性[14],但天然的植物细胞壁中的阿魏酸半纤维素B(FCB)含量较少。所以,目前研究人员开始将阿魏酸接枝到多糖上。例如,王紫薇等[15]成功将阿魏酸接枝到可德兰多糖上;黄对对等[16]将阿魏酸接枝到普鲁兰多糖上,并显著提高了多糖的抗氧化活性;Liu等[17]将阿魏酸接枝到壳聚糖上同样提高了多糖的抗氧化性活性。因此,阿魏酸接枝处理能够改变多糖的抗氧化活性。目前并未发现阿魏酸接枝化核桃壳半纤维素B的研究,本研究以废弃的核桃果壳为原料提取半纤维素B,在无氧条件下利用阿魏酸接枝获得FCB聚合物,并首次将其应用于泡菜发酵。该研究以期解决蔬菜内部FCB含量少以及微生物不方便利用的弊端;在降低发酵过程中氧化程度的同时,还对其改良挥发性风味物质的作用进行了探索。
1. 材料与方法
1.1 材料与仪器
植物乳杆菌 川秀乳酸泡菌泡菜发酵粉(麦芽糊精、植物乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌),北京川秀国际贸易有限公司;核桃果壳 取自市售核桃;维生素C、阿魏酸 上海源叶生物科技有限公司;正辛醇 上海麦克林生化科技股份有限公司;白萝卜、胡萝卜、辣椒、花椒、大蒜、八角、香叶、红糖 购自本地超市;食用盐 中盐西南盐业有限公司。
TU-1901紫外可见分光光度计 上海元析仪器有限公司;Nicolet 670傅里叶变换红外光谱仪 美国尼高力公司;7890B+5977A气质联用色谱 安捷伦科技有限公司。
1.2 实验方法
1.2.1 核桃壳半纤维素B的提取
将核桃果壳经过烘干后进行粉碎,过50目筛。细粉经过1%氢氧化钠溶液沸水浴浸提1 h后过滤去除滤液;滤渣再采用0.8%的草酸铵沸水浴浸提1 h,过滤去除滤液,滤渣即为膳食纤维。所得膳食纤维利用4%的氢氧化钠溶液于45 ℃水浴中搅拌提取半纤维素8~12 h;过滤后所得滤液使用冰醋酸调节pH至5,4500 r/min离心3~5 min后去除沉淀;所得上清液加入三倍体积98%的乙醇,置于4 ℃冰箱中过夜沉淀后获得半纤维素B,去除上清液后的底部浑浊沉淀再4500 r/min离心3~5 min,离心所得沉淀再经冷冻干燥后备用[18]。
1.2.2 蛋白与核酸分析
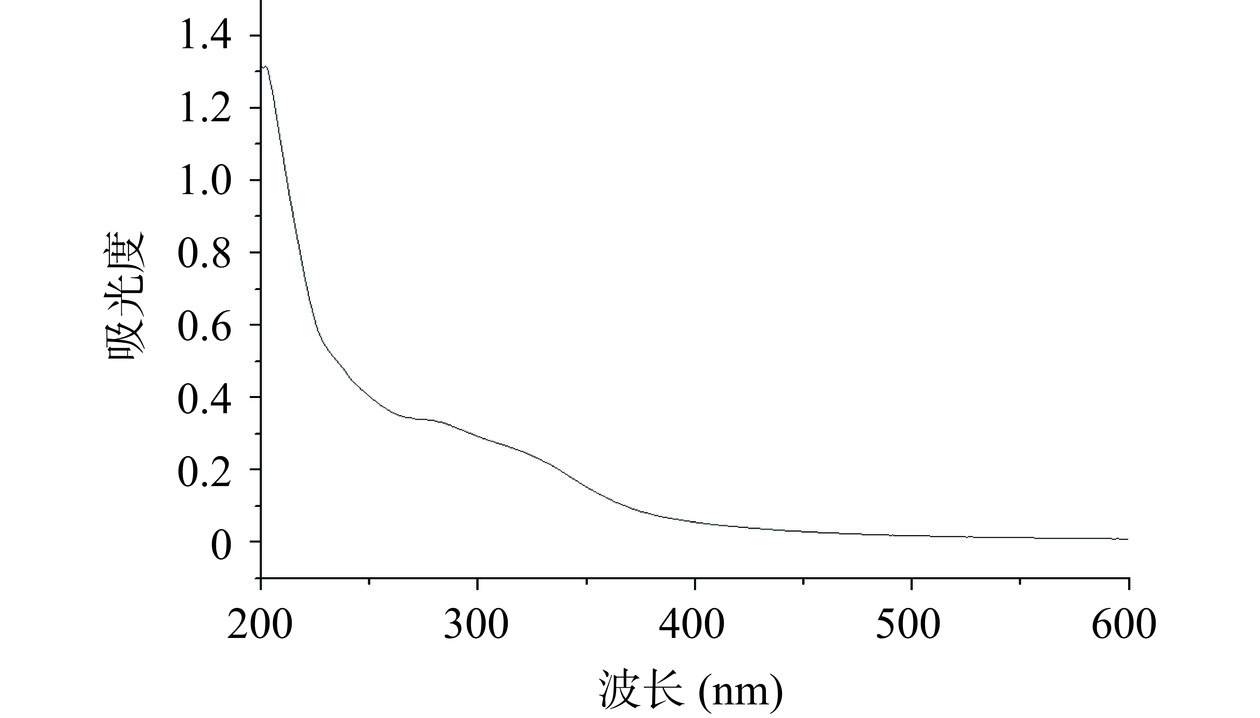
以蒸馏水作为空白扫基线,配制1~2 mg/mL的半纤维素B加入蒸馏水后进行溶解;离心去除沉淀,上清液采用TU-1901型光谱仪进行200~600 nm波长扫描[19]。
1.2.3 阿魏酸接枝化半纤维素B
A液:125 mg半纤维素B溶于15 mL蒸馏水;B液:5 mL蒸馏水中加入0.51 mL 30%的H2O2,搅拌过程中加入50 mg抗坏血酸,反应10 min;C液:200 mg阿魏酸加入到5 mL蒸馏水中。将B液逐滴加入到A液中,在氮气保护条件下反应30 min,之后加入C液无氧反应24 h。反应完后5000 r/min离心5 min,上清液采用3500 D透析袋透析24 h,之后再冷冻干燥待用[15]。
1.2.4 FCB表征
在上述半纤维素B紫外可见分析的基础上,再利用TU-1901光谱仪对阿魏酸和FCB进行分析。同时,将阿魏酸、半纤维素B、FCB分别与KBr混合并研磨,采用FT-IR进行分析,以1 cm−1的分辨率测定4000~500 cm−1的透光率[20]。
1.2.5 泡菜发酵
清洗500 g白萝卜与50 g胡萝卜,切条后采用6%的盐水出胚处理1.5 h,沥干水后完全浸没到6%~8%的盐水中,再加入20 g辣椒、15 g花椒、10 g大蒜、3 g八角、2 g香叶与1 g红糖;按照1 kg蔬菜接种1 g菌种发酵粉,将FCB和半纤维素B分别加入到不同的发酵样中,浓度均为0.1 mg/mL,以不添加作为对照;泡菜玻璃瓶置于室温条件下暗发酵7 d,后期注意放气。
1.2.6 挥发性风味物质分析
微萃取探针为55 μm SPME-C-02 PA;将5 g样品置于20 mL顶空进样瓶中,加入NaCl 1 g,20 μL正辛醇(5 μg/mL)作为内标,插入萃取头50 ℃萃取30 min,250 ℃解吸5 min进样。GC条件:DB-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度为250 ℃。升温程序:起始柱温40 ℃保持3 min,以3 ℃/min升至140 ℃,保持1 min,然后20 ℃/min升至260 ℃,气体流量为1.5 mL/min,不分流进样。MS条件:EI电离源,电子能量70 eV,电子倍增器电压1153 V,离子源温度230 ℃,接口温度280 ℃,质量扫描范围35~350 u[21]。通过样品与标准物质的质谱进行比较,对样品进行定性鉴定。挥发性风味物质计算公式如下所示:
(1) 式中:C0为内标正辛醇的浓度,C1为待测物质的浓度,A0为内标正辛醇的峰面积,A1为待测物质的峰面积。
1.3 数据处理
GC-MS数据以平均值±标准差(SD)表示,实验重复3次。结果采用方差分析,P<0.05时差异被认为是显著的。
2. 结果与分析
2.1 蛋白与核酸检测
阿魏酸与蛋白、核酸同样具有苯环结构,因此,接枝化的测定会受到蛋白与核酸的影响。核酸与蛋白分别在260和280 nm处有最大吸收峰[22],因此,通过在此范围内进行扫描可以判断蛋白与核酸是否被去除。本研究采用UV-Vis对纯化后的半纤维素B在200~600 nm范围内进行波长扫描,结果如图1所示,在260、280 nm处没有明显的吸收峰,由此可见,半纤维素B中蛋白与核酸已经被去除干净。所得半纤维素B即可以用于接枝化处理。
2.2 接枝化反应过程
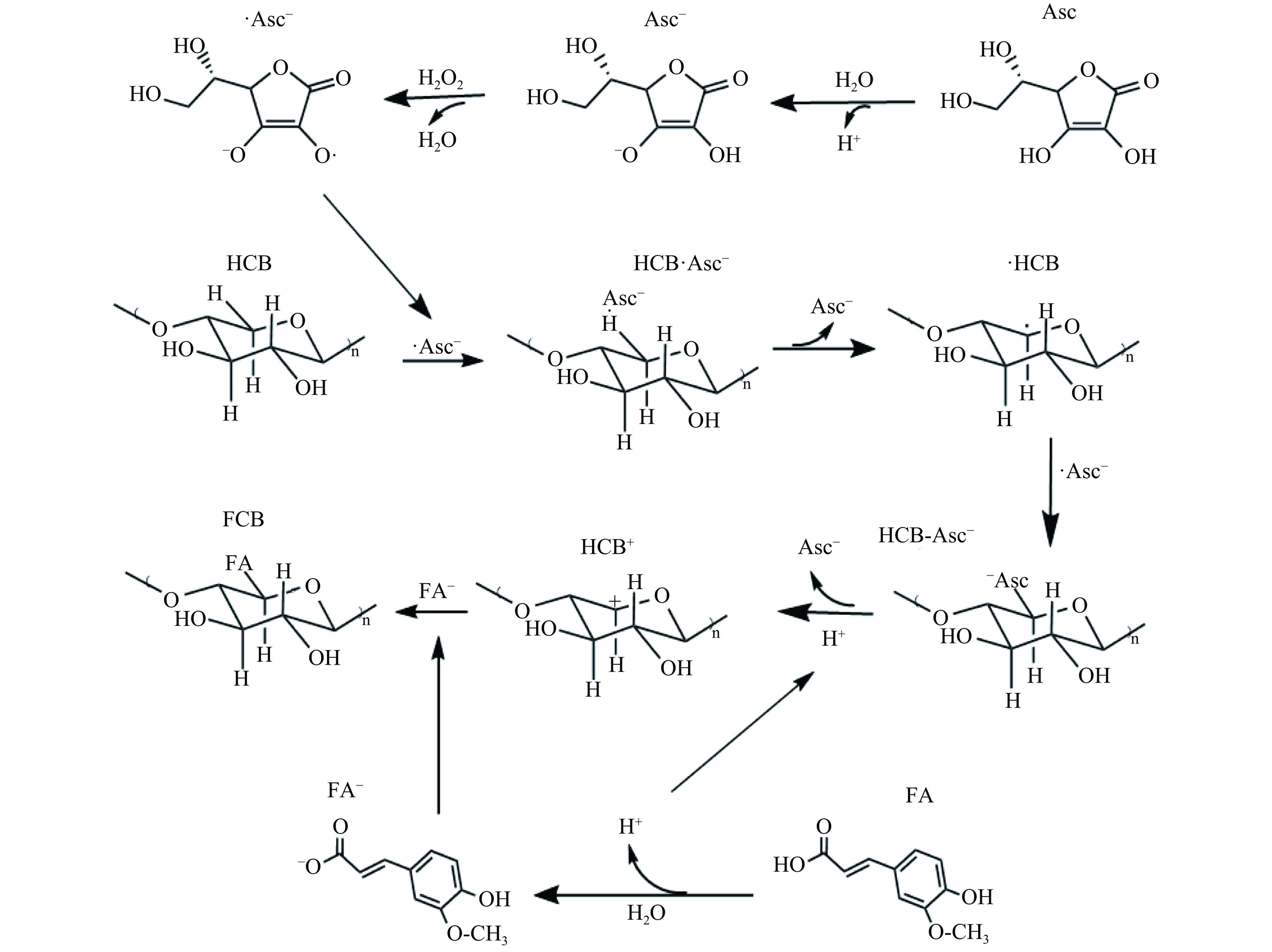
在多糖接枝化的方法中,由于Asc/H2O2氧化还原方法具有成本低、环保的优点而被广泛应用[16−17]。本研究在无氧条件下,利用该方法将阿魏酸接枝到核桃壳半纤维素B上,其机理如图2所示。首先,抗坏血酸中C3位羟基电离出H+(pK1=4.0),形成抗坏血酸阴离子Asc−;C2位上的羟基氢不容易解离(pK2=11.6),因此,抗坏血酸二价阴离子含量相对较低。抗坏血酸C2的羟基具有很强的还原性,在Asc−和H2O2相互作用的过程中,Asc− C2位的羟基氢被氧化生成水,Asc−转化为一价离子自由基·Asc−。木糖的C-H之间的作用力小于O-H之间的力,并且Asc−的还原性大于木糖羟基的还原性;因此,·Asc−不容易从木糖羟基中获得氢形成Asc−。而·Asc−的单电子自由基容易与木糖C-H结构上的氢电子形成氢键,即形成C-H-O连接,类似于氢键,H中的单电子在与C和O共用时并不稳定。与碳原子相比,氧原子获得电子的能力更强,·Asc−更有可能获得氢(H·)形成Asc−;同时,木糖形成以碳原子为中心的自由基[22]。木糖上碳单电子自由基与·Asc−自由基配对形成木糖与Asc−连接的醚。阿魏酸溶于水后会解离成H+和阿魏酸阴离子FA−。羧酸的酸度大于羟基的酸度,阿魏酸中解离出的H+导致木糖抗坏血酸离子醚的酸解。同样由于氧获得电子的能力比碳原子更强,抗坏血酸C2上的氧抢夺了木糖碳原子的电子,并与H+配位形成Asc−;同时,木糖形成木糖阳离子,其与离子化的阿魏酸阴离子通过静电结合而形成阿魏酸和木糖残基的酯。
2.3 接枝化鉴定
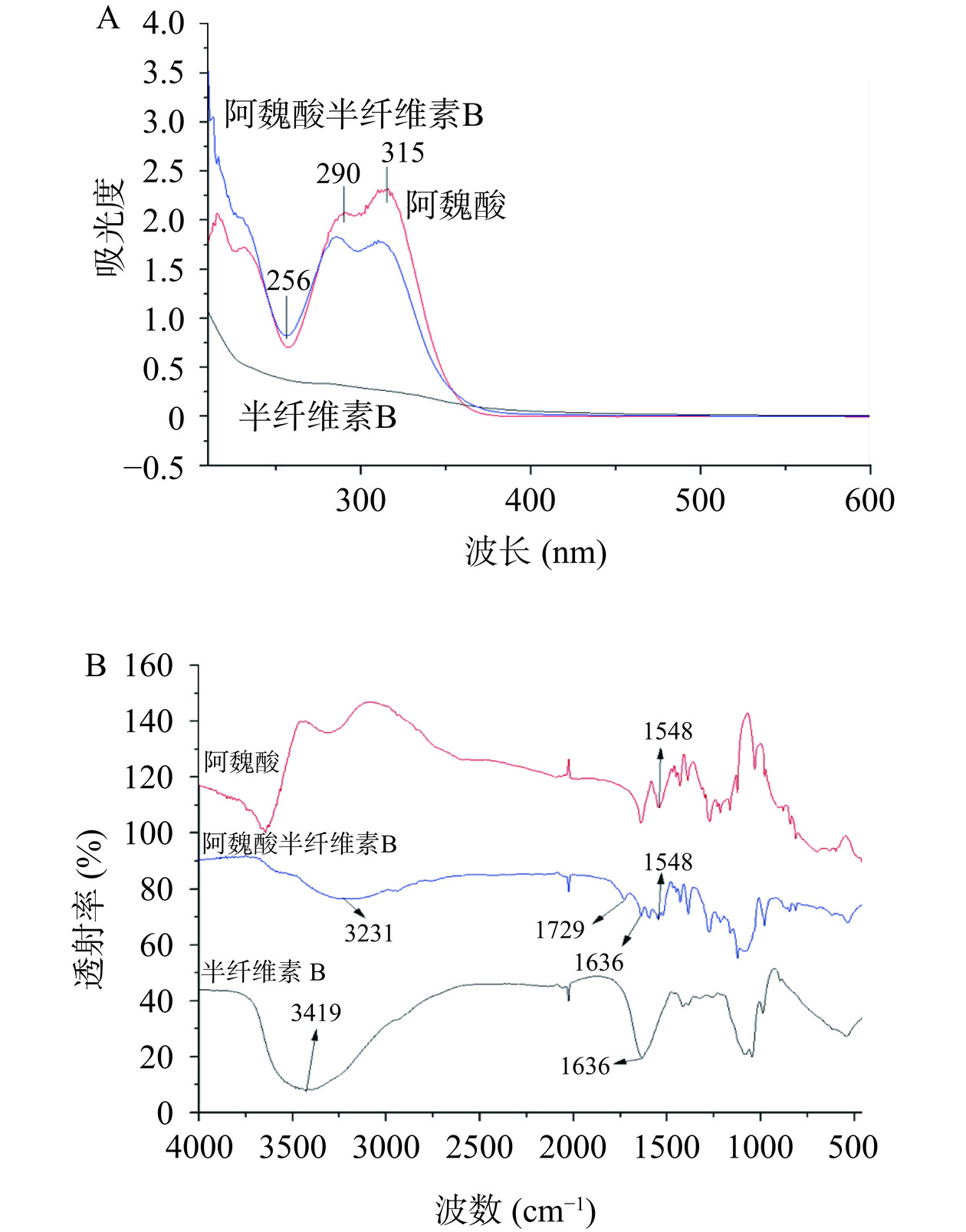
为分析半纤维素B的接枝化效果,首先采用UV-Vis对FCB进行表征,结果如图3A所示。多糖在200~600 nm范围内相对平滑,没有明显的特征峰。阿魏酸在290和315 nm处有两个明显的特征峰,在256 nm处有吸收波谷。FCB的吸收曲线明显受到阿魏酸接枝化的影响,FCB在290与315 nm处出现类似阿魏酸的峰。上述分析表明,半纤维素B与阿魏酸形成了接枝化共聚物。由于FT-IR具有灵敏度高、波数准确、重复性好的优点,被广泛用于分子组成和结构的分析。本研究采用FT-IR进一步对阿魏酸与半纤维素B的接枝化进行分析,结果如图3B所示。半纤维素B在3419 cm−1处的吸收峰为-OH的伸缩振动[23];部分多糖的C-H结构中的氢被阿魏酸取代,致使羟基的特征峰(3231 cm−1)发生蓝移。阿魏酸和FCB在1548 cm−1处具有相同的特征峰,均属于芳环C=C的振动[24],其并未出现在半纤维素B的样品中;这进一步证明阿魏酸与半纤维素B形成了FCB共聚物。特征峰1636 cm−1为多糖羟基的弯曲振动[25]。结合图2表明,FCB中1729 cm−1处所产生的新吸收带是酯的特征峰[24]。FT-IR分析表明,FA和半纤维素B形成了共聚物。
2.4 风味物质分析
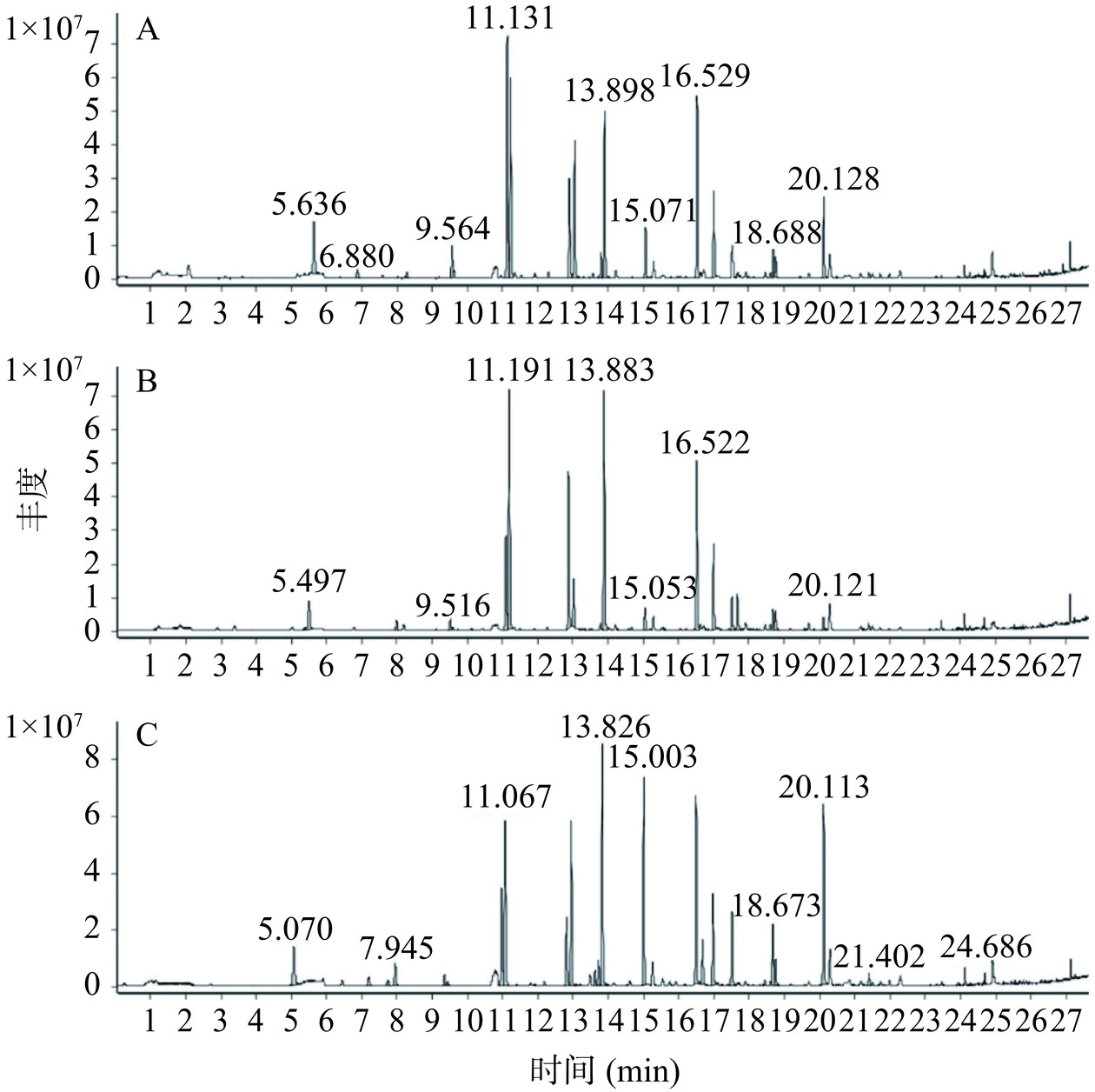
GC-MS可以检测化合物的分子量,并能根据质谱推测出分子的结构信息;因此,其常用于香气物质的检测[26]。本研究利用GC-MS检测泡菜发酵中的香气成分,并根据检测结果分析FCB对泡菜挥发性风味物质的影响。由GC图(图4)可以看出,三个发酵样品中的香气物质基本相同。根据已知物统计可知,出现了10种硫化物、17种烯类、5种醇类、3种醚类、2种酯类、1种醛类,以及其他化合物3种。相较于对照组,添加半纤维素B和FCB的实验组出现了特有成分(表1)。三个实验组中均检测出β-杨梅烯等8种物质(表1中7、11、12、16~19、26号);其中添加半纤维素B发酵样的香气浓度均低于其他两组,这是由于木聚糖被优先利用而延缓植物乳杆菌对蔬菜的发酵[27]。相较于对照组和添加半纤维素B的发酵样品,除了β-杨梅烯,添加FCB的泡菜样品中其他成分均有所提高,这表明FCB促进了泡菜的厌氧发酵挥发性风味物质的产生。
表 1 风味物质组成分析Table 1. Analysis of flavor substance composition序号 化合物 对照组 半纤维素B 阿魏酸半纤维素B 浓度
(μg/L)保留时间
(min)浓度
(μg/L)保留时间
(min)浓度
(μg/L)保留时间
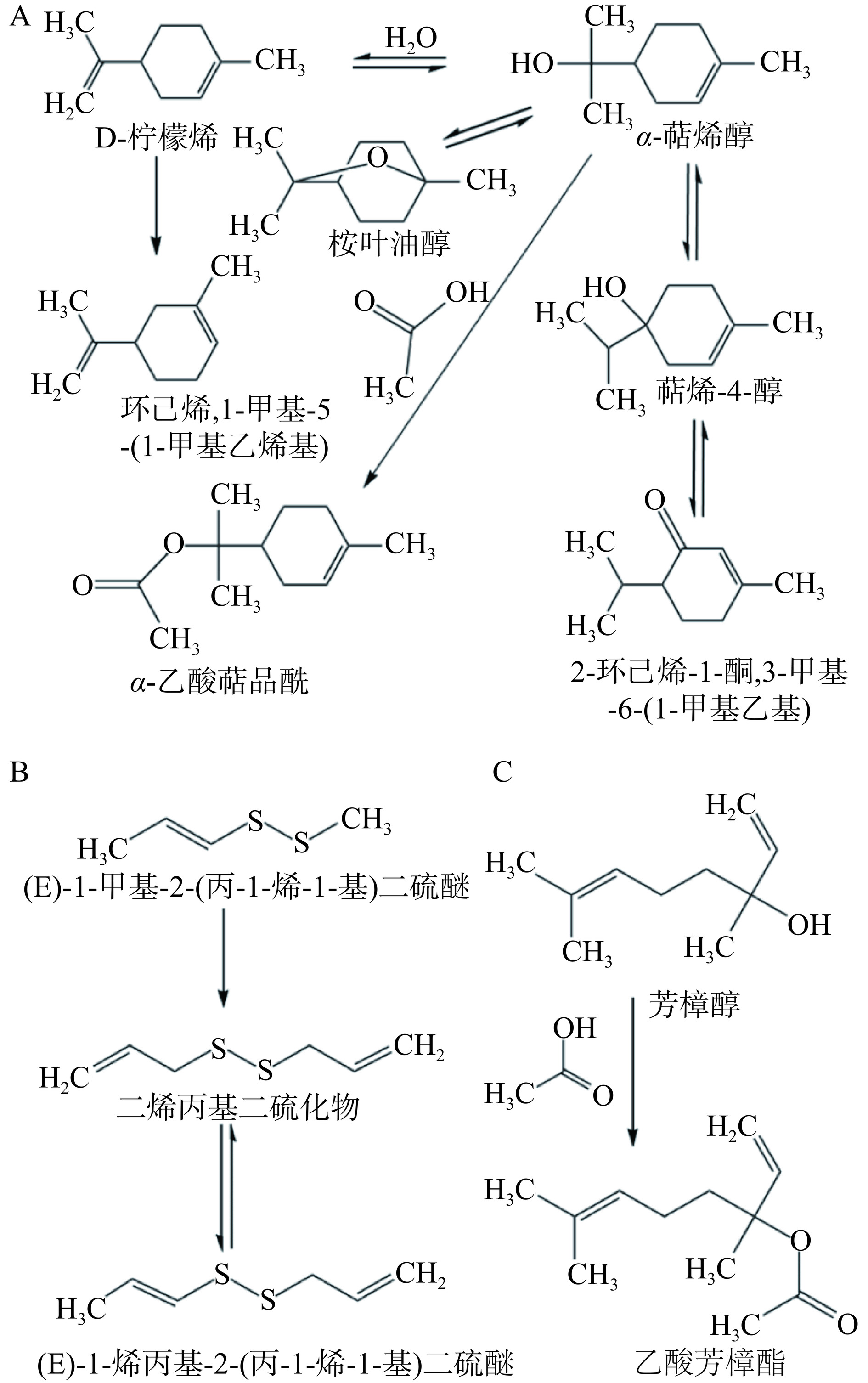
(min)1 甲基2-丙烯基二硫化物 15.68±0.97b 5.636 − − 18.95±2.02a 5.07 2 * − − 6.01±1.07 5.497 − − 3 (E)-1-甲基-2-(丙-1-烯-1-基)二硫醚 2.27±0.27 6.880 − − − − 4 3H-1,2-二硫杂环戊烯 − − − − 3.51±0.27 7.199 5 安息香醛 − − 1.74±0.22b 7.983 2.25±0.17a 7.742 6 二甲基三硫醚 1.65±0.33b 8.271 − − 8.45±0.74a 7.945 7 β-杨梅烯 7.18±0.85a 9.564 1.61±0.17c 9.516 3.77±0.52b 9.347 8 * − − − − 1.53±0.19 9.433 9 环己烯,1-甲基-5-(1-甲基乙烯基) − − − − 31.67±2.20 10.966 10 D-柠檬烯 54.91±1.72a 11.131 14.52±2.60b 11.090 − − 11 桉叶油醇 46.40±2.01b 11.229 35.14±2.01c 11.191 54.70±2.61a 11.067 12 二烯丙基二硫化物 27.21±1.63b 13.047 6.06±0.40c 13.021 48.18±1.89a 12.945 13 3-甲基-3H-1,2-二硫杂环戊烯 − − − − 4.31±1.25 13.616 14 (E)-1-烯丙基-2-(丙-1-烯-1-基)二硫醚 5.16±0.18b 13.800 − − 7.03±0.25a 13.718 15 3-乙烯基-1,2-二硫杂环己基-4-烯 − − − − 13.05±1.91 16.675 16 芳樟醇 33.14±2.66b 13.898 31.54±2.10c 13.883 67.59±2.58a 13.826 17 甲基2-丙烯基三硫化物 10.19±1.03b 15.071 3.05±0.36c 15.053 54.55±2.48a 15.003 18 萜烯-4-醇 35.80±1.19b 16.529 21.98±1.45c 16.522 51.73±3.31a 16.492 19 α-萜烯醇 17.34±1.43b 17.002 11.09±0.81c 16.994 26.44±2.30a 16.968 20 2-乙烯基-4H-1,3-二噻吩 − − − − 23.24±2.29 17.511 21 * − − 4.37±0.31 17.515 − − 22 乙酸芳樟酯 − − − − 16.28±1.08 18.673 23 β-杨梅烯 5.48±0.70 18.688 − − − − 24 2,3-二氢苯并呋喃 − − 5.04±0.57 17.673 − − 25 1,6-辛二烯-3-醇,3,7-二甲基-甲酸酯 − − 2.71±0.47 18.685 − − 26 2-环己烯-1-酮,3-甲基-6-(1-甲基乙基) 4.01±0.43b 18.76 2.81±0.18b 18.760 8.07±1.03a 18.741 27 二-2-丙烯基三硫化物 15.68±1.23b 20.128 − − 46.45±2.89a 20.113 28 * − − 1.76±0.40 20.121 − − 29 α-乙酸萜品酰 − − − − 0.82±0.12 21.402 注:*未知香气成分;−未检出;同行不同小写字母代表处理组间有显著性差异(P<0.05)。 对照组中出现了(E)-1-甲基-2-(丙-1-烯-1-基)二硫醚,而在其他两个实验组中并未出现;这可能是由于该物质在半纤维素B的诱导下,被利用而衍生成其他物质[28]。D-柠檬烯存在于未对照组和添加半纤维素B的样品中,而在FCB样品中并未出现;因此,支链阿魏酸结构可能诱使D-柠檬烯衍生成其他物质。其可能的衍生路径如图5A所示,首先,D-柠檬烯发生甲基转移,生成环己烯,1-甲基-5-(1-甲基乙烯基);D-柠檬烯还可能水加成生成α-萜烯醇,α-萜烯醇再与乙酸酯化反应生成α-乙酸萜品酰。其中,α-萜烯醇内部羟基和烯双键自我加成后生成桉叶油醇。α-萜烯醇还可能发生羟基转移生成萜烯-4-醇,萜烯-4-醇内部脱氢后生成2-环己烯-1-酮,3-甲基-6-(1-甲基乙基)。(E)-1-烯丙基-2-(丙-1-烯-1-基)二硫醚只出现在未添加的发酵样品中,二甲基三硫醚出现在未添加和FCB实验组中。其可能同样存在衍化作用,(E)-1-甲基-2-(丙-1-烯-1-基)二硫醚的一端烯烃双键转移,并且另一端连接了乙烯基形成二烯丙基二硫化物,而二烯丙基二硫化物一端发生烯烃双键转移后形成(E)-1-烯丙基-2-(丙-1-烯-1-基)二硫醚(图5B)。由于多糖的存在使得后两种样品中均出现了安息香醛,安息香醛使得泡菜带有杏仁味[29]。化合物2-乙烯基-4H-1,3-二噻吩仅存在FCB实验组中,其为抗血栓物质[30],使得泡菜具有蒜香味[31]。2,3-二氢苯并呋喃与1,6-辛二烯-3-醇,3,7-二甲基-甲酸酯仅存在于半纤维素B样品中,因此,半纤维素B可能为这两种香气成分提供了前体物质或具有诱导作用,而FCB发酵样品中则未出现这两种物质,这进一步表明阿魏酸改变了半纤维素B在发酵中的作用。
在FCB的样品中出现了独有的7种物质。其中3H-1,2-二硫杂环戊烯、3-甲基-3H-1,2-二硫杂环戊烯、3-乙烯基-1,2-二硫杂环己基-4-烯均为含硫化合物,可能都来自大蒜发酵,使得泡菜具有大蒜香气。其中,3-甲基-3H-1,2-二硫杂环戊烯为3H-1,2-二硫杂环戊烯的甲基化衍生物。乙酸芳樟酯只出现在了FCB的实验组中,其为芳樟醇的乙酸酯,使得泡菜具有愉快的花香和果香(图5C)。综上,FCB在泡菜发酵过程中诱导了多种挥发性香气物质的产生,增加了水果与大蒜的香气成分。
在GC-MS中出现未知香气成分(表1),因此,在发酵过程中除了挥发性香味物质种类和浓度产生差异,在香气物质异构和衍生上也发生了变化。在添加半纤维素B的样品中,有两种物质没有被解析(图6B、D)。根据特征峰峰值与保留时间可以推测其分别对应对照组样品中的甲基-2-丙烯基二硫化物和二-2-丙烯基三硫化物(图6A、C);分子碎片存在一定的差异,则表明其对应分子在分子量和结构上存在一定的差异。此外,添加半纤维素B实验组中还出现了质谱未能预测的物质(图6I,21号),从质谱碎片上推测其可能为2-乙烯基-4H-1,3-二噻吩(图6J)的衍生物。对照组中出现了两种β-杨梅烯(表1),由于两者特征峰值基本一致(图6E、F);质谱数据库推测两种物质均为β-杨梅烯;但两者保留时间差别较大,说明两种分子可能为异构体[32−33]。FCB样品中的7号化合物(图6G)与对照组的β-杨梅烯(图6E)在保留时间和质谱图上基本一致;说明两者为同一类型的β-杨梅烯。而FCB样品中的8号化合物(图6H),在分子碎片上与未添加实验组和半纤维素B添加组中的7号化合物出现了类似的特征峰,且保留时间相近;因此,推测其为β-杨梅烯的衍生物[34]。未知香气成分分析表明,半纤维素B与FCB的添加促使发酵衍生出了其他的香气成分。
3. 结论
本研究以核桃果壳为底物提取半纤维素B;利用UV-Vis对提取物进行全波长扫描以确保无蛋白质与核酸的干扰,经过UV-Vis扫描,半纤维素B提取物中的蛋白质与核酸被基本去除。在无氧环境下对半纤维素B接枝阿魏酸,利用UV-Vis与FT-IR对接枝化进行验证;结果表明,获得了FCB聚合物。以不添加实验组为对照,分别将半纤维素B和FCB加入到泡菜中进行发酵,利用GC-MS对香气物质进行检测;结果表明,半纤维素B使得泡菜在发酵过程中的挥发性香气物质发生了衍生化;而FCB使得泡菜在发酵过程中产生更多的独有的挥发性香气成分。该研究表明FCB能够改善泡菜发酵的风味物质的种类与含量。综上,本研究为核桃壳多糖改善泡菜风味物质提供了一定的实验基础。
-
表 1 风味物质组成分析
Table 1 Analysis of flavor substance composition
序号 化合物 对照组 半纤维素B 阿魏酸半纤维素B 浓度
(μg/L)保留时间
(min)浓度
(μg/L)保留时间
(min)浓度
(μg/L)保留时间
(min)1 甲基2-丙烯基二硫化物 15.68±0.97b 5.636 − − 18.95±2.02a 5.07 2 * − − 6.01±1.07 5.497 − − 3 (E)-1-甲基-2-(丙-1-烯-1-基)二硫醚 2.27±0.27 6.880 − − − − 4 3H-1,2-二硫杂环戊烯 − − − − 3.51±0.27 7.199 5 安息香醛 − − 1.74±0.22b 7.983 2.25±0.17a 7.742 6 二甲基三硫醚 1.65±0.33b 8.271 − − 8.45±0.74a 7.945 7 β-杨梅烯 7.18±0.85a 9.564 1.61±0.17c 9.516 3.77±0.52b 9.347 8 * − − − − 1.53±0.19 9.433 9 环己烯,1-甲基-5-(1-甲基乙烯基) − − − − 31.67±2.20 10.966 10 D-柠檬烯 54.91±1.72a 11.131 14.52±2.60b 11.090 − − 11 桉叶油醇 46.40±2.01b 11.229 35.14±2.01c 11.191 54.70±2.61a 11.067 12 二烯丙基二硫化物 27.21±1.63b 13.047 6.06±0.40c 13.021 48.18±1.89a 12.945 13 3-甲基-3H-1,2-二硫杂环戊烯 − − − − 4.31±1.25 13.616 14 (E)-1-烯丙基-2-(丙-1-烯-1-基)二硫醚 5.16±0.18b 13.800 − − 7.03±0.25a 13.718 15 3-乙烯基-1,2-二硫杂环己基-4-烯 − − − − 13.05±1.91 16.675 16 芳樟醇 33.14±2.66b 13.898 31.54±2.10c 13.883 67.59±2.58a 13.826 17 甲基2-丙烯基三硫化物 10.19±1.03b 15.071 3.05±0.36c 15.053 54.55±2.48a 15.003 18 萜烯-4-醇 35.80±1.19b 16.529 21.98±1.45c 16.522 51.73±3.31a 16.492 19 α-萜烯醇 17.34±1.43b 17.002 11.09±0.81c 16.994 26.44±2.30a 16.968 20 2-乙烯基-4H-1,3-二噻吩 − − − − 23.24±2.29 17.511 21 * − − 4.37±0.31 17.515 − − 22 乙酸芳樟酯 − − − − 16.28±1.08 18.673 23 β-杨梅烯 5.48±0.70 18.688 − − − − 24 2,3-二氢苯并呋喃 − − 5.04±0.57 17.673 − − 25 1,6-辛二烯-3-醇,3,7-二甲基-甲酸酯 − − 2.71±0.47 18.685 − − 26 2-环己烯-1-酮,3-甲基-6-(1-甲基乙基) 4.01±0.43b 18.76 2.81±0.18b 18.760 8.07±1.03a 18.741 27 二-2-丙烯基三硫化物 15.68±1.23b 20.128 − − 46.45±2.89a 20.113 28 * − − 1.76±0.40 20.121 − − 29 α-乙酸萜品酰 − − − − 0.82±0.12 21.402 注:*未知香气成分;−未检出;同行不同小写字母代表处理组间有显著性差异(P<0.05)。 -
[1] TIKHOMIROVA E A, SOROKINA A A, BUBENCHIKOVA V N, et al. Chemical composition and content of polysaccharides from the yellow iris (Iris pseudacorus L.) rhizomes[J]. Pharmacognosy Journal,2020,12(5):1012−1018. doi: 10.5530/pj.2020.12.143
[2] LIU X, LIN Q, YAN Y, et al. Hemicellulose from plant biomass in medical and pharmaceutical application:A critical review[J]. Current Medicinal Chemistry,2019,26(14):2430−2455. doi: 10.2174/0929867324666170705113657
[3] 伍悦, 张根义, 彭善丽. 阿拉伯木聚糖和海藻酸钠复合包埋益生菌研究[J]. 食品与生物技术学报,2018,37(8):868−874. [WU Yue, ZHANG Genyi, PENG Shanli. Survival of arabinoxylans-alginate microencapsulated probiotics[J]. Journal of Food Science and Biotechnology,2018,37(8):868−874.] doi: 10.3969/j.issn.1673-1689.2018.08.013 WU Yue, ZHANG Genyi, PENG Shanli. Survival of arabinoxylans-alginate microencapsulated probiotics[J]. Journal of Food Science and Biotechnology, 2018, 37(8): 868−874. doi: 10.3969/j.issn.1673-1689.2018.08.013
[4] HAOKOK C, LUNPROM S, REUNGSANG A, et al. Efficient production of lactic acid from cellulose and xylan in sugarcane bagasse by newly isolated Lactiplantibacillus plantarum and Levilactobacillus brevis through simultaneous saccharification and co-fermentation process[J]. Heliyon,2023,9:e17935. doi: 10.1016/j.heliyon.2023.e17935
[5] WANG Y L, WANG W K, WU Q C, et al. The release and catabolism of ferulic acid in plant cell wall by rumen microbes:A review[J]. Animal Nutrition,2022,9:335−344. doi: 10.1016/j.aninu.2022.02.003
[6] 洪倩. 阿魏酸抗辐射活性剂其作用机制研究[D]. 北京:中国人民解放军军事医学科学院, 2012. [HONG Q. Antiradiation activity and mechanism of action of ferulic acid[D]. Beijing:Chinese Academy of Military Medical Sciences of the People's Liberation Army, 2012.] HONG Q. Antiradiation activity and mechanism of action of ferulic acid[D]. Beijing: Chinese Academy of Military Medical Sciences of the People's Liberation Army, 2012.
[7] SRINIVASAN M, SUDHEER A R, MENON V P. Ferulic acid:therapeutic potential through its antioxidant property[J]. Journal of Clinical Biochemistry & Nutrition,2007,40(2):92−100.
[8] KOSE T, SHARP P A, LATUNDE-DADA G O. Upregulation of Nrf2 signalling and the inhibition of erastin-induced ferroptosis by ferulic acid in MIN6 cells[J]. International Journal of Molecular Sciences,2022,23(24):15886. doi: 10.3390/ijms232415886
[9] 姜瑞平, 李颖, 李博琦, 等. 阿魏酸在蒸煮香肠中对亚硝酸盐残留量的影响[J]. 通化师范学院学报,2013,34:56−57. [JIANG Ruiping, LI Ying, LI Boqi, et al. Effect of ferulic acid on nitrite residue in steamed sausages[J]. Journal of Tonghua Normal University,2013,34:56−57.] doi: 10.3969/j.issn.1008-7974.2013.03.014 JIANG Ruiping, LI Ying, LI Boqi, et al. Effect of ferulic acid on nitrite residue in steamed sausages[J]. Journal of Tonghua Normal University, 2013, 34: 56−57. doi: 10.3969/j.issn.1008-7974.2013.03.014
[10] HU B, PAN J, CHEN L, et al. Effect of ferulic acid treatment on postharvest quality and blue mold in tomato fruit[J]. Storage and Process,2019,19(1):14−24.
[11] OU S, KWOK K C. Ferulic acid:Pharmaceutical functions, preparation and applications in foods[J]. Journal of the Science of Food and Agriculture,2004,84(11):1261−1269. doi: 10.1002/jsfa.1873
[12] SAULNIER L, THIBAULT J F. Ferulic acid and diferulic acids as components of sugar-beet pectins and maize bran heteroxylans[J]. Journal of the Science of Food and Agriculture,1999,79(3):396−402. doi: 10.1002/(SICI)1097-0010(19990301)79:3<396::AID-JSFA262>3.0.CO;2-B
[13] CHEN C, ZHAO X, WANG X, et al. Mutagenesis of UDP-xylose epimerase and xylan arabinosyl-transferase decreases arabinose content and improves saccharification of rice straw[J]. Plant Biotechnology Journal,2021,19(5):863−865. doi: 10.1111/pbi.13552
[14] 宋春艳, 李彦林, 张蔚, 等. 源于啤酒糟的阿魏酰低聚糖组成及其抗氧化活性分析[J]. 食品工业科技,2019,40(9):1−5,12. [SONG Chunyan, LI Yanlin, ZHANG Wei, et al. Composition and antioxidant activity analysis of feruloyl oligosaccharides produced from brewer's grains[J]. Science and Technology of Food Industry,2019,40(9):1−5,12.] SONG Chunyan, LI Yanlin, ZHANG Wei, et al. Composition and antioxidant activity analysis of feruloyl oligosaccharides produced from brewer's grains[J]. Science and Technology of Food Industry, 2019, 40(9): 1−5,12.
[15] 王紫薇, 蔡吴丹, 闫景坤. 可德兰多糖-阿魏酸接枝共聚物的制备工艺优化[J]. 现代食品科技,2021,37(9):179−185,85. [WANG Ziwei, CAI Wudan, YAN Jingkun. Synthetic optimization of ferulic acid/curdlan graft copolymers[J]. Modern Food Science and Technology,2021,37(9):179−185,85.] WANG Ziwei, CAI Wudan, YAN Jingkun. Synthetic optimization of ferulic acid/curdlan graft copolymers[J]. Modern Food Science and Technology, 2021, 37(9): 179−185,85.
[16] 黄对对, 韦庆益, 袁尔东, 等. 阿魏酸-普鲁兰多糖接枝共聚物的制备及其抗氧化活性研究[J]. 现代食品科技,2016,32(4):150−155. [HUNAG Duidui, WEI Qingyi, YUAN Erdong, et al. Preparation, characterization, and antioxidant properties of ferulic acid-grafted-pullulan[J]. Modern Food Science & Technology,2016,32(4):150−155.] HUNAG Duidui, WEI Qingyi, YUAN Erdong, et al. Preparation, characterization, and antioxidant properties of ferulic acid-grafted-pullulan[J]. Modern Food Science & Technology, 2016, 32(4): 150−155.
[17] LIU J, LU J, KAN J, et al. Preparation, characterization and antioxidant activity of phenolic acids grafted carboxymethyl chitosan[J]. International Journal of Biological Macromolecules,2013,62:85−93. doi: 10.1016/j.ijbiomac.2013.08.040
[18] 蒋文明. 大豆豆皮黑曲霉ATCC16404固体发酵产木聚糖酶及制备低聚木糖的研究[D]. 广州:暨南大学, 2011. [JIANG Wenming. Xylanase preparation by Aspergillus niger ATCC16404 fermentation of soybean hull and production of xylo-oligosaccharides[D]. Guangzhou:Jinan University, 2011.] JIANG Wenming. Xylanase preparation by Aspergillus niger ATCC16404 fermentation of soybean hull and production of xylo-oligosaccharides[D]. Guangzhou: Jinan University, 2011.
[19] 蒋文明, 周石洋. 椰子皮多糖的提取, 结构表征及生物活性研究[J]. 中国食品添加剂,2023,34(5):111−118. [JIANG Wenming, ZHOU Shiyang. Extraction, structure characterization and biological activity of polysaccharide from coconut peel[J]. China Food Additives,2023,34(5):111−118.] JIANG Wenming, ZHOU Shiyang. Extraction, structure characterization and biological activity of polysaccharide from coconut peel[J]. China Food Additives, 2023, 34(5): 111−118.
[20] 蒋文明, 周石洋. 海棠果多糖提取、结构表征以及生物活性研究[J]. 中国食品添加剂,2023(7):81−89. [JIANG Wenming, ZHOU Shiyang. Extraction, structure characterization and biological activity of polysaccharides from Malus prunifolia[J]. China Food Additives,2023(7):81−89.] JIANG Wenming, ZHOU Shiyang. Extraction, structure characterization and biological activity of polysaccharides from Malus prunifolia[J]. China Food Additives, 2023(7): 81−89.
[21] LEE M, SONG J H, CHOI E J, et al. UPLC-QTOF-MS/MS and GC-MS characterization of phytochemicals in vegetable juice fermented using lactic acid bacteria from kimchi and their antioxidant potential[J]. Antioxidants,2021,10:1761. doi: 10.3390/antiox10111761
[22] LIU J B, CAO S C, LIU J, et al. Effect of probiotics and xylo-oligosaccharide supplementation on nutrient digestibility, intestinal health and noxious gas emission in weanling pigs[J]. Asian-Australasian Journal of Animal Sciences,2018,31(10):1660−1669. doi: 10.5713/ajas.17.0908
[23] ZHANG C, JIANG Q, LIU A, et al. The bead-like Li3V2(PO4)3/NC nanofibers based on the nanocellulose from waste reed for long-life Li-ion batteries[J]. Carbohydrate Polymers,2020,237:116134. doi: 10.1016/j.carbpol.2020.116134
[24] THIRUKUMARAN P, SATHIYAMOORTHI R, SHAKILA PARVEEN A, et al. New benzoxazines from renewable resources for green composite applications[J]. Polymer Composites,2016,37(2):573−582. doi: 10.1002/pc.23214
[25] SHEN S, CHENG H, LI X, et al. Effects of extraction methods on antioxidant activities of polysaccharides from camellia seed cake[J]. European Food Research and Technology,2014,238:1015−1021. doi: 10.1007/s00217-014-2183-2
[26] GUO X, SCHWAB W, HO C-T, et al. Characterization of the aroma profiles of oolong tea made from three tea cultivars by both GC-MS and GC-IMS[J]. Food Chemistry,2022,376:131933. doi: 10.1016/j.foodchem.2021.131933
[27] SEONG H, BAE J H, SEO J S, et al. Comparative analysis of prebiotic effects of seaweed polysaccharides laminaran, porphyran, and ulvan using in vitro human fecal fermentation[J]. Journal of Functional Foods,2019,57:408−416. doi: 10.1016/j.jff.2019.04.014
[28] MA Y, LI B, ZHANG X, et al. Production of gluconic acid and its derivatives by microbial fermentation:Process improvement based on integrated routes[J]. Frontiers in Bioengineering and Biotechnology,2022,10:864787. doi: 10.3389/fbioe.2022.864787
[29] ZHANG R, JIA W. Deciphering the competitive binding interaction of β-lactoglobulin with benzaldehyde and vanillic acid via high-spatial-resolution multi-spectroscopic[J]. Food Hydrocolloids,2023,141:108724. doi: 10.1016/j.foodhyd.2023.108724
[30] MOGHADDAM-MANESH M, GHAZANFARI D, SHEIKHHOSSEINI E, et al. MgO-nanoparticle-catalyzed synthesis and evaluation of antimicrobial and antioxidant activity of new multi-ring compounds containing spiro[indoline-3,4′-[1,3]dithiine][J]. Chemistry Europe,2019,4(31):9247−9251.
[31] HOSSAIN M S, SHAHIDUZZAMAN M, RAHIM M A, et al. Bioactive properties and organosulfur compounds profiling of newly developed garlic varieties of Bangladesh[J]. Food Chemistry,2023,17:100577.
[32] RODRÍGUEZ-PÉREZ C, QUIRANTES-PINÉ R, AMESSIS-OUCHEMOUKH N. et al. A metabolite-profiling approach allows the identification of new compounds from Pistacia lentiscus leaves[J]. Journal of Pharmaceutical and Biomedical Analysis,2013,77:167−174. doi: 10.1016/j.jpba.2013.01.026
[33] CARIUS B, SILVA H, SILVA A M S, et al. Chemical profiling of Limonium vulgare Mill. using UHPLC-DAD-ESI/MS2 and GC-MS analysis[J]. Applied Sciences,2022,12(13):6384. doi: 10.3390/app12136384
[34] SOARES-CASTRO P, SOARES F, REIS F, et al. Bioprospection of the bacterial β-myrcene-biotransforming trait in the rhizosphere[J]. Applied Microbiology and Biotechnology,2023,107:5209−5224. doi: 10.1007/s00253-023-12650-w





 下载:
下载:
 下载:
下载:
