Effect of Extraction Methods on Physicochemical and Functional Properties of Nannochloropsis Proteins
-
摘要: 以微拟球藻粉为原料,分别采用冻融盐析法、酶提辅助法和碱提酸沉法制备冻融蛋白(Nannochloropsis freeze-thawed extraction protein,NFP)、酶提蛋白(Nannochloropsis enzyme-assisted extraction protein,NEP)和碱提蛋白(Nannochloropsis alkali extraction protein,NAP),并对其理化性质和功能特性进行对比分析。结果表明,碱提酸沉法的提取率为18.70%±0.50%,显著高于其他两种提取方式(P<0.05)。NFP、NEP与NAP中均含有多种人体必需氨基酸,分别占总氨基酸含量的38.75%、38.16%和37.88%;紫外吸收光谱显示三种提取蛋白在200~220 nm处有较强的吸光值;傅里叶变换红外光谱表明三种蛋白均具有典型的蛋白吸收峰,但二级结构发生变化,碱提处理使NAP中β-转角相对含量降低至19.62%±1.48%,β-折叠相对含量增加至32.90%±1.55%;与NEP和NFP相比,NAP的游离巯基含量和Zeta电位绝对值显著上升,粒径显著下降(P<0.05);扫描电镜显示不同提取方式下蛋白的显微结构有差异。功能特性分析显示三种蛋白的溶解性、起泡性及起泡稳定性随pH的变化趋势相似;相比NEP和NAP,NFP具有更好的功能特性。该研究结果为微藻蛋白资源在食品领域的开发利用提供了一定的理论依据。Abstract: Nannochloropsis freeze-thawed extraction protein (NFP), Nannochloropsis enzyme-assisted extraction protein (NEP) and Nannochloropsis alkali extraction protein (NAP) were extracted from the Nannochloropsis powder by using freeze-thawed salt precipitation method, enzyme-assisted extraction method and alkali dissolution acid precipitation method, respectively. The physicochemical properties and functional properties were compared and analyzed. The results showed that the extraction rate of alkali-solution and acid-precipitation was 18.70%±0.50%, which was significantly higher than that of the other two extraction methods (P<0.05). NFP, NEP and NAP all contained a variety of essential amino acids, accounting for 38.75%, 38.16% and 37.88% of the total amino acid content, respectively. The UV absorption spectrum showed that the three extracted proteins exhibited strong absorbance values at 200~220 nm. Fourier transform infrared spectroscopy (FTIR) showed that all three proteins displayed typical protein absorption peaks, however, the secondary structure changed. After alkaline extraction treatment, the proportions of β-turn in NAP decreased to 19.62%±1.48%, respectively, whereas the β-sheet content increased to 32.90%±1.55%. Compared with NEP and NFP, the free sulfhydryl content and Zeta potential absolute value of NAP were significantly increased, while the particle size was obviously reduced (P<0.05). The results of scanning electron microscopy (SEM) showed that the microstructure of the three proteins was different. Functional properties analysis demonstrated that the solubility, foaming ability and foaming stability of the three proteins displayed similar trends with that of pH. Compared to NEP and NAP, NFP had better functional capacities. The results provide a certain theoretical basis for the development and utilization of Nannochloropsis protein resources in the food industry.
-
微拟球藻(Nannochloropsis)是一类分布广泛的单细胞藻类真核生物,属于真眼点藻纲,真眼点藻目,单株藻科。其细胞呈球形或近似球形,直径约为2~8 μm,形态简单,生长迅速,光和效率高,可以实现大规模养殖,具有很高的开发潜力和商业化应用前景[1−2]。微拟球藻中营养成分含量丰富,主要活性成分包括蛋白质、藻多糖、叶绿素a、β-胡萝卜素等,在缺氮胁迫下还能大量合成油脂(富含二十碳五烯酸(Eicosapentaenoic acid,EPA)),是工业化生产EPA的优质原料,也可作为鱼类幼体和轮虫的饲料添加剂,已于2021年被国家卫健委批准作为人类新食品原料[3]。目前,该藻种主要应用于水产养殖、食品、保健食品、生物制药、化妆品和生物柴油等领域[4]。
蛋白质是微藻中最主要的物质成分之一,一般在干基物质中占比为25%~40%[5]。相较于其他植物源蛋白,微藻蛋白具有原料生长速度快、产量高、不占耕地等特性[6]。同时,微藻蛋白的氨基酸种类齐全,且生物利用率高、致敏性低,是良好的可持续性未来食品蛋白质来源,作为保健食品、药品和化妆品的原料也具有巨大应用潜力[7−8]。由于有些微藻具有较厚的细胞壁,因此为了提高蛋白提取效率,通常需要对微藻细胞壁进行轻度破碎处理。目前,常用的细胞壁破碎处理方法通常包括机械法和非机械法。机械处理主要是超声波、研磨、高压、均质等,非机械法包括物理方法(反复冻融、负压)、化学方法(例如裂解液、酸碱处理等)和酶处理方法等[9]。其中,碱提酸沉法因操作便利、经济实惠且提取率高的优点,成为目前使用较多的蛋白质提取方法。
近年来,国内外对微拟球藻的相关研究热度持续攀升,但大多集中在微藻产油生产及应用,对微拟球藻蛋白理化性质的相关研究探索不多。关于不同的提取方式对微拟球藻蛋白理化特性和功能性质的影响,国内外鲜有报道。因此,本实验拟采用冻融盐析法、酶提辅助法和碱提酸沉法分别提取微拟球藻蛋白,比较不同提取方法下蛋白理化性质和功能性质的差异,旨在为微拟球藻的精深加工以及相关蛋白产品的高值化开发应用提供理论依据。
1. 材料与方法
1.1 材料与仪器
微拟球藻粉 烟台海融生物技术有限公司;纤维素酶(3000 U/g)、考马斯亮蓝G-250、十二烷基硫酸钠(SDS,电泳纯)、丙烯酰胺、过硫酸氨(ammonium persulphate,AP) 北京索莱宝生物科技有限公司;漆酶(20000 U/mg)、硫酸铵、5,5-二巯基-2,2-二硝基苯甲酸溶液(DTNB) 上海源叶生物科技有限公司;所有试剂均为国产分析纯。
SCIENTZ-10N冷冻干燥机 宁波新芝股份有限公司;ZHSY-50N水浴恒温振荡器 上海知楚仪器有限公司;FE20 pH计 上海梅特勒-托利多有限公司;LC-4012低速离心机 安徽中科中佳科学仪器有限公司;UV-9000紫外可见分光光度计 上海元析仪器有限公司;Bruker Tensor27傅里叶变换红外光谱仪 德国Bruker公司;高速均质机 德国IKA仪器公司;JSM-6390LV低真空扫描电镜 日本电子株式会社;Hitachi 835-50氨基酸自动分析仪 日本日立公司;Zetasizer NanoZS90纳米粒度/Zera电位分析仪 英国马尔文公司。
1.2 实验方法
1.2.1 微拟球藻蛋白的提取
1.2.1.1 冻融盐沉法
根据陈艺煊[10]的方法并在此基础上修改。将微拟球藻粉与去离子水以料液比1:10(g/mL)混合均匀,溶胀24 h后置于−20 ℃条件下冷冻12 h左右。于室温下融化,反复以上操作至少4次。冻融结束后,将混合物离心(4000 r/min,20 min)后取上清液。在上清液中加入终浓度为75%的硫酸铵,利用盐析作用使蛋白质沉淀,静置过夜。经离心(4000 r/min,20 min)后收集沉淀,使用透析袋(3.5 kDa,4 ℃)透析72 h,冷冻干燥后得到微拟球藻冻融蛋白(Nannochloropsis freeze-thawed extraction protein,NFP)。
1.2.1.2 酶提辅助法
将微拟球藻粉与去离子水以料液比1:10(g/mL)混合均匀,溶胀24 h后用2 mol/L HCl将pH调节至5.0。加入1%(w/w)漆酶,于50 ℃下酶解4 h;再加入1%(w/w)纤维素酶,于50 ℃下酶解4 h。酶解结束后,经离心(4000 r/min,20 min)处理收集上清液。按照1.2.1.1中盐析、透析和冷冻干燥后,得到酶提蛋白(Nannochloropsis enzyme-assisted extraction protein,NEP)[11]。
1.2.1.3 碱提酸沉法
参考Duppeti等[12]的方法并略作改动。将微拟球藻粉与去离子水以料液比1:10(g/mL)混合均匀,溶胀24 h后用2 mol/L NaOH溶液调节pH至9.0,置于4 ℃下提取30 min。经离心(4000 r/min,20 min)后获得上清液,用2 mol/L HCl调节pH至最佳沉淀点5.0后静置1 h。经离心(4000 r/min,20 min)后收集沉淀物,使用透析袋(3.5 kDa,4 ℃)透析72 h,冷冻干燥后得到碱提蛋白(Nannochloropsis alkali extraction protein,NAP)。
1.2.2 蛋白提取率的测定
采用凯氏定氮法测定蛋白提取液中的蛋白质含量,根据式(1)计算蛋白提取率:
蛋白提取率(%)=提取液质量×提取液蛋白质含量样品质量×样品中蛋白质含量×100 (1) 1.2.3 微拟球藻蛋白理化性质的研究
1.2.3.1 UV-Vis吸收光谱分析
将冻干样品配制成0.5 mg/mL的蛋白溶液,使用紫外可见分光光度计对其进行200~800 nm范围内的扫描[11]。
1.2.3.2 氨基酸分析
精确称取一定量蛋白样品,加入10 mL 6 mo/L的HCl溶液,在110 ℃下水解24 h。水解液脱酸后用水定容至50 mL。准确吸取1.0 mL滤液移入到15 mL试管内,对其减压干燥,最后蒸干。用1.0~2.0 mL pH2.2柠檬酸钠缓冲溶液加入到干燥后试管内溶解,振荡混匀后,吸取溶液通过0.22 μm滤膜过滤,转移至仪器进样瓶,为样品测定液。使用Hitachi 835-50氨基酸自动分析仪测定其氨基酸组成[13]。
1.2.3.3 傅里叶变换红外光谱分析
采用溴化钾压片法进行分析。取2 mg冻干样品,加入200 mg左右干燥后的KBr,用玛瑙研钵研磨均匀后压片,将制备好的样品压片在4000~500 cm−1波数范围内进行扫描。测试完成后,使用Peakfit软件分析酰胺I带特征峰(1600~1700 cm−1)的波段,校正基线后用Gaussian法去卷积,再利用二阶导数法进行拟合,计算各二级结构比例[14]。
1.2.3.4 游离巯基含量的测定
将15 mg微拟球藻蛋白样品溶于3 mL Tris-Gly-SDS缓冲液(0.086 mol/L Tris,0.09 mol/L Gly,4 mmol/L EDTA,0.087 mol/L SDS,pH8.0)中,充分混匀后,将上述溶液以6000×g离心10 min。取1 mL上清液于试管中,加入4 mL Tris-Gly-SDS缓冲液,再加入0.04 mL DTNB溶液(10 mmol/L)在黑暗中反应30 min,在412 nm处测量溶液的吸光度。根据式(2)计算游离巯基含量[14]。
-SH(μmol/g)=73.53×A412×DC (2) 式中,A412是样品在412 nm处的吸光度;D是稀释因子;C是样品浓度,mg/mL。
1.2.3.5 粒径和Zeta电位的测定
配制浓度1 mg/mL的样品蛋白溶液,用0.1 mol/L NaOH调节pH至7.0。取适量的样品溶液加入样品池中,测定平均粒径。用0.1 mol/L NaOH或0.1 mol/L HCl调节pH至7.0,再测量Zeta电位,在室温下重复3次[15]。
1.2.3.6 扫描电镜分析
取少量NFP、NEP与NAP蛋白样品固定于载物片上,进行真空喷金处理,并放大至合适的倍数,然后上机观察拍照[13]。
1.2.4 微拟球藻蛋白功能特性的研究
1.2.4.1 溶解度的测定
参考Tao等[16]的方法并稍作修改。用去离子水配制1.0 mg/mL的微拟球藻蛋白溶液,用0.1 mol/L HCl或0.1 mol/L NaOH调节溶液的pH分别至2、4、6、8、10。室温振荡20 min后,6000 r/min离心10 min,用Bradford法对上清液中蛋白含量进行测定。根据式(3)计算蛋白溶解度。
蛋白溶解度(%)=上清液蛋白含量样品中总蛋白含量×100 (3) 1.2.4.2 吸水性和吸油性的测定
参考贾明月等[17]的方法,稍作修改。测定微拟球藻蛋白的吸水性和吸油性。
吸水性:取一定量的微拟球藻蛋白置于离心管中,加入5 mL去离子水,充分混匀后在室温条件下静置30 min,6000 r/min离心10 min,弃去上清液,收集沉淀物。记录空白离心管的质量、微藻蛋白粉的质量和弃去上清液后沉淀物和离心管的质量。计算公式如下:
吸水性(g/g)=M2−M1M (4) 式中,M2表示弃去上清液后沉淀物和离心管的质量,g;M1表示初始离心管和样品的质量,g;M表示蛋白样品的质量,g。
吸油性:取一定量的微拟球藻蛋白溶于5 mL玉米油中,涡旋2 min后室温放置30 min,6000 r/min离心10 min,收集沉淀物。记录空白离心管的质量、微藻蛋白粉的质量和离心后沉淀物和离心管的质量。计算公式如下:
吸油性(g/g)=M2−M1M (5) 式中,M2表示离心后沉淀物和离心管的质量,g;M1表示初始离心管和样品的质量,g;M表示蛋白样品的质量,g。
1.2.4.3 起泡性和起泡稳定性的测定
参考Simayi等[18]的方法并稍作修改。配制1.0 mg/mL的微拟球藻蛋白溶液,用0.1 mol/L HCl或NaOH溶液分别调pH至2.0、4.0、6.0、8.0、10.0,用高速均质机在15000×g条件下均质1 min,立即记录均质前(V)和均质后(V1)的体积。室温下放置10 min,再次记录体积(V2)。按照公式(6)、(7)计算:
起泡性(%)=V1−VV×100 (6) 起泡稳定性(\%)=V2−VV1−V×100 (7) 式中:V表示初始样品体积,mL;V1表示样品均质后的体积,mL;V2表示静置10 min后的体积,mL。
1.2.4.4 乳化性和乳化稳定性的测定
参考Li等[19]的方法并稍作修改。配制1.0 mg/mL的微拟球藻蛋白溶液,用0.1 mol/L HCl或NaOH溶液分别调节pH至2、4、6、8、10。取3 mL溶液与1 mL玉米油混合,用高速均质机在15000×g条件下均质1 min,迅速从底部取50 μL乳状液,分别在0和10 min加入到5 mL的0.1% SDS溶液中混匀,在500 nm处测定吸光度。分别根据公式(8)、(9)计算乳化性和乳化稳定性:
乳化性(m2/g)=2×2.303×A0×NL×C×Φ×10000 (8) 乳化稳定性(min)=A0A0−A10×10 (9) 式中:A0和A10分别是乳状液储存0和10 min的吸光度;N是稀释因子(N=100);C是蛋白质溶液的浓度,mg/mL;Φ是油的体积分数(Φ=0.25);L是光路宽度(L=0.01 m)。
1.3 数据处理
采用Excel和SPSS 27.0软件进行数据处理和显著性分析,用Origin 2022对数据进行制图。上述试验均进行三次平行测定,数据以均值±标准差表示。用Excel 2021软件和IBM SPSS Statistics 27软件进行数据分析及显著性分析,采用Origin 2022软件对数据进行绘图。
2. 结果与分析
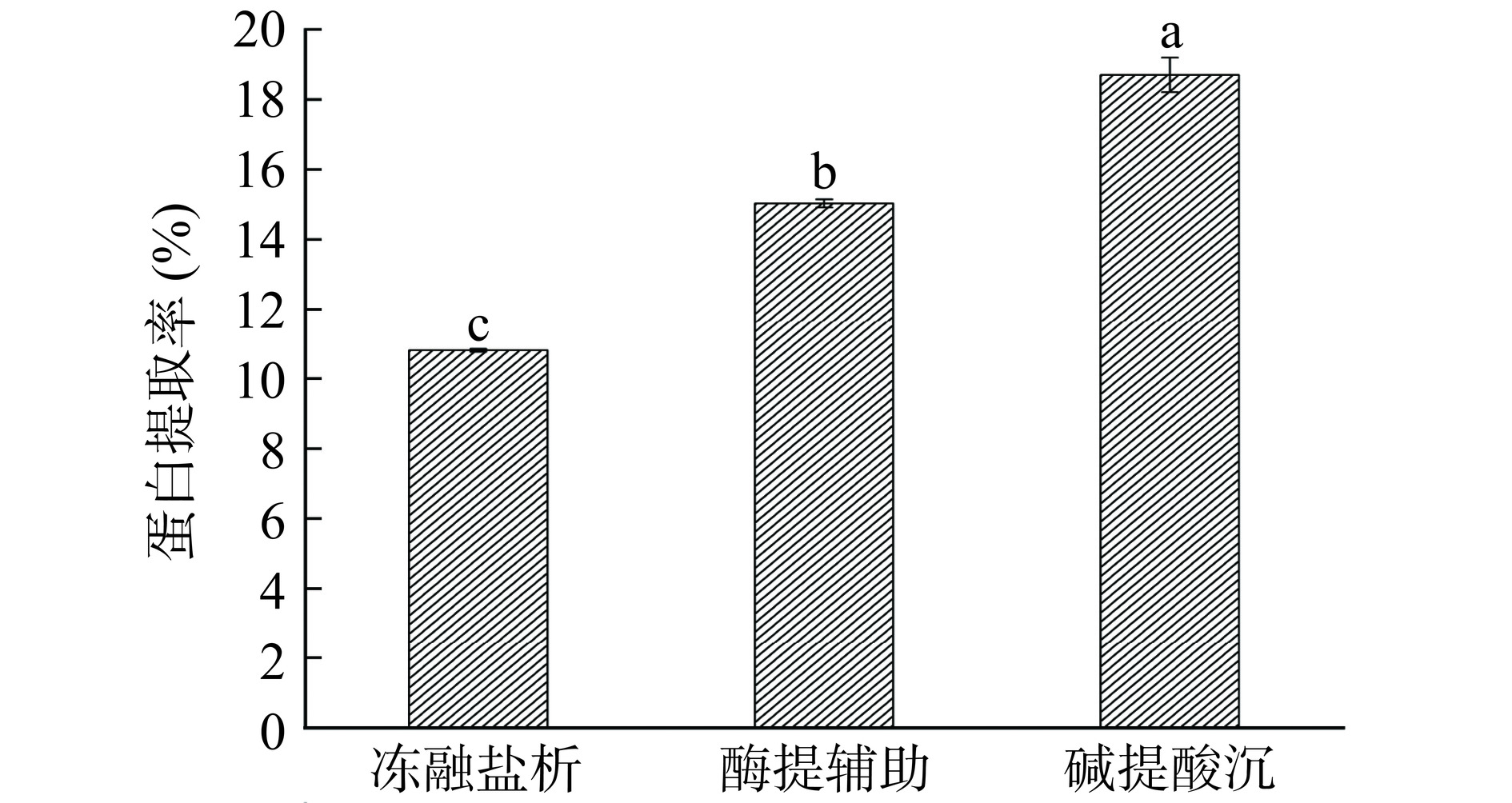
2.1 不同提取方式对微拟球藻蛋白提取率的影响
由图1可知,三种提取方式的蛋白提取率存在显著差异(P<0.05)。在碱性条件下,pH的增高不仅可以促进细胞壁的破裂,还可改变蛋白的带电性质、有利于蛋白的溶出[20]。因此,碱提酸沉法提取率可达到18.70%±0.50%,显著高于冻融盐析法和酶提辅助法(P<0.05)。冻融法通过细胞内冰晶形成和细胞液盐度增高引起溶胀,从而使细胞壁破碎,所制备蛋白质不易变性。但相对于碱提法,循环冻融所需时间较长,且对细胞壁破碎力度不强[21]。酶提辅助是基于特定的酶降解植物细胞壁和纤维的主要成分,从而破坏细胞壁的完整性。其操作相对简便,且对蛋白质品质无影响,但成本相对较高[22]。目前,碱提酸沉法仍是提取植物源蛋白质最普遍的方法,具有提取率高、成本低、便于操作的优点,适于工业化生产。但在使用碱提法过程中需要注意pH变化,pH过高会造成蛋白分子间交联与重排,过量碱还可能会进一步引发脱氨脱羧反应,在一定程度上破坏蛋白质的营养价值,甚至产生有害物质,例如赖丙氨酸[23]。因此,选取合适的碱浓度和处理时间尤为重要,一般选择碱提的pH为8~9[24]。
2.2 不同提取方式微拟球藻蛋白的理化性质
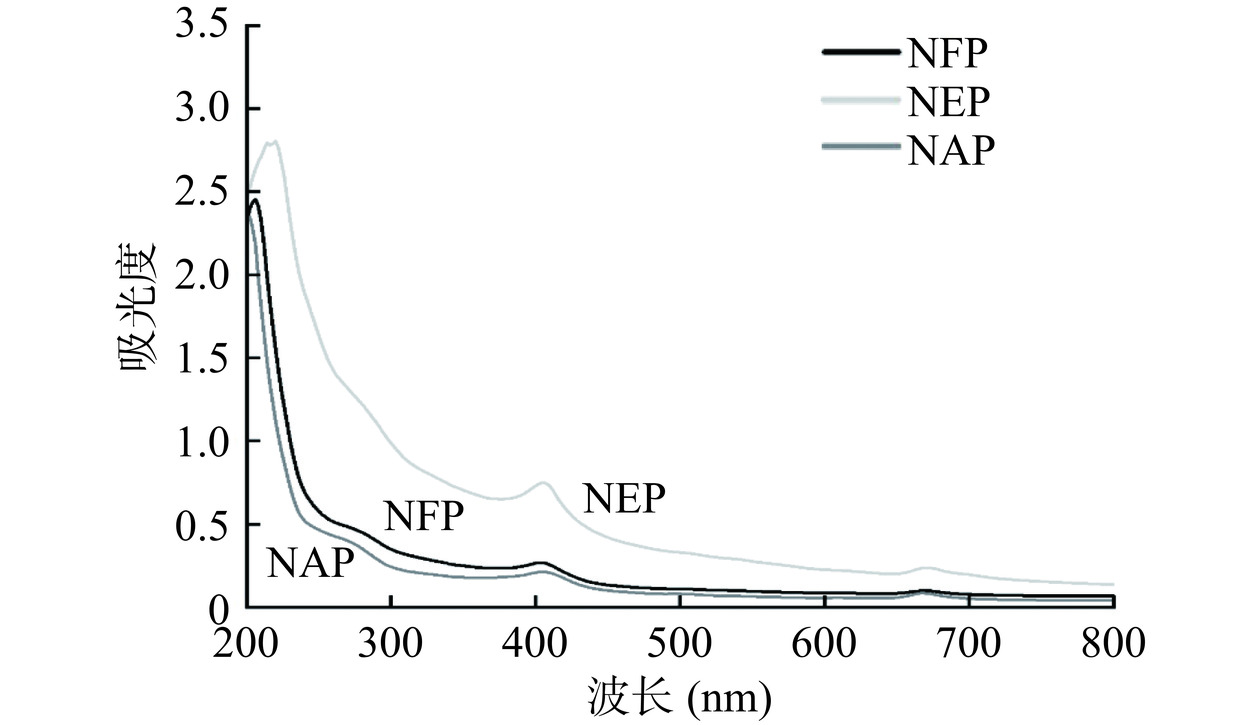
2.2.1 UV-Vis吸收光谱分析
微拟球藻蛋白在200~800 nm范围内的紫外可见吸收光谱如图2所示。三种提取方式的蛋白样品在200~220 nm处有最大吸收峰,这主要是由于蛋白中的C=O、-COOH与CO-NH2等基团的n→π*电子跃迁所引起的[25]。三种蛋白样品在260~280 nm波长处也具有较弱的吸收峰,说明蛋白中含有少量的芳香族氨基酸。此外,微拟球藻蛋白在400 nm左右也出现一个较小的吸收峰,这可能是因为少量β-胡萝卜素的存在[26]。酶提辅助组的样品吸光度相对较高,这可能是由于酶解后暴露的氨基酸较多,紫外吸收强度增加。
2.2.2 氨基酸组成分析
由表1可知,三种方法提取的蛋白质氨基酸组成基本相似,含量无显著差异(P>0.05)。其中,谷氨酸含量最高,与大多数植物蛋白相一致[27]。NFP、NEP和NAP均含有人体所需的多种必需氨基酸(Essential amino acids,EAA),分别占总氨基酸(Total amino acid,TAA)的38.75%、38.16%和37.88%。其中,苏氨酸、缬氨酸、异亮氨酸和亮氨酸的相对含量能够达到联合国粮食及农业组织/世界卫生组织(Food and Agriculture Organization/World Health Organization,FAO/WHO)的儿童推荐值(分别为3.4%、3.5%、2.8%和6.6%);所有必需氨基酸的相对含量均高于FAO/WHO的成人推荐值(苏氨酸0.9%、缬氨酸1.3%、蛋氨酸1.7%、异亮氨酸1.3%、亮氨酸1.9%、苯丙氨酸1.9%、赖氨酸1.6%)[28]。此外,必需氨基酸与非必需氨基酸(Non essential amino acids,NEAA)的比值分别为0.63、0.62和0.61,高于大豆蛋白(0.4804)[29]。因此,微拟球藻蛋白是一种富有特色的潜在海洋蛋白资源,有进一步开发应用的前景。
表 1 NFP、NEP和NAP的氨基酸组成Table 1. Amino acid composition of NFP, NEP and NAP氨基酸 NFP NEP NAP 含量(g/100 g) 相对含量(%) 含量(g/100 g) 相对含量(%) 含量(g/100 g) 相对含量(%) 天冬氨酸 7.30±3.10a 11.31 7.12±1.61a 10.74 7.09±1.46a 10.16 谷氨酸 8.62±1.99a 13.36 9.59±2.03a 14.45 9.73±2.67a 13.95 丝氨酸 3.00±0.16a 4.65 3.28±0.43a 4.94 3.25±0.04a 4.66 苏氨酸* 3.81±1.26a 5.91 3.67±1.02a 5.53 4.15±0.71a 5.94 甘氨酸 4.21±0.51a 6.53 4.31±0.89a 6.50 4.41±0.27a 6.32 丙氨酸 4.74±1.56a 7.35 4.75±1.84a 7.16 4.91±1.34a 7.04 半胱氨酸 0.51±0.16a 0.78 0.41±0.22a 0.61 0.26±0.11a 0.37 缬氨酸* 3.80±0.89a 5.89 4.18±0.98a 6.29 3.88±0.18a 5.56 蛋氨酸* 2.06±0.69a 3.19 1.16±0.26a 1.74 1.43±0.49a 2.05 异亮氨酸* 3.22±0.61a 4.99 3.44±0.57a 5.19 3.03±0.81a 4.34 亮氨酸* 5.23±0.52a 8.10 5.82±0.78a 8.77 5.79±1.41a 8.30 酪氨酸 2.19±0.66a 3.39 2.27±0.53a 3.41 2.63±0.26a 3.76 苯丙氨酸* 3.28±0.52a 5.08 3.31±0.33a 4.99 3.68±0.10a 5.28 赖氨酸* 3.73±0.65a 5.78 3.83±0.37a 5.77 4.55±0.52a 6.52 组氨酸 1.62±0.36a 2.50 1.13±0.27a 1.70 1.54±0.45a 2.21 精氨酸 3.99±1.31a 6.18 4.36±0.86a 6.57 5.50±0.52a 7.88 脯氨酸 3.22±0.58a 4.99 3.74±0.24a 5.64 3.95±0.09a 5.66 EAA/TAA(%) 38.75±3.02a / 38.16±4.15a / 37.88±3.97a / EAA/NEAA(%) 63.48±5.71a / 62.06±7.69a / 61.32±7.28a / 注:*为必需氨基酸;同行相同字母表示差异不显著,P>0.05。 2.2.3 红外光谱分析
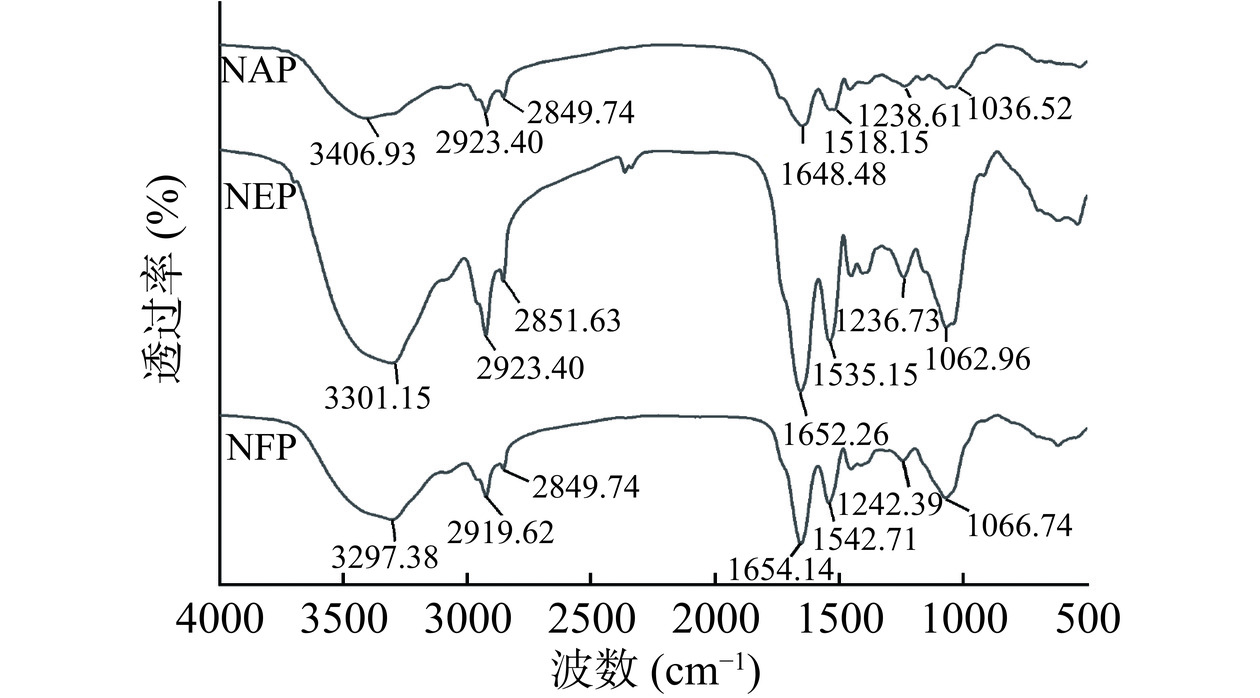
如图3所示,不同方式提取的微拟球藻蛋白具有相似的红外特征吸收峰,均有酰胺A、B带和酰胺Ⅰ、Ⅱ、Ⅲ带。酰胺A的吸收通常在3440~3400 cm−1,反映了N-H与O-H中氢键的伸缩振动吸收。当含N-H基团的蛋白分子参与氢键形成时,N-H基团伸缩振动产生的吸收峰会降低约100 cm−1[30]。NFP、NEP和NAP符合酰胺A的特征吸收峰值范围,同时NAP的吸收峰波数相对高于NFP和NEP,说明NFP和NEP中的氢键含量高于NAP,传统碱提酸沉法可能会破坏蛋白质分子中的部分氢键[27,31]。
酰胺I带(1600~1700 cm−1)是由C=O伸缩振动或H-O-H弯曲振动产生,常用于分析蛋白质的二级结构的敏感性[27]。研究表明酰胺I与以下二级结构有关,包括:β-折叠(1600~1640 cm−1),无规则卷曲(1640~1650 cm-1),α-螺旋(1650~1660 cm−1),β-转角(1660~1700 cm−1)[32]。三种提取方式制备蛋白的二级结构定量如表2所示。与冻融盐析和酶提辅助相比,经碱提处理后NAP蛋白质中的β-折叠含量显著上升至32.90%±1.55%,β-转角含量(19.62%±1.48%)则显著降低(P<0.05)。其变化趋势与Hou等[23]研究结果相近,这可能是由于碱性提取使α-螺旋与β-转角发生分子间的相互作用,从而向β-折叠发生转变。α-螺旋是蛋白质二级结构中最稳定的,提取过程中的碱处理可能会导致α-螺旋中的氢键逐渐断裂,发生解螺旋,导致蛋白结构的随机性增强[33−34]。有研究表明,β-折叠增加与分子聚集程度呈正相关[31],因此可推断碱提酸沉使NAP中蛋白质分子更加聚集,形成粒径更小的蛋白颗粒。
表 2 不同提取方式的微拟球藻蛋白二级结构相对含量(%)Table 2. Secondary structure relative content of Nannochloropsis protein with different extraction methods (%)蛋白样品 β-折叠 无规则卷曲 α-螺旋 β-转角 NFP 23.42±0.58b 22.76±0.86a 25.81±0.14a 28.00±1.11a NEP 25.26±0.07b 23.52±0.29a 25.66±0.35a 25.56±0.66a NAP 32.90±1.55a 24.36±0.59a 23.11±2.19a 19.62±1.48b 注:同列小写字母不同表示差异显著(P<0.05),表3同。 2.2.4 游离巯基含量、粒径和Zeta电位
如表3所示,相比于NFP和NEP,NAP的游离巯基含量(88.24±2.21 μmol/g)显著上升(P<0.05)。游离巯基含量的增加可能归因于在碱提酸沉处理下蛋白质亚基内部的部分二硫键断裂,发生了巯基和二硫键之间的交换反应,从而增加了游离巯基含量[35]。
表 3 不同提取方式对微拟球藻蛋白的游离巯基含量、平均粒径和Zeta电位的影响Table 3. Effects of different extraction methods on the free sulfhydryl content, average particle size and Zeta potential of Nannochloropsis protein样品 游离巯基含量(μmol/g) 平均粒径(nm) Zeta电位 NFP 43.97±0.59b 456.60±4.90a −31.60±2.05a NEP 34.45±1.43c 340.33±7.05b −32.93±1.35a NAP 88.24±2.21a 291.50±8.54c −34.30±1.49a Zeta电位通常反映蛋白在溶液中的电荷及分布状态,Zeta电位绝对值越高,蛋白质分子更易互相排斥,溶液的稳定性越好;反之,体系则不稳定[36]。此外,Zeta电位的大小与pH、蛋白质的结构构象及颗粒大小有关[37]。由表3可知,三种蛋白中NAP的Zeta电位绝对值最高,这可能是碱提酸沉提取处理使蛋白空间结构及表面性质发生了一定变化,导致静电相互作用增加,蛋白质分子之间的排斥力增大,使其在水溶液中更加稳定[38]。各样品组中,NAP平均粒径显著低于NFP和NEP(P<0.05),这可能由于蛋白分子表面电荷增加,通过静电排斥作用使其以更小的颗粒尺寸均匀分布在溶液中[39],这与Zeta电位值对溶液稳定性的影响相一致。
2.2.5 扫描电镜分析
蛋白质的微观结构对蛋白质的功能特性起着重要的作用,如图4所示,NFP、NEP和NAP的颗粒表面形态存在一定差异。NFP由多层连续的片状结构组成,同时含有少量纤维状的蛋白细丝;虽然交联程度不高,但存在一定的多孔状结构,因此可能会影响其吸附性,进而促进蛋白吸水性和吸油性。NEP呈大小不一的碎片状结构,且碎片之间相互分离,无蛋白纤维交联结构[40]。NAP则出现蛋白质团聚现象,这可能是在冷冻干燥过程中,溶液中均匀分布的颗粒发生聚集折叠,形成了较为均一的球状聚集体。此外,研究发现游离巯基含量较高的蛋白质更有可能相互结合或聚集[41]。由表3可知,NAP的游离巯基含量显著高于NFP和NEP(P<0.05)。与NFP和NEP相比,NAP的显微结构相对更加紧密,这与其游离巯基含量的测定结果相一致。
2.3 不同提取方式微拟球藻蛋白的功能特性
2.3.1 溶解性
溶解性指蛋白质在水溶液中的溶解能力,通过溶解性可以判断蛋白质的聚集情况[42]。由图5可知,三种提取方式制备的微拟球藻蛋白,其溶解度随pH的增大呈先下降后上升的趋势,在pH4~6时,溶解度达到最低。微拟球藻蛋白溶解性随pH变化规律与Jiang等[43]的研究结果相似。因此,可以判断NFP和NEP的等电点在pH4左右,NAP的等电点在pH6左右。这是由于在等电点时,蛋白质的净电荷几乎为零,分子间的相互作用力减弱,导致蛋白质颗粒聚集而产生沉淀,溶解度降低。当溶液pH远离等电点时,蛋白质与水分子之间、蛋白质与蛋白质之间的相互排斥作用增强,因此有利于溶解性的进一步增加[44]。当 pH 为 10 时,NFP 和 NEP的溶解度均达到最大,但NAP的溶解度下降,这可能是因为在碱性条件下,氨基的脱质子和羧基的电离导致负电荷增加,蛋白质分子之间的静电斥力增大,蛋白质的溶解度增加,但pH过高会导致蛋白质变性、溶解度下降[45]。当pH为2~6时,NAP的溶解度显著低于NEP和NAP(P<0.05);当pH为8时,NAP的溶解度显著高于NFP和NEP(P<0.05),其溶解度最高为(77.67%±5.08%),NEP次之(61.46%±3.06%),NFP溶解度最低(53.14%±0.57%)。
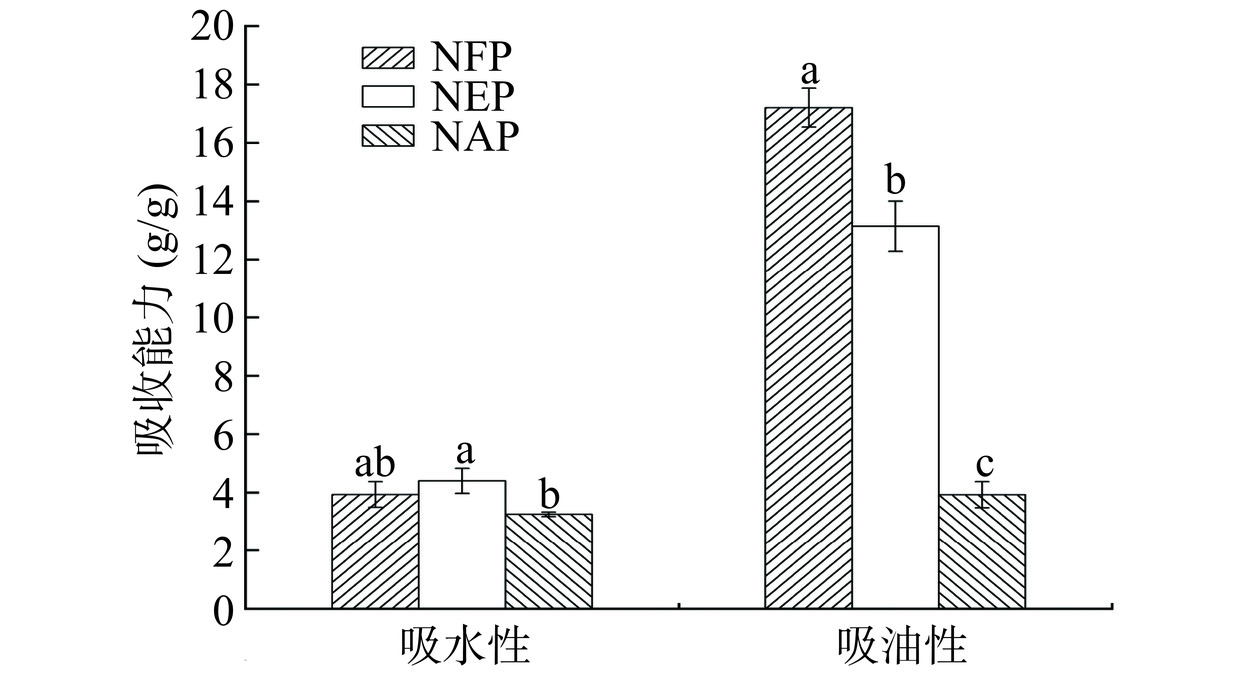
2.3.2 吸水性和吸油性
蛋白质的吸水性是指蛋白质与水直接作用后吸收水分的能力,吸油性是指蛋白质在一定条件下保持油脂的能力[42]。由图6可见,不同提取方式得到的蛋白质的吸油性均高于吸水性,这可能是由于蛋白质的空间结构展开,疏水基团增加,导致样品的吸油能力增加[46]。当蛋白的吸水性为1.49~4.71 mL/g时,较适合用于如汤、肉汁等黏性食品及焙烤食品,因此三种蛋白均可作为重要成分添加在黏性食品中[47]。微拟球藻蛋白的吸油性存在显著差异(P<0.05),其中NFP的吸油能力最强(17.21±0.38 g/g),NAP吸油性(3.93±0.26 g/g)最低,这可能由于在冻干过程中NAP蛋白发生聚集,形成较为紧密的聚集折叠结构,降低了其对油脂的吸附能力,Ogunbusola等[48]在利用碱提酸沉淀法制备甜瓜蛋白时也得到了相同的结论。蛋白质的吸油性是影响食品风味保留,改善适口性并延长保质期的重要功能特性,高持油性的蛋白质可用于食品工业中的肉类配方、肉类替代品和填充剂[30]。因此,NFP可作为一种潜在重要成分应用于高脂食品加工中。
2.3.3 起泡性和起泡稳定性
起泡性是指蛋白溶液在搅打过程中产生泡沫的能力,泡沫稳定性表示蛋白具有足够的黏度以维持泡沫并防止破裂和聚结的能力。适宜的起泡性和泡沫稳定性可以赋予食品疏松的结构和良好的口感,因此蛋白质的起泡性能在食品产品开发中具有重要作用。如图7A所示,在pH为2~10时,NEP的起泡性随pH升高呈先升高后降低再升高的趋势,NFP和NAP的起泡性呈先减小后增大的趋势。在pH4~6时,三种提取方式得到的微拟球藻蛋白起泡性均达到最低,NFP、NEP和NAP的最低起泡性分别为48.33%±1.70%、14.00%±3.74%和10.00%±1.41%。这可能是由于在接近等电点时蛋白溶解度降低,导致结合空气-水界面的蛋白不足。在pH为10时,NFP(67.67%±5.79%)和NEP(62.00%±2.16%)的起泡性显著高于NAP(45.60%±2.57%)(P<0.05)。这主要因为碱性条件下蛋白质的净电荷增多,分子之间相互排斥,增强了蛋白质分子包封空气的能力,从而产生较高的起泡性[49]。实验还发现,NFP的起泡性相对较好,其原因可能由于反复冻融促使冰晶重组分布改变了蛋白质的结构,从而形成了较强的表面张力,使其拥有较高的起泡性和泡沫稳定性[50]。在 pH 为2、4、10 时,酶法制备的 NEP起泡性显著高于碱提酸沉制备的NAP(P<0.05),吕静等[51]研究不同提取方式对油茶籽粕蛋白质起泡性的影响时也得出相似结论。这可能是因为酶法预处理去除了糖类等杂质,一方面使蛋白肽链柔软程度增加,另一方面使蛋白分子间可以更加充分地接触,增加了空气-水界面的蛋白质的分子数量。除pH8外,NAP的泡沫稳定性低于NFP和NEP(图7B)。这可能是当pH为8时,NAP的溶解度最高,蛋白质间分子作用力较强,导致起泡稳定性增强;当pH继续升高时,其起泡稳定性下降。蛋白溶解性、柔韧性、膜的气体渗透性和强度以及泡沫的流变性能均会影响泡沫稳定性[28]。
2.3.4 乳化性和乳化稳定性
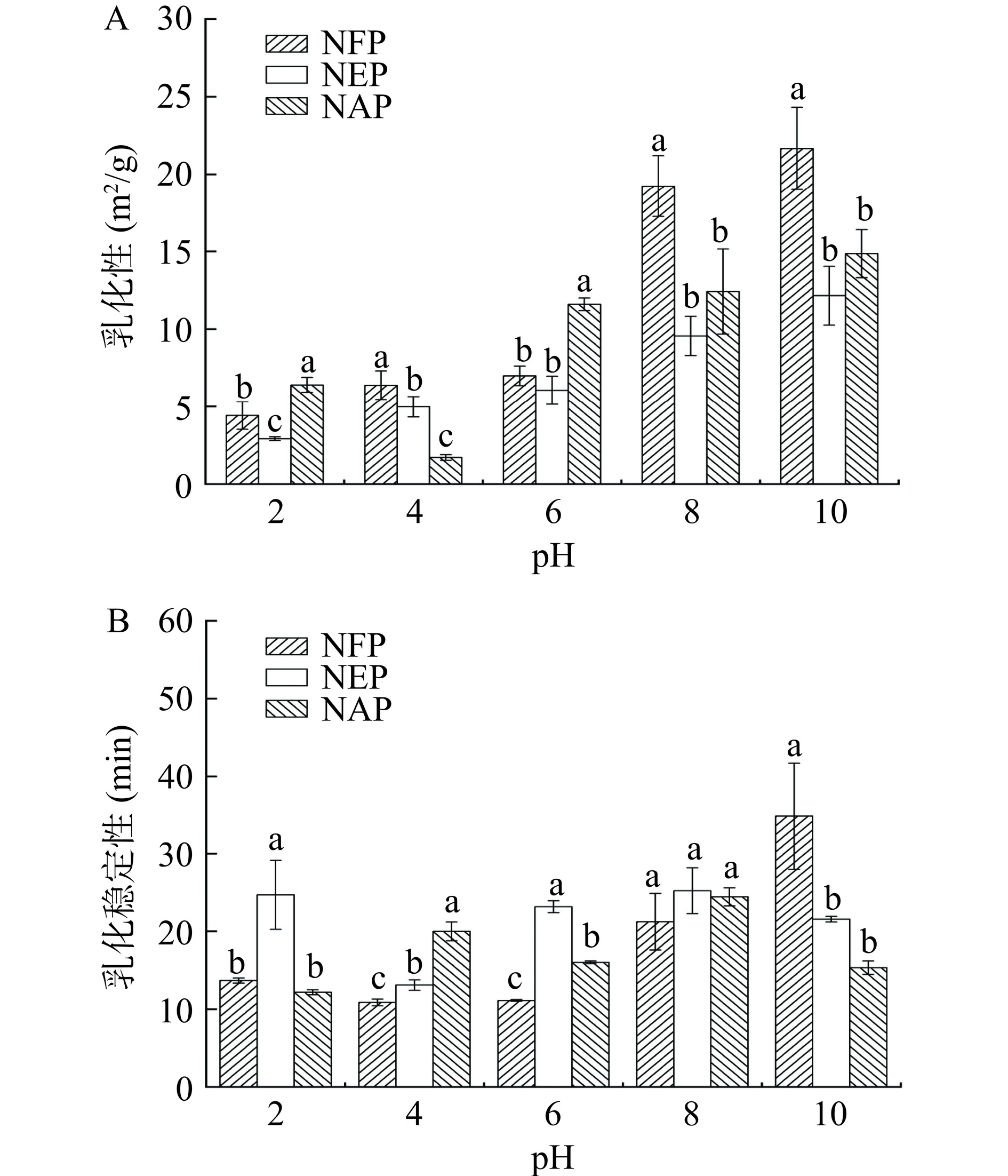
乳化性表示形成蛋白乳液的能力,乳化稳定性是蛋白在一定时间内形成稳定乳状液能力的量度[30]。如图8A和8B所示,三种微拟球藻蛋白在不同pH下的乳化性和乳化稳定性有所不同。在pH接近等电点时,净电荷几乎为零,蛋白质分子之间的排斥力减弱,其胶体作用较弱,不利于乳状液的稳定,因此乳化性较小;当pH继续升高时,蛋白所带的负电荷增加,蛋白颗粒之间的静电排斥作用阻止了油滴间聚合,从而导致乳化性的提高[52]。NFP和NEP的乳化稳定性呈先下降后上升趋势,并在pH4附近出现最低值,分别为10.85%±0.44%和13.09%±0.67%。这可能是由于在接近等电点时,蛋白胶体作用较弱,有利于液滴的乳化聚合,因此乳化稳定性差。当pH继续升高时,静电斥力有助于延缓乳液聚合,足够多的蛋白分子吸附在油水界面形成高强度界面膜也更利于乳液的稳定[30]。在食品加工过程中,常出现乳状液失稳的问题,因此乳化性相对较好的NFP适合应用于烘焙食品、冷冻食品、牛奶、汤类食品以及食品添加剂中。
3. 结论
本研究采用3种不同提取方法提取微拟球藻蛋白,并对蛋白理化指标和功能特性进行初步研究。结果表明,碱提酸沉法可以显著提高微拟球藻蛋白的提取率,但过高的pH可能会破坏蛋白的营养性和安全性。红外光谱显示不同提取方式制备的三种蛋白均具有典型的蛋白吸收峰,经碱处理后的蛋白质β-折叠含量上升、α-螺旋与β-转角含量降低,导致NAP蛋白结构的随机性增强;三种蛋白中NAP游离巯基含量、Zeta电位绝对值最高,平均粒径则显著低于NEP与NFP;扫描电镜结果显示提取方法会对蛋白显微结构产生影响,NAP结构更为紧密,可能会导致其吸附性降低。功能特性分析显示三种蛋白质的溶解性、起泡性及起泡稳定性随pH的变化趋势相似;NFP相比NAP具有更好的吸油性、起泡性和乳化性等功能特性。本研究结果可为微拟球藻蛋白的开发及在食品加工中的应用提供实验支撑,基于以上研究,选择合适的提取方式能够有效提高微拟球藻蛋白的提取率,并在一定程度上改善微拟球藻蛋白的功能特性。下一步研究将进一步优化制备工艺,提高微拟球藻蛋白提取率及功能特性,开发相关营养健康食品,并对其作用机理进行深入探讨。
-
表 1 NFP、NEP和NAP的氨基酸组成
Table 1 Amino acid composition of NFP, NEP and NAP
氨基酸 NFP NEP NAP 含量(g/100 g) 相对含量(%) 含量(g/100 g) 相对含量(%) 含量(g/100 g) 相对含量(%) 天冬氨酸 7.30±3.10a 11.31 7.12±1.61a 10.74 7.09±1.46a 10.16 谷氨酸 8.62±1.99a 13.36 9.59±2.03a 14.45 9.73±2.67a 13.95 丝氨酸 3.00±0.16a 4.65 3.28±0.43a 4.94 3.25±0.04a 4.66 苏氨酸* 3.81±1.26a 5.91 3.67±1.02a 5.53 4.15±0.71a 5.94 甘氨酸 4.21±0.51a 6.53 4.31±0.89a 6.50 4.41±0.27a 6.32 丙氨酸 4.74±1.56a 7.35 4.75±1.84a 7.16 4.91±1.34a 7.04 半胱氨酸 0.51±0.16a 0.78 0.41±0.22a 0.61 0.26±0.11a 0.37 缬氨酸* 3.80±0.89a 5.89 4.18±0.98a 6.29 3.88±0.18a 5.56 蛋氨酸* 2.06±0.69a 3.19 1.16±0.26a 1.74 1.43±0.49a 2.05 异亮氨酸* 3.22±0.61a 4.99 3.44±0.57a 5.19 3.03±0.81a 4.34 亮氨酸* 5.23±0.52a 8.10 5.82±0.78a 8.77 5.79±1.41a 8.30 酪氨酸 2.19±0.66a 3.39 2.27±0.53a 3.41 2.63±0.26a 3.76 苯丙氨酸* 3.28±0.52a 5.08 3.31±0.33a 4.99 3.68±0.10a 5.28 赖氨酸* 3.73±0.65a 5.78 3.83±0.37a 5.77 4.55±0.52a 6.52 组氨酸 1.62±0.36a 2.50 1.13±0.27a 1.70 1.54±0.45a 2.21 精氨酸 3.99±1.31a 6.18 4.36±0.86a 6.57 5.50±0.52a 7.88 脯氨酸 3.22±0.58a 4.99 3.74±0.24a 5.64 3.95±0.09a 5.66 EAA/TAA(%) 38.75±3.02a / 38.16±4.15a / 37.88±3.97a / EAA/NEAA(%) 63.48±5.71a / 62.06±7.69a / 61.32±7.28a / 注:*为必需氨基酸;同行相同字母表示差异不显著,P>0.05。 表 2 不同提取方式的微拟球藻蛋白二级结构相对含量(%)
Table 2 Secondary structure relative content of Nannochloropsis protein with different extraction methods (%)
蛋白样品 β-折叠 无规则卷曲 α-螺旋 β-转角 NFP 23.42±0.58b 22.76±0.86a 25.81±0.14a 28.00±1.11a NEP 25.26±0.07b 23.52±0.29a 25.66±0.35a 25.56±0.66a NAP 32.90±1.55a 24.36±0.59a 23.11±2.19a 19.62±1.48b 注:同列小写字母不同表示差异显著(P<0.05),表3同。 表 3 不同提取方式对微拟球藻蛋白的游离巯基含量、平均粒径和Zeta电位的影响
Table 3 Effects of different extraction methods on the free sulfhydryl content, average particle size and Zeta potential of Nannochloropsis protein
样品 游离巯基含量(μmol/g) 平均粒径(nm) Zeta电位 NFP 43.97±0.59b 456.60±4.90a −31.60±2.05a NEP 34.45±1.43c 340.33±7.05b −32.93±1.35a NAP 88.24±2.21a 291.50±8.54c −34.30±1.49a -
[1] 李志坤. 微拟球藻藻渣膳食纤维的制备及功能特性研究[D]. 镇江:江苏大学, 2022. [LI Z K. Study on preparation of dietary fiber from residue of Nannochloropsis and its functional properties[D]. Zhenjiang:Jiangsu University, 2022.] LI Z K. Study on preparation of dietary fiber from residue of Nannochloropsis and its functional properties[D]. Zhenjiang: Jiangsu University, 2022.
[2] 辛易燃, 尤升波, 武俊瑞, 等. 酶菌协同处理对微拟球藻营养功能成分及生物活性的影响[J]. 食品工业科技,2023,44(21):198−207. [XIN Y R, YOU S B, WU J R, et al. Effects of enzyme-microorganisms synergy treatment on nutrient functional components and biological activities of Nannochloropsis oceanica[J]. Science and Technology of Food Industry,2023,44(21):198−207.] XIN Y R, YOU S B, WU J R, et al. Effects of enzyme-microorganisms synergy treatment on nutrient functional components and biological activities of Nannochloropsis oceanica[J]. Science and Technology of Food Industry, 2023, 44(21): 198−207.
[3] 张元博, 田娇娇, 叶凌志, 等. 几种环境因子对微拟球藻营养物质积累的影响[J]. 核农学报, 2022, 36(6):1273−1283. [ZHANG Y B, TIAN J J, YE L Z, et al. Effects of several environmental factors on nutrient accumulations of Nannochloropsis oceanica[J]. Journal of Nuclear Agricultural Science, 2022, 36(6):1273−1283.] ZHANG Y B, TIAN J J, YE L Z, et al. Effects of several environmental factors on nutrient accumulations of Nannochloropsis oceanica[J]. Journal of Nuclear Agricultural Science, 2022, 36(6): 1273−1283.
[4] 梁鑫, 朱葆华, 杨官品, 等. 一株分离微拟球藻LAMB0002的鉴定[J]. 中国海洋大学学报,2014,44(7):39−45. [LIANG X, ZHU B H, YANG G P, et al. Isolation and identification of Nannochloropsis sp. LAMB0002[J]. Periodical of Ocean University of China,2014,44(7):39−45.] LIANG X, ZHU B H, YANG G P, et al. Isolation and identification of Nannochloropsis sp. LAMB0002[J]. Periodical of Ocean University of China, 2014, 44(7): 39−45.
[5] PHONG W N, SHOW P L, LING T C, et al. Mild cell disruption methods for bio-functional proteins recovery from microalgae-Recent developments and future perspectives[J]. Algal Research-Biomass Biofuels and Bioproducts,2018,31:506−516.
[6] GEADA P, MOREIRA C, SILVA M, et al. Algal proteins:Production strategies and nutritional and functional properties[J]. Bioresource Technology,2021,332:125125. doi: 10.1016/j.biortech.2021.125125
[7] 陈峰, 杨帅伶, 刘宾. 微藻蛋白质及其在食品中的应用研究进展[J]. 中国食品学报,2022,22(6):21−32. [CHEN F, YANG S L, LIU B. Microalgal protein and research progress on application in foods[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(6):21−32.] CHEN F, YANG S L, LIU B. Microalgal protein and research progress on application in foods[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(6): 21−32.
[8] EJIKE C, COLLINS S A, BALASURIYA N, et al. Prospects of microalgae proteins in producing peptide-based functional foods for promoting cardiovascular health[J]. Trends in Food Science & Technology,2017,59:30−36.
[9] 曾剑华, 杨杨, 石彦国, 等. 适度破碎微藻细胞释放功能性蛋白的技术研究进展[J]. 食品工业科技,2018,9(17):319−327, 334. [ZENG J H, YANG Y, SHI Y G, et al. Research progress on mild disruption technology of microalgae for functional protein releasing[J]. Science and Technology of Food Industry,2018,9(17):319−327, 334.] ZENG J H, YANG Y, SHI Y G, et al. Research progress on mild disruption technology of microalgae for functional protein releasing[J]. Science and Technology of Food Industry, 2018, 9(17): 319−327, 334.
[10] 陈艺煊. 微藻源活性肽对骨质疏松的改善作用及其机制研究[D]. 杭州:浙江大学, 2023. [CHEN Y X. The ameliorative effect of bioactive tides derived from microalgae mechanisms on osteoporosis and its mechanisms[D]. Hangzhou:Zhejiang University, 2023.] CHEN Y X. The ameliorative effect of bioactive tides derived from microalgae mechanisms on osteoporosis and its mechanisms[D]. Hangzhou: Zhejiang University, 2023.
[11] 赵康宇. 酶解破壁促进微拟球藻EPA脂质提取的研究[D]. 武汉:武汉轻工大学, 2022. [ZHAO K Y. Study on enzymatic treatment of Nannochloropsis sp. for promoting the extraction of EPA lipid[D]. Wuhan:Wuhan University of Light Industry, 2022.] ZHAO K Y. Study on enzymatic treatment of Nannochloropsis sp. for promoting the extraction of EPA lipid[D]. Wuhan: Wuhan University of Light Industry, 2022.
[12] DUPPETI H, MANJABHATTA S N, KEMPAIAH B B. Physicochemical, structural, functional and flavor adsorption proprties of white shrimp (Penaeus vannamei) proteins as affected by processing methods[J]. Food Research International,2023,163:112296. doi: 10.1016/j.foodres.2022.112296
[13] 李娜, 林海燕, 吕世伟, 等. 3种不同方式提取鳕鱼鱼鳔胶原蛋白与胶原蛋白肽的基本特性研究[J]. 中国海洋药物,2019,38(3):7−14. [LI N, LIN H Y, LÜ S W, et al. Characterization of three kinds of collagens and collagen peptides extracted from cod swim bladder[J]. Chinese Journal of Marine Drugs,2019,38(3):7−14.] LI N, LIN H Y, LÜ S W, et al. Characterization of three kinds of collagens and collagen peptides extracted from cod swim bladder[J]. Chinese Journal of Marine Drugs, 2019, 38(3): 7−14.
[14] DI Y, LI X, CHANG X W, et al. Impact of germination on structural, functional properties and in vitro protein digestibility of sesame (Sesamum indicum L.) protein[J]. LWT-Food Science and Technology,2022,154:112651. doi: 10.1016/j.lwt.2021.112651
[15] SHI R J, LI T, WANG K L, et al. Investigation of the consequences of ultrasound on the physicochemical, emulsification, and gelatinization characteristics of citric acid-treated whey protein isolate[J]. Journal of Dairy Science,2021,104(10):10628−10639. doi: 10.3168/jds.2021-20171
[16] TAO Y, WANG P, XU X L, et al. Effects of ultrasound treatment on the morphological characteristics, structures and emulsifying properties of genipin cross-linked myofibrillar protein[J]. Ultrasonics Sonochemistry,2023,97:106467. doi: 10.1016/j.ultsonch.2023.106467
[17] 贾明月, 贵香茹, 原秋艳, 等. 不同提取方式对金针菇菇脚蛋白性质的影响[J]. 食品工业科技,2024,45(8):119−126. [JIA M Y, GUI X R, YUAN Q Y, et al. Effect of different extraction methods on properties of flammulina velutipes stembase proteins[J]. Science and Technology of Food Industry,2024,45(8):119−126.] JIA M Y, GUI X R, YUAN Q Y, et al. Effect of different extraction methods on properties of flammulina velutipes stembase proteins[J]. Science and Technology of Food Industry, 2024, 45(8): 119−126.
[18] SIMAYI Z, AIERKEN W, ROZI P, et al. Optimization of ultrasound-assisted extraction, structural, functional, and antioxidant properties of Glycyrrhiza uralensis seed protein[J]. Process Biochemistry,2023,124:1−12. doi: 10.1016/j.procbio.2022.11.001
[19] LI X T, LUO T, WANG L F, et al Emulsifying properties of wheat germ protein:Effect of different ultrasonic treatment[J]. Ultrasonics Sonochemistry, 2023, 9:1064798.
[20] 李湘利, 刘静, 梁宝东, 等. 微波辅助碱溶酸沉法提取芡实蛋白的工艺优化及其抗氧化性[J]. 食品工业科技,2017,38(24):206−211. [LIU X L, LIU J, LIANG B D, et al. Optimization on microwave-assisted alkali-solution and acid-isolation extraction of protein from euryale ferox and its antioxidant activity[J]. Science and Technology of Food Industry,2017,38(24):206−211.] LIU X L, LIU J, LIANG B D, et al. Optimization on microwave-assisted alkali-solution and acid-isolation extraction of protein from euryale ferox and its antioxidant activity[J]. Science and Technology of Food Industry, 2017, 38(24): 206−211.
[21] 李思梦, 高风正, 曾名湧. 聚球藻7002藻蓝蛋白的分离纯化研究[J]. 食品工业科技,2016,37(23):96−102,108. [LI S M, GAO F Z, ZENG M Y. Study on extraction and purification of C-phycocyanin in Synechococcus sp. PCC 7002[J]. Science and Technology of Food Industry,2016,37(23):96−102,108.] LI S M, GAO F Z, ZENG M Y. Study on extraction and purification of C-phycocyanin in Synechococcus sp. PCC 7002[J]. Science and Technology of Food Industry, 2016, 37(23): 96−102,108.
[22] 商海军, 蒋丽君, 於春, 等. 酶法辅助提取藜麦秸秆蛋白工艺研究[J]. 安徽农业科学,2021,49(17):170−173. [SHANG H J, JIANG L J, YU C, et al. Study on the technology of extracting quinoa straw protein by enzymatic method[J]. Anhui Agric Scicence,2021,49(17):170−173.] SHANG H J, JIANG L J, YU C, et al. Study on the technology of extracting quinoa straw protein by enzymatic method[J]. Anhui Agric Scicence, 2021, 49(17): 170−173.
[23] HOU F R, DING W H, QU W J, et al. Alkali solution extraction of rice residue protein isolates:Influence of alkali concentration on protein functional, structural properties and lysinoalanine formation[J]. Food Chemistry,2017,218:207−215. doi: 10.1016/j.foodchem.2016.09.064
[24] 付丽霄, 冯潇, 汤晓智. 藜麦蛋白的提取、功能特性及改性方式研究进展[J]. 食品工业科技,2023,44(23):346−353. [FU L X, FENG X, TANG X Z. Research progress on extraction, functional properties and modification approach of Quinoa protein[J]. Science and Technology of Food Industry,2023,44(23):346−353.] FU L X, FENG X, TANG X Z. Research progress on extraction, functional properties and modification approach of Quinoa protein[J]. Science and Technology of Food Industry, 2023, 44(23): 346−353.
[25] 李娜. 鳕鱼鳔胶原蛋白和胶原肽特性及对细胞衰老进程干预作用与机制[D]. 上海:上海海洋大学, 2019. [LI N. Study on characteristics of collagen and collagen peptides in cod swim bladder and its effect and mechanism of intervention on cellular aging process[D]. Shanghai:Shanghai Ocean University, 2019.] LI N. Study on characteristics of collagen and collagen peptides in cod swim bladder and its effect and mechanism of intervention on cellular aging process[D]. Shanghai: Shanghai Ocean University, 2019.
[26] LI W, SU H N, PU Y, et al. Phycobiliproteins:Molecular structure, production, applications, and prospects[J]. Biotechnology Advances,2019,37(2):340−353. doi: 10.1016/j.biotechadv.2019.01.008
[27] 刘昱迪, 李佳美, 王坤华, 等. 元宝枫籽蛋白的营养性及理化性质[J]. 食品科学,2021,42(2):271−277. [LIU Y D, LI J M, WANG K H, et al. Nutritional and physicochemical properties of acer truncatum seed protein[J]. Food Science,2021,42(2):271−277.] LIU Y D, LI J M, WANG K H, et al. Nutritional and physicochemical properties of acer truncatum seed protein[J]. Food Science, 2021, 42(2): 271−277.
[28] 马德坤, 王汝华, 吕筱, 等. 亚麻籽蛋白特性及营养价值分析[J]. 食品科学,2022,43(6):257−264. [MA D K, WANG R H, LÜ X, et al. Physicochemical and functional properties and nutritional value of flaxseed protein[J]. Food Science,2022,43(6):257−264.] doi: 10.7506/spkx1002-6630-20210331-402 MA D K, WANG R H, LÜ X, et al. Physicochemical and functional properties and nutritional value of flaxseed protein[J]. Food Science, 2022, 43(6): 257−264. doi: 10.7506/spkx1002-6630-20210331-402
[29] 魏君慧, 薛媛, 冯莉, 等. 杏鲍菇分离蛋白和清蛋白的理化性质及功能分析[J]. 食品科学,2018,39(18):54−60. [WEI J H, XUE Y, FENG L, et al. Physicochemical and functional properties of pleurotus eryngii protein isolate and albumin[J]. Food Science,2018,39(18):54−60.] WEI J H, XUE Y, FENG L, et al. Physicochemical and functional properties of pleurotus eryngii protein isolate and albumin[J]. Food Science, 2018, 39(18): 54−60.
[30] LIU F F, LI Y Q, WANG C Y, et al. Physicochemical, functional and antioxidant properties of mung bean protein enzymatic hydrolysates[J]. Food Chemistry,2022,393:133397. doi: 10.1016/j.foodchem.2022.133397
[31] 郑文祺, 张颖, 莫海珍, 等. 两种工艺提取的白玉菇蛋白理化性能比较[J]. 食品工业科技,2023,44(16):70−80. [ZHENG W Q, ZHANG Y, MO H Z, et al. Comparison of physicochemical properties of white hypsizygus marmoreu protein extracted by two methods[J]. Science and Technology of Food Industry,2023,44(16):70−80.] ZHENG W Q, ZHANG Y, MO H Z, et al. Comparison of physicochemical properties of white hypsizygus marmoreu protein extracted by two methods[J]. Science and Technology of Food Industry, 2023, 44(16): 70−80.
[32] XIE D F, DENG F H, SHU J X, et al. Impact of the frying temperature on protein structures and physico-chemical characteristics of fried surimi[J]. International Journal of Food Science and Technology,2022,57(7):4211−4221. doi: 10.1111/ijfs.15741
[33] JIANG J, CHEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J]. Journal of Agricultural and Food Chemistry,2009,57(16):7576−7583. doi: 10.1021/jf901585n
[34] 孙佳悦, 钱方, 姜淑娟, 等. 基于红外光谱分析热处理对牛乳蛋白质二级结构的影响[J]. 食品科学,2017,38(23):82−86. [SUN J Y, QIAN F, JIANG S J, et al. Effect of heat treatments on the secondary structure of milk proteins analyzed by fourier transform infrared spectroscopy[J]. Food Science,2017,38(23):82−86.] SUN J Y, QIAN F, JIANG S J, et al. Effect of heat treatments on the secondary structure of milk proteins analyzed by fourier transform infrared spectroscopy[J]. Food Science, 2017, 38(23): 82−86.
[35] 吴晓娟, 王晓婵, 张佳妮, 等. pH值碱性偏移结合热处理对米糠蛋白结构和功能性质的影响[J]. 食品科学,2021,42(4):23−30. [WU X J, WANG X C, ZHANG J N, et al. Effect of alkaline pH-shifting combined with heat treatment on the structural and functional properties of rice bran protein[J]. Food Science,2021,42(4):23−30.] WU X J, WANG X C, ZHANG J N, et al. Effect of alkaline pH-shifting combined with heat treatment on the structural and functional properties of rice bran protein[J]. Food Science, 2021, 42(4): 23−30.
[36] 朱增芳. 蛋白质氧化对鹰嘴豆蛋白结构、理化性质及功能性的影响[D]. 石河子:石河子大学, 2021. [ZHU Z F. Effects of protein oxidation on structure, physicochemical properties and function of chickpea protein isolate[D]. Shihezi:Shihezi University, 2021.] ZHU Z F. Effects of protein oxidation on structure, physicochemical properties and function of chickpea protein isolate[D]. Shihezi: Shihezi University, 2021.
[37] JULAKANTI S, CHARLES A P R, ZHAO J, et al. Hempseed protein (Cannabis sativa L.):Influence of extraction pH and ball milling on physicochemical and functional properties[J]. Food Hydrocolloids,2023,143:108835. doi: 10.1016/j.foodhyd.2023.108835
[38] DE SOUZA T S P, DIAS F F G, KOBLITZ M G B, et al. Effects of enzymatic extraction of oil and protein from almond cake on the physicochemical and functional properties of protein extracts[J]. Food and Bioproducts Processing,2020,122:280−290. doi: 10.1016/j.fbp.2020.06.002
[39] 李琦, 葛思彤, 张士禹, 等. 玉米后熟期间醇溶蛋白结构和理化特性[J]. 食品科学,2022,43(18):16−23. [LI Q, GE S T, ZHANG S Y, et al. Structure and physicochemical properties of zein during postharvest ripening of corn[J]. Food Science,2022,43(18):16−23.] doi: 10.7506/spkx1002-6630-20211108-088 LI Q, GE S T, ZHANG S Y, et al. Structure and physicochemical properties of zein during postharvest ripening of corn[J]. Food Science, 2022, 43(18): 16−23. doi: 10.7506/spkx1002-6630-20211108-088
[40] 曹迪, 范远景, 黄婷, 等. 不同改性方法对花生浓缩蛋白结构及功能特性的影响[J]. 食品工业,2014,35(10):186−190. [CAO Di, FAN Yuanjing, HUANG Ting, et al. Effects of modified methods on conformational and functional properties of peanut protein concentratrate[J]. Food Industry,2014,35(10):186−190.] CAO Di, FAN Yuanjing, HUANG Ting, et al. Effects of modified methods on conformational and functional properties of peanut protein concentratrate[J]. Food Industry, 2014, 35(10): 186−190.
[41] TANG C H, TEN Z, WANG X S, et al. Physicochemical and functional properties of hemp (Cannabis sativa L.) protein isolate[J]. Journal of Agricultural and Food Chemistry,2006,54(23):8945−8950.
[42] 张舒, 王长远, 盛亚男, 等. 加工方式对绿豆蛋白亚基和功能性质的影响[J]. 食品科学,2019,40(19):113−119. [ZHANG S, WANG C Y, SHENG Y N, et al. Effects of processing methods on structure and functional properties of mung bean protein[J]. Food Science,2019,40(19):113−119.] doi: 10.7506/spkx1002-6630-20190307-098 ZHANG S, WANG C Y, SHENG Y N, et al. Effects of processing methods on structure and functional properties of mung bean protein[J]. Food Science, 2019, 40(19): 113−119. doi: 10.7506/spkx1002-6630-20190307-098
[43] JIANG Y, ZHU Y, ZHENG Y, et al. Effects of salting-in/out-assisted extractions on structural, physicochemical and functional properties of Tenebrio molitor larvae isolates[J]. Food Chemistry,2021,338:128158. doi: 10.1016/j.foodchem.2020.128158
[44] 许英一, 徐艳霞, 王宇. 不同方式提取的燕麦蛋白功能特性比较[J]. 食品与机械,2018,34(3):166−169. [XU Y Y, XU Y X, WANG Y. Comparison on functional properties of oat protein extracted from different ways[J]. Food and Machinery,2018,34(3):166−169.] XU Y Y, XU Y X, WANG Y. Comparison on functional properties of oat protein extracted from different ways[J]. Food and Machinery, 2018, 34(3): 166−169.
[45] 商海军, 蒋丽君, 江本利, 等. 藜麦秸秆蛋白的结构和功能性质[J]. 食品研究与开发,2022,43(17):49−56. [SHANG H J, JIANG L J, JIANG B L, et al. Structural and functional characteristics of proteins in quinoa straw[J]. Food Research and Development,2022,43(17):49−56.] SHANG H J, JIANG L J, JIANG B L, et al. Structural and functional characteristics of proteins in quinoa straw[J]. Food Research and Development, 2022, 43(17): 49−56.
[46] 刘家希, 王钰琦, 曾怡欣, 等. 超声辅助碱法提取热稳定米糠蛋白及其功能特性研究[J]. 粮食与油脂,2022,35(11):40−43,47. [LIU J X, WANG Y Q, ZENG Y X, et al. Extraction of heat-stabilized rice bran protein by ultrasonic assisted alkali and its functional properties[J]. Grains and Fats,2022,35(11):40−43,47.] doi: 10.3969/j.issn.1008-9578.2022.11.008 LIU J X, WANG Y Q, ZENG Y X, et al. Extraction of heat-stabilized rice bran protein by ultrasonic assisted alkali and its functional properties[J]. Grains and Fats, 2022, 35(11): 40−43,47. doi: 10.3969/j.issn.1008-9578.2022.11.008
[47] HU H, ECY L C, WAN L, et al. The effect of high intensity ultrasonic pre-treatment on the properties of soybean protein isolate gel induced by calcium sulfate[J]. Food Hydrocolloids,2013,32(2):303−311. doi: 10.1016/j.foodhyd.2013.01.016
[48] OGUNBUSOLA E M, ALABI O O, ARAOYE K T, et al. Impact of extraction methods on the quality, physicochemical, and functional properties of white melon (Cucumeropsis mannii) seed protein concentrates[J]. Food Chemistry Advances,2022,1:100131. doi: 10.1016/j.focha.2022.100131
[49] 代晹鑫, 徐莹, 毕爽, 等. 核桃粕蛋白提取纯化工艺优化及其功能性质分析[J]. 食品工业科技,2023,44(2):241−252. [DAI Y X, XU Y, BI S, et al. Extraction and purification process optimization and functional properties analysis of walnut meal protein[J]. Science and Technology of Food Industry,2023,44(2):241−252.] DAI Y X, XU Y, BI S, et al. Extraction and purification process optimization and functional properties analysis of walnut meal protein[J]. Science and Technology of Food Industry, 2023, 44(2): 241−252.
[50] 王鑫. 反复冻融对鳞杯伞可溶性蛋白结构、加工特性及消化特性的影响[D]. 晋中:山西农业大学, 2022. [WANG X. Effects of repeated freezing and thawing on the structure, processing and digestion characteristics of soluble protein in Clitocybe squamulose[D]. Jinzhong:Shanxi Agricultural University, 2022.] WANG X. Effects of repeated freezing and thawing on the structure, processing and digestion characteristics of soluble protein in Clitocybe squamulose[D]. Jinzhong: Shanxi Agricultural University, 2022.
[51] 吕静, 杨洁茹, 李坤, 等. 不同提取工艺对油茶籽粕蛋白质结构及功能特性的影响[J]. 食品工业科技,2023,44(14):102−110. [LÜ J, YANG J R, LI K, et al. Effects of different extraction processes on the structure and functional properties of camellia seeds protein[J]. Science and Technology of Food Industry,2023,44(14):102−110.] LÜ J, YANG J R, LI K, et al. Effects of different extraction processes on the structure and functional properties of camellia seeds protein[J]. Science and Technology of Food Industry, 2023, 44(14): 102−110.
[52] GROSSMANN L, HINRICHS J, WEISS J. Solubility of extracted proteins from Chlorella sorokiniana, Phaeodactylum tricornutum, and Nannochloropsis oceanica:Impact of pH-value[J]. LWT,2019,105:408−416. doi: 10.1016/j.lwt.2019.01.040





 下载:
下载:



 下载:
下载:



