Optimization of the Extraction Process and in Vitro Antioxidant and Hypolipidemic Activities of Polysaccharides from Sophora flavescens
-
摘要: 目的:为提高苦参多糖的得率,明确多糖的抗氧化和降血脂活性,通过正交试验优化多糖的提取工艺,并评价其体外抗氧化和降血脂活性。方法:以多糖得率为评价指标,在单因素实验研究提取温度、提取次数、料液比和提取时间对苦参多糖得率影响的基础上,通过正交试验优化多糖的提取工艺。通过对DPPH自由基、羟基自由基和超氧阴离子自由基的清除作用评价多糖的体外抗氧化活性,通过与胆酸钠 (SC)、牛磺胆酸钠 (STC)、甘氨胆酸钠 (SGC) 和混合胆酸盐 (MBS)的结合作用评价多糖的体外降血脂活性。结果:苦参多糖的最佳提取条件为:温度85 ℃,料液比1:35 (g:mL),提取时间3.5 h,在此条件下多糖平均得率为3.07%±0.07%。苦参多糖在浓度为5 mg/mL时对DPPH自由基、羟基自由基和超氧阴离子自由基的清除率分别为60.1%±3.6%、39.6%±3.1%和45.1%±4.1%;在浓度为10 mg/mL时与胆酸钠 (SC)、牛磺胆酸钠 (STC)、甘氨胆酸钠 (SGC) 和混合胆酸盐 (MBS) 的结合率分别为34.4%±0.75%、45.4%±0.15%、19.7%±0.94%和37.7%±0.64%。结论:苦参多糖具有较好的体外抗氧化和降血脂活性。本研究为苦参多糖的开发利用提供了一定的理论依据。Abstract: Objective: To increase the yield of Sophora flavescens polysaccharides and elucidate their antioxidant and hypolipidemic properties, this study optimised the polysaccharide extraction process through orthogonal experiments, followed by evaluation of their antioxidant and hypolipidemic activities in vitro. Methods: Using polysaccharide yield as the primary metric, this study performed orthogonal experiments to optimise the extraction process, building on preliminary one-way experiments. This study investigated the effect of extraction temperature, number of extractions, material-liquid ratio and extraction time on the polysaccharide yield of Sophora flavescens. Furthermore, this study evaluated the in vitro antioxidant activity of the polysaccharides by investigating their scavenging potential against DPPH radicals, hydroxyl radicals and superoxide anion radicals. In addition, the in vitro hypolipidemic activity of the polysaccharides was evaluated by their binding affinity to sodium cholate (SC), sodium taurocholate (STC), sodium glycylcholate (SGC) and mixed bile salts (MBS). Results: The optimal conditions for the extraction of Sophora flavescens polysaccharide were determined as follows: a temperature of 85 ℃, a material-liquid ratio of 1:35 (g:mL), and an extraction duration of 3.5 hours, yielding an average polysaccharide content of 3.07%±0.07%. The scavenging efficiencies of Sophora flavescens polysaccharides against DPPH radicals, hydroxyl radicals, and superoxide anion radicals at a concentration of 5 mg/mL were measured at 60.1%±3.6%, 39.6%±3.1% and 45.1%±4.1%, respectively. Furthermore, the binding affinities of Sophora flavescens polysaccharides to SC, STC, SGC and MBS at a concentration of 10 mg/mL were determined to be 34.4%±0.75%, 45.4%±0.15%, 19.7%±0.94% and 37.7%±0.64%, respectively. Conclusion: Sophora flavescens polysaccharide exhibits notable in vitro antioxidant and hypolipidemic activities. This investigation furnishes a foundational understanding for the potential development and exploitation of Sophora flavescens polysaccharide.
-
苦参 (Sophora flavescens Ait.),豆科植物,是一种灌木,分布于东亚和一些欧洲国家,因为它具有潜在的健康益处,如抗炎、抗哮喘、驱虫、清除自由基和抗菌等活性,一直被用作草药和功能性食品配料[1]。多糖是一种多功能的天然成分,具有较大的相对分子质量[2]。目前,已从植物的根、茎、叶、花以及果实等组织中分离得到多种不同活性的多糖。植物多糖不仅具有低毒副作用,且对于改善人体健康和治疗疾病具有极大潜力[3]。多糖具有多种独特的生物活性,是维持生命活性的重要物质之一[4]。大量研究表明植物多糖具有抗氧化、抗炎、调节免疫和降血脂等生理功效[5]。因此,从植物中探寻具有生物活性的多糖类化合物是近些年科研工作者聚焦的热门研究方向。本研究以苦参根部为原料提取苦参多糖,评价其体外抗氧化和降血脂活性。
对于苦参多糖的研究已有相关报道。陈彦旭等[6]经过水煎、醇沉、透析获得苦参多糖,采用测定小鼠脾淋巴细胞增殖和IFN-γ分泌,以及腹腔巨噬细胞分泌TNF-α评价了苦参多糖的免疫活性。Li等[7]采用热水提取法提取了苦参多糖并使用RAW264.7细胞研究了苦参多糖的抗炎活性。王迎进等[8]采用水提醇沉法获得苦参多糖,并考察了苦参多糖的体外抗氧化活性。这些研究表明苦参多糖具有多种生物活性,有进一步深入研究和开发的前景。
多糖的活性与其结构密切相关,而其结构如单糖组成、分子量及分布等又与提取条件有关。目前研究中常采用的多糖提取方法主要有热水提取法、酸碱提取法、酶提取法、超声波辅助和微波辅助提取等[9]。随着研究的深入,超临界流体萃取法、超高压提取法、高压脉冲电场提取技术等方法也用于多糖的提取,但不同提取方法对多糖的产量、理化性质和生物活性有直接影响,选择合适的提取方法是多糖制备的关键。如何快速获得多糖,提高多糖的得率成为苦参多糖研究过程中需要解决的问题之一。本文在考察单因素对苦参多糖提取影响的基础上,采用正交试验优化多糖提取工艺,并评价其体外抗氧化及降血脂活性,为苦参多糖的进一步开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
苦参根部切片 北京同仁堂 (集团) 有限责任公司;乙腈 色谱纯,上海吉至生化科技有限公司;单糖标准品 (阿拉伯糖、半乳糖、甘露糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、岩藻糖、氨基半乳糖、氨基葡萄糖和葡萄糖) 分析纯,美国Sigma-Aldrich公司;磷酸二氢钾、硫酸钠 分析纯,国药集团化学试剂有限公司;牛血清白蛋白 (BSA) 分析纯,赛宝生物有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、1-苯基-3-甲基-5-吡唑啉酮 (PMP) 分析纯,北京索莱宝科技有限公司;其它化学试剂 均为国产分析纯。
BJ-800A型多功能粉碎机 浙江拜杰实验仪器公司;DHG-9030A型恒温电热鼓风干燥箱 上海精宏实验仪器厂;B220型恒温水浴锅 上海亚荣生化仪器厂;AB104-N型分析天平 梅特勒-托利多仪器公司;LC-20AD型岛津高效液相色谱仪 岛津企业管理(中国)有限公司;RE-52AA型旋转蒸发仪 上海叶拓科技有限公司;YTLG-12D-80型冷冻干燥机、YTUP-15型超纯水仪 上海叶拓科技有限公司;TG16-WS型低速大容量离心机 长沙湘仪离心机仪器公司;UV754N型紫外分光光度计 上海佑科仪器仪表有限公司;Nexus670型红外光谱仪 美国尼高力公司;Thremo-Fisher C18色谱柱(150 mm×4.6 mm, 5 μm) 美国Thermo-Fisher;Shodex OHpak SB-804 HQ色谱柱 (8.03 mm×300 mm, 10 μm) 日本昭和电工。
1.2 实验方法
1.2.1 苦参药材处理
将苦参在干燥箱中50 ℃干燥后,粉碎并过80目筛,使用80%乙醇按料液比1:8 (g:mL),80 ℃水浴搅拌脱脂4 h,过滤保留药材,脱脂6次,将脱脂后的苦参药材粉末置于干燥箱50 ℃干燥后备用。
1.2.2 苦参多糖提取单因素实验
1.2.2.1 提取温度对多糖得率的影响
分别称取0.5 g脱脂后的苦参药材粉末分别于5个50 mL离心管中,加入15 mL蒸馏水,分别在50、60、70、80、90 ℃水浴下提取3 h,提取3次,合并提取液,浓缩备用。
1.2.2.2 提取次数对多糖得率的影响
分别称取0.5 g脱脂后的苦参药材粉末分别于5个50 mL离心管中,加入15 mL蒸馏水,在80 ℃水浴下提取3 h,分别提取1、2、3、4、5次,合并提取液,浓缩备用。
1.2.2.3 料液比对多糖得率的影响
分别称取0.5 g脱脂后的苦参药材粉末分别于5个50 mL离心管中,按料液比1:10、1:20、1:30、1:40、1:50 (g:mL) 加入对应体积的蒸馏水,在80 ℃水浴下各提取3 h,提取3次,合并提取液,浓缩备用。
1.2.2.4 提取时间对多糖得率的影响
分别称取0.5 g脱脂后的苦参药材粉末于5个50 mL离心管中,加入15 mL蒸馏水,在80 ℃水浴下,分别提取1、2、3、4、5 h,各提取3次,合并提取液,浓缩备用。
各条件下浓缩液按照体积比1:4 (V浓缩液:V乙醇) 加入无水乙醇醇沉,4500 r/min离心10 min后收集沉淀,经干燥后配制成1 mg/mL水溶液,用苯酚-硫酸法测定总糖含量,根据公式(1)计算多糖得率。
(1) 1.2.3 正交试验
根据单因素实验结果,设计正交试验因素水平,如表1所示。
表 1 正交试验因素水平Table 1. Factors and levels for orthogonal experiments水平 因素 A 时间 (h) B 温度 (℃) C 料液比 (g:mL) 1 2.5 75 1:25 2 3.0 80 1:30 3 3.5 85 1:35 1.2.4 苦参多糖的提取及理化性质分析
1.2.4.1 苦参多糖的提取
根据正交试验获得的最佳工艺条件提取多糖,提取液浓缩后加入4倍体积无水乙醇,过夜后4500 r/min离心10 min收集沉淀,沉淀溶于水后用蒸馏水透析48 h (透析袋截留分子量为7000 Da),每隔6 h换一次水,透析内液经过浓缩、冷冻干燥后得苦参多糖,并测定多糖总糖和蛋白质含量。
1.2.4.2 蛋白质含量测定
以BSA为标准品,采用考马斯亮蓝法[10]测定蛋白质含量。分别配制0.01、0.02、0.04、0.06、0.08、0.1 mg/mL标准BSA溶液,取1 mL加入试管中,再加考马斯亮蓝G-250溶液5 mL,30 ℃恒温水浴30 min,冷却后用紫外分光光度计在595 nm处测其吸光度值。以BSA浓度 (mg/mL) 为横坐标,吸光度为纵坐标绘制标准曲线,根据牛血清蛋白 (BSA) 线性回归方程y=6.18x+0.0303 (R2=0.9984) 计算苦参多糖的蛋白质含量。
1.2.4.3 总糖含量测定
采用苯酚-硫酸法[11]测定总糖含量,分别配制20、40、60、80和100 μg/mL的葡萄糖标准品溶液,各取1 mL于试管中,再加入0.5 mL 6%苯酚溶液,摇匀,最后加入5 mL浓硫酸,沸水浴10 min,冷却至室温后在490 nm波长处测定吸光度,以葡萄糖浓度 (μg/mL) 为横坐标,吸光度为纵坐标绘制标准曲线,根据葡萄糖线性回归方程y=9.2583x+0.0422 (R2=0.9986) 计算苦参多糖的总糖含量。
1.2.4.4 红外光谱分析
根据常雪花等[12]的方法并做修改,将干燥后的苦参多糖与KBr晶体1:100混合充分研磨,压制成片,置于红外光谱分析仪中在4000~400 cm−1范围扫描,记录光谱图。
1.2.4.5 紫外-可见光谱分析
根据杨建安等[13]的方法,将0.1 mg/mL的苦参多糖用紫外-可见光分光光度计于200~800 nm进行全波长扫描,记录光谱图,蒸馏水作为对照。
1.2.4.6 单糖组成分析
多糖降解:称取1~2 mg苦参多糖于安瓿瓶中,加入200 µL水充分溶解后加200 µL 4 mol/L三氟乙酸 (TFA) 混匀,封口,105 ℃降解6 h,水解液用氮吹仪吹干,加入400 µL甲醇,氮吹仪吹干,重复3次,除去TFA,备用[14]。
PMP衍生:水解样品加入100 µL超纯水溶解后加入100 µL 0.3 mol/L的NaOH混匀,加入120 µL 0.5 mol/L PMP的甲醇溶液,70 ℃避光水浴衍生60 min,后加入100 µL 0.3 mol/L的HCl中和,反应液用氯仿萃取5次,除去未反应的PMP,过0.22 µm微孔滤膜后用HPLC分析。单糖标准品按照同样的方法衍生、处理。
色谱分析条件:以磷酸盐缓冲液:乙腈=83:17 (v/v) 作为流动相,使用Thremo-Fisher C18柱,进样量20 µL,柱温30 ℃,流速1 mL/min,紫外检测器245 nm在线检测,根据已知单糖标准品的出峰时间确定样品中单糖的种类,根据峰面积计算单糖的相对摩尔比[15]。
1.2.5 苦参多糖的抗氧化活性评价
1.2.5.1 DPPH自由基清除活性
将苦参多糖和VC分别配制成不同质量浓度 (0.001~5 mg/mL) 的水溶液。取1 mL样品与1 mL 2×10−4 mmoL/L的DPPH乙醇溶液混匀,室温避光静置30 min,将反应液加入酶标板,用酶标仪在517 nm处测定吸光值,每组实验重复3次[16]。
1.2.5.2 羟基自由基清除活性
将苦参多糖和VC分别配制成不同质量浓度 (0.001~5 mg/mL) 的多糖水溶液。分别取1 mL样品溶液依次加入1 mL 9 mmol/L水杨酸溶液,1 mL 0.05 mol/L FeSO4和1 mL 8.8 mmol/L的H2O2混合均匀后,37 ℃恒温水浴30 min后,在510 nm处测定吸光值。每组实验重复3次[17]。
1.2.5.3 超氧阴离子清除活性
将苦参多糖和VC分别配制成不同质量浓度 (0.001~5 mg/mL) 的水溶液。取1 mL 50 mmol/L的Tirs-HCl (pH-8.0) 溶液,加200 μL的样品溶液,37 ℃水浴20 min后加入已预热的50 mmol/L邻苯三酚200 μL,混合均匀反应4 min,最后加入100 μL浓盐酸终止反应,在320 nm处测定吸光值,每组实验重复3次[18]。
根据公式(2)计算多糖对三种自由基的清除率。
(2) 式中,OD对照为未加入多糖的反应液吸光值;OD样品为加入样品后反应液的吸光值。
1.2.6 苦参多糖体外降血脂活性评价
参考杨丰榕等[19]的方法并做修改。
1.2.6.1 标准曲线绘制
配制模拟人体胃肠道环境的人工胃液和人工肠液。用0.05 mol/L pH 6.8的磷酸缓冲液分别配制浓度为0.1、0.2、0.3、0.4和0.5 mmol/L的胆酸钠 (SC)、牛磺胆酸钠 (STC)、甘氨胆酸钠 (SGC) 和混合胆酸盐 (三种胆酸钠等体积混合MBS) 标准溶液,加入质量分数为60%的硫酸溶液7.5 mL,混匀,70 ℃水浴加热20 min后迅速冰浴5 min,紫外可见分光光度法于387 nm波长处测定吸光度值,以胆酸盐浓度为横坐标,吸光值为纵坐标,绘制标准曲线。胆酸钠 (SC)、牛磺胆酸钠 (STC)、甘氨胆酸钠 (SGC) 和混合胆酸盐 (MBS) 的线性回归方程分别为:ySC=0.695x+0.1329 (R2=0.9971),ySTC=1.362x+0.123 (R2=0.9964),ySGC=0.659x+0.1243 (R²=0.9976),yMBS=0.863x+0.1409 (R2=0.9965),在0.1~0.5 mmol/L线性范围内各胆酸盐浓度 (x) 与吸光值 (y) 线性关系良好,可根据以上回归方程计算对应胆酸盐的含量。
1.2.6.2 胆酸盐结合实验
分别取1 mL浓度为2、4、6、8和10 mg/mL的苦参多糖水溶液于具塞试管中,加入1 mL人工胃液37 ℃恒温振荡消化1 h。调节pH至6.8,加入4 mL人工肠液,37 ℃恒温振荡消化1 h后加入4 mL1.0 mmol/L的胆酸盐溶液,37 ℃恒温振荡1 h,4000 r/min离心20 min后取2.5 mL上清液,加入质量分数为60%的硫酸溶液7.5 mL,混匀,70 ℃水浴加热20 min,迅速冰浴5 min,在387 nm波长处测定吸光值。根据相应标准曲线,计算上清液中胆酸盐含量,即为未结合胆酸盐含量,结合率根据公式(3)计算。
(3) 式中,A0:胆酸盐加入量,mmol/L;A1:胆酸盐剩余量,mmol/L。
1.3 数据处理
使用软件SPSS Statistics 26对数据通过单因素方差分析 (ANOVE) 和Duncan多重比 较确定显著性差异 (P<0.05),Origin Pro2021软件作图,所有试验均重复3次,用平均值±标准偏差表示,P<0.05表示具有显著性差异。
2. 结果与分析
2.1 单因素实验结果
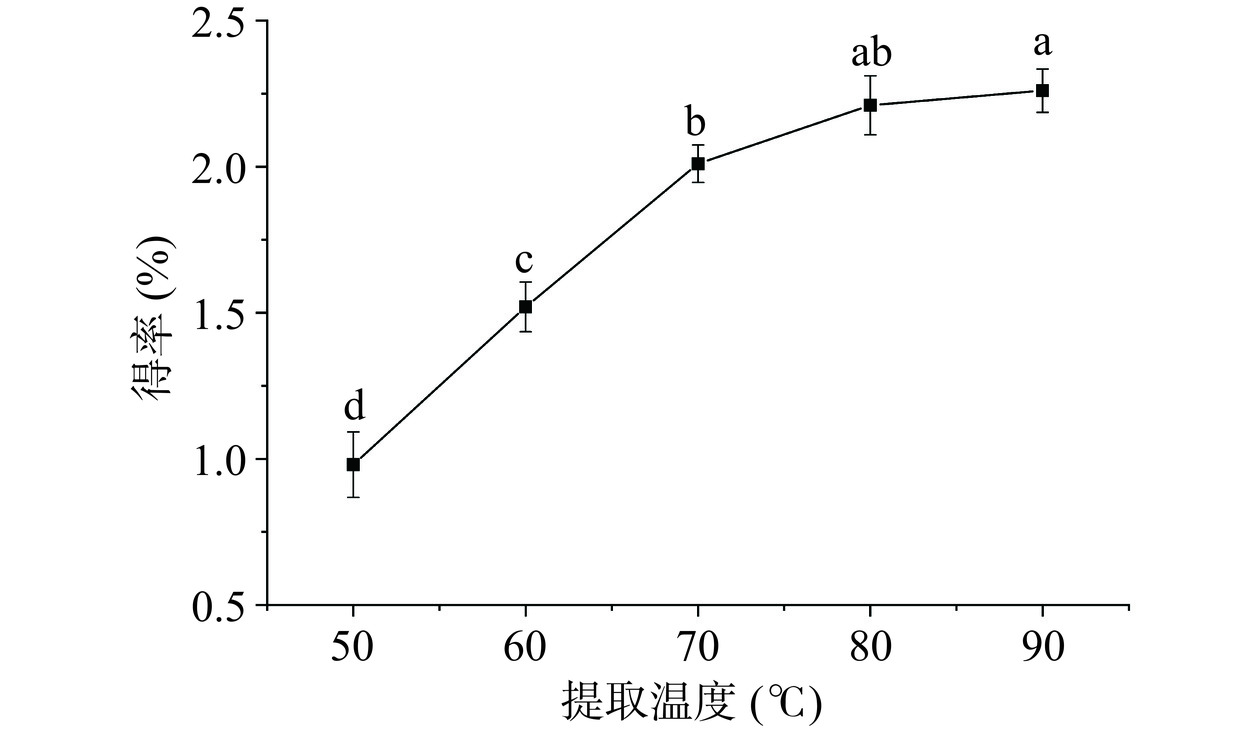
2.1.1 提取温度对多糖得率的影响
从图1可知,多糖得率随着提取温度的不断升高明显提高,当温度达到90 ℃时,得率达到2.26%,当温度大于80 ℃时,多糖得率随温度升高增加不显著 (P>0.05)。分析原因可能是随着温度的升高,溶剂的渗透能力和溶解能力随之提高,多糖分子运动加快,有利于多糖从细胞结构内部溶解析出,但温度过高,料液中多糖分子受到破坏,导致部分多糖分解,使多糖得率不再升高或者降低[20]。故选用80 ℃为后续正交试验工艺优化的中心值。
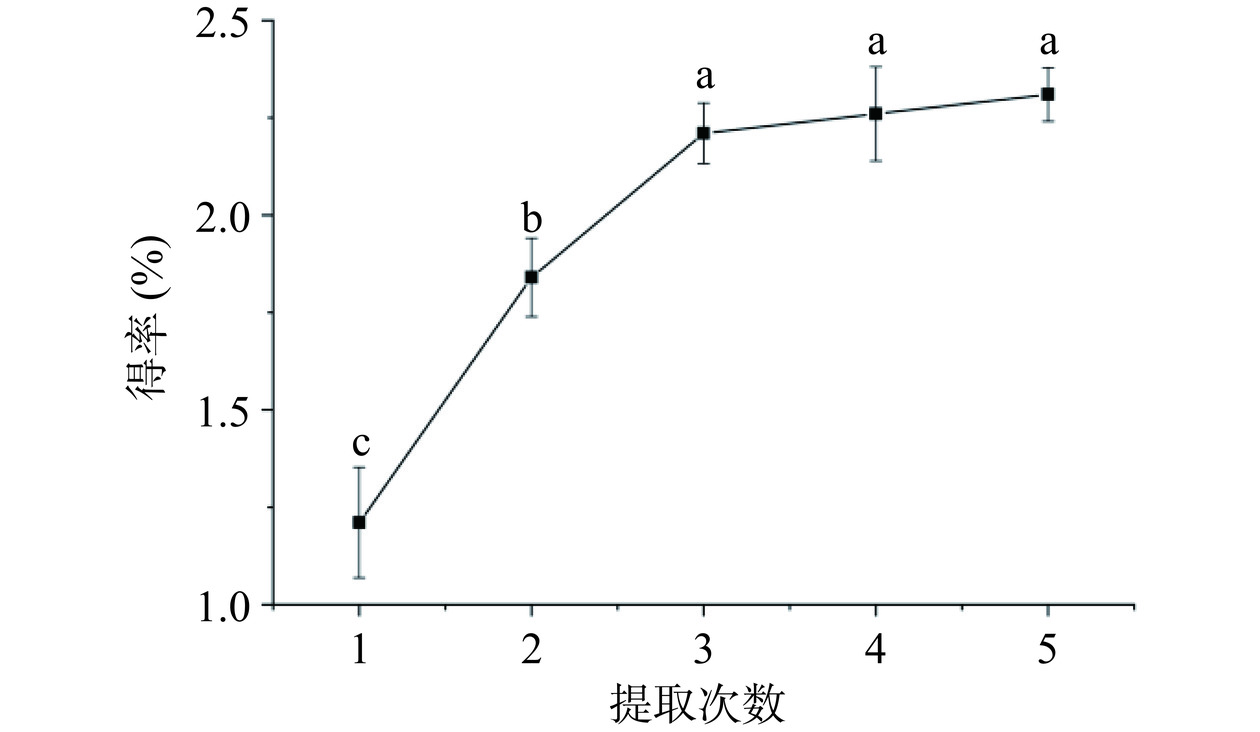
2.1.2 提取次数对多糖得率的影响结果分析
从图2可知,随着提取次数的不断增加,多糖得率明显提高,当提取次数达到5次时,多糖得率达到2.31%,当提取次数大于3次后,多糖得率随提取次数增加提高不显著 (P>0.05)。分析原因,随着提取次数的增加,样品中的多糖逐渐被充分提出,当提取次数达到3次后,样品中的多糖提取完全导致后续多糖得率不再显著提高。结合经济成本和实际情况,选用3次为最优提取次数。
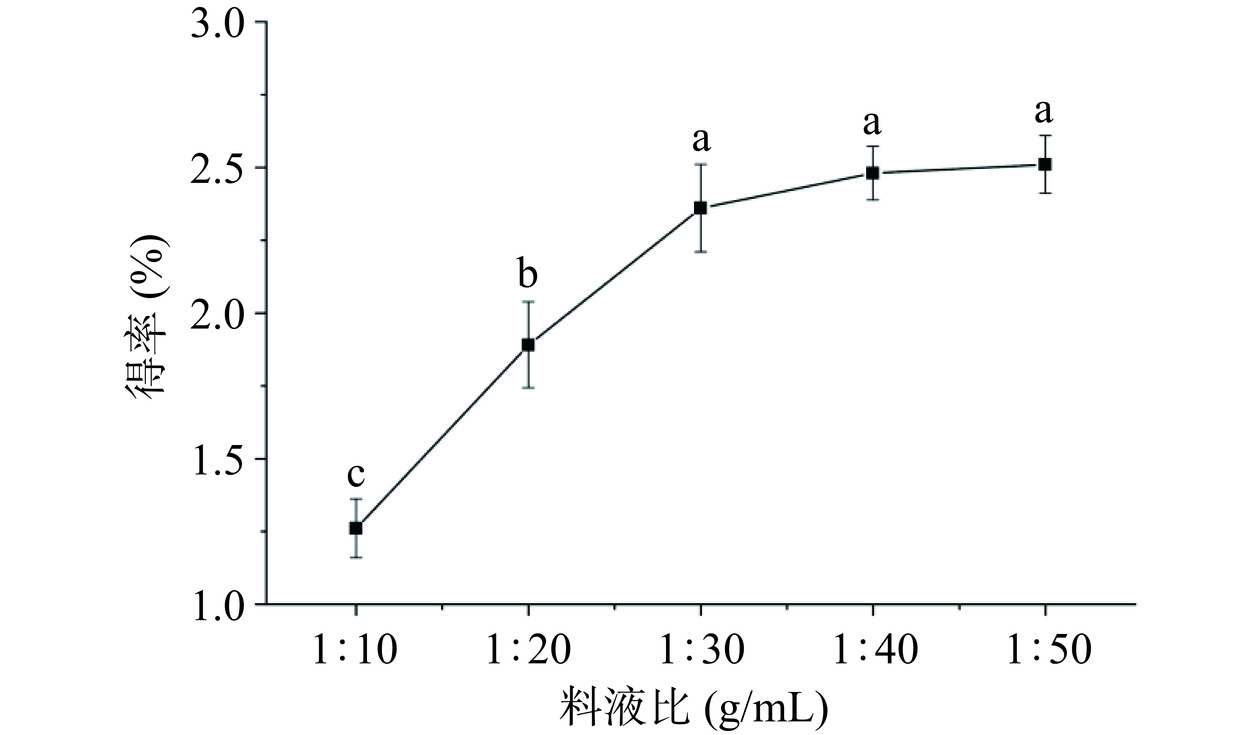
2.1.3 料液比对多糖得率的影响结果分析
从图3可知,多糖得率随着料液比的增加不断提高,当料液比达到1:40时,多糖得率达到2.51%,当料液比大于1:30时,多糖得率随料液比增加变化不显著(P>0.05)。分析原因,在热量一定情况下,固相与液相之间存在浓度差,溶剂量越多,细胞内外多糖浓度梯度就越大,使多糖扩散到溶剂里的含量增加,但随着溶剂量继续增大,苦参多糖和水分子的吸附作用形成的水合胶体逐渐增多而达到一种动态平衡而不再增加,且随着溶剂的增加,其他一些非多糖物质在溶剂中的溶解度也可能增加,这些因素可能导致了多糖的得率不再升高[20]。结合经济成本和实际情况,选用1:30作为后续正交试验工艺优化的中心值。
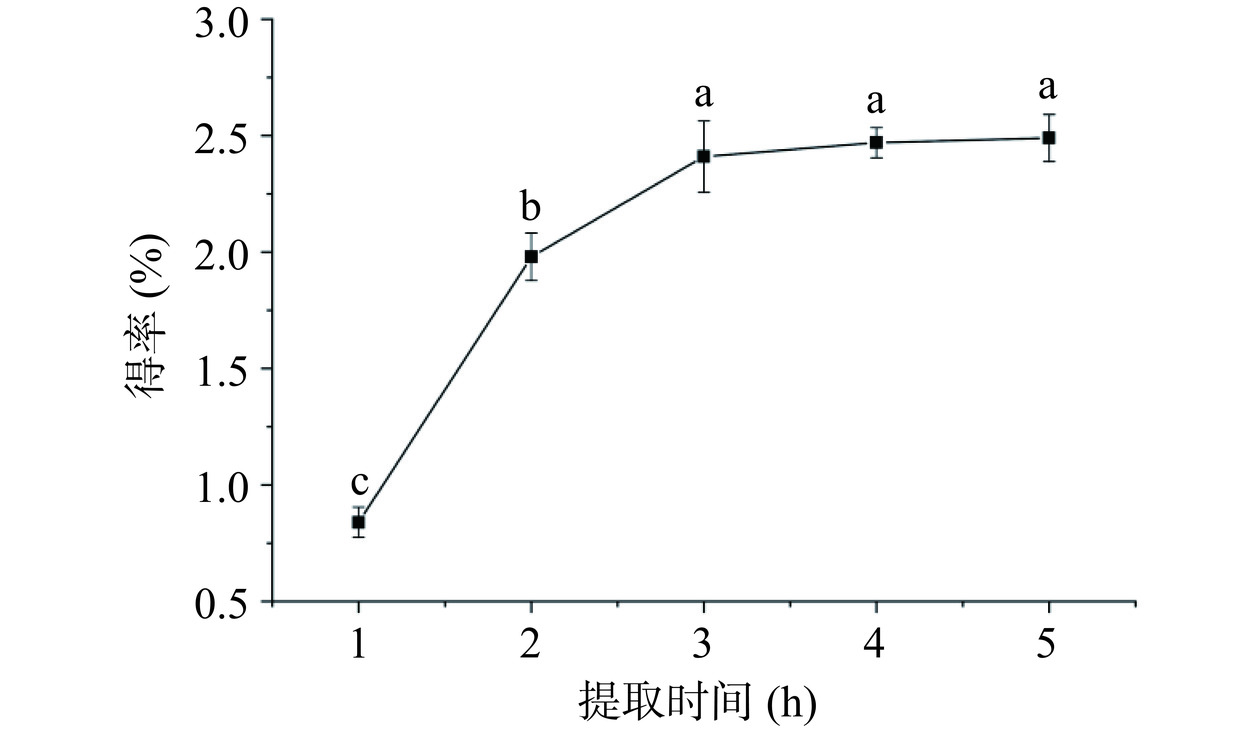
2.1.4 提取时间对多糖得率的影响结果分析
从图4可知,多糖得率随着提取时间的延长不断提高,当提取时间达到5 h时,多糖得率达到2.48%,当提取时间大于3 h时,多糖得率随提取时间的延长提高幅度不显著(P>0.05)。分析原因:提取时间较短时,产物不能充分溶解,但时间过长,多糖稳定性下降,结构部分易被破坏,影响提取效果,导致多糖得率不再升高[20]。结合经济效益和实际情况,选用3 h作为后续正交试验工艺优化的中心值。
2.2 正交试验
2.2.1 正交试验结果分析
根据单因素实验结果,采用标准L9(34) 正交试验设计进行多糖提取工艺优化[21],选取影响苦参多糖得率的料液比、温度和时间三个因素,提取次数固定为3次,正交试验和方差分析结果见表2和表3。
表 2 正交试验及结果Table 2. Orthogonal experiment and results序号 因素 A B C D (空白列) 多糖得率 (%) 1 1 1 1 1 1.57±0.04 2 1 2 2 2 2.24±0..08 3 1 3 3 3 3.01±0.03 4 2 1 2 3 1.32±0.09 5 2 2 3 1 2.46±0.11 6 2 3 1 2 2.24±0.06 7 3 1 3 2 2.13±0.04 8 3 2 1 3 2.54±0.09 9 3 3 2 1 2.64±0.12 K1 6.82 5.02 6.35 6.67 K2 6.02 7.24 6.20 6.61 K3 7.31 7.89 7.60 6.87 k1 2.27 1.67 2.12 2.22 k2 2.01 2.41 2.07 2.20 k3 2.44 2.63 2.53 2.29 R 0.43 0.96 0.47 0.09 B>C>A 表 3 方差分析结果Table 3. Analysis of variance results来源 III类平方和 自由度 均方 F 显著性 修正模型 2.186 6 0.3644 58.984 0.0168 截距 45.114 1 45.1136 7302.563 0.0001 A 0.283 2 0.1413 22.879 0.0419 B 1.510 2 0.7549 122.192 0.0081 C 0.394 2 0.1969 31.879 0.0304 误差 0.012 2 0.0062 总计 47.312 9 修正后总计 2.199 8 注:R2 =0.994 (调整后R2=0.978)。 从表2正交试验结果极差分析可以看出,3个提取因素对得率影响的顺序为B>C>A,即温度对得率的影响最大,其次是提取料液比和提取时间,最佳提取条件为A3B3C3,即提取时间3.5 h,温度85 ℃,料液比为1:35 (g:mL)。
回归模型方差分析结果如表3所示,模型F值为58.948远大于4,P<0.05,说明该模型设置合理,可以预测提取温度、时间和料液比对多糖得率的影响。模型决定系数R2=0.994 (调整后R2=0.978),说明模型预测值与试验值相关性较好[22]。通过比较提取温度、时间和料液比的F值可知,三个因素对多糖得率的影响主次顺序,温度>料液比>时间,这与正交试验计算结果一致,且提取温度对苦参多糖得率的影响具有显著性差异。
2.2.2 工艺验证实验
在最佳提取工艺条件下,重复3次进行工艺验证,并计算出苦参多糖得率。三次验证的苦参多糖得率分别为2.98%,3.15%和3.09%,平均得率为3.07%±0.07%,与单因素实验相比,多糖得率有所提高;与Bai等[1]通过水提醇沉得到的苦参多糖得率(2.5%)比较,本工艺得到苦参多糖的得率明显提高,说明工艺优化成功,同时该提取条件具有较好的合理性和可靠性,适用于苦参多糖的提取。
2.3 苦参多糖理化性质分析结果
2.3.1 苦参多糖总糖含量及蛋白含量测定
计算结果显示苦参多糖总糖含量为81.8%±0.65%,蛋白质含量为2.4%±0.09%,表明本实验工艺优化条件下提取的多糖纯度较高,可用于进一步的分析和活性评价。
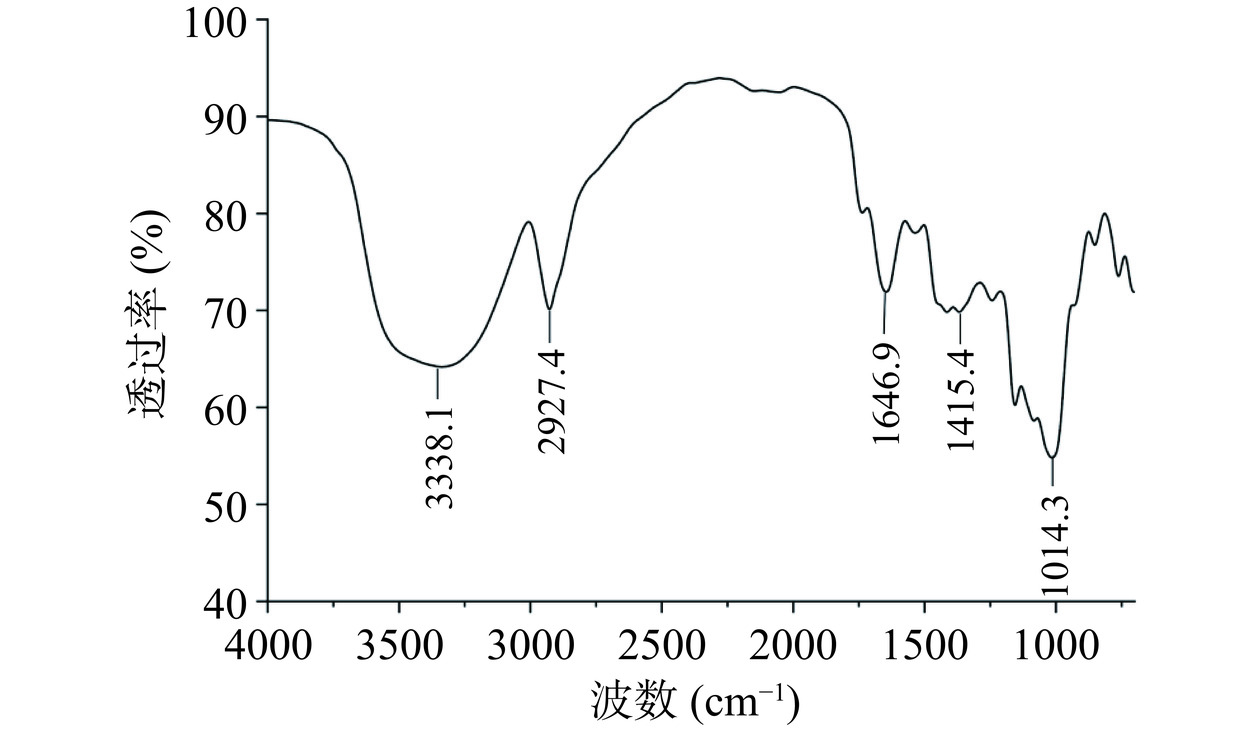
2.3.2 红外光谱分析结果
如图5所示,苦参多糖的红外光谱图在3338、2927和1014 cm−1附近均具有多糖特有的吸收峰[23]。3338 cm−1附近的吸收峰是O-H或N-H的伸缩振动峰,2927 cm−1附近是C-H的伸缩振动峰[24]。1647 cm−1和1415 cm−1附近的吸收峰分别归因于吸收峰C=O的不对称拉伸振动和−COOH的对称拉伸振动,说明多糖中含有糖醛酸[25]。1014.3 cm−1附近的吸收峰表明存在吡喃糖[26],这与Zhang等[27]提取的苦参多糖的红外谱图相似。
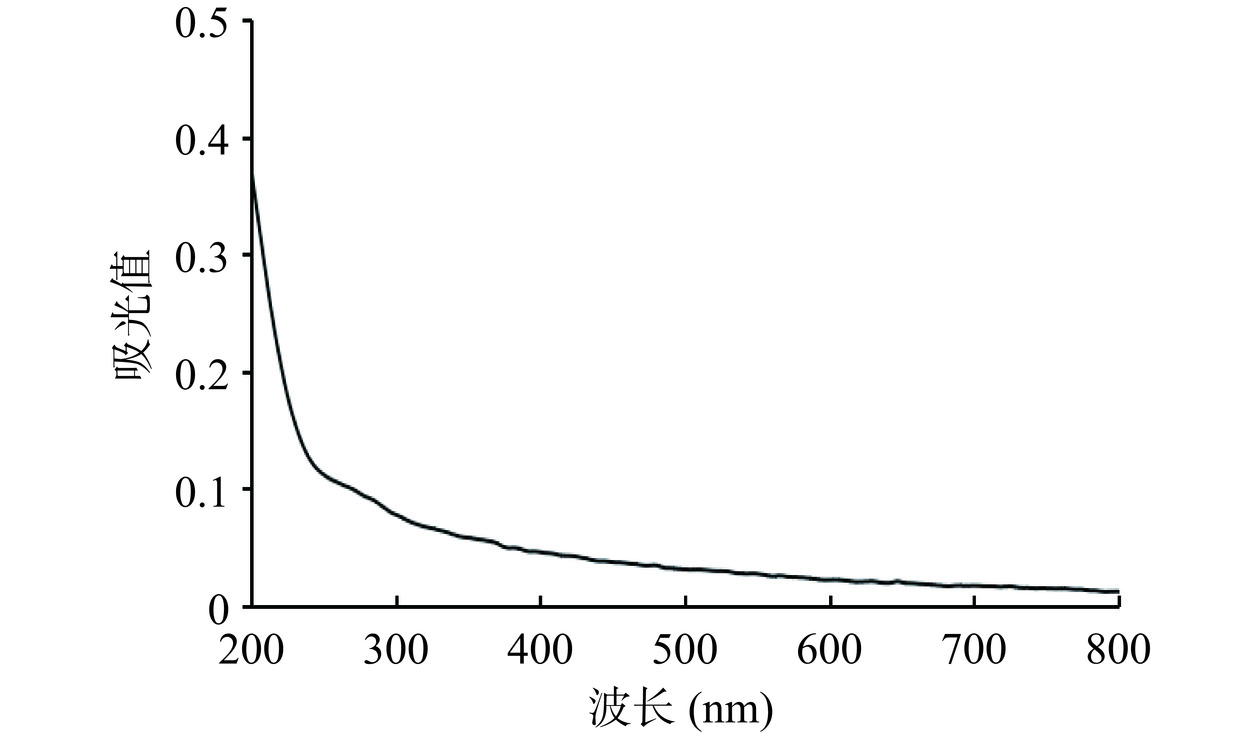
2.3.3 紫外-可见光谱分析结果
如图6所示,在280 nm处有微弱的吸收峰,说明含有少量的蛋白质,这与蛋白质含量测定结果一致。260 nm附近无明显吸收峰,说明苦参多糖中不含核酸[28]。
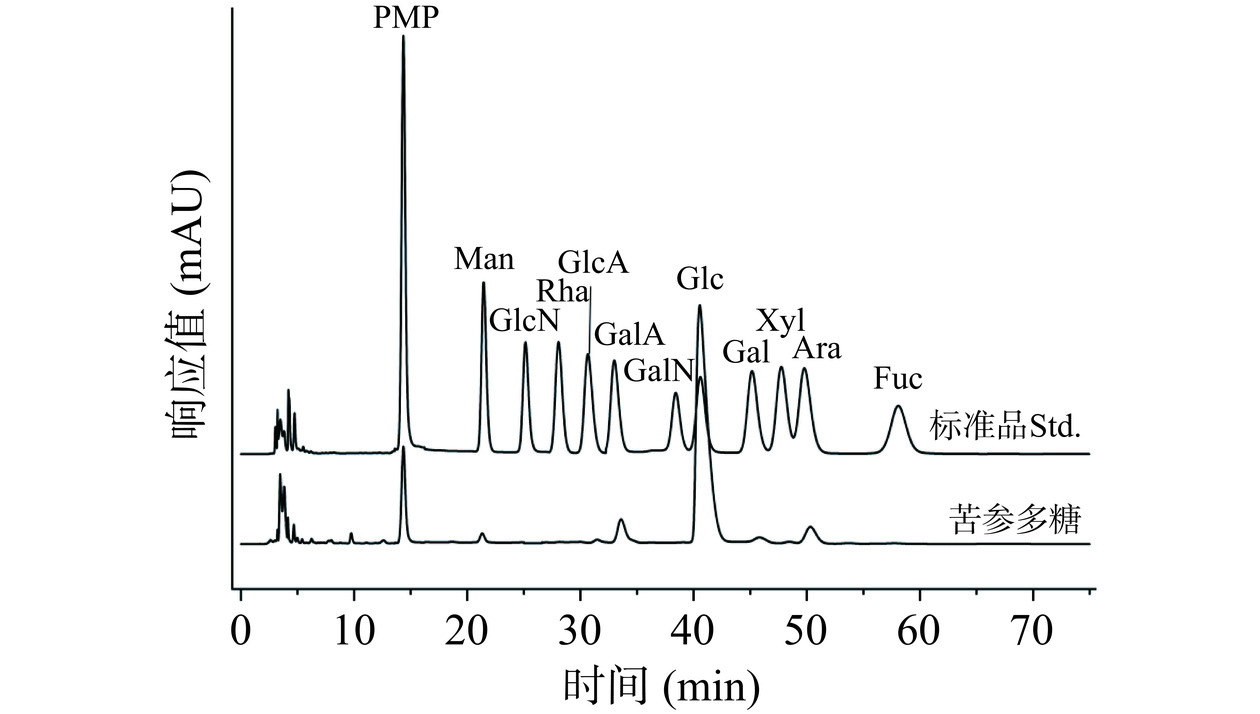
2.3.4 单糖组成分析
经PMP柱前衍生-HPLC法分析苦参多糖的单糖组成,结果见图7。
由图7可知,苦参多糖是由Man、GalA、Glc、Gal和Ara组成,经计算相对摩尔比为1.4:6.20:83.9:2.6:5.7,说明苦参多糖是主要由Glc组成的酸性杂多糖,这与陈彦旭等[6]提取的苦参多糖单糖组成结果相近。单糖组成是影响多糖活性的重要因素,与多糖的溶解性、稳定性及其与生物体内受体的结合相关[29]。
2.4 抗氧化活性评价结果与分析
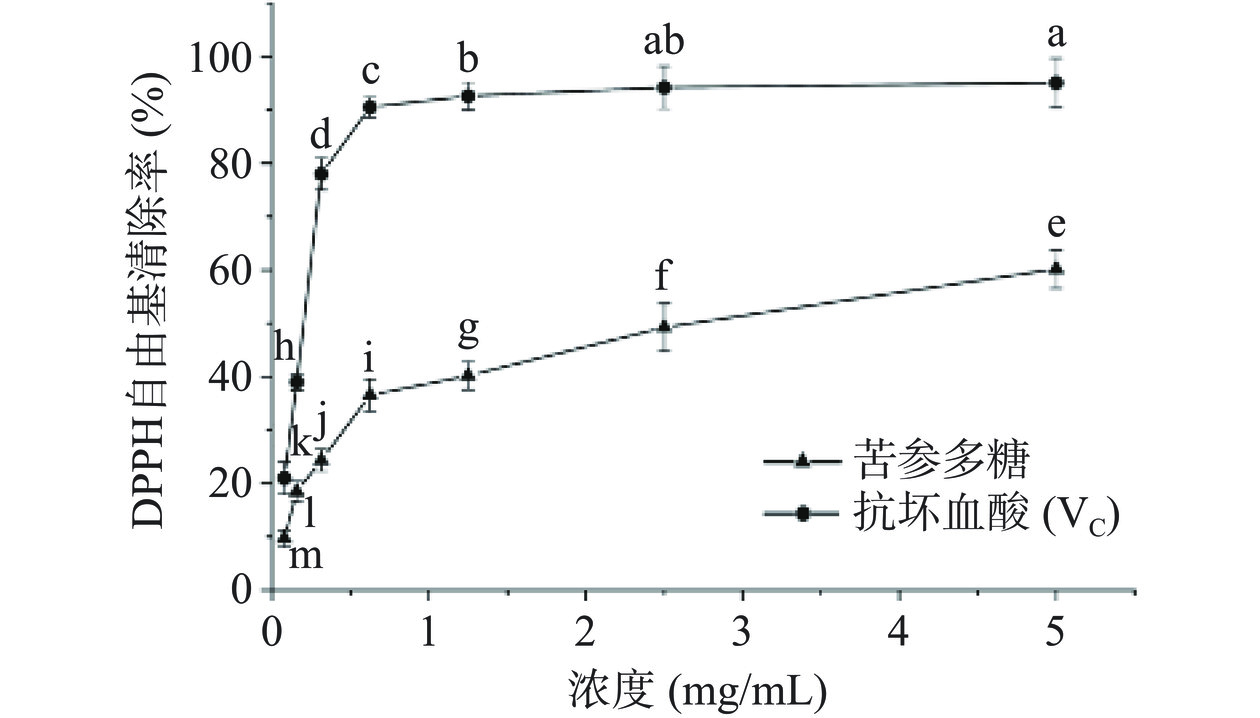
2.4.1 苦参多糖和VC对DPPH自由基的清除活性
从图8可知,在0~5 mg/mL浓度范围内,苦参多糖对DPPH自由基的清除活性随着多糖浓度的增加而增强,具有明显的浓度依赖性。当浓度达到5 mg/mL时,苦参多糖对DPPH自由基的清除率达到60.1%±3.6%,VC为95.1%±4.6%,与同属植物苦豆子中提取的多糖(6 mg/mL)对DPPH自由基的清除率(34.92%)相比,苦参多糖对DPPH自由基的清除能力优于苦豆子多糖[30]。经计算,苦参多糖对DPPH自由基的半抑制浓度(IC50)为2.43 mg/mL,与阳性对照VC的IC50相比(0.23 mg/mL),苦参多糖表现出较好的DPPH自由基清除活性。
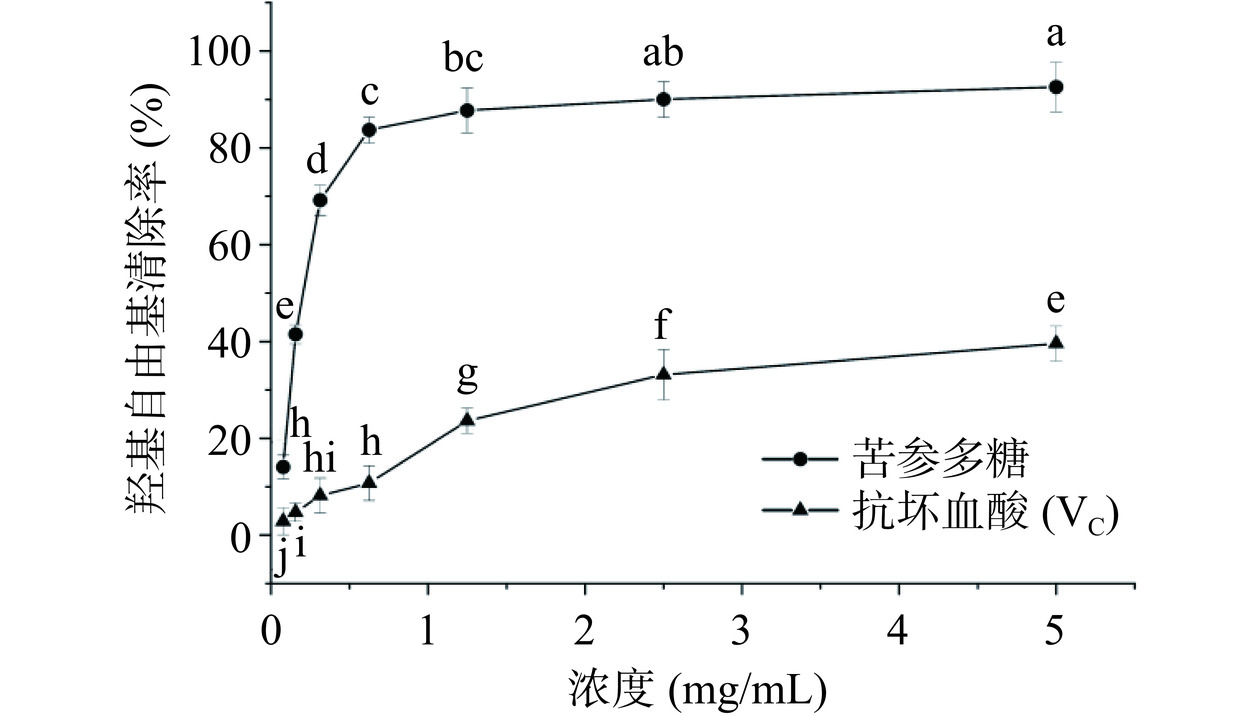
2.4.2 苦参多糖和VC对羟基自由基的清除活性
从图9可知,在0~5 mg/mL浓度范围内,苦参多糖对羟基自由基的清除活性随着多糖浓度的增加而增强,呈现明显的浓度依赖性。当浓度达到5 mg/mL时,苦参多糖对羟基自由基的清除率达到39.6%±3.1%,VC为92.6%±5.1%,与同属植物苦豆子中提取的多糖(5 mg/mL)对羟基自由基的清除率(34.14%)相比,苦参多糖对羟基自由基的清除能力优于苦豆子多糖[30]。经计算,苦参多糖对羟基自由基的IC50为12.71 mg/mL,与阳性对照VC的IC50(0.37 mg/mL)相比,苦参多糖对羟基自由基具有清除活性但不显著,导致清除率低的原因可能与多糖结构的糖苷键连接方式有关,具体机制还需进一步深入研究[31]。
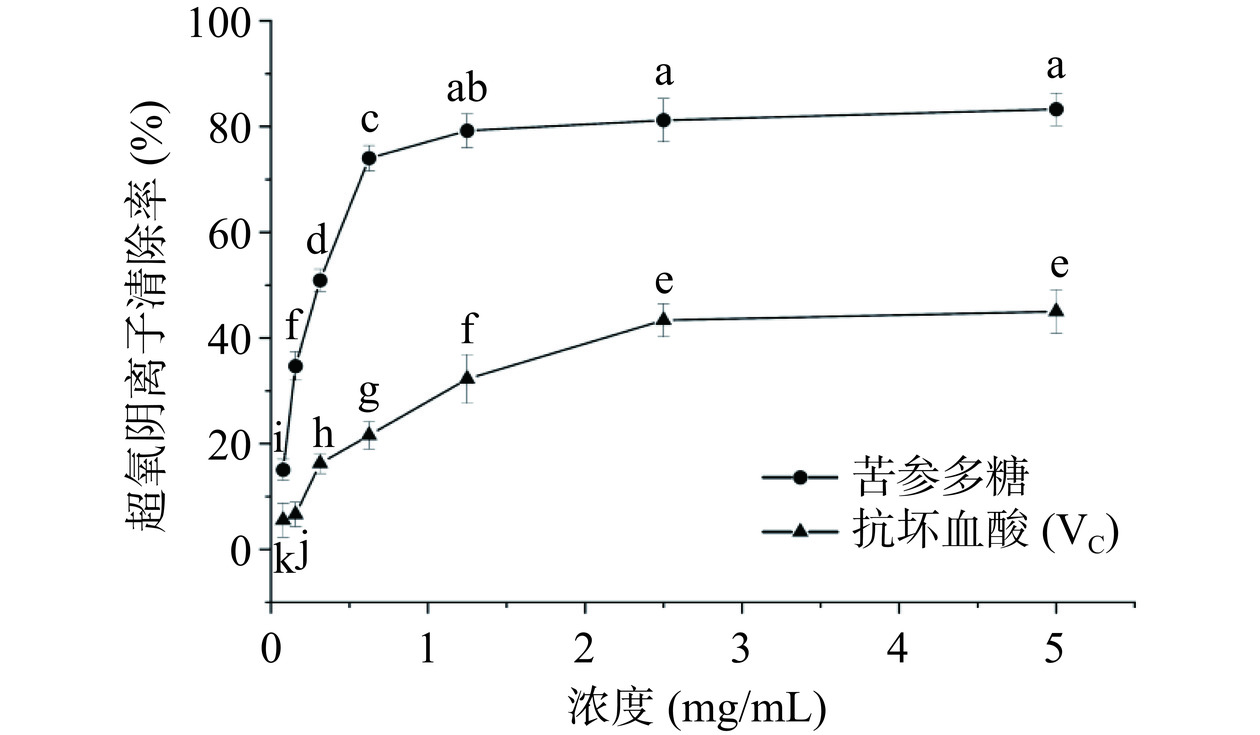
2.4.3 苦参多糖和VC对超氧阴离子自由基的清除活性
从图10可知,在0~5 mg/mL浓度范围内,苦参多糖对超氧阴离子自由基的清除活性随着浓度增加而增强,当浓度达到5 mg/mL时,清除率达到45.1%±4.1%,VC为83.3%±3.1%。与同属植物苦豆子中提取的多糖(6 mg/mL)对超氧阴离子的清除率(28.22%)相比,苦参多糖对超氧阴离子的清除能力优于苦豆子多糖[30],但清除率低于50%。清除率低的原因可能与多糖结构的糖苷键连接方式有关,具体机制还需进一步深入研究[31]。
2.5 体外降血脂活性结果与分析
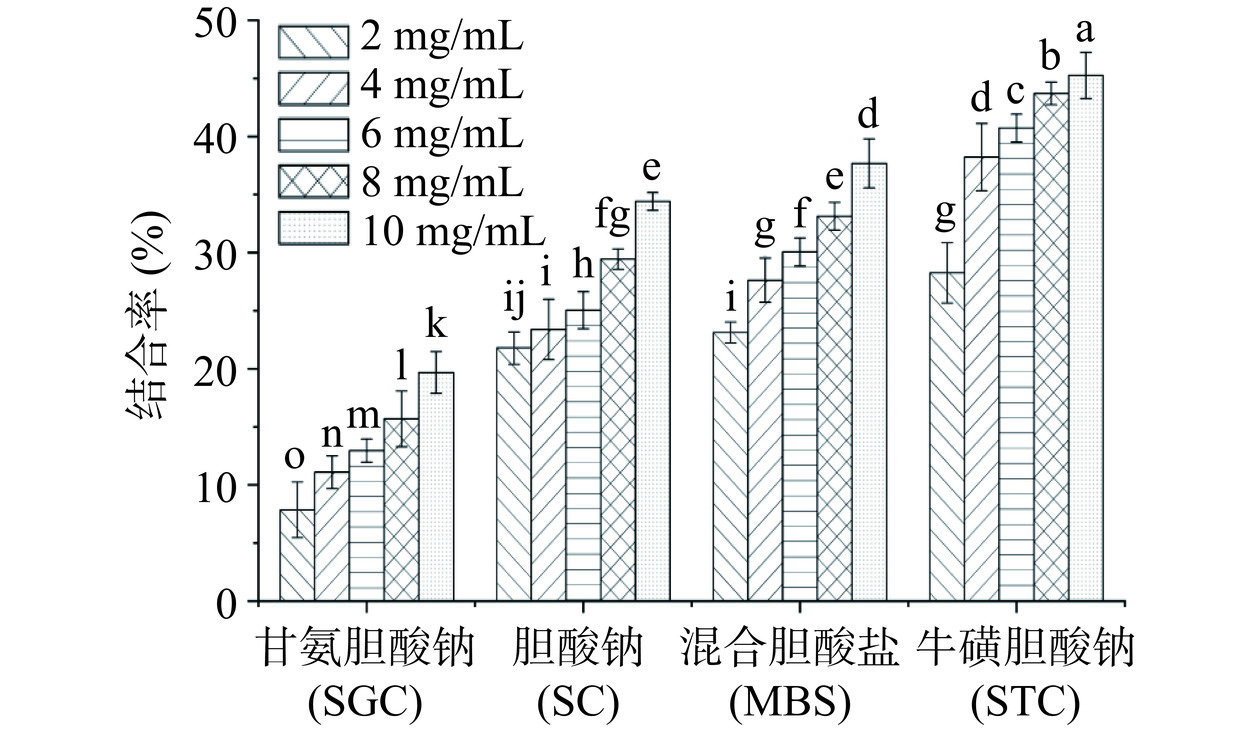
从图11可知,苦参多糖对胆酸盐的结合能力随着多糖浓度的增加而显著提高,但对不同胆酸盐的结合能力存在差异。苦参多糖对4种胆酸盐的结合能力从大到小排序为:STC>MBS>SC>SGC。当苦参多糖浓度达到10 mg/mL时与SC、STC、SGC和MBS的结合率分别为34.4%±0.75%、45.4%±0.15%、19.7%±0.94%和37.7%±0.64%,这说明苦参多糖对不同的胆酸盐都具有一定的结合能力,其中对STC的结合作用最为明显。体内的胆酸盐对降血脂和降胆固醇有重要的作用,多糖较高的胆酸盐结合率可能与其复杂的空间结构和糖醛酸含量有关[32−34]。本实验结果说明苦参多糖具有通过与不同胆酸盐结合从而发挥降血脂作用的潜力。
3. 结论
本研究在单因素实验的基础上通过正交试验优化了苦参多糖的提取工艺,最佳工艺为:提取时间3.5 h,温度85 ℃,料液比为1:35 (g:mL)。最佳工艺条件下,苦参多糖得率可达到3.07%±0.07%,所获得的工艺操作简单,容易控制,多糖得率高,为苦参多糖的大量制备奠定了基础。单糖组成分析发现所制备的苦参多糖是一种主要由Glc组成的杂多糖,这为苦参多糖的质量控制提供了依据。活性研究结果表明,苦参多糖具有较好的体外抗氧化活性,其中对DPPH自由基清除效果最好。苦参多糖能够与4种胆酸盐结合,其中与牛磺胆酸钠结合作用最强,并且与浓度成正相关,推测其可能具有一定的降血脂活性。
本研究为苦参多糖的制备,以及在抗氧化和降血脂功能等方面的研究提供了参考,也为苦参多糖的进一步研究奠定了基础,但在苦参多糖的纯化、精细结构表征以及其它生物活性和作用机制研究方面的还需要进一步加强。
-
表 1 正交试验因素水平
Table 1 Factors and levels for orthogonal experiments
水平 因素 A 时间 (h) B 温度 (℃) C 料液比 (g:mL) 1 2.5 75 1:25 2 3.0 80 1:30 3 3.5 85 1:35 表 2 正交试验及结果
Table 2 Orthogonal experiment and results
序号 因素 A B C D (空白列) 多糖得率 (%) 1 1 1 1 1 1.57±0.04 2 1 2 2 2 2.24±0..08 3 1 3 3 3 3.01±0.03 4 2 1 2 3 1.32±0.09 5 2 2 3 1 2.46±0.11 6 2 3 1 2 2.24±0.06 7 3 1 3 2 2.13±0.04 8 3 2 1 3 2.54±0.09 9 3 3 2 1 2.64±0.12 K1 6.82 5.02 6.35 6.67 K2 6.02 7.24 6.20 6.61 K3 7.31 7.89 7.60 6.87 k1 2.27 1.67 2.12 2.22 k2 2.01 2.41 2.07 2.20 k3 2.44 2.63 2.53 2.29 R 0.43 0.96 0.47 0.09 B>C>A 表 3 方差分析结果
Table 3 Analysis of variance results
来源 III类平方和 自由度 均方 F 显著性 修正模型 2.186 6 0.3644 58.984 0.0168 截距 45.114 1 45.1136 7302.563 0.0001 A 0.283 2 0.1413 22.879 0.0419 B 1.510 2 0.7549 122.192 0.0081 C 0.394 2 0.1969 31.879 0.0304 误差 0.012 2 0.0062 总计 47.312 9 修正后总计 2.199 8 注:R2 =0.994 (调整后R2=0.978)。 -
[1] BAI L, ZHU Li Y, YANG B S, et al. Antitumor and immunomodulating activity of a polysaccharide from Sophora flavescens Ait[J]. International Journal of Biological Macromolecules,2012,51(5):705−709. doi: 10.1016/j.ijbiomac.2012.07.004
[2] 苏玉宵, 丁长河. 多糖的功能性研究[J]. 粮食与油脂,2022,35(4):35−38. [SU Y X, DING C H. Study on the function of polysaccharides[J]. Grain & Oil,2022,35(4):35−38.] doi: 10.3969/j.issn.1008-9578.2022.04.010 SU Y X, DING C H. Study on the function of polysaccharides[J]. Grain & Oil, 2022, 35(4): 35−38. doi: 10.3969/j.issn.1008-9578.2022.04.010
[3] 陈湑慧. 生姜茎叶多糖的结构解析、体外消化酵解和保肝活性研究[D]. 重庆:西南大学, 2022. [CHEN X H. Structural analysis in vitro digestive enzymology and hepatoprotective activity of polysaccharides from ginger stem and leaves[D]. Chongqing:Southwest University, 2022.] CHEN X H. Structural analysis in vitro digestive enzymology and hepatoprotective activity of polysaccharides from ginger stem and leaves[D]. Chongqing: Southwest University, 2022.
[4] BAUER S, WEI H J, ZHANG F M, et al. The application of seaweed polysaccharides and their derived products with potential for the treatment of Alzheimer’s disease[J]. Marine Drugs,2021,19(2):89. doi: 10.3390/md19020089
[5] 段雪伟, 张敏君, 王燕, 等. 构树花多糖提取工艺优化及其抗氧化活性[J]. 食品研究与开发,2023,44(21):84−91. [DUAN X W, ZHANG M J, WANG Y, et al. Extraction process optimization and antioxidant activity of polysaccharides from Broussonetia papyrifera flowers[J]. Food Research and Development,2023,44(21):84−91.] doi: 10.12161/j.issn.1005-6521.2023.21.012 DUAN X W, ZHANG M J, WANG Y, et al. Extraction process optimization and antioxidant activity of polysaccharides from Broussonetia papyrifera flowers[J]. Food Research and Development, 2023, 44(21): 84−91. doi: 10.12161/j.issn.1005-6521.2023.21.012
[6] 陈彦旭, 杨华, 徐慧琳, 等. 苦参多糖的提取分离、理化性质及免疫调节活性研究[J]. 国际药学研究杂志,2018,45(8):611−618. [CHEN Y X, YANG H, XU H L, et al. Isolation physicochemical properties and immunomodulating effects of polysaccharides from Sophorae flavescentis Radix[J]. International Journal of Pharmaceutical Research,2018,45(8):611−618.] CHEN Y X, YANG H, XU H L, et al. Isolation physicochemical properties and immunomodulating effects of polysaccharides from Sophorae flavescentis Radix[J]. International Journal of Pharmaceutical Research, 2018, 45(8): 611−618.
[7] LI Y X, LU B W, JIANG S L, et al. Structural characterization of water-soluble polysaccharides from Sophora flavescens Ait. and their anti-inflammatory activities based on NO release[J]. Journal of Carbohydrate Chemistry,2022,41:7−9,405−423.
[8] 王迎进, 马文辉, 李嘉慧, 等. 苦参多糖的单糖组成分析及体外抗氧化性研究[J]. 药物分析杂志,2014,34(7):1187−1191. [WANG Y J, MA W H, LI J H, et al. Monosaccharide analysis and in vitro antioxidant activity of polysaccharides from Sophora flaves cens[J]. Journal of Pharmaceutical Analysis,2014,34(7):1187−1191.] WANG Y J, MA W H, LI J H, et al. Monosaccharide analysis and in vitro antioxidant activity of polysaccharides from Sophora flavescens[J]. Journal of Pharmaceutical Analysis, 2014, 34(7): 1187−1191.
[9] 龙瑞阳. 毛木耳多糖提取、结构及其锌复合物制备与生物活性研究[D]. 广州:广州大学, 2023. [LONG R Y. Extraction, structure, preparation and biological activity of polysaccharides from Auricularia auriculae, and their zinc complexes[D]. Guangzhou:Guangzhou University, 2023.] LONG R Y. Extraction, structure, preparation and biological activity of polysaccharides from Auricularia auriculae, and their zinc complexes[D]. Guangzhou: Guangzhou University, 2023.
[10] SANTHOSHANI W, HUDA M, METHTHA R, et al. Advancement of milk protein analysis:From determination of total proteins to their identification and quantification by proteomic approaches[J]. Journal of Food Composition and Analysis,2024,126:105854. doi: 10.1016/j.jfca.2023.105854
[11] 黄秋凌, 雷婷, 何子昕, 等. 苯酚-硫酸法测定消渴丸中多糖含量[J]. 中西医结合研究, 2023, 15(5):308-310,327. [HUANG Q L, LEI T, HE Z X, et al. Determination of polysaccharides in Xiaoke Pill by phenol-sulfuric acid method[J]. Research on Integrative Chinese and Western Medicine, 2023, 15(5):308−310, 327.] HUANG Q L, LEI T, HE Z X, et al. Determination of polysaccharides in Xiaoke Pill by phenol-sulfuric acid method[J]. Research on Integrative Chinese and Western Medicine, 2023, 15(5): 308−310, 327.
[12] 常雪花, 钱雅雯, 王振菊, 等. 籽瓜多糖对益生菌生长促进效应及其结构表征[J]. 食品研究与开发,2022,43(19):68−78. [CHANG X H, QIAN Y W, WANG Z J, et al. Growth-promoting effect of seed melon folysaccharides on probiotics and structure analysis[J]. Food Research and Development,2022,43(19):68−78.] doi: 10.12161/j.issn.1005-6521.2022.19.009 CHANG X H, QIAN Y W, WANG Z J, et al. Growth-promoting effect of seed melon folysaccharides on probiotics and structure analysis[J]. Food Research and Development, 2022, 43(19): 68−78. doi: 10.12161/j.issn.1005-6521.2022.19.009
[13] 杨建安, 张超, 文焱炳, 等. 油茶籽粕茶皂素的脱除工艺及高纯度多糖的制备[J]. 食品科技,2022,47(6):243−248. [YANG J A, ZHANG C, WEN Y B, et al. Removal technology of tea saponin from Camellia oleifera seed meal and preparation of high-purity polysaccharides[J]. Food Science and Technology,2022,47(6):243−248.] doi: 10.3969/j.issn.1005-9989.2022.6.spkj202206036 YANG J A, ZHANG C, WEN Y B, et al. Removal technology of tea saponin from Camellia oleifera seed meal and preparation of high-purity polysaccharides[J]. Food Science and Technology, 2022, 47(6): 243−248. doi: 10.3969/j.issn.1005-9989.2022.6.spkj202206036
[14] WANG L B, LI L Y, GAO J Y, et al. Characterization, antioxidant and immunomodulatory effects of selenized polysaccharides from dandelion roots[J]. Carbohydrate Polymers,2021,260:117796. doi: 10.1016/j.carbpol.2021.117796
[15] YUAN Q X, LI H, WANG Q, et al. Deaminative-cleaved Smonotuberculatus fucosylated glycosaminoglycan:Structural elucidation and anticoagulant activity[J]. Carbohydrate Polymers,2022,298:120072. doi: 10.1016/j.carbpol.2022.120072
[16] LI X G, ZHANG F Y, JIANG C Q, et al. Structural analysis, in vitro antioxidant and lipid-lowering activities of purified Tremella fuciformis polysaccharide fractions[J]. Process Biochemistry,2023,133:99−108. doi: 10.1016/j.procbio.2023.06.005
[17] ZHAO X L, MENG Y, LIU Y, et al. Pectic polysaccharides from Lilium brownii and Polygonatum odoratum exhibit significant antioxidant effects in vitro[J]. International Journal of Biological Macromolecules,2024,257:128830. doi: 10.1016/j.ijbiomac.2023.128830
[18] LIU J F, PU Q S, QIU H D, et al. Polysaccharides isolated from Lycium barbarum L. by integrated tandem hybrid membrane technology exert antioxidant activities in mitochondria[J]. Industrial Crops and Products,2021,168:113547. doi: 10.1016/j.indcrop.2021.113547
[19] 杨丰榕, 高建萍, 李春燕. 生菜子多糖提取方法及其降血脂活性研究[J]. 农学学报,2021,11(11):81−87. [YANG F R, GAO J P, LI C Y. Polysaccharide extraction in Lactuca satya L and its anti hyperlipidemic activity[J]. Agronomy Journal,2021,11(11):81−87.] doi: 10.11923/j.issn.2095-4050.cjas20191000234 YANG F R, GAO J P, LI C Y. Polysaccharide extraction in Lactuca satya L and its anti hyperlipidemic activity[J]. Agronomy Journal, 2021, 11(11): 81−87. doi: 10.11923/j.issn.2095-4050.cjas20191000234
[20] 涂玲飞, 李焱, 张振. 响应面优化硒化白及多糖的制备工艺及其体外抗氧化活性研究[J]. 食品工业科技,2024,45(7):1−10. [TU F L, LI Y, ZHANG Z. Optimization of selenized Bletilla striata polysaccharides preparationby response surface methodology and determination of the antioxidant activity in vitro[J]. Science and Technology of Food Industry,2024,45(7):1−10.] TU F L, LI Y, ZHANG Z. Optimization of selenized Bletilla striata polysaccharides preparationby response surface methodology and determination of the antioxidant activity in vitro[J]. Science and Technology of Food Industry, 2024, 45(7): 1−10.
[21] 胡玲玲, 吴佳财. 正交法优化党参多糖提取工艺的研究[J]. 陕西农业科学,2020,66(10):36−38. [HU L L, WU J C. Research on the optimization of polysaccharide extraction process of Radixet Rhizoma Ginseng by orthogonal method[J]. Shaanxi Agricultural Science,2020,66(10):36−38.] doi: 10.3969/j.issn.0488-5368.2020.10.009 HU L L, WU J C. Research on the optimization of polysaccharide extraction process of Radixet Rhizoma Ginseng by orthogonal method[J]. Shaanxi Agricultural Science, 2020, 66(10): 36−38. doi: 10.3969/j.issn.0488-5368.2020.10.009
[22] 刘洪均, 包誉, 胡江苗, 等. 正交试验优化齿瓣石斛多糖提取工艺[J]. 食品工业,2023,44(3):38−42. [LIU H J, BAO Y, HU J M, et al. Optimization of extraction process of polysaccharide from Dendrobium devonianum by orthogonal experiment[J]. Food Industry,2023,44(3):38−42.] LIU H J, BAO Y, HU J M, et al. Optimization of extraction process of polysaccharide from Dendrobium devonianum by orthogonal experiment[J]. Food Industry, 2023, 44(3): 38−42.
[23] GONG G P, DANG T T, DENG Y N, et al. Physicochemical properties and biological activities of polysaccharides from Lycium barbarum prepared by fractional precipitation[J]. International Journal of Biological Macromolecules,2018,109:611−618. doi: 10.1016/j.ijbiomac.2017.12.017
[24] ZOU M Y, HU X B, WANG Y J, et al. Structural characterization and anti-inflammatory activity of a pectin polysaccharide HBHP-3 from Houttuynia cordata[J]. International Journal of Biological Macromolecules,2022,210:161−171. doi: 10.1016/j.ijbiomac.2022.05.016
[25] NEERAJ K, MANOJ K, RADH A, et al. Onion and garlic polysaccharides:A review on extraction, characterization, bioactivity, and modifications[J]. International Journal of Biological Macromolecules,2022,219:1047−1061. doi: 10.1016/j.ijbiomac.2022.07.163
[26] CAO D X, WEI E W, WANG Z Y, et al. Microwave-assisted extraction, structural elucidation, and in vitro anti-glioma and immunostimulatory activity of polysaccharide from Panax ginseng C A Meyer[J]. Industrial Crops and Products,2022,189:115729. doi: 10.1016/j.indcrop.2022.115729
[27] ZHANG Q H, YU J B, ZHANG L F, et al. Extraction, characterization, and biological activity of polysaccharides from Sophora flavescens Ait[J]. International Journal of Biological Macromolecules,2016,93:459−467. doi: 10.1016/j.ijbiomac.2016.08.052
[28] 陈娟娟, 张高鹏, 邓佳颖, 等. 银耳子实体多糖的分离制备与构象特征研究[J]. 食品工业,2023,44(11):88−92. [CHEN J J, ZHANG G P, DENG J Y, et al. Study on isolation, preparation and conformation of polysaccharides from Tremella fuciformis fruit body[J]. Food Industry,2023,44(11):88−92.] CHEN J J, ZHANG G P, DENG J Y, et al. Study on isolation, preparation and conformation of polysaccharides from Tremella fuciformis fruit body[J]. Food Industry, 2023, 44(11): 88−92.
[29] WANG Z C, ZHENG Y, LAI Z R, ET AL. Effect of monosaccharide composition and proportion on the bioactivity of polysaccharides:A review[J]. International Journal of Biological Macromolecules,2024,254:127955. doi: 10.1016/j.ijbiomac.2023.127955
[30] 赵永安, 陈冠, 陶遵威. 苦豆子多糖及其衍生物的体外抗氧化活性[J]. 中国实验方剂学杂志,2013,19(5):229−232. [ZHAO Y A, CHEN G, TAO Z W. Antioxidative effects in vitro of polysaccharides in Sophora alopecuroides and its derivatives J]. Chinese Journal of Experimental Traditional Medical Formulae,2013,19(5):229−232.
[31] 李淑敏, 何瑞娟, 任宝旗, 等. 不同提取工艺对生姜渣中多糖结构的影响及其抗氧化活性分析[J]. 中国调味品,2023,48(10):113−116. [LI S M, HE R J, REN B Q, et al. Effects of different extraction processes on polysaccharide structure and antioxidant activity of Ginger dregs[J]. China Condiment,2023,48(10):113−116.] doi: 10.3969/j.issn.1000-9973.2023.10.018 LI S M, HE R J, REN B Q, et al. Effects of different extraction processes on polysaccharide structure and antioxidant activity of Ginger dregs[J]. China Condiment, 2023, 48(10): 113−116. doi: 10.3969/j.issn.1000-9973.2023.10.018
[32] WEI L, HUANG L, DU L, et al. Structural characterization and in vitro antioxidant, hypoglycemic and hypolipemic activities of a natural polysaccharide from Liupao Tea[J]. Foods,2023,12(11):2226. doi: 10.3390/foods12112226
[33] 赵有伟, 李德海. 超声微波协同制备粗毛纤孔菌多糖及体外降脂作用的研究[J]. 食品工业科技,2021,42(20):191−198. [ZHAO Y W, LI H D. Ultrasonic and microwave synergistic preparation of polysaccharide from Inonotus hispidus and its effect on lowering lipid in vitro[J]. Science and Technology of Food Industry,2021,42(20):191−198.] ZHAO Y W, LI H D. Ultrasonic and microwave synergistic preparation of polysaccharide from Inonotus hispidus and its effect on lowering lipid in vitro[J]. Science and Technology of Food Industry, 2021, 42(20): 191−198.
[34] 冯诗华. 绿球藻多糖的抗氧化、抗炎及体外降糖降脂活性探究[D]. 太原:山西大学, 2023. [FENG S H. Antioxidant, anti-inflammatory and in vitro hypoglycemic and hypolipidemic activities of polysaccharides from Chlorella vulgaris[D]. Taiyuan:Shanxi University, 2023.] FENG S H. Antioxidant, anti-inflammatory and in vitro hypoglycemic and hypolipidemic activities of polysaccharides from Chlorella vulgaris[D]. Taiyuan: Shanxi University, 2023.
-
期刊类型引用(1)
1. 刘丽桃,傅春燕,刘诗薇,周秀娟,谢雨芊,欧阳玉珍,王彪,葛金文. 响应面法优化降脂通脉方多糖的提取工艺研究. 中医药导报. 2024(12): 58-62 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



