Effect of Rich GABA of Germinated Adzuki Bean on Intestinal Microflora in T2DM Mice
-
摘要: 为了研究富含GABA萌发红小豆对2型糖尿病(Diabetes Mellitus Type 2,T2DM)小鼠血糖水平及肠道菌群的影响,采用C57BL/6J小鼠为研究对象,通过高脂膳食+链脲菌素(Streptozocin,STZ)注射构建T2DM模型,选择不同剂量的富含GABA萌发红小豆对T2DM小鼠连续膳食干预6周,并利用16S rRNA测序技术对T2DM小鼠盲肠内容物的菌群结构和分布进行鉴定。结果显示:不同剂量富含GABA红小豆膳食干预可使T2DM小鼠FBG值明显下降,其中高剂量富含GABA红小豆(TF3)组FBG值为8.36±0.78 mmol/L,相比模型组(M)下降54.09%,干预效果最好。此外,TF3膳食可引起T2DM小鼠肠道菌群丰度发生显著(P<0.05)改变,门水平上Firmicutes丰度为35.96%,比M模型组下降53.17%,并可显著上调Bacteroidetes、Verrucomicrobia的菌群丰度(P<0.05)。表明TF3膳食改善糖脂代谢与Bacteroidetes、Verrucomicrobia优势菌丰度呈正相关,暗示高剂量富含GABA红小豆膳食可通过增加有益菌来缓解T2DM小鼠高血糖症状,为进一步解释T2DM与肠道菌群的关系提供参考。Abstract: In order to study the effects of GABA-rich germinated adzuki bean on blood glucose level and intestinal flora in T2DM mice. C57BL/6J mice were used as subjects to construct T2DM model by high fat diet+STZ injection. Different doses of GABA-rich germinated adzuki bean were used to treat T2DM mice for 6 weeks and 16S rRNA sequencing technique was used to identify the microbial structure and distribution in the cecal contents of T2DM mice. The results showed that different doses of GABA-rich adzuki bean dietary intervention could significantly reduce the FBG value of T2DM mice, and the FBG value of high dose GABA-rich adzuki bean (TF3) group was 8.36±0.78 mmol/L, which was 54.09%, lower than that of model group (M). In addition, TF3 diet induced significant changes in intestinal flora abundance in T2DM mice. Firmicutes abundance at gate level was 35.96%, which decreased by 53.17% compared with M model group, and Bacteroidetes and Verrucomicrobia abundance were significantly up-regulated. In summary, the improvement of glucose and lipid metabolism by TF3 diet was significantly correlated with the abundance of dominant bacteria in Bacteroidetes and Verrucomicrobia, suggesting that high dose of GABA-rich adzuki bean diet could alleviate hyperglycemia symptoms in T2DM mice through beneficial bacteria, which provided reference for further explaining the relationship between T2DM and intestinal flora.
-
Keywords:
- adzuki bean /
- germinating /
- GABA /
- T2DM /
- intestinal microflora
-
糖尿病是一种与碳水化合物代谢失调、胰岛素分泌或作用缺陷有关的代谢性疾病。据IDF推测,到2040年,全球将有近6.4亿人受到糖尿病的影响,其中90%患者为2型糖尿病(Diabetes Mellitus Type 2, T2DM)。T2DM每年导致100多万人死亡,是全球第九大死亡因素[1−2]。膳食调节是糖尿病防控的基石,贯穿于疾病形成及发展的全过程[3]。因此,从食疗的角度出发获得绿色天然和安全可靠的营养食品对人类慢性病进行干预已成为食品科学界的研究热点。越来越多研究表明以豆类为基础的饮食有助于预防和控制T2DM的发生及发展[4]。
红小豆是人们喜食的高蛋白、低热量的豆类之一,含有丰富的膳食纤维、氨基酸及钙、铁、镁等多种营养素,被誉为“谷豆中的红色珍珠”[5]。同时红小豆中还含有降低血糖反应酶活性的物质,对ɑ-葡萄糖苷酶具有良好的抑制能力,对餐后血糖反应有积极影响,是糖尿病患者首选豆类之一[6]。萌发是一种简单、有效提升植物适口性、消化性和部分营养成分含量的技术[7]。萌发处理使豆类籽粒中生物活性化合物的含量显著增加,如维生素、多酚、γ-氨基丁酸比原豆类高出数倍,且有害物质明显降低[8−9]。红小豆中谷氨酸含量较高,是γ-氨基丁酸(γ-aminobutyric acid,GABA)合成的前体物质,有潜力通过植物代谢等手段富集GABA,极大提高了红小豆的健康效应[10]。GABA是一种非蛋白源氨基酸,可诱导α细胞向β细胞转化,增加胰岛素分泌,是食品中新型生物活性成分[11]。此外,多项研究显示豆类膳食对糖尿病小鼠肠道健康有积极影响。Monk等[12]报道熟豇豆可改善瘦小鼠的肠道健康,并在肥胖发展的同时食用豇豆可减轻肠道生态失衡和炎症反应。Tan等[13]发现食用黑豆可通过葡萄糖信号通路和JNK/c-Jun通路改善C57BL/6J小鼠的胰岛素抵抗,并能恢复肠道微生物的菌群结构。膳食补充绿豆可逆转HFD诱导的肠道微生物群失衡[14]。除此之外,亦有研究显示GABA对糖尿病小鼠肠道菌群具有良性调节作用[15]。富含GABA红小豆的本质属于更具有营养价值的杂豆,是否对糖尿病小鼠肠道健康有正向调节作用,有待进一步研究。
因此,本文以红小豆为原料,采用萌发联合真空胁迫富集GABA,并通过动物体内实验,研究富含GABA萌发红小豆对STZ诱导的T2DM小鼠血糖水平及肠道菌群的变化进行分析,揭示其调控血糖的作用效果及途径,为富含GABA芽豆功能食品开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
红小豆 品种珍珠红,购买于大庆市瑞泽丰科技有限公司,储存于4 ℃下待用;γ-氨基丁酸标品、谷氨酸、重蒸酚 分析纯,上海源叶生物科技有限公司;链脲菌素 美国Sigma公司; SPF级C57BL/6J雄性小鼠 体重18~22 g,6周龄,64只,购于长春市亿斯实验动物技术有限责任公司(许可证号:SCXK(吉)2018-0007);普通饲料、TP23300 60%高脂饲料 购买于南通特洛菲饲料科技有限公司。
ZXMP-R1230 恒温恒湿培养箱 上海智城分析仪器制造有限公司;TU-1810PC紫外可见分光光度计 北京普析通用仪器有限公司;Agilent1200液相色谱仪 安捷伦科技有限公司;H2050R高速台式冷冻离心机 湘仪离心机仪器有限公司;BZF-30真空干燥箱 上海博讯医疗生物仪器有限公司;DW-86L626超低温冰箱 青岛海尔生物医疗有限公司;SCIENTZ-18N冷冻干燥机 宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 萌发红小豆的制备
将精选清洗后红小豆种子用1.0% NaClO溶液浸泡15 min,之后用无菌水冲洗3次,加入4倍体积的水,浸泡液中加入0.4 mmol/L CaCl2,在35 ℃浸泡16 h,缓冲液pH5。浸泡结束后用去离子水清洗红小豆,均匀平铺在四层纱布的发芽板上,盖上较润湿的纱布放入到可以调节温度的真空干燥箱中,将温度设定到31 ℃,抽真空至−0.1 MPa后,关闭真空泵,真空处理16 h后,将发芽板转移到31℃恒温恒湿培养箱中继续发芽至48 h,萌发期间每1 h喷射一次2 mmmol/L的谷氨酸钠,萌发结束后,一部分低温干燥用于测定GABA的含量及动物实验的材料,再取一部分样品用液态冷冻存在−80 ℃冰箱中用于检测其他指标。
按照上述胁迫技术处理红小豆,可将其中红小豆GABA含量由原来2.57 mg/100 g提高到249.47 mg/100 g。GABA含量测定采用柱前衍生高效液相色谱法,以GABA的峰面积(Y)和浓度(X,mmol/L)作为因子进行线性分析,回归方程为Y=7.4727X−0.0241,R2=0.9963。
1.2.2 实验动物、造模、分组、膳食干预用量
1.2.2.1 实验动物
实验动物饲养于黑龙江八一农垦大学生物技术中心。动物饲养室温20~25 ℃,相对湿度50%±5%,12 h明暗交换。动物自由进食、进水,开始实验前动物适应性喂养1周,期间认真观察小鼠的精神状态,并记录小鼠每天摄食量,为后期膳食干预物含量的确定提供参考。本实验严格按照动物管理条例办法执行,动物伦理批准号为Spxy2023020。
1.2.2.2 T2DM造模、分组、膳食干预用量
将健康C57BL/6J小鼠分为正常对照组(8只)和高脂膳食+STZ造模糖尿病组(56只)。正常对照普通饲料喂养,造模组饲喂TP23300 60%高脂模型饲料,连续饲喂4周后,造模组禁食不禁水12 h后,以50 mg/kg STZ(0.1mol/L柠檬酸缓冲液,pH=4.0)剂量腹腔注射,对照组注射同等剂量的柠檬酸缓冲液,STZ注射后第3 d,测定小鼠空腹血糖,以连续3 d造模小鼠空腹血糖大于12 mmol/L视为造模成功[16],将造模成功小鼠纳入下一步实验。
随后将造模成功的T2DM小鼠按照血糖随机分组,分别为模型组M,高脂饮食(HFD)+低剂量富含GABA发芽红小豆组TF1(15 g/100 g),HFD+中剂量富含GABA发芽红小豆组TF2(25 g/100 g),HFD+高剂量富含GABA发芽红小豆TF3(35 g/100 g),HFD+红小豆干预组B(35 g/100 g),HFD+GABA干预组TG(0.1g/kg),HFD+二甲双胍组TS(0.1g/kg)。TF1、TF2、TF3、B组用不同剂量发芽红小豆和正常红小豆替换部分高脂饲料对小鼠进行膳食干预,M组一直是高脂膳食,C组普通饲料,TG、TS组为高脂膳食+药物处理。每组8只小鼠,第1周为适应喂养,第2~5周高脂膳食,同时在第5周结束后注射STZ,第6周处于观察造模情况,膳食干预从第7周开始,直到12周结束,共计干预时间为6周。
膳食及药物干预期间,每2周测量各组小鼠体重及空腹血糖,饲喂至12周结束后,禁食不禁水12 h,采用戊巴比妥钠麻醉小鼠后,进行解剖采血,血样室温静止30 min,4 ℃下离心10 min(3000 r/min)后收集血清。此外,摘取小鼠肝脏、盲肠等组织,立即放入液氮冷冻,保存于−80 ℃待用。
1.2.3 T2DM小鼠盲肠内容物的收集及菌群组成测定
1.2.3.1 T2DM小鼠盲肠内容物的收集
将膳食干预结束后的各组小鼠麻醉处死后,基于前期血糖及生化指标发现TF3高剂量干预组降糖效果比较好,因此选取有代表性的对照组(C)、模型组(M)、高剂量富含GABA红小豆组(TF3)、GABA组(TG)和二甲双胍(TS)五组小鼠盲肠内容物进行收集,并经液氮冷冻后放置于−80℃冰箱内贮存,直至送检。
1.2.3.2 DNA提取及浓度测定
各组样品内容物DNA的提取,按照QIA amp DNA stool mini kit试剂盒操作步骤进行,操作人员为北京百迈客生物有限公司的技术人员。DNA提取完成后,采用Nanodrop微量分光光度计,在230、260和280 nm等三个波长下测定DNA样本吸光度值,当DNA浓度高于10 ng/µL,OD 260/280比值超多1.5和DNA总量要大于150 ng条件下,判定DNA质量符合可用标准。
1.2.3.3 引物合成
引物设计及合成参照测序方法,其中引物序列为338F(ACTCCTACGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)。
1.2.3.4 扩增子制备及测序
吸取40 ng不同组DNA提取液,加入2.5个单位的Accu Prime Taq DNA聚合酶,实现对16S rRNA基因的V3~V4高变区进行扩增的效果。按照DNA提取试剂盒步骤操作,依次加入5×FastPfu Buffer 4 µL,dNTPs µL,正向引物0.8 µL,逆向引物0.8 µL,DNA模板10 ng,并添加Free Water至20 µL反应体系。PCR扩增条件为:95 ℃下样本经初始变性处理2 min,循环扩增次数为20,单次循环条件为95 ℃下保持30 s,60 ℃下保持30 s,72 ℃下保持60 s。然后对PCR产物纯化,按照Agencourt AMPure XP 试剂盒步骤进行操作。选择高精确度DNA芯片7500,应用Bio Analyzer 2100生物分析仪对纯化扩增子进行定量分析。再利用NEXTFLEX Rapid DNA -Seq Kit构建文库,通过单个样本的纯化扩增子按照等摩尔浓度比进行文库模板富集,并通过磁珠回收PCR产物形成最终的文库。应用Bio Analyzer 2100生物分析仪对已构建文库的浓度进行鉴定,使用Illumina Mi Seq测序平台,利用PE法对基因片段两端信息进行检测,DNA片段两端分别和引物碱基进行互补,先形成“桥”,扩増为DNA簇,再线性化成DNA单链,捕捉荧光信号,获取碱基信息,如此反复,最后获得模板DNA片段序列。
1.3 数据处理
采用软件SPSS 22.0对单因素数据进行统计及方差分析,当P<0.05时即认为数据间存在显著性差异。肠道微生物数据处理,各组样品共有及特有OUT分类数、α多样性和β多样性、物种构成及丰富度等数据均在百迈克生物云平台上分析完成,云平台网站为(http://www.biomarker.com.cn/biocloud)。
2. 结果与分析
2.1 对T2DM小鼠空腹血糖的影响
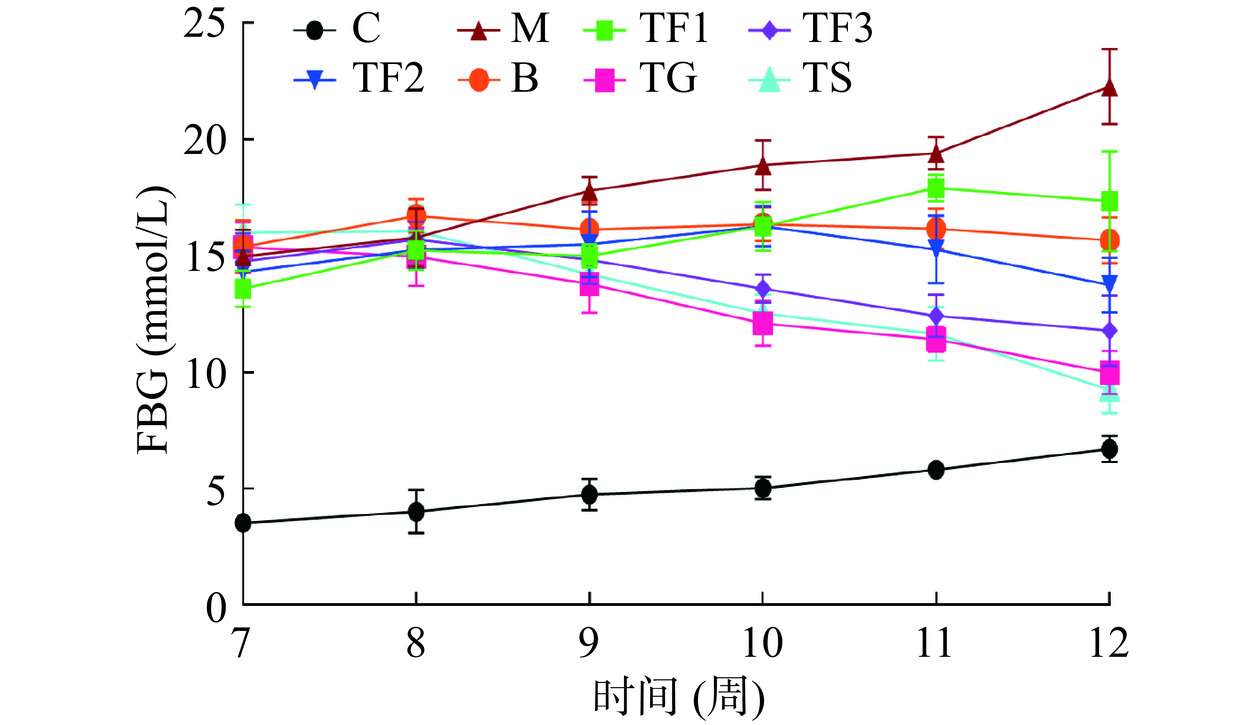
由图1可知,在第7周膳食干预初期,与C组相比,各处理组小鼠空腹血糖显著升高(P<0.05)。第9周后,不同剂量富含GABA红小豆膳食及GABA、二甲双胍组的小鼠血糖值开始出现变化,与M模型组相比,各处理组小鼠FBG值均明显下降。截至12周时,各干预组血糖值显著降低(P<0.05),且组间均一性良好,具体来说M模型组小鼠FBG为18.21±1.27 mmol/L,而TF3膳食干预组FBG为8.36±0.78 mmol/L,相比M组下降54.09%,TG组(10.12±1.46 mmol/L)相比M组下降44.42%,TS组(10.84±1.21 mmol/L)相比M组下降40.47%,TF3、TG和TS组与M模型组之间均存在显著差异(P<0.05)。表明富含GABA红小豆膳食干预具有良好平衡血糖的效果。高秋丽等[17]报道GABA强化米干预可缓解T2DM小鼠血糖水平上升,也是考察GABA以粮食携带方式调控糖尿病的研究。Chaiyasut等[18]给予HFD+STZ诱导T2DM小鼠补充发芽黑糙米,有助于预防和管理糖尿病,并可抵抗因高脂饲料摄入而引发糖尿病小鼠的体重的增加,与本研究结果吻合。
2.2 对T2DM小鼠肠道菌群的影响
2.2.1 Alpha多样性指数分析
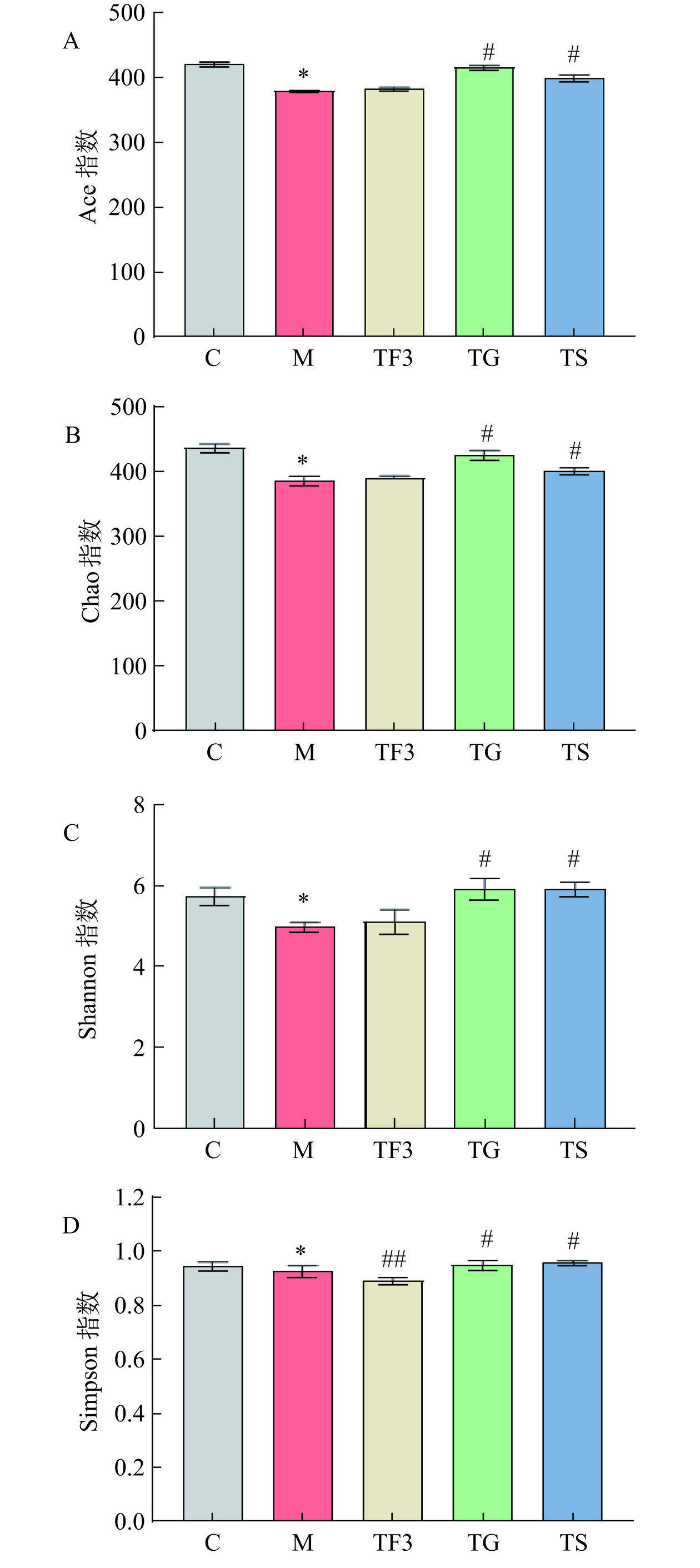
根据此前的研究,富含GABA膳食与微生物丰富度和多样性之间的关系尚无定论。因此本研究以Ace、Chao、Shannon和Simpson四个指标来评价所测样本的微生物菌群多样性,其中Ace、Chao指标侧重反映所测样本菌群的丰富度,Shannon和Simpson指数兼顾丰富度和均匀度。如图2A所示,M模型组Ace指数明显低于其他各处理组,其中比C组低10.57%,比TG组低9.38%,而M与TF3组之间无明显差异(P>0.05)。Chao和Shannon指数分析表明,M模型组显著低于正常对照C组(P<0.05),经TF3、TG和TS干预后,T2DM下属盲肠中就Chao指数呈不同程度增加,其中TF3组膳食干预相比M略微增加,TG组效果最好,以达到C正常组水平(图2B、图2C)。Simpson指数变化情况如图2D所示,发现高剂量富含GABA红小豆(TF3)膳食干预组Simpson指数最低,且与M模型组和C对照组之间均存在显著差异(P< 0.05)。综上分析,与M模型组相比,TF3膳食能够增加T2DM小鼠ACE、Chao和Shanon指数,极显著降低Simpson指数(P<0.01)。说明TF3处理可增加小鼠盲肠内微生物的多样性。
2.2.2 Beta多样性的分析
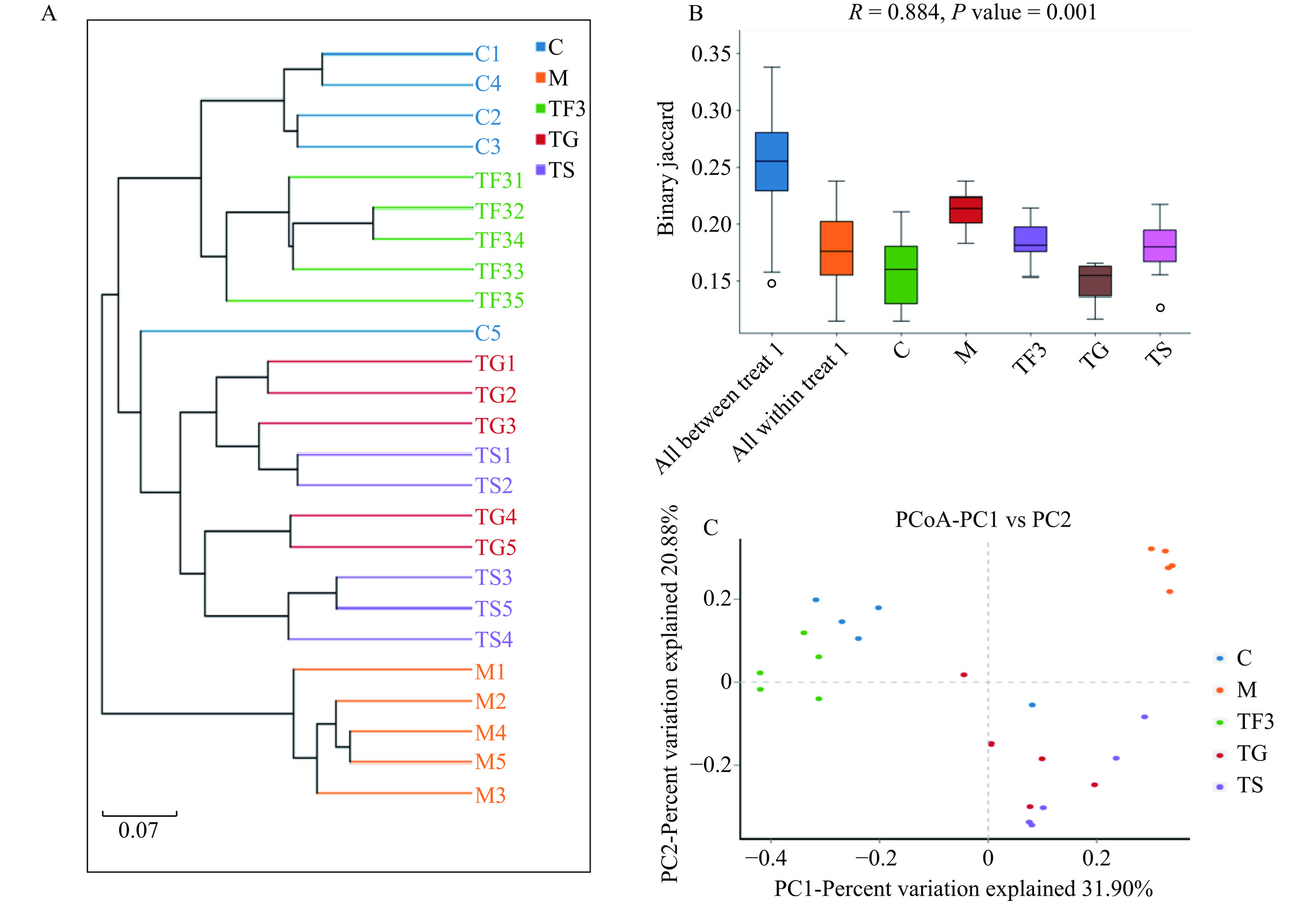
Beta多样性主要是依据所测样本序列之间的进化关系及菌群丰度信息来表征样本间菌群分布的差异。先对样本间的Bray-Curtis距离进行计算,之后利用主坐标分析(PCoA)寻找物种距离矩阵,并用UPGMA聚类树描述多个样本之间的物种结构的差异程度[19−20]。图3A为25个样本的聚类树,其中不同颜色代表不同分组,可以看到C、M、TF3、TG和TS各组间样本均出现较好的聚类,其中正常C组和M模型组之间距离最远,表明彼此之间微生物差异明显。而TF3、TG和TS干预可逆转糖尿病小鼠肠道微生物失衡状态,其中高剂量富含GABA红小豆(TF3)与C正常组小鼠相邻,表明TF3膳食干预比单一GABA及二甲双胍效果更显著,更有利于糖尿病小鼠肠道微生物恢复到健康状态。图3B为β多样性箱形图,它可直观反应组内样本相似性及组间的差异性。从图3B中可知,所有样本组内菌群差异极显著(P<0.001)。PCoA分析(图3C)揭示了C正常组与M模型组菌群已明显分离,而TF3、TG和TS处理组的微生物群向C正常组转移,其中TF3组多样本与C组非常接近,这与层级聚类分析的结果一致。这些结果表明TF3组小鼠盲肠内内容物微生物菌群与正常组相似,可改善因高血糖引起的肠道菌群的紊乱,且T2DM小鼠肠道微生物对高剂量富含GABA红小豆膳食反应十分敏感,其调控作用也极其明显。
2.2.3 门水平下群落组成的变化
基于不同分类学水平,评估富含GABA红小豆对T2DM小鼠肠道微生物群落组成的影响,寻找优势菌以及调控血糖作用之间的关联性。
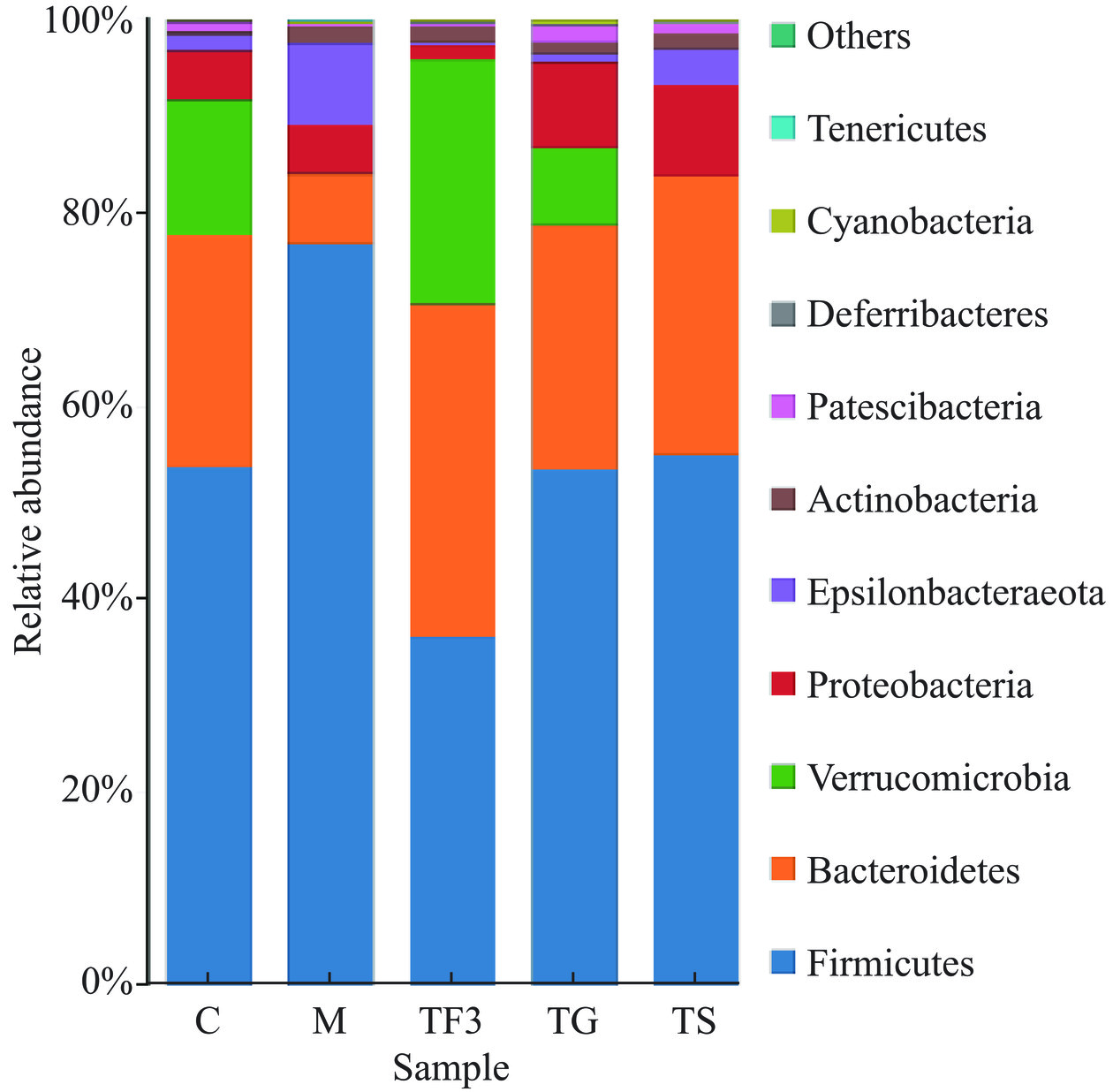
在门水平下对物种进行初步分析,由图4所示,发现小鼠盲肠中有6种优势菌群,分别是Firmicutes、Bacteroidetes、Verrucomicrobia、Proteobacteria、Epsilonbacteraeota、Actinobacteria。在Firmicutes(厚壁菌门)水平上,与C组(53.78%)相比,M组中Firmicutes(76.79%)相对丰度比例显著升高(P<0.05),而TF3组小鼠Firmicutes(35.96%)丰度显著下降(P <0.05),TG、TS组与对照差异不显著(P>0.05)。在Verrucomicrobia(疣微菌门)水平上,与对照C组相比,TF3、TG组丰度显著增加(P<0.05),但TF3与对照差异不显著(P>0.05),TS和M组丰度均显著低于对照(P<0.05),占比分别为0.2%和0.07%。在Bacteroidetes(拟杆菌门)水平上,T2DM模型组丰度最低(7.14%),TF3膳食干预使拟杆菌门的丰度增加至34.62%,显著高于其他各组(P<0.05),TG和TS药物干预与C组之间差异不显著(P>0.05),表明药物组逆转了优势菌组成的改变,使糖尿病小鼠肠道菌群组成接近于正常健康小鼠。
肠道菌群失衡形成的主要诱因与不健康的饮食习惯及饮食因素密切相关[21]。据报道摄入过多过度营养饮食会破坏菌群多样性和稳定性,引起肠道微生物组成的不平衡,诱发慢性低度炎症,增强了肠壁通透性和脂多糖的合成,引起葡萄糖代谢紊乱,甚至导致胰岛素抵抗(IR)和糖尿病的形成[22−23]。通过对各组门水平初步比较,发现T2DM模型组Firmicutes丰度显著增加(P<0.05),Bacteroidetes显著降低(P<0.05),F/B比值为10.75,比对照组高出8.51,TG、TS与对照组极其接近,分别为2.11、1.91,TF组F/B比值最低。说明富含GABA红小豆膳食干预对Firmicutes和Bacteroidetes有显著影响,且Firmicutes/Bacteroidetes的比例与糖尿病呈正相关,这与文献[24−25]研究结论一致。可能是Firmicutes和Bacteroidetes存在共生关系,有助于肠道对能量的吸收及存储,进而达到调控宿主代谢的作用。在T2DM模型组小鼠中,F/B比值升高,增加了能量利用。TF3、TG和TS的干预组F/B比值降低,减少了能量吸收,对小鼠糖代谢紊乱起到改善作用。也有研究证实,Firmicutes和Bacteroidetes不仅是小鼠肠道优势菌群,也是人类肠道优势菌群[26]。另外,有研究认为Clostridium difficile、Eubacteriumrectale、Verrucomicrobiaceae等菌群的增加会对糖尿病症状起到改善作用[27]。本研究中,TG、TF干预组增加了Verrucomicrobia的丰度,M组和TS组Verrucomicrobia丰度下降趋于零,表明高剂量富含GABA红小豆组(TF3)改善糖脂代谢与Verrucomicrobia的增加关系密切。Peng等[28]也证实了Verrucomicrobia与Bacteroidaceae的改变对粪便代谢物有显著影响,与本研究结果相符。此外,Zhang等[29]发现Verrucomicrobia和Bacteroidaceae在糖尿病小鼠模型中也发生了失调[29]。Liu等[30]证实Verrucomicrobia与肿瘤坏死因子(TNF-α)和干扰素γ的浓度升高有关。此外,还有研究进一步发现Verrucomicrobia和Bacteroidaceae与TNF-α、白细胞介素-1β和白细胞介素-6呈反相关[31]。这些发现揭示Verrucomicrobia、Bacteroidaceae及其相关的粪便代谢产物可能与T2DM相关的炎症有关。
鉴于此,高剂量富含GABA红小豆在平衡小鼠血糖的同时会对肠道菌群的构成产生显著影响,并推测TF3膳食降血糖作用可能是通过增加Verrucomicrobia和Bacteroidaceae优势菌丰度来调节肠道菌群紊乱,进而实现抑制炎症因子来改善糖脂代谢水平。
2.2.4 肠道菌群的物种差异分析
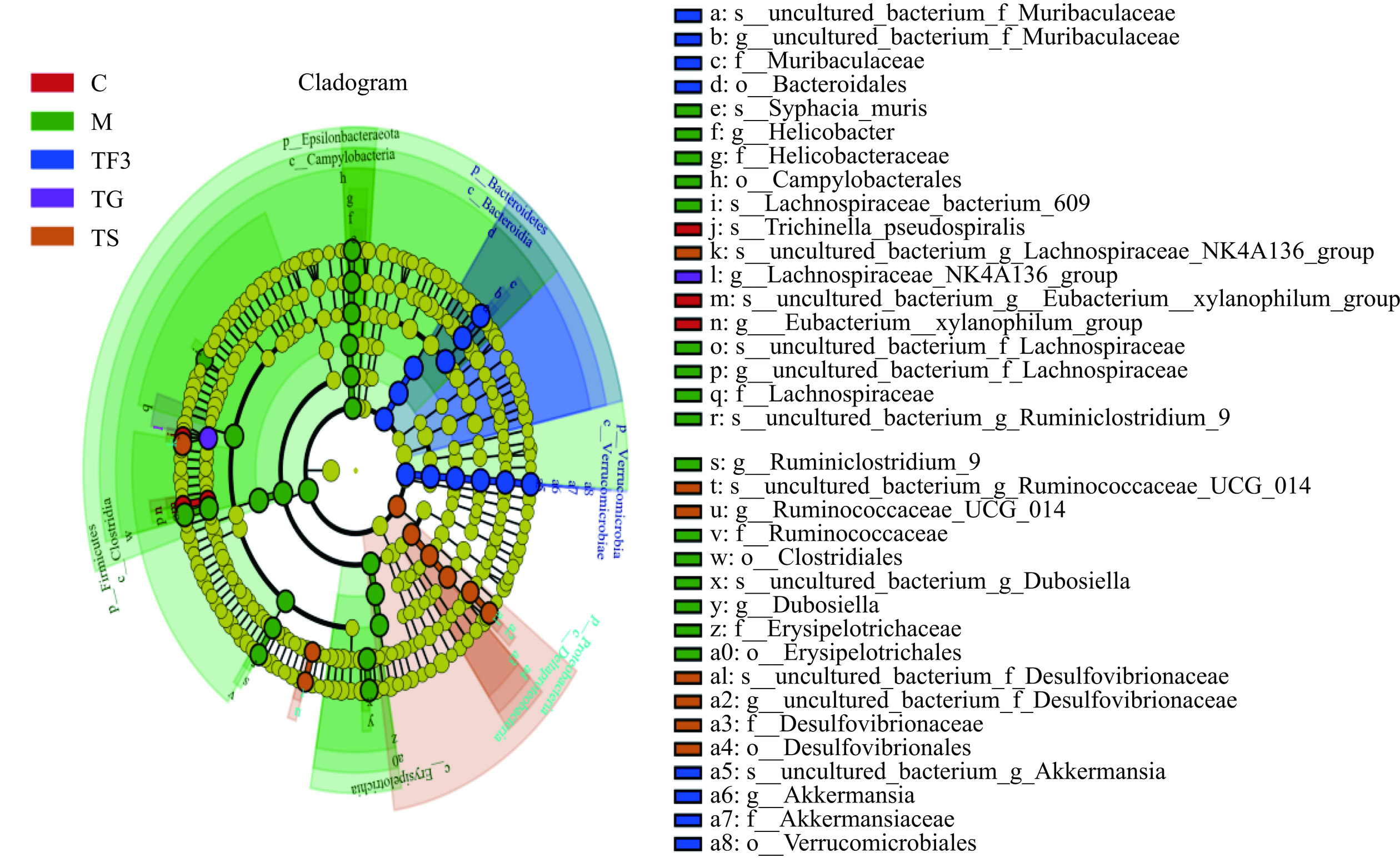
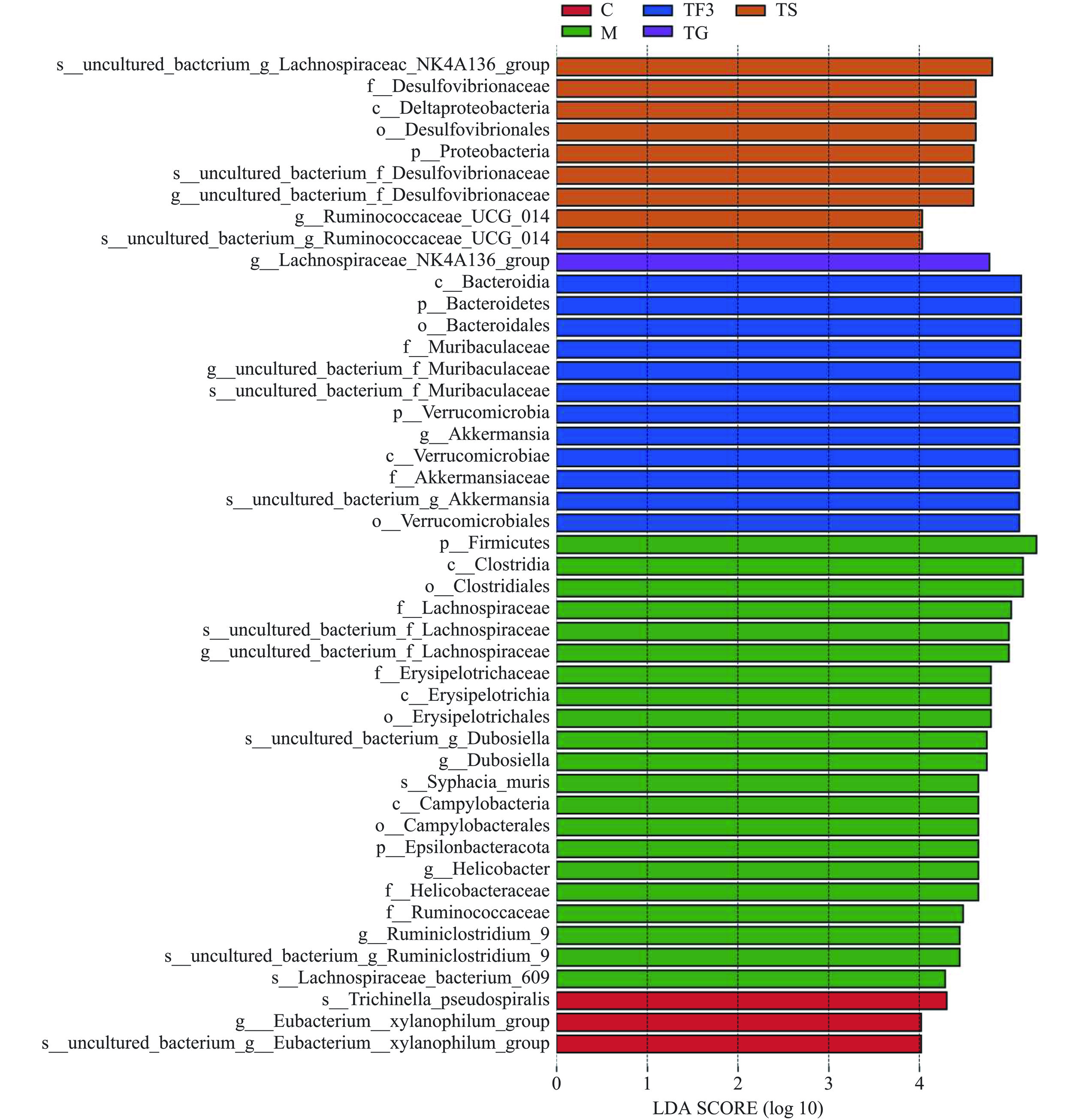
为了更清楚地了解富含GABA红小豆膳食干预对糖尿病小鼠盲肠的生物标记物种的影响程度,利用LEfSe对不同处理组样本与物种关系进行分析,通过Kruskal-Wallis和Wilcoxon检验显著丰度差异特征,确定不同组间具有显著差异的分类单元(即为生物标记物种),之后采用线性判别分析(LDA)评估每个组物种的丰度对差异效果的影响大小(即LDA得分)。其LEfSe分析结果如图5,LDA得分判别见图6所示。
从图5中可看出,图例不同颜色表示不同分组,圆圈大小与物种的相对丰度成正比,即圆圈越大,表示其物种丰度越高。图中右侧为基于多分类水平的不同组中潜在biomarker名称,LEfSe分析验证了TF3膳食及药物处理TG可以显著改变糖尿病小鼠肠道内微生物特征,其具体影响力见图6所示。据不同组LDA得分可知,C正常对照组的微生物菌群的特征是主要由Firmicutes门下的Trichinella_pseudospiralis、Eubacterium_xylanophilum_group等3种存在显著不同的群落(P<0.05),TF3组膳食干预后主要对Verrucomicrobia、Akkermansia、f_Muribaculaceae、Bacteroidetes菌群的选择性显著上调(P<0.05)。TS二甲双胍处理组对毛螺菌科(Lachnospiraceae)和瘤胃菌科(Ruminococcaceae)的几个属有显著(P<0.05)的影响。Verrucomicrobia、Akkermansia、f_Muribaculaceae、Bacteroidetes这些菌被认为是一些有益菌,对机体具有一定的抗炎的作用,且可改善糖脂代谢,与糖尿病呈负相关[32],其中Bacteroidetes丰度占比最高,且与脂多糖(LPS)呈负相关,可通过抑制炎症因子来调节肠道菌群和平衡血糖,可推测Bacteroidetes是调节T2DM的菌群失衡的标志菌。而Dubosiella、Epsilonbacteraeota在M模型组中丰度值显著高于C对照组(P<0.05),该菌在T2DM小鼠肠道内高丰度被认为是反馈高血糖的一种途径。这进一步印证了TF3膳食降血糖可能是通过增加有益菌,降低有害菌来实现调控肠道微生态,进而起到改善血糖和血脂的作用。
3. 结论
本研究表明,高剂量富含GABA红小豆可有效控制T2DM小鼠空腹血糖水平,并能引起盲肠肠道微生物组成的变化,门水平上显著降低了Firmicutes的丰度,并显著增加了具有改善糖脂代谢作用的Verrucomicrobia和Bacteroidetes有益菌丰度,进而来缓解T2DM小鼠肠道菌群失调,最终使宿主受益,达到降血糖的作用。但仅局限于T2DM小鼠盲肠内容物中菌群组合及变化规律,这些优势菌对肠道菌群及健康改善作用还需要进一步验证。此外,未来可进一步探寻富含GABA红小豆膳食干预与肠道菌炎症因子之间关系,利用全面评估和阐释富含GABA红小豆降糖作用与肠道菌群之间的内在联系。为富含GABA豆类资源加工应用和增加T2DM的食物干预方法提供基础依据。
-
-
[1] KHAN M A B, HASHIM M J, KING J K, et al. Epidemiology of type 2 diabetes-global burden of disease and forecasted trends[J]. Journal of Epidemiology and Global Health,2020(10):107−111.
[2] AMALIA M, PUTERI M U, SAPUTRI F C, et al. Platelet glycoprotein-Ib (GPIb) may serve as a bridge between type 2 diabetes mellitus (T2DM) and atherosclerosis, making it a potential target for antiplatelet agents in T2DM patients[J]. Life (Basel),2023,13(7):1473. doi: 10.3390/life13071473
[3] MERRY A H, ERKENS P M, BOER J M, et al. Co-occurrence of metabolic factors and the risk of coronary heart disease:A prospective cohort study in the Netherlands[J]. International Journal of Cardiology,2012,155(2):223−229. doi: 10.1016/j.ijcard.2010.09.047
[4] 丁忠, 贾艳菊, 生庆海. 豆类在糖尿病饮食干预中的作用[J]. 农产品加工,2021(1):66−70. [DING Z, JIA Y J, SHENG Q H. The role of legumes in diabetic diet intervention[J]. Farm Products Processing,2021(1):66−70.] DING Z, JIA Y J, SHENG Q H. The role of legumes in diabetic diet intervention[J]. Farm Products Processing, 2021(1): 66−70.
[5] 许庆鹏, 姜秀杰, 张家瑜, 等. 冷等离子体联合L-谷氨酸与盐胁迫对红小豆萌发富集γ-氨基丁酸的效果及工艺条件[J]. 食品工业科技,2023,44(22):160−168. [XU Q P, JIANG X J, ZHANG J Y, et al. Effect and process conditions of cold plasma combined with L-glutamic acid and salt stress on germination and enrichment of γ-aminobutyric acid in adzuki bean[J]. Science and Technology of Food Industry,2023,44(22):160−168.] XU Q P, JIANG X J, ZHANG J Y, et al. Effect and process conditions of cold plasma combined with L-glutamic acid and salt stress on germination and enrichment of γ-aminobutyric acid in adzuki bean[J]. Science and Technology of Food Industry, 2023, 44(22): 160−168.
[6] YAO Y, CHENG X, REN G. Alpha-glucosidase inhibitory activity of protein-rich extracts from extruded adzuki bean in diabetic KK-Ay mice[J]. Food & Function,2014,5(5):966−971.
[7] ZHANG D R, WEI X N, LIU Z, et al. Transcriptome analysis reveals the molecular mechanism of GABA accumulation during Quinoa (Chenopodium quinoa Willd.) germination[J]. Journal of Agricultural and Food Chemistry,2021,69(41):12171−12186. doi: 10.1021/acs.jafc.1c02933
[8] VANN K, TECHAPARIN A, APIRAKSAKORN J. Beans germination as a potential tool for GABA-enriched tofu production[J]. Journal of Food Science and Technology,2020,57(1):1−8. doi: 10.1007/s13197-019-04044-6
[9] YANG R Q, HUI Q R, FENG X Y, et al. The mechanism of freeze-thawing induced accumulation of γ-aminobutyric acid in germinated soybean[J]. Journal of the Science of Food and Agriculture,2020,100(3):1099−1105. doi: 10.1002/jsfa.10118
[10] JIANG X J, XU Q P, ZHANG J Y, et al. Nutrient transfer and antioxidant effect of adzuki bean before and after GABA enrichment[J]. Frontiers in Nutrition,2023(10):1123075.
[11] Al-KURAISHY H M, HUSSIAN N R, Al-NAIMI M S, et al. The potential role of pancreatic γ-aminobutyric acid (GABA) in diabetes mellitus:A critical reappraisal[J]. International Journal of Medical Sciences, 2021(2):12:19.
[12] MONK J M, WU W, LEPP D, et al. Navy bean supplementation in established high-fat diet-induced obesity attenuates the severity of the obese inflammatory phenotype[J]. Nutrients,2021,13(3):757. doi: 10.3390/nu13030757
[13] TAN Y, TAM C C, MENG S, et al. Cooked black turtle beans ameliorate insulin resistance and restore gut microbiota in C57BL/6J mice on high-fat diets[J]. Foods,2021,10(8):1691. doi: 10.3390/foods10081691
[14] HOU D Z, ZHAO Q Y, YOUSAF L, et al. Whole mung bean (Vigna radiata L.) supplementation prevents high-fat diet-induced obesity and disorders in a lipid profile and modulates gut microbiota in mice[J]. European Journal of Nutrition,2020,59(8):3617−3634. doi: 10.1007/s00394-020-02196-2
[15] 张宇新. GABA 通过调节肠道内有益菌群有效改善糖尿病模型兔的血糖水平[D]. 长春:吉林大学, 2020. [ZHANG Y X. GABA effectively improves blood glucose level of diabetic rabbits through intestinal beneficial flora[D]. Changchun: Jilin University, 2020.] ZHANG Y X. GABA effectively improves blood glucose level of diabetic rabbits through intestinal beneficial flora[D]. Changchun: Jilin University, 2020.
[16] IMAM M U, MUSA S N, AZMI N H, et al. Effects of white rice, brown rice and germinated brown rice on antioxidant status of type 2 diabetic rats[J]. International Journal of Molecular Sciences,2012,13(10):12952−12969.
[17] 高秋丽, 蒋羽鸽, 罗婷玉, 等. γ-氨基丁酸强化米缓解2型糖尿病模型小鼠胰腺损伤[J]. 卫生研究,2019,48(2):179−186. [GAO Q L, JIANG Y G, LUO T Y, et al. γ-aminobutyric acid fortified rice alleviated oxidative stress and pancreatic injury in type 2 diabetic mice[J]. Jouranal of Hygiene Research,2019,48(2):179−186.] GAO Q L, JIANG Y G, LUO T Y, et al. γ-aminobutyric acid fortified rice alleviated oxidative stress and pancreatic injury in type 2 diabetic mice[J]. Jouranal of Hygiene Research, 2019, 48(2): 179−186.
[18] CHAIYASUT C, SIVAMARUTHI B S, PENGKUMSRI N, et al. Germinated Thai black rice extract protects experimental diabetic rats from oxidative stress and other diabetes-related consequences[J]. Pharmaceuticals,2016,10(1):3.
[19] 叶紫梦玮, 徐冰蕊, 赵祎, 等. 人参皂苷Rb1、小檗碱及其联合应用对肥胖小鼠肠道菌群的影响[J]. 北京中医药大学学报,2023,46(11):1541−1553. [YE Z M W, XU B R, ZHAO W, et al. Effect of ginsenoside Rb1, berberine, and their combination on intestinal flora in obese mice[J]. Journal of Beijing University of Traditional Chinese Medicine,2023,46(11):1541−1553.] YE Z M W, XU B R, ZHAO W, et al. Effect of ginsenoside Rb1, berberine, and their combination on intestinal flora in obese mice[J]. Journal of Beijing University of Traditional Chinese Medicine, 2023, 46(11): 1541−1553.
[20] 刘奔, 高晓雨, 程学英, 等. 红茶对2型糖尿病小鼠肠道菌群分布的影响[J]. 中国微生态学杂志,2023,35(11):1272−1279. [LIU B, GAO X Y, CHENG X Y, et al. The effect of black tea on intestinal flora distribution in type 2 diabetes mice[J]. China Journal Microecology,2023,35(11):1272−1279.] LIU B, GAO X Y, CHENG X Y, et al. The effect of black tea on intestinal flora distribution in type 2 diabetes mice[J]. China Journal Microecology, 2023, 35(11): 1272−1279.
[21] FUKE N, NAGATA N, SUGANUMA H, et al. Regulation of gut microbiota and metabolic endotoxemia with dietary factors[J]. Nutrients,2019,11(10):2277. doi: 10.3390/nu11102277
[22] TANASE D M, GOWAV E M, NECULAE E, et al. Role of gut microbiota on set and progression of microvascular complications of type 2 diabetes (T2DM)[J]. Nutrients,2020,12(12):3719.
[23] CANDIDO F G, VALENTE F X, GRZESKOWIAK L M, et al. Impact of dietary fat on gut microbiota and low-grade systemic inflammation:Mechanisms and clinical implications on obesity[J]. International Journal of Food Sciences and Nutrition,2018,69(2):125−143.
[24] LI X W, CHEN H P, HE Y Y, et al. Effects of rich-polyphenols extract of dendrobium loddigesii on anti-diabetic, anti-inflammatory, anti-oxidant, and gut microbiota modulation in db/db mice[J]. Molecules,2018,23(12):3245. doi: 10.3390/molecules23123245
[25] CHEN C, YOU L J, HUANG Q, et al. Modulation of gut microbiota by mulberry fruit polysaccharide treatment of obese diabetic db/db mice[J]. Food & Function,2018,9(7):3732−3742.
[26] SALGACO M K, OLIVEIRA L G S, COSTA G N, et al. Relationship between gut microbiota, probiotics, and type 2 diabetes mellitus[J]. Applied Microbiology and Biotechnology,2019,103(24):9229−9238.
[27] HARTSTRA A V, BOUTER K E, BACKHED F, et al. Insights into the role of the microbiome in obesity and type 2 diabetes[J]. Diabetes Care,2015,38(1):159−165. doi: 10.2337/dc14-0769
[28] PENG W, HUANG J, YANG J, et al. Integrated 16S rRNA sequencing, metagenomics, and metabolomics to characterize gut microbial composition, function, and fecal metabolic phenotype in non-obese type 2 diabetic goto-kakizaki rats[J]. Frontiers in Microbiology,2020,10:3141. doi: 10.3389/fmicb.2019.03141
[29] ZHANG H H, LIU J, LU Y J, et al. Changes in Intestinal microbiota of type 2 diabetes in mice in response to dietary supplementation with instant tea or matcha[J]. Can J Diabetes,2020,44(1):44−52. doi: 10.1016/j.jcjd.2019.04.021
[30] LIU C H, CHEN C C, CHIANG H L, et al. Altered gut microbiota and inflammatory cytokine responses in patients with Parkinson's disease[J]. Journal Neuroinflammation,2019,16(1):129. doi: 10.1186/s12974-019-1528-y
[31] KIM S J, KIM S E, KIM A R, et al. Dietary fat intake and age modulate the composition of the gut microbiota and colonic inflammation in C57BL/6J mice[J]. BMC Microbiolgy,2019(19):193.
[32] IATCU C O, STEEN A, COVASA M. Gut Microbiota and complications of type-2 diabetes[J]. Nutrients,2021,14(1):166. doi: 10.3390/nu14010166
-
期刊类型引用(0)
其他类型引用(2)





 下载:
下载:
 下载:
下载:



