Effects of Cold Plasma Technology on the Structural and Functional Properties of Highland Barley Protein
-
摘要: 本研究旨在通过采用低温等离子体技术对青稞蛋白进行改性,探究不同处理条件对青稞蛋白结构特性和功能特性的影响。采用扫描电子显微镜(SEM)观察青稞蛋白微观结构的变化;十二烷基琼脂糖凝胶电泳(SDS-PAGE)研究其一级结构的变化;傅里叶红外光谱和荧光光谱分别研究其二级、三级结构的变化,并分析了低温等离子体对青稞蛋白基本功能性质的影响。结果表明:随着处理时间的增加,样品表面形态被破坏,孔洞增大且数量增多。低温等离子体处理后蛋白的一级结构未发生改变,二级结构中β-折叠含量显著增加(P<0.05),α-螺旋、无规卷曲含量显著降低(P<0.05)。此外,三级结构中表面疏水性显著增加(P<0.05)、荧光强度下降。与未处理样品相比,低温等离子体处理40 min后青稞蛋白的溶解度、持水性、乳化特性和起泡性能达到最佳。综上所述,低温等离子体处理通过改变青稞蛋白的结构特性,促进了功能性质的改善,对青稞蛋白和青稞资源的利用具有重要指导意义。Abstract: To modify highland barley protein by low temperature plasma technology, and to explore the effects of different treatment conditions on the structural and functional properties of highland barley protein. Scanning electron microscopy (SEM) was used to observe changes in the microstructure of highland barley protein. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) was employed to study changes in its primary structure. Fourier-transform infrared spectroscopy and fluorescence spectroscopy were utilized to analyze changes in its secondary and tertiary structures. Additionally, the impact of cold plasma on the basic functional properties of barley protein was analyzed. The results showed that with the increased treatment time, the surface morphology of the samples was disrupted, resulting in increased pore size and quantity. The primary structure of the protein remained unchanged after cold plasma treatment, while the β-sheet content in the secondary structure significantly increased (P<0.05), and the α-helix and random coil content significantly decreased (P<0.05). Moreover, the tertiary structure analysis revealed a significant increase in hydrophobicity (P<0.05) and a decrease in fluorescence intensity. Compared to untreated samples, after 40 min of cold plasma treatment, the solubility, water-holding capacity, emulsifying properties, and foaming properties of highland barley protein reached optimal levels. In conclusion, cold plasma treatment would improve the functional properties of highland barley protein by modifying its structural characteristics, offering important guidance for the utilization of highland barley protein and barley resources.
-
Keywords:
- highland barley protein /
- cold plasma /
- structure properties /
- function properties
-
青稞是青藏高原特有的粮食作物,富含β-葡聚糖、膳食纤维、酚类化合物、维生素E和γ-氨基丁酸等生物活性成分,具有“两高一低”(高膳食纤维、高蛋白、低血糖生成指数)的营养特性,已成为开发健康食品的理想原料[1]。蛋白质是青稞中的重要营养功能成分,平均含量约为12.43%,高于水稻蛋白或玉米蛋白[2]。青稞蛋白是含有18种氨基酸的优质植物蛋白来源,其中人体必需的8种氨基酸含量较高,尤其富含限制性氨基酸如赖氨酸,含量高达0.79%[3]。但是青稞蛋白的功能特性并不理想,具有较低的溶解性、乳化性和成膜性,限制了其在食品基质中的应用。在食品加工过程中通常会使用酶、化学和物理法改善蛋白质的功能特性以满足实际生产的要求,然而传统改性方法通常需要较高的成本和能耗,其对环境不友好且可能对人体健康不利。因此,使用生态友好的非热物理方法修饰蛋白质结构并改善其功能特性已经成为当下食品科学领域的一个研究热点[4]。低温等离子体技术是通过自身产生的活性氧(ROS)、活性氮(RNS)、自由基及高速电子打破蛋白质中共价键并引发各种化学反应对蛋白进行改性的一种新型非热技术,既能较好保持蛋白原有的营养价值,也能改善其功能特性[5]。
近年来,低温等离子体技术在蛋白质分子结构修饰和功能化方面显示出巨大的潜力。李可等[6]利用介质阻挡放电(DBD)等离子体对鹰嘴豆分离蛋白(CPI)进行改性处理,经等离子体处理后,CPI溶液的溶解性、乳化活性和乳化稳定性得到显著的改善(P<0.05)。Abarghoei等[7]采用低温等离子体对小麦胚芽蛋白(WGPI)进行改性,发现适当的功率和有限的时间(25 kV和5 min)可以有效地改善WGPI的功能性能,而不会产生明显的破坏作用。Sharafodin等 [8]采用DBD等离子体对大豆分离蛋白(SPI)进行改性,结果表明,SPI的乳化性能、溶解度、持水力和发泡性能均得到提高,且在18 kV处理15 min后达到最大值。青稞作为一种优质的植物蛋白资源,由于种植区域的限制,国内外对青稞蛋白功能特性的研究较少,在一定程度上限制了青稞的深加工与利用。而且近年来通过低温等离子体技术处理提高植物蛋白功能的研究主要涉及SPI、豌豆蛋白和花生蛋白,该技术对青稞蛋白的改性研究目前尚未见报道。
因此,本研究采用低温等离子体技术对青稞蛋白进行不同时间的处理,评价不同条件下等离子体处理的青稞蛋白形态、结构及溶解度、持水性、乳化性和起泡性等功能特性的影响,并进一步分析了等离子体处理下青稞蛋白结构与功能的相互联系,以期为扩大青稞蛋白在食品加工中的应用提供理论与技术依据,这对提高青稞蛋白的经济价值具有重要意义。
1. 材料和方法
1.1 材料与仪器
青稞籽粒 西宁昆仑18号(由青海省农林科学院提供);氢氧化钠、盐酸均为分析纯 国药集团化学试剂有限公司;5,5ʹ-二硫-2-硝基苯甲酸(DTNB) 上海少辛生物科技有限公司;8-苯胺基-1-萘磺酸(ANS) 北京伊诺凯科技有限公司;葵花籽油 北京广达恒益科技有限公司。
低温等离子体设备 中国农业科学院蜜蜂研究所(高压电源型号YD(JZ)-1.5/50、控制器型号KZX-1.5KVA);BF2000-2C分析天平 北京赛欧华创科技有限公司;XHF-D高速分散器、SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;MB-RC52精米机 北京广达恒益有限公司;DM5-2200破壁机 德玛仕(德国)有限公司;LXJ-B型飞鸽离心机 上海安亭科学仪器厂;FE28型pH计 梅特勒-托利多仪器(上海)有限公司;Nexus470傅里叶变换红外光谱仪 美国NICOLET 公司;SU8010扫描电子显微镜、F-2500荧光分光光度计 日本东京日立有限公司公司;SP-Max2300A2光吸收型全波长酶标仪 上海闪谱生物科技有限公司。
1.2 实验方法
1.2.1 青稞蛋白的提取
采用碱溶酸沉法[9]提取青稞蛋白并做了一些修改。采用精米机碾磨青稞籽粒,去除青稞麸皮,然后去离子水浸泡过夜;以1:15(w/v)的比例加入去离子水用破壁机打浆,高速搅打4个1 min。用2 mol/L NaOH调节浆液pH至10.5,4500 r/min离心10 min。取上清液用2 mol/L HCl调节pH至青稞蛋白等电点4.5,水洗沉淀后取沉淀冷冻干燥,样品存放−20 ℃冰箱备用。
1.2.2 青稞蛋白的低温等离子体处理
称取2 g青稞蛋白粉,平铺于直径90 mm的培养皿中,低温等离子体处理条件为:电压30 kV、频率为50 Hz,上下电极距离约4 cm。样品分别处理0、10、20、30、40 min,回收后置于−20 ℃冰箱中保存,分别记为T0、T1、T2、T3和T4。
1.2.3 蛋白质结构特性测定
1.2.3.1 扫描电子显微镜(SEM)观察
各处理组青稞蛋白粉末用双面胶带固定在扫描镜的载物台上,并用离子溅射镀膜仪溅射镀金,电子枪加速电压为 10 kV,在2000倍下进行观察。
1.2.3.2 十二烷基琼脂糖凝胶电泳(SDS-PAGE)分析
采用12%分离胶、5%浓缩胶对青稞蛋白进行SDS-PAGE分析。称量50 mg蛋白加入2 mL 1 mol/L pH8.8 Tris-HCl充分涡旋混匀后,离心取其上清液,上清液与5×蛋白上样缓冲液按4:1比例混匀后沸水浴中加热5 min,静置冷却至室温后,吸取10 μL上样;运行电压为90 V。凝胶分别用考马斯亮蓝快速染色液和脱色液进行染色和脱色。非还原型电泳的方法同上,但是使用的上样缓冲液中不含DTT且操作时不用沸水浴加热。
1.2.3.3 衰减全反射傅立叶红外光谱(ATR-FTIR)分析
吸取1 mg/mL蛋白浓度的上清液约20 μL于ATR附件上,扫描条件为波数500~4000 cm−1,设置分辨率为4 cm−1,共扫描64次。记录红外光谱图。采用Omnic对各谱图进行自动基线校正、去卷积、二阶求导,然后采用 Peakfit 4.12软件对红外光谱图的酰胺Ⅰ带(1600~1700 cm−1)进行分析并计算蛋白二级结构的相对含量。
1.2.3.4 表面疏水性(H0)测定
采用ANS疏水荧光探针法[10]测定不同处理时间下青稞蛋白的H0。用0.01 mol/L pH7.0 磷酸盐缓冲液(PBS)制备浓度分别为0.01、0.05、0.1、0.2、0.4 mg/mL的蛋白溶液,取15 μL ANS(8 mmol/L)溶液加入到3 mL蛋白溶液中,在黑暗下反应10 min后在激发波长390 nm,发射波长470 nm,狭缝5 nm条件下迅速测定混合液的荧光强度。通过线性回归分析将荧光强度和青稞蛋白浓度的初始斜率作为H0。
1.2.3.5 荧光光谱测定
将浓度为1 mg/mL的蛋白溶液稀释100倍后采用F-2500荧光分光光度计进行测定。测量条件为:激发波长为280 nm,在5 nm的恒定狭缝下发射波长为300~500 nm,扫描速率为1500 nm/min。
1.2.3.6 游离巯基含量测定
将0.2 g蛋白加入到10 mL Tris-Gly-8 mol/L尿素溶液中充分搅拌溶解后,4500 r/min离心15 min,取上清液3 mL加入20 μL DTNB,然后25 ℃下反应30 min,用分光光度计在412 nm处测定其吸光度值。游离巯基(-SH)含量按下式进行计算:
巯基含量(µmol/g)=73.53×A412×DC (1) 式中:73.53为DTNB的摩尔吸光系数;A412为样品在412 nm处吸光度;D为样品稀释倍数,取6.04;C为样品质量浓度(mg/mL)。
1.2.4 蛋白质功能特性测定
1.2.4.1 溶解度
参考Du等[11]的方法并稍作修改。取0.2 g不同处理时间的青稞蛋白溶于10 mL 0.01 mol/L pH7.0 PBS中,在室温下磁力搅拌2 h,放入4 ℃冰箱中过夜以完全水合。将得到的蛋白溶液在3000×g上离心3 min,用酶标仪测定溶液在595 nm下的吸光度。根据考马斯亮蓝G-250与蛋白质结合的Bradford法绘制的牛血清蛋白(BSA)标准曲线测定上清液中的蛋白质含量。溶解度的计算公式如下:
溶解度(%)=C1/C0×100 (2) 式中:C1为上清液中的蛋白浓度(mg/mL);C0为初始蛋白浓度(mg/mL)。
1.2.4.2 持水性
称取50 mg左右蛋白于5 mL离心管中,在离心管中加入2.5 mL去离子水,涡旋5 min使其充分混匀后在室温下静置30 min,4500 r/min离心15 min,弃去上清液,用滤纸吸干离心管壁的水分,称重并记录其质量。持水性按每克样品吸附水的质量(g/g)表示。持水性按下式进行计算:
持水性(g/g)=M2−M1M0 (3) 式中:M0为样品质量(g);M1为试管质量加样品质量(g);M2为吸水离心后试管质量加样品质量(g)。
1.2.4.3 乳化性(EAI)和乳化稳定性(ESI)
参考陈玉玉等[12]的方法。取6 mL浓度为2%、pH7.0的蛋白质上清液,加入2 mL葵花籽油在1000 r/min下高速分散1 min,立即从底部取50 μL于离心管中,加入5 mL 0.1% SDS,混匀后在500 nm下测定吸光度。室温下静置 30 min后,重复上述操作,均以0.1% SDS 溶液作为空白对照。根据以下公式计算乳化性和乳化稳定性。
EAI(m2/g)=2×2.303×A0×NC×ϕ×104 (4) ESI(%)=EAI30EAI×100 (5) 式中:A0为样品吸光度值;N为稀释倍数;C为样品质量浓度(g/mL);ϕ为乳液中油相所占比例,0.25;EAI、EAI30为0 min和30 min的乳化能力。
1.2.4.4 起泡性和泡沫稳定性
用0.01 mol/L pH7.0 PBS制备2%青稞蛋白悬浮液,室温下搅拌过夜以完全水化。取8 mL悬浮液在直径20 mm,高100 mm的25 mL量筒中,高速分散器下10000 r/min搅打1 min,快速读取其体积。30 min后再次读取泡沫体积计算泡沫稳定性。起泡性(FC)和泡沫稳定性(FS)用下式进行计算:
起泡性(%)=V1−V0V0×100 (6) 泡沫稳定性(%)=V30V1×100 (7) 式中:V1为搅拌后泡沫体积(mL);V30为泡沫保存30 min后的体积(mL);V0为溶液的初始体积(mL)。
1.3 数据处理
所有实验至少进行三次,用SPSS 20.0和Origin 2021对数据进行统计分析和作图处理,运用方差分析法(ANOVA)对数据进行显著性分析,P<0.05表示差异显著。
2. 结果与分析
2.1 低温等离子体处理对青稞蛋白微观结构的影响
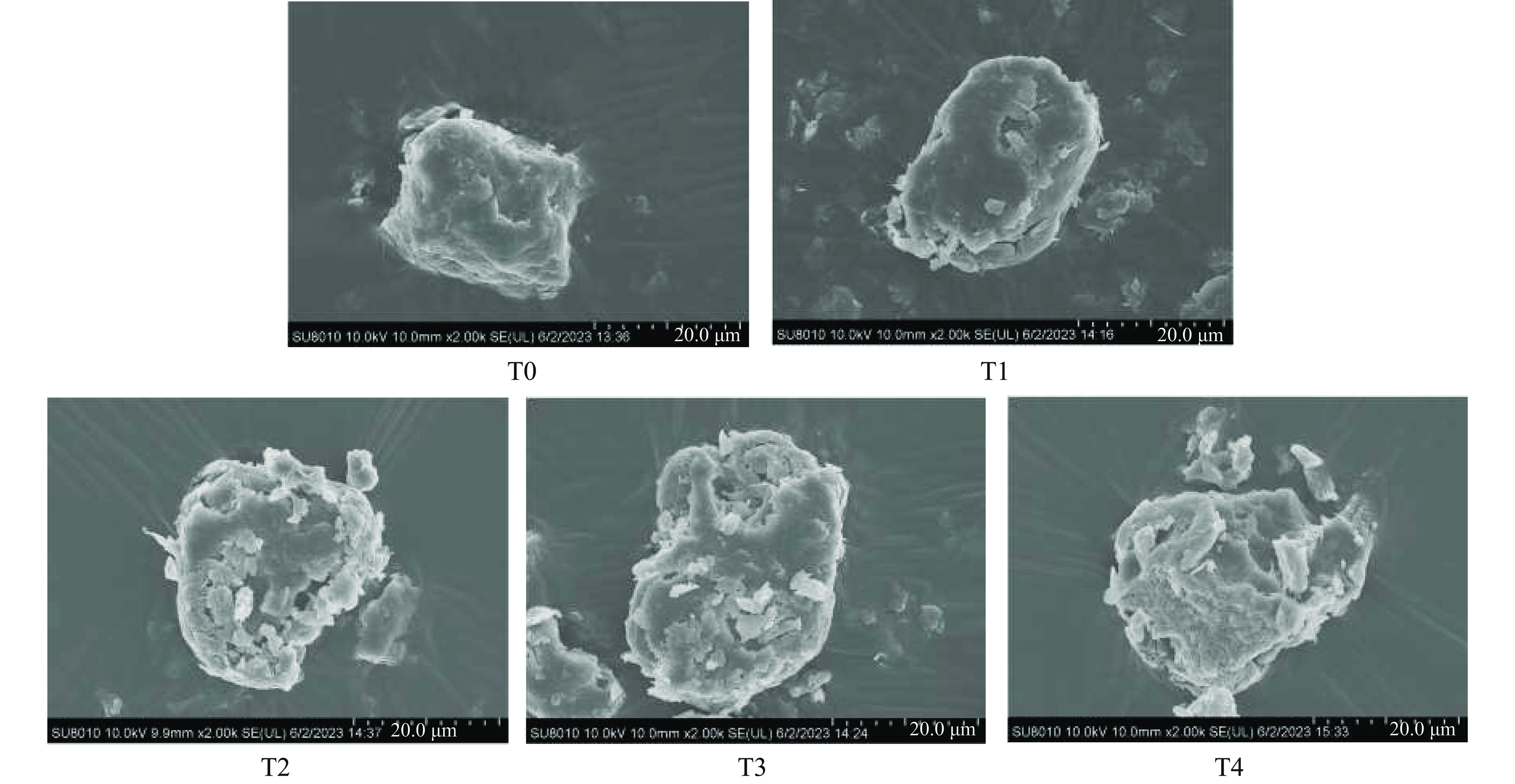
采用SEM研究了不同处理时间对青稞蛋白微观结构的影响。由图1对照组可见,青稞蛋白表面较平整且呈大块状。这与李涛[13]的研究结果相一致,青稞蛋白颗粒的外形比较完整,且呈不规则的球形。随着处理时间的增加,青稞蛋白表面被蚀刻且孔洞增大,20 min时,蛋白质表面的裂纹孔洞明显增加,40 min时,蛋白质表面基本全部被破坏,这可能是由于长时间的等离子体处理过程中产生的高能电子、离子和其他类型的活性物质的存在,这些活性物质会轰击蛋白表面,改变其形态[14]。
2.2 低温等离子体处理对青稞蛋白一级结构的影响
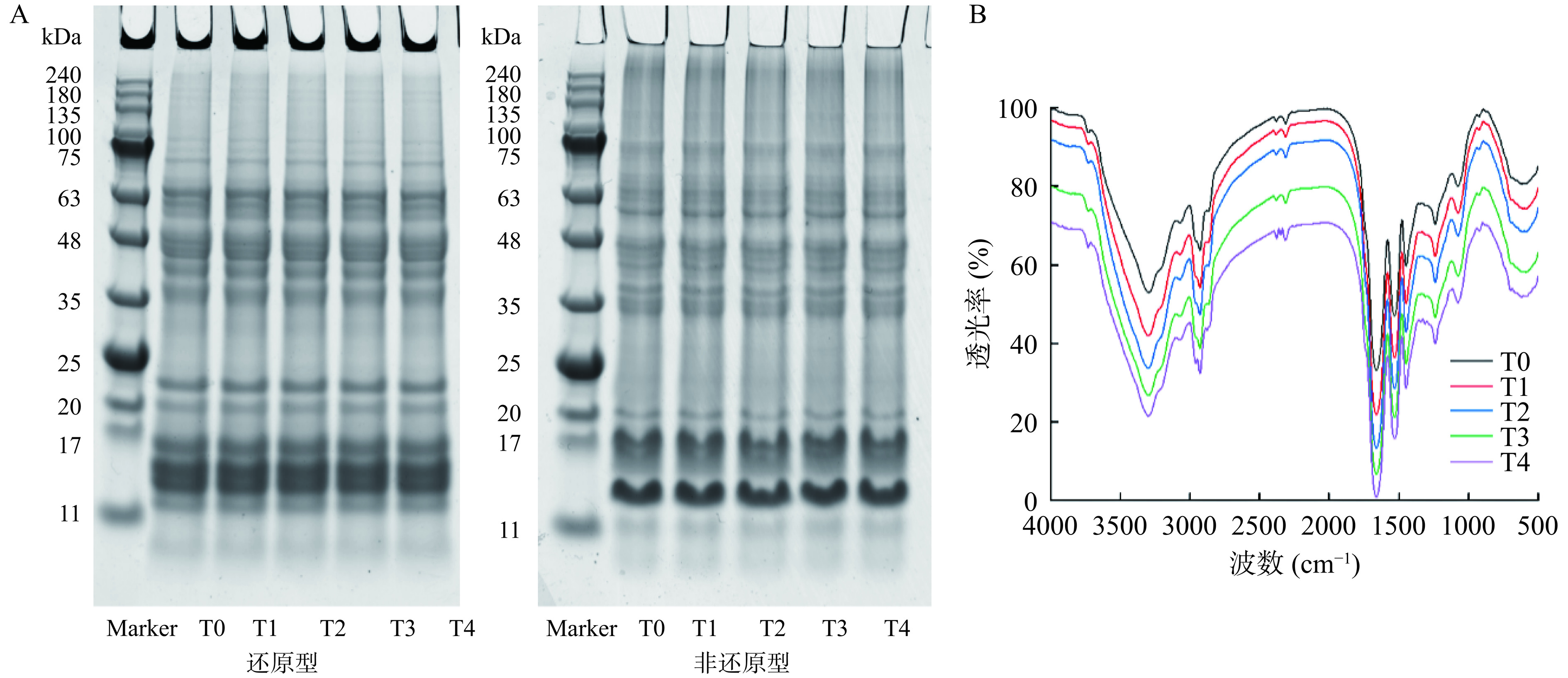
青稞蛋白包含清蛋白、球蛋白、醇溶蛋白、谷蛋白4种组分,其中含量最多的蛋白为醇溶蛋白和谷蛋白[15]。采用SDS-PAGE方法分析低温等离子体处理后青稞蛋白亚基的变化。由图2A还原型电泳图可知,青稞蛋白分子量主要分布在11~22 kDa、35~50 kDa、55~65 kDa和75~100 kDa的范围内,由Du等[16]的研究结果可知,醇溶蛋白的分子量在10~110 kDa范围内,主要亚基为35~60 kDa,谷蛋白的两个主要亚基分布在30~45 kDa和50~60 kDa(低分子量亚基),综上,11~22 kDa的条带应为清蛋白和球蛋白。与未处理的青稞蛋白相比,处理后的青稞蛋白在还原型和非还原型图谱上都没有差异,这表明,低温等离子体处理并未改变青稞蛋白的一级结构。该结果与季慧等[17]的研究结果相同,低温等离子处理花生分离蛋白粉末并没有改变花生蛋白的一级结构。
2.3 低温等离子体处理对青稞蛋白二级结构的影响
各处理组青稞蛋白的红外光谱图如图2B所示。酰胺I带(1600~1700 cm−1)是蛋白质主链中最突出、最敏感的振动带,与蛋白质的二级结构有关,由α-螺旋(1645~1662 cm−1)、β-折叠(1613~1637 cm−1)、β-转角(1682~1696 cm−1) 和无规卷曲(1662~1682 cm−1)[18]组成,因此选择它进行详细研究。
不同处理时间下青稞蛋白二级结构含量的拟合结果如表1所示。与未处理的青稞蛋白样品相比,β-折叠含量从最初36.67%±1.09%显著增加到42.33%±0.34%(P<0.05),α-螺旋从18.31%±0.42%显著下降到14.32%±0.46%(P<0.05),无规卷曲的含量也从14.77%±0.42%下降到13.18%±0.57%,β-转角的含量则无显著变化(P>0.05)。该结果与Wang等[19]处理CPI二级结构变化趋势一致。此外,Ji等[20]报告也称,在DBD等离子体处理后,花生分离蛋白β-折叠含量增加,α-螺旋含量下降。经过低温等离子体处理后,蛋白质二级结构发生变化可能包含以下原因:β-折叠的存在是蛋白质疏水的原因,等离子体处理导致蛋白质展开,从而增加了β-折叠的含量[21]。α-螺旋表示酰胺和水分子间氢键相互作用增加,低温等离子体处理降低了α-螺旋结构,破坏了氢键,使蛋白质分子变得更有弹性,从而导致蛋白质展开[22]。这些结果表明,等离子体处理破坏了青稞蛋白的二级结构,使其由α-螺旋和无规则卷曲转变为β-折叠,形成有部分无序结构的松散有序状态[23]。
表 1 低温等离子体处理对青稞蛋白二级结构的影响Table 1. Effects of cold plasma treatment on the secondary structure of highland barley protein处理时间 β-折叠(%) α-螺旋(%) β-转角(%) 无规则卷曲(%) T0 36.67±1.09b 18.31±0.42a 30.26±0.63a 14.77±0.42a T1 40.51±0.69a 16.30±0.67b 29.40±0.73a 13.45±0.21c T2 41.36±0.56a 16.20±0.19b 28.24±0.76a 14.12±0.46b T3 41.97±0.28a 15.87±0.75b 28.60±0.39a 13.18±0.57c T4 42.33±0.34a 14.32±0.46c 29.39±0.33a 13.26±1.22c 注:同一列中不同小写字母表示显著性差异(P<0.05);表2~表3同。 2.4 低温等离子体处理对青稞蛋白三级结构的影响
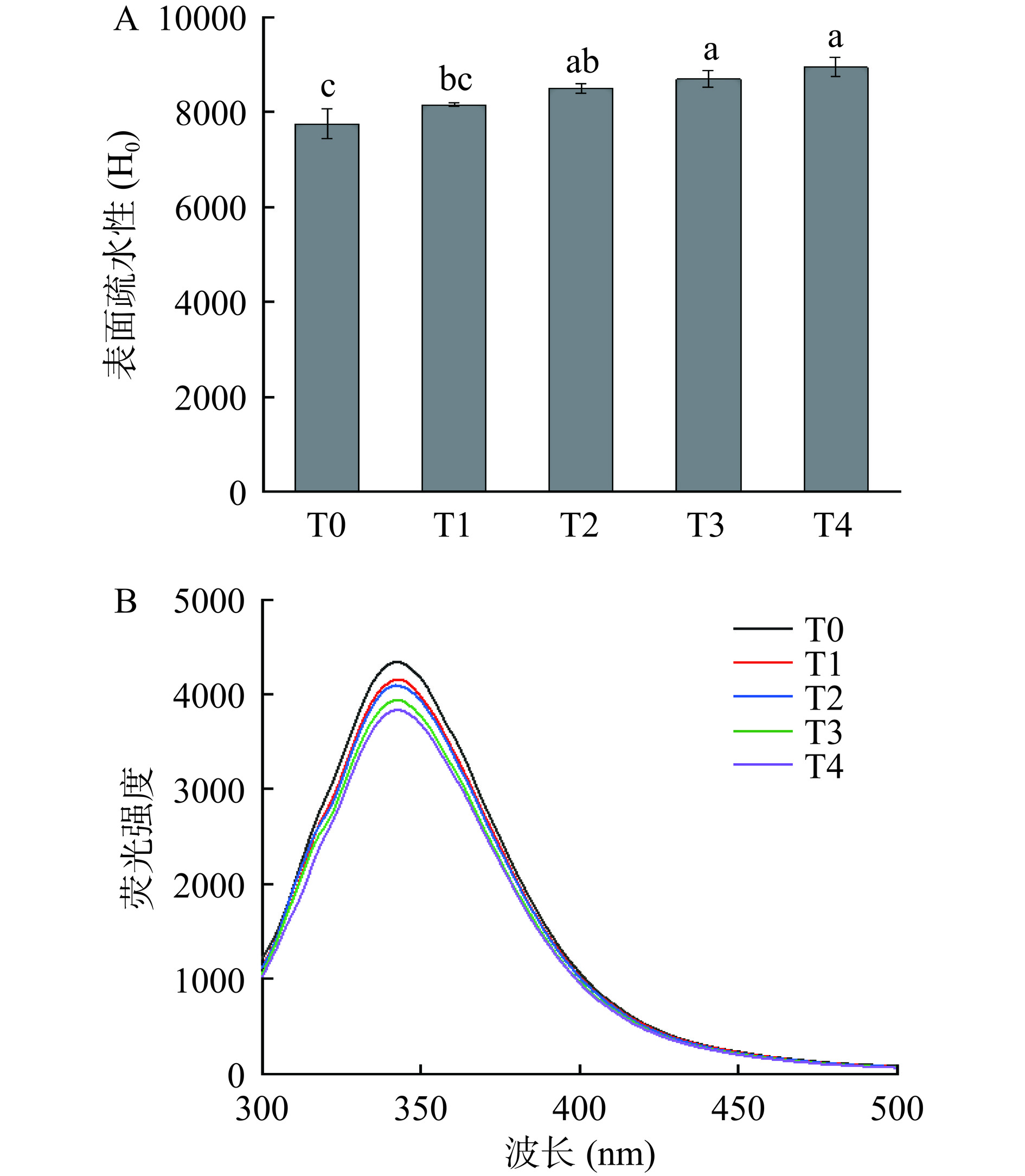
表面疏水性是衡量蛋白质分子表面疏水基团数量的重要指标,与蛋白质的功能性质密切相关,反映了蛋白质三级结构的变化[24]。表面疏水性的变化如图3A所示。与对照组相比,随着处理时间的增加,青稞蛋白的疏水能力增加,H0从7752±303显著增加到8944±203(P<0.05)。这可能是由于等离子体处理过程中产生的活性自由基会氧化蛋白质,使蛋白质聚集体或亚基结构解离,埋藏在内部的疏水基团更易暴露出来与ANS结合,从而增加蛋白表面疏水性[6];此外,由于高能粒子轰击后,蛋白分子结构展开,分子间疏水性也会增加[17],而蛋白质疏水性的提高有利于蛋白质分子更牢固地吸附在油滴表面,促进蛋白质乳化能力的提高[25]。
荧光光谱也可以用于揭示蛋白质三级结构的变化。一些芳香氨基酸,如色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基,负责蛋白质的发光,它们对周围微环境的变化非常敏感,常被用来监测蛋白质三级构象的变化[26]。
青稞蛋白的荧光发射光谱如图3B所示。不同处理时间下样品荧光发射峰最大吸收波长(λmax)均为342 nm,荧光强度的下降未伴随着λmax蓝移红移等现象。样品荧光强度随处理时间的增加而下降,40 min时下降最为明显。这与Ji等[27]得研究结论相同,常压低温等离子体处理前后花生蛋白荧光发射峰值波长(λmax=331 nm)均无偏移。色氨酸残基对周围环境的极性非常敏感,更倾向于被埋没在疏水蛋白核心中。低温等离子体处理使氨基酸侧链展开,使色氨酸残基暴露在极性环境中,从而导致荧光强度降低[28]。
2.5 低温等离子体处理对青稞蛋白游离巯基含量的影响
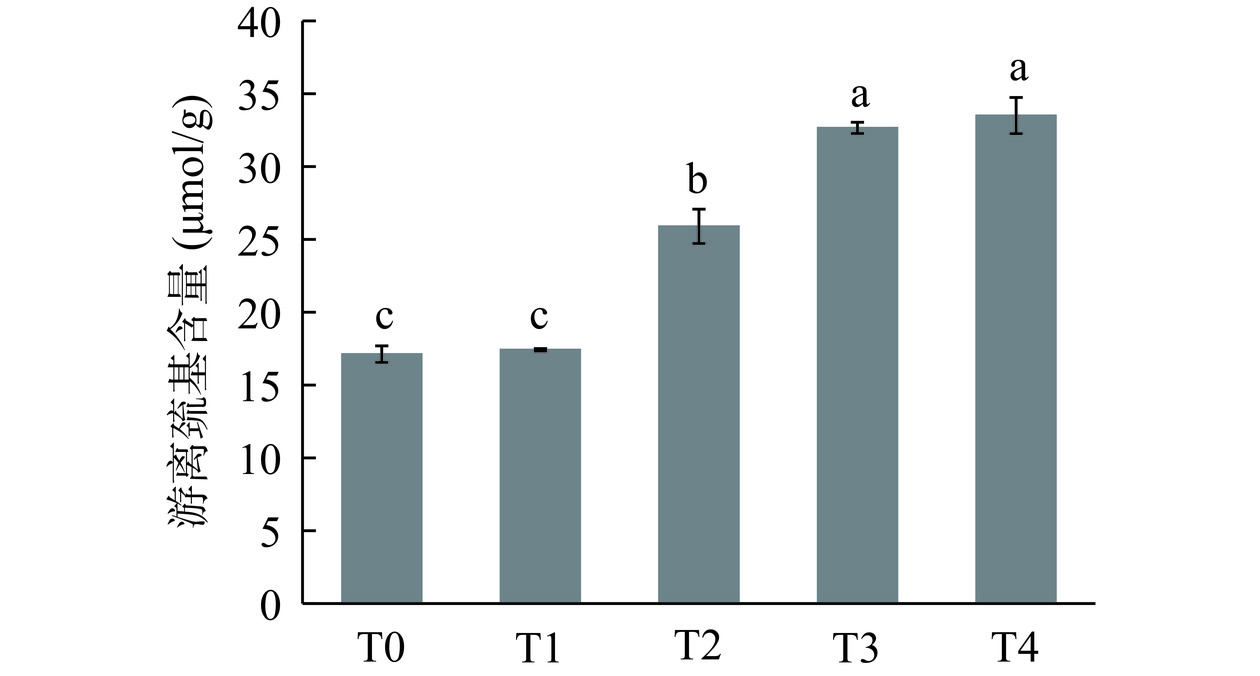
巯基是蛋白质类产品中一个重要的官能团,巯基的减少或增加表明蛋白质结构的改变。因此,巯基是反映蛋白质功能性质的重要活性基团[8]。各组游离巯基含量变化如图4所示。处理10 min时,游离巯基含量(17.42±0.08) μmol/g与未处理组间含量(17.12±0.57) μmol/g无显著差异(P>0.05),当处理时间为20 min时,巯基含量开始显著增加(P<0.05),到40 min时达到最大值(33.50±1.24) μmol/g。Dong等[29]采用低温等离子体处理玉米醇溶蛋白粉末也显示了类似的结果,与未处理样品(6.684 μmol/g)相比,处理7 min时游离巯基含量显著增加至7.554 μmol/g(P<0.05)。游离巯基含量的增加可能归因于处理过程中蛋白质链的展开和蛋白质表面隐藏巯基的出现。此外,处理过程中产生的高能离子可以使二硫键断裂,形成游离巯基基团[20]。
2.6 低温等离子体处理对青稞蛋白溶解度和持水性的影响
溶解性是蛋白质功能特性的基础,在食品加工中为了获得更好的乳化性或起泡性,通常需要蛋白质具有较高的溶解性。表2是溶解度随着处理时间延长的变化,溶解度随处理时间的延长而增加,对照组青稞蛋白的溶解度为6.25%±0.30%,处理时间40 min时溶解度达到了10.97%±0.10%。可溶性蛋白浓度的增加可能是由于以下两个方面原因:高能等离子体粒子轰击引起的蚀刻反应(图1);处理过程中产生的ROS和RNS对蛋白质进行轰击,两者都可以使蛋白质表面的活性位点暴露出来,增强蛋白质与水分子的相互作用,从而增加溶解度[17,19]。
表 2 低温等离子体处理对青稞蛋白溶解度和持水性的影响Table 2. Effects of cold plasma treatment on solubility and water holding capacity of highland barley protein处理时间 溶解度(%) 持水性(g/g) T0 6.25±0.30e 2.47±0.03d T1 6.74±0.22d 2.52±0.01d T2 9.21±0.36c 2.62±0.01c T3 10.25±0.08b 2.72±0.05b T4 10.97±0.10a 2.84±0.04a 持水性与蛋白质的溶解度密切相关,对蛋白质的发泡性能起着至关重要的作用[30]。持水性的变化如表2所示,处理时间对青稞蛋白的持水性有显著影响(P<0.05),处理20 min时,青稞蛋白的持水性开始显著增加(P<0.05),到40 min时与0 min相比,青稞蛋白的持水性增加了14.98%(P<0.05)。这与溶解度的变化趋势相一致。Mehr等[31]发现低温等离子体在9.4和18.6 kV下分别处理30 s和60 s时,山黧豆蛋白的持水力和溶解度呈正相关。由2.3结果可知,等离子体处理诱导青稞蛋白质的空间结构发生改变,从而增强其吸收和保留水分子的能力[30];此外,等离子体活性物质与蛋白质分子的相互作用导致表面刻蚀和粗糙度增加(图1),使蛋白质能够吸收更多的水,这些都可能增加青稞蛋白的持水性。
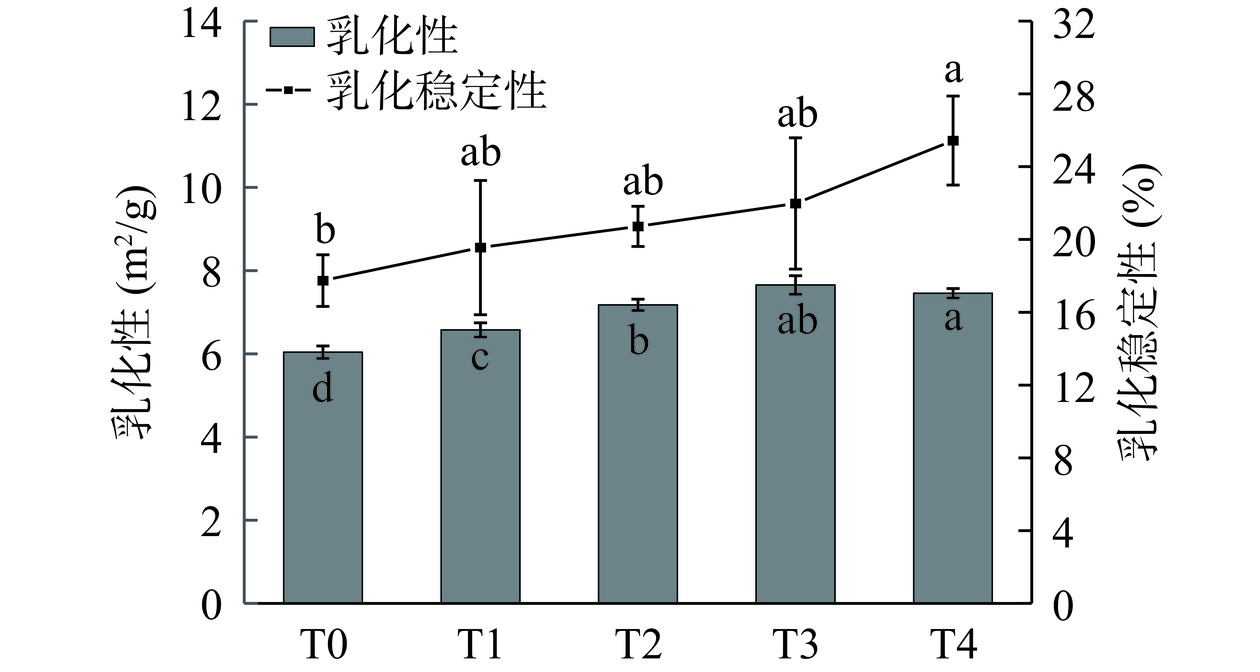
2.7 低温等离子体处理对青稞蛋白乳化特性的影响
乳化性是表征蛋白质乳化能力的重要指标,其数值越高,表明蛋白质可快速吸附在油滴表面,形成油水界面。乳化稳定性则反映了蛋白质防止乳液分离的能力[32]。图5显示了低温等离子体处理后青稞蛋白乳化性和乳化稳定性的变化。青稞蛋白的乳化性在处理30 min时达到最大值7.66 m2/g,相比于对照组6.04 m2/g增加了26.82%(P<0.05);乳化稳定性也观察到类似的趋势,随着处理时间的延长而增加,从19.56%增加到25.44%(P<0.05)。
乳化特性的提高可能是由于以下两个方面原因:低温等离子体处理产生的ROS和RNS不断轰击蛋白质,暴露蛋白质内部存在的疏水性基团(图3A)和氨基酸,增加了蛋白质与油滴的结合能力;同时,溶解度的增加(表2)使蛋白质在乳化过程中能够更好地进入水-油界面,从而提高了乳化活性[33]。Wang等[19]研究也发现在30 s的常压低温等离子体处理下,CPI的乳化性和乳化稳定性得到了很好的改善。
2.8 低温等离子体处理对青稞蛋白起泡特性的影响
未处理和处理的青稞蛋白的起泡性和泡沫稳定性见表3。与对照组相比,低温等离子体处理显著提高了青稞蛋白的起泡性和泡沫稳定性,且随着处理时间的增加而增加(P<0.05)。起泡性从30.42%±0.72%增加到43.75±1.25%(P<0.05);泡沫稳定性从60.28%±2.10%提高到74.77%±3.35%(P<0.05)。Acharjee等[34]也得到了相同的研究结果,在230 V、15 min的等离子体处理下,豌豆蛋白的起泡性和稳定性分别提高了57.28%和6.06%。由2.3和2.4结果可知,等离子体处理产生的ROS和RNS,促使蛋白质氧化和氨基酸侧链展开,形成更灵活的结构,从而在空气-水界面更好地产生泡沫[31]。此外,表面疏水性的增加可以通过增加气-水界面的吸附程度对发泡能力产生积极的影响[35]。
表 3 低温等离子体处理对青稞蛋白起泡特性的影响Table 3. Effects of cold plasma treatment on the foaming properties of highland barley protein处理时间 起泡性(%) 泡沫稳定性(%) T0 30.42±0.72c 60.28±2.10c T1 32.71±1.58bc 63.77±3.66bc T2 35.00±1.08b 65.83±2.38bc T3 42.71±1.80a 66.69±2.08b T4 43.75±1.25a 74.77±3.35a 3. 结论
本文研究了低温等离子体技术对青稞蛋白结构及功能特性的影响。SEM、ATR-FTIR、荧光光谱结果表明低温等离子体处理后蛋白质分子不仅表面形态被破坏,分子结构也发生了显著变化(P<0.05),β-折叠增加,α-螺旋、无规卷曲降低,这导致了青稞蛋白游离巯基含量和表面疏水性提高。随着处理时间的增加,青稞蛋白的溶解度、持水性、乳化性和起泡性显著(P<0.05)提高,处理40 min时青稞蛋白的功能特性指标均达到最佳。综上所述,低温等离子体技术通过改变青稞蛋白质的形态与分子结构促进了功能性质的进一步改善,这为青稞蛋白的综合利用奠定了理论基础。此外,低温等离子体技术对青稞蛋白在凝胶化与乳液稳定性等方面的影响还有待深入,这也是青稞蛋白在食品领域功能应用的重要拓展。
-
表 1 低温等离子体处理对青稞蛋白二级结构的影响
Table 1 Effects of cold plasma treatment on the secondary structure of highland barley protein
处理时间 β-折叠(%) α-螺旋(%) β-转角(%) 无规则卷曲(%) T0 36.67±1.09b 18.31±0.42a 30.26±0.63a 14.77±0.42a T1 40.51±0.69a 16.30±0.67b 29.40±0.73a 13.45±0.21c T2 41.36±0.56a 16.20±0.19b 28.24±0.76a 14.12±0.46b T3 41.97±0.28a 15.87±0.75b 28.60±0.39a 13.18±0.57c T4 42.33±0.34a 14.32±0.46c 29.39±0.33a 13.26±1.22c 注:同一列中不同小写字母表示显著性差异(P<0.05);表2~表3同。 表 2 低温等离子体处理对青稞蛋白溶解度和持水性的影响
Table 2 Effects of cold plasma treatment on solubility and water holding capacity of highland barley protein
处理时间 溶解度(%) 持水性(g/g) T0 6.25±0.30e 2.47±0.03d T1 6.74±0.22d 2.52±0.01d T2 9.21±0.36c 2.62±0.01c T3 10.25±0.08b 2.72±0.05b T4 10.97±0.10a 2.84±0.04a 表 3 低温等离子体处理对青稞蛋白起泡特性的影响
Table 3 Effects of cold plasma treatment on the foaming properties of highland barley protein
处理时间 起泡性(%) 泡沫稳定性(%) T0 30.42±0.72c 60.28±2.10c T1 32.71±1.58bc 63.77±3.66bc T2 35.00±1.08b 65.83±2.38bc T3 42.71±1.80a 66.69±2.08b T4 43.75±1.25a 74.77±3.35a -
[1] GE X Z, JING L Z, ZHAO K, et al. The phenolic compounds profile, quantitative analysis and antioxidant activity of four naked barley grains with different color[J]. Food Chemistry,2021,335(2):127655.
[2] GUO H , FENG K L, ZHOU J, et al. Carboxymethylation of Qingke β-glucans and their physicochemical properties and biological activities[J]. International Journal of Biological Macromolecules, 2020, 147(6):200−208.
[3] 王恒良. 西藏青稞资源利用评价及其青稞提取物β-葡聚糖的生理功效研究[D]. 拉萨:西藏大学, 2008. [WANG H L. The evaluation of resource using and the research of distilling components β-glucan physiological efficacy for Qingke in Tibet[D]. Lhasa:Tibet University, 2008.] WANG H L. The evaluation of resource using and the research of distilling components β-glucan physiological efficacy for Qingke in Tibet[D]. Lhasa: Tibet University, 2008.
[4] MIRMOGHTADAIE L, ALIABADI S S, HOSSEINI S M. Recent approaches in physical modification of protein functionality[J]. Food Chemistry,2016,199(10):619−627.
[5] 李琦, 支爱, 何学明, 等. 低温等离子体改性粮油植物蛋白结构的研究进展[J]. 中国粮油学报,2022,37(11):305−313. [LI Q, ZHI A, HE X M, et al. Research progress of structure modification of grain and oil plant protein by cold plasma[J]. Journal of the Chinese Cereals and Oils Association,2022,37(11):305−313.] doi: 10.3969/j.issn.1003-0174.2022.11.041 LI Q, ZHI A, HE X M, et al. Research progress of structure modification of grain and oil plant protein by cold plasma[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(11): 305−313. doi: 10.3969/j.issn.1003-0174.2022.11.041
[6] 李可, 田金凤, 郑思雨, 等. 等离子体对鹰嘴豆分离蛋白溶解性和乳化特性的影响[J]. 农业工程学报,2021,37(4):31−39. [LI K, TIAN J F, ZHENG S Y, et al. Effects of plasma on solubility and emulsifying properties of chickpea protein isolates[J]. Transactions of the Chinese Society of Agricultural Engineering,2021,37(4):31−39.] doi: 10.11975/j.issn.1002-6819.2021.4.005 LI K, TIAN J F, ZHENG S Y, et al. Effects of plasma on solubility and emulsifying properties of chickpea protein isolates[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(4): 31−39. doi: 10.11975/j.issn.1002-6819.2021.4.005
[7] ABARGHOEI M, GOLI M, SHAHI S. Investigation of cold atmospheric plasma effects on functional and physicochemical properties of wheat germ protein isolate[J]. LWT,2023,177(5):154585.
[8] SHARAFODIN H, SOLTANIZADEH N. Potential application of DBD plasma technique for modifying structural and physicochemical properties of soy protein isolate[J]. Food Hydrocolloids,2022,122(1):107077.
[9] 吴桂玲, 刘立品, 李文浩, 等. 碱溶酸沉法提取青稞蛋白质的工艺研究[J]. 食品研究与开发,2015,36(5):19−24. [WU G L, LIU L P, LI W H, et al. Research on technology for extraction of highland barley protein by alkaline extraction and acid precipitation method[J]. Food Research and Development,2015,36(5):19−24.] doi: 10.3969/j.issn.1005-6521.2015.05.006 WU G L, LIU L P, LI W H, et al. Research on technology for extraction of highland barley protein by alkaline extraction and acid precipitation method[J]. Food Research and Development, 2015, 36(5): 19−24. doi: 10.3969/j.issn.1005-6521.2015.05.006
[10] GAO C F, JIA J Q, YANG Y, et al. Structural change and functional improvement of wheat germ protein promoted by extrusion[J]. Food Hydrocolloids,2023,137(4):108389.
[11] DU Y, LIANG F, CHEN Z X, et al. Effects of decolorization on aggregation behavior of highland barley proteins:Comparison with wheat proteins[J]. Food Research International,2022,160(10):111712.
[12] 陈玉玉, 石梦梦, 王月琴, 等. 超声对青稞蛋白理化性质和消化特性的影响[J]. 食品与发酵工业,2024,50(8):68−75. [CHEN Y Y, SHI M M, WANG Y Q, et al. Effect of ultrasound on physicochemical properties and digestive characteristics of barley protein[J]. Food and Fermentation Industries,2024,50(8):68−75.] CHEN Y Y, SHI M M, WANG Y Q, et al. Effect of ultrasound on physicochemical properties and digestive characteristics of barley protein[J]. Food and Fermentation Industries, 2024, 50(8): 68−75.
[13] 李涛. 青稞蛋白质的提取及其特性研究[D]. 郑州:河南工业大学, 2010. [LI T. The studies on extraction and properties of hulless barley protein[D]. Zhengzhou:Henan University of Technology, 2010.] LI T. The studies on extraction and properties of hulless barley protein[D]. Zhengzhou: Henan University of Technology, 2010.
[14] YU X, HUANG S S, NIE C Z, et al. Effects of atmospheric pressure plasma jet on the physicochemical, functional, and antioxidant properties of flaxseed protein[J]. Journal of Food Science,2020,85(7):2010−2019. doi: 10.1111/1750-3841.15184
[15] 王洪伟, 武菁菁, 阚建全. 青稞和小麦醇溶蛋白和谷蛋白结构性质的比较研究[J]. 食品科学,2016,37(3):43−48. [WANG H W, WU J J, KAN J Q. Comparison of structure characteristics of gliadin and glutenin in highland barley and wheat[J]. Food Science,2016,37(3):43−48.] doi: 10.7506/spkx1002-6630-201603009 WANG H W, WU J J, KAN J Q. Comparison of structure characteristics of gliadin and glutenin in highland barley and wheat[J]. Food Science, 2016, 37(3): 43−48. doi: 10.7506/spkx1002-6630-201603009
[16] DU Y, CHEN Z X, LIANG F, et al. Effects of salidroside on functional and structural changes in highland barley proteins[J]. LWT,2022,160(8):113310.
[17] 季慧, 陈野. 常压低温等离子处理提高花生分离蛋白水合性质的研究[J]. 中国粮油学报,2019,34(8):61−65,72. [JI H, CHEN Y. Improved hydrated properties of peanut protein isolate powders treated by atmospheric pressure cold plasma treatment[J]. Journal of the Chinese Cereals and Oils Association,2019,34(8):61−65,72.] doi: 10.3969/j.issn.1003-0174.2019.08.011 JI H, CHEN Y. Improved hydrated properties of peanut protein isolate powders treated by atmospheric pressure cold plasma treatment[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(8): 61−65,72. doi: 10.3969/j.issn.1003-0174.2019.08.011
[18] DONG X, WANG J, RAGHAVAN V. Impact of microwave processing on the secondary structure, in vitro protein digestibility and allergenicity of shrimp (Litopenaeus vannamei) proteins[J]. Food Chemistry,2021,337(4):127811.
[19] WANG J, ZHOU X Y, JU S L, et al. Influence of atmospheric pressure plasma jet on the structural, functional and digestive properties of chickpea protein isolate[J]. Food Research International,2023,174(12):113565.
[20] JI H, DONG S, HAN F, et al. Effects of dielectric barrier discharge (DBD) cold plasma treatment on physicochemical and functional properties of peanut protein[J]. Food and Bioprocess Technology,2018,11(2):344−354. doi: 10.1007/s11947-017-2015-z
[21] SHARIFIAN A, SOLTANIZADEH N, ABBASZADEH R. Effects of dielectric barrier discharge plasma on the physicochemical and functional properties of myofibrillar proteins[J]. Innovative Food Science and Emerging Technologies,2019,54(4):1−8.
[22] EKEZIE F C, CHENG J H, SUN D W. Effects of atmospheric pressure plasma jet on the conformation and physicochemical properties of myofibrillar proteins from king prawn (Litopenaeus vannamei)[J]. Food Chemistry,2019,276(7):147−156.
[23] CHEN Y, YAO M Y, YANG T Y, et al. Changes in structure and emulsifying properties of coconut globulin after the atmospheric pressure cold plasma treatment[J]. Food Hydrocolloids,2023,136(3):108289.
[24] HU H, WU J H, LI-CHAN E C, et al. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions[J]. Food Hydrocolloids,2013,30(2):647−655. doi: 10.1016/j.foodhyd.2012.08.001
[25] JIANG J, CHEN J, XIONG Y L. Structural and emulsifying properties of soy protein isolate subjected to acid and alkaline pH-shifting processes[J]. Journal of Agricultural and Food Chemistry,2009,57(16):7576−83. doi: 10.1021/jf901585n
[26] ZHANG Y, CHEN S, QI B K , et al. Complexation of thermally-denatured soybean protein isolate with anthocyanins and its effect on the protein structure and in vitro digestibility[J]. Food Research International, 2018, 106(4):619-625.
[27] JI H, HAN F, PENG S L, et al. Behavioral solubilization of peanut protein isolate by atmospheric pressure cold plasma (ACP) treatment[J]. Food and Bioprocess Technology:An International Journal,2019,12(4):2018−2027.
[28] LI J G, XIANG Q S, LIU X F, et al. Inactivation of soybean trypsin inhibitor by dielectric-barrier discharge (DBD) plasma[J]. Food Chemistry,2017,232(19):515−522.
[29] DONG S, GAO A, XU H, et al. Effects of dielectric barrier discharges (DBD) cold plasma treatment on physicochemical and structural properties of zein powders[J]. Food and Bioprocess Technology,2017,10(3):434−444. doi: 10.1007/s11947-016-1814-y
[30] REN X, LI C Z, YANG F, et al. Comparison of hydrodynamic and ultrasonic cavitation effects on soy protein isolate functionality[J]. Journal of Food Engineering,2020,265(2):109697.
[31] MEHR H M , KOOCHEKI A. Effects of short-term and long-term cold plasma treatment on the color, structure, and pickering foaming properties of grass pea protein particles[J]. Food Hydrocolloids, 2023, 143(10):108846.
[32] GUPTA A, SHARMA S, SURASANI V K R. Quinoa protein isolate supplemented pasta:Nutritional, physical, textural and morphological characterization[J]. LWT,2021,135(1):110045.
[33] SEGAT A, MISRA N, CULLEN P, et al. Atmospheric pressure cold plasma (ACP) treatment of whey protein isolate model solution[J]. Innovative Food Science and Emerging Technologies,2015,29(3):247−254.
[34] ACHARJEE A, DABADE A, KAHAR S, et al. Effect of atmospheric pressure non-thermal pin to plate cold plasma on structural and functional properties of pea protein isolate[J]. Journal of Agriculture and Food Research,2023,14(4):100821.
[35] DELAHAIJE R J, GRUPPEN H, GIUSEPPIN M L, et al. Quantitative description of the parameters affecting the adsorption behaviour of globular proteins[J]. Colloids and Surfaces B:Biointerfaces,2014,123(11):199−206.





 下载:
下载:
 下载:
下载:



