Research on Atomic Transfer Radical Polymerization Modified Lactic Acid Bacteria and Their Removal of Aflatoxin B1
-
摘要: 为了研究植物乳杆菌材料对黄曲霉毒素去除新方法,为黄曲霉毒素B1的高效生物去除提供了新思路。本文采用基于聚多巴胺的原子转移自由基聚合方法(Polydopamine-based Atom Transfer Radical Polymerization,p-ATRP)和细胞自催化的无铜添加原子转移自由基聚合方法(Cell-catalyzed Copper-free Atom Transfer Radical Polymerization,c-ATRP)对植物乳杆菌活细胞表面进行修饰,引导原子转移自由基聚合(Atom Transfer Radical Polymerization,ATRP)体系自组装聚合反应形成聚合物材料,对修饰后的植物乳杆菌进行表征,并比较修饰前后植物乳杆菌对黄曲霉毒素B1吸附脱附能力。结果表明,未修饰的植物乳杆菌,细胞表面圆润光滑,经过p-ATRP修饰后的植物乳杆菌,细胞表面变得极为粗糙,经过c-ATRP修饰后的植物乳杆菌,细胞表面出现褶皱;未修饰的植物乳杆菌的Zeta点位为-8.43 mV,经过Dopamine和PNIPAAm修饰后的植物乳杆菌点位分别为1.791和13.767 mV;植物乳杆菌在0.1~100 μg/mL黄曲霉毒素B1吸附率为75.3%,p-ATRP和c-ATRP修饰的植物乳杆菌比未修饰的植物乳杆菌吸附能力分别提高了7.8%和6.4%。在相同黄曲霉毒素B1浓度下,植物乳杆菌脱附率为6.1%,p-ATRP和c-ATRP修饰的植物乳杆菌脱附能力分别提高了14.4%和42%。经过修饰后的植物乳杆菌显著提升了植物乳杆菌对黄曲霉毒素的吸附和脱附能力。Abstract: To study the new method of aflatoxin removal by Lactobacillus plantarum materials, and provide a new idea for the efficient biological removal of aflatoxin B1, this study used the polydopamine-based atom transfer radical polymerization (p-ATRP) and cell-catalyzed copper-free atom transfer radical polymerization (c-ATRP) to modify the surface modification of living cells of Lactobacillus plantarum, and guided the self-assembly polymerization reaction within the ATRP system to form polymer materials, characterized the modified Lactobacillus plantarum and compared its adsorption and desorption capabilities towards aflatoxin B1 before and after modification. Results showed that, the unmodified Lactobacillus plantarum had a smooth cell surface, while the Lactobacillus plantarum modified by p-ATRP had a very rough cell surface, and the Lactobacillus plantarum modified by c-ATRP had wrinkles on the cell surface. The Zeta point of unmodified Lactobacillus plantarum was -8.43 mV, while the points of Lactobacillus plantarum after PD and PNIPAAm modification were 1.791 and 13.767 mV, respectively. The adsorption rate of Lactobacillus plantarum for aflatoxin B1 at concentrations ranging from 0.1~100 μg/mL was 75.3%. Furthermore, the adsorption capacity of p-ATRP and c-ATRP modified Lactobacillus plantarum exhibited an increase of 7.8% and 6.4%, respectively, compared with unmodified Lactobacillus plantarum. Additionally, at the same concentration of aflatoxin B1, the desorption rate of Lactobacillus plantarum was 6.1%, while the desorption capabilities of p-ATRP and c-ATRP modified Lactobacillus plantarum were enhanced by 14.4% and 42%, respectively. Overall, the modified Lactobacillus plantarum demonstrated a significant enhancement in both adsorption and desorption abilities towards aflatoxin.
-
黄曲霉毒素是由黄曲霉(Aspergillus flavus)和顶曲霉(Aspergillus parasiticus)等曲霉属的真菌所产生的一类有毒次生代谢物[1]。黄曲霉毒素能够溶解在多数有机溶剂中,但其在水中的溶解度较低。黄曲霉毒素不仅毒性强,而且是一种致癌物,其毒性是砒霜的68倍,是已知霉菌毒性中最强的[2]。这种毒素在土壤和多种植物中广泛分布,特别是在花生及其产品中,黄曲霉毒素污染的情况格外显著,造成了全球性的农作物和食品安全问题[3]。黄曲霉在食品中的污染威胁着人们的生命安全,因此,研究开发高效、安全的黄曲霉毒素脱毒方法至关重要。其中,生物脱毒法是一种安全、高效可靠的新技术,具有强大的潜力[4]。近年来,研究团队逐渐增多,利用微生物降解黄曲霉毒素成为了生物脱毒法的主要研究方向。生物脱毒法主要包括微生物菌体制剂法、酶解法、生物提取物抑制法。在深入探索生物处理技术时,前期研究注意到各种方法在应用中的独特性和局限性。对于微生物菌体制剂法,这一方法以其优异的处理效果而著称,能够针对性地解决特定问题,同时保持了处理过程的环保性质。然而,尽管其专一性在某些情况下显得突出,不同的应用场景可能会导致效果上的差异性,而高昂的成本也是需要考量的一个重要因素[5]。酶解法作为另一种高效的生物处理方式,其最大的优点在于对产品无污染,并能保持产品的营养价值不受损害。酶的高度专一性确保了处理过程的精准度,但这种方法的一个显著缺点是酶本身的稳定性问题,这限制了其在某些环境下的应用[6]。至于微生物提取物法,这一技术以其绿色、清洁和高效的特点脱颖而出,不仅能够处理问题,还能在一定程度上增加产品中的营养价值,这对于提高产品附加值具有重要意义。然而,尽管它有着众多的优点,微生物提取物法的作用机制和安全性仍旧是研究的重点,这些未知因素需要进一步的探索和明确[7]。
植物乳杆菌(Lactic Acid Bacteria,LAB)是一种能发酵碳水化合物产生乳酸的革兰氏阳性菌的统称,其形态、代谢能力和生理学特征不完全相同。植物乳杆菌细胞形态呈球状或者杆状,需氧或兼性厌氧,过氧化氢酶呈阴性。植物乳杆菌种类主要包括乳杆菌属、双歧杆菌属、明串珠菌属等。近年来研究证明了它对黄曲霉毒素B1具备了一定的去除能力[8−9]。赵亚茹等[10]对74株植物乳杆菌进行降低AFB1能力的测定,成功筛选出对AFB1降解率为53%的植物乳杆菌A9;蒋采贝[11]对植物乳杆菌进行了AFB1吸附能力的比较,获得了一株吸附能力最强的植物乳杆菌P1,并对吸附特性进行研究。但AFB1对乳酸菌的毒害作用,进一步限制了生物处理法的应用。而使用新型ATRP方法应用于植物乳杆菌表面修饰,对生物进行工程强化之后,再用于AFB1处理是一种有效的做法。
ATRP主要发生的是氧化还原反应,通过建立有机卤化物(引发物)和过渡金属结合物(催化剂)反应,进而控制自由基与休眠种之间的动态平衡,从而控制高分子聚合反应。原子转移自由基高分子技术是具有重大使用价值的活性高分子科学技术,可以高效地对高分子的分子结构进行设计,生产出各类不同特性、不同功效的高分子材料[11−14]。
聚N-异丙基丙烯酰胺(PNIPAAm)是一种常见的热敏感材料,它含有可与水形成氢键的亲水性酰胺基和较疏水的异丙基。在低于其特定的低临界溶液温度(Lower Critical Solution Temperature,LCST)的情况下,因为酰胺基团容易与水形成氢键,整个材料呈现出亲水性[15−17]。但随着环境温度的上升超过LCST,这些氢键会逐渐减弱或者断裂,导致疏水性的异丙基团间相互作用增强,从而整个材料表现出疏水性[18]。这样的温度响应性让PNIPAAm能够快速地响应环境温度变化,实现物理状态的转换,因为它们的这一特点和良好的生物相容性,PNIPAAm被广泛用于多种应用领域[19−20]。薛颖[21]用N-异丙基丙烯酰胺合成了热响应型聚合物,并修饰在CAP菌表面,最终完成水中氯毒素的局部富集和生物降解。
本实验通过使用ATRP新技术对植物乳杆菌表面进行修饰,引导ATRP体系自组装聚合反应形成聚合物材料,构建植物乳杆菌表面温控吸附层,实现对低浓度黄曲霉毒素B1的局部温控增浓,大幅度提高植物乳杆菌对黄曲霉毒素B1的吸附降解性能,项目的实施对保障黄曲霉毒素食品安全具有重要意义。
1. 材料与方法
1.1 材料与仪器
植物乳杆菌ATCC8014 上海晅科生物科技有限公司;N,N-二甲基甲酰胺、三乙胺、α-溴异丁酰溴、甲基丙烯酸钠 北京沃凯生物科技有限公司;2,2-联吡啶、多巴胺、溴化铜 均为分析纯,上海阿拉丁生化科技股份有限公司;抗坏血酸、PBS缓冲液、N-异丙基丙烯酰胺 化学纯,上海阿拉丁生化科技股份有限公司;SYTO9/PI 凯新生物科技有限公司。
SU8010型扫描电子显微镜 HITACHI公司;ZS90型Zeta电位仪 马尔文帕纳科公司;20A型高效液相色谱 岛津有限公司;FACSAria II型流式细胞仪 BD公司。
1.2 实验方法
1.2.1 使用基于聚多巴胺的ATRP方式(p-ATRP)修饰植物乳杆菌
在无氧环境下,将2 mL的N,N-二甲基甲酰胺(DMF)和400 mg的多巴胺盐酸盐(DPA)加入持续振荡的100 mL Tris-HCl缓冲液(40 mmol/L,pH=8)中,再加入0.15 mL三乙胺(TEA)和0.13 mL α-溴异丁酰溴(BIBB),在25 ℃下继续振荡4 h。
将活化后的植物乳杆菌以5000 r/min离心5 min,取出菌泥并同PBS溶液洗涤2~3次,使菌泥重悬于20 mL Tris-DPA混合溶液中,细菌终浓度为OD600=2,在室温下摇床培养3 h。此时多巴胺发生自聚合反应,于植物乳杆菌表面形成聚多巴胺层。将植物乳杆菌再次进行离心,PBS溶液洗涤菌泥,并转移至ATRP溶液(包含1 mol/L N-异丙基丙烯酰胺,0.001 mol/L CuBr2,0.002 mol/L 2,2-联吡啶和0.01 mol/L抗坏血酸)中[11],摇床培养60 min,并用PBS缓冲液洗涤2~3遍,通过离心获得p-ATRP修饰的LAB@PD@PNIPAAm。
1.2.2 利用细胞自催化的无铜ATRP方法(c-ATRP)修饰植物乳杆菌
将活化后的植物乳杆菌以5000 r/min转速离心5 min,用去离子水清洗沉淀的菌泥,重复一次,并将其重新悬浮在5 mL PBS缓冲液中。将0.4 g N-异丙基丙烯酰胺溶解在25 mL PBS缓冲液中,边振荡边充入氮气,持续30 min,以此来制备0.1 mol/L浓度的N-异丙基丙烯酰胺单体溶液。向细胞的反应溶液中加入0.01 mol/L抗坏血酸溶液和0.05 mol/L α-溴异丁酰溴并在添加完成后立刻封闭好厌氧瓶盖,然后将瓶子放入设定在30 ℃的摇床中培养60 min。最后以5000 r/min离心5 min,保留沉淀,菌泥用新鲜的PBS液体清洗并重悬,以获得经过c-ATRP修饰的LAB@PNIPAAm。
1.2.3 SEM扫描电子显微镜分析细胞表面形貌结构
以5000 r/min离心未修饰的植物乳杆菌和经过c-ATRP、p-ATRP修饰的植物乳杆菌样品5 min,随后洗涤菌泥2~3次,将细胞重悬于2.5%的戊二醛溶液中,并静置过夜以固定细胞。去除戊二醛溶液之后,进一步使用按20%、50%、70%、85%、95%和100%梯度递增浓度的乙醇水溶液对细胞进行逐步脱水处理,每一步渗透时间保持在15 min。脱水后的样品使用无水乙醇重悬,并调节到适宜浓度。使用短时超声处理10 s来使样品的均匀分散。然后取5 μL的样品滴置于硅片上,并把滴好的硅片放置在真空干燥仪中干燥2 min。之后,将导电胶贴在样品台上,并将干燥后的硅片黏贴至导电胶表面。先对样品台进行喷金处理,将样品台放入扫描电子显微镜下,进行微观形貌的观察与分析[22]。
1.2.4 Zeta电位分析细胞表面电荷
用离心机将三种样品细胞以6000 r/min离心10 min,取沉淀菌泥用去离子水洗涤2~3遍,将样品最终重悬于去离子水中,用于Zeta电位仪测定。
1.2.5 流式细胞仪检测细胞活性
将SYTO9、PI和未修饰的植物乳杆菌、经过c-ATRP、p-ATRP修饰的植物乳杆菌样品细胞进行等体积混合,分别取出600 μL样本置入流式细胞试管内,并在暗处染色15 min。使用485 nm的激发波长,发射波长分别为535和600 nm[23−24]。
1.2.6 黄曲霉毒素吸附率计算
通过高效液相色谱法(HPLC)建立黄曲霉毒素B1(AFB1)的标准曲线,首先需要准备不同浓度的AFB1标准溶液,浓度设定为0.1、0.5、1、2、10 µg/mL,并且采用甲醇作为溶剂。随后在高效液相色谱仪上对这些标准品进行定量分析[25−26]。通过所述的方法测定AFB1的标准工作曲线,回归方程为y=1937.570x+2689.811,R2=0.99906。
色谱条件:色谱柱:C18(150 mm×4.6 mm,5 μm);流动相:甲醇、水、乙腈(15:70:15),流速:1.4 mL/min;紫外检测器:波长360 nm;柱温40 ℃;进样量25 μL[27]。根据下式计算吸附率:
Q(%)=C1−CeC0×100 式中,Q代表AFB1吸附率;C1代表对照组AFB1浓度;Ce代表菌体处理中残存的AFB1浓度;C0代表加入的初始AFB1的浓度[28]。
1.2.7 两种方法合成的植物乳杆菌吸附AFB1效果的比较
将未修饰的乳酸菌、通过c-ATRP修饰的乳酸菌和p-ATRP修饰的乳酸菌体(OD600=1)分别加入1 mL浓度为0.1、0.5、2、10、30、50、70、100 µg/mL的AFB1工作液中,混合均匀后于28 ℃,180 r/min摇床中培养1 h,5000 r/min离心5 min,取上清液待测。设一组平行实验,同时设未加入菌体的同浓度AFB1溶液作为空白对照。
1.2.8 不同吸附时间的合成植物乳杆菌吸附AFB1效果的比较
将未修饰的乳酸菌、通过c-ATRP修饰的乳酸菌和p-ATRP修饰的乳酸菌菌体(OD600=1)分别加入1 mL浓度为0.1 µg/mL的AFB1工作液中,混合均匀后于28 ℃,180 r/min摇床中分别培养0.5、1、4、8 h,5000 r/min离心5 min,取上清液待测。设一组平行实验,同时设未加入菌体的同浓度AFB1溶液作为空白对照。
1.2.9 不同ATRP方法修饰植物乳杆菌的温控吸附脱附AFB1性能
将不同方法修饰的植物乳杆菌(OD600=1)加入1 mL浓度为10 µg/mL的AFB1工作液中,再放置于25 ℃,180 r/min摇床中培养2 h,对样品上清液进行检测。取出菌泥放入1 mL甲醇溶液于37 ℃,180 r/min摇床中培养2 h,对样品上清液进行检测。
脱附率计算:根据上述得到的标准曲线,计算得出黄曲霉毒素B1脱附浓度再比较初始浓度得到脱附率。根据下式计算脱附率:
Q(%)=CeC0×100 式中:Ce代表菌体处理中残存的AFB1浓度;C0代表加入的初始AFB1的浓度。
1.3 数据处理
所有试验重复3次,以平均值±标准差表示,利用Origin2021软件分析作图。
2. 结果与分析
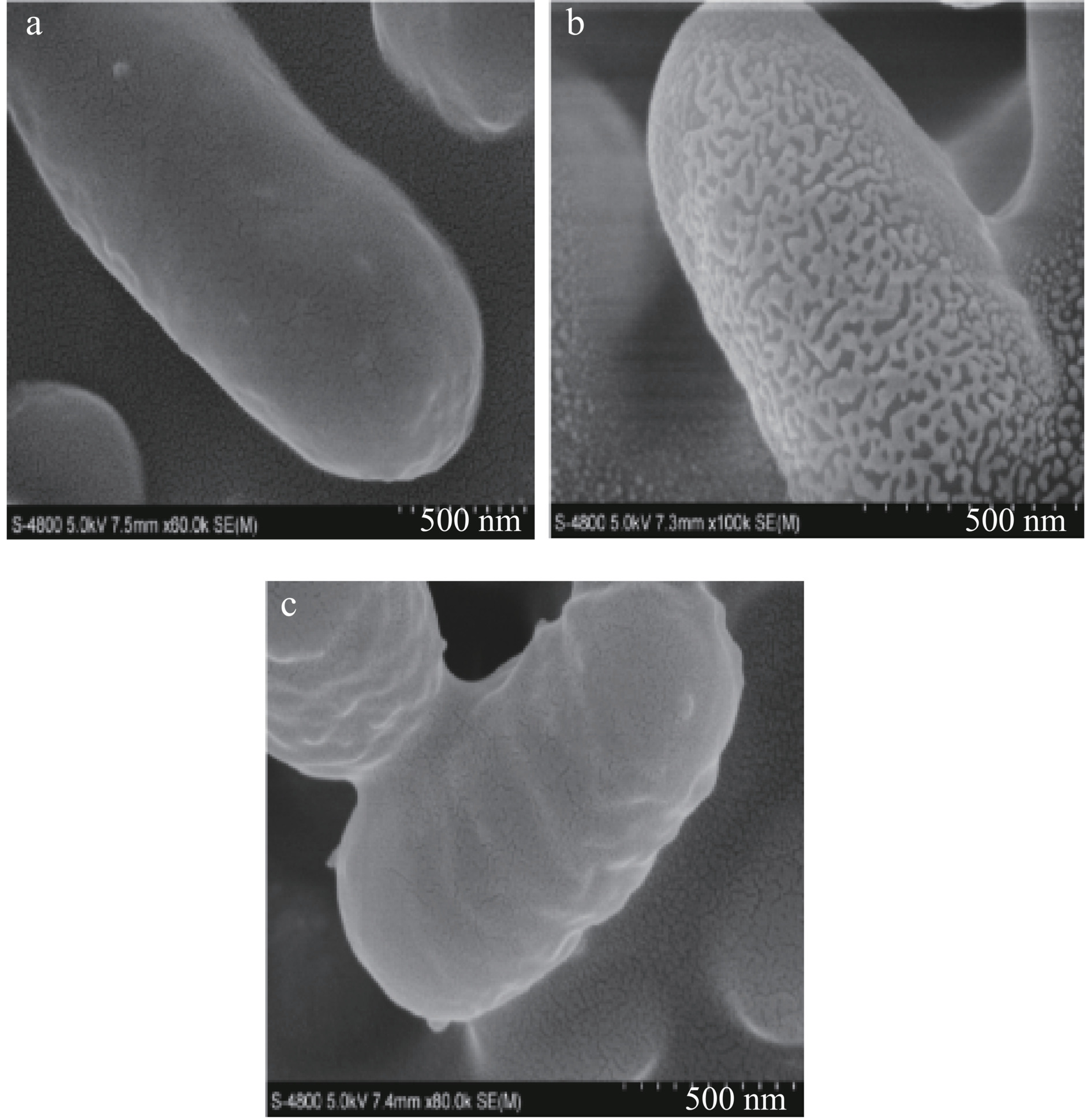
2.1 SEM扫描电子显微镜分析细胞形貌结构
图1a细胞表面圆润光滑;图1b细胞表面变得极为粗糙,150 nm颗粒包裹在细胞表面,初步推断p-ATRP成功将聚合物修饰在植物乳杆菌表面。图1c细胞表面出现褶皱。微观表征证明了c-ATRP方法在植物乳杆菌表面修饰聚合物。
2.2 Zeta电位分析细胞表面电荷
通过测定Zeta电位,对植物乳杆菌修饰前后的表面电荷特性进行分析,确认聚合物是否成功修饰在植物乳杆菌表面。
未修饰的植物乳杆菌的Zeta点位为−8.43 mV,经过PD和PNIPAAm修饰后的植物乳杆菌点位分别为1.791 mV和13.767 mV。薛颖[21]的实验验证了N-异丙基丙烯酰胺单体携带正电荷,通过两种ATRP方法后,植物乳杆菌表面成功地被N-异丙基丙烯酰胺单体修饰,使其Zeta电位由负转正。具有PD层的LAB@PD@PNIPAAm的Zeta电位显著(P<0.05)低于LAB@PNIPAAm,这是因为PD层带有负电,减少了PNIPAAm正电性层的电位。进一步证实植物乳杆菌表面成功修饰了聚合物层。
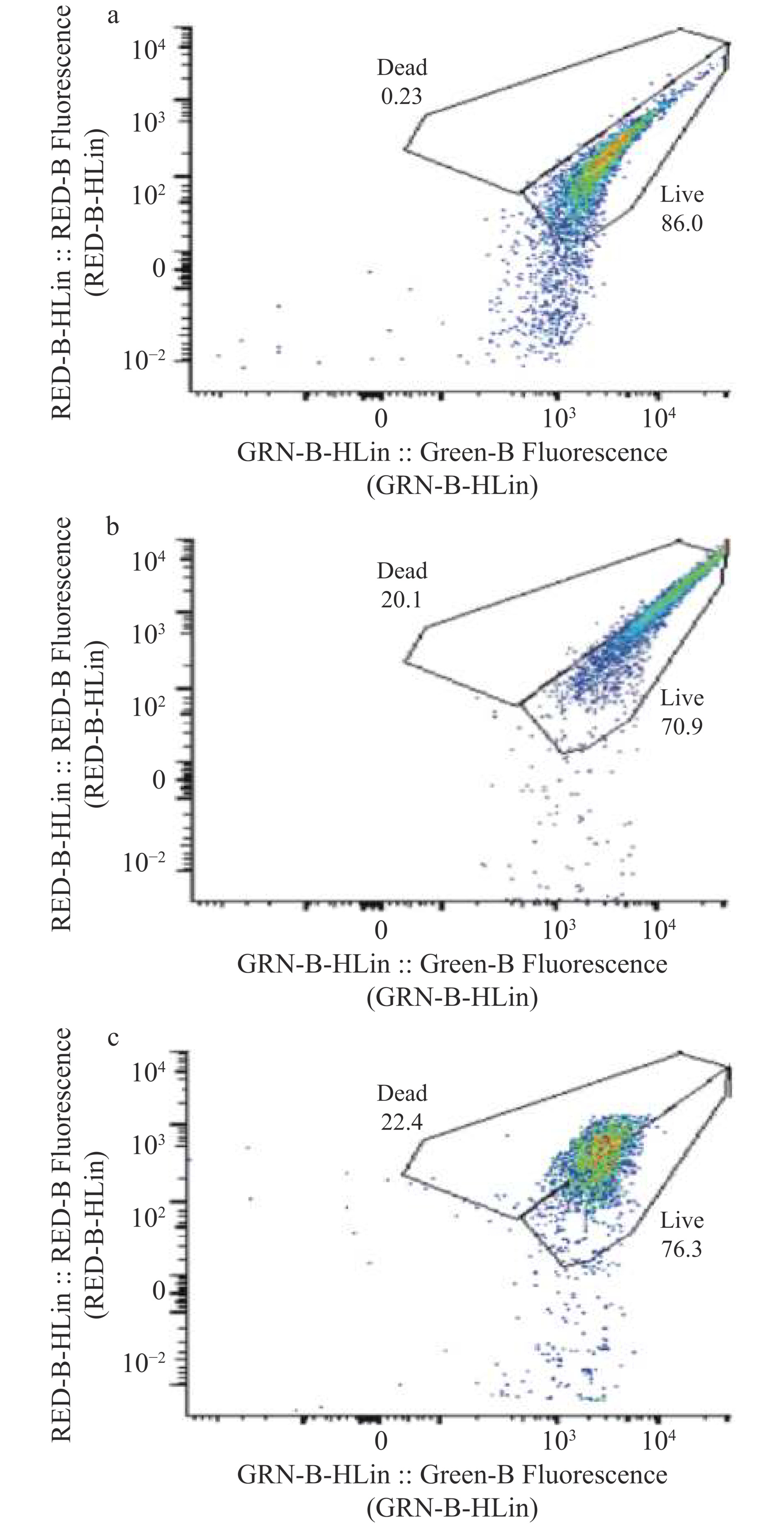
2.3 流式细胞仪检测细胞活性
由图2可知,未经修饰的植物乳杆菌存活率为86%。使用p-ATRP方法修饰后的植物乳杆菌存活率有所下降,达到了70.9%,而经过c-ATRP方法修饰的植物乳杆菌细胞的存活率为76.3%,实验数据显示c-ATRP相对于p-ATRP在维持细胞存活率上可能具有一定的优势。相较于p-ATRP,c-ATRP技术因其较小的对植物乳杆菌细胞的破坏性,被认为更适合应用于ATRP反应。
2.4 两种合成方法的植物乳杆菌吸附AFB1效果的比较
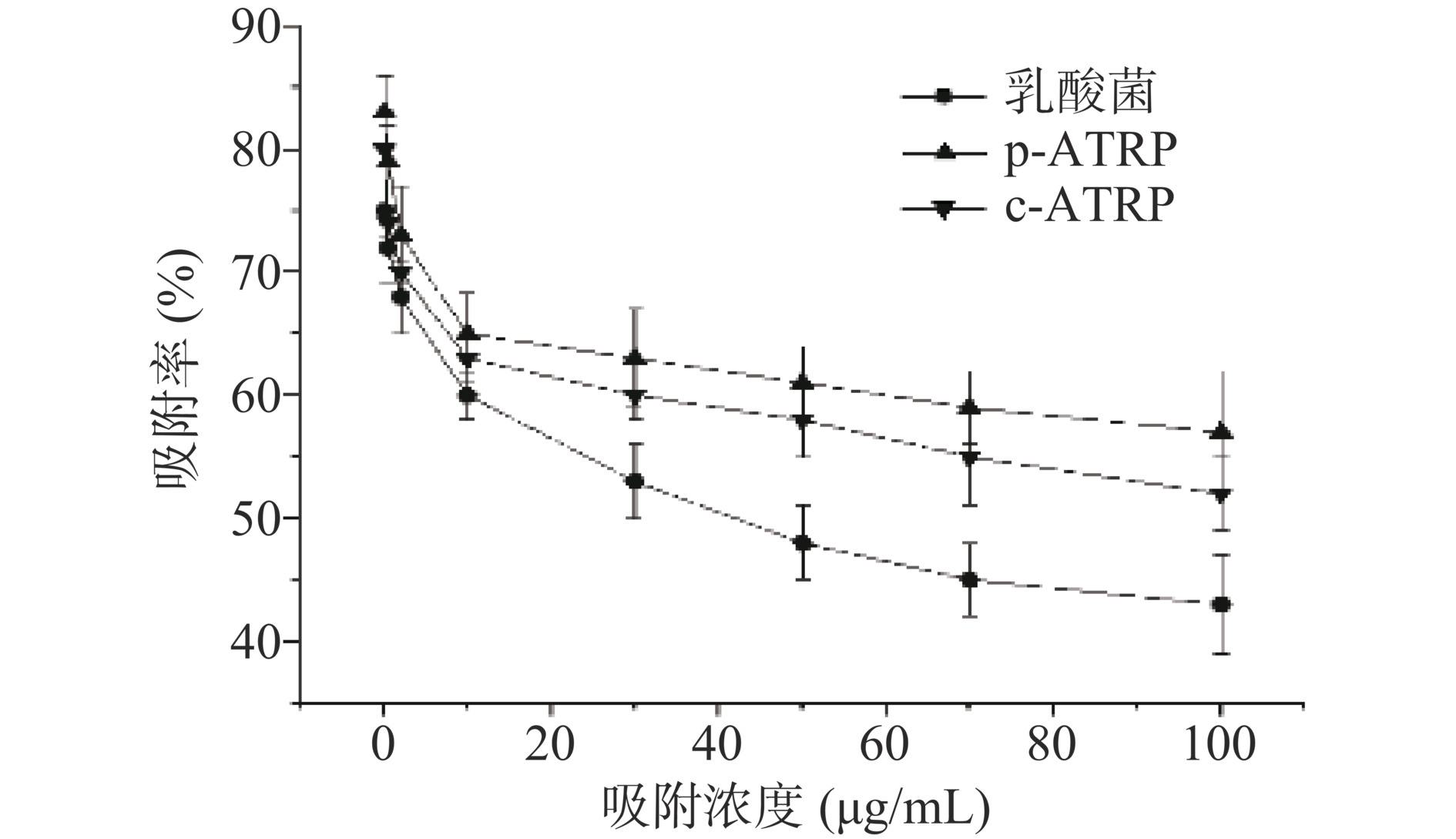
植物乳杆菌对AFB1具有一定的吸附能力,随着毒素浓度增加,植物乳杆菌对AFB1的吸附量也随之增多,但吸附率随之降低。两种不同方法合成的植物乳杆菌和未修饰的植物乳杆菌对吸附AFB1效果如图3所示。
黄曲霉毒素浓度0.1~100 μg/mL时,植物乳杆菌吸附率平均值为75.3%;经过p-ATRP修饰的植物乳杆菌,在相同黄曲霉毒素浓度的吸附率平均为83.8%;经过c-ATRP修饰的植物乳杆菌则为79.4%。当AFB1浓度比较低的时候,溶液中的AFB1能与细胞膜上的结合点位相结合,从而AFB1去除率较高[29]。相较于未修饰的植物乳杆菌吸附能力,经过p-ATRP修饰的植物乳杆菌细胞膜表面具有聚多巴胺层,增加了结合点位[11,21],提高了吸附能力;经过c-ATRP修饰的植物乳杆菌细胞表面出现褶皱,增加了吸附面积,提高了吸附能力。
2.5 不同吸附时间的两种合成植物乳杆菌吸附AFB1效果的比较
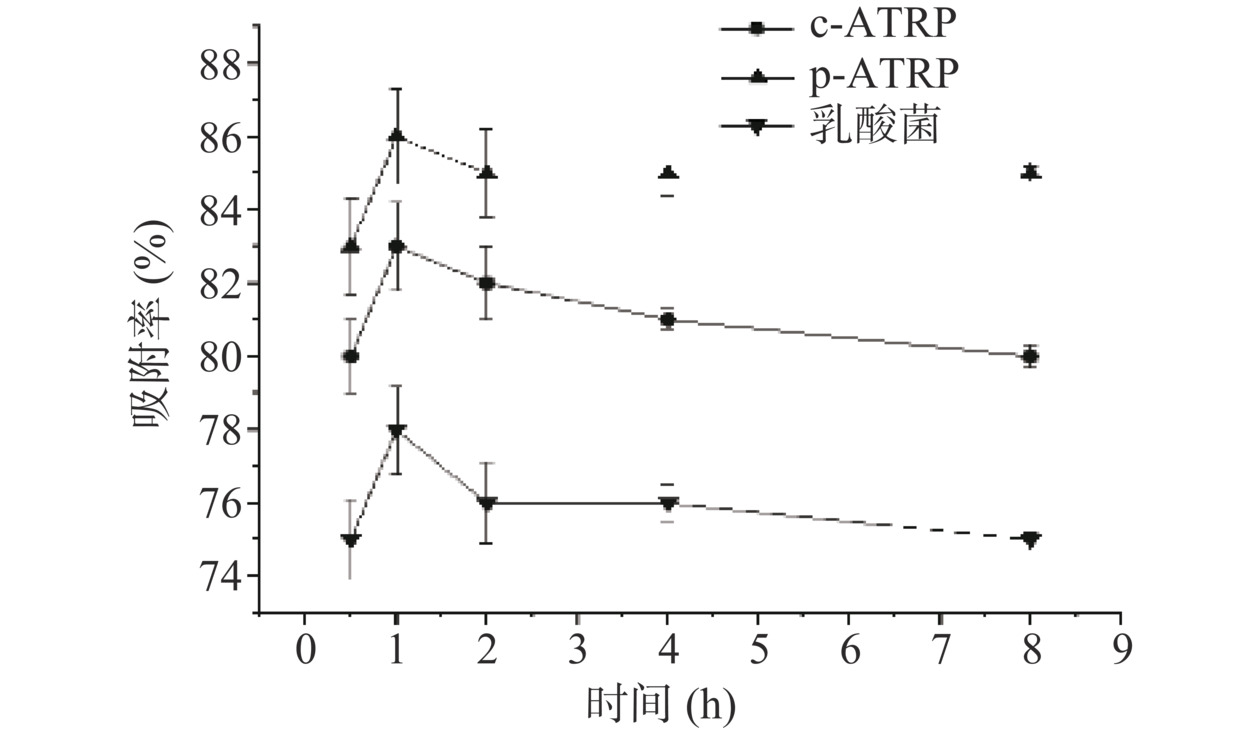
在黄曲霉毒素B1浓度为0.1 μg/mL条件下,未修饰的植物乳杆菌、p-ATRP修饰的植物乳杆菌、c-ATRP修饰的植物乳杆菌吸附率如图4所示。
未修饰的植物乳杆菌、p-ATRP修饰的植物乳杆菌、c-ATRP修饰的植物乳杆菌在1 h达到吸附峰值,分别为75.3%、83.4%、79.7%。随着时间的增加,三种材料的吸附率减少,这是因为吸附时间的过程中,一些和结合点结合不紧密的AFB1从植物乳杆菌脱落下来,而p-ATRP修饰的植物乳杆菌表面的聚多巴胺层可以紧密地和AFB1结合,最不易脱落[22]。相较于未修饰的植物乳杆菌,c-ATRP修饰的植物乳杆菌细胞表面因为修饰后出现褶皱,提高了吸附面积,所以吸附率略高于未修饰的植物乳杆菌。
2.6 不同ATRP方法修饰植物乳杆菌的温控吸附脱附AFB1性能
由表1可知,p-ATRP技术修饰的植物乳杆菌吸附能力略高于c-ATRP修饰的植物乳杆菌,然而在脱附过程中,通过c-ATRP修饰的植物乳杆菌黄曲霉毒素B1脱附率仅为p-ATRP方法的0.53倍。这可能源于p-ATRP修饰所形成的聚多巴胺层对黄曲霉毒素B1有较强的吸附作用,但聚多巴胺层并不能脱附出黄曲霉毒素B1。结果表明,c-ATRP修饰植物乳杆菌具有较高的温度敏感特性,这可能在需要黄曲霉毒素的选择性释放和再循环处理的应用中更为有用。
表 1 不同ATRP方法修饰植物乳杆菌的温控吸附脱附AFB1Table 1. Temperature-controlled adsorption desorption of AFB1 by lactic acid bacteria modified by different ATRP methods样品 吸附率(%) 脱附量(μg) 脱附率(%) 植物乳杆菌 51.0±0.2 0.3±0.03 6.1±0.1 p-ATRP 63.4±0.1 1.6±0.02 25.6±0.2 c-ATRP 58.2±0.2 2.8±0.03 48.2±0.2 3. 结论
通过使用两种ATRP方法制备出具有温控性能材料修饰的植物乳杆菌,利用基于聚多巴胺的ATRP(p-ATRP)方法修饰了植物乳杆菌,制备了LAB@PD@PNIPAAm,细胞存活率为70%。利用细胞自催化的无铜ATRP(c-ATRP)方法修饰了植物乳杆菌,制备了LAB@PNIPAAm,细胞存活率为74%。
通过实验发现两种材料对黄曲霉毒素B1的吸附能力主要在1 h内。两种方法合成的植物乳杆菌与未经修饰的植物乳杆菌相比,经过p-ATRP和c-ATRP修饰的植物乳杆菌对黄曲霉毒素的吸附性能分别提高了约7.8%和6.4%,而脱附性能分别增加了14.4%和42%,表明修饰后的菌株在吸附和脱附黄曲霉毒素B1方面性能得到了显著提升,其中c-ATRP方法修饰的植物乳杆菌的温度响应性能更好。后续可以通过更全面的研究,探究c-ATRP和p-ATRP修饰植物乳杆菌的具体机理,有针对性地进行优化,提高制备效果。将实验应用到复杂的实际环境当中,探究其在实际环境中的应用性能。
-
表 1 不同ATRP方法修饰植物乳杆菌的温控吸附脱附AFB1
Table 1 Temperature-controlled adsorption desorption of AFB1 by lactic acid bacteria modified by different ATRP methods
样品 吸附率(%) 脱附量(μg) 脱附率(%) 植物乳杆菌 51.0±0.2 0.3±0.03 6.1±0.1 p-ATRP 63.4±0.1 1.6±0.02 25.6±0.2 c-ATRP 58.2±0.2 2.8±0.03 48.2±0.2 -
[1] 苟双. 绵阳市饲料黄曲霉毒素B1污染情况调查[J]. 饲料广角,2013(12):30−32. [GOU S. Investigation on feed aflatoxins B1 pollution in Mianyang[J]. Feed Wide Angle,2013(12):30−32.] doi: 10.3969/j.issn.1002-8358.2013.12.009 GOU S. Investigation on feed aflatoxins B1 pollution in Mianyang[J]. Feed Wide Angle, 2013(12): 30−32. doi: 10.3969/j.issn.1002-8358.2013.12.009
[2] ADEBOLA O I, OLADITI O O, OLUSOLA C O, et al. Lactic acid bacteria bio-detoxified aflatoxins contaminated cereals, ameliorate toxicological effects and improve haemato-histological parameters in albino rats[J]. Toxin Reviews, 2021, 40(4):985−996.
[3] 王金勇, 刘颖莉, 关舒. 2012年中国饲料和原料霉菌毒素检测报告[J]. 中国畜牧杂志,2013,49(4):29−34. [WANG J Y, LIU Y L, GUAN S. Report on mycotoxin detection of feed and raw materials in China in 2012[J]. Chinese Journal of Animal Husbandry,2013,49(4):29−34.] doi: 10.3969/j.issn.0258-7033.2013.04.008 WANG J Y, LIU Y L, GUAN S. Report on mycotoxin detection of feed and raw materials in China in 2012[J]. Chinese Journal of Animal Husbandry, 2013, 49(4): 29−34. doi: 10.3969/j.issn.0258-7033.2013.04.008
[4] 刘大岭, 姚冬生, 黄炳贺, 等. 黄曲霉毒素解毒酶的固定化及其性质的研究[J]. 生物工程学报,2003,19(5):603−607. [LIU D L, YAO D S, HUANG B H, et al. Study on immobilization and properties of aflatoxin detoxifying enzyme[J]. Journal of Biotechnology,2003,19(5):603−607.] doi: 10.3321/j.issn:1000-3061.2003.05.018 LIU D L, YAO D S, HUANG B H, et al. Study on immobilization and properties of aflatoxin detoxifying enzyme[J]. Journal of Biotechnology, 2003, 19(5): 603−607. doi: 10.3321/j.issn:1000-3061.2003.05.018
[5] 王少军, 于春娣, 唐娟, 等. 黄曲霉毒素生物脱毒法研究进展[J]. 食品研究与开发,2018,39(24):204−208. [WANG S J, GAN C T, TANG J. et al. Research progress on biological detoxification of aflatoxin[J]. Food Research and Development,2018,39(24):204−208.] doi: 10.3969/j.issn.1005-6521.2018.24.035 WANG S J, GAN C T, TANG J. et al. Research progress on biological detoxification of aflatoxin[J]. Food Research and Development, 2018, 39(24): 204−208. doi: 10.3969/j.issn.1005-6521.2018.24.035
[6] 王涛. 发酵豆制品中黄曲霉毒素的控制[D]. 成都:西华大学, 2010. [WANG T. Control of aflatoxins in fermented soybean products[D]. Chengdu:Xihua University, 2010.] WANG T. Control of aflatoxins in fermented soybean products[D]. Chengdu: Xihua University, 2010.
[7] 曹冬梅, 张洪英, 何成华, 等. 弯曲乳酸杆菌HB02抑制黄曲霉生长及产毒[J]. 南京农业大学学报,2008,31(3):125−129. [CAO D M, ZHANG H Y, HE C H, et al. Lactobacillus flexus HB02 inhibits the growth and toxin production of Aspergillus flavus[J]. Nanjing Agricultural University,2008,31(3):125−129.] CAO D M, ZHANG H Y, HE C H, et al. Lactobacillus flexus HB02 inhibits the growth and toxin production of Aspergillus flavus[J]. Nanjing Agricultural University, 2008, 31(3): 125−129.
[8] 赵亚茹. 具有降低黄曲霉毒素B1菌株的筛选、生物学特性研究及应用[D]. 呼和浩特:内蒙古农业大学, 2022. [ZHAO Y R. Screening, biological characteristics and application of strains capable of reducing aflatoxin B1[D]. Hohhot:Inner Mongolia Agricultural University, 2022.] ZHAO Y R. Screening, biological characteristics and application of strains capable of reducing aflatoxin B1[D]. Hohhot: Inner Mongolia Agricultural University, 2022.
[9] 王晓伟, 高鹏飞, 姚国强, 等. 植物乳杆菌对乳制品中黄曲霉毒素的生物防治作用[J]. 中国乳品工业,2015,43(3):42−45,49. [WANG X W, GAO P F, YAO G Q, et al. The biological control effect of lactic acid bacteria on aflatoxin in dairy products[J]. China Dairy Industry,2015,43(3):42−45,49.] doi: 10.3969/j.issn.1001-2230.2015.03.011 WANG X W, GAO P F, YAO G Q, et al. The biological control effect of lactic acid bacteria on aflatoxin in dairy products[J]. China Dairy Industry, 2015, 43(3): 42−45,49. doi: 10.3969/j.issn.1001-2230.2015.03.011
[10] 赵雅茹, 玉柱, 高文俊, 等. 植物乳杆菌降解饲料中霉菌毒素的研究进展[J]. 草学,2021(2):1−6,30. [ZHAO Y R, YU Z, GAO W J, et al. Research progress on the degradation of mycotoxins in feed by lactic acid bacteria[J]. Grass Science,2021(2):1−6,30.] doi: 10.3969/j.issn.2096-3971.2021.02.001 ZHAO Y R, YU Z, GAO W J, et al. Research progress on the degradation of mycotoxins in feed by lactic acid bacteria[J]. Grass Science, 2021(2): 1−6,30. doi: 10.3969/j.issn.2096-3971.2021.02.001
[11] 蒋采贝. 植物乳杆菌对黄曲霉毒素B1的吸附作用效果[D]. 上海:上海海洋大学, 2019. [JIANG C B. Lactic acid bacteria against aflatoxin B1 the adsorption effect[D]. Shanghai:Shanghai Ocean University, 2019.] JIANG C B. Lactic acid bacteria against aflatoxin B1 the adsorption effect[D]. Shanghai: Shanghai Ocean University, 2019.
[12] 方旭东, 周博, 尤伟, 等. 原子转移自由基活性可控聚合进展[J]. 天津化工,2010,24(4):10−12. [FANG X D, ZHOU B, YOU W, et al. Progress in controlled polymerization of atom transfer radical activity[J]. Tianjin Chemical Industry,2010,24(4):10−12.] doi: 10.3969/j.issn.1008-1267.2010.04.004 FANG X D, ZHOU B, YOU W, et al. Progress in controlled polymerization of atom transfer radical activity[J]. Tianjin Chemical Industry, 2010, 24(4): 10−12. doi: 10.3969/j.issn.1008-1267.2010.04.004
[13] 谢鹏程. 细胞催化有氧原子转移自由基聚合新方法建立及其在微生物燃料电池中的应用研究[D]. 镇江:江苏大学, 2022. [XIE P C. Establishment of a new method of cellular catalytic aerobic atom-transfer radical-polymerization and its application in microbial fuel cell[D]. Zhenjiang:Jiangsu University, 2022.] XIE P C. Establishment of a new method of cellular catalytic aerobic atom-transfer radical-polymerization and its application in microbial fuel cell[D]. Zhenjiang: Jiangsu University, 2022.
[14] 彭婷婷, 王祺, 刘洪海, 等. 原子转移自由基聚合在生物质材料功能化改良中的应用[J]. 世界林业研究,2023,36(5):83−88. [PENG T T, WANG Q, LIU H H, et al. The application of atomic transfer radical polymerization in functional improvement of biomass materials[J]. World Forestry Research,2023,36(5):83−88.] PENG T T, WANG Q, LIU H H, et al. The application of atomic transfer radical polymerization in functional improvement of biomass materials[J]. World Forestry Research, 2023, 36(5): 83−88.
[15] 曾凡宝, 易昌凤. 原子转移自由基聚合的研究进展[J]. 胶体与聚合物,2023,41(2):84−88. [ZHAO F B, YI C F. Research progress on atom transfer radical polymerization[J]. Colloids and Polymers,2023,41(2):84−88.] ZHAO F B, YI C F. Research progress on atom transfer radical polymerization[J]. Colloids and Polymers, 2023, 41(2): 84−88.
[16] 章彧, 谢采云, 王铭博, 等. 基于聚(N-异丙基丙烯酰胺)的热响应性细胞培养表面及其在细胞片工程的应用研究进展[J]. 山东化工,2023,52(15):122−126,137. [ZHANG X, XIE C Y, WANG, M B, et al. Research progress on thermal responsive cell culture surface based on poly (N-isopropylacrylamide) and its application in cell sheet engineering[J]. Shandong Chemical,2023,52(15):122−126,137.] ZHANG X, XIE C Y, WANG, M B, et al. Research progress on thermal responsive cell culture surface based on poly (N-isopropylacrylamide) and its application in cell sheet engineering[J]. Shandong Chemical, 2023, 52(15): 122−126,137.
[17] 周静秋, 万美君, 何洁, 等. 新型衍生化纤维素和N-异丙基丙烯酰胺共修饰的多模式热响应型手性固定相的制备[J]. 西南医科大学学报,2022,45(6):478−483. [ZHOU J Q, WAN M J, HE J, et al. Preparation of a multi-mode thermally responsive chiral stationary phase co modified with a novel derivative cellulose and N-isopropylacrylamide[J]. Journal of Southwest Medical University,2022,45(6):478−483.] ZHOU J Q, WAN M J, HE J, et al. Preparation of a multi-mode thermally responsive chiral stationary phase co modified with a novel derivative cellulose and N-isopropylacrylamide[J]. Journal of Southwest Medical University, 2022, 45(6): 478−483.
[18] 田君. 磁—温度响应聚N-异丙基丙烯酰胺基溶菌酶分子印迹复合材料的制备及吸附性能[D]. 长春:长春工业大学, 2022. [TIAN J. Preparation and adsorption performance of magnetic temperature responsive poly (N-isopropylacrylamide) lysozyme molecularly imprinted composite materials[D]. Changchun:Changchun University of Technology, 2022.] TIAN J. Preparation and adsorption performance of magnetic temperature responsive poly (N-isopropylacrylamide) lysozyme molecularly imprinted composite materials[D]. Changchun: Changchun University of Technology, 2022.
[19] 王禹. 基于N-异丙基丙烯酰胺的温敏性聚合物及其功能化的制备与性能研究[D]. 深圳:深圳大学, 2020. [WANG Y. Preparation and properties of temperature sensitive polymers based on N-isopropylacrylamide and their functionalization[D]. Shenzhen:Shenzhen University, 2020.] WANG Y. Preparation and properties of temperature sensitive polymers based on N-isopropylacrylamide and their functionalization[D]. Shenzhen: Shenzhen University, 2020.
[20] RAHIMI M , NASIRI M. Polymer brushes prepared by surface-initiated atom transfer radical polymerization of poly (N-isopropyl acrylamide) and their antifouling properties[J]. European Polymer Journal, 2020, 125:109536.
[21] 薛颖. 用于细菌活细胞原位修饰的原子转移自由基聚合新方法及其水污染处理应用研究[D]. 镇江:江苏大学, 2020. [XUE Y. A new method of atomic transfer radical polymerization for in situ modification of live bacterial cells and its application in water pollution treatment[D]. Zhenjiang:Jiangsu University, 2020.] XUE Y. A new method of atomic transfer radical polymerization for in situ modification of live bacterial cells and its application in water pollution treatment[D]. Zhenjiang: Jiangsu University, 2020.
[22] 李新玥, 牟行翠. 扫描电子显微镜测试常见制样方法综述[J]. 纺织检测与标准,2023,9(6):36−39. [LI X Y, MU X C. A review of common sample preparation methods for scanning electron microscopy testing[J]. Textile Testing and Standards,2023,9(6):36−39.] LI X Y, MU X C. A review of common sample preparation methods for scanning electron microscopy testing[J]. Textile Testing and Standards, 2023, 9(6): 36−39.
[23] 谢丽, 李海燕, 彭亮, 等. 流式细胞仪检测氧化亚铁硫杆菌的生长量及活性[J]. 实验室科学,2017,20(2):12−16,19. [XIE L, LI H Y, PENG L, et al. Flow cytometry detection of growth and activity of Thiobacillus ferrooxidans[J]. Laboratory Science,2017,20(2):12−16,19.] doi: 10.3969/j.issn.1672-4305.2017.02.004 XIE L, LI H Y, PENG L, et al. Flow cytometry detection of growth and activity of Thiobacillus ferrooxidans[J]. Laboratory Science, 2017, 20(2): 12−16,19. doi: 10.3969/j.issn.1672-4305.2017.02.004
[24] 石芳芳, 李成华, 宋林生, 等. 用流式细胞仪测定扇贝血细胞吞噬活性[J]. 生物技术通报,2006(增刊1):430−433. [SHI F F, LI C H, SONG L S, et al. Measure the phagocytic activity of scallop blood cells using flow cytometry[J]. Biotechnology Bulletin,2006(S1):430−433.] doi: 10.3969/j.issn.1002-5464.2006.z1.095 SHI F F, LI C H, SONG L S, et al. Measure the phagocytic activity of scallop blood cells using flow cytometry[J]. Biotechnology Bulletin, 2006(S1): 430−433. doi: 10.3969/j.issn.1002-5464.2006.z1.095
[25] 杨媛媛, 谢志民, 胡静, 等. 高效液相色谱-柱后光化学衍生法测定茵栀黄口服液中黄曲霉毒素G2、G1、B2、B1的含量[J]. 中南药学,2020,18(10):1695−1698. [YANG Y Y, XIE Z M, HU J, et al. High performance liquid chromatography post column photochemical derivatization method for the determination of aflatoxin G2, G1, B2, and B1 in Yinzhihuang oral liquid[J]. Zhongnan Pharmacy,2020,18(10):1695−1698.] YANG Y Y, XIE Z M, HU J, et al. High performance liquid chromatography post column photochemical derivatization method for the determination of aflatoxin G2, G1, B2, and B1 in Yinzhihuang oral liquid[J]. Zhongnan Pharmacy, 2020, 18(10): 1695−1698.
[26] 梁婷婷, 陈想, 陈红歌, 等. 超高效液相色谱串联飞行时间质谱法检测黑水虻产品中黄曲霉毒素B1[J]. 饲料研究,2020,43(3):83−87. [LIANG T T, CHEN X, CHEN H G, et al. Detection of aflatoxin B1 in black fly products by ultra-high performance liquid chromatography tandem time-of-flight mass spectrometry[J]. Feed Research,2020,43(3):83−87.] LIANG T T, CHEN X, CHEN H G, et al. Detection of aflatoxin B1 in black fly products by ultra-high performance liquid chromatography tandem time-of-flight mass spectrometry[J]. Feed Research, 2020, 43(3): 83−87.
[27] 牛宏亮, 赵亮, 田秀等. 高效液相色谱-光化学柱后衍生法测定紫苏籽中黄曲霉毒素B1[J]. 食品安全质量检测学报,2019,10(19):6463−6467. [NIU H L, ZHAO L, TIAN X, et al. High performance liquid chromatography photochemical post column derivatization method for the determination of aflatoxin B1 in Perilla seeds[J]. Journal of Food Safety and Quality Testing,2019,10(19):6463−6467.] NIU H L, ZHAO L, TIAN X, et al. High performance liquid chromatography photochemical post column derivatization method for the determination of aflatoxin B1 in Perilla seeds[J]. Journal of Food Safety and Quality Testing, 2019, 10(19): 6463−6467.
[28] 陈瑞莲. 高效液相色谱-柱前衍生法测定食用油中黄曲霉毒素B1和B2的方法研究[J]. 现代食品,2019(1):110−113. [CHEN R L. Study on the method for determining aflatoxin B1 and B2 in edible oil by high performance liquid chromatography pre column derivatization[J]. Modern Food,2019(1):110−113.] CHEN R L. Study on the method for determining aflatoxin B1 and B2 in edible oil by high performance liquid chromatography pre column derivatization[J]. Modern Food, 2019(1): 110−113.
[29] KENJI O, NAOKI K, YOSUKE U, et al. In vivo and in vitro mitigation effects of lactic acid bacteria derived from fresh vegetables on aflatoxins[J]. Shokuhin Eiseigaku Zasshi,2021,62(5):148−156. doi: 10.3358/shokueishi.62.148





 下载:
下载:
 下载:
下载:



