Active Components and Antioxidant, Hypoglycaemic and Antihypertensive Activities of Fermented Pyropia yezoensis
-
摘要: 为开发条斑紫菜发酵食品,本研究采用红曲霉并复配酵母菌和乳酸菌对条斑紫菜进行发酵,对发酵过程中条斑紫菜的活性成分进行测定,并评价其抗氧化、降血糖和降血压活性,以探究其功能特性。结果表明,红曲霉发酵(MF)、红曲霉和酵母菌共同发酵(MYF)、红曲霉和乳酸菌共同发酵(MLF)的条斑紫菜,其总酚和黄酮含量随发酵时间持续显著增加(P<0.05);抗氧化活性在发酵后有明显提升,MYF的ABTS+自由基和DPPH自由基清除能力最强,trolox当量分别为(0.709±0.007)、(0.179±0.014)mg/g,MF的铁还原能力最高,达到(0.279±0.007)mg/g;MF表现出最强的降血糖活性,其α-淀粉酶和α-葡萄糖苷酶的抑制率最高达到50.37%±0.73%和69.42%±0.37%,MLF的抑制率则分别为41.49%±0.51%和39.60%±0.13%,MYF的降血糖活性较弱,其α-葡萄糖苷酶抑制能力仅增加至10.36%±0.45%;发酵显著增强了紫菜的降血压活性(P<0.05),MF、MYF、MLF的ACE抑制率在6~8 d达到最高,分别为83.21%±0.89%、47.09%±0.27%、52.65%±0.64%。研究结果表明,发酵可以促进活性物质的产生,提高条斑紫菜的抗氧化、降血糖和降血压活性,且红曲霉发酵表现出最佳的活性提升性能。本研究为将发酵加工方式应用于功能性条斑紫菜食品的开发提供了理论依据。Abstract: To develop the fermented food of Porphyra yezoensis, monascus and compound yeast and lactic acid bacteria were used to ferment Porphyra yezoensis. The active ingredients of Porphyra yezoensis during fermentation were determined, and their antioxidant, hypoglycemic and antihypertensive activities were evaluated. Results showed that the total phenol and flavonoid contents of M. purpureus fermented P. yezoensis (MF), M. purpureus and L. plantarum co-fermented P. yezoensis (MLF), M. purpureus and S. cerevisiae co-fermented P. yezoensis (MYF) significantly increased with fermentation time (P<0.05). The antioxidant activity was enhanced after fermentation. MYF had the highest ABTS+ free radical scavenging capacity and DPPH free radical scavenging capacity with trolox equivalents of (0.709±0.007), (0.179±0.014) mg/g, respectively. MF showed the highest ferric reducing antioxidant power of (0.279±0.007) mg/g. MF exhibited the best hypoglycemic activity with the highest α-amylase and α-glucosidase inhibition values of 50.37%±0.73% and 69.42%±0.37%, respectively. The α-amylase and α-glucosidase inhibition values of MLF were 41.49%±0.51% and 39.60%±0.13%, whereas MYF had a lower hypoglycaemic activity of which the α-glucosidase inhibition capacity reached only 10.36%±0.45%. After fermentation, the antihypertensive activity was significantly enhanced (P<0.05) and the highest ACE inhibition rates were observed in MF, MYF and MLF with 83.21%±0.89%, 47.09%±0.27%, and 52.65%±0.64%, respectively. The results indicated that fermentation process could effectively promote the production of active substances and enhance the antioxidant, hypoglycemic, and antihypertensive activities of P. yezoensis. Among the three tested fermentation formula, MF exhibited the greatest improvement. This study would provide theoretical basis for the potential application of fermentation technique in P. yezoensis food processing.
-
Keywords:
- Pyropia yezoensis /
- fermentation /
- polyphenol /
- flavone /
- antioxidant activity /
- hypoglycemic activity /
- antihypertensive activity
-
条斑紫菜(Pyropia yezoensis)是一种生长于北太平洋西部的海藻,主要分布在中国、日本、韩国沿海地区[1],是我国重要的经济藻类之一,2022年养殖产量为217658吨(干重)[2]。条斑紫菜含有丰富均衡的营养成分,高蛋白低脂肪[3],是优质膳食的良好选择,深受消费者喜爱,其需求量逐年增加。条斑紫菜富含多种生物活性成分如多糖、多肽、多酚、黄酮,具有抗氧化、抗肿瘤、降血糖、降血压、抗辐射等生物活性[4]。目前条斑紫菜的加工方式为一次加工和二次加工,其中一次加工为干制,其产品为二次加工品的原料;二次加工为烤制,其产品为消费者熟悉的海苔[5]。无论是干制还是烤制,由于紫菜细胞壁中的紫菜多糖和纤维素的存在,紫菜细胞内的营养成分和生物活性物质的释放受到阻碍[6]。因此,亟需开发一种新型加工方式,提升条斑紫菜的营养和生物活性价值,同时丰富其现有产品形式。
发酵是一种历史悠久的加工方式,可有效提升工艺效率、改善产品质量[7],不仅能够产生醇类、酯类、酸类等物质,还能够赋予发酵食品独特的风味,有利于延长食品的保藏期[8]。因此可将发酵技术应用于条斑紫菜,提升产品品质并丰富产品形式。乳酸菌和酵母菌是食品加工常用的菌种,目前已有研究将其应用于发酵条斑紫菜,Yang等[9]利用三种乳酸菌发酵条斑紫菜后改善了紫菜的风味和感官特性,并增强了其体外抗氧化活性,Uchida等[10]研究发现乳酸菌发酵的紫菜具有丰富的游离氨基酸,并表现出ACE抑制活性,Kuda等[11]发现乳酸菌发酵后紫菜具有较强的抗氧化活性,李缓缓[12]采用酵母菌和枯草芽孢杆菌发酵紫菜和螺旋藻,并比较了其ACE和α-葡萄糖苷酶抑制能力。但目前乳酸菌和酵母菌发酵条斑紫菜处于实验室研究阶段,没有实现产业化的生产,并且研究内容主要聚焦于风味特征,对生物活性及变化机理的探究不够全面。
红曲霉是一种小型丝状腐生真菌[13],接种于大米可制备发酵红曲米[14],富含多种活性代谢物质如γ-氨基丁酸、洛伐他汀[15]等。目前红曲霉发酵主要用于研制酒、调味品、肉制品、茶叶等产品,主要探究发酵产品的风味、代谢产物,以及降血压、降血脂、改善胆固醇等生物活性[16],于配配等[17]采用红曲霉发酵紫菜饮料并对其工艺进行了优化。然而,红曲霉发酵条斑紫菜的活性研究尚未被探索。与酵母菌和乳酸菌相比,红曲霉具有强大的产酶能力,在发酵过程中能够产生丰富酶系,如多糖酶,可以分解紫菜细胞壁中的多糖和纤维素,具有促进活性物质产生与释放的潜力[18]。将红曲霉复配酵母菌和乳酸菌发酵应用于条斑紫菜食品加工,对提高产品的功能活性和促进健康具有良好的可行性,预期能够更加有效地提升条斑紫菜的生物活性。
因此,本研究选取红曲霉以及复配酵母菌和乳酸菌对条斑紫菜进行发酵,测定其总酚与黄酮的含量变化,并通过ABTS+自由基、DPPH自由基抑制率测定实验和FRAP实验对体外抗氧化活性进行探究,进一步通过α-淀粉酶和α-葡萄糖苷酶抑制活性评价体外降血糖能力,并以ACE抑制能力评价体外降血压活性,从而为发酵提高条斑紫菜食品的开发及其生物活性的研究提供理论依据,为开发新型紫菜产品提供实践指导。
1. 材料与方法
1.1 材料与仪器
条斑紫菜(Pyropia yezoensis)(一次加工菜饼) 盐城海瑞食品有限公司;红曲米 中慧生物科技股份有限公司,其发酵菌为红曲霉(Monascus purpureus);乳酸菌(Lactobacillus plantarum) 川秀科技有限公司;酵母菌(Saccharomyces cerevisiae) 安琪酵母股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 上海梯希爱化成工业发展有限公司;α-葡萄糖苷酶、α-淀粉酶、对-硝基苯基-α-D-吡喃葡萄糖苷(pNPG)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三(2-吡啶基)三嗪(TPTZ)、Trolox 美国Sigma公司;槲皮素、福林酚 麦克林生化科技股份有限公司;血管紧张素转换酶(ACE) 上海颖心实验室设备有限公司;没食子酸 上海源叶生物科技有限公司;可溶性淀粉 上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
FA2004B电子天平 上海天美天平仪器有限公司;LDZM-90L-II立式高压蒸汽灭菌器 上海申安医疗器械厂;SW-CJ-1FD超净工作台 苏净集团苏州安泰空气技术有限公司;TGL-16M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;EPOCH2酶标仪 美国伯腾仪器有限公司;JYL-C012料理机 九阳股份有限公司;ZHSY-50V恒温水浴摇床 上海知楚仪器有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司;DHG-9140A电热恒温鼓风干燥箱 上海申光仪器仪表有限公司。
1.2 实验方法
1.2.1 发酵剂制备
参考邵悦春等[19]的方法,制备菌液:红曲霉菌液:0.01 g红曲米粉加入100 mL灭菌超纯水,30 ℃孵育2 h;乳酸菌液:1.00 g乳酸菌粉加入25 mL灭菌超纯水,30 ℃孵育3 h;酵母菌液:0.04 g酵母菌粉加入10 mL灭菌超纯水,30 ℃孵育1 h。
1.2.2 条斑紫菜发酵工艺
参考Nie等[6]的方法,将片状条斑紫菜片剪成2 cm×2 cm的小方片,以1:30的质量比加入蒸馏水,在室温下浸泡30 min,复水后用纱布过滤多余水分,将紫菜在121 ℃下灭菌20 min,冷却至室温。在100 mL锥形瓶中加入20 g复水灭菌后的紫菜、10 mL水、2 g蔗糖,并接种不同菌液,然后在30 ℃、100 r/min的摇床中密封发酵10 d,得到发酵条斑紫菜,不同菌种发酵组合如下:UF:紫菜不接种任何菌液;MF:紫菜接种500 μL红曲霉菌液(2.5%, v/w);MLF:紫菜接种500 μL红曲霉菌液(2.5%, v/w)和500 μL乳酸菌液(2.5%, v/w);MYF:紫菜接种500 μL红曲霉菌液(2.5%, v/w)和50 μL酵母菌液(0.25%, v/w)。
1.2.3 发酵提取液的制备
发酵后将条斑紫菜取出,加入等质量的蒸馏水进行匀浆,将匀浆液离心(8000 r/min,15 min,4 ℃),取上清液,重复两次,合并上清液并定容至30 mL,即得样品提取液,保存于−20 ℃,用于后续测定。
1.2.4 生物活性物质测定
1.2.4.1 总酚
发酵紫菜中总酚含量的测定采用福林酚法[20]。取50 μL发酵提取液,加入350 μL去离子水、200 μL福林酚试剂,静置3 min,再加入7.5%的碳酸钠溶液400 μL,涡旋混匀,室温避光反应1 h,在765 nm处测定吸光度,以没食子酸作为标准品,制作标准曲线(y=0.0679x+0.0513,R2=0.9994),计算发酵条斑紫菜样品中的总酚含量。
1.2.4.2 黄酮
黄酮含量的测定采用亚硝酸钠-氯化铝-氢氧化钠比色法[21]。取0.5 mL发酵提取液,加入5%亚硝酸钠溶液70 μL,室温静置5 min,加入10%氯化铝溶液150 μL,再次静置5 min,加入1 mol/L氢氧化钠溶液1 mL,静置5 min后在415 nm处测定吸光度,槲皮素做标准品,制作标准曲线(y=0.0033x+0.1763,R2=0.9993),计算发酵条斑紫菜样品中的黄酮含量。
1.2.5 抗氧化活性
1.2.5.1 ABTS+自由基清除能力测定
参考Guo等[22]的方法,取发酵提取液30 μL,加入170 μL去离子水、800 μL的ABTS试剂,混匀,室温避光反应10 min,在734 nm波长处测定吸光度,计算ABTS+自由基清除率,并以trolox为标准品,制作标准曲线(y=0.1046x−0.0045,R2=0.9991,x为trolox当量,y为抑制率),计算结果表示为每克发酵条斑紫菜样品的trolox毫克当量(mg TE/g)。
ABTS+自由基清除率(%)=(1−Α1−A2A3−A4)×100 式中:A1表示待测液和ABTS反应后的吸光度;A2表示待测液和水混合后的吸光度;A3表示水和ABTS混合液的吸光度值;A4表示水的吸光度值。
1.2.5.2 DPPH自由基清除能力测定
参考Thinzar等[23]的方法并略有修改,取发酵提取液30 μL,加入170 μL去离子水、200 μL的DPPH甲醇溶液(0.1 mg/mL),涡旋混匀,室温避光反应30 min,在515 nm处测定吸光度,计算DPPH自由基清除率,并以trolox做标准品,制作标准曲线(y=0.2102x-0.0825,R2=0.9998,x为trolox当量,y为抑制率),计算结果表示为每克发酵条斑紫菜样品的trolox毫克当量(mg TE/g)。
DPPH自由基清除率(%)=(1−A1−A2A3−A4)×100 式中:A1表示待测液和DPPH反应后的吸光度;A2表示待测液和甲醇混合液的吸光度;A3表示甲醇和DPPH溶液混合液的吸光度值;A4表示甲醇的吸光度值。
1.2.5.3 铁还原能力测定
参考Kuda等[11]的方法,FRAP试剂由300 mmol/L的NaAc-HAc缓冲溶液、20 mmol/L的FeCl3溶液、10 mmol/L的TPTZ盐酸溶液以10:1:1混合配制。取50 μL发酵提取液,加去离子水至100 μL,加入37 ℃预热后的FRAP试剂900 μL,在37 ℃培养箱中避光反应10 min,测定593 nm波长下的吸光度值。以trolox作为标准品,制作标准曲线(y=0.1057x+0.074,R2=0.9999,x为trolox当量,y为吸光度),计算结果表示为每克发酵条斑紫菜样品的trolox毫克当量(mg TE/g)。
1.2.6 降血糖活性
1.2.6.1 α-淀粉酶抑制能力的测定
参考He等[24]的方法,PBS缓冲液由0.2 mol/L的Na2HPO4-12H2O溶液和0.2 mol/L的NaH2PO4-2H2O溶液以49:51的比例混合配制,并用0.06 mol/L的NaCl溶液调节pH至6.8。称取1.0 g可溶性淀粉溶解于100 mL缓冲液中,100 ℃沸煮10 min使其糊化至半透明状态,冷却至室温。具塞试管中加入10 μL发酵提取液、40 μL去离子水、50 μL的α-淀粉酶(0.1 mg/mL)溶液,涡旋混匀,37 ℃孵育15 min,再加入50 μL 1%淀粉溶液,继续在37 ℃反应10 min,再加入100 μL的DNS试剂,沸水浴15 min,然后冷却15 min,加入1 mL去离子水,混匀后测定540 nm处的吸光度值。根据公式计算α-淀粉酶活性抑制率。
α-淀粉酶抑制率(%)=(1−A1−A2+A3−A4A5−A6)×100 式中:A1表示样品与淀粉酶反应后的吸光度值;A2表示缓冲液代替淀粉酶后的吸光度值;A3表示缓冲液代替淀粉酶和淀粉后的吸光度值;A4表示缓冲液代替淀粉后的吸光度值;A5表示缓冲液代替样品后的吸光度值;A6表示缓冲液代替样品和淀粉酶后的吸光度值。
1.2.6.2 α-葡萄糖苷酶抑制能力的测定
参照Yang等[25]的方法测定α-葡萄糖苷酶抑制率。在500 μL离心管中加入发酵提取液、5 U/mL的α-葡萄糖苷酶溶液、磷酸钠缓冲溶液各50 μL,涡旋混匀,37 ℃孵育10 min后加入50 µL的PNPG试剂(5 mmol/L),继续在37 ℃反应10 min,再加入0.2 mol/L的Na2CO3溶液100 µL终止反应,测定反应液在405 nm处的吸光度。根据公式计算α-葡萄糖苷酶抑制率。
α-葡萄糖苷酶抑制率(%)=(1−A1−A2A3−A4)×100 式中:A1表示样品与α-葡萄糖苷酶、PNPG反应后的吸光度;A2表示缓冲液代替α-葡萄糖苷酶后的吸光度;A3表示缓冲液代替样品后的吸光度;A4表示缓冲液代替样品和α-葡萄糖苷酶后的吸光度。
1.2.7 降血压活性
参照Sofia等[26]的方法测定发酵样品的体外ACE抑制率,在96微孔板中依次加入稀释六倍的发酵提取液40 μL、0.1 U/mL的ACE试剂10 μL,最后加入1 mmol/L的FAPGG底物50 μL,对照组用40 μL的HEPES缓冲液(80 mmol/L)代替样品。加入试剂后立即测定340 nm波长处的吸光度,然后在37 ℃避光反应30 min,再次立即测定340 nm的吸光度。根据公式计算ACE抑制率。
ACE抑制率(%)=(1−A1−A2B1−B2)×100 式中:A1表示样品与底物和酶反应前的吸光度值;A2表示样品与底物和酶反应30 min后的吸光度值;B1表示缓冲液与底物和酶反应前的吸光度值;B2表示缓冲液与底物和酶反应30 min后的吸光度值。
1.3 数据处理
每组实验均进行3次独立重复,结果以平均值±标准差表示,采用Graphpad Prism 9.5 软件进行数据整理和显著性分析(基于双因素方差分析和T检验,P<0.05)。
2. 结果与分析
2.1 生物活性物质
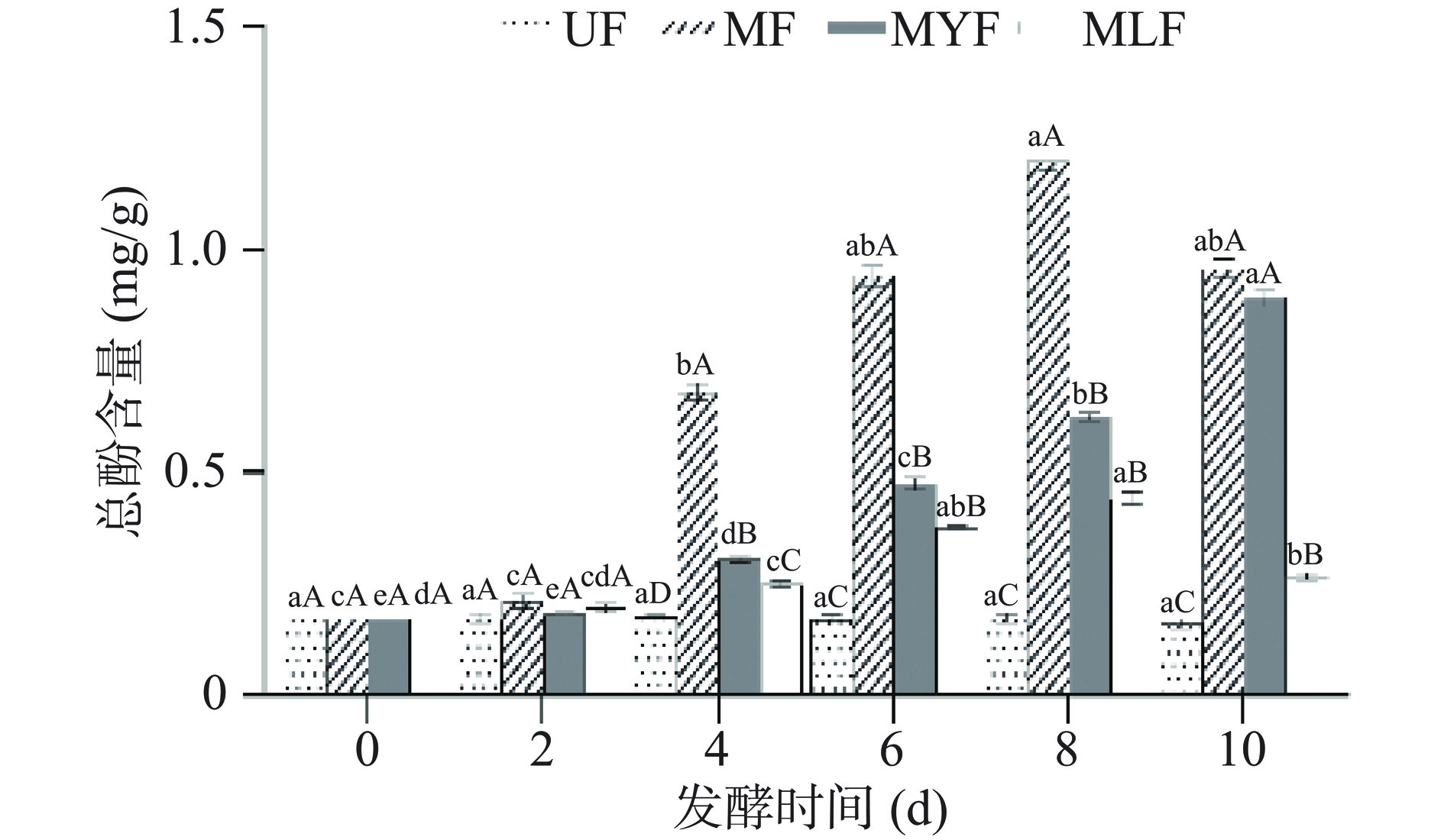
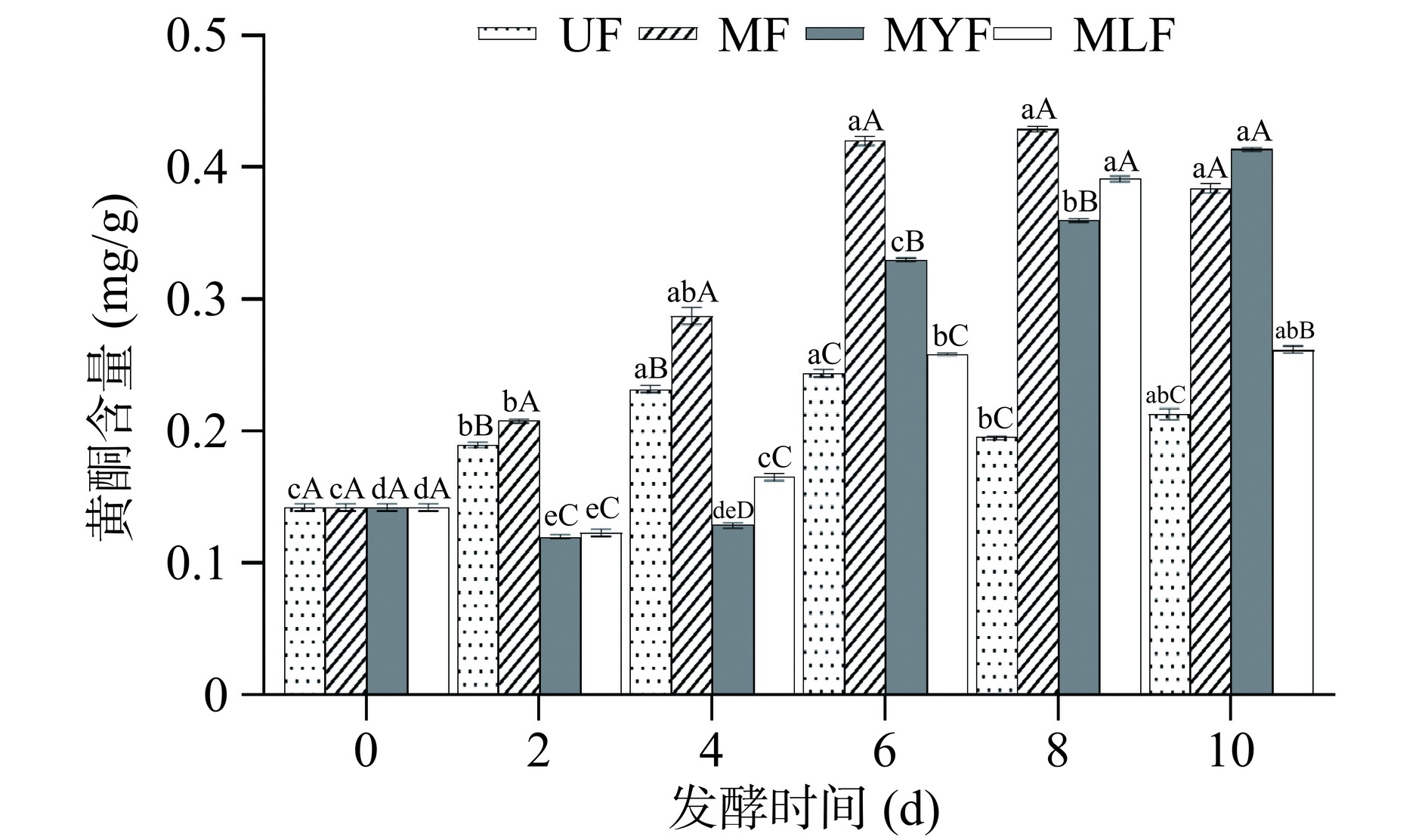
多酚和黄酮是紫菜中重要的生物活性物质,具有抗氧化、抗炎、降血糖、降血压、降血脂等功能活性[27],其含量在发酵后增加有益于条斑紫菜功能性食品的开发,不同发酵菌种和不同发酵时间的条斑紫菜中总酚和黄酮的含量变化分别如图1、图2所示。
2.1.1 总酚
如图1所示,总酚含量在未发酵组中无明显变化,而在三组发酵样品中均有显著增加(P<0.05)。其中,MF的总酚含量升高最为显著(P<0.05),随发酵时间先升高后降低,在第8 d含量最高,为(1.198±0.004) mg/g,达到第0 d的7倍;MLF的总酚含量同样呈现先增加后减少的趋势,在第8 d达到(0.443±0.014) mg/g;MYF的总酚含量随发酵时间逐渐增加,从(0.172±0.001) mg/g升高至(0.892±0.002) mg/g。发酵过程中微生物不仅通过代谢活动产生活性物质,同时能够释放出大量的纤维素酶、果胶酶、半纤维素和淀粉酶,可以有效破坏细胞壁,促进多酚化合物的释放[28],并将不溶性结合酚转化为可溶性酚类[29],从而使多酚含量明显升高,此外,微生物和酶也会促进多酚的进一步代谢和转化[30],因此总酚含量在发酵末期有所降低,这与Kuligowski等[31]的研究结果相似。
2.1.2 黄酮
如图2所示,未发酵样品中的黄酮在发酵前期略有升高,是因为浸泡作用导致少量黄酮浸出[32],但在发酵后期其含量明显低于发酵组。发酵前条斑紫菜中的黄酮含量为0.142±0.003 mg/g,MF和MLF均呈现随发酵时间先增加后减少的趋势,在第8 d含量显著增加(P<0.05),分别升高至0.430±0.007、0.391±0.004 mg/g。MYF中的黄酮随发酵时间延长而逐渐增加,在第6 d显著升高(P<0.05),含量为0.330±0.001 mg/g,发酵结束时升高至0.414±0.013 mg/g。发酵过程中微生物可通过代谢途径合成黄酮化合物,并且复杂的多酚化合物可以被微生物酶分解产生简单的黄酮醇化合物[33]。此外,黄酮含量与发酵环境中酸水平的变化有关[34],酸性环境下可以促进结合类黄酮化合物的释放与分解[23],发酵前期微生物产生有机酸,有利于黄酮积累使其含量增加,发酵后期酸类物质被进一步代谢,酸水平减弱,因此第10 d黄酮含量增加缓慢甚至下降。
以上结果说明发酵能够促进活性物质的产生与释放,并且不同菌种发酵的总酚与黄酮含量增加不同。MF中含量增加最高,原因是红曲霉为主要优势菌,在发酵前期快速生长,产生的有机酸、酶等代谢产物促进了活性成分的溶出,并将大分子降解为小分子,使多酚和黄酮含量迅速增加;而MLF和MYF中的活性成分增加较为缓慢,可能是因为乳酸菌和酵母菌在发酵过程中与红曲霉共同利用发酵底物,一定程度上减缓了红曲霉的生长,并且其产酶能力较弱,因此活性物质的产生与释放较少。此外,研究表明,酵母菌比植物乳杆菌发酵更有利于大分子的水解与转化[35],因此MYF中的总酚与黄酮含量比MLF更高。
2.2 抗氧化活性分析
条斑紫菜抗氧化活性的变化主要与酚类和黄酮等活性物质有关[36],天然多酚和黄酮类化合物具有明显的抗氧化活性[37],可以通过提供氢原子或螯合剂来清除自由基[38],通过测定ABTS+自由基、DPPH自由基抑制率和FRAP实验评估发酵过程中条斑紫菜的抗氧化活性变化。
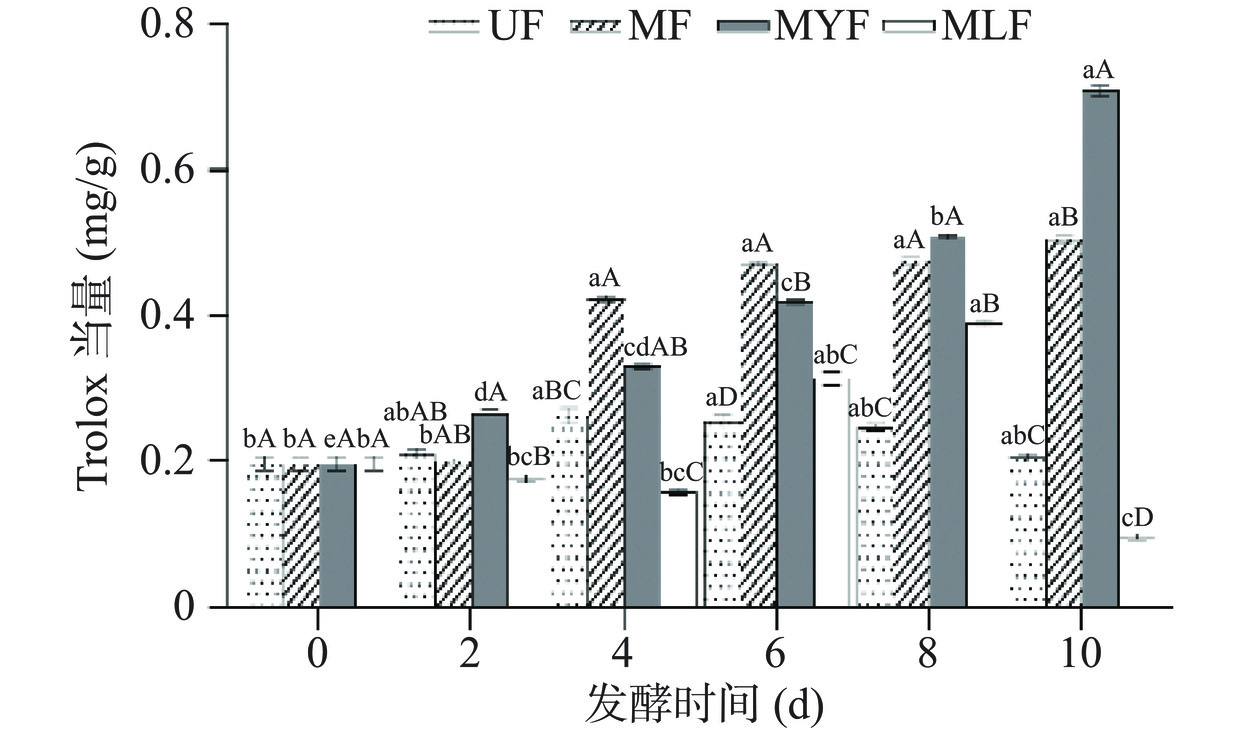
2.2.1 ABTS+自由基清除能力
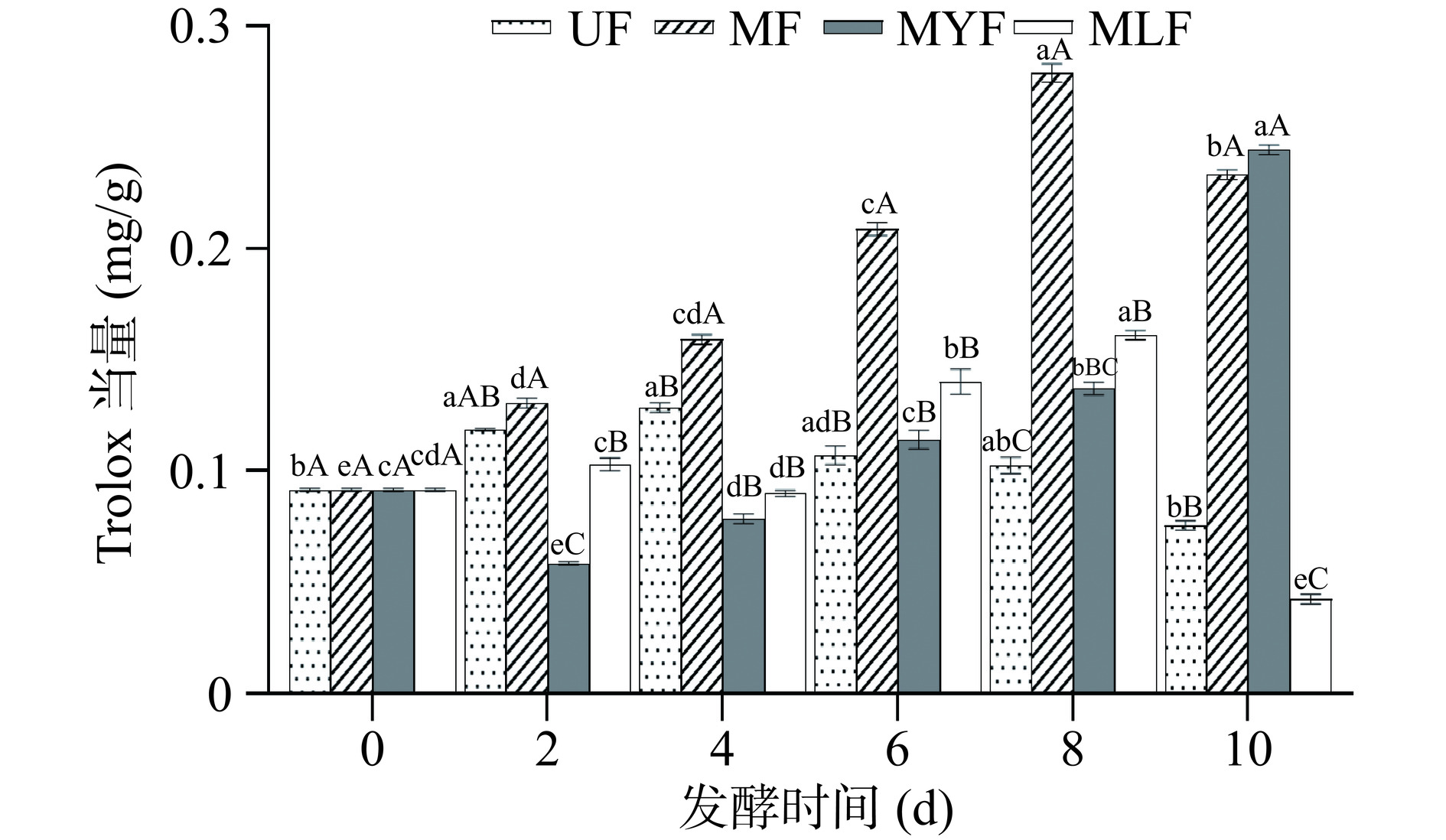
发酵过程中条斑紫菜的ABTS+自由基清除能力结果如图3所示,未发酵组的清除能力在第4 d略有提升,Trolox当量从0.196±0.002 mg/g升高至0.262±0.002 mg/g,因为有少量活性物质浸出,含量增加,使其抗氧化能力有所上升,但明显低于发酵组。发酵组的清除能力均有明显升高,其中,MF的活性在第4 d显著提升(P<0.05),Trolox当量为0.424±0.006 mg/g,而后在第6至10 d保持稳定,无明显变化;MYF的清除能力随发酵时间逐渐升高,并在第10 d显著增加(P<0.05),Trolox当量达到0.709±0.007 mg/g,升高为第0 d的3.6倍;MLF与MF、MYF相比抗氧化活性较弱,其ABTS+自由基清除能力在发酵前期呈现略微下降的趋势,第6 d明显上升,并在第8 d显著升高至0.389±0.007 mg/g (P<0.05),但在第10 d迅速下降至0.097±0.001 mg/g,与其总酚和黄酮含量在第10 d明显下降有关。
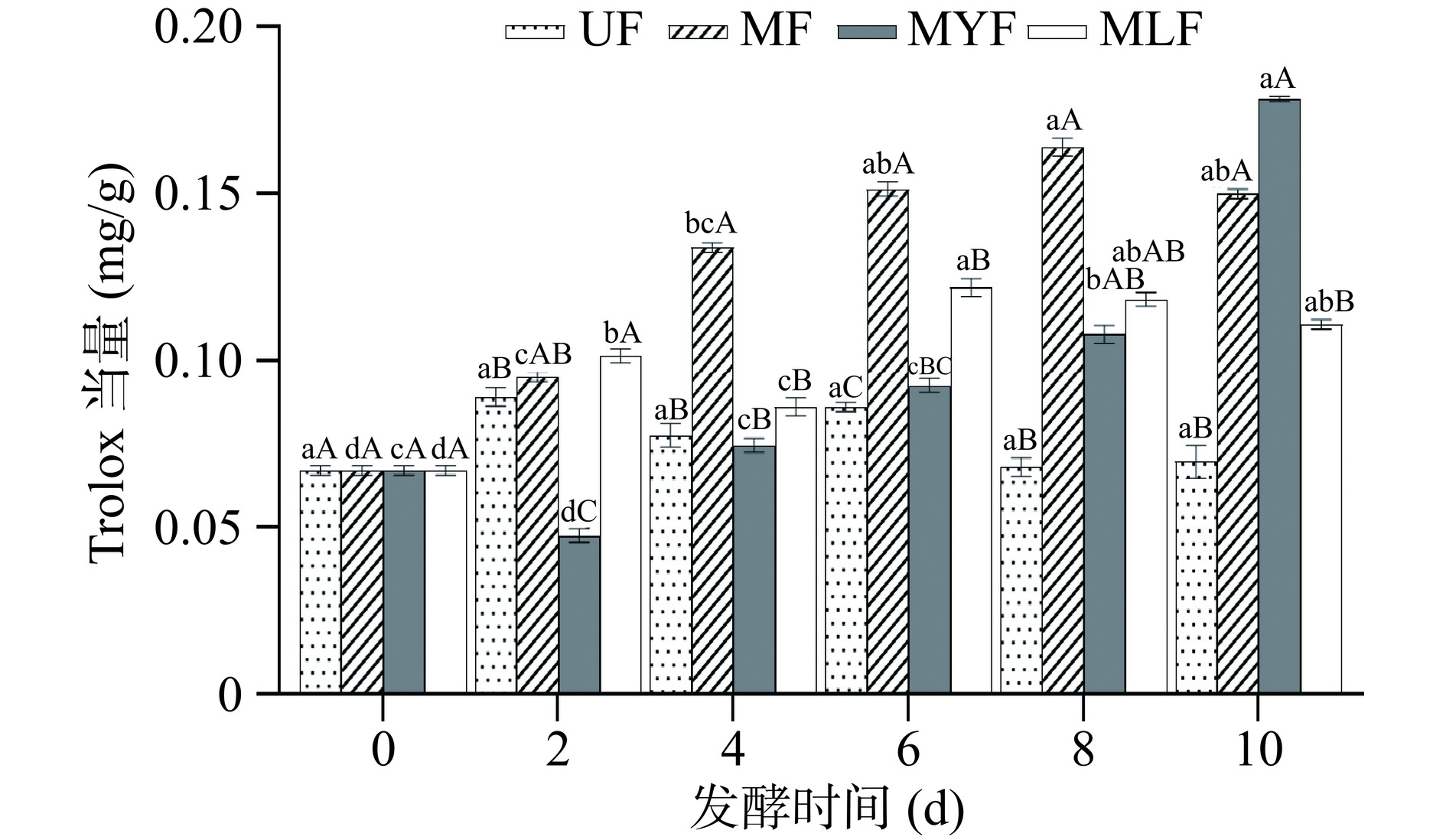
2.2.2 DPPH自由基清除能力
发酵过程中条斑紫菜的DPPH自由基清除能力结果如图4所示,其变化趋势与总酚和黄酮含量变化呈现明显的一致性。MF的清除能力在第2~8 d呈现稳定上升的趋势,在第8 d达到最高,Trolox当量为0.164±0.003 mg/g,明显高于其它三组样品,而第10 d则下降至与第6 d相近的水平,并且MF中的活性物质含量同样表现出先上升后下降的趋势;MYF对DPPH自由基的清除能力随发酵时间呈先下降后上升的趋势,第2 d下降至0.048±0.001 mg/g,而后逐渐上升,第10 d显著升高至0.179±0.0003 mg/g (P<0.05),这与MYF的黄酮含量在第2 d明显减少然后逐渐增加的趋势一致;MLF的清除能力在第6 d达到最高,Trolox当量为0.122±0.005 mg/g,与未发酵组相比提升了41.86%,董玉婷等[39]采用植物乳杆菌发酵紫菜,结果显示其DPPH自由基清除能力提升了35%,本研究中植物乳杆菌与红曲霉复配后表现出更强的清除效果,说明红曲霉的添加进一步提升了条斑紫菜的抗氧化活性。
2.2.3 铁还原能力
如图5所示,发酵过程中条斑紫菜的铁还原能力与DPPH自由基清除能力的变化趋势相似,并在发酵第8~10 d达到最高。其中,MF具有最强的抗氧化活性,其铁还原能力从第2 d开始逐渐增加,并在第8 d的表现出四组中最强的还原能力,Trolox当量为0.279±0.007 mg/g,达到第0 d的3倍,而后在发酵结束时略有下降;MYF的铁还原能力在第2 d显著下降至0.058±0.001 mg/g (P<0.05),而后在发酵过程中逐渐上升,并在第10 d显著升高至0.244±0.002 mg/g (P<0.05);MLF的铁还原能力较弱,在发酵前期略有波动,而后呈现先上升后下降的趋势,第8 d升高至0.162±0.005 mg/g,第10 d其活性物质明显减少,导致铁还原能力显著降低(P<0.05)。
以上结果说明发酵能够明显提升条斑紫菜的抗氧化活性,不同菌种发酵的抗氧化能力差异与不同微生物的代谢产物和活性物质有关。总体而言,MF具有比MYF和MLF更强的抗氧化活性,Xia等[40]同样发现使用霉菌发酵后的抗氧化活性最强,酵母菌和乳酸菌的活性次之,原因可能是酵母菌和乳酸菌发酵使黄酮的酚羟基发生了改变,导致抗氧化活性降低。
2.3 降血糖活性分析
α-淀粉酶和α-葡萄糖苷酶分别与碳水化合物的水解和葡萄糖的吸收有关[41],是餐后血糖升高的重要原因,因此抑制其活性是控制Ⅱ型糖尿病的有效措施[42],本研究测定了条斑紫菜在发酵过程中对α-淀粉酶和α-葡萄糖苷酶的抑制率。
2.3.1 α-淀粉酶抑制能力
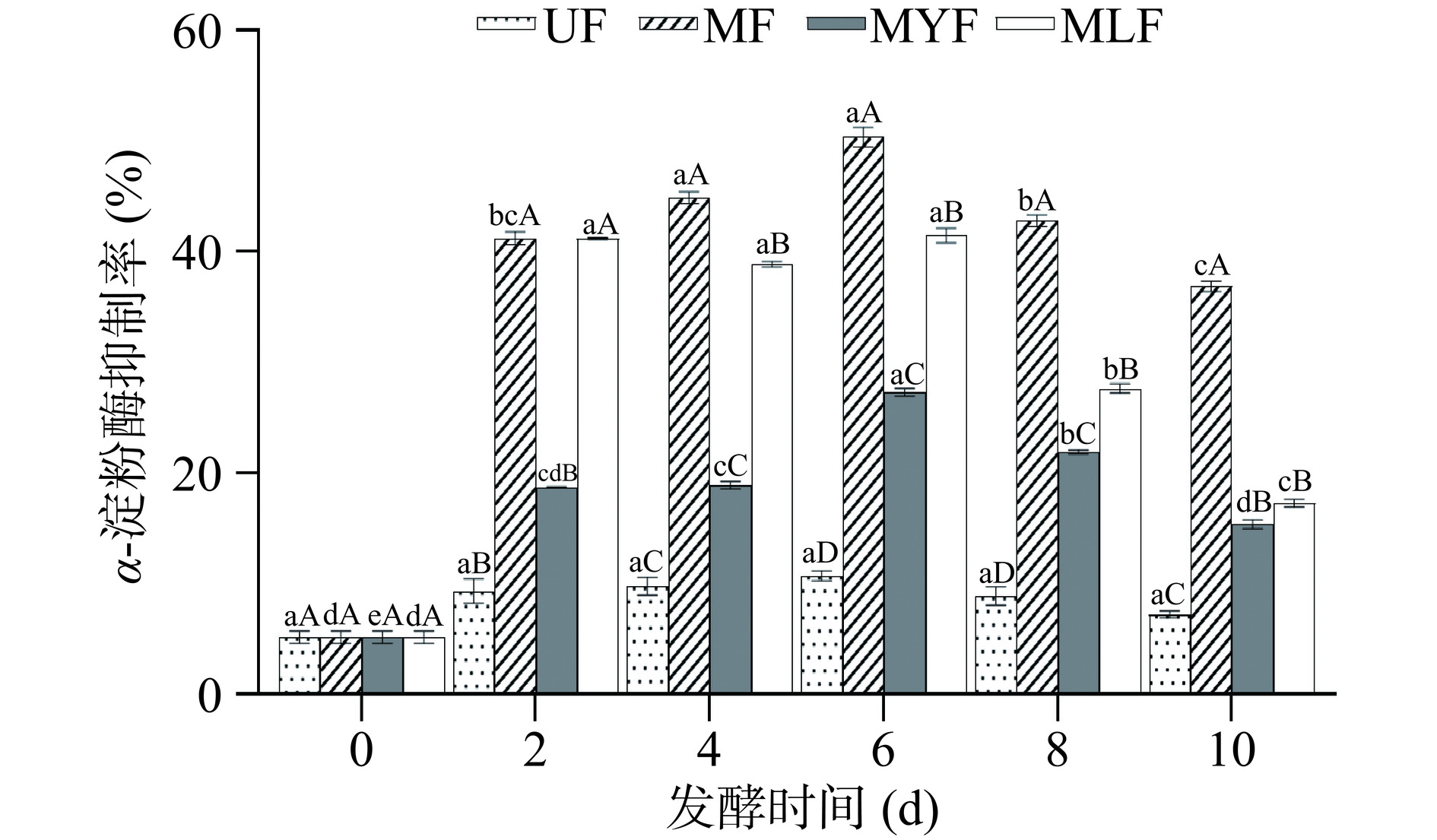
如图6所示,α-淀粉酶抑制实验中MF的抑制能力最强,MLF次之,MYF最弱,但三组发酵样品均表现出比UF更高的抑制活性。MF、MYF、MLF的α-淀粉酶抑制效果随发酵时间均呈现先增加后减弱的趋势,在发酵第2 d抑制率显著升高(P<0.05),从5.18%±0.57%分别增加至41.25%±0.44%、18.72%±0.05%、41.20%±0.10%,并在第6 d达到最高,分别为50.37%±0.73%、27.27%±0.20%、41.49%±0.51%,而后逐渐下降。海藻中含有多糖、多酚、多肽等多种降血糖活性物质,推测发酵前期条斑紫菜产生并积累了大量活性成分,在后期被进一步代谢和转化,因此活性先上升后下降。
2.3.2 α-葡萄糖苷酶抑制能力
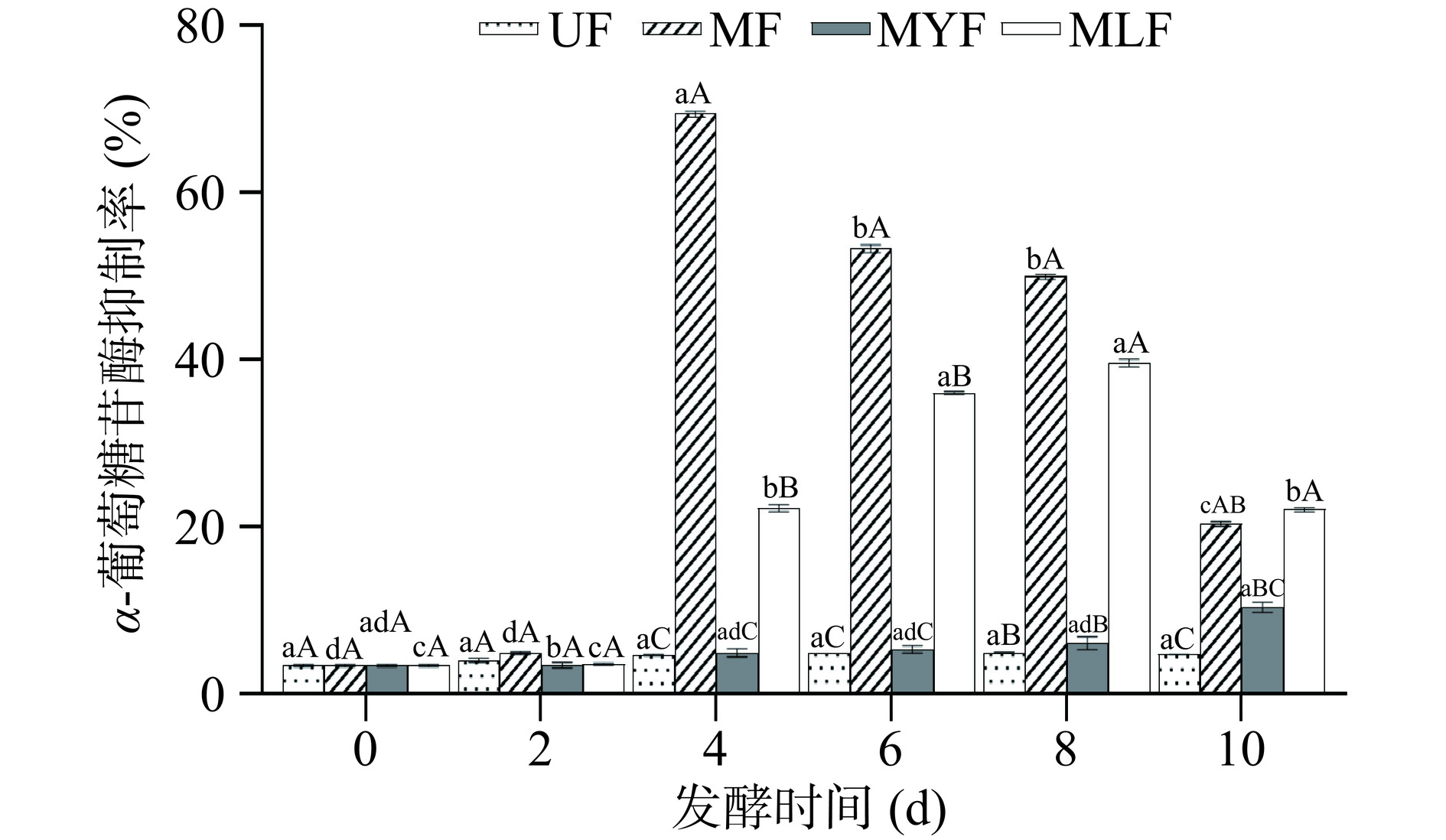
如图7所示,未发酵组的α-葡萄糖苷酶抑制率保持在3.41%±0.19%~4.98%±0.02%,因为UF中无微生物进行发酵活动,未代谢生成活性物质,因此其活性无明显改变。发酵组中MF表现出明显升高的α-葡萄糖苷酶抑制能力,第4 d抑制率出现显著上升(P<0.05),增加至69.42%±0.37%,而后在第6~10 d逐渐下降。MLF的抑制能力从第4 d开始逐渐升高,在第8 d达到最高,抑制率为39.60%±0.13%,与未发酵组相比增加了35%,董玉婷等[39]采用乳酸菌发酵坛紫菜后其α-葡萄糖苷酶抑制率增加了37%,与本研究结果相似。MYF仅表现出微弱的抑制活性,在第10 d略微升高至10.36%±0.45%。在酵母菌发酵坛紫菜的[12]研究中,固态发酵提取物对α-葡萄糖苷酶的抑制率同样仅为10%左右,而液态发酵提取物的抑制率达到41%,因此推测酵母菌发酵紫菜的活性可能与料液比有关。
以上结果说明发酵能够提升条斑紫菜对α-淀粉酶和α-葡萄糖苷酶的抑制能力,并且MF表现出最明显的降血糖活性。王丹等[43]同样发现红曲霉发酵对α-淀粉酶和α-葡萄糖苷酶的抑制能力明显高于乳酸菌与酵母菌,推测与活性物质的产生有关,多酚和黄酮具有降血糖活性[44],并且在MF中增加最明显,因此其降血糖活性显著提升(P<0.05)。此外,研究表明有机酸具有抑制消化酶的能力[45],MLF中的乳酸菌发酵能够产生大量有机酸,从而促进了其降血糖活性的提升。因此发酵条斑紫菜具有产生天然降血糖活性物质的潜力,可应用于功能性食品的开发。
2.4 降血压活性分析
ACE在肾素-血管紧张素系统和激肽释放酶-激肽系统中具有关键作用[46],抑制ACE的活性可以使血管紧张素I无法转化为血管紧张素II,从而使血压下降[47]。采用体外ACE抑制实验对发酵条斑紫菜的降血压活性进行评价,结果如图8所示。
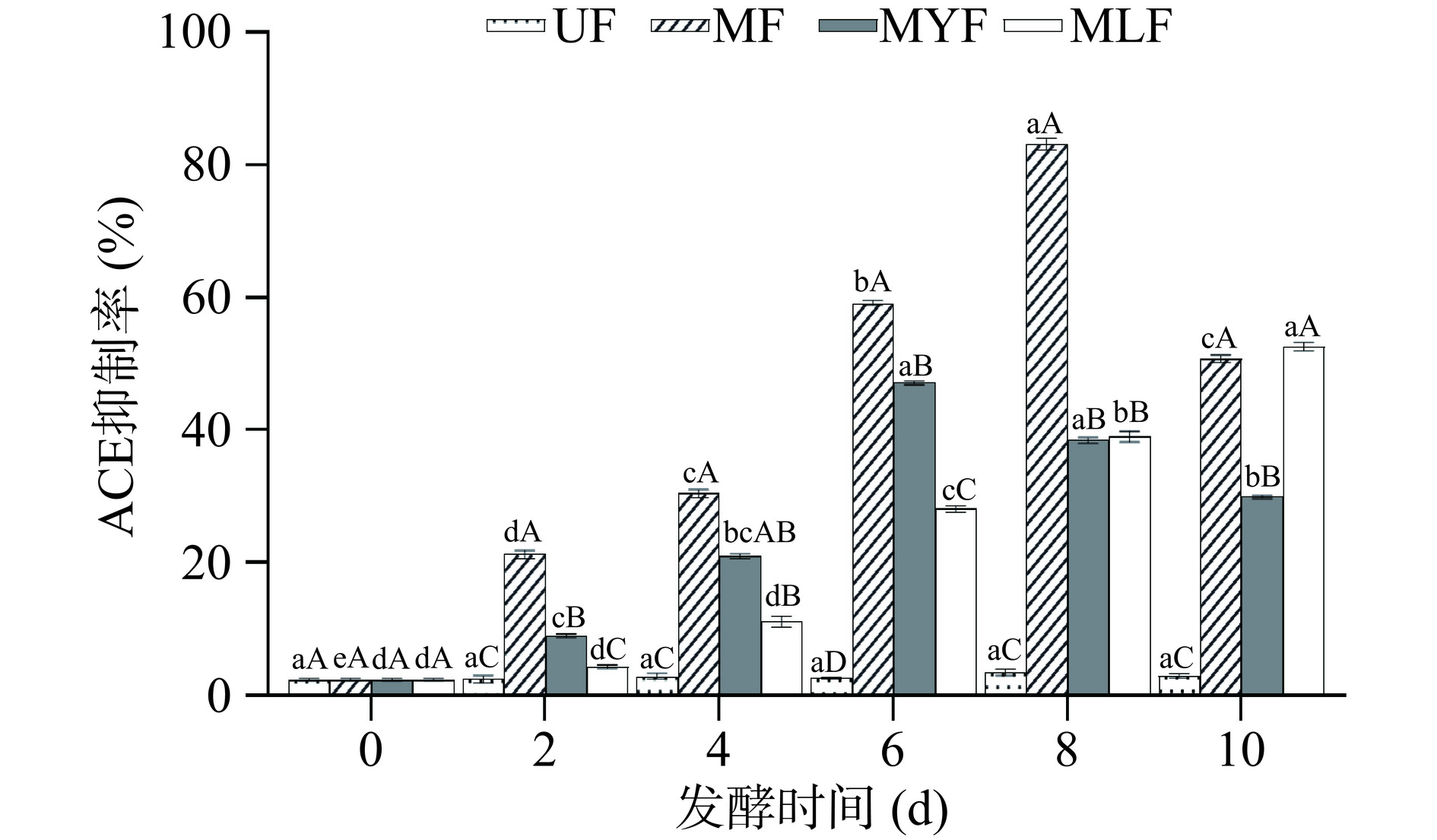
未发酵组的ACE抑制率在2.29%±0.02%~3.33%±0.13%之间波动,无明显变化,微生物发酵后,条斑紫菜对ACE的抑制作用均有明显升高,其中MF表现出最强的抑制效果,其抑制能力主要随发酵时间延长而增加,并在第8 d达到最高,抑制率为83.21%±0.89%,与其他组相比具有显著性差异(P<0.05);MYF的抑制能力呈现先上升后下降的趋势,在第6 d达到最高,抑制率为47.09%±0.27%;MLF的ACE抑制能力在整个发酵过程中逐渐升高,第10 d的ACE抑制率达到52.65%±0.64%,与UF相比存在显著性差异(P<0.05)。Uchida等[10]用嗜盐四联球菌发酵条斑紫菜后ACE抑制率最高达到53%,本研究中MLF和MYF的抑制率同样为50%左右,而MF则达到80%以上,说明红曲霉发酵具有显著的降血压活性。
具有降血压活性的物质主要包括多糖和肽类等,并且其生物活性与分子量有关,分子量较小的组分更有可能表现出降血压活性[27]。发酵过程中微生物产生的酶类可以对紫菜中的多糖和多肽起到降解作用,从而促进ACE抑制能力的提升。此外,研究表明海藻中的多酚类化合物同样具有显著的降血压活性[48],红曲霉发酵后多酚含量的升高有助于降血压活性的改善。发酵产生的降压活性物质天然安全,且具有良好的功能效果,因此发酵条斑紫菜可以作为功能性降压食品的优质来源。
3. 结论
本研究对比了红曲霉发酵及红曲霉复配酵母菌和乳酸菌发酵对条斑紫菜活性物质和生物功能的影响。结果表明发酵明显提升了条斑紫菜中总酚与黄酮的含量,促进了活性物质的产生与释放。进一步通过生物活性实验反映了发酵条斑紫菜具有较好的功能效果,ABTS+、DPPH自由基清除能力和铁还原实验表明MF、MYF、MLF的抗氧化活性随发酵时间明显升高,并且活性变化与总酚和黄酮含量的变化趋势相似;降血糖活性中,MF具有最高的α-淀粉酶和α-葡萄糖苷酶抑制能力,发酵第2~4 d的抑制率显著升高(P<0.05),MLF的降血糖活性次之,在发酵第6~8 d达到最高,而MYF的降血糖活性较弱,其抑制率分别为27.27%±0.20%、10.36%±0.45%;发酵组的降血压活性在发酵第6~10 d达到最高,并且MF具有最强的ACE抑制能力。因此,红曲霉发酵可以作为提高条斑紫菜生物活性的加工技术,本研究结果为功能性条斑紫菜食品的开发提供了理论依据和研究基础。而对发酵后条斑紫菜中代谢产物的变化和生物活性提升的机制,有待进一步的研究。
-
-
[1] SIVAKUMAR S A, NAZIYA B, SUNG K, et al. Biopeptides of Pyropia yezoensis and their potential health benefits:A review[J]. Asian Pacific Journal of Tropical Biomedicine,2021,11(9):375−384. doi: 10.4103/2221-1691.321127
[2] 国家统计局. 中国渔业统计年鉴[M]. 北京:中国农业出版社, 2023:23−24. [State Statistical Bureau. China fishery statistical year book[M]. Beijing:China Agriculture Press, 2023:23−24.] State Statistical Bureau. China fishery statistical year book[M]. Beijing: China Agriculture Press, 2023: 23−24.
[3] NATHALIE B, SOPHIE A B, GAËLLE A J. Chapter Five - Algae for global sustainability?[J]. Advances in Botanical Research,2021,100:145−212.
[4] GAO T Q, CHEN J L, XU J, et al. Screening of a novel Lactiplantibacillus plantarum MMB-05 and Lacticaseibacillus casei fermented sandwich seaweed scraps:Chemical composition, in vitro antioxidant, and volatile compounds analysis by GC-IMS[J]. Foods,2022,11(18):2875. doi: 10.3390/foods11182875
[5] CHO J T, RHEE S M. Health functionality and quality control of laver (Porphyra pyropia):Current issues and future perspectives as an edible seaweed[J]. Marine Drugs,2020,18(1):14.
[6] NIE J L, FU X T, WANG L, et al. Impact of Monascus purpureus fermentation on antioxidant activity, free amino acid profiles and flavor properties of kelp (Saccharina japonica)[J]. Food Chemistry,2022,400:133990.
[7] UCHIDA M, MIYOSHI T, YOSHIDA G, et al. Isolation and characterization of halophilic lactic acid bacteria acting as a starter culture for sauce fermentation of the red alga nori (Porphyra yezoensis)[J]. Journal of Applied Microbiology,2014,116(6):1506−1520. doi: 10.1111/jam.12466
[8] 崔韵, 刘烨, 黄小芬, 等. 食用海藻发酵加工研究进展[J]. 粮食与食品工业,2010,17(1):31−33. [CUI Y, LIU Y, HUANG X F, et al. Advances review on fermentation of edible seaweed[J]. Cereal & Food Industry,2010,17(1):31−33.] doi: 10.3969/j.issn.1672-5026.2010.01.009 CUI Y, LIU Y, HUANG X F, et al. Advances review on fermentation of edible seaweed[J]. Cereal & Food Industry, 2010, 17(1): 31−33. doi: 10.3969/j.issn.1672-5026.2010.01.009
[9] YANG J, GAO T Q, GE F, et al. Porphyra yezoensis sauces fermented with lactic acid bacteria:Fermentation properties, flavor profile, and evaluation of antioxidant capacity in vitro[J]. Frontiers in Nutrition,2022,8:810460. doi: 10.3389/fnut.2021.810460
[10] UCHIDA M, KURUSHIMA H, ISHIHARA K, et al. Characterization of fermented seaweed sauce prepared from nori (Pyropia yezoensis)[J]. Journal of Bioscience and Bioengineering,2016,123(3):327−332.
[11] KUDA T, EDA M, KATAOKA M, et al. Anti-glycation properties of the aqueous extract solutions of dried algae products and effect of lactic acid fermentation on the properties[J]. Food Chemistry,2016,192:1109−1115. doi: 10.1016/j.foodchem.2015.07.073
[12] 李缓缓. 紫菜和螺旋藻发酵提取物的活性研究[D]. 厦门:集美大学, 2018. [LI H H. Study on the active of fermentation extracts of Porphyra and Spirulina[D]. Xiamen:Jimei University, 2018.] LI H H. Study on the active of fermentation extracts of Porphyra and Spirulina[D]. Xiamen: Jimei University, 2018.
[13] CHEN W P, HE Y, ZHOU Y X, et al. Edible filamentous fungi from the species Monascus:Early traditional fermentations, modern molecular biology, and future genomics[J]. Comprehensive Reviews in Food Science and Food Safety,2015,14(5):555−567. doi: 10.1111/1541-4337.12145
[14] HIROYUKI F, YUKI H, TOMOHIRO H, et al. A review of red yeast rice, a traditional fermented food in Japan and east Asia:Its characteristic ingredients and application in the maintenance and improvement of health in lipid metabolism and the circulatory system[J]. Molecules,2021,26(6):1619. doi: 10.3390/molecules26061619
[15] 杨树玲, 陈冬, 孔维宝, 等. 红曲霉发酵制品中的代谢产物及其生理活性研究进展[J]. 生物学通报,2019,54(9):1−5. [YANG S L, CHEN D, KONG W B, et al. Research advance on the metabolites and physiological activity of Monascus fermented products[J]. Bulletin of Biology,2019,54(9):1−5.] doi: 10.3969/j.issn.0006-3193.2019.09.001 YANG S L, CHEN D, KONG W B, et al. Research advance on the metabolites and physiological activity of Monascus fermented products[J]. Bulletin of Biology, 2019, 54(9): 1−5. doi: 10.3969/j.issn.0006-3193.2019.09.001
[16] 李沅达, 邓秀娟, 吴婷, 等. 红曲霉发酵食品研究现状与分析[J]. 食品安全质量检测学报,2022,13(3):688−696. [LI Y D, DENG X J, WU T, et al. Research status and analysis of Monascus fermented food[J]. Journal of Food Safety & Quality,2022,13(3):688−696.] doi: 10.3969/j.issn.2095-0381.2022.3.spaqzljcjs202203002 LI Y D, DENG X J, WU T, et al. Research status and analysis of Monascus fermented food[J]. Journal of Food Safety & Quality, 2022, 13(3): 688−696. doi: 10.3969/j.issn.2095-0381.2022.3.spaqzljcjs202203002
[17] 于配配, 方孝贤, 何鑫平, 等. 海藻植物发酵液饮料的研制[J]. 食品工业科技,2017,38(21):224−228,318. [YU P P, FANG X X, HE X P, et al. Development of fermented seaweed-plants beverage[J]. Science and Technology of Food Industry,2017,38(21):224−228,318.] YU P P, FANG X X, HE X P, et al. Development of fermented seaweed-plants beverage[J]. Science and Technology of Food Industry, 2017, 38(21): 224−228,318.
[18] YOICHIRO H, EMI Y, NORIKO T, et al. Liberation of eicosapentaenoic acid and degradation of the major cell wall polysaccharide porphyran by fermentation of nori, the dried thalli of Pyropia yezoensis, with koji[J]. Journal of Applied Phycology,2021,33(6):4105−4111. doi: 10.1007/s10811-021-02590-1
[19] 邵悦春, 付晓婷, 许加超, 等. 基于气相离子迁移谱的发酵海带风味分析[J]. 食品工业科技,2021,42(12):300−306. [SHAO Y C, FU X T, XU J C, et al. Flavor analysis of fermented Laminaria japonica based on gas chromatograph-ion mobility spectrometer (GC-IMS)[J]. Science and Technology of Food Industry,2021,42(12):300−306.] SHAO Y C, FU X T, XU J C, et al. Flavor analysis of fermented Laminaria japonica based on gas chromatograph-ion mobility spectrometer (GC-IMS)[J]. Science and Technology of Food Industry, 2021, 42(12): 300−306.
[20] THINZAR A, SEON-JAE K, JONG-BANG E. A hybrid RSM-ANN-GA approach on optimisation of extraction conditions for bioactive component-rich laver (Porphyra dentata) extract[J]. Food Chemistry,2022,366:130689. doi: 10.1016/j.foodchem.2021.130689
[21] EUN-SUN H, NHUAN D T. Effects of extraction and processing methods on antioxidant compound contents and radical scavenging activities of laver (Porphyra tenera)[J]. Preventive Nutrition and Food Science,2014,19(1):40−48. doi: 10.3746/pnf.2014.19.1.040
[22] GUO J B, LU A C, SUN Y N, et al. Purification and identification of antioxidant and angiotensin converting enzyme-inhibitory peptides from Guangdong glutinous rice wine[J]. LWT-Food Science and Technology,2022,169:113953. doi: 10.1016/j.lwt.2022.113953
[23] THINZAR A, JONG-BANG E. Production and characterization of a novel beverage from laver (Porphyra dentata) through fermentation with kombucha consortium[J]. Food Chemistry,2021,350:129274. doi: 10.1016/j.foodchem.2021.129274
[24] HE T, ZHANG X, ZHAO L, et al. Insoluble dietary fiber from wheat bran retards starch digestion by reducing the activity of alpha-amylase[J]. Food Chemistry,2023,426:136624. doi: 10.1016/j.foodchem.2023.136624
[25] YANG Y J, ZHANG P L, HUANG Z, et al. Phenolics from Sterculia nobilis Smith pericarp by-products delay carbohydrate digestion by uncompetitively inhibiting α-glucosidase and α-amylase[J]. LWT-Food Science and Technology,2023,173:114339. doi: 10.1016/j.lwt.2022.114339
[26] SOFIA A O, ODILA J P, CARLOS F, et al. Peptide-rich extracts from spent yeast waste streams as a source of bioactive compounds for the nutraceutical market[J]. Innovative Food Science and Emerging Technologies,2022,81:103148. doi: 10.1016/j.ifset.2022.103148
[27] SZUTOWSKA J. Functional properties of lactic acid bacteria in fermented fruit and vegetable juice:A systematic literature review[J]. European Food Research and Technology,2020,246(3):357−372. doi: 10.1007/s00217-019-03425-7
[28] ZHANG H F, LU Q, LIU R. Widely targeted metabolomics analysis reveals the effect of fermentation on the chemical composition of bee pollen[J]. Food Chemistry,2022,375:131908. doi: 10.1016/j.foodchem.2021.131908
[29] SHUMOY H, GABAZA M, VANDEVELDE J, et al. Soluble and bound phenolic contents and antioxidant capacity of tef injera as affected by traditional fermentation[J]. Journal of Food Composition and Analysis,2017,58:52−59. doi: 10.1016/j.jfca.2017.01.004
[30] THINZAR A, JONG B E. Impact of time and temperature on the physicochemical, microbiological, and nutraceutical properties of laver kombucha (Porphyra dentata) during fermentation[J]. LWT-Food Science and Technology,2022,154:112643. doi: 10.1016/j.lwt.2021.112643
[31] KULIGOWSKI M, PAWłOWSKA K, JASIŃSKA-KULIGOWSKA I, et al. Isoflavone composition, polyphenols content and antioxidative activity of soybean seeds during tempeh fermentation[J]. CyTA - Journal of Food,2017,15(1):27−33.
[32] 许亮, 师俊玲, 任健, 等. 枸杞果酒发酵过程中黄酮含量的变化[J]. 食品科学,2011,32(5):100−103. [XU L, SHI J L, REN J, et al. Change of flavonoid content in Chinese wolfberry wine during fermentation[J]. Food Science,2011,32(5):100−103.] XU L, SHI J L, REN J, et al. Change of flavonoid content in Chinese wolfberry wine during fermentation[J]. Food Science, 2011, 32(5): 100−103.
[33] 罗悦, 刘瑞山, 王志远, 等. 不同β-葡萄糖苷酶活性乳酸菌发酵豆乳特性分析[J]. 食品科学,2023,44(20):155−164. [LUO Y, LIU R S, WANG Z Y, et al. Characteristics of soymilk fermented by lactic acid bacteria with different β-glucosidase activities[J]. Food Science,2023,44(20):155−164.] doi: 10.7506/spkx1002-6630-20221108-079 LUO Y, LIU R S, WANG Z Y, et al. Characteristics of soymilk fermented by lactic acid bacteria with different β-glucosidase activities[J]. Food Science, 2023, 44(20): 155−164. doi: 10.7506/spkx1002-6630-20221108-079
[34] KWAW E, MA Y, TCHABO W, et al. Effect of lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J]. Food Chemistry,2018,250:148−154. doi: 10.1016/j.foodchem.2018.01.009
[35] 延莎, 邢洁雯, 王晓闻. 不同菌种发酵对藜麦蛋白质特性及脂质构成的影响[J]. 中国农业科学,2020,53(10):2045−2054. [YAN S, XING J W, WANG X W. Effects of different strain fermentation on protein hydrolysis and lipid profile of quinoa[J]. Scientia Agricultura Sinica,2020,53(10):2045−2054.] doi: 10.3864/j.issn.0578-1752.2020.10.011 YAN S, XING J W, WANG X W. Effects of different strain fermentation on protein hydrolysis and lipid profile of quinoa[J]. Scientia Agricultura Sinica, 2020, 53(10): 2045−2054. doi: 10.3864/j.issn.0578-1752.2020.10.011
[36] YUAN J, ZHANG H Y, ZENG C Z, et al. Impact of fermentation conditions on physicochemical properties, antioxidant activity, and sensory properties of apple-tomato pulp[J]. Molecules (Basel, Switzerland),2023,28(11):4363. doi: 10.3390/molecules28114363
[37] 袁鑫, 闫培生. 褐藻降血糖活性物质的研究进展[J]. 食品研究与开发,2021,42(4):215−219. [YUAN X, YAN P S. Research progress of brown algae hypoglycemic active substances[J]. Food Research and Development,2021,42(4):215−219.] doi: 10.12161/j.issn.1005-6521.2021.04.037 YUAN X, YAN P S. Research progress of brown algae hypoglycemic active substances[J]. Food Research and Development, 2021, 42(4): 215−219. doi: 10.12161/j.issn.1005-6521.2021.04.037
[38] 伊娟娟, 左丽丽, 王振宇. 植物多酚的分离纯化及抗氧化、降脂降糖功能研究[J]. 食品工业科技,2013,34(19):391−395,399. [YI J J, ZUO L L, WANG Z Y. Research of separation and purification of plant polyphenols and their antioxidant, lipid-lowering, hypoglycemic function[J]. Science and Technology of Food Industry,2013,34(19):391−395,399.] YI J J, ZUO L L, WANG Z Y. Research of separation and purification of plant polyphenols and their antioxidant, lipid-lowering, hypoglycemic function[J]. Science and Technology of Food Industry, 2013, 34(19): 391−395,399.
[39] 董玉婷, 蔡宏浩, 李志朋, 等. 乳杆菌发酵提高坛紫菜的抗氧化和抑制糖脂代谢关键酶活性[J]. 食品科学,2022,43(10):162−171. [DONG Y T, CAI H H, LI Z P, et al. Lactobacillus fermentation improves the antioxidant activity of Porphyra haitanensis and its inhibitory activity on key enzymes of glycolipid metabolism[J]. Food Science,2022,43(10):162−171.] doi: 10.7506/spkx1002-6630-20210405-047 DONG Y T, CAI H H, LI Z P, et al. Lactobacillus fermentation improves the antioxidant activity of Porphyra haitanensis and its inhibitory activity on key enzymes of glycolipid metabolism[J]. Food Science, 2022, 43(10): 162−171. doi: 10.7506/spkx1002-6630-20210405-047
[40] XIA G H, LI X H, ZHANG Z, et al. Effects of fermentation treatments on Polygonatum odoratum flavones’ antioxidant activities[J]. Saudi Journal of Biological Sciences,2021,28(9):5011−5016. doi: 10.1016/j.sjbs.2021.01.026
[41] HASSAN L, PEDRO F, ZLATINA G, et al. Unraveling the chemical composition, antioxidant, α-amylase and α-glucosidase inhibition of Moroccan propolis[J]. Food Bioscience,2021,42:101160. doi: 10.1016/j.fbio.2021.101160
[42] 朱运平, 任斐. 降血糖食品的研究进展[J]. 中国酿造,2022,41(9):1−7. [ZHU Y P, REN F. Research progress of hypoglycemic foods[J]. China Brewing,2022,41(9):1−7.] ZHU Y P, REN F. Research progress of hypoglycemic foods[J]. China Brewing, 2022, 41(9): 1−7.
[43] 王丹, 袁永俊, 谭青云, 等. 不同菌种发酵对铁皮石斛多糖及其生物活性的影响[J]. 中国调味品,2019,44(9):39−43. [WANG D, YUAN Y J, TAN Q Y, et al. Effects of different strains fermentation on polysaccharide and biological activity of Dendrobium candidum[J]. China Condiment,2019,44(9):39−43.] doi: 10.3969/j.issn.1000-9973.2019.09.008 WANG D, YUAN Y J, TAN Q Y, et al. Effects of different strains fermentation on polysaccharide and biological activity of Dendrobium candidum[J]. China Condiment, 2019, 44(9): 39−43. doi: 10.3969/j.issn.1000-9973.2019.09.008
[44] 王雪竹. 天然产物中降血糖功能因子研究进展[J]. 河南预防医学杂志,2018,29(4):241−243. [WANG X Z. Research progress on hypoglycemic function factors of natural product[J]. Modern Disease Control and Prevention,2018,29(4):241−243.] WANG X Z. Research progress on hypoglycemic function factors of natural product[J]. Modern Disease Control and Prevention, 2018, 29(4): 241−243.
[45] 安江, 刘敬科, 生庆海, 等. 乳酸菌发酵杂粮面包品质改善和降糖机理研究进展[J]. 食品工业科技,2022,43(24):1−10. [AN J, LIU J K, SHENG Q H, et al. Research progress on the quality improvement and hypoglycemic mechanism of multi-grain bread fermented by lactic acid bacteria[J]. Science and Technology of Food Industry,2022,43(24):1−10.] AN J, LIU J K, SHENG Q H, et al. Research progress on the quality improvement and hypoglycemic mechanism of multi-grain bread fermented by lactic acid bacteria[J]. Science and Technology of Food Industry, 2022, 43(24): 1−10.
[46] MORALES-CAMACHO J I, ESPINOSA-HERNÁNDEZ E, ROSAS-CÁRDENAS F F, et al. Insertions of antihypertensive peptides and their applications in pharmacy and functional foods[J]. Applied Microbiology and Biotechnology,2019,103(6):2493−2505. doi: 10.1007/s00253-019-09633-1
[47] 胡学佳, 戴致远, 张晓頔, 等. 海洋源降血压肽研究进展[J]. 中国食品学报,2022,22(8):353−363. [HU X J, DAI Z Y, ZHANG X D, et al. Research progress on antihypertensive peptides derived marine sources[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(8):353−363.] HU X J, DAI Z Y, ZHANG X D, et al. Research progress on antihypertensive peptides derived marine sources[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(8): 353−363.
[48] 高枫宇, 吴晗琪, 高秀君, 等. 大型海藻的降血压活性研究进展[J]. 食品研究与开发,2019,40(2):210−217. [GAO F Y, WU H Q, GAO X J, et al. Research progress on hypotensive activity of macroalgae[J]. Food Research and Development,2019,40(2):210−217.] doi: 10.3969/j.issn.1005-6521.2019.02.038 GAO F Y, WU H Q, GAO X J, et al. Research progress on hypotensive activity of macroalgae[J]. Food Research and Development, 2019, 40(2): 210−217. doi: 10.3969/j.issn.1005-6521.2019.02.038





 下载:
下载:
 下载:
下载:



