Effects of Acid and Enzymatic Extraction on the Structure and Physicochemical Characterization of Collagen from Chinemys reevesii Skin
-
摘要: 本研究以中华草龟皮胶原蛋白为研究对象,探究不同提取方法对其结构和理化特性的影响。分别采用酸法和酶法对中华草龟皮胶原蛋白进行提取,并运用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、高效液相色谱法、圆二色光谱法、差式扫描量热、扫描电镜、溶解性、感官评价及色度等分析酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC)的组成、结构以及理化特性。结果表明,ASC和PSC的提取率分别为24.50%±0.44%和51.68%±0.06%,酶法提取胶原蛋白的提取率显著高于酸法(P<0.05)。ASC和PSC主要由α1和α2链组成,均为I型胶原蛋白。ASC和PSC中甘氨酸的含量最多,分别是370.17和387.75个残基/1000个氨基酸残基。圆二色光谱表明这两种胶原蛋白二级结构相似,均具有胶原蛋白的特征峰。ASC和PSC的变性温度分别为27.21±0.28 ℃和28.37±0.23 ℃。扫描电镜结果表明,ASC具有无序的纤维结构,而PSC的微观结构更为规则。ASC的溶解度整体略低于PSC,PSC的感官品质和色度优于ASC。Abstract: This study investigated the effects of different extraction methods on the structure and physicochemical characterization of collagen extracted from the skin of Chinemys reevesii. Collagen from Chinemys reevesii skin was obtained using acid and enzymatic extraction methods. The composition, structure, and physicochemical characteristics of acid-soluble collagen (ASC) and enzyme-soluble collagen (PSC) were determined using sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), high-performance liquid chromatography (HPLC), circular dichroism spectrometry (CD), differential scanning calorimetry (DSC), scanning electron microscopy (SEM), solubility, sensory evaluation, and chroma. ASC and PSC extraction yields were 24.50%±0.44% and 51.68%±0.06% respectively, with PSC demonstrating significantly higher extraction yield than ASC (P<0.05). Both ASC and PSC comprised α1 and α2 chains and exhibited a distribution pattern typical of type Ⅰ collagen. The content of glycine in ASC and PSC was the highest, 370.17 and 387.75 residues/1000 amino acid residues, respectively. ASC and PSC exhibited similar secondary structures, according to their comparable characteristic absorption peaks. The thermal denaturation temperatures of ASC and PSC were 27.21±0.28 ℃ and 28.37±0.23 ℃, respectively. SEM images indicated a disordered fiber state in the microstructure of ASC, whereas the microstructure of PSC exhibited a more uniform pattern. The solubility of ASC was slightly lower than that of PSC, and PSC had better sensory evaluation and chroma than ASC.
-
Keywords:
- Chinemys reevesii skin /
- collagen /
- acid method /
- enzyme method /
- structural /
- physicochemical characteristics
-
胶原蛋白是动物结缔组织中的主要成分,占蛋白质总量的25%~30%,有些动物皮中胶原蛋白能够达到80%[1]。胶原蛋白具有保水、乳化、生物相容性,低抗原性,抗氧化等特性[2],因而被广泛用于食品、化妆品、生物医药领域。动物皮是提取胶原蛋白的主要原料,主要来源于猪皮、牛皮等陆地哺乳动物。然而,陆生动物传染性疾病的爆发导致了陆源动物胶原蛋白衍生产品受到限制[2]。因此,水产胶原蛋白逐渐成为研究热点。中华草龟,又名乌龟,是一种淡水生动物,广泛分布于全国各地。中华草龟具有重要的营养和药用价值[3],龟板是制作龟甲胶的主要原料。草龟皮是制备龟甲胶的副产品,含有丰富的胶原蛋白[4],直接丢弃会造成生物资源的浪费,同时也会污染环境。
胶原蛋白的提取方法主要有热水法、碱法、酸法以及酶法。热水法提取的胶原蛋白部分结构被破坏,从而影响其功能特性。碱法对胶原蛋白的结构有很大的破坏,并且产量较低且污染风险较大[5]。酸法制备的胶原蛋白理化性质稳定,提取率较低。酶法提取胶原蛋白效率高,且能降低胶原的抗原性、对环境污染较小[6]。黄文[7]采用酶法提取了龟皮和猪皮的胶原蛋白,只对两者的氨基酸组成做了对比,并未对龟皮胶原蛋白的结构和理化特性进行研究。目前,不同提取方法对中华草龟皮胶原蛋白结构和理化特性影响的研究较少。
本研究采用酸法和酶法对中华草龟皮胶原蛋白进行提取,确定酸溶性胶原蛋白(acid-soluble collagen,ASC)和酶溶性胶原蛋白(pepsin-soluble collagen,PSC)的类型,并对其结构和理化特性进行分析,以期为中华草龟皮胶原蛋白高值化功能产品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
中华草龟 扬州茂达生态水产养殖有限公司,将中华草龟进行龟甲、龟皮、龟肉的分离,将龟皮剪碎,冷冻备用;硫酸、硫酸铜、碳酸钠、氯化钠、冰乙酸、甲醇 分析纯,国药集团化学试剂有限公司;十二烷基硫酸钠、丙烯酰胺、过硫酸铵 北京金泰宏达生物科技有限公司;考马斯亮蓝、溴酚蓝、甘氨酸 上海Sangon Biotech有限公司;L-羟脯氨酸标准品、氯胺-T 上海源叶生物科技有限公司;胃蛋白酶(3000 U/g) 北京Solarbio公司。
KDN-4III全自动凯氏定氮仪 上海纤检仪器有限公司;ALLEGRAX-30R台式高速冷冻离心机 美国贝克曼库尔特有限公司;DS-200色度仪 彩谱科技(浙江)有限公司;JASCO-810 圆二色谱仪 日本JASCO公司;DSC 8500 差示扫描量热仪 美国PerkinElmer公司;GeminiSEM 300扫描电镜 德国Carl Zeiss公司;Ag1100安捷伦液相色谱仪 美国安捷伦公司。
1.2 实验方法
1.2.1 草龟皮预处理
将龟皮在室温条件下自然解冻后,剪碎,去除脂肪和杂蛋白[8]。
1.2.2 酸溶性胶原蛋白(ASC)的制备
称取预处理后的草龟皮1.5 g,加30 mL 0.5 mol/L的冰乙酸打浆。于4 ℃下静置24 h,每2 h搅拌一次,9000 r/min离心20 min,过滤,取上清液[9]。在沉淀中再次加入冰乙酸溶液,重复上述步骤2次,混合所有上清液。盐析(0.9 mol/L NaCl)24 h后,以8000 r/min离心15 min,将胶原蛋白沉淀溶于0.5 mol/L的冰乙酸溶液中,再以0.1 mol/L冰乙酸溶液为透析液,于透析袋(8000~14000 kDa)中透析24 h,用去离子水透析48 h,透析至滤液中无氯离子且透析液为中性,冷冻干燥得到酸溶性胶原蛋白。
1.2.3 酶溶性胶原蛋白(PSC)的制备
称取预处理后的草龟皮1.5 g,加30 mL 0.5 mol/L的冰乙酸打浆。调pH至胃蛋白酶最适值,在混合液中加入1%的胃蛋白酶,置于4 ℃下,酶解反应24 h,经离心,过滤,取上清液[10]。将沉淀溶入冰乙酸溶液中并加入1%胃蛋白酶,重复上述步骤2次,混合所有上清液。盐析(0.9 mol/L)24 h后,离心,将胶原蛋白沉淀溶于0.5 mol/L的冰乙酸溶液中,再以0.1 mol/L冰乙酸溶液为透析液,于透析袋中透析24 h,用去离子水透析48 h,透析至滤液中无氯离子且透析液为中性,冷冻干燥得到酶溶性胶原蛋白。
1.2.4 羟脯氨酸含量测定
参照GB/T 9695.23-2008[11],测定样品中羟脯氨酸含量。羟脯氨酸标准曲线为y=0.0324x+0.0703,决定系数R2=0.9996。
1.2.5 胶原蛋白提取率的测定
羟脯氨酸是胶原蛋白的特有氨基酸,可通过测定其含量来计算胶原蛋白的提取率。水生动物的换算系数为11.1[12],计算公式如下:
胶原蛋白含量(mg)=Mf×11.1 (1) 提取率(%)=MyMP×100 (2) 式中:Mf表示羟脯氨酸含量,mg;My表示提取液中胶原蛋白含量,mg;Mp表示龟皮中胶原蛋白含量,mg。
1.2.6 SDS-PAGE电泳分析
参照Anguchamy等[13]的方法稍作修改,在2 mg/mL胶原蛋白溶液中加入上样缓冲液。将混合液煮沸5 min后冷却,8000 r/min离心10 min,取8 μL上样。以8%分离胶和5%浓缩胶制得电泳凝胶。在80 V下电泳保持20 min,120 V下保持90 min。用用染色液染色30 min,再脱色2~3次。
1.2.7 氨基酸成分分析
根据Tamilmozhi等[14]的方法,采用OPAFMOC柱前衍生法进行分析。取100 mg胶原蛋白冻干样品,缓慢加入6 mol/L盐酸溶液,于110 ℃水解24 h。将样品转移至50 mL容量瓶中,加入NaOH中和酸水解,用去离子水定容;过滤,以10000 r/min离心10 min;取上清液0.5 mL于样品瓶中上机测定。
1.2.8 圆二色谱分析(CD)
将冻干的胶原蛋白粉末配成0.1 mg/mL胶原蛋白溶液。采用石英狭缝比色皿(0.1 cm),在温度为10 ℃、扫描波长为190~250 nm,持续通入氮气的情况下进行圆二光谱扫描,扫描速率为100 nm/min。平行测样三次。
1.2.9 扫描电子显微镜分析(SEM)
根据汪海波等[15]的方法,将冻干的胶原蛋白样品放置在标准SEM样品台上,并离子喷涂金,以5 kV电压观察蛋白微观结构,比较不同提取方法下胶原蛋白的结构特征与差异。
1.2.10 热稳定性分析
参考Liu等[16]的方法,取5 mg胶原蛋白粉末置于铝制坩埚上,以空的铝制坩埚作为对照。使用差示扫描量热仪对其热稳定性温度进行测定,温度扫描范围为10~90 ℃,升温速率为20 ℃/min,样品室氮气流速20 mL/min。
1.2.11 溶解性分析
1.2.11.1 NaCl浓度对胶原蛋白溶解性的影响
称取胶原蛋白冻干粉于离心管中,加入0.5 mol/L的冰乙酸溶液,配制成浓度为0.5 mg/mL的胶原蛋白溶液,然后向胶原蛋白溶液中加入NaCl使其浓度分别为0~9%。置于摇床中,转速200 r/min,振荡30 min,然后在10000 r/min条件下离心20 min,采用双缩脲法测定上清液中蛋白质的含量,相对溶解度由以下公式计算:
相对溶解度(%)=W1W2×100 (3) 式中:W1为上清液蛋白质含量,g;W2为胶原蛋白量,g。
1.2.11.2 pH对胶原蛋白溶解性的影响
参考仇雷雷等[17]的方法,将胶原蛋白冻干粉配制成浓度为0.5 mg/mL的胶原蛋白溶液,将胶原蛋白溶液pH分别调为2、4、6、8、10。蒸馏水定容至7 mL。置于摇床中,转速200 r/min,振荡30 min,在10000 r/min条件下离心20 min,测定上清液中蛋白质的含量,相对溶解性按照公式(3)计算。
1.2.12 感官评价
根据国家质量检测标准QB 2732-2005[18],从色泽、气味、外观形态和杂质等方面对不同方法提取的胶原蛋白感官品质做出分析。
1.2.13 胶原蛋白色度的测定
取适量冻干胶原蛋白,用色度仪测定其L*、a*、b*值。
1.3 数据处理
采用Excel、Origin 2021、SPSS 26、GraphPad Prism 8软件对数据进行处理和作图,每次实验均重复3次。采用单因素方差分析,P<0.05表示显著性差异。
2. 结果与分析
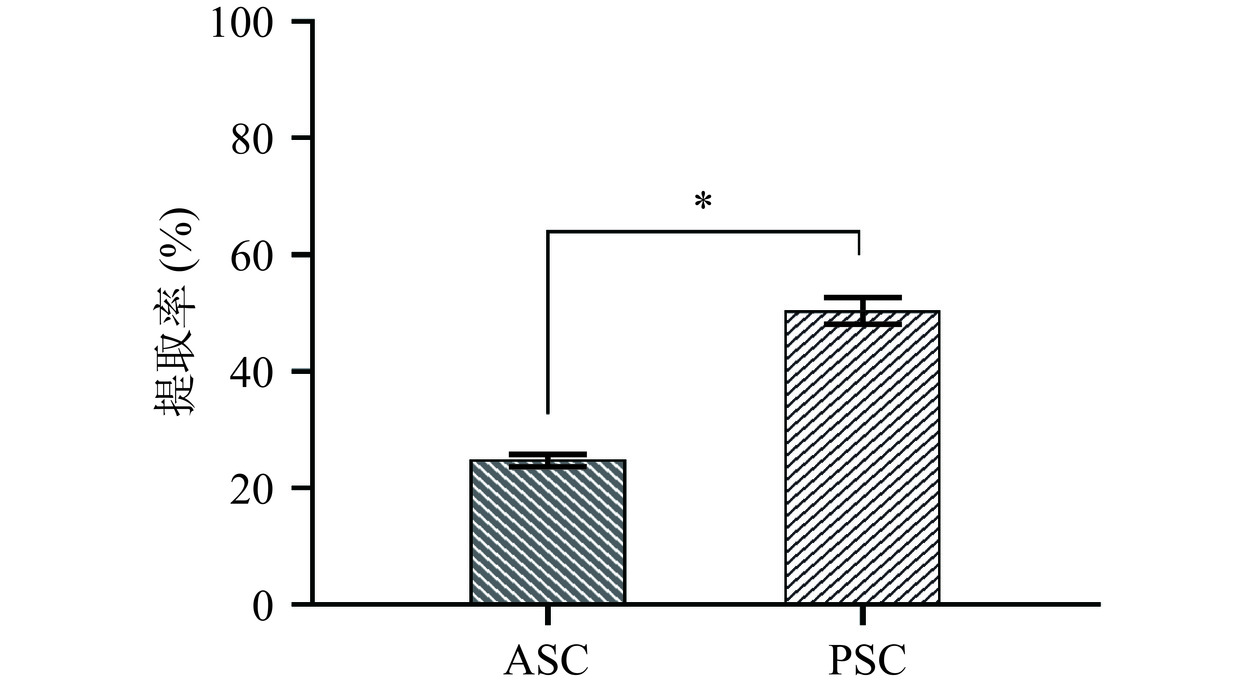
2.1 不同提取方法对胶原蛋白提取率的影响
如图1所示,通过测定羟脯氨酸含量计算出 ASC和 PSC 的提取率分别为 24.50%±0.44% 和 51.68%±0.06%。在胶原蛋白末端肽区的醛基可与赖氨酸、羟脯氨酸通过共价键形成交联[19],分子间也可能存在大量的交联,导致胶原蛋白在酸中的溶解度较低,酸法提取胶原蛋白的提取率较低。采用酶法提取胶原蛋白,随着胃蛋白酶有限的酶解,胶原蛋白末端区域的交联被裂解,增加部分裂解的胶原蛋白的产量[20]。Tamilmozhi等[14]研究的旗鱼皮的PSC提取率是ASC的3倍,表明酶法可以显著提高胶原蛋白的提取率。本实验研究与上述结果一致,PSC的提取率显著高于ASC(P<0.05)。
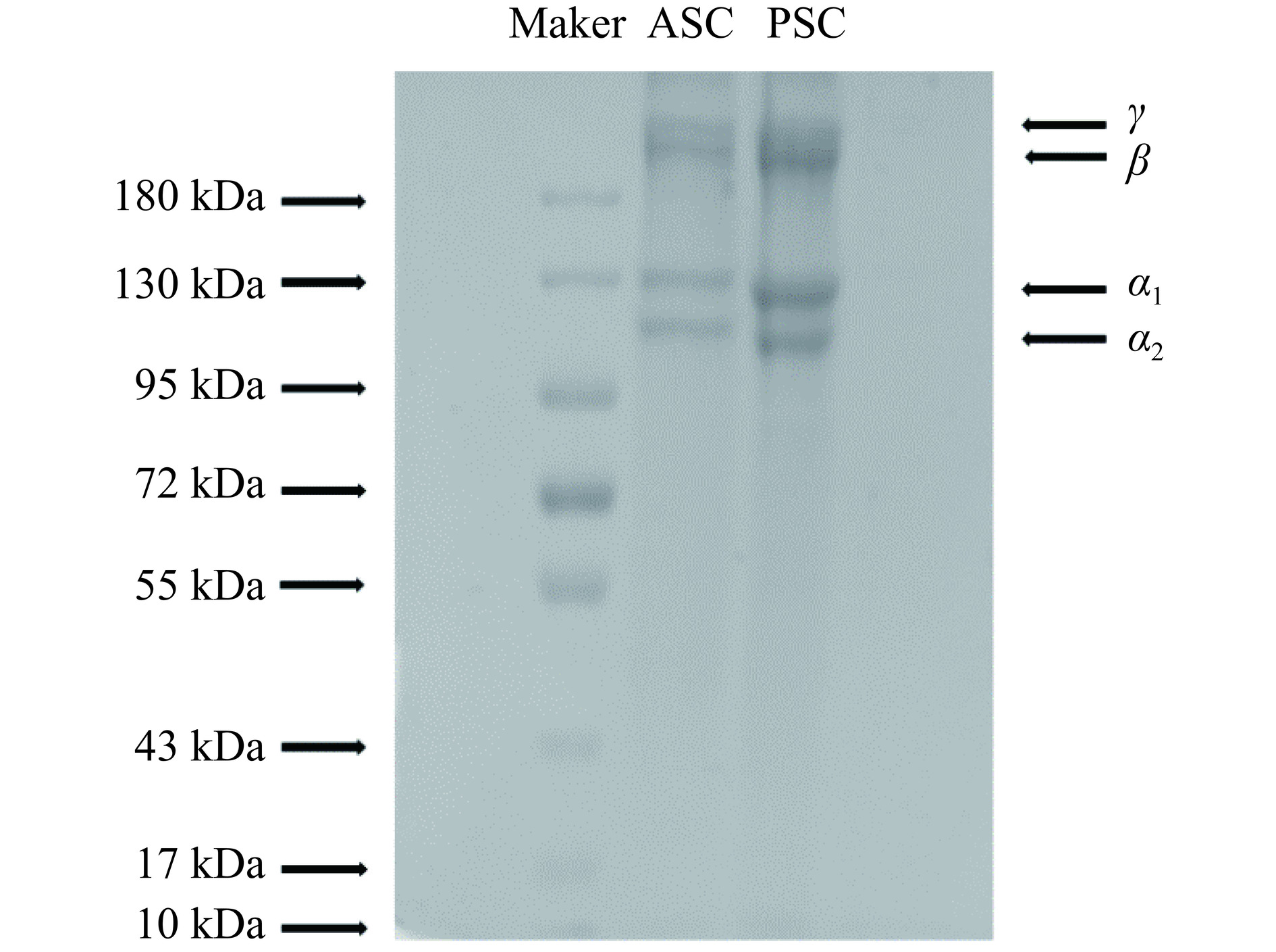
2.2 SDS-PAGE凝胶电泳分析
不同提取方法提取的胶原蛋白SDS-PAGE图谱如图2所示,ASC和PSC的SDS-PAGE蛋白模式相似,在电泳图谱上,可以明显观察到β、γ、α1和α2组分,α1的分子量约为130 kDa,α2的分子量约为110 kDa,符合I型胶原蛋白的结构特征,与其它水生类的I型胶原蛋白结构相似,如鲟鱼皮[21]、甲鱼裙边[22]等。ASC和PSC都含有属于β-链、γ-链的高分子量带,表明胶原蛋白分子存在共价交联,在α2链下面没有明显的条带,表明龟皮胶原蛋白几乎没有降解为小分子多肽,在提取的过程中PSC的三螺旋结构没有被胃蛋白酶破坏。ASC的条带细、颜色浅,而PSC的条带颜色较深,这是由于胃蛋白酶可能切断了胶原蛋白的部分共价交联,促使PSC有更好的溶解性,易与SDS结合。
2.3 氨基酸组成分析
由表1可知,ASC和PSC均富含Gly、Ala、Glu和Pro,其中,ASC和PSC中Gly的含量最多,分别是370.17和387.75,与其他来源的胶原蛋白相似[23],大约每三个氨基酸残基中就包含一个Gly,这是形成三螺旋结构的必要条件[24]。ASC和PSC中的必需氨基酸含量占总氨基酸含量的比例分别为14.47%和13.27%;Pro含量分别是92.36和92.88,Pro是胶原蛋白的特征性氨基酸,其含量越高,胶原蛋白热稳定性越好[25]。
表 1 ASC和PSC的氨基酸组成(残基数/1000个氨基酸总残基)Table 1. Amino acid compositions of ASC and PSC (residues/1000 residues)氨基酸种类 ASC PSC 天冬氨酸(Asp) 53.45±0.19a 52.19±0.12b 谷氨酸(Glu)* 93.84±0.18a 92.25±0.07b 丝氨酸(Ser) 51.30±0.04a 49.86±0.22b 组氨酸(His) 9.35±0.04a 8.05±0.03b 甘氨酸(Gly)#* 370.17±0.60b 387.75±0.93a 苏氨酸(Thr) 25.85±0.04a 24.64±0.00b 精氨酸(Arg)* 59.62±0.15b 60.44±0.05a 丙氨酸(Ala)# 118.16±0.11b 121.75±0.10a 酪氨酸(Tyr) 5.81±0.00a 2.85±0.02b 半胱氨酸(Cys-s) 0.56±0.47a 0.08±0.04a 缬氨酸(Val)#* 21.64±0.03a 19.83±0.06b 蛋氨酸(Met)# 0.69±0.15a 0.38±0.05a 苯丙氨酸(Phe)# 16.13±0.03a 14.43±0.02b 异亮氨酸(Ile)#* 15.60±0.03a 13.86±0.01b 亮氨酸(Leu)#* 30.99±0.05a 27.12±0.01b 赖氨酸(Lys) 33.82±0.18a 32.43±0.15b 脯氨酸(Pro)#* 92.36±0.94a 92.88±1.16b 注:#为疏水性氨基酸;*为功能性氨基酸;同行不同字母表示差异具有显著性,P<0.05。 ASC和PSC中疏水性氨基酸含量占总氨基酸含量的66.57%和67.80%,PSC的疏水性氨基酸含量显著高于ASC(P<0.05),疏水性氨基酸含量越高抗氧化能力越强[26],说明PSC是制备抗氧化肽较为理想的原料之一,并且为制备其他功能肽提供了更多选择。功能性氨基酸在物质代谢和免疫功能调控中起到重要作用,ASC和PSC的功能性氨基酸含量分别为68.32%和69.41%,二者的差异具有显著性(P<0.05),且高于陆生动物酸溶液胶原和酶溶性胶原蛋白[27],说明酶法提取的中华草龟皮胶原蛋白具有较好的生物活性。
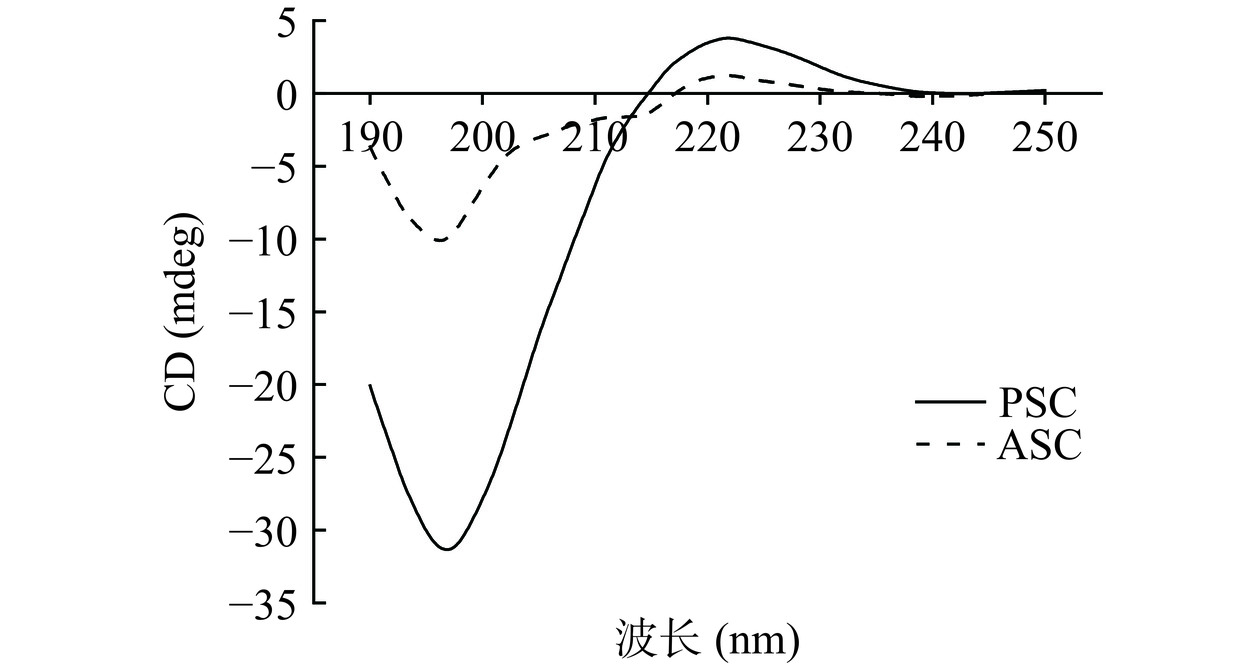
2.4 圆二色光谱分析(CD)
胶原蛋白一般在221 nm处有正吸收峰,在197 nm处有负吸收峰,如果胶原蛋白发生变性,其在221 nm处的正吸收峰会完全消失[28]。图3为酸法和酶法提取的龟皮胶原蛋白的圆二色光谱图,PSC和ASC均在221 nm有一个正吸收峰,在196 nm有一个负吸收峰,与其他I型胶原蛋白的圆二色光谱图类似,显示出Cotton效应,符合蛋白质的三螺旋构象特征。Feng等[29]报道,圆二色光谱的正负峰强度比值的绝对值称为RPN,RPN值小于1即可判断其存在三螺旋结构,且RPN值越大结构越稳定。PSC的RPN值为0.13,ASC的RPN值为0.12。两种胶原蛋白二级结构百分比如表2所示,PSC的β-折叠含量显著高于ASC(P<0.05),说明酶法提取的胶原蛋白二级结构稳定性高于酸法提取的胶原蛋白。综上,两种方法都能保持胶原蛋白三螺旋结构的完整性,而PSC的结构更稳定。
表 2 不同方法提取的胶原蛋白的二级结构含量Table 2. Secondary structure content of collagen prepared by different methods样品 α-螺旋(%) β-折叠(%) β-转角(%) 无规则卷曲(%) ASC 0.63±0.01 50.13±0.01b 3.09±0.01 46.14±0.01a PSC − 78.87±0.03a − 21.13±0.03b 注:同一列不同小写字母表示差异具有显著性,P<0.05。 2.5 扫描电子显微镜分析
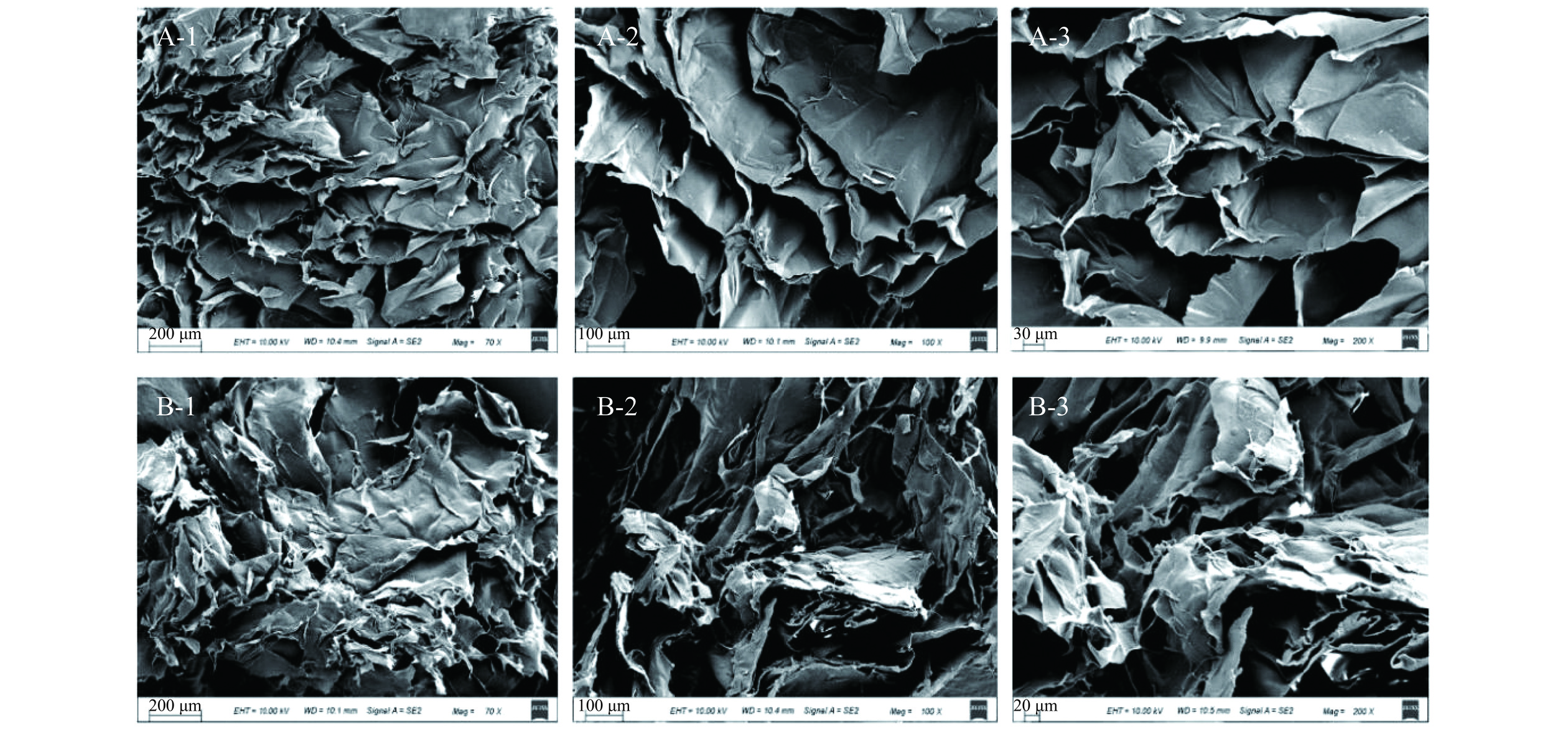
如图4A、4B所示,两种蛋白质的微观结构存在明显差异。ASC表现为致密、不均匀、多层的聚集体,具有微小的孔隙,孔隙间隔不规则。PSC是一种更疏松、多孔、海绵状的结构,孔径更大,可能是由于蛋白酶的作用使蛋白质之间的部分氢键发生断裂,使得蛋白质内部基团暴露增加,进而可以提高PSC的生物活性。ASC和PSC的纤维结构与Abdollahi等[30]研究鲢鱼皮胶原蛋白的扫描电镜结果相一致。
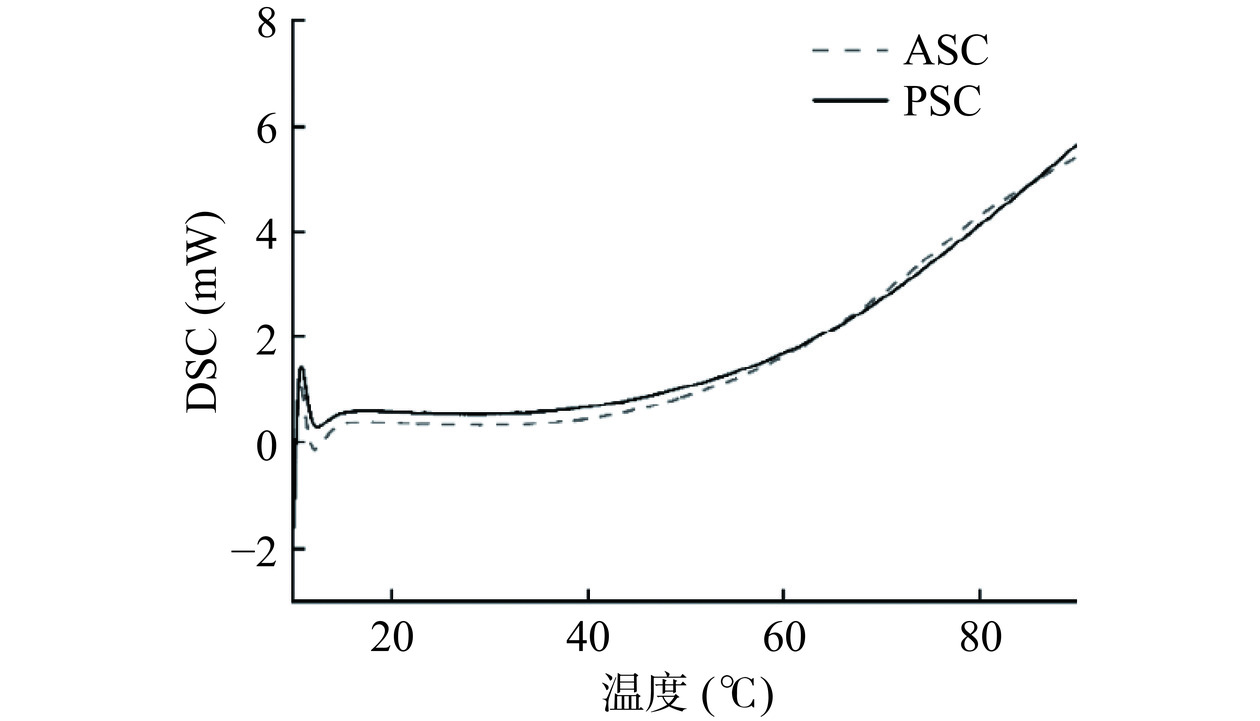
2.6 热稳定性分析
图5为本实验提取得到的ASC和PSC的热性能曲线,两种胶原蛋白的热性能曲线趋势一致。ASC的热变性温度为27.21±0.28 ℃,低于PSC的28.37±0.23 ℃。结果表明,PSC热稳定性高于ASC,这可能是酸法提取减少了胶原蛋白的α1亚基的表达,使胶原蛋白的总体热稳定性改变。从电泳图谱可以看出,PSC的α1亚基含量比ASC高。Hill等[31]也指出α1链有很好的重折叠能力,能使三螺旋结构更加紧密,增加胶原蛋白的结构稳定性。另外,从胶原蛋白二级结构成分占比可以看出,PSC的β-折叠含量显著高于ASC,说明PSC的稳定性更好。从中华草龟皮提取的胶原蛋白与河豚(28 ℃)[32]、草鱼(24.6 ℃)[20]、黑鱼(25.6 ℃)[33]等其他水产类来源的胶原蛋白的热稳定性相似。一般来说,水产胶原蛋白的热变性温度低于陆生动物胶原蛋白,如羊骨(44.9 ℃)[34]、驼掌(57.6 ℃)[35]。胶原蛋白的热稳定性与其亚胺酸含量有关,亚胺酸含量越高,其热稳定性越好。本实验制备的中华草龟皮ASC和PSC的热稳定性正符合这一规律,与上述氨基酸分析结果一致。
2.7 溶解性分析
2.7.1 NaCl浓度对胶原蛋白溶解性的影响
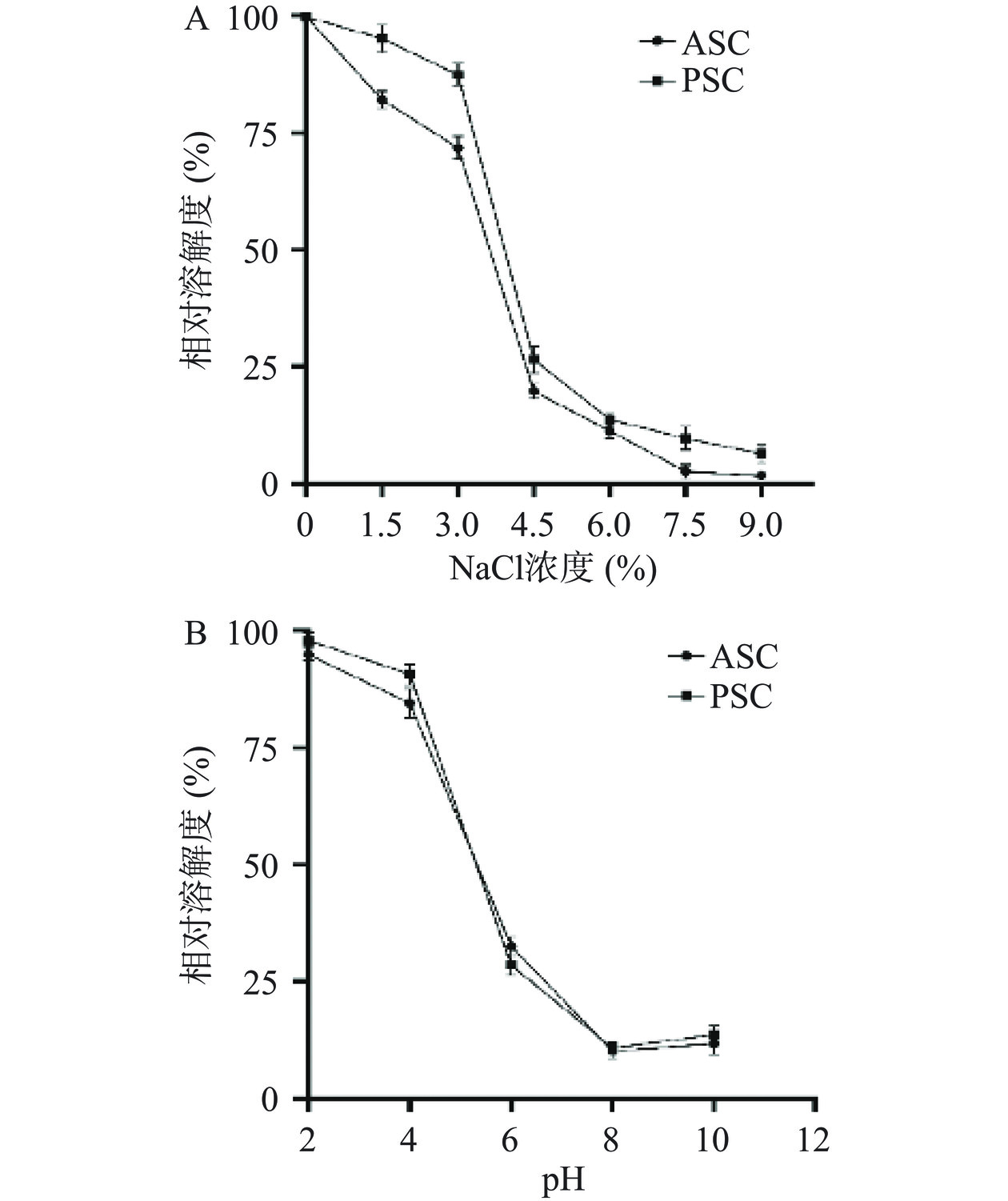
图6A表明NaCl浓度对ASC和PSC相对溶解度的影响。由图可知,ASC和PSC的溶解度模式相似,当NaCl浓度为0~3%时,ASC和PSC相对溶解度下降较缓慢,可能是由于钠离子与胶原蛋白结合使胶原蛋白的结构相对稳定,不易析出。当NaCl浓度为3%~4.5%时,ASC和PSC的溶解度急剧下降,此时盐析效应最强,因为NaCl浓度较高时,极性较强的盐离子夺走了与胶原蛋白结合的水分子,破坏了其周围的水化膜[36],增强了胶原蛋白分子的疏水相互作用,导致胶原蛋白析出,溶解度下降。当NaCl浓度为4.5%~9%时,溶解度下降缓慢。ASC的溶解度整体略低于PSC,可能是胃蛋白酶使PSC表面暴露了更多的亲水基团,有利于结合水分子,使其具有良好溶解性。
2.7.2 pH对胶原蛋白相对溶解度的影响
从中华草龟皮中提取的ASC和PSC的相对溶解度与pH的关系见图6B。结果表明,ASC和PSC在pH2时相对溶解度最高,在pH范围在2~4较容易溶解,当pH大于4时相对溶解度急剧下降。当pH为8时,ASC和PSC的相对溶解度最低。当pH大于8时,胶原蛋白相对溶解度呈轻微上升趋势。胶原蛋白的溶解度与pH的变化密切相关,尤其是在其等电点附近,溶解度最低。偏离等电点的酸碱条件下,胶原蛋白的溶解度增高[37]。在本实验中ASC和PSC的pI约为8,这与之前的报道一致,即胶原蛋白的pI在6~9之间变化[38]。
2.8 不同提取方法对胶原蛋白感官品质的影响
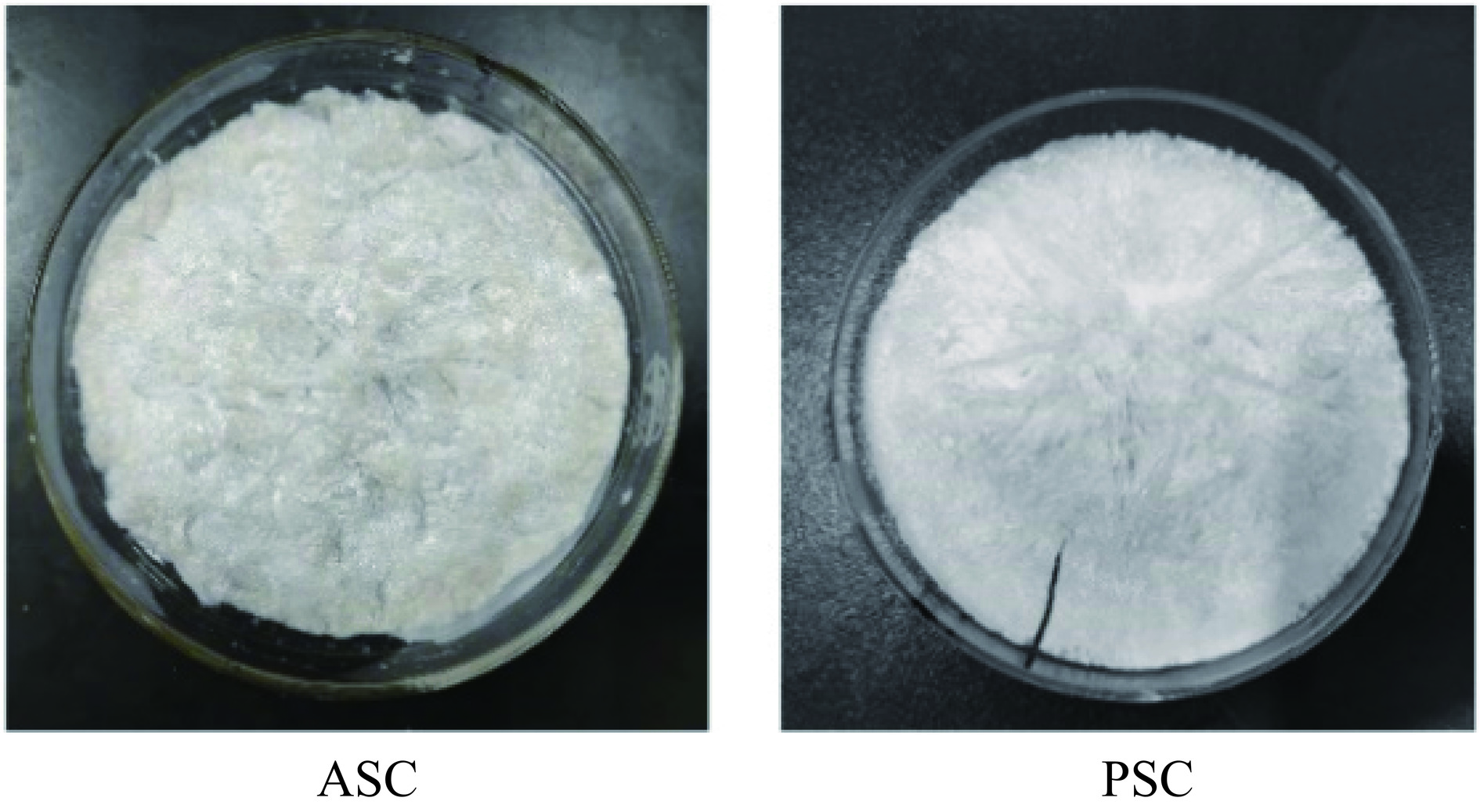
不同方法提取后冻干所得龟皮胶原蛋白如图7所示,PSC 和 ASC 在色泽、气味、外观形态和杂质方面差异显著,两种胶原蛋白的感官评价如表3所示,PSC 呈乳白色,纤维状海绵结构松散,没有异味,而ASC颜色偏黄灰,纤维状海绵结构较粗糙,稍有腥味,二者均无肉眼可见的杂质。
表 3 不同提取方法对胶原蛋白感官品质的影响Table 3. Effects of different extraction methods on sensory quality of collagen指标 ASC PSC 色泽 黄灰色,较不均匀 均匀一致的乳白色 气味 有较淡的腥味 无异味 外观形态 纤维较粗糙,不均匀,
有明显结块疏松海绵状,细腻,均匀,
无结块杂质 稍有杂质 无肉眼可见的杂质 2.9 不同提取方法对胶原蛋白色度的影响
不同提取方法对胶原蛋白色度的影响如表4所示,PSC的L*显著高于ASC(P<0.05),达到86.34,ASC的L*为74.63。两种胶原蛋白a*(红度值)无显著性差异(P>0.05)。ASC的b*(黄度值)略高于PSC,可能是酸法提取过程中生成游离氨基酸,与龟皮中的羰基化合物发生非酶褐变反应,导致其黄度值增加,亮度降低[39]。结果表明,酶法提取的胶原蛋白亮度值较好。
表 4 不同提取方法对胶原蛋白色度的影响Table 4. Effect of different extracting methods on the color of collagen样品 L* a* b* ASC 74.63±0.87b 1.45±0.38a 4.22±1.00a PSC 86.34±0.59a 0.89±0.06a 3.60±0.28a 注:L*表示亮度值,a*表示红度值,b*表示黄度值;同一列不同字母表示差异具有显著性,P<0.05。 3. 结论
本研究采用酸法和酶法从中华草龟皮中提取胶原蛋白,并对其结构和理化性质进行了分析。酶法提取率高于酸法提取率,两种方法提取的胶原蛋白结构均保留完整,且胃蛋白酶的有限消化没有破坏胶原的三螺旋结构。PSC与ASC相比,含有更多的疏水性氨基酸以及功能性氨基酸,其热稳定性更高,具有较好的溶解性和感官接收性,且PSC的色度优于ASC,这表明PSC在食品工业的应用前景广泛。此外,PSC微观结构较为规则,孔隙较大,呈现疏松的海绵状结构,可被开发为新型止血海绵。而ASC的微观结构由不规则的致密片状相互堆叠,在生物支架方面具有良好的应用潜力。综上,酸法和酶法提取的胶原蛋白特性存在差异,可根据产品的需求选择特定的提取方法。
-
表 1 ASC和PSC的氨基酸组成(残基数/1000个氨基酸总残基)
Table 1 Amino acid compositions of ASC and PSC (residues/1000 residues)
氨基酸种类 ASC PSC 天冬氨酸(Asp) 53.45±0.19a 52.19±0.12b 谷氨酸(Glu)* 93.84±0.18a 92.25±0.07b 丝氨酸(Ser) 51.30±0.04a 49.86±0.22b 组氨酸(His) 9.35±0.04a 8.05±0.03b 甘氨酸(Gly)#* 370.17±0.60b 387.75±0.93a 苏氨酸(Thr) 25.85±0.04a 24.64±0.00b 精氨酸(Arg)* 59.62±0.15b 60.44±0.05a 丙氨酸(Ala)# 118.16±0.11b 121.75±0.10a 酪氨酸(Tyr) 5.81±0.00a 2.85±0.02b 半胱氨酸(Cys-s) 0.56±0.47a 0.08±0.04a 缬氨酸(Val)#* 21.64±0.03a 19.83±0.06b 蛋氨酸(Met)# 0.69±0.15a 0.38±0.05a 苯丙氨酸(Phe)# 16.13±0.03a 14.43±0.02b 异亮氨酸(Ile)#* 15.60±0.03a 13.86±0.01b 亮氨酸(Leu)#* 30.99±0.05a 27.12±0.01b 赖氨酸(Lys) 33.82±0.18a 32.43±0.15b 脯氨酸(Pro)#* 92.36±0.94a 92.88±1.16b 注:#为疏水性氨基酸;*为功能性氨基酸;同行不同字母表示差异具有显著性,P<0.05。 表 2 不同方法提取的胶原蛋白的二级结构含量
Table 2 Secondary structure content of collagen prepared by different methods
样品 α-螺旋(%) β-折叠(%) β-转角(%) 无规则卷曲(%) ASC 0.63±0.01 50.13±0.01b 3.09±0.01 46.14±0.01a PSC − 78.87±0.03a − 21.13±0.03b 注:同一列不同小写字母表示差异具有显著性,P<0.05。 表 3 不同提取方法对胶原蛋白感官品质的影响
Table 3 Effects of different extraction methods on sensory quality of collagen
指标 ASC PSC 色泽 黄灰色,较不均匀 均匀一致的乳白色 气味 有较淡的腥味 无异味 外观形态 纤维较粗糙,不均匀,
有明显结块疏松海绵状,细腻,均匀,
无结块杂质 稍有杂质 无肉眼可见的杂质 表 4 不同提取方法对胶原蛋白色度的影响
Table 4 Effect of different extracting methods on the color of collagen
样品 L* a* b* ASC 74.63±0.87b 1.45±0.38a 4.22±1.00a PSC 86.34±0.59a 0.89±0.06a 3.60±0.28a 注:L*表示亮度值,a*表示红度值,b*表示黄度值;同一列不同字母表示差异具有显著性,P<0.05。 -
[1] HULMES D J. Building collagen molecules, fibrils, and suprafibrillar structures[J]. Journal of Structural Biology,2002,137(1−2):2−10. doi: 10.1006/jsbi.2002.4450
[2] ABRAHAM L C, ZUENA E, PEREZ-RAMIREZ B, et al. Guide to collagen characterization for biomaterial studies[J]. Journal of Biomedical Materials Research Part B,2008,87(1):264−285.
[3] 王福田, 李正荣, 赖年悦, 等. 中华草龟龟肠和龟胃的营养品质分析[J]. 肉类工业,2020(4):20−25. [WANG F T, LI Z R, LAI N Y, et al. Nutritional quality analysis of tortoise intestine and stomach of Chinese grass tortoise[J]. Meat Industry,2020(4):20−25.] WANG F T, LI Z R, LAI N Y, et al. Nutritional quality analysis of tortoise intestine and stomach of Chinese grass tortoise[J]. Meat Industry, 2020(4): 20−25.
[4] 邓燕, 印大中, 江南. 龟皮胶原蛋白的提取及分析[J]. 食品研究与开发,2006(6):62−64. [DENG Y, YIN D Z, JIANG N. Extraction and analysis of turtle skin collagen[J]. Food Research and Development,2006(6):62−64.] DENG Y, YIN D Z, JIANG N. Extraction and analysis of turtle skin collagen[J]. Food Research and Development, 2006(6): 62−64.
[5] CAO C W, XIAO Z C, GE C R, et al. Animal by-products collagen and derived peptide, as important components of innovative sustainable food systems-A comprehensive review[J]. Critical Reviews in Food Science and Nutrition,2021,52(1):21−25.
[6] TAN Y, CHANG S K C. Isolation and characterization of collagen extracted from channel catfish (Ictalurus punctatus) skin[J]. Food Chemistry,2018,242:147−155. doi: 10.1016/j.foodchem.2017.09.013
[7] 黄文. 乌龟(Chinemys reevesii)潜水呼吸代谢及龟皮胶原蛋白成分的分析研究[D]. 长沙:湖南师范大学, 2006. [HUANG W. Analysis of diving respiratory metabolism and collagen components of turtle skin (Chinemys reevesii)[D]. Changsha: Hunan Normal University, 2006.] HUANG W. Analysis of diving respiratory metabolism and collagen components of turtle skin (Chinemys reevesii)[D]. Changsha: Hunan Normal University, 2006.
[8] SONG W, CHEN W, YANG Y, et al. Extraction optimization and characterization of collagen from the lung of soft-shelled turtle Pelodiscus sinensis[J]. Biomedical Materials,2014,2:4.
[9] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper (Lutjanus vitta)[J]. Food Chemistry,2005,93(3):475−484. doi: 10.1016/j.foodchem.2004.10.026
[10] 王聪艳. 金枪鱼鱼皮胶原蛋白的分离制备、性质及应用研究[D]. 大连:大连工业大学, 2019. [WANG C Y. Isolation, preparation, properties and application of collagen from tuna skin[D]. Dalian:Dalian Polytechnic University, 2019.] WANG C Y. Isolation, preparation, properties and application of collagen from tuna skin[D]. Dalian: Dalian Polytechnic University, 2019.
[11] 国家质量监督检验检疫总局. GB/T 9695.23-2008 肉与肉制品羟脯氨酸含量测定[S]. 北京:中国标准出版社, 2018. [General Administration of Quality Supervision. GB/T 9695.23-2008 Determination of hydroxyproline content in meat and meat products[S]. Beijing:China Standard Publishing, 2018.] General Administration of Quality Supervision. GB/T 9695.23-2008 Determination of hydroxyproline content in meat and meat products[S]. Beijing: China Standard Publishing, 2018.
[12] 史睿. 超声波辅助提取骆驼皮胶原蛋白及其性质研究[D]. 呼和浩特:内蒙古农业大学, 2021. [SHI R. Ultrasonic assisted extraction of collagen from camel skin and its properties[D]. Hohhot:Inner Mongolia Agricultural University, 2021.] SHI R. Ultrasonic assisted extraction of collagen from camel skin and its properties[D]. Hohhot: Inner Mongolia Agricultural University, 2021.
[13] ANGUCHAMY V, MUTHUVEL A, THANGAPPAN A, et al. Isolation and characterization of collagen from the outer skin of squid (Doryteuthis singhalensis)[J]. Food Hydrocolloids,2015,43:708−716. doi: 10.1016/j.foodhyd.2014.07.025
[14] TAMILMOZHI, SOMASUNDARAM, VEERURAJ, et al. Isolation and characterization of acid and pepsin-solubilized collagen from the skin of sailfish (Istiophorus platypterus)[J]. Food Research International,2013,54(2):1499−1505. doi: 10.1016/j.foodres.2013.10.002
[15] 汪海波, 梁艳萍, 汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J]. 水产学报,2012,36(4):553−561. [WANG H B, LIANG Y P, WANG H Y, et al. Extraction and partial biological properties of collagen from fish scales of grass carp[J]. Journal of Fisheries of China,2012,36(4):553−561.] doi: 10.3724/SP.J.1231.2012.27700 WANG H B, LIANG Y P, WANG H Y, et al. Extraction and partial biological properties of collagen from fish scales of grass carp[J]. Journal of Fisheries of China, 2012, 36(4): 553−561. doi: 10.3724/SP.J.1231.2012.27700
[16] LIU D, WEI G, LI T, et al. Effects of alkaline pretreatments and acid extraction conditions on the acid-soluble collagen from grass carp (Ctenopharyngodon idella) skin[J]. Food Chemistry,2015,172:836−843. doi: 10.1016/j.foodchem.2014.09.147
[17] 仇雷雷, 王博, 邹帅军, 等. 水母胶原蛋白的提取及性能研究[J]. 药学实践杂志,2020,38(6):509−515. [CHOU L L, WANG B, ZOU S J, et al. Study on the extraction and properties of collagen from jellyfish[J]. Journal of Pharmaceutical Practice,2020,38(6):509−515.] CHOU L L, WANG B, ZOU S J, et al. Study on the extraction and properties of collagen from jellyfish[J]. Journal of Pharmaceutical Practice, 2020, 38(6): 509−515.
[18] 国家发展和改革委员会. QB 2732-2005 水解胶原蛋白[S]. 北京:中国标准出版社, 2005. [National Development and Reform Commission. QB 2732-2005 Hydrolyzed collagen[S]. Beijing:China Standard Publishing, 2005.] National Development and Reform Commission. QB 2732-2005 Hydrolyzed collagen[S]. Beijing: China Standard Publishing, 2005.
[19] AHMED R, HAQ M, CHUN B S. Characterization of marine derived collagen extracted from the by-products of bigeye tuna (Thunnus obesus)[J]. International Journal of Biological Macromolecules,2019,135:668−676.
[20] ZHANG Y, LIU W, LI G, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella)[J]. Food Chemistry,2007,103(3):906−912. doi: 10.1016/j.foodchem.2006.09.053
[21] WANG L, LIANG Q, CHEN T, et al. Characterization of collagen from the skin of Amur sturgeon (Acipenser schrenckii)[J]. Food Hydrocolloids,2014,38:104−109. doi: 10.1016/j.foodhyd.2013.12.002
[22] LU J, WAN Q, YIN Z, et al. Extraction and characterization of collagen from calipash of Chinese soft-shelled turtle (Pelodiscus sinensis)[J]. Journal of Fisheries of China,2010,34(6):801−808. doi: 10.3724/SP.J.1231.2010.06800
[23] 冯玲玲, 冯进, 李春阳. 海蜇Ⅰ型胶原蛋白的提取及结构特性研究[J]. 食品工业科技,2021,42(7):15−21. [FENG L L, FENG J, LI C Y. Study on the extraction and structural characteristics of Type I collagen from jellyfish[J]. Science and Technology of Food industry,2021,42(7):15−21.] FENG L L, FENG J, LI C Y. Study on the extraction and structural characteristics of Type I collagen from jellyfish[J]. Science and Technology of Food industry, 2021, 42(7): 15−21.
[24] BURGHAGEN M. Collagen[J]. Food Chemistry, 1999:540-547.
[25] MUYONGA J H, COLE C G B, DUODU K G. Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry,2004,85:81−89. doi: 10.1016/j.foodchem.2003.06.006
[26] 王艳茹, 王欣悦, 何龙, 等. 超高压辅助酶解制备胶原蛋白抗氧化肽及构效分析[J/OL]. 食品科学, 1−17[2024-10-05]. http://kns.cnki.net/kcms/detail/11.2206.TS.20231218.0844.004.html. [WANG Y R, WANG X Y, HE L, et al. Preparation and structure-activity analysis of antioxidant peptides of collagen by enzymatic hydrolysis assisted by ultra-high pressure[J/OL]. Food Science, 1−17[2024-10-05]. http://kns.cnki.net/kcms/detail/11.2206.TS.20231218.0844.004.html.] WANG Y R, WANG X Y, HE L, et al. Preparation and structure-activity analysis of antioxidant peptides of collagen by enzymatic hydrolysis assisted by ultra-high pressure[J/OL]. Food Science, 1−17[2024-10-05]. http://kns.cnki.net/kcms/detail/11.2206.TS.20231218.0844.004.html.
[27] 王杉杉, 罗学刚, 苏峰丙, 等. 牦牛皮胶原蛋白的提取及性能分析[J]. 精细化工,2018,35(5):830−837. [WANG S S, LUO X G, SU F B, et al. Extraction and characterization of collagen from the skin of Yak[J]. Journal of Fine Chemicals,2018,35(5):830−837.] WANG S S, LUO X G, SU F B, et al. Extraction and characterization of collagen from the skin of Yak[J]. Journal of Fine Chemicals, 2018, 35(5): 830−837.
[28] VEERURAJ A, ARUMUGAM M, BALASUBRAMANIAN T. Isolation and characterization of thermostable collagen from the marine eel-fish (Evenchelys macrura)[J]. Process Biochemistry,2013,48(10):1592−1602. doi: 10.1016/j.procbio.2013.07.011
[29] FENG Y, MELACINI G, TAULANE J P, et al. Acetyl-terminated and template-assembled collagen-based polypeptides composed of Gly-Pro-Hyp Sequences. 2. Synthesis and conformational analysis by circular dichroism, ultraviolet absorbance, and optical rotation[J]. Journal of the American Chemical Society,1996,118(43):10351−10358. doi: 10.1021/ja961260c
[30] ABDOLLAHI M, REZAEI M, JAFARPOUR A, et al. Sequential extraction of gel-forming proteins, collagen and collagen hydrolysate from gutted silver carp (Hypophthalmichthys molitrix), a biorefinery approach[J]. Food Chemistry,2018,242:568−578. doi: 10.1016/j.foodchem.2017.09.045
[31] HILL S E, LEDWARD D A, MITCHELL J R, et al. Functional properties of food macromolecules[M]. New York:Springer Science & Business Media, 1998.
[32] TAKESHI N, YOKO A, NOBUTAKA S. Collagen of skin of ocelate pufer fish (Takifugu rubripes)[J]. Food Chemistry,2002(78):173−177.
[33] WU G P, WANG X M, LIN L P, et al. Isolation and characterization of pepsin-solubilized collagen from the skin of black carp (Mylopharyngdon piceus)[J]. Advances in Bioscience and Biotechnology,2014,5:642−650. doi: 10.4236/abb.2014.57076
[34] 刘彦秋, 都日玛, 白杨, 等. 超高压处理对羊骨胶原蛋白三级结构的影响[J]. 中国食品学报,2022,22(8):207−213. [LIU Y Q, DU R M, BAI Y, et al. Effects of ultra-high pressure treatment on the tertiary structure of sheep collagen[J]. Chinese Journal of Food Science,2022,22(8):207−213.] LIU Y Q, DU R M, BAI Y, et al. Effects of ultra-high pressure treatment on the tertiary structure of sheep collagen[J]. Chinese Journal of Food Science, 2022, 22(8): 207−213.
[35] 宋乐. 驼掌胶原蛋白的提取及其理化性质研究[D]. 呼和浩特:内蒙古农业大学, 2021. [SONG L. Study on extraction and physicochemical properties of collagen from camel paw[D]. Hohhot:Inner Mongolia Agricultural University, 2021.] SONG L. Study on extraction and physicochemical properties of collagen from camel paw[D]. Hohhot: Inner Mongolia Agricultural University, 2021.
[36] 黄诗萌, 王景琦, 皮钰珍, 等. 梅花鹿角盘胶原蛋白的鉴定及其理化性质[J]. 食品工业科技,2024,45(3):284−292. [HUANG S M, WANG J Q, PI Y Z, et al. Identification and physicochemical properties of collagen from the antler disc of plum deer[J]. Science and Technology of Food industry,2024,45(3):284−292.] HUANG S M, WANG J Q, PI Y Z, et al. Identification and physicochemical properties of collagen from the antler disc of plum deer[J]. Science and Technology of Food industry, 2024, 45(3): 284−292.
[37] WOO J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowfin tuna (Thunnus albacares) dorsal skin[J]. Food Hydrocolloids,2008,22(5):879−887. doi: 10.1016/j.foodhyd.2007.04.015
[38] LE T M T, NGUYEN V M, TRAN T T, et al. Comparison of acid-soluble collagen characteristic from three important freshwater fish skins in mekong delta region, vietnam[J]. Journal of Food Biochemistry,2020,44(9):e13397.
[39] ALI A M M, KISHIMURA H, BENJAKUL S. Physicochemical and molecular properties of gelatin from skin of golden carp (Probarbus Jullieni) as influenced by acid pretreatment and prior-ultrasonication[J]. Food Hydrocolloids,2018,82(9):164−172.





 下载:
下载:
 下载:
下载:



