Immunostimulatory Activity of Tilapia-head Chondroitin Sulfate in RAW 264.7 Cells and Mice
-
摘要: 本文采用了RAW 264.7细胞和免疫抑制模型,通过体外、体内实验研究罗非鱼头硫酸软骨素(CS)的免疫刺激活性。结果表明,罗非鱼头硫酸软骨素(CS)可以诱导RAW 264.7细胞产生NO、IL-1β、IL-6、IL-10、TNF-α;环磷酰胺(CTX)诱导小鼠的胸腺萎缩(胸腺指数0.11%±0.01%),低剂量CS(胸腺指数(0.17%±0.03%)、高剂量CS(胸腺指数(0.18%±0.02%)干预后,显著上调了小鼠胸腺指数(P<0.05);同时,CS干预显著上调CTX诱导小鼠脾脏指数(P<0.05),上调绒毛长度和V/C值并且高剂量CS显著上调了绒毛长度(330.92±21.55)μm(P<0.05);另外,CS对CTX诱导小鼠血清sIgA的分泌有促进作用。这些结果表明CS可以改善免疫抑制小鼠肠道屏障损伤及免疫功能。因此,本研究可为罗非鱼硫酸软骨素的肠道黏膜免疫调节作用提供理论基础,并表明罗非鱼头硫酸软骨素(CS)是一种潜在的可替代鲨鱼硫酸软骨素的免疫调节多糖,并可能成为干预免疫疾病相关功能食品的潜在材料。Abstract: In this study, RAW 264.7 cells and immunosuppressive models were used to investigate the immunostimulatory activity of tilapia-head chondroitin sulfate (CS) through in vitro and in vivo experiments. The results showed that tilapia-head chondroitin sulfate (CS) could induce the produce of NO, IL-1β, IL-6, IL-10 and TNF-α in RAW 264.7 cells. Cyclophosphamide (CTX) induced thymic atrophy in mice (thymic index 0.11%±0.01%), while thymic index was significantly up-regulated by low-dose CS (thymic index (0.17%±0.03%) and high-dose CS (thymic index (0.18%±0.02%) interventions (P<0.05). Meanwhile, CS significantly increased spleen index in CTX-induced mice (P<0.05), promoted villus length and V/C value, with high-dose CS significantly increased villus length (330.92±21.55) μm (P<0.05). Furthermore, CS enhanced the secretion of serum sIgA in CTX-induced mice, indicating that CS could improve intestinal barrier damage and immune function in immunosuppressive mice. Therefore, this study provides a theoretical basis for the intestinal mucosal immune regulation of tilapia chondroitin sulfate, and suggests that tilapia-head chondroitin sulfate (CS) is a potential immunoregulatory polysaccharide that could replace shark chondroitin sulfate, potentially serving as a promising material for functional foods aimed at intervening in immune-related diseases.
-
Keywords:
- tilapia /
- chondroitin sulfate /
- immunostimulatory activity /
- immunosuppression /
- intestinal barrier /
- RAW 264.7
-
环磷酰胺(CTX)是一种常见的抗癌药物,目前仍广泛用于血液系统恶性肿瘤和各种上皮性肿瘤[1],然而,CTX有不同的副作用,类似于其他化疗药物。CTX会损害胃肠道黏膜,导致免疫缺陷和继发感染的风险增加[2],因此,为了减少CTX的副作用,提高疗效,低毒性和低副作用免疫调节剂备受关注。硫酸软骨素(CS)已被发现具有低毒性和低副作用,具有新型膳食补充剂和功能食品的开发和应用前景[3],在免疫调节剂方面有巨大潜力。
硫酸软骨素(Chondroitin sulfate,CS)是一种糖胺聚糖,根据D-葡萄糖醛酸(D-glucuronic acid,GlcA)和N-乙酰氨基半乳糖(N-acetyl-D-galactosamine,GalNAc)在各个位点连接硫酸基团的数量以及类型不同,可分为A型、C型、D型和E型[4]。CS具有抗氧化[5]、抗炎[6]、促伤口愈合[7]、抗病毒[8]、抗关节炎[9]等生物活性。CS主要从动物软骨中获取,但是,陆地生物存在疯牛病和猪霍乱等疾病[10],相对来说,海洋来源的安全系数更高。因此,海洋衍生的CS引起了人们极大的兴趣。罗非鱼(Oreochromis mossambicus)又称非洲鲫鱼,属于热带性硬骨鱼类,具有生长快、肉质美、产量大、繁殖力强等特点[11]。二零二零年,全世界罗非鱼产量估计接近700万吨[12],在工业加工过程中,罗非鱼的加工副产品数量庞大,估计约占总重量的百分之七十[13],包括鱼头、鱼体、内脏等[14],通常会被丢弃或加工成饲料等低值产品。然而,罗非鱼头CS与鲨鱼CS相似,从经济、安全性的角度,罗非鱼可作为硫酸软骨素新来源[15]。由于从不同来源和提取方法获得的CS的硫化部位、硫化程度和相对分子质量(Mr)的变化[16],CS的生物活性尚不清楚。
近年来,大量研究表明,多糖具有调节肠道黏膜免疫的能力[17]。有研究发现,非消化多糖可被认为是利用肠道微生物群的潜在益生元,导致微生物多样性和组成的改变[18]。研究表明,海参来源CS可以改善CTX造成的小鼠体重减轻和脾脏指数下降,改善CTX受损肠道TJ蛋白的表达[19]。另外,小肠作为消化吸收的主要部分[20],分为十二指肠、空肠和回肠,小肠完整性是发挥正常肠屏障功能的关键。肠黏膜屏障能够抵抗病毒和细菌侵入,在机体健康中扮演重要角色[21]。肠绒毛是肠道特有的结构,绒毛长度和隐窝深度的检测可以反映肠道功能[22],绒毛长度和隐窝深度的变化会影响肠道吸收功能,综上所述,肠道形态的检测是研究肠道的一个重要部分。而CS因为其化学结构与硫酸化程度的不同,导致生物活性不同,当前CS作用于肠道少有人报道,对于罗非鱼头CS调节肠道的能力尚未可知。因此,本研究采用体外、体内实验,通过巨噬细胞细胞系RAW 264.7和免疫抑制小鼠研究罗非鱼头硫酸软骨素(CS)的免疫刺激活性,为开发新来源硫酸软骨素和免疫调节剂提供理论基础。
1. 材料与方法
1.1 材料与仪器
二甲苯、盐酸分化液、中性树胶 国药集团化学试剂有限公司;苏木素染液 杭州浩克生物科技有限公司;氨水 MACKLIN;环磷酰胺 上海麦克林生化科技股份有限公司;盐酸左旋咪唑 广东南国药业有限公司;细胞因子、sIgA试剂盒 江苏酶免实业有限公司;NO试剂盒 上海碧云天生物技术有限公司;Savinase 16 L 美国Sigma公司;2709碱性蛋白酶(酶活范围20万U/g) 南京庞博生物工程有限公司;C57BL/6小鼠(6周龄,18~20 g,NO.44822700026356(质量合格证明)) 珠海百试通生物科技有限公司;ZETA胎牛血清 湛江市安培生物科技有限公司;100X青霉素-链霉素溶液 生物生工(上海)股份有限公司;RAW 264.7细胞 上海细胞库;3500 Da再生纤维素透析袋 上海碧云天生物技术股份有限公司;罗非鱼副产物 恒诚生物科技有限公司。
JB-P5生物组织自动包埋机、JB-P5石蜡包埋机(冷台) 湖北贝诺医疗科技有限公司;HistoCoreBIOCUT转轮式切片机 徕卡显微系统上海有限公司;710510载玻片及盖玻片 江苏汇达医疗器械有限公司;DP260s达科为染色机 深圳市达科为医疗科技有限公司;ECLIPSE E100显微镜 NIKON;Varioskan Flas全自动酶标仪、Sorval Lynx6000高速落地离心机 美国Thermo Fisher Scientific公司;FD8508真空冷冻干燥机 韩国ILSHIN公司。
1.2 实验方法
1.2.1 罗非鱼头硫酸软骨素提取
参考左格格等[15]的罗非鱼硫酸软骨素提取方法,取罗非鱼头进行蒸煮,乙醇浸泡过夜,烘干,粉碎成骨粉。50 mmol/L Na2CO3溶液加入10 g骨粉,按液料比25:1(mL/g)。加200 μL Savinase 16 L,在水浴条件为55 ℃下搅拌4 h,沸水浴10 min。冷却至室温,加入终质量浓度5.4 mg/mL的2709碱性蛋白酶,在水浴条件为50 ℃下反应2 h,沸水浴10 min。冷却后离心(8000 r/min,4 ℃,20 min)取上清液。按上清液质量加入5%三氯乙酸后,将溶液放置室温静置3 h,离心(8000 r/min,4 ℃,20 min)取上清液,3倍乙醇醇沉过夜。离心(8000 r/min,4 ℃,20 min)取沉淀,并将沉淀溶于20 mL 20 mmol/L Na2SO4溶液,然后缓慢滴入6 g/100 mL氯化十六烷基吡啶溶液。离心(1500 r/min,4 ℃,15 min)取沉淀,加入15 mL 2 mol/L NaCl溶液-乙醇(100:15,V/V)溶液,3倍乙醇醇沉8 h。离心(1500 r/min,4 ℃,15 min)取沉淀再加蒸馏水溶解,在4 ℃下透析(3500 Da)24 h,浓缩,冷冻干燥(3 d),得到罗非鱼头硫酸软骨素(CS)。
1.2.2 细胞培养
RAW 264.7细胞在添加10% 胎牛血清(V/V)、青霉素(100 U/mL)和链霉素(100 μg/mL)的DMEM培养基中培养。细胞在37 ℃的含5% CO2培养箱中培养。
1.2.3 细胞增殖实验
采用CCK-8法检测CS对RAW 264.7细胞活力的影响[23]。将处于对数生长期的细胞调整到浓度为5×104个细胞/mL,100 μL的细胞悬液加入到96孔板中,在37 ℃下培养24 h。去除培养基,然后再分别用100 μL CS(125、250、500和1000 μg/mL)和LPS(1 μg/mL)处理细胞24 h。以无血清培养基为空白组(CON),LPS为阳性对照组。每孔加入10 μL CCK-8试剂,培养1 h,调整波长至540 nm测定。细胞活力计算公式如下:
细胞活力(%)=AB×100 式中,A为处理组的吸光度,B为空白组的吸光度。
1.2.4 一氧化氮(NO)检测
将RAW 264.7细胞(1×105个细胞/孔)接种于96孔板中,孵育24 h。分别用CS(分别为125、250和500 μg/mL)和LPS(1 μg/mL)处理细胞,孵育24 h后收集上清液用于后续实验。无CS的治疗组为阴性对照组,有LPS的治疗组为阳性对照组。采用Griess法测定巨噬细胞NO的分泌量[24]。
1.2.5 细胞因子检测
将RAW 264.7细胞(1×104个细胞/孔)接种于24孔板中,孵育24 h。用CS(125、250和500 μg/mL)或LPS(1 μg/mL)处理细胞,孵育24 h。根据制造商的说明,使用ELISA试剂盒分析细胞上清液中细胞因子IL-1β、TNF-α、IL-10和IL-6的释放情况。
1.2.6 体内实验设计
C57BL/6小鼠(6周龄,18~20 g,雄性),每组8只,饲养在23±2 ℃,12 h的昼夜循环中,控制水和食物摄入量(自由)。所有实验均获得了广东海洋大学-湖光校区动物护理和使用委员会(SYXK(粤)2019-0204)的许可,伦理审查批文号为(GDOU-LAE-2023-026),符合《广东省实验动物管理条例》,严格遵守SPF级动物使用规范。将小鼠分为5组:C(空白组)、M(模型组)、LH(40 mg/kg)(阳性对照组)、LD(80 mg/kg)(低剂量组)、HD(150 mg/kg)(高剂量组)。所有小鼠都被完全喂食无菌水和食物(随意喂食)。第1~3 d,M、LD、HD和LH组小鼠注射CTX(80 mg/kg),建立免疫抑制小鼠模型,C组注射生理盐水。第4~10 d,C组和M组灌胃无菌生理盐水,LD、HD和LH组小鼠分别灌胃80 mg/kg CS,150 mg/kg CS和盐酸左旋咪唑(40 mg/kg)[25]。第10 d收集小鼠粪便,禁食12 h后,第11 d处死小鼠。
1.2.7 小鼠体重变化
每天灌胃前,称重小鼠,并记录每只小鼠的体重。
1.2.8 免疫器官指数
用生理盐水清洗胸腺和脾脏,用滤纸吸干胸腺和脾脏表面的生理盐水,称量胸腺、脾脏重量。用器官重量(g)和小鼠体重(g)的比率代表胸腺、脾脏指数[26],公式如下:
胸腺指数(%)=胸腺质量(g)动物体重(g)×100 脾脏指数(%)=脾脏质量(g)动物体重(g)×100 1.2.9 空肠形态检测
样本前处理:小心剪取空肠组织约1 cm,用生理盐水清洗空肠。滤纸吸干,将空肠放入4%的多聚甲醛中固定[19]。
1.2.9.1 石蜡切片脱蜡至水
将修整好的蜡块置于石蜡切片机切片,厚3~4 μm。切片漂浮于摊片机40 ℃温水上将组织展平,载玻片将组织捞起,60 ℃烘箱内烤片。水烤干蜡烤化后取出常温保存备用。依次将切片放入二甲苯Ⅰ 8 min-二甲苯Ⅱ 8 min-二甲苯Ⅲ 8 min-无水乙醇Ⅰ 5 min-无水乙醇Ⅱ 5 min-85%酒精5 min-75%酒精5 min,自来水洗2 min。
1.2.9.2 苏木素染色
苏木素染色5 min,盐酸水溶液分化2 s,氨水水溶液返蓝15~30 s,水洗;伊红染色:切片入95%的酒精脱水,入伊红染液中染色5~8 s。
1.2.9.3 脱水封片
切片依次放入无水乙醇I 30 s-无水乙醇II 2.5 min-无水乙醇Ⅲ 2.5 min -二甲苯Ⅰ 2.5 min- 二甲苯Ⅱ 2.5 min透明,中性树胶封片。
1.2.9.4 图像采集分析
显微镜镜检,使用Visiopharm软件,识别肠绒毛、隐窝和黏膜,测量隐窝深度、绒毛长度。
1.2.10 血清细胞因子
小鼠眼球取血,12000 r/min,4 ℃离心5 min,取上清液,参照相应ELISA试剂盒操作说明,检测sIgA的表达量。
1.3 数据处理
采用IBM SPSS Statistics 26进行统计分析,所有数据均以“平均值±标准差”表示,采用单因素ANOVA检验邓肯分析。不同字母表示各组间差异有统计学意义(P<0.05),用GraphPad Prism 8绘制软件作图。
2. 结果与分析
2.1 CS对RAW 264.7细胞的增殖作用
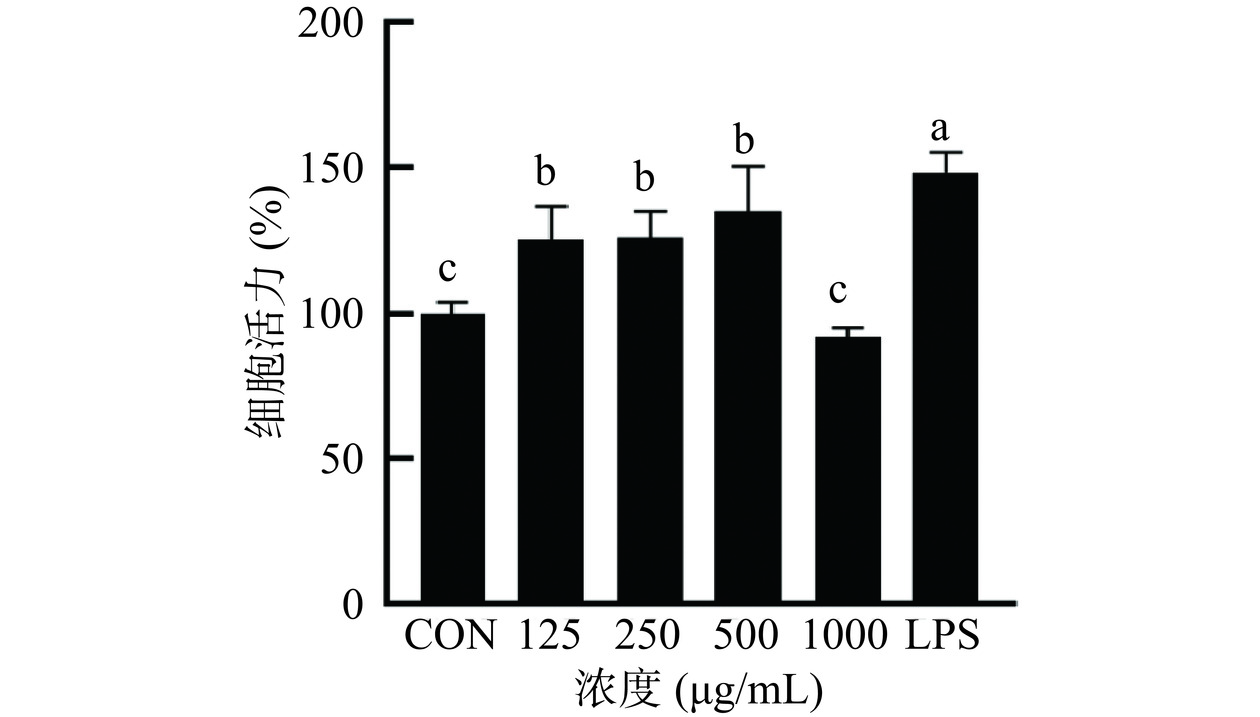
根据CS对细胞活力的影响,采用CCK-8方法评价CS的细胞安全性。确定安全浓度范围,并选择最佳的药物浓度,以减少浓度过高造成细胞损害对实验准确性的影响[27]。从图1可以看出,在125~1000 μg/mL浓度下,CS对细胞没有细胞毒性。在浓度达到1000 μg/mL时,CS与空白组的差异无统计学意义(P>0.05)。在125、250和500 μg/mL时,CS处理组的细胞活力分别为125.26%、125.97%和134.97%,显著高于空白组(P<0.05),LPS组的细胞活力为148.01%。这些结果表明CS在125~1000 μg/mL浓度下对细胞无毒性。
2.2 CS对RAW 264.7细胞产生NO的作用
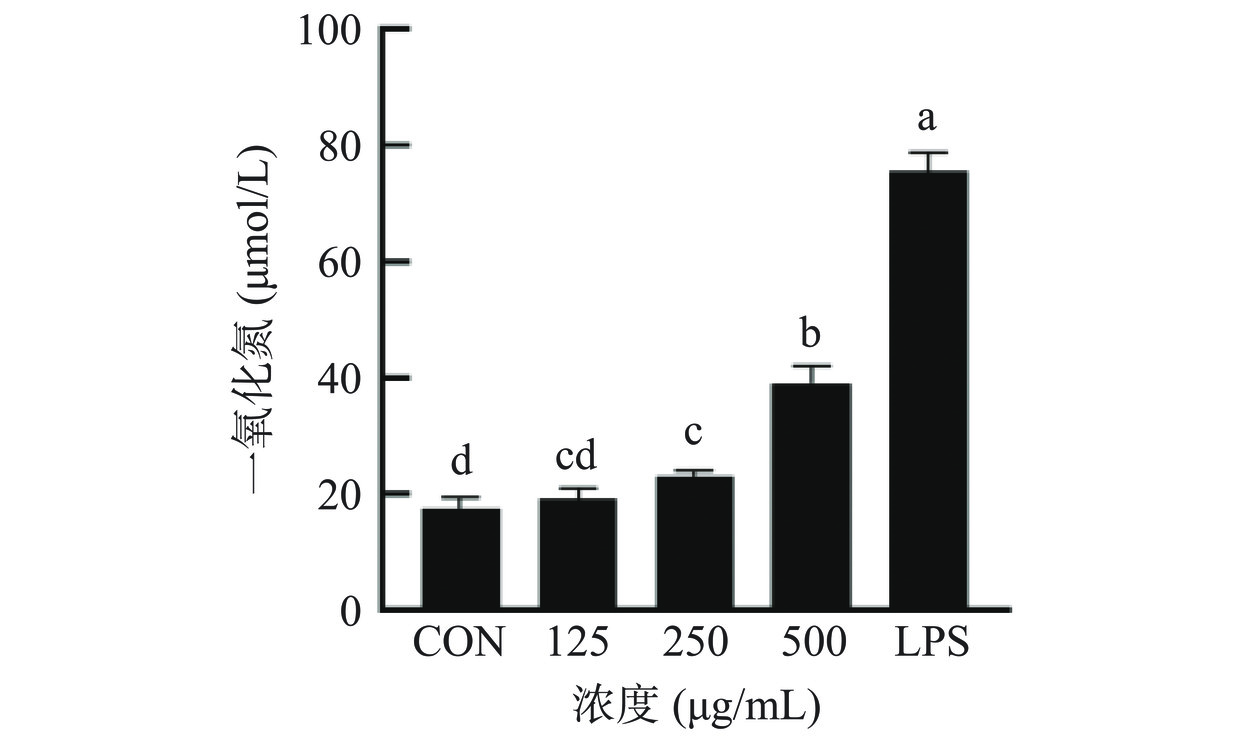
NO由巨噬细胞释放,促进促炎细胞因子分泌诱导免疫反应[28]。图2显示,与空白组相比,CS显著刺激了RAW 264.7细胞中NO的产生,且呈剂量依赖性(P<0.05)。LPS组的NO分泌量显著上升(P<0.05),CS在浓度为125 μg/mL时,NO分泌无显著性差异(P>0.05)。在浓度为500 μg/mL时,NO分泌量达到最高值,相比LPS处理组的NO分泌量低。这些结果表明,CS的加入导致细胞中NO的释放水平显著增加,巨噬细胞通过产生NO吞噬或杀死外来感染细菌、病原体甚至肿瘤细胞[29],激活免疫反应,这在一定的安全范围内,不会导致过度的炎症反应。
2.3 CS对细胞因子分泌的影响
IL-6是一种白细胞介素,既作为促炎细胞因子,又作为抗炎细胞因子。IL-1β是一种促炎细胞因子,对局部和全身炎症至关重要[30]。同时,关键的抗炎细胞因子IL-10可以抑制巨噬细胞的活化和增殖。如图3所示,与空白组相比,经过CS处理后,IL-1β和TNF-α(图3A、3D)的分泌呈剂量依赖性显著增加(P<0.05);同时,CS还显著促进了IL-6和IL-10的分泌(图3B、3C)(P<0.05);LPS显著上调IL-1β、TNF-α、IL-6和IL-10的分泌量(P<0.05)。这些结果表明,CS可以刺激巨噬细胞产生细胞因子,从而增强机体免疫反应。
2.4 CS对免疫抑制小鼠体重的影响
环磷酰胺在发挥作用的同时,对机体产生免疫抑制的副作用,导致体重减轻, 进食减少,精神萎靡[21]。造模期间,CTX组小鼠与正常对照组小鼠相比食欲不佳,有脱毛症状,活跃度下降,精神状态不佳。灌胃不同剂量CS及盐酸左旋咪唑后,与模型组对比,小鼠精神状态改善,脱毛症状减轻。如表1所示,注射CTX后,M、LD、HD以及LH组小鼠从第2 d开始体重下降。造膜3 d结束(第4 d),与空白组相比,M、LD、HD以及LH组小鼠体重显著下降(P<0.05);与模型组对比,LD、HD以及LH组小鼠体重均无显著性差异(P>0.05)。灌胃7 d内,模型组小鼠体重不稳定,说明CTX导致精神萎靡,影响食欲[21];LD组和HD组小鼠的体重先下降后上升,CS的干预可以调理CTX诱导小鼠的食欲。结果表明,注射CTX导致小鼠精神萎靡,体重下降,饮食减少,综上所述,免疫抑制模型造模成功[21]。
表 1 小鼠体重变化(n=8)Table 1. Weight change of mice (n=8)时间(d) C(g) M(g) LD(g) HD(g) LH(g) 1 21.25±0.69 20.74±0.60 21.44±0.43 20.45±0.56 21.28±0.66 2 21.11±0.75 19.96±0.59 20.88±0.43 20.21±0.34 20.11±0.93 3 20.90±1.24 19.61±0.65 20.31±0.44 19.96±0.50 20.03±0.60 4 21.19±1.07a 19.06±0.76b 19.88±0.81b 19.55±0.43b 19.70±0.65b 5 21.72±1.03 19.45±0.93 19.64±1.11 19.68±0.71 20.39±0.70 6 21.60±1.15 19.20±0.50 19.63±1.22 19.66±0.59 20.28±0.56 7 21.74±1.02 19.32±0.57 19.60±1.39 19.23±0.81 20.36±0.52 8 22.00±1.23 19.35±0.45 19.63±1.05 19.19±0.90 20.28±0.59 9 22.20±0.71 19.75±0.31 20.24±0.81 19.76±0.81 20.66±0.56 10 22.30±0.69 19.68±0.33 19.96±0.89 19.75±0.93 20.68±0.57 注:不同字母表示组间有显著性差异(P<0.05)。 2.5 免疫器官指数
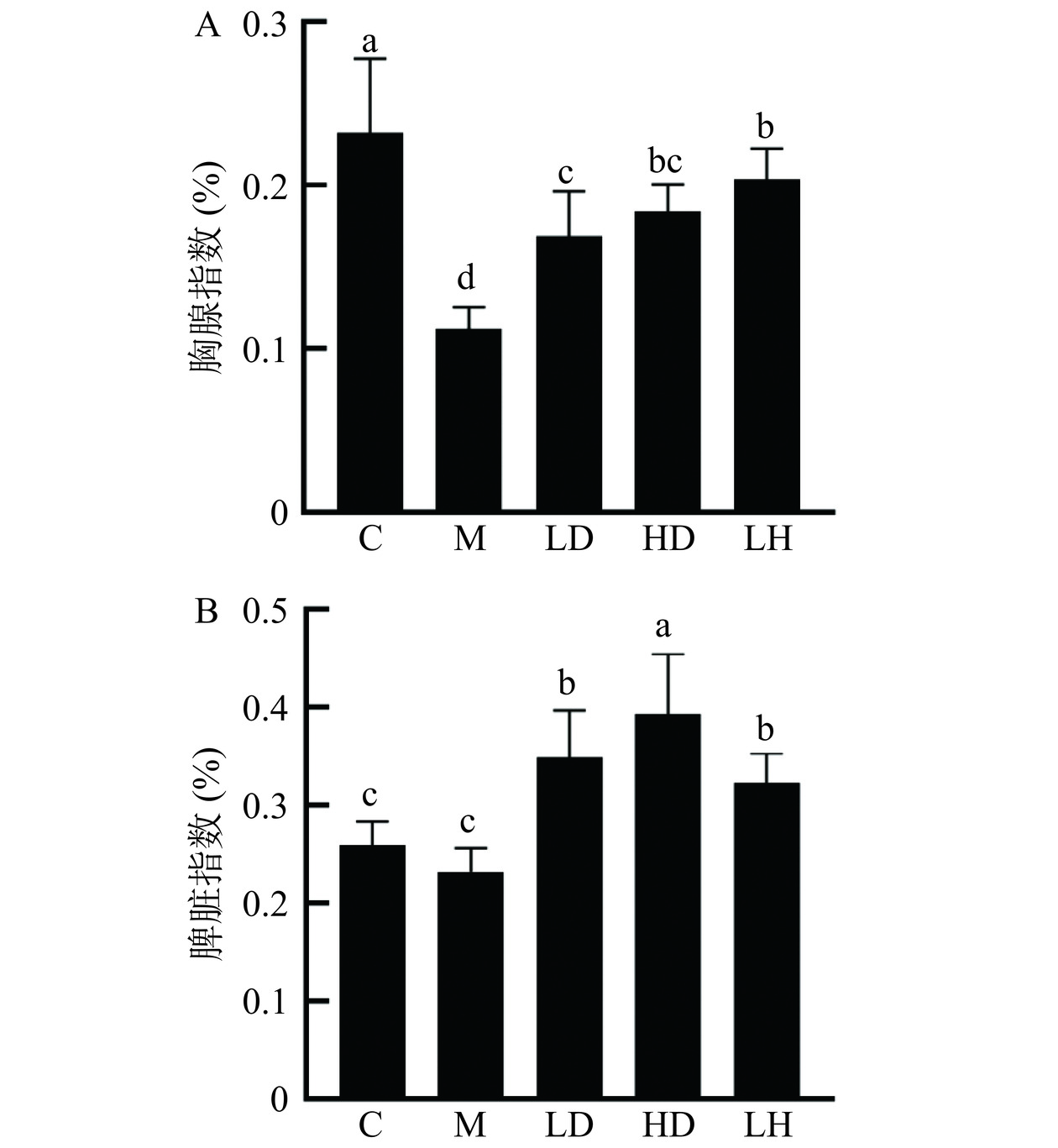
胸腺是机体重要的免疫器官,为机体提供成熟T细胞,对机体免疫具有调节作用[31]。胸腺可以反映非特异性免疫功能。模型组小鼠的胸腺萎缩严重,LD组、HD组及LH组与空白组的胸腺状态相似。图4A所示,注射CTX的四组小鼠胸腺指数均显著低于空白组小鼠0.23%±0.05%(P<0.05);与模型组0.11%±0.01%对比,LH组、LD及HD组小鼠胸腺指数均显著上升(P<0.05),LD、HD组胸腺指数分别是0.17%±0.03%和0.18%±0.02%。图4B显示,与模型组相比,LD、HD组和LH组的脾脏指数均显著升高(P<0.05),C组的脾脏指数无显著性差异(P>0.05),但M组的脾脏指数比C组低。免疫器官的重量与免疫细胞的数量有关,因此免疫器官指数可以用来间接反映身体的免疫功能异常。研究结果表明,CS显著提高了免疫抑制小鼠的脾脏指数和胸腺指数(P<0.05),CS能够影响免疫抑制小鼠免疫器官的生长发育,进而改善免疫抑制小鼠的机体免疫。
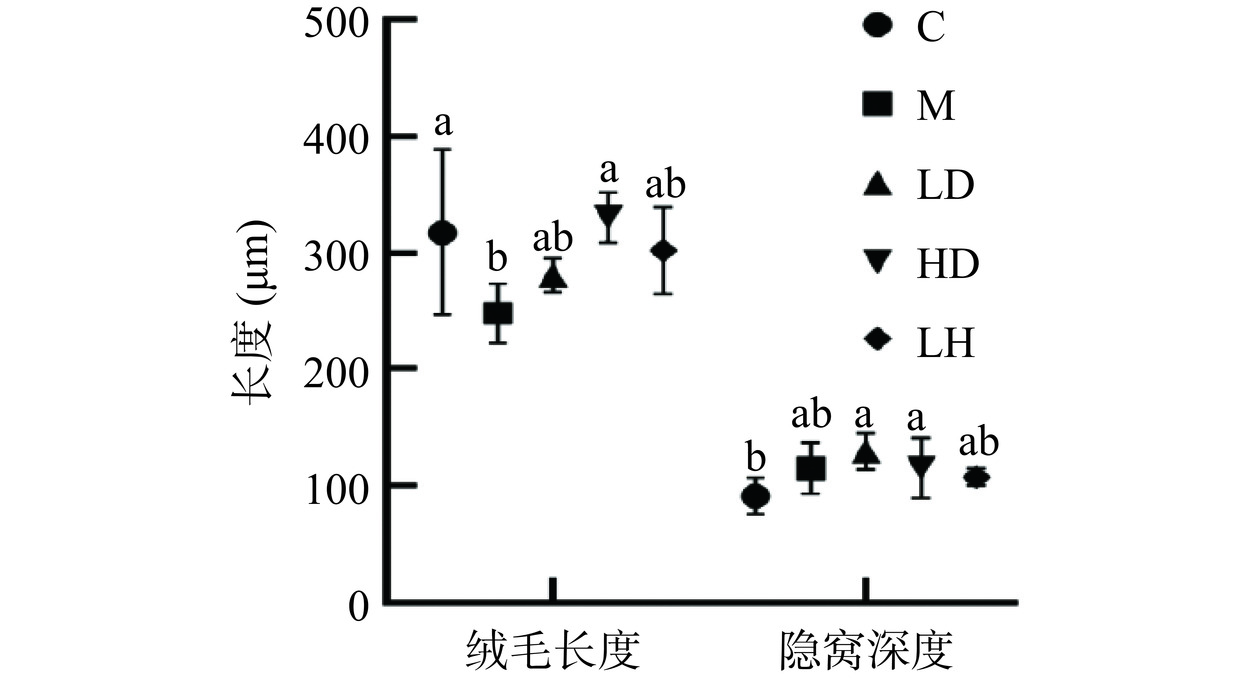
2.6 CS对免疫抑制小鼠空肠绒毛长度和隐窝深度的作用
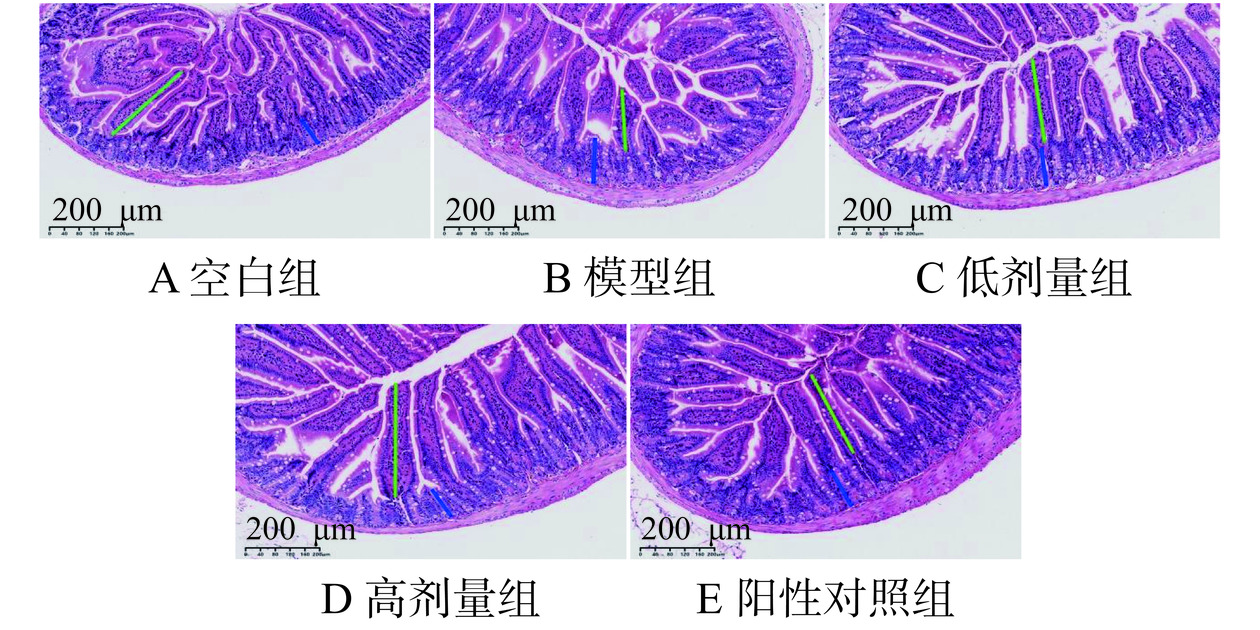
本实验采用HE染色的方式,观察小肠组织切片黏膜结构。图5显示,相比空白组(图5A),模型组(图5B)的绒毛较短且隐窝深度增加。相比模型组(图5B),CS低剂量组(图5C)绒毛略长,高剂量组(图5D)绒毛长度增加;阳性对照组(图5E)绒毛较长。空白组隐窝深度较浅,注射CTX导致隐窝深度增加,在CS和盐酸左旋咪唑干预后,有不同程度的恢复。
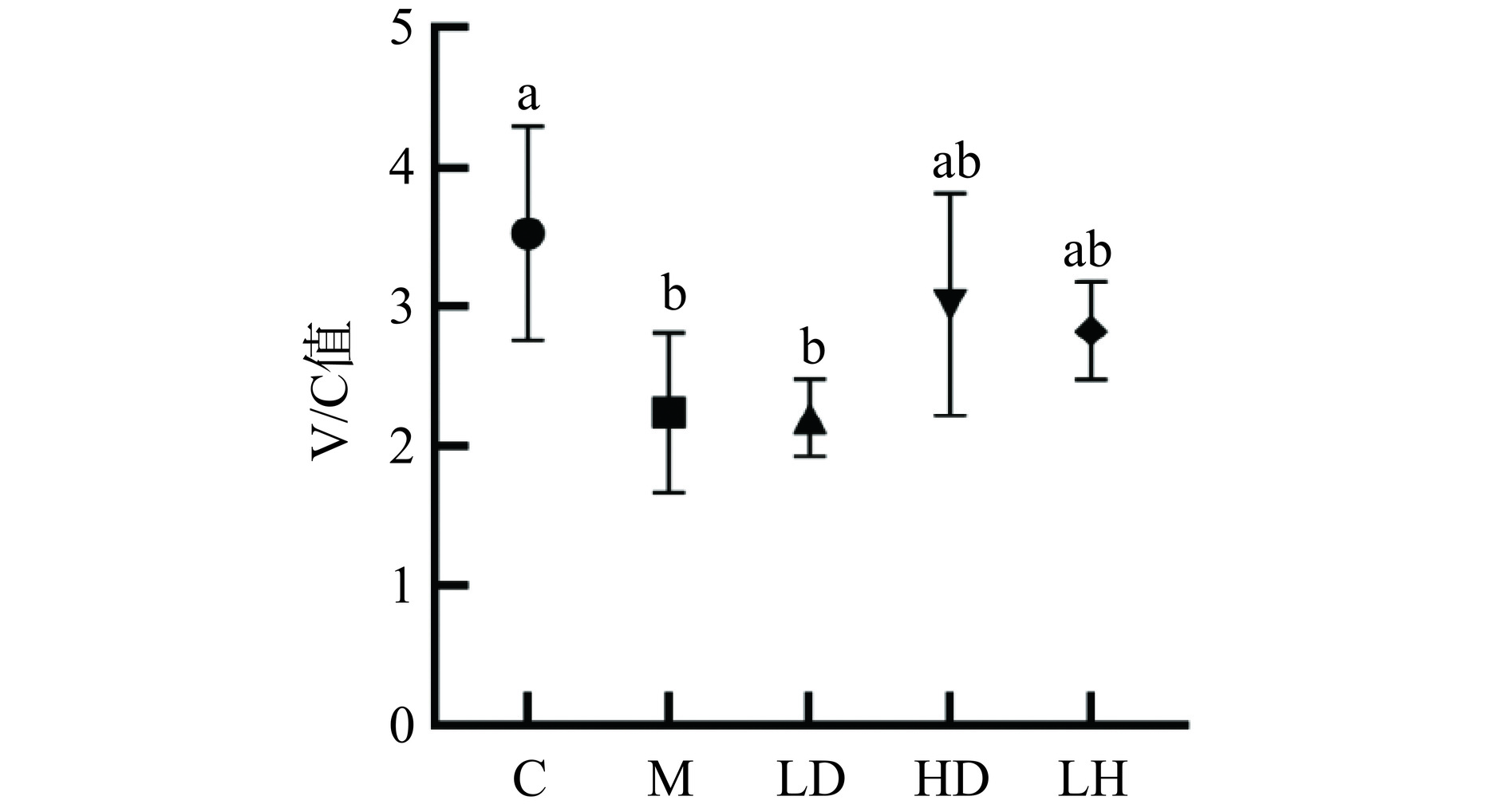
如图6所示,与空白组相比,模型组小鼠绒毛长度显著下降(P<0.05)。与模型组相比,HD组小鼠绒毛长度显著增加(P<0.05),达到了330.92±21.55 μm。与空白组相比,模型组隐窝深度增加,与模型组相比,LD和HD组隐窝深度均无显著性差异(P>0.05)。如图7所示,与空白组相比,模型组V/C值(绒毛长度/隐窝深度)显著下降(P<0.05),与模型组相比,经过CS处理后略微上升。小肠是消化吸收的主要部分[20],肠绒毛是肠道特有的结构,绒毛长度和隐窝深度与肠道功能密切相关,绒毛变短和隐窝深度变深,从而导致肠道形态恶化,而绒毛长度与隐窝深度的比值(V/C)通常被用作观察肠道形态以及表征肠消化吸收能力[21−22]。结果表明,CS可以在一定程度上恢复CTX诱导的免疫抑制小鼠绒毛长度以及提高V/C值,改善小鼠的吸收消化能力。
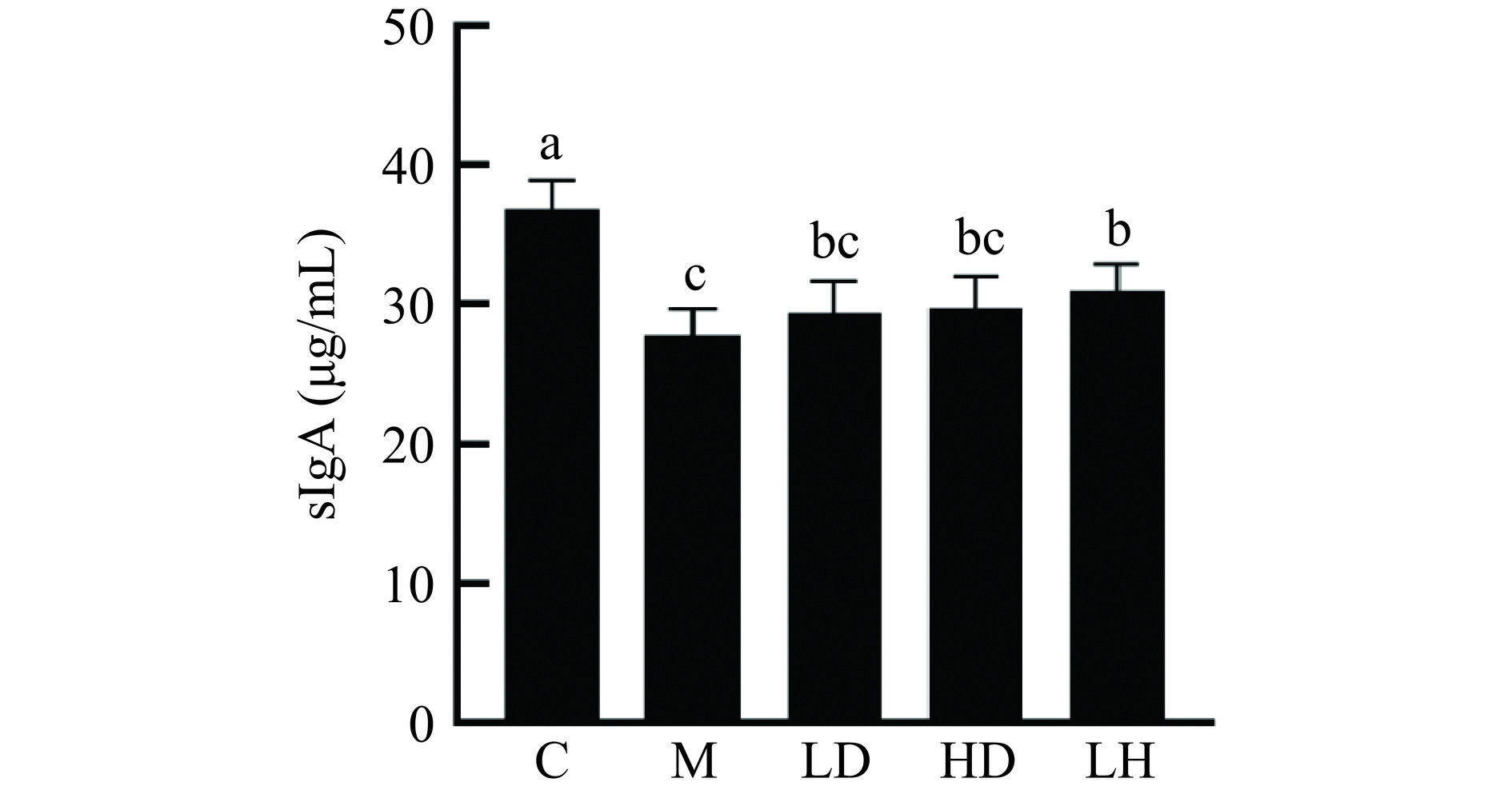
2.7 血清sIgA分泌量
sIgA与肠道免疫紧密相关,sIgA的增加可以增强肠道免疫力[32]。由图8可知,注射CTX后,与空白组相比,模型组小鼠血清sIgA分泌量显著下降(P<0.05),与模型组相比,CS低、高剂量组和阳性对照组的sIgA含量升高。检测血清中的sIgA可替代间接测定肠道中产生的免疫球蛋白,具有抵抗肠道上皮细胞中有害物质和毒素的功能[33],结果表明CS可增加免疫抑制小鼠血清sIgA分泌量,从而改善小鼠肠道免疫抑制情况。
3. 结论
本研究发现酶解法提取的罗非鱼头硫酸软骨素CS对RAW 264.7细胞和免疫抑制小鼠有免疫增强活性。体外实验表明,CS显著促进RAW264.7细胞产生NO和细胞因子来达到免疫刺激作用(P<0.05)。体内实验发现CS显著上调了CTX诱导小鼠的脾脏和胸腺指数(P<0.05),恢复肠道损伤小鼠的绒毛长度和隐窝深度,且高剂量组绒毛长度达到了330.92±21.55 μm。同时CS可以促进CTX诱导小鼠血清sIgA分泌,从而改善肠道免疫环境。本研究表明,CS是一种很有前途的免疫调节多糖,并可能成为调节免疫疾病相关功能食品的潜在材料,可为罗非鱼来源的硫酸软骨素开发利用提供理论依据。
-
表 1 小鼠体重变化(n=8)
Table 1 Weight change of mice (n=8)
时间(d) C(g) M(g) LD(g) HD(g) LH(g) 1 21.25±0.69 20.74±0.60 21.44±0.43 20.45±0.56 21.28±0.66 2 21.11±0.75 19.96±0.59 20.88±0.43 20.21±0.34 20.11±0.93 3 20.90±1.24 19.61±0.65 20.31±0.44 19.96±0.50 20.03±0.60 4 21.19±1.07a 19.06±0.76b 19.88±0.81b 19.55±0.43b 19.70±0.65b 5 21.72±1.03 19.45±0.93 19.64±1.11 19.68±0.71 20.39±0.70 6 21.60±1.15 19.20±0.50 19.63±1.22 19.66±0.59 20.28±0.56 7 21.74±1.02 19.32±0.57 19.60±1.39 19.23±0.81 20.36±0.52 8 22.00±1.23 19.35±0.45 19.63±1.05 19.19±0.90 20.28±0.59 9 22.20±0.71 19.75±0.31 20.24±0.81 19.76±0.81 20.66±0.56 10 22.30±0.69 19.68±0.33 19.96±0.89 19.75±0.93 20.68±0.57 注:不同字母表示组间有显著性差异(P<0.05)。 -
[1] AHLMANN M, HEMPEL G. The effect of cyclophospha-mide on the immune system:Implications for clinical cancer therapy[J]. Cancer Chemotherapy and Pharmacology,2016,78(4):661−671. doi: 10.1007/s00280-016-3152-1
[2] YU Q, NIE S P, WANG J Q, et al. Molecular mechanism underlying chemoprotective effects of Ganoderma atrum polysaccharide in cyclophosphamide-induced immunosuppressed mice[J]. Jou-rnal of Functional Foods,2015,15:52−60. doi: 10.1016/j.jff.2015.03.015
[3] YU H, YI X, GAO X, et al. Tilapia-head chondroitin sulfate protects against nonalcoholic fatty liver disease via modulating the gut-liver axis in high-fat-diet-fed C57BL/6 Mice[J]. Foods,2022,11(7):922. doi: 10.3390/foods11070922
[4] WANG X, YANG Y, ZOU J, et al. Chondroitin sulfate E alleviates β-amyloid toxicity in transgenic Caenorhabditis elegans by inhibiting its aggregation[J]. International Journal of Biological Macromolecules,2022,209:1280−1287. doi: 10.1016/j.ijbiomac.2022.04.124
[5] ZOU Y F, LI C Y, FU Y P, et al. Restorative effects of inulin from Codonopsis pilosula on intestinal mucosal immunity, anti-inflammatory activity and gut microbiota of immunosuppressed mice[J]. Front Pharmacol,2022,13:786141. doi: 10.3389/fphar.2022.786141
[6] WU G, MA F, XUE Y, et al. Chondroitin sulfate zinc with antibacterial properties and anti-inflammatory effects for skin wound healing[J]. Carbohydrate Polymers,2022,278:118996. doi: 10.1016/j.carbpol.2021.118996
[7] RONG H, DONG Y, ZHAO J, et al. Fetal milieu-simulating hyaluronic acid-dopamine-chondroitin sulfate hydrogel promoting angiogenesis and hair regeneration for wound healing[J]. International Journal of Biological Macromolecules, 2023:125739.
[8] GALUS A, MALLET J M, LEMBO D, et al. Hexagonal-shaped chondroitin sulfate self-assemblies have exalted anti-HSV-2 activity[J]. Carbohydrate Polymers,2016,136:113−120. doi: 10.1016/j.carbpol.2015.08.054
[9] LI L, LI Y, FENG D, et al. Preparation of low molecular weight chondroitin sulfates, screening of a high anti-complement capacity of low molecular weight chondroitin sulfate and its biological activity studies in attenuating osteoarthritis[J]. International Journal of Molecular Sciences,2016,17(10):1685. doi: 10.3390/ijms17101685
[10] VOLPI N. Chondroitin sulfate safety and quality[J]. Molecules,2019,24(8):1447. doi: 10.3390/molecules24081447
[11] 杭瑜瑜, 于淑池, 商文慧, 等. 百香果皮粉对非漂洗罗非鱼鱼糜凝胶品质的影响[J]. 食品工业科技,2022,43(19):92−97. [HANG Yuyu, YU Shuchi, SHANG Wenhui, et al. Effect of passion fruit peel powder on the gelation characteristics of non-rinsed tilapia surimi[J]. Science and Technology of Food Industry,2022,43(19):92−97.] HANG Yuyu, YU Shuchi, SHANG Wenhui, et al. Effect of passion fruit peel powder on the gelation characteristics of non-rinsed tilapia surimi[J]. Science and Technology of Food Industry, 2022, 43(19): 92−97.
[12] PEÑARUBIA O, TOPPE J, AHERN M, et al. How value addition by utilization of tilapia processing by-products can improve human nutrition and livelihood[J]. Reviews in Aquaculture,2023,15(S1):32−40. doi: 10.1111/raq.12737
[13] DOS SANTOS E A, CHAVES RIBEIRO A E, BARCELLOS T T, et al. Exploitation of byproducts from the passion fruit juice and tilapia filleting industries to obtain a functional meat product[J]. Food Bioscience,2021,41:101084. doi: 10.1016/j.fbio.2021.101084
[14] DE FREITAS S J, TORREZAN R, FURTADO A A L, et al. Nile Tilapia (Oreochromis niloticus Linnaeus, 1758) sausages developed from mechanically separated meat (MSM) and enriched with pineapple (Ananas comosus (L.) Merril) fibers[J]. Journal of Aquatic Food Product Technology,2022,31(8):801−813. doi: 10.1080/10498850.2022.2106806
[15] 左格格, 钟赛意, 陈菁, 等. 罗非鱼加工副产物不同部位硫酸软骨素的制备、理化性质及结构表征[J]. 食品科学,2022,43(24):67−73. [ZUO Gege, ZHONG Saiyi, CHEN Jing, et al. Preparation, physicochemical properties and structural characterization of chondroitin sulfate from tilapia processing by-products[J]. Food Science,2022,43(24):67−73.] doi: 10.7506/spkx1002-6630-20211013-119 ZUO Gege, ZHONG Saiyi, CHEN Jing, et al. Preparation, physicochemical properties and structural characterization of chondroitin sulfate from tilapia processing by-products[J]. Food Science, 2022, 43(24): 67−73. doi: 10.7506/spkx1002-6630-20211013-119
[16] VOLPI N. Disaccharide mapping of chondroitin sulfate of different origins by high-performance capillary electrophoresis and high-performance liquid chromatography[J]. Carbohydrate Polymers,2004,55(3):273−281. doi: 10.1016/j.carbpol.2003.09.010
[17] DUERKOP B A, VAISHNAVA S, HOOPER L V. Immune responses to the microbiota at the intestinal mucosal surface[J]. Immunity,2009,31(3):368−376. doi: 10.1016/j.immuni.2009.08.009
[18] PORTER N T, MARTENS E C. The critical roles of polysaccharides in gut microbial ecology and physiology[J]. Annual Review of Microbiology,2017,71(1):349−369. doi: 10.1146/annurev-micro-102215-095316
[19] YIN H, LI R, LIU J, et al. Fucosylated chondroitin sulfate from sea cucumber Stichopus chloronotus alleviate the intestinal barrier injury and oxidative stress damage in vitro and in vivo[J]. Carbohydrate Polymers,2024,328:121722. doi: 10.1016/j.carbpol.2023.121722
[20] WU G. Intestinal mucosal amino acid catabolism12[J]. The Journal of Nutrition,1998,128(8):1249−1252. doi: 10.1093/jn/128.8.1249
[21] 赵明明. 黑灵芝多糖对小鼠肠道黏膜免疫及黏膜损伤的影响[D]. 南昌:南昌大学, 2018. [ZHAO Mingming. Effect of polysaccharide from Ganoderma atrum on intestinal mucosal immunity and mucosal injury in mice[D]. Nanchang:Nanchang University, 2018.] ZHAO Mingming. Effect of polysaccharide from Ganoderma atrum on intestinal mucosal immunity and mucosal injury in mice[D]. Nanchang: Nanchang University, 2018.
[22] HAN M, SONG P, HUANG C, et al. Dietary grape seed proanthocyanidins (GSPs) improve weaned intestinal microbiota and mucosal barrier using a piglet model[J]. Oncotarget,2016,7(49):80313−80326. doi: 10.18632/oncotarget.13450
[23] LIU Z, LIU Z, LI L, et al. Immunomodulatory effects of the polysaccharide from Sinonovacula constricta on RAW264.7 macr-ophage cells[J]. Food Science & Nutrition,2022,10(4):1093−1102.
[24] WANG G, YAN X, YANG X, et al. Structural characterization and immunomodulatory activity of an acidic polysaccharide from walnut green husk[J]. Journal of Functional Foods,2023,110:105877. doi: 10.1016/j.jff.2023.105877
[25] CHEN S, WANG J, FANG Q, et al. A polysaccharide from natural Cordyceps sinensis regulates the intestinal immunity and gut microbiota in mice with cyclophosphamide-induced intestinal injury[J]. Food Funct,2021,12(14):6271−6282. doi: 10.1039/D1FO00596K
[26] BAI Y, ZENG Z, XIE Z, et al. Effects of polysaccharides from Fuzhuan brick tea on immune function and gut microbiota of cyclophosphamide-treated mice[J]. J Nutr Biochem,2022,101:108947. doi: 10.1016/j.jnutbio.2022.108947
[27] LIAO W, LUO Z, LIU D, et al. Structure characterization of a novel polysaccharide from Dictyophora indusiata and its macro-phage immunomodulatory activities[J]. Journal of Agricultural and Food Chemistry,2015,63(2):535−544. doi: 10.1021/jf504677r
[28] JANG A Y, MONMAI C, ROD-IN W, et al. Immune-modulation effect of Halocynthia aurantium tunic lipid on RAW264.7 cells[J]. Food Science and Biotechnology,2022,31(1):101−110. doi: 10.1007/s10068-021-01017-4
[29] AKIRA S, UEMATSU S, TAKEUCHI O. Pathogen recognition and innate immunity[J]. Cell,2006,124(4):783−801. doi: 10.1016/j.cell.2006.02.015
[30] DINARELLO C A. Immunological and inflammatory functions of the interleukin-1 family[J]. Annu Rev Immunol,2009,27:519−550. doi: 10.1146/annurev.immunol.021908.132612
[31] 王长山, 李丽, 朱喜科. 胸腺增龄性萎缩分子机制研究进展[J]. 国际免疫学杂志,2011(4):257−261. [WANG Changshan, LI Li, ZHU Xike. Progress in study on the molecular mechanism of age-related thymic involution[J]. The International Journal of Immunology,2011(4):257−261.] doi: 10.3760/cma.j.issn.1673-4394.2011.04.004 WANG Changshan, LI Li, ZHU Xike. Progress in study on the molecular mechanism of age-related thymic involution[J]. The International Journal of Immunology, 2011(4): 257−261. doi: 10.3760/cma.j.issn.1673-4394.2011.04.004
[32] CAI G, YANG Y, GU P, et al. The secretion of sIgA and dendritic cells activation in the intestinal of cyclophosphamide-induced immunosuppressed mice are regulated by Alhagi honey poly-saccharides[J]. Phytomedicine,2022,103:154232. doi: 10.1016/j.phymed.2022.154232
[33] GRAUBALLE P C, HJELT K, KRASILNIKOFF P A, et al. Elisa for Rotavirus-specific secretory IgA in human sera[J]. The Lancet,1981,318(8246):588−589. doi: 10.1016/S0140-6736(81)90981-8





 下载:
下载:

 下载:
下载:



