Effect of Bacillus Fermentation on the Quality and Bacteria Diversity of Shrimp Paste
-
摘要: 为了研究解淀粉芽孢杆菌Y11和贝莱斯芽孢杆菌Y12作为发酵剂对在较低盐分添加情况下发酵虾酱对虾酱品质和菌群变化的影响,利用毛虾为原料,以10%(w/w)作为食盐添加量,对不同发酵阶段虾酱的感官、风味、丙二醛(MDA)含量、挥发性盐基氮(TVB-N)以及细菌菌群结构进行了分析,比较单菌、混菌发酵的虾酱品质及菌群多样性变化。结果表明两种芽孢杆菌混菌发酵的虾酱与单菌和自然发酵相比,感官、颜色和风味等评定值更高;其pH在发酵过程中没有发生显著变化,在7.5~8.0之间;MDA值随发酵时间延长由0.98 mg/kg降低为0.33 mg/kg,TVB-N值在发酵10 d时最低为33.32 mg/100 g。对发酵虾酱扩增子测序结果显示,接入发酵剂后在发酵初期对菌群的相对丰度影响较大,在发酵后期,Alkalibacterium、Atopostipes、Staphylococcus和Tetragenococcus在不同组别中的相对丰度较高。研究结果为芽孢杆菌作为发酵剂在虾酱以及相关海产品发酵领域的应用提供理论依据。Abstract: The low-salt fermented shrimp pastes with 10% (w/w) salt addition were made using acetes chinensis as the substrates and Bacillus amyloliquefaciens Y11 and Bacillus velezensis Y12 as fermentation starter cultures to investigate the impact of Bacillus amyloliquefaciens Y11 and Bacillus velezensis Y12 on the quality and bacterial community diversity. Sensory evaluation, flavor analysis, MDA content, TVB-N value, and bacterial community were examined to compare the quality and microbial diversity changes of shrimp paste fermented using single-strain and mixed-strain fermentation methods. The results revealed that shrimp paste subjected to mixed-strain fermentation using two Bacillus strains exhibited higher sensory evaluation scores, color, and flavor assessment than the single-strain and natural fermentation shrimp paste. For the shrimp paste fermented with mixed Bacillus strains, the pH was between 7.5 and 8.0, and remained relatively stable throughout the fermentation process. The MDA content decreased from 0.98 mg/kg to 0.33 mg/kg with an increased fermentation time, and the lowest TVB-N value (33.32 mg/100 g) was observed after 10 days of fermentation. Amplicon sequencing of the fermented shrimp paste indicated the addition of starter cultures had a significant impact on the relative abundance of bacterial communities in the early stage of fermentation. At the end of fermentation, the relative abundance of Alkalibacterium, Atopistipes, Staphylococcus, and Tetragonococcus was relatively high in different groups. These findings provide a theoretical foundation for utilizing Bacillus strains as fermentation agents in producing shrimp paste and other related seafood products.
-
Keywords:
- Bacillus /
- shrimp paste /
- mixed-strain fermentation /
- microbial diversity /
- starter culture
-
虾酱是具有一定营养价值的传统发酵食品之一[1],一般以毛虾、虾头或者虾肉为原料。这些原料在内源酶及微生物共同作用下,经过一段时间发酵,其中的蛋白质和脂肪发生水解,转化为多肽、氨基酸和有机酸等具有生物活性的物质,同时也形成虾酱特征风味[2−5]。虾酱中微生物群落复杂,涉及到乳酸菌、芽孢杆菌等多种菌群参与[6−8]。菌株在发酵过程中产生的蛋白酶或脂肪酶等代谢物能促进虾组织的水解,进而加速发酵过程;产生的抑菌物质则可在一定程度上防止腐败发生,从而减少虾酱中盐分的添加[9]。发酵温度、时间、调味料的添加以及是否接种发酵剂都会对虾酱微生物群落组成产生影响[10−14]。
芽孢杆菌是革兰氏阳性杆菌,依靠鞭毛运动,属于好氧或兼性厌氧菌,能产生孢子。芽孢杆菌对外界环境的适应能力较强,能在比较不利的温度和pH范围下存活。芽孢杆菌及其分泌的多种代谢物具有抑菌、抗氧化等功效[15]。部分芽孢杆菌因为具有产胞外蛋白酶、酯酶和甲壳素酶的能力,可以用作发酵剂发酵虾酱[16]。研究表明芽孢杆菌在虾酱发酵的过程中对菌群和风味的变化起到了非常重要的作用[17−18]。也有研究表明从传统发酵虾酱中筛选出的枝芽孢菌ZV10-1和尼泊尔葡萄球菌JS11组合作为发酵菌株发酵虾酱,采用顶空气相色谱-离子迁移谱/质谱(HS-GC-IMS/MS)方法鉴定出虾酱中含有95种挥发性化合物,其指纹图谱与传统虾酱相似,芳香和支链醛的含量却有所增加,更有助于产生宜人香气[19]。植物乳杆菌和解淀粉芽孢杆菌混合发酵也可以缩短发酵周期,改善虾酱颜色,并可增加其中的谷氨酸含量[17]。但对芽孢杆菌作为发酵剂对虾酱细菌菌群的影响较少,还有待进一步研究。
基于目前的研究状况,本研究以前期从自然虾酱中分离的具抑菌和抗氧化功能、产蛋白酶和脂肪酶并且具有溶血安全性的解淀粉芽孢杆菌B. amyloliquefaciens Y11和贝莱斯芽孢杆菌B. velezensis Y12为发酵剂[20],参考目前低盐虾酱的盐分含量[21],以10%(w/w)作为虾酱制作食盐添加量,研究单菌和混菌发酵对虾酱品质和微生物菌群变化的影响,为虾酱发酵的方法开发提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
毛虾 锦州凌西市场;氯化钠、甲基红、溴甲酚绿、氧化镁 天津市致远化学试剂有限公司;三氯乙酸、氢氧化钠 天津市永晟精细化工有限公司;2-硫代巴比妥酸 国药集团化学试剂有限公司;其他试剂 均为国产分析纯;解淀粉芽孢杆菌Y11、贝莱斯芽孢杆菌Y12 从传统自然发酵虾酱中分离,保存于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏号分别为CGMCC No.27124、CGMCC No.27125。
FSH-2A高速均质机 常州越新仪器制造有限公司;FE20 pH计 梅特勒-托利多仪器(上海)有限公司;DK-8D恒温水浴锅 上海一恒科技有限公司;UV-2250紫外-可见光光度计 尤尼柯仪器有限公司;PEN3电子鼻 德国AIRSENCE公司。
1.2 实验方法
1.2.1 虾酱制作
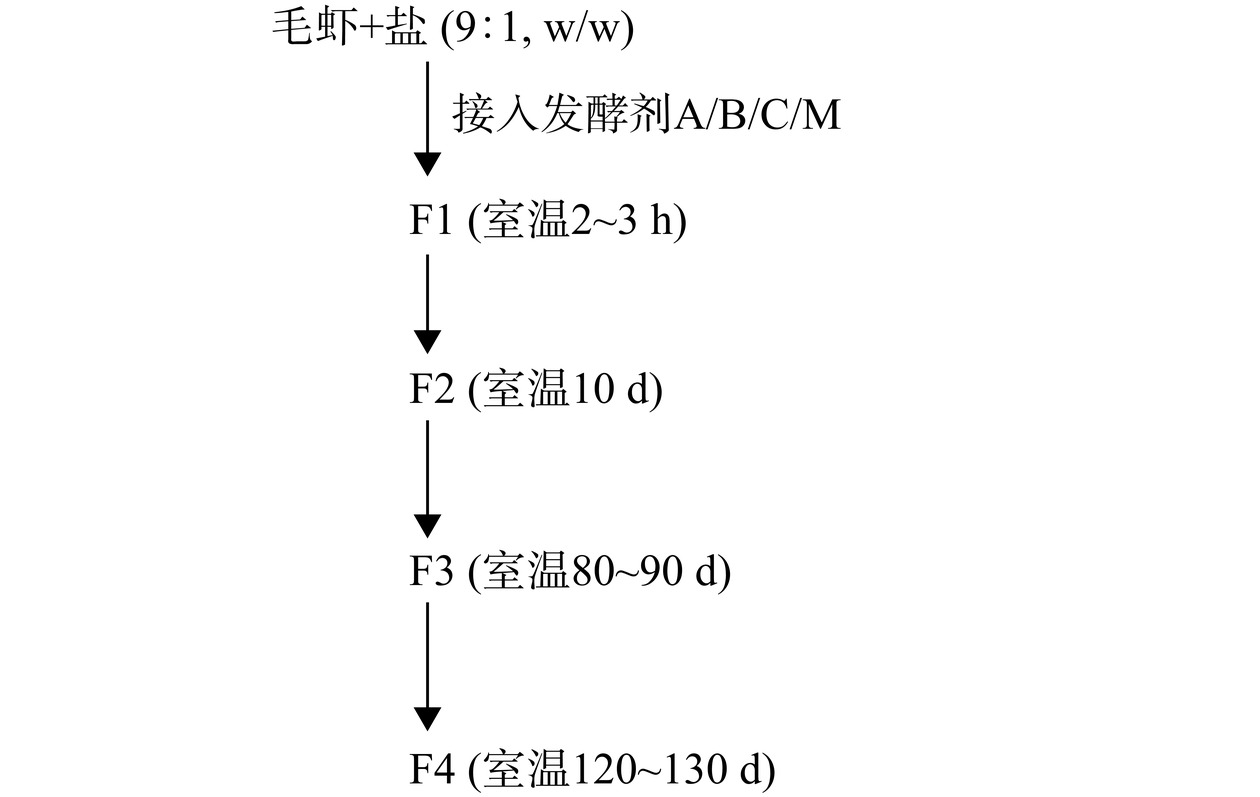
选定前期从自然虾酱中分离解淀粉芽孢杆菌B. amyloliquefaciens Y11和贝莱斯芽孢杆菌B. velezensis Y12为发酵剂,将毛虾清洗搅碎后接入发酵剂(1%,v/v),区别于传统发酵中20%~30%高盐添加量,参考目前已有制作低盐虾酱所采用的12%(w/w)的盐分含量(其盐分含量在8周发酵时间内在10%~13%区间波动)[21],本研究所采用的盐分添加量为10%(w/w),分别设置A、B、C、M四组。其中A组接入发酵剂解淀粉芽孢杆菌Y11;B组接入发酵剂贝莱斯芽孢杆菌Y12;C组为对照组(不接入菌株作为发酵剂)采取自然发酵方式;M组为同时接入发酵剂解淀粉芽孢杆菌Y11和贝莱斯芽孢杆菌Y12(1:1,v/v)进行混菌发酵,于室温(20 ℃左右)进行。在F1(发酵的起始阶段)、F2(发酵10 d)、F3(发酵80~90 d)、F4(发酵120~130 d)对四组样品分别取样(图1)。
1.2.2 虾酱感官评价
邀请10位从事食品方向的专业人员成立感官评价小组,对不同发酵虾酱样品进行感官评价。具体过程分别将不同的虾酱样品置于白色盘子中,打乱样品顺序进行感官评价,每组样品评分间隔10 min,评分过程禁止讨论。打分以虾酱的色泽、气味、质地状态为依据,满分10分,具体打分标准见表1[22]。
表 1 感官评价标准Table 1. Sensory evaluation standard指标 标准 分值 色泽 粉红色 2.1~3.0 暗红色 1.1~2.0 红色变淡,显示灰色 0~1.0 气味 鲜香无腥味 3.1~4.0 有一定鲜香气味、有少许腥味、无臭味 2.1~3.0 鲜香味道一般、有腥味、无臭味 1.1~2.0 以腥味为主、无鲜香味、有臭味 0~1.0 质地 质地黏稠、细腻 2.1~3.0 质地较稀 1.1~2.0 质地稀、不均匀 0~1.0 1.2.3 虾酱颜色测定
分别将不同虾酱样品置于白色盘子中,采用色差计对所取样品进行测定,得到样品L*、a*、b*值,评价不同发酵时间段单菌、混菌发酵与自然发酵状态下虾酱样品颜色的变化。
1.2.4 虾酱pH测定
以GB 5009.237-2016《食品安全国家标准 食品pH值的测定》为参照进行适当修改。在超净台中称取5 g发酵虾酱样品放置于无菌烧杯中,加入45 mL去离子水,均质5 min,将烧杯盖上无菌保鲜膜,放置于4 ℃冰箱中静置30 min后,用pH计对样品进行检测,每组样品测定三次。
1.2.5 虾酱电子鼻分析
称取发酵虾酱样品10 g于无菌烧杯中密封,采用电子鼻对烧杯内气体进行分析。调节电子鼻软件取样间隔为1 s,检测时间为120 s,最终选择110 s至115 s稳定的数值进行分析,采用WinMuster软件处理电子鼻测定各个样品的响应值。电子鼻传感器如表2所示。
表 2 电子鼻传感器Table 2. Sensors of the electronic nose传感器 传感器特征 R1 对芳香化合物敏感 R2 对氮氧化合物敏感 R3 对芳香化合物和氨敏感 R4 对氢化合物敏感 R5 对烷烃敏感 R6 对碳氢化合物敏感 R7 对硫化氢敏感 R8 对醇类敏感 R9 对有机硫化物和芳香化合物敏感 R10 对烷烃敏感 1.2.6 虾酱中丙二醛(MDA)含量测定
依据GB 5009.181-2016《食品安全国家标准 食品中丙二醛的测定》方法,称取10 g发酵虾酱样品于150 mL无菌烧杯中,加入25 mL的无菌去离子水,用高速均质机将其搅碎,再加入25 mL 10%三氯乙酸,搅匀后常温下静置30 min。用双层滤纸进行过滤后,用移液枪吸取5 mL上清液于试管中,以加入5 mL的三氯乙酸为对照,吸取5 mL的0.02 mol/L硫代巴比妥酸溶液,放置于90 ℃的水浴锅中反应30 min后取出,冷却至室温取部分上清液于比色皿中,使用紫外分光光度计在OD532 nm处测定吸光度。
1.2.7 虾酱挥发性盐基氮(TVB-N)含量测定
以GB 5009.228-2016《食品安全国家标准 食品中挥发性盐基氮的测定》方法中的自动凯氏定氮法为参考进行适当修改。将标准硼酸溶液和氢氧化钠溶液加入自动凯氏定氮仪中,加入30 mL去离子水进行空白试样测定,记录取得的空白值。将发酵虾酱样品搅碎,称取10 g发酵样品和1 g氧化镁置于凯氏定氮仪的蒸馏管底部,设置参数后对发酵虾酱样品进行TVB-N值的测定。
1.2.8 虾酱菌群多样性分析
按照发酵时间点分别对虾酱样品进行取样,使用Ezup柱基因组DNA纯化试剂盒提取总基因组DNA。获取的DNA样品用干冰寄送至诺禾致源(北京)使用Illumina HiSeq平台对16S rRNA基因进行测序。探究发酵虾酱细菌菌群结构。
1.3 数据处理
每组实验独立重复3次,实验结果采用平均值±标准差(±s)表示,使用SPSS 22.0和Graphpad Prism 9进行数据分析和绘图,采用双因素方差分析,P<0.05具有显著性。
2. 结果与分析
2.1 虾酱感官评价
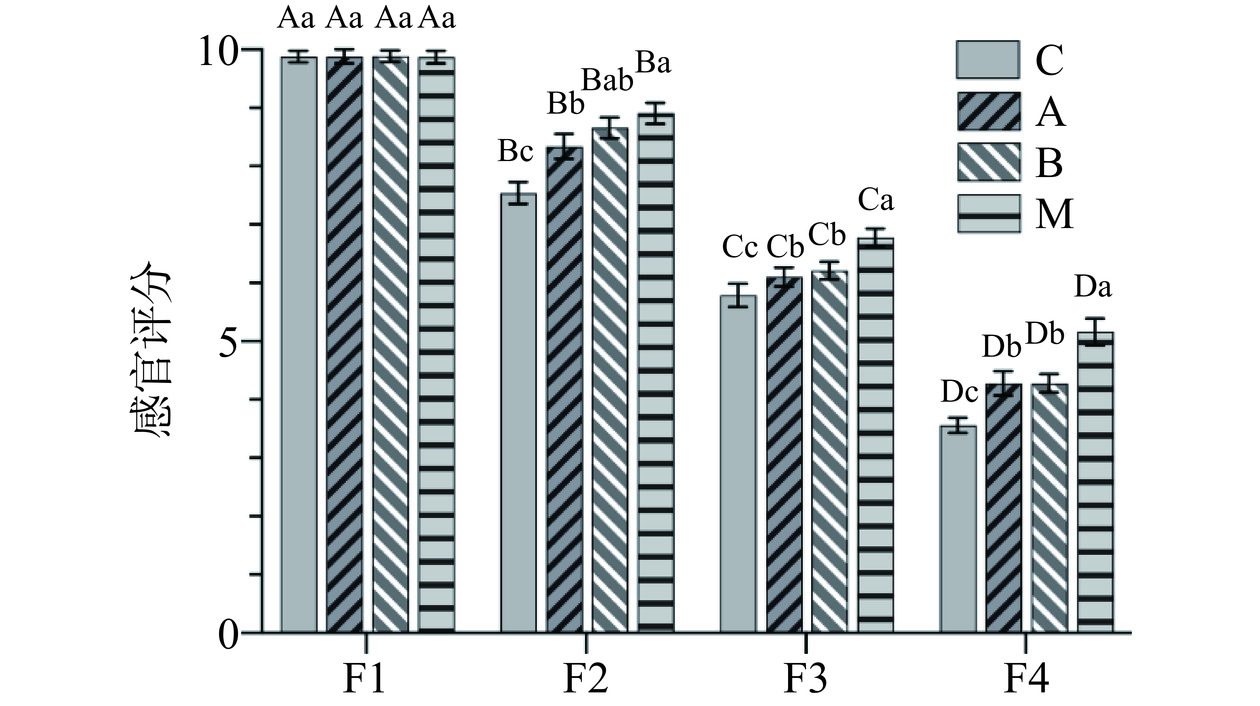
对发酵过程中虾酱样品进行感官评价(如图2),随着发酵时间延长,不同组别虾酱样品的感官评分整体呈现下降趋势,主要是由于腥味增加以及胺味的产生,F4阶段样品的感官评分最差,但所有样品整体感官评分值大于3分,在可接受范围内。F1阶段为发酵起始阶段,此时虾酱样品的色泽在不同组别间主要都以粉红色为主,鲜香味道比较明显,质地黏稠、细腻;F2阶段感官评价整体值略有降低,腥味逐渐产生,此时混菌发酵M组鲜香味道更浓,颜色呈现粉红色,并且感官评价显著优于B. amyloliquefaciens Y11发酵组(P<0.05),与B. velezensis Y12发酵组无显著差异;在随后的F3和F4发酵阶段,虾酱感官评分持续下降,不仅质地变稀,同时颜色变得暗沉;F3和F4发酵阶段内,自然发酵组虾酱感官评分最低,采用B. amyloliquefaciens Y11和B. velezensis Y12单独作为发酵剂的A组和B组则显著优于自然发酵组(P<0.05),混菌发酵M组感官评价最优。发酵时间是影响虾酱风味的一个非常重要的因素。随着发酵时间的延长虾酱中氨基酸态氮和多肽含量增加,醛、酮、酯、吡嗪和呋喃类挥发性化合物的含量增加都会在一定程度上影响虾酱的风味[23]。但是发酵时间过长,原料过度分解容易产生一些不被消费者接受的风味,并且一些腐败菌和致病菌的繁殖也给虾酱的食用安全带来了风险。发酵剂的加入则可以缩短发酵时间,促进风味物质的形成[19]。本研究所采用两种芽孢杆菌混菌发酵可以使虾酱在比较短时间内达到消费者感官可接受水平。
2.2 虾酱颜色变化分析
通过色差计对不同样品的色差值进行分析,L*值表示明暗程度、a*值表示红绿程度、b*值表示黄蓝程度[1]。研究结果(表3)表明,F1阶段,单菌发酵A组L*显著低于其他各组(P<0.05),而单菌发酵B组的a*、b*与其他各组相比更高。在F2阶段,混菌发酵M组的L*、a*、b*均高于其他各组,单菌发酵B组和自然发酵组在L*、a*没有显著差异,其 b*最低。在F3阶段,混菌发酵M组的L*、a*、b*仍显著高于其他各组(P<0.05),单菌发酵A和B组a*值、b*值与自然发酵组差异不大。F4阶段,各组样品L*、a*、b*值基本呈现下降的趋势,此结果与感官评价的结果基本一致。有研究表明,虾酱颜色变化与美拉德产物和虾青素含量变化有关,美拉德产物的形成会使虾酱显现出棕色;虾酱的粉红色泽则受到虾青素含量的影响,在发酵初期由于干燥和盐渍脱水,虾青素得到浓缩[24],同时虾青素一般与虾青蛋白结合存在,而发酵过程产生的酶等可破坏两者结合的化学键,虾青素得到释放[9],含量增加,使得虾酱呈现出粉红色泽;但是虾青素的化学性质不稳定,在光和氧等外界条件的影响下会发生分解[25],这会导致随着发酵时间的延长,虾酱的颜色变得暗沉。因此颜色变化的差异也能在一定程度上反映虾酱发酵的状态,证实加入发酵剂发酵可以在一定程度上加速发酵的进程,混菌发酵效果更为明显。
表 3 虾酱样品不同发酵阶段颜色变化Table 3. Color changes of shrimp paste at different fermentation stages不同发酵阶段 组别 L* a* b* F1 C组 53.51±0.60a 10.49±1.12b 11.61±0.89b A组 52.46±0.64b 9.92±0.71c 10.52±0.46c B组 53.67±2.07a 11.50±0.81a 13.37±0.44a M组 53.48±0.70a 10.31±0.05b 13.33±1.19a F2 C组 51.64±2.04c 11.85±0.58c 11.29±0.83b A组 52.73±1.15b 12.06±0.46b 12.01±0.60a B组 51.12±1.26c 11.66±0.83c 10.92±0.83c M组 53.18±1.49a 13.13±0.42a 12.67±0.91a F3 C组 48.76±0.63b 11.94±0.57b 10.97±0.41b A组 48.07±1.44b 11.16±0.94b 10.70±0.91b B组 47.47±0.90c 11.53±0.46b 10.91±0.50b M组 52.12±0.43a 12.17±0.44a 12.14±0.16a F4 C组 47.39±0.84b 9.41±0.32c 9.99±0.36c A组 47.98±1.67b 10.50±0.92b 10.79±0.98b B组 47.37±1.62b 11.32±0.58a 11.76±0.59a M组 48.83±1.29a 9.70±0.79c 10.81±0.81b 注:不同小写字母代表同一发酵阶段内接种或不接种发酵剂虾酱样品间显著性差异(P<0.05)。 2.3 虾酱pH变化分析
发酵过程中虾酱样品pH变化如图3。在发酵F1阶段,混菌发酵M组、单菌发酵B组和自然发酵组C组发酵虾酱样品pH没有明显变化;F2阶段,pH整体较F1阶段有所上升,自然发酵组和解淀粉芽孢杆菌Y11发酵的A组pH略高于B组;F3阶段较前两个阶段pH下降较为明显,原因可能是由于新鲜的毛虾体内的糖原会随着发酵时间的增加而分解成酸类物质,使其pH下降;而F4阶段样品的pH整体与F1阶段pH没有显著差异(P>0.05),可能是由于发酵剂的添加影响了虾酱中菌群的代谢活动所产生的生物胺等碱类物质的含量[26],发酵剂B. amyloliquefaciens Y11、B. velezensis Y12和样品中内在微生物生长和繁殖,产生了挥发性化合物如氨等,所带来的影响主要为嗜碱菌等在虾酱发酵过程中的急剧增加,使pH出现升高。综合分析可知B. amyloliquefaciens Y11对pH的影响较为明显。总体来说,本研究发酵虾酱pH在整体发酵期间内基本保持稳定。其他相关研究也发现虾酱的pH在7.5左右[27],这也与本研究所分析结果一致。
2.4 虾酱电子鼻分析
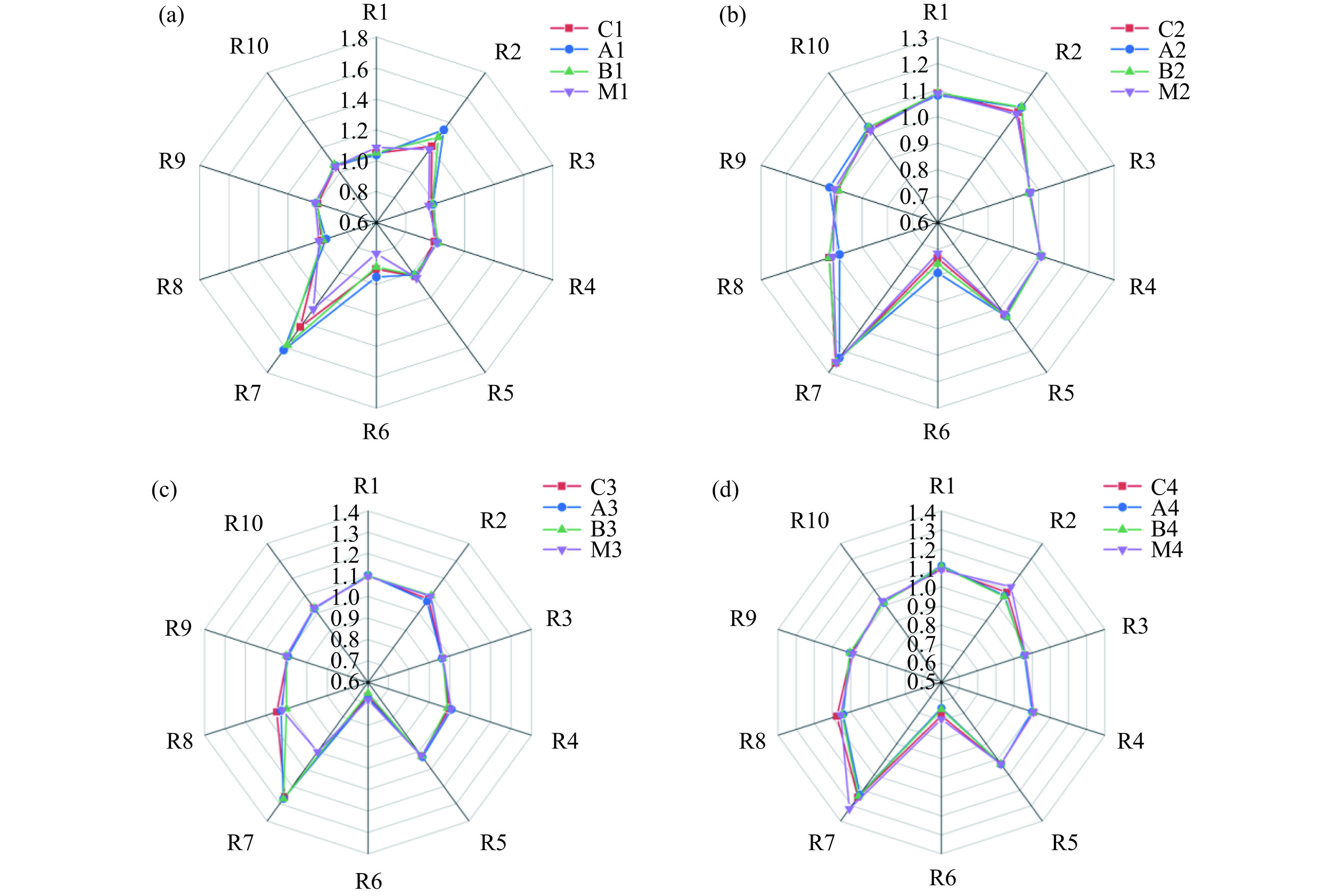
虾酱电子鼻分析结果如图4所示。在F1阶段,各组样品在R7(含硫化合物)和R2(氮氧化合物)检测器响应值较高,不同样品之间存在差别,其中A1组的信号最强。在F2~F4阶段,R7和R2检测器依然有比较高的响应值,含硫化合物信号强度最高,从F2阶段开始,其他检测器的响应值明显增高,说明虾酱中风味由于发酵的作用开始变得多样化。可以检测到芳香化合物、碳氢化合物和烷烃等物质,氨类物质的检测的信号强度(R3)与其他检测器相比较低,F2阶段,各样品电子鼻数据相差不大。F3阶段,M组样品R7(含硫化合物)检测器响应值相比于其他样品有所降低,但是在F4阶段又发生升高。总的来说,电子鼻不能很好地区分不同发酵虾酱样品的气味差异。
2.5 虾酱MDA值测定
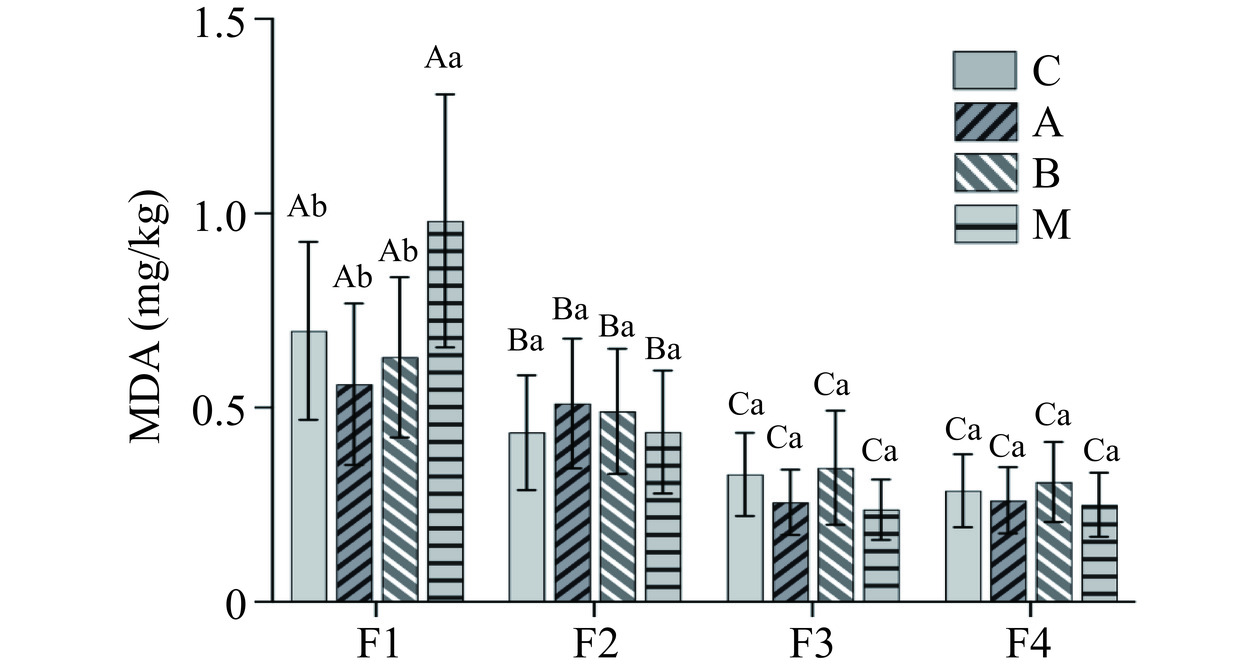
MDA含量可以用来评估发酵食品中脂肪氧化程度(图5)。在不同的发酵阶段,整体上混菌发酵M组、单菌发酵A组、B组和自然发酵组C组MDA值呈现下降趋势,其中F3阶段和F4阶段MDA值不存在显著差异;除F1阶段外,在其他发酵阶段内,接种和不接种发酵剂的各个虾酱样品之间的MDA值不存在显著差异(P>0.05),说明在发酵过程中,发生的氧化程度较低,是否接种发酵剂对MDA值变化影响不大。在实验中也发现,在发酵初期(F1),接入混菌发酵的M组虾酱样品MDA值高于其他组,约为0.98 mg/kg,但是在其他各个发酵阶段M组虾酱样品的MDA值发生下降,在F4阶段降低为0.33 mg/kg,这可能与菌株的代谢活性有关。脂质氧化产物硫代巴比妥酸(TBARS)等与肉和油中的酸败和异味形成有关,但是另一些物质苯甲醛、苯乙醛和3-甲基丁醛则具有麦芽味、焦糖味,有可能参与改善虾酱风味[19],因此需要合理优化发酵条件,将脂质氧化控制在一个合理的范围内。
2.6 虾酱挥发性盐基氮值测定
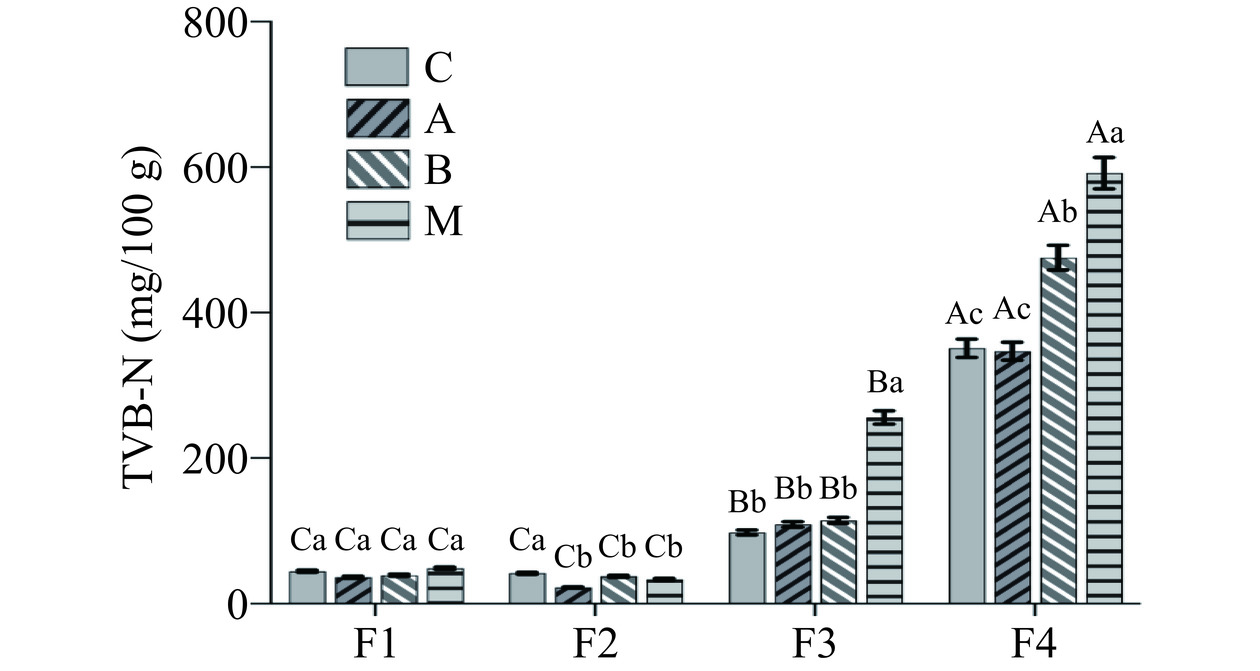
虾酱在不同发酵阶段下TVB-N值变化见图6,在发酵前期F1阶段,混菌发酵组M组、单菌发酵组A组、B组和自然发酵组C组TVB-N值没有显著差异;F2阶段,TVB-N值与F1阶段相比无显著变化,单菌发酵和混菌发酵虾酱的TVB-N值发生下降,解淀粉芽孢杆菌Y11和贝莱斯芽孢杆菌Y12以及两种芽孢杆菌混菌发酵的TVB-N值分别为22.12、37.52、33.32 mg/100 g;在F3阶段,TVB-N值较前两个阶段相比,显著上升(P<0.05),自然发酵组和两个单菌发酵组的TVB-N无显著差异(P>0.05),混菌发酵虾酱样品TVB-N值则显著增加(P<0.05),说明混菌发酵相对于单菌和自然发酵加速了发酵的过程,促进了对蛋白的分解和利用。有研究报道表明盘锦、荣成、寿光、大连、唐山、秦皇岛、烟台等地的不同虾酱样品的TVB-N值在200~430 mg/100 g之间[8],一般市售农家制作虾酱成熟的发酵周期普遍为3~6个月,这也与本研究自然发酵虾酱在120~130 d的TVB-N值一致。但在F4发酵阶段混菌发酵组M组TVB-N值较高,为591.92±21.55 mg/100 g,进一步说明芽孢杆菌混菌发酵提高了发酵速度。有研究表明较高的TVB-N是由于生物胺类物质增加引起的,例如尸胺、腐胺、组胺等的存在,由于生物胺会引发过敏和中毒,会带来一定的食用安全隐患[28]。根据《食品安全国家标准鲜(冻)畜、禽产品》(GB 2707-2016)规定,TVB-N值在海水虾中的最大限量值为30 mg/100 g。虾酱中的TVB-N值普遍偏高,结合本研究对F2阶段样品TVB-N值的观察,接入一定芽孢杆菌发酵剂发酵10 d左右的虾酱比较适宜食用,需要对虾酱发酵的工艺再进行优化。
2.7 虾酱微生物群落变化分析
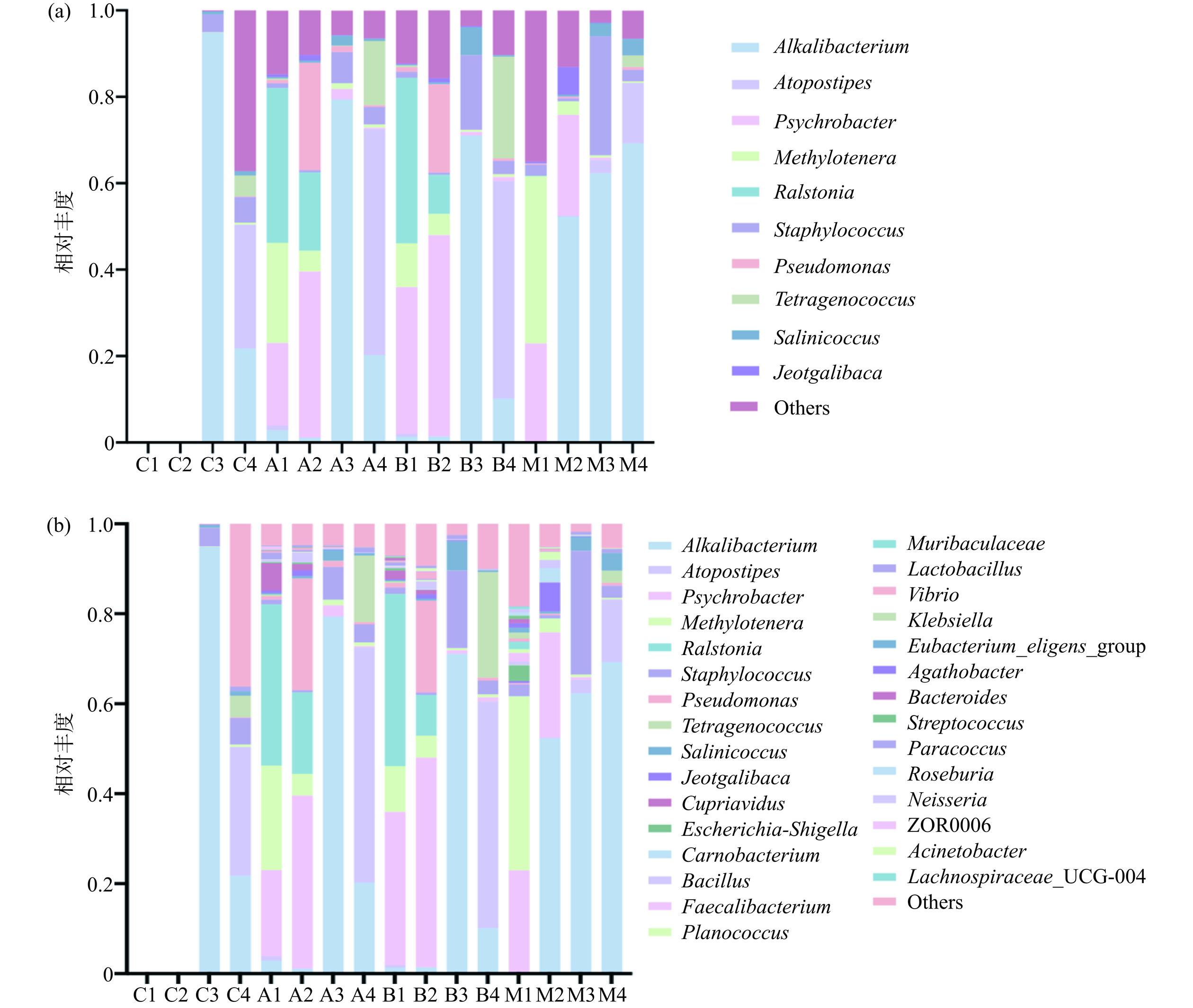
采用扩增子测序对虾酱的细菌微生物多样性进行分析(图7),在属水平前10种微生物主要有:Alkalibacterium(嗜盐嗜碱菌)、Atopostipes(肉杆菌)、Psychrobacter(嗜冷杆菌)、Jeotgalibaca(咸海鲜芽孢杆菌)、Methylotenera(甲基营养型反硝化菌)、Ralstonia(罗尔斯通菌)、Staphylococcus(葡萄球菌)、Pseudomonas(假单胞菌)、Tetragenococcus(金黄色四联球菌)、Salinicoccus(盐水球菌),为虾酱发酵过程中的主要优势菌群。
研究结果表明,对于自然发酵虾酱F1、F2阶段采用本实验方法和相同取样量没有检测到菌群的存在,可能由于其中菌群的丰度较低以及样品DNA降解的原因;在F3发酵阶段Alkalibacterium丰度最高,菌群多样性较低,在F4阶段,菌群多样性增高,说明自然发酵虾酱菌群丰度和多样性的增加需要时间较长。A、B和M组在F1阶段,可检测到多个属的菌群存在,但菌群丰度有所不同。单菌发酵A组、B组Ralstonia、Psychrobacter、Methylotenera三种微生物占比较高,混菌发酵组M组Psychrobacter、Methylotenera两种微生物相对丰度较高,Ralstonia微生物相对于A组、B组较低,但整体的微生物相对丰度分布的趋势较为相近。在F2阶段中,单菌发酵组A组、B组中Psychrobacter微生物相对丰度仍在增加,但Ralstonia在此阶段有明显的减少趋势,Methylotenera也在相对减少,但在混菌发酵组M中,与A组、B组不同的是,Alkalibacterium在第二阶段呈现出迅速增加的状态。在发酵时间达到80~90 d时,A组、B组中Alkalibacterium、Staphylococcus逐渐占据优势地位。在F4阶段,除了一些无法鉴定的菌种,在不同组别中Alkalibacterium、Atopostipes、Staphylococcus和Tetragenococcus的相对丰度都较高。
虾酱中细菌群落的构成与地域和发酵工艺有关,同时也在很大程度上决定了虾酱的品质和风味。研究发现泰国虾酱中,在发酵初级阶段,Salimicrobium spp.(53.6%)和Salinicoccus spp.(44.0%)丰度最高,随着发酵时间的延长,菌群的多样性和丰度也发生变化,Alkalibacterium、Macrococcus caseolyticus、Jeotgalicoccus psychophillus和Staphylococcus spp.等则逐渐占据优势[24]。可以分泌氨肽酶的细菌的存在由于可通过水解提高与滋味形成有关的二肽和三肽的含量,因此对虾酱滋味的形成非常重要。Alkalibacterium spp.、Jeotgalicoccus spp.、Lentibacillus spp.、Salimicrobium spp.、Salinicoccus spp.和Staphylococcus spp.等菌株的存在都与水产品风味肽的形成有关,包括γ-Glu-Val-Gly和γ-Glu-Val等[6]。另外Tetragenococcus以及Pseudomonas与非有机硫化物、氮氧化物以及长链烷烃的形成有关,Psychrobacter等与酯类等芳香化合物的形成有关[10,29]。菌群组成与电子鼻初步分析结果较为一致,同时混菌发酵菌群在F1阶段与自然发酵虾酱菌群C4组成类似,也进一步证实了混菌发酵可以缩短虾酱制作时间,可以在较短时间内获得类似自然发酵虾酱风味。
3. 结论
本研究以B. amyloliquefaciens Y11、B. velezensis Y12菌作为发酵剂,探究单菌和混菌发酵在四个不同时间段对发酵虾酱样品的理化指标及菌群结构变化的影响。结果表明加入混菌发酵M组、单菌发酵A组、B组发酵虾酱样品与自然发酵组C组相比,其理化指标如感官、颜色等,化学指标如MDA值、TVB-N值以及菌群结构变化等都存在一定的差别。其中对混菌发酵的样品来说,在10~80 d品质较好,120 d左右混菌发酵虾酱样品的品质指标变化较大,可能会具有一些潜在食用安全隐患。综上分析,研究表明加入发酵剂可使发酵虾酱的品质及菌群结构发生改变,但要控制接入发酵剂的含量及发酵时间的长短。本研究对芽孢杆菌菌株作为发酵剂在发酵虾酱中的应用提供理论依据。
-
表 1 感官评价标准
Table 1 Sensory evaluation standard
指标 标准 分值 色泽 粉红色 2.1~3.0 暗红色 1.1~2.0 红色变淡,显示灰色 0~1.0 气味 鲜香无腥味 3.1~4.0 有一定鲜香气味、有少许腥味、无臭味 2.1~3.0 鲜香味道一般、有腥味、无臭味 1.1~2.0 以腥味为主、无鲜香味、有臭味 0~1.0 质地 质地黏稠、细腻 2.1~3.0 质地较稀 1.1~2.0 质地稀、不均匀 0~1.0 表 2 电子鼻传感器
Table 2 Sensors of the electronic nose
传感器 传感器特征 R1 对芳香化合物敏感 R2 对氮氧化合物敏感 R3 对芳香化合物和氨敏感 R4 对氢化合物敏感 R5 对烷烃敏感 R6 对碳氢化合物敏感 R7 对硫化氢敏感 R8 对醇类敏感 R9 对有机硫化物和芳香化合物敏感 R10 对烷烃敏感 表 3 虾酱样品不同发酵阶段颜色变化
Table 3 Color changes of shrimp paste at different fermentation stages
不同发酵阶段 组别 L* a* b* F1 C组 53.51±0.60a 10.49±1.12b 11.61±0.89b A组 52.46±0.64b 9.92±0.71c 10.52±0.46c B组 53.67±2.07a 11.50±0.81a 13.37±0.44a M组 53.48±0.70a 10.31±0.05b 13.33±1.19a F2 C组 51.64±2.04c 11.85±0.58c 11.29±0.83b A组 52.73±1.15b 12.06±0.46b 12.01±0.60a B组 51.12±1.26c 11.66±0.83c 10.92±0.83c M组 53.18±1.49a 13.13±0.42a 12.67±0.91a F3 C组 48.76±0.63b 11.94±0.57b 10.97±0.41b A组 48.07±1.44b 11.16±0.94b 10.70±0.91b B组 47.47±0.90c 11.53±0.46b 10.91±0.50b M组 52.12±0.43a 12.17±0.44a 12.14±0.16a F4 C组 47.39±0.84b 9.41±0.32c 9.99±0.36c A组 47.98±1.67b 10.50±0.92b 10.79±0.98b B组 47.37±1.62b 11.32±0.58a 11.76±0.59a M组 48.83±1.29a 9.70±0.79c 10.81±0.81b 注:不同小写字母代表同一发酵阶段内接种或不接种发酵剂虾酱样品间显著性差异(P<0.05)。 -
[1] LI W Y, LU H Q, HE Z H, et al. Quality characteristics and bacterial community of a Chinese salt-fermented shrimp paste[J]. LWT-Food Science and Technology,2021,136:110358. doi: 10.1016/j.lwt.2020.110358
[2] CHEN G, CHEN C C, LEI Z H. Meta-omics insights in the microbial community profiling and functional characterization of fermented foods[J]. Trends in Food Science & Technology,2017,65:23−31.
[3] CHEOK C Y, SOBHI B, ADZAHAN N M, et al. Physicochemical properties and volatile profile of chili shrimp paste as affected by irradiation and heat[J]. Food Chemistry,2017,216:10−18. doi: 10.1016/j.foodchem.2016.08.011
[4] FAITHONG N, BENJAKUL S, PHATCHARAT S, et al. Chemical composition and antioxidative activity of Thai traditional fermented shrimp and krill products[J]. Food Chemistry,2010,119(1):133−140. doi: 10.1016/j.foodchem.2009.06.056
[5] KLEEKAYAI T, HARNEDY P A, O’KEEFFE M B, et al. Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J]. Food Chemistry,2015,176:441−447. doi: 10.1016/j.foodchem.2014.12.026
[6] PHEWPAN A, PHUWAPRISIRISAN P, TAKAHASHI H, et al. Microbial diversity during processing of Thai traditional fermented shrimp paste, determined by next generation sequencing[J]. LWT-Food Science and Technology,2019,122:108989.
[7] LI W Y, MI S, LIU X C, et al. Variations in the physicochemical properties and bacterial community composition during fermentation of low-salt shrimp paste[J]. Food Research International,2022,154:111034. doi: 10.1016/j.foodres.2022.111034
[8] SANG X, MA X X, HAO H S, et al. Evaluation of biogenic amines and microbial composition in the Chinese traditional fermented food grasshopper sub shrimp paste[J]. LWT-Food Science and Technology,2020,134:109979. doi: 10.1016/j.lwt.2020.109979
[9] CAI L Y, WANG Q J, DONG Z J, et al. Biochemical, nutritional, and sensory quality of the low salt fermented shrimp paste[J]. Journal of Aquatic Food Product Technology,2017,26(6):706−718. doi: 10.1080/10498850.2016.1276111
[10] YAO Y P, ZHOU X Y, HADIATULLAH H, et al. Determination of microbial diversities and aroma characteristics of Beitang shrimp paste[J]. Food Chemistry,2021,344:128695. doi: 10.1016/j.foodchem.2020.128695
[11] LÜ X R, LI Y, CUI T Q, et al. Bacterial community succession and volatile compound changes during fermentation of shrimp paste from Chinese Jinzhou region[J]. LWT-Food Science and Technology,2019,122:108998.
[12] NAKAMURA A, KONDO A, TAKAHASHI H, et al. Microbiological safety and microbiota of Kapi, Thai traditional fermented shrimp paste, from different sources[J]. LWT-Food Science and Technology,2021,154:112763.
[13] 班雨函, 米思, 韩军, 等. 香辛料对低盐虾酱中生物胺和风味的影响[J]. 中国食品学报,2023,23(12):153−166. [BAN Y H, MI S, HAN J, et al. Effect of spices on biogenic amine and flavor in low-salt shrimp paste[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(12):153−166.] BAN Y H, MI S, HAN J, et al. Effect of spices on biogenic amine and flavor in low-salt shrimp paste[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(12): 153−166.
[14] YU J, LU K, DONG X F, et al. Virgibacillus sp. SK37 and Staphylococcus nepalensis JS11 as potential starters to improve taste of shrimp paste[J]. LWT-Food Science and Technology,2022,154:112657. doi: 10.1016/j.lwt.2021.112657
[15] RHAYAT L, MARESCA M, NICOLETTI C, et al. Effect of Bacillus subtilis strains on intestinal barrier function and inflammatory response[J]. Frontiers in Immunology,2019,10:564. doi: 10.3389/fimmu.2019.00564
[16] PONGSETKUL J, BENJAKUL S, SUMPAVAPOL P, et al. Bacillus subtilis K-C3 isolated from Thai salted shrimp paste (Kapi):Its extracellular enzymes and use as a starter culture in Kapi production[J]. Journal of Food Biochemistry,2018,42(6):e12649. doi: 10.1111/jfbc.12649
[17] PRIHANTO A A, NURDIANI R, JATMIKO Y D, et al. Physicochemical and sensory properties of terasi (an Indonesian fermented shrimp paste) produced using Lactobacillus plantarum and Bacillus amyloliquefaciens[J]. Microbiological Research,2021,242:126619. doi: 10.1016/j.micres.2020.126619
[18] PONGSETKUL J, BENJAKUL S, BOONCHUEN P. Bacillus subtilis K-C3 as potential starter to improve nutritional components and quality of shrimp paste and corresponding changes during storage at two alternative temperatures[J]. Fermentation,2023,9(2):107. doi: 10.3390/fermentation9020107
[19] YU J, LU K, ZI J W, et al. Halophilic bacteria as starter cultures:A new strategy to accelerate fermentation and enhance flavor of shrimp paste[J]. Food Chemistry,2022,393:133393. doi: 10.1016/j.foodchem.2022.133393
[20] 檀茜倩, 王丹, 程笑笑, 等. 虾酱源芽孢杆菌的筛选及其益生特性[J]. 中国食品学报,2023,23(12):51−60. [TAN X Q, WANG D, CHENG X X, et al. Screening and probiotic characteristics of shrimp paste originated Bacillus spp J]. Journal of Chinese institute of Food Science and Technology,2023,23(12):51−60.
[21] YANG B B, LIU Y L, SANG Y X, et al. Bacterial diversity and physicochemical properties of low-salt shrimp paste fermented at different temperatures[J]. LWT-Food Science and Technology,2023,187:115277. doi: 10.1016/j.lwt.2023.115277
[22] CHUKEATIROTE E, ARFARITA N, NIAMSUP P, et al. Phenotypic and genetic characterization of Bacillus species exhibiting strong proteolytic activity isolated from terasi, an indonesian fermented seafood product[J]. Journal of Northeast Agricultural University (English Edition),2015,22(4):15−22. doi: 10.1016/S1006-8104(16)30014-9
[23] 栾宏伟, 朱文慧, 祝伦伟, 等. 不同发酵时间对乌虾酱风味的影响[J]. 食品工业科技,2020,41(12):75−87. [LUAN H W, ZHU W H, ZHU L W, et al. Effect of different fermentation time on the flavor of shrimp paste[J]. Science and Technology of Food Industry,2020,41(12):75−87.] LUAN H W, ZHU W H, ZHU L W, et al. Effect of different fermentation time on the flavor of shrimp paste[J]. Science and Technology of Food Industry, 2020, 41(12): 75−87.
[24] PONGSETKUL J, BENJAKUL S, VONGKAMJAN K, et al. Changes in volatile compounds, ATP-related compounds and antioxidative properties of Kapi, produced from Acetes vulgaris, during processing and fermentation[J]. Food Bioscience,2017,19:49−56. doi: 10.1016/j.fbio.2017.06.002
[25] YAO Q M, MA J Q, CHEN X M, et al. A natural strategy for astaxanthin stabilization and color regulation:Interaction with proteins[J]. Food Chemistry,2023,402:134343. doi: 10.1016/j.foodchem.2022.134343
[26] SANG X, LI K X, ZHU Y L, et al. The impact of microbial diversity on biogenic amines formation in grasshopper sub shrimp paste during the fermentation[J]. Frontiers in Microbiology,2020,11:782. doi: 10.3389/fmicb.2020.00782
[27] PONGSETKUL J, BENJAKUL S, BOONCHUEN P. Changes in volatile compounds and quality characteristics of salted shrimp paste stored in different packaging containers[J]. Fermentation,2022,8(2):69. doi: 10.3390/fermentation8020069
[28] FENG C, TEUBER S, GERSHWIN M E. Histamine (Scombroid) fish poisoning:A comprehensive review[J]. Clinical Reviews in Allergy & Immunology,2016,50(1):64−69.
[29] CHE H X, YU J, SUN J Y, et al. Bacterial composition changes and volatile compounds during the fermentation of shrimp paste:Dynamic changes of microbial communities and flavor composition[J]. Food Bioscience,2021,43:101169. doi: 10.1016/j.fbio.2021.101169





 下载:
下载:

 下载:
下载:



