Preliminary Investigation of the Immunomodulatory Capacity of Mixed Lactobacillus plantarum by in Vitro and in Vivo Experiments
-
摘要: 目的:通过体外体内实验研究混合植物乳杆菌的免疫调节能力。方法:采用CCK8法观察混合植物乳杆菌对巨噬细胞的增殖能力影响。采用巨噬细胞吞噬中性红法检测混合植物乳杆菌对巨噬细胞吞噬能力的影响。采用NO、TNF-α、IL-6、IL-1β试剂盒测定混合植物乳杆菌促巨噬细胞分泌细胞因子能力。将健康的BALB/c小鼠随机分为3组,即空白组(NC组)、模型组(MC组)、混合植物乳杆菌组(Mix组)。记录实验室小鼠建模前、后和最终体重。并在小鼠处死后测定各实验组脾脏、胸腺指数,以及脾淋巴细胞增殖能力和自然杀伤细胞(NK)活性。结果:与空白组相比,MOI=1、10、100时混合植物乳杆菌无细胞毒性,并且能显著促进巨噬细胞的增殖(P<0.05)(MOI=1、10、100、1000。1,10,100,1000分别代表混合植物乳杆菌与RAW 264.7巨噬细胞感染复数(MOI)为1:1,10:1,100:1,1000:1)。当MOI=100时,混合植物乳杆菌的最高相对增殖率为176.75%。与空白组相比,各MOI值下混合植物乳杆菌均能显著提高巨噬细胞的吞噬能力(P<0.05),表现出良好的免疫活性。特别是在MOI=100时,混合植物乳杆菌组细胞的吞噬活性(A540=0.80)显著优于LPS组(A540=0.55)(P<0.05)。当MOI=1、10、100时混合植物乳杆菌组与空白组相比,能显著上调巨噬细胞分泌NO和细胞因子水平(P<0.05)。当MOI=100时巨噬细胞NO分泌量为27.32 µmol/L、TNF-α分泌量为116.97 pg/mL、IL-6分泌量为41.98 pg/mL、IL-1β分泌量为149.88 pg/mL。与MC组相比,混合植物乳杆菌的摄入增加了小鼠的体重、上调脾脏指数和胸腺指数。同时,对由环磷酰胺造成的脾淋巴细胞损伤有显著促增殖的作用(P<0.05)。与MC组相比,Mix组能够显著提高小鼠NK细胞活性(P<0.05),达到41.72%。结论:混合植物乳杆菌具有免疫调节活性,是一种良好的免疫调节剂。Abstract: Objective: To study the immunomodulatory capacity of Lactobacillus plantarum mixed by in vitro and in vivo experiments. Methods: The effect of Lactobacillus plantarum mixed on the proliferative capacity of macrophages was observed using the CCK8 method. The effect of Lactobacillus plantarum mixed on macrophage phagocytosis was detected using the macrophage phagocytosis neutral red method. NO, TNF-α, IL-6, IL-1β kits were used to determine the macrophage-promoting cytokine secretion capacity of Lactobacillus plantarum mixed. Healthy BALB/c mice were randomly divided into three groups: normal group (NC group), model group (MC group), and Lactobacillus plantarum mixed group (Mix group). The body weight of laboratory mice before, after and at the end of modeling was recorded, and the spleen and thymus indexes of each experimental group, as well as the proliferation ability of spleen lymphocytes and the activity of natural killer cells (NK) after the mice died were measured. Results: Lactobacillus plantarum mixed was not cytotoxic and significantly promoted macrophage proliferation at MOI=1, 10, and 100 compared to the normal group (P<0.05) (MOI=1, 10, 100, and 1000. 1, 10, 100, and 1000 represented the number of Lactobacillus plantarum mixed infected with the RAW 264.7 macrophage complex, respectively, (MOI) of 1:1, 10:1, 100:1, and 1000:1). The highest relative proliferation rate of Lactobacillus plantarum mixed was 176.75% when MOI=100. Lactobacillus plantarum mixed significantly increased phagocytosis of macrophages at all MOI values (P<0.05) and showed excellent immune activity compared to the normal group. Especially at MOI=100, the phagocytic activity of cells in the Lactobacillus plantarum mixed group (A540=0.80) was significantly better than that in the LPS group (A540=0.55) (P<0.05). The Lactobacillus plantarum mixed group significantly up-regulated the levels of NO and cytokines secreted by macrophages compared to the normal group when MOI=1, 10 and 100 (P<0.05). Macrophage NO secretion was 27.32 µmol/L, TNF-α secretion was 116.97 pg/mL, IL-6 secretion was 41.98 pg/mL, and IL-1β secretion was 149.88 pg/mL when MOI=100. Lactobacillus plantarum mixed intake increased body weight, up-regulated spleen index and thymus index in mice compared to MC. Lactobacillus plantarum mixed also had a significantly pro-proliferative effect on splenic lymphocyte damage caused by cyclophosphamide (P<0.05). Compared with MC group, Mix group could significantly increase the activity of NK cells in mice (P<0.05), reached 41.72%. Conclusion: Lactobacillus plantarum mixed has immunomodulatory activity and is a good immunomodulator.
-
Keywords:
- Lactobacillus plantarum /
- macrophages /
- mice /
- immunomodulation
-
免疫系统在各种疾病和健康的发病机制中起着重要作用。人体免疫系统分为先天性免疫和适应性免疫。物理屏障是人体抵御病原体的第一道防线,由皮肤、胃肠道系统、呼吸系统和泌尿生殖道的上皮层组成[1]。当病原体遇到物理屏障,先天免疫系统被激活来保护身体。如果病原体穿过他们,适应性免疫系统就会被激活作为第二道防线,并产生一系列的炎症反应[2]。因此,增强机体免疫力,提高抗病毒能力,避免自身基础疾病的发展尤为重要。
20世纪初期,诺贝尔学家埃利·梅契尼科夫提出益生菌的概念[3]。益生菌被定义为活的微生物,摄入足够量后对机体的健康有益[4]。益生菌在母体怀孕、分娩、母乳喂养和断奶期间对婴儿微生物群和免疫系统的早期发育起着非常重要的作用,并决定了成年人的免疫系统、微生物群和整体健康[5]。益生菌可通过单个菌株或多个菌株共同发挥作用,与服用单菌株相比,多菌株益生菌具有更多的优势[6]。乳酸杆菌作为益生菌是机体先天免疫系统的重要组成部分,是维持机体免疫功能稳定状态不可缺少的,对维持宿主微生态平衡、提高机体免疫系统功能起着至关重要的作用[7]。乳酸菌可通过调节微生物群刺激免疫细胞,在疾病发病机制特异性免疫应答紊乱的调节中发挥作用[8]。有研究表明,植物乳杆菌可以激活Th1免疫应答[9]、促进IgA分泌和预防流感病毒感染[10]、并增加自然杀伤细胞活性[11]。JORJAO等[12]研究发现,鼠李糖乳杆菌可以体外诱导巨噬细胞合成TNF-α、IL-1β、IL-6细胞因子,在免疫应答中起调节作用。SONG等[13]研究发现,口服乳酸杆菌激活机体的体液免疫和细胞免疫应答,同时增强宿主对病毒感染的抵抗力。Al-HASSI等[14]研究表明,一些益生菌可以通过分泌免疫调节肽刺激树突状细胞,促进抗炎细胞因子的分泌,缓解炎症反应。肠道微生物群对免疫系统的发育有效[15]。研究发现,益生菌可以改善肠道菌群结构,激活免疫细胞,进而保护机体健康[8]。因此,充分探讨益生菌作为免疫膳食补充剂和益生产品调节机体免疫功能的能力显得尤为必要。
植物乳杆菌KLDS1.0318和植物乳杆菌KLDS1.0386是实验室保藏的两株具有强耐受力和高抗炎性益生菌[16−17],本实验选用此两株益生菌混合菌株作用,联合体内和体外实验评估混合植物乳杆菌免疫调节能力。
1. 材料与方法
1.1 材料与仪器
植物乳杆菌KLDS1.0318、植物乳杆菌KLDS1.0386 均分离于新疆传统发酵乳制品,保存于东北农业大学乳品科学教育部重点实验室工业微生物菌种保藏中心(KLDS-DICC);小鼠单核巨噬细胞RAW 264.7 本细胞株购买于中国科学院典型培养物保藏委员会细胞库;YAC-1细胞 本细胞株购买于尚恩生物;BALB/c小鼠 雄性,清洁级,6~8周龄,初始体重18~20 g,购自哈尔滨医科大学(合格证号:SCXK(黑)2019-001),动物实验福利伦理审查编号NEAUEC20230409;10×磷酸盐缓冲溶液(phosphate buffered saline,PBS)、中性红染色液(活细胞专用)、刀豆蛋白(ConA) 北京索莱宝科技有限公司;脂多糖(LPS) 兰杰柯科技有限公司;高糖DMEM培养基、细胞增殖及毒性检测试剂盒(CCK8)、无菌PBS、RPMI-1640细胞培养基 大连美仑生物;胎牛血清 南京维森特;NO、IL-6、IL-1β、TNF-α酶联免疫吸附分析试剂盒 上海碧云天;胰蛋白酶-EDTA(0.25%) 海克隆公司;苏木素-伊红染液 武汉百千度生物科技有限公司。
DHP-9272电热恒温培养箱 上海一恒科技有限公司;Thermo Fisher台式高速冷冻离心机 赛默飞世尔科技有限公司;DW-86L828超低温冰箱 青岛海尔;C60825-1多功能酶标仪 美国Molecular Devices公司;(−0.1−0.5)MPa全自动高压灭菌锅 上海申安医疗器械厂;CJ-2D洁净工作台 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制
Man-Rogosa-Sharp(MRS)培养基配制见表1(高压灭菌锅121 ℃,20 min)。
表 1 MRS培养基成分Table 1. MRS medium composition成分 含量(g/L) 成分 含量(g/L) 蛋白胨 5.0 酵母粉 5.0 胰蛋白胨 10.0 硫酸锰 0.25 乙酸钠 5.0 硫酸镁 0.58 磷酸氢二钾 2.0 柠檬酸氢二铵 2.0 葡萄糖 20.0 吐温-80 1.0 牛肉膏 5.0 1.2.2 混合植物乳杆菌的制备
将植物乳杆菌KLDS1.0318和植物乳杆菌KLDS1.0386接种到MRS液体培养基中,37 ℃孵育24 h,并重复以上步骤,得到活化2代的菌株。随后,将得到的2代菌株再次接种于MRS液体培养基中,37 ℃孵育14 h。将培养好的菌株进行离心(6000 r/min,10 min),离心后得到的沉淀用PBS缓冲液洗涤3次。最后用PBS缓冲液重悬菌体浓度至109 CFU/mL。将制备好的植物乳杆菌KLDS1.0318、KLDS1.0386按照体积比(v:v)=1:1混合,得到混合植物乳杆菌。
1.2.3 细胞培养
待RAW 264.7巨噬细胞接种于无菌细胞培养瓶中,当生长状态良好(单层细胞贴壁生长至70%~80%)时进行传代。用1 mL 0.25%胰酶消化1~2 min,加入DMEM高糖培养基终止消化。将培养瓶中的全部液体转移至15 mL无菌离心管中离心(1000 r/min,5 min),离心后弃去上清液。加入DMEM高糖培养基重悬细胞,按照1:3比例进行传代,传代后的细胞置于CO2培养箱中培养。
1.2.4 LPS溶液制备
将10 mg LPS粉末溶于10 mL无菌PBS缓冲液中,配制成浓度为1 mg/mL LPS原液,放置于−20 ℃冰箱备用。使用时加入DMEM高糖培养基将其稀释为1 µg/mL。
1.2.5 RAW 264.7巨噬细胞增殖实验
使用CCK-8试剂盒测定巨噬细胞的增殖活性。小鼠RAW 264.7巨噬细胞培养在37 ℃、含5% CO2的培养箱中。将培养好的细胞以1×105个/孔的密度接种于96孔板中(200 µL/孔),在培养箱中继续培养24 h。然后在孔板中加入200 µL溶于DMEM高糖培养基中的混合植物乳杆菌(MOI=1、10、100、1000。1,10,100,1000分别代表混合植物乳杆菌与RAW 264.7细胞感染复数(MOI)为1:1,10:1,100:1,1000:1)。参考占萌[18]的方法,测定巨噬细胞的相对增殖率。
细胞相对增殖率(%)=(处理组吸光度值空白对照组吸光度值)×100 1.2.6 RAW 264.7巨噬细胞吞噬中性红实验
将对数生长期RAW 264.7巨噬细胞,以1×105个/孔的密度接种于96孔板中(200 µL/孔)培养24 h。培养结束后,用PBS缓冲液洗涤2次。再加入不同浓度(MOI=1、10、100、1000)的混合植物乳杆菌溶液(200 µL)继续培养24 h。阳性对照和空白对照组分别为200 µL LPS和200 µL空白DMEM高糖培养基。孵育结束后,用PBS缓冲液洗涤2次,加入200 µL中性红试剂孵育30 min后,去除上清液,用PBS缓冲液洗涤3次,加入200 µL裂解液(冰醋酸:无水乙醇,1:1(v/v))孵育2 h,用酶标仪测定540 nm处的吸光度值。
1.2.7 对RAW 264.7巨噬细胞NO分泌量的影响
将RAW 264.7巨噬细胞以1×105个/孔的密度接种于6孔板中(200 µL/孔)培养24 h。将培养好的细胞用PBS缓冲液洗涤2次,随后在6孔板中以200 µL/孔的体积分别接入混合植物乳杆菌溶液(MOI=1、10、100、1000)、LPS(阳性对照组)和DMEM高糖培养基(空白对照组)。根据一氧化氮检测试剂盒(Beyotime Biotechnology,Jiangsu,China)说明书检测NO分泌量。
1.2.8 对RAW 264.7巨噬细胞IL-6、IL-1β和TNF-α分泌量的影响
将RAW 264.7巨噬细胞以1×105个/孔的密度(200 µL/孔)接种于6孔板中培养24 h。培养结束后,用PBS缓冲液洗涤2次。随后在6孔板中以200 µL/孔的体积分别接入混合植物乳杆菌溶液(MOI=1、10、100、1000)、LPS(阳性对照组)和DMEM高糖培养基(空白对照组)。采用TNF-α免疫反应试剂盒、IL-6免疫反应试剂盒、IL-1β免疫反应试剂盒说明书检测IL-6、IL-1β、TNF-α分泌量。
1.2.9 动物实验设计
1.2.9.1 动物实验分组及实验设计
BALB/c雄性小鼠30只,0~7 d在鼠房适应性饲养。将小鼠随机分为3组,每组10只,分别为空白组(NC组)、模型组(MC组)、混合植物乳杆菌组(Mix组)。8~10 d除空白组外,其余各组小鼠均注射环磷酰胺(80 mg/kg,空白组给予等量PBS)。10~24 d各组每天于上午10:00进行灌胃,实验组小鼠灌服0.2 mL浓度为1×109 CFU/mL的混合植物乳杆菌,空白组和模型组灌服等量的PBS缓冲液。第25 d处死。
1.2.9.2 小鼠体重和免疫器官指数测定
记录各小鼠初始体重,且实验期间每5 d测定一次小鼠体重。小鼠宰杀后称量其胸腺和脾脏的重量。胸腺和脾脏指数为胸腺和脾脏重量与小鼠重量的比值[19]:
胸腺或脾脏指数(mg/g)=胸腺或脾脏鲜重量(mg)体重(g) 1.2.9.3 脾淋巴细胞的制备
按照NIU等[19]方法制备脾淋巴细胞。将小鼠浸泡在75%乙醇中3 min,然后在无菌超净工作台中取出其脾脏。用PBS缓冲液洗涤脾,并通过200目筛缓慢研磨。将悬液离心(1500 r/min,10 min),弃上清,沉淀与3倍体积的红细胞裂解液混合。在冰上裂解15 min后离心(1500 r/min,10 min),弃上清液,加入RPMI-1640培养基终止裂解。随后离心(1500 r/min,10 min),将离心后的沉淀用含10%胎牛血清RPMI-1640培养基悬浮。将重悬液置于37 ℃、含5% CO2细胞培养箱中培养。培养24 h后除去贴壁细胞,用台盼蓝染色原始代脾细胞并计数。活细胞率为90%~93%。
1.2.9.4 脾淋巴细胞增殖能力的测定
参考YUAN等[20]方法稍作改动。将脾细胞(1×105个细胞/mL,100 μL)接种到含有ConA(50 μg/mL)的96孔板中,并在37 ℃、含5% CO2细胞培养箱中培养72 h。向每孔加入20 μL CCK-8溶液,继续孵育2 h,振荡混匀。在酶标仪450 nm处测定各孔光密度值。
1.2.9.5 NK细胞活性检测
按照1.2.9.4方法制备脾细胞(2×105个细胞/mL,100 μL)作为效应细胞,并将YAC-1细胞作为靶细胞(1×104个细胞/mL,100 μL)接种于96孔板中作为反应对照孔(C)。效应细胞孔(B)加效应细胞(2×105个细胞/mL)和RPMI-1640完全培养液各100 μL。自然释放孔(A)加靶细胞(1×104个细胞/mL)和RPMI-1640完全培养液各100 μL。细胞在37 ℃、含5% CO2细胞培养箱中孵育20 h。随后加入20 μL CCK-8溶液共培养4 h,在酶标仪450 nm处测定各孔光密度值。按下列方式计算NK细胞活性:
NK细胞活性(%)=(A+B−C)A×100 1.3 数据处理
研究所用数据为3组试样的平均值,实验数据用平均数±标准差表示,采用SPSS16.0统计软件对不同组之间的数据进行单因素方差分析,并用GraphPad Prism 8.0软件作图,P<0.05为统计学上有显著差异。
2. 结果与分析
巨噬细胞在病原体和抗原的刺激下,会启动免疫应答[21]。因此,实验以小鼠巨噬细胞RAW 264.7为细胞模型,考察混合植物乳杆菌对RAW 264.7细胞增殖、细胞吞噬、细胞因子分泌的影响,评估混合植物乳杆菌的免疫调节能力。
2.1 混合植物乳杆菌对RAW 264.7巨噬细胞增殖能力影响
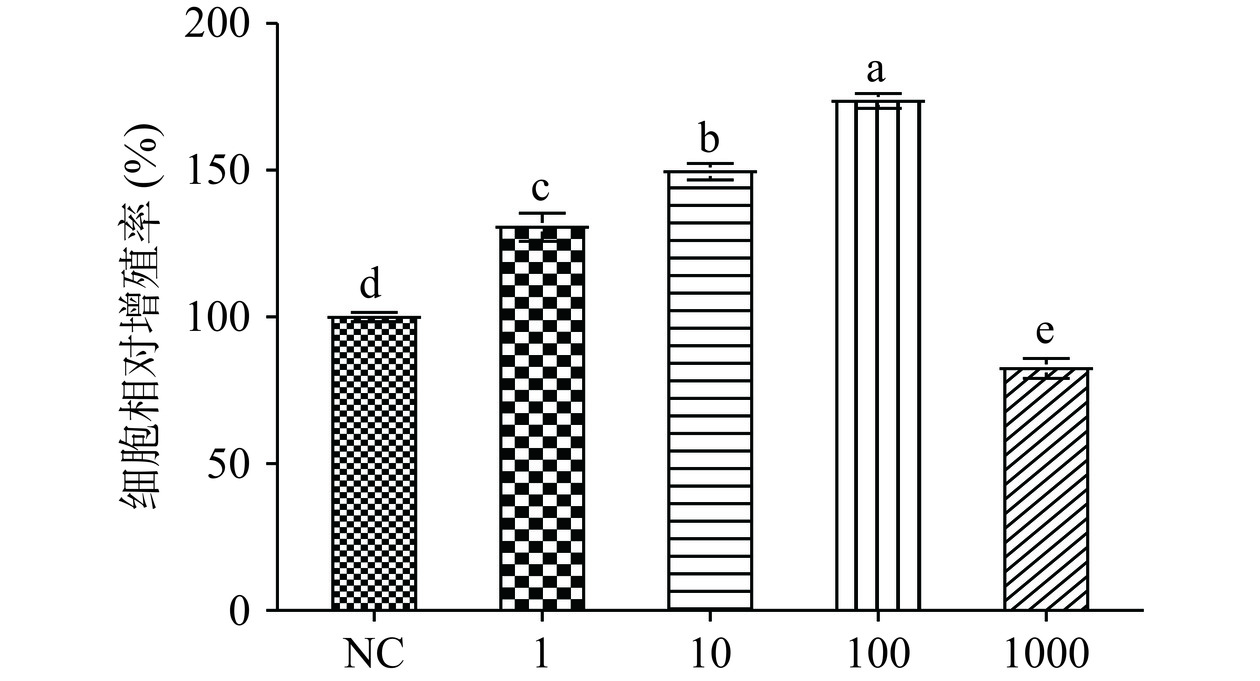
混合植物乳杆菌作用RAW 264.7巨噬细胞后,对细胞增殖能力的影响结果见图1。与NC组相比,MOI=1、10和100时各混合植物乳杆菌组对巨噬细胞的增殖作用是显著的(P<0.05),细胞相对增殖率随剂量依赖性增加。特别是当MOI=100时,巨噬细胞最高相对增殖率为176.75%。而当MOI值为1000时,细胞相对增殖率下降到84.78%。结果表明在MOI=1、10、100时混合植物乳杆菌组对巨噬细胞无毒性作用,MOI=100是促细胞增殖最佳浓度。
2.2 混合植物乳杆菌对RAW 264.7巨噬细胞吞噬能力影响
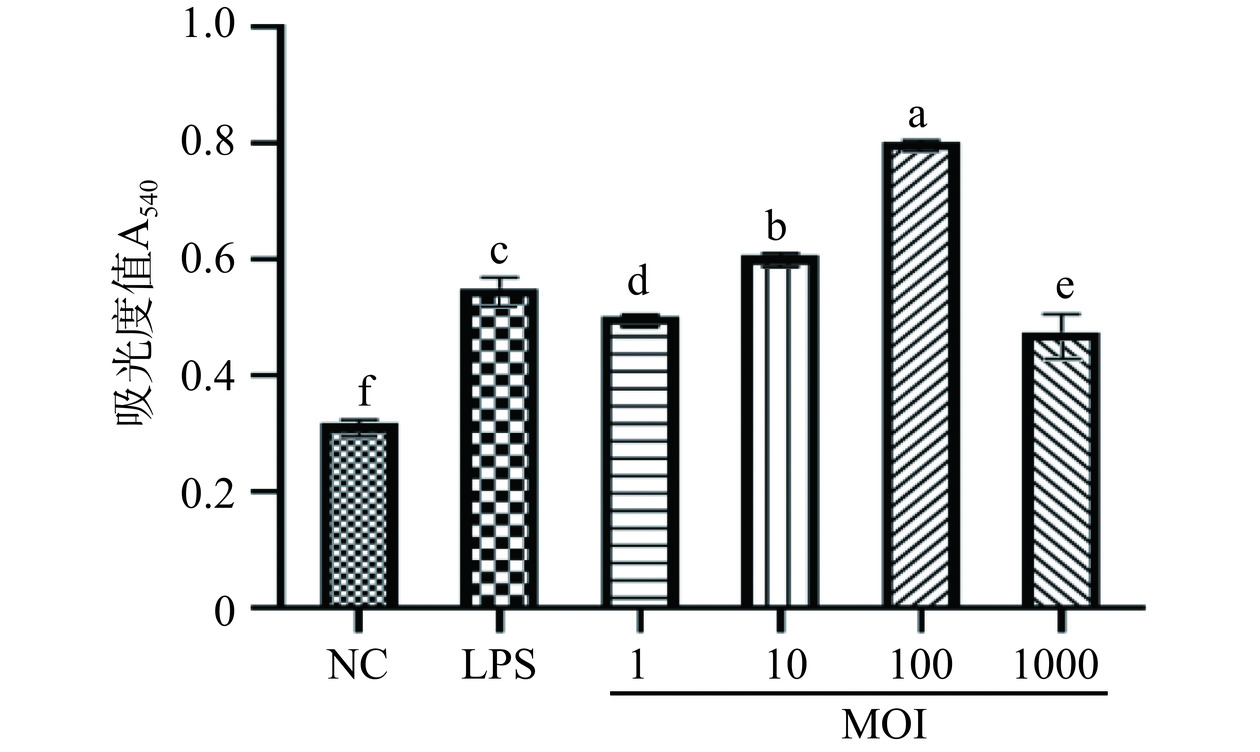
混合植物乳杆菌吞噬中性红能力如图2所示。与NC组相比,LPS组和各MOI下混合植物乳杆菌组均能显著促进巨噬细胞的吞噬能力(P<0.05),且在MOI=1、10、100时吞噬能力呈剂量依赖性增加。各MOI下混合植物乳杆菌组与LPS组相比作用差异是显著的(P<0.05)。LPS组吸光度值为0.55,当MOI=100时,混合植物乳杆菌组吸光度值达到了0.80,显著高于LPS组(P<0.05),此时巨噬细胞吞噬能力最强。结果表明,混合植物乳杆菌能促进巨噬细胞的吞噬作用,激活机体先天性免疫。
2.3 混合植物乳杆菌对RAW 264.7巨噬细胞分泌NO能力的影响
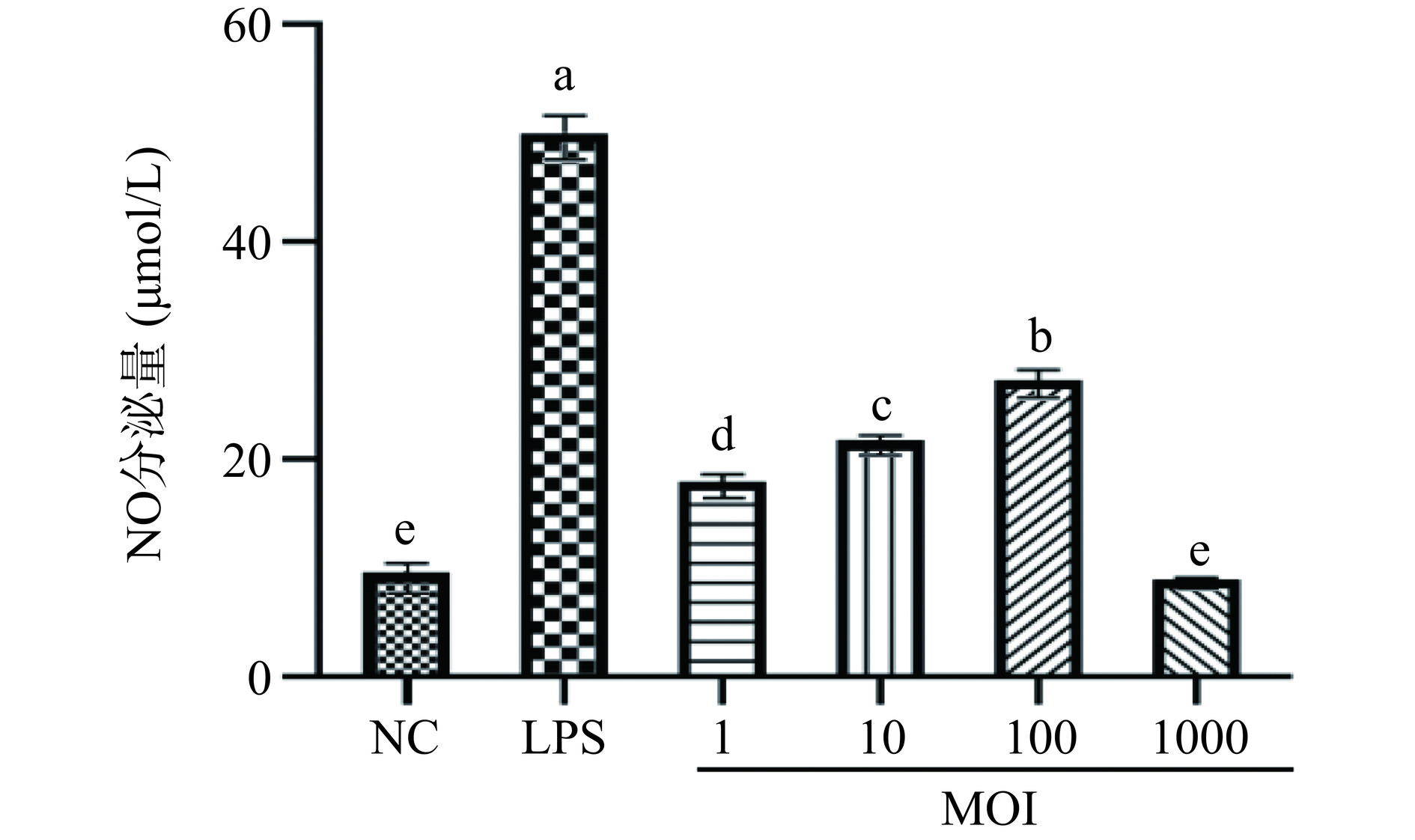
NO的分泌是巨噬细胞激活的重要指标,抗癌抗病毒等功能通过释放NO来实现[22]。图3为混合植物乳杆菌对RAW 264.7巨噬细胞分泌NO的影响。与NC组相比,在MOI=1、10、100时混合植物乳杆菌组和LPS组对细胞分泌NO能力促进作用均是显著的(P<0.05),MOI=1000时作用效果不显著(P>0.05)。MOI=1、10、100时,促进作用呈剂量依赖型增加。在MOI=100时,混合植物乳杆菌组的作用效果达到最大,NO分泌量达到27.32 µmol/L。LPS组与各MOI下混合植物乳杆菌组作用差异是显著的(P<0.05)。实验结果表明,混合植物乳杆菌能促进RAW 264.7巨噬细胞NO的分泌,具有免疫调节活性。
2.4 混合植物乳杆菌对RAW 264.7巨噬细胞分泌细胞因子水平的影响
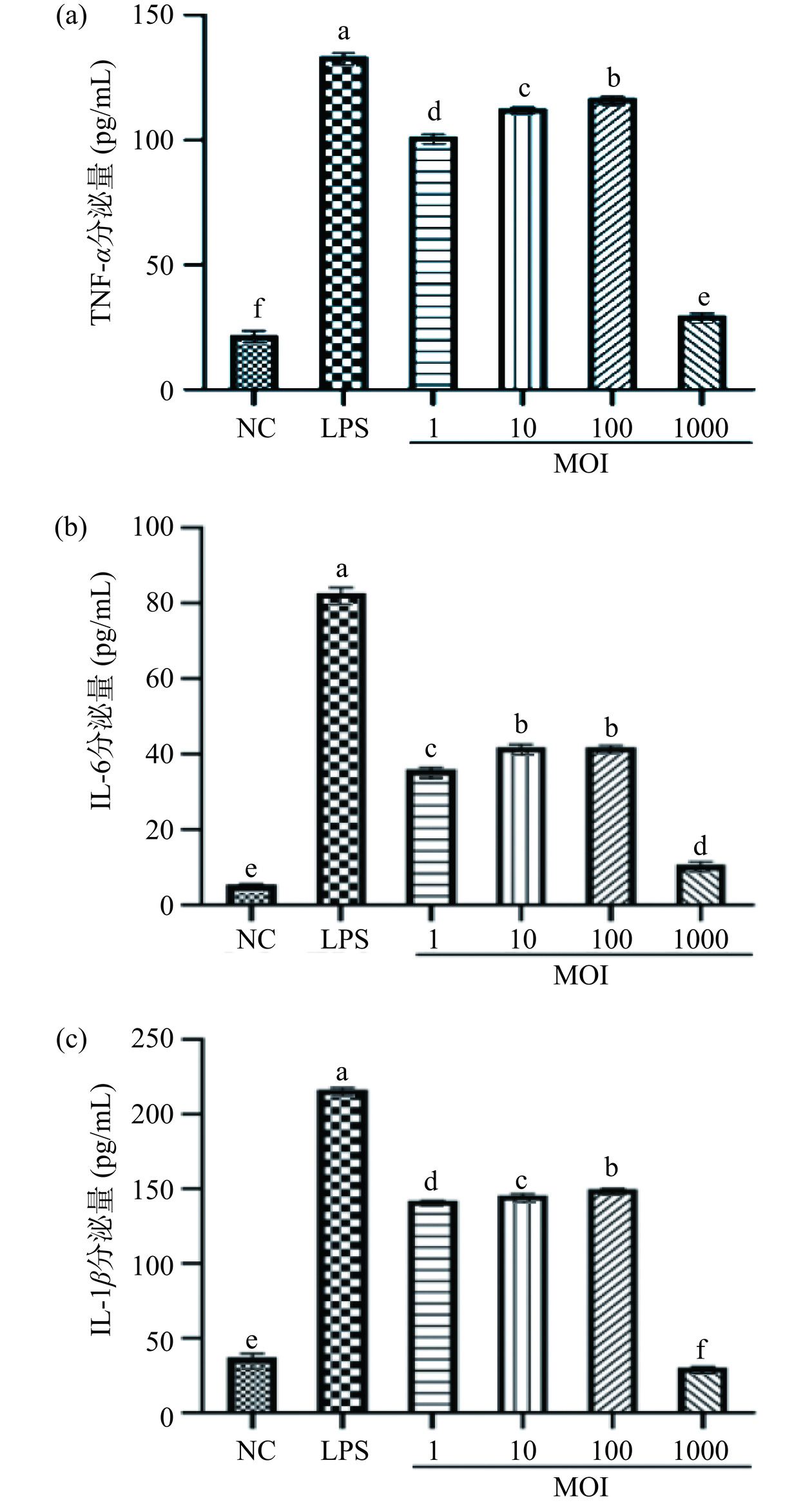
被激活的巨噬细胞能释放大量的细胞因子。细胞因子在免疫反应中起到了至关重要的作用,可以抗击炎症、抑制肿瘤等[23−24]。图4为混合植物乳杆菌对巨噬细胞中细胞因子分泌的影响。与NC组相比,LPS组和MOI=1、10、100时混合植物乳杆菌组对巨噬细胞分泌细胞因子IL-6、IL-1β和TNF-α作用是显著的(P<0.05)。LPS组与各MOI下混合植物乳杆菌组作用效果差异显著(P<0.05)。总体来看,当MOI=100时,混合植物乳杆菌促进巨噬细胞分泌细胞因子量最高,TNF-α分泌量为116.97 pg/mL;IL-6分泌量为41.98 pg/mL;IL-1β分泌量为149.88 pg/mL。结果表明,混合植物乳杆菌能激活RAW 264.7巨噬细胞释放细胞因子,调节免疫细胞活性。
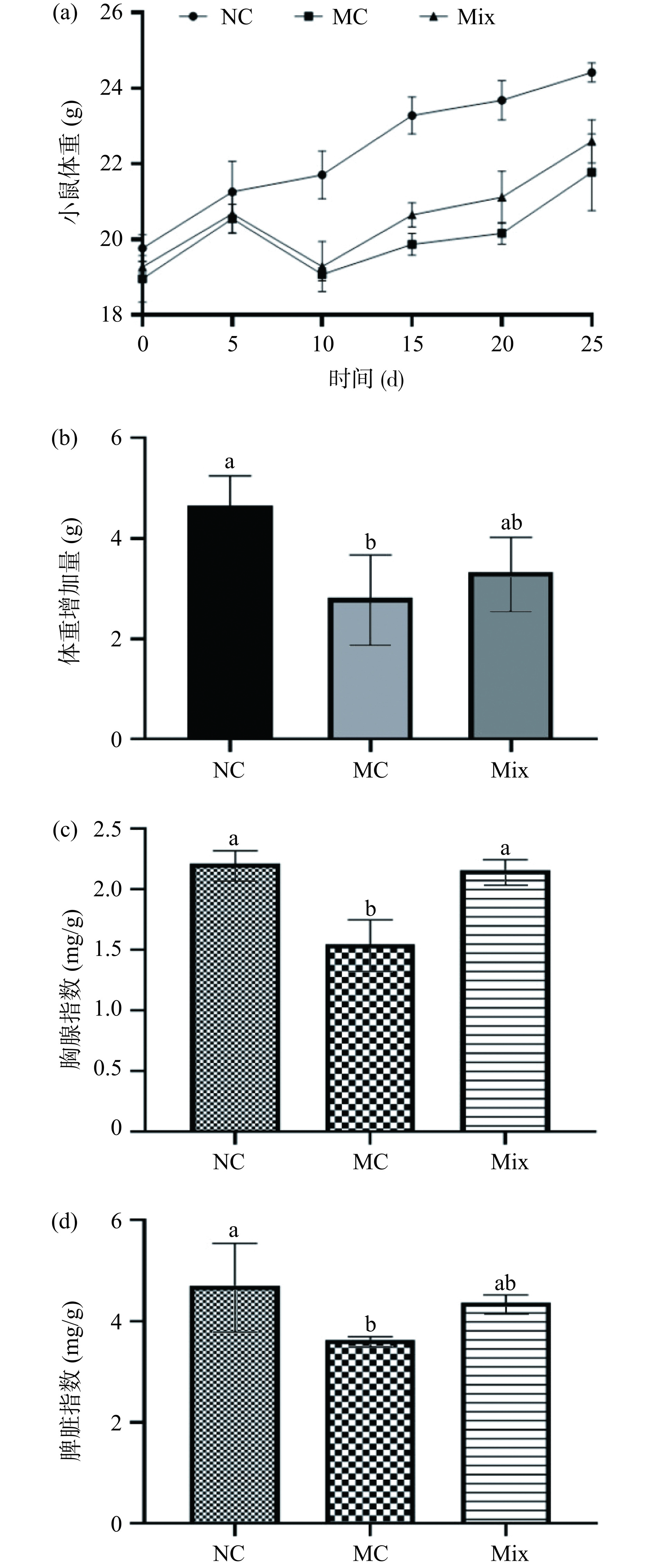
2.5 混合植物乳杆菌对小鼠体重、胸腺和脾脏指数影响
环磷酰胺是临床研究中使用的重要免疫抑制药物[25],能够杀死免疫细胞,干扰脾淋巴的增殖和分化,并抑制体液免疫和细胞免疫应答[26]。用环磷酰胺处理的动物已被广泛用于评价各种生物活性组分和药物的免疫调节特性[27]。本研究通过对小鼠体重、脾脏和胸腺脏器指数分析,探讨混合植物乳杆菌对环磷酰胺所致免疫抑制的治疗作用,实验结果见图5。图5(a)显示了各组小鼠体重变化趋势。NC组小鼠体重处于平稳增长状态。在8~10 d给MC组和Mix组小鼠注射环磷酰胺,在第10 d时,这两组小鼠体重明显下降。Mix组小鼠在灌服混合植物乳杆菌后体重逐渐回升,并较MC组呈较快的增长。MC组小鼠在注射环磷酰胺造成体重下降后虽有体重回升趋势,但增加速度慢于NC组。图5(b)显示了实验始末体重增加情况。与MC组相比,混合植物乳杆菌的摄入增加了小鼠的体重,与NC组相比增重效果差异并不显著(P>0.05)。
与NC组相比,MC组小鼠胸腺和脾脏指数均显著下降(P<0.05),Mix组小鼠胸腺和脾脏指数无显著变化(P>0.05)。由于胸腺和脾脏在非特异性免疫中的重要作用,这些器官指数可以很好地反映免疫功能[28]。实验结果表明,与MC组相比,Mix组的胸腺和脾脏指数都有所回升,特别是小鼠胸腺指数显著升高(P<0.05),恢复到接近正常水平。结果表明,混合植物乳杆菌可以增加由环磷酰胺诱导免疫低下小鼠的体重,恢复由环磷酰胺诱导的免疫器官损伤。
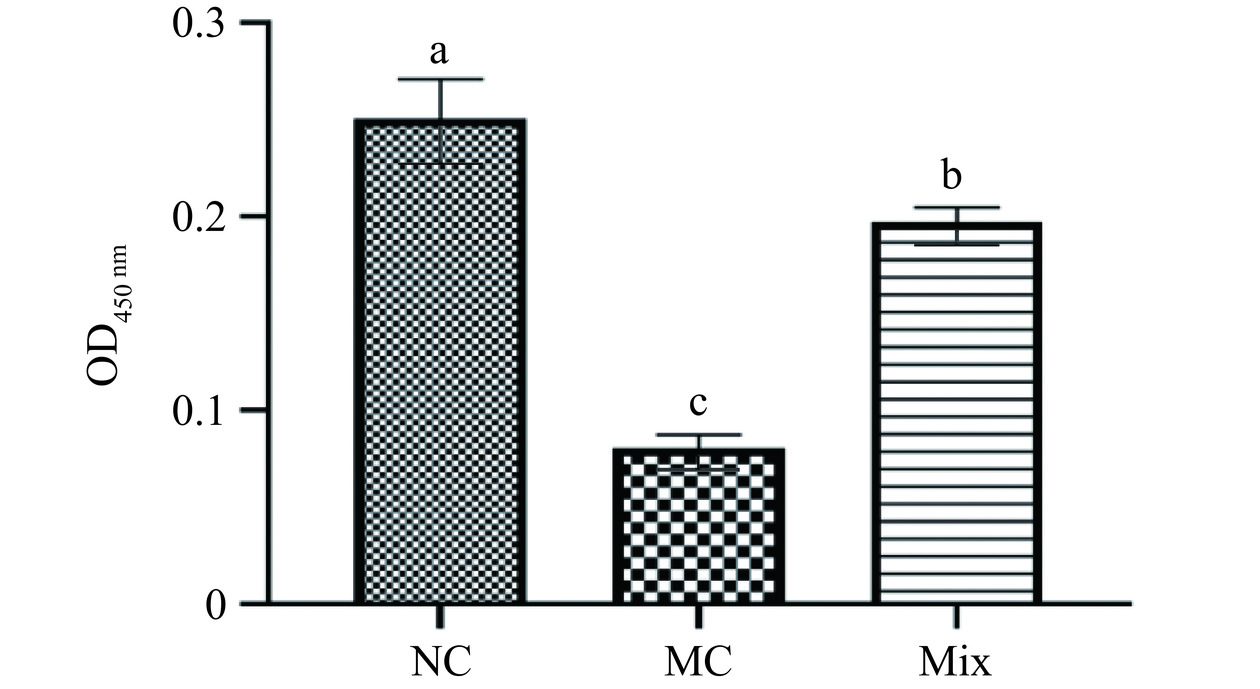
2.6 混合植物乳杆菌对小鼠脾淋巴细胞增殖能力的影响
小鼠脾淋巴细胞在无菌条件下培养,采用ConA诱导淋巴细胞分化,观察各组淋巴细胞增殖情况如图6所示。与NC组相比,MC组和Mix组小鼠的脾淋巴细胞增殖能力显著下降(P<0.05)。混合植物乳杆菌的摄入,使Mix组小鼠的脾淋巴细胞增殖能力与MC组相比显著增加(P<0.05),表明混合益生菌能改善由环磷酰胺导致的小鼠脾淋巴细胞的增殖受抑制的情况。实验结果表明,混合植物乳杆菌能提高小鼠脾淋巴细胞的增殖能力,具有免疫活性。
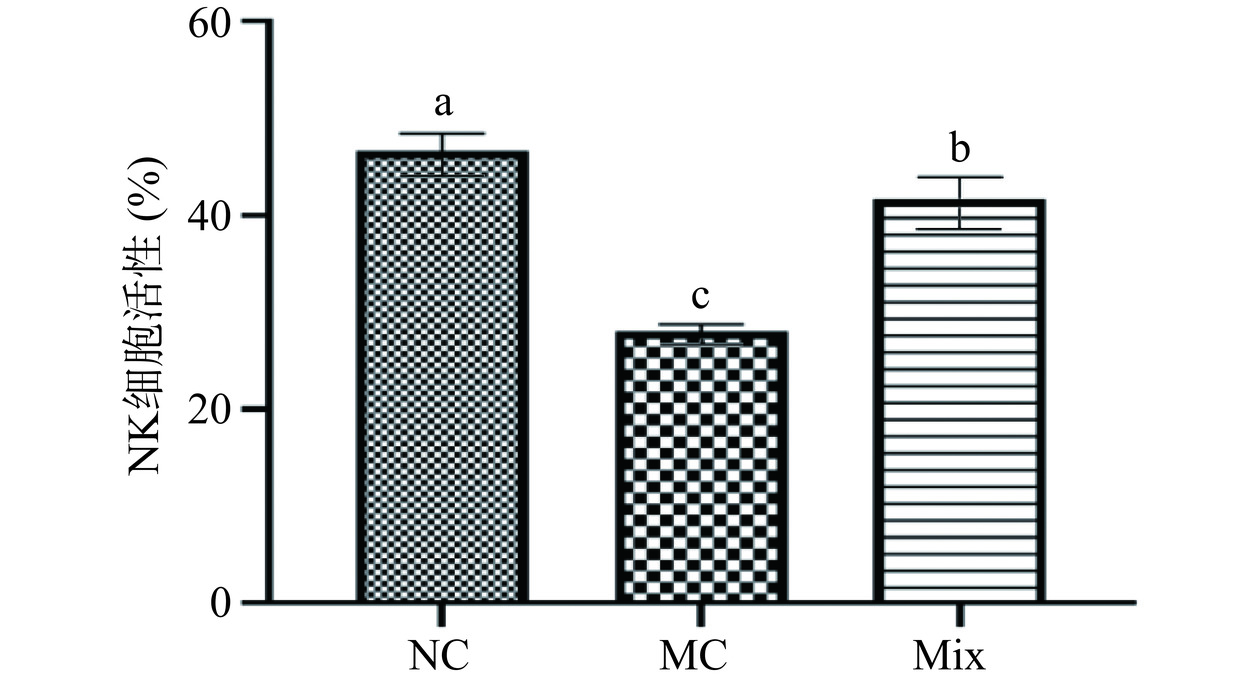
2.7 混合植物乳杆菌对小鼠NK细胞活性的影响
图7为混合植物乳杆菌对小鼠NK细胞活性的影响。与NC组相比,MC组和Mix组NK细胞活性显著降低(P<0.05)。MC组NK细胞活性为28.05%,而摄入混合植物乳杆菌后,Mix组小鼠NK细胞活性提高到41.72%,接近NC组46.66%水平。与MC组相比,Mix组显著增强了NK细胞的活性(P<0.05)。结果表明混合植物乳杆菌能促进NK细胞活性,具有体内免疫调节能力。
3. 讨论与结论
人体的免疫系统功能是由免疫器官、免疫细胞和免疫分子组成的完整的免疫系统来执行的。巨噬细胞通过其吞噬作用在宿主防御系统中发挥重要作用并且通过促进免疫细胞分泌NO和产生细胞因子来刺激免疫系统[29−33]。胸腺和脾脏作为人体重要的免疫器官,监控机体免受外来侵害并适时发挥抗炎作用[34]。T淋巴细胞主要参与机体细胞免疫,B淋巴细胞主要参与体液免疫[35]。NK细胞作为免疫细胞参与先天免疫应答,在人体第一道防线和保护中起重要作用[36]。因此,选用上述指标来测定混合植物乳杆菌的免疫调节能力。
混合益生菌包含多种益生菌,每种益生菌具有各自不同的功效,因此其作用效果优于单一菌株[37]。本实验选用的实验室储藏的两株植物乳杆菌KLDS1.0318和KLDS1.0386均具有良好的胃肠液耐受力和抗炎活性[16,38]。将两株植物乳杆菌按体积比(v:v)=1:1混合,探究混合植物乳杆菌的免疫调节能力。已有研究证明益生菌对先天免疫和适应性免疫具有直接的治疗机制[39]。鼠李糖乳杆菌能诱导巨噬细胞的吞噬能力,并激活巨噬细胞产生细胞因子(TNF-α、IL-6、IL-1β),对巨噬细胞发挥免疫调节作用[12]。JUNG等[40]研究表明,混合益生菌能促进巨噬细胞TNF-α的表达,在激活先天免疫系统方面起作用。本实验结果表明,混合植物乳杆菌在一定MOI值下无细胞毒性,且能促进RAW 264.7巨噬细胞增殖和细胞吞噬。在MOI=100时混合植物乳杆菌的促增殖能力和吞噬能力都达到最高,最高相对增殖率为176.75%,吞噬吸光度值为0.80。在MOI=1、10、100时,混合植物乳杆菌组均能激活巨噬细胞NO和细胞因子的产生,且与NC组相比促进效果是显著的(P<0.05)。本实验结果与文献结果一致。4种乳源性益生菌被证明可以改善小鼠免疫抑制低下状态,调节Th1和Th2相关细胞因子[41]。SUZUKI等[42]研究发现乳酸菌JCM5805在体内和体外均能激活NK细胞活性,刺激宿主细胞免疫防御系统。本实验结果表明,与MC组相比,混合植物乳杆菌能增加小鼠体重、上调脾脏指数和胸腺指数,显著促进脾淋巴细胞的增殖并且提高NK细胞的活性(P<0.05),细胞活性为41.72%。
综上所述,本实验通过体内体外实验研究表明,混合植物乳杆菌无毒性作用,具有增强机体免疫应答的效果,激活先天免疫系统,促进适应性免疫,是一种良好的免疫调节剂,为进一步探究混合植物乳杆菌免疫调节机制的研究奠定基础。混合植物乳杆菌在食品医药中的应用还有待进一步研究。
-
表 1 MRS培养基成分
Table 1 MRS medium composition
成分 含量(g/L) 成分 含量(g/L) 蛋白胨 5.0 酵母粉 5.0 胰蛋白胨 10.0 硫酸锰 0.25 乙酸钠 5.0 硫酸镁 0.58 磷酸氢二钾 2.0 柠檬酸氢二铵 2.0 葡萄糖 20.0 吐温-80 1.0 牛肉膏 5.0 -
[1] NONE. Overview of the immune response[J]. Journal of Allergy & Clinical Immunology,2010,125(2):S345.
[2] MOWAT A M, VINEY J L. The anatomical basis of intestinal immunity[J]. Immunological Reviews,2010,156(1):145−166.
[3] KUMAR R, SOOD U, GUPTA V, et al. Recent advancements in the development of modern probiotics for restoring human gut microbiome dysbiosis[J]. Indian Journal of Microbiology,2020,60(1):12−25. doi: 10.1007/s12088-019-00808-y
[4] CHIU Y H, LIN S L, OU C C, et al. Anti-inflammatory effect of Lactobacilli bacteria on HepG2 cells is through cross-regulation of TLR4 and NOD2 signalling[J]. Journal of Functional Foods,2013,5(2):820−828. doi: 10.1016/j.jff.2013.01.028
[5] MAYNERIS-PERXACHS J, SWANN J R. Metabolic phenotyping of malnutrition during the first 1000 days of life[J]. Springer Berlin Heidelberg,2019,58(3):909−930.
[6] TIMMERMAN H M, KONING C J M, MULDER L, et al. Monostrain, multistrain and multispecies problotics-A comparison of functionality and efficacy[J]. International Journal of Food Microbiology,2004,96(3):219−233. doi: 10.1016/j.ijfoodmicro.2004.05.012
[7] MA W, LI W, YU S, et al. Immunomodulatory effects of complex probiotics on the immuno-suppressed mice induced by cyclophosphamide[J]. Frontiers in Microbiology,2023,14:1055197. doi: 10.3389/fmicb.2023.1055197
[8] DARGAHI N, JOHNSON J, DONKOR O, et al. Immunomodulatory effects of probiotics:Can they be used to treat allergies and autoimmune diseases?[J]. Elsevier,2019,119:25−38.
[9] KAWASHIMA T, HAYASHI K, KOSAKA A, et al. Lactobacillus plantarum strain YU from fermented foods activates Th1 and protective immune responses[J]. International Immunopharmacology,2011,11(12):2017−2024. doi: 10.1016/j.intimp.2011.08.013
[10] YOSUKE K, AYAMI K A, KATSUYUKI H, et al. Oral administration of Lactobacillus plantarum strain AYA enhances IgA secretion and provides survival protection against influenza virus infection in mice[J]. Plos One,2014,9(1):e86416. doi: 10.1371/journal.pone.0086416
[11] RIZZO A, LOSACCO A, CARRATELLI C R, et al. Lactobacillus plantarum reduces Streptococcus pyogenes virulence by modulating the IL-17, IL-23 and toll-like receptor 2/4 expressions in human epithelial cells[J]. International Immunopharmacology,2013,17(2):453−461. doi: 10.1016/j.intimp.2013.07.005
[12] JORJAO A L, DE OLIVEIRA F E, LEAO M V P, et al. Live and heat-killed Lactobacillus rhamnosus ATCC 7469 may induce modulatory cytokines profiles on macrophages RAW 264.7[J]. The Scientific World Journal,2015,2015:716749. doi: 10.1155/2015/716749
[13] SONG J A, HEE J, SEONG K, et al. Oral intake of Lactobacillus rhamnosus M21 enhances the survival rate of mice lethally infected with influenza virus[J]. Journal of Microbiology, Immunology, and Infection:Wei Mian Yu Gan Ran Za Zhi,2016,49(1):16−23. doi: 10.1016/j.jmii.2014.07.011
[14] AL-HASSI H O, MANN E R, SANCHEZ B, et al. Altered human gut dendritic cell properties in ulcerative colitis are reversed by Lactobacillus plantarum extracellular encrypted peptide STp[J]. Molecular Nutrition & Food Research,2014,58(5):1132−1143.
[15] GILL H S, RUTHERFURD K J, CROSS M L. Dietary probiotic supplementation enhances natural killer cell activity in the elderly:An investigation of age-related immunological changes[J]. Journal of Clinical Immunology,2001,21(4):264−271. doi: 10.1023/A:1010979225018
[16] 靳妲, 于上富, 李柏良, 等. 植物乳杆菌KLDS 1.0386对C57BL/6小鼠胆固醇代谢的影响[J]. 食品工业科技,2017,38(23):275−279, 283. [JIN D, YU S F, LI B L, et al. Effect of Lactobacillus plantarum KLDS 1.0386 on the cholesterol metabolism in C57BL/6 mice[J]. Science and Technology of Food Industry,2017,38(23):275−279, 283.] JIN D, YU S F, LI B L, et al. Effect of Lactobacillus plantarum KLDS 1.0386 on the cholesterol metabolism in C57BL/6 mice[J]. Science and Technology of Food Industry, 2017, 38(23): 275−279, 283.
[17] 蒙月月. 免疫活性乳酸菌的筛选及其对小鼠免疫调节作用的研究[D]. 哈尔滨:东北农业大学, 2018. [MENG Y Y. Screening immunocompetent lactic acid bacteria and its immunoregulatory effect on mice[D]. Harbin:Northeast Agricultural University, 2018.] MENG Y Y. Screening immunocompetent lactic acid bacteria and its immunoregulatory effect on mice[D]. Harbin: Northeast Agricultural University, 2018.
[18] 占萌. 高黏附乳酸菌的筛选及其对RAW264.7细胞的免疫调节作用[D]. 哈尔滨:东北农业大学, 2019. [ZHAN M. Screening of high adhesive lactic acid bacteria and its immunomodulatory activity against RAW264.7 macrophages[D]. Harbin:Northeast Agricultural University, 2019.] ZHAN M. Screening of high adhesive lactic acid bacteria and its immunomodulatory activity against RAW264.7 macrophages[D]. Harbin: Northeast Agricultural University, 2019.
[19] NIU Y, DONG J, JIANG H, et al. Effects of polysaccharide from Malus halliana Koehne flowers in cyclophosphamide-induced immunosuppression and oxidative stress on mice[J]. Oxidative Medicine and Cellular Longevity,2020,2020:1603735.
[20] YUAN H M, SONG J M, LI X G, et al. Immunomodulation and antitumor activity of κ-carrageenan oligosaccharides[J]. Cancer Letters,2006,243(2):228−234. doi: 10.1016/j.canlet.2005.11.032
[21] 吴静, 胡居吾, 熊伟, 等. 樟树果实多糖对巨噬细胞RAW264.7的免疫调节作用[J]. 现代食品科技,2018,34(9):8. [WU J, HU J W, XIONG W, et al. Immunomodulatory effect of polysaccharide isolated from Cinamomum camphora fruits on macrophage RAW264.7[J]. Modern Food Science and Technology,2018,34(9):8.] WU J, HU J W, XIONG W, et al. Immunomodulatory effect of polysaccharide isolated from Cinamomum camphora fruits on macrophage RAW264.7[J]. Modern Food Science and Technology, 2018, 34(9): 8.
[22] 陈健, 申超群, 贺婷, 等. 正红菇多糖的抗癌和免疫调节活性研究[J]. 现代食品科技,2016,32(11):6. [CHEN J, SHEN C Q, HE T, et al. Anticancer and immunoregulation activities of a polysaccharide from Russula vinosa[J]. Modern Food Science and Technology,2016,32(11):6.] CHEN J, SHEN C Q, HE T, et al. Anticancer and immunoregulation activities of a polysaccharide from Russula vinosa[J]. Modern Food Science and Technology, 2016, 32(11): 6.
[23] 刘萌萌, 张伊, 张耀元, 等. 天麻多糖对脂多糖诱导抑郁小鼠的作用及机制研究[J]. 中国药师,2021(11):24. [LIU M M, ZHANG Y, ZHANG Y Y, et al. Effects and potential mechanisms of Gastrodia elata polysaccharides in LPS-induced depression model mice[J]. China Pharmacist,2021(11):24.] LIU M M, ZHANG Y, ZHANG Y Y, et al. Effects and potential mechanisms of Gastrodia elata polysaccharides in LPS-induced depression model mice[J]. China Pharmacist, 2021(11): 24.
[24] 杨晰茗, 徐红艳, 刘巳齐, 等. 食用菌多糖调节炎症性肠病研究进展[J]. 食品与机械,2021,37(9):211−217. [YANG X M, XU H Y, LIU S Q, et al. Recent progress on regulation of inflammatory bowel disease by polysaccharides from edible fungi[J]. Food & Machinery,2021,37(9):211−217.] YANG X M, XU H Y, LIU S Q, et al. Recent progress on regulation of inflammatory bowel disease by polysaccharides from edible fungi[J]. Food & Machinery, 2021, 37(9): 211−217.
[25] WANG H, WANG M, CHEN J, et al. A polysaccharide from Strongylocentrotus nudus eggs protects against myelosuppression and immunosuppression in cyclophosphamide-treated mice[J]. International Immunopharmacology,2011,11(11):1946−1953. doi: 10.1016/j.intimp.2011.06.006
[26] XU X F, ZHANG X W. Effects of cyclophosphamide on immune system and gut microbiota in mice[J]. Microbiological Research,2015,171:97−106. doi: 10.1016/j.micres.2014.11.002
[27] HUANG R, ZHANG J, LIU Y, et al. Immunomodulatory effects of polysaccharopeptide in immunosuppressed mice induced by cyclophosphamide[J]. Molecular Medicine Reports,2013,8(2):669−675. doi: 10.3892/mmr.2013.1542
[28] CHANDRASHEKAR P M, VENKATESH Y P. Fructans from aged garlic extract produce a delayed immunoadjuvant response to ovalbumin antigen in BALB/c mice[J]. Immunopharmacology & Immunotoxicology,2012,34(1):174.
[29] KIM B H, SHIN H M, JUNG S H, et al. Anti-inflammatory benzene diamine compound inhibited toll-like receptor 4-mediated inducible nitric oxide synthase expression and nuclear factor-KappaB activation[J]. Biological & Pharmaceutical Bulletin,2005,28(5):908−911.
[30] JUNG J Y, SHIN J S, LEE S G, et al. Lactobacillus sakei K040706 evokes immunostimulatory effects on macrophages through TLR 2-mediated activation[J]. International Immunopharmacology,2015,28(1):88−96. doi: 10.1016/j.intimp.2015.05.037
[31] KWON A, PARK Y S. Immunostimulatory activity of synbiotics using[J]. Microorganisms,2021,9(12):2437. doi: 10.3390/microorganisms9122437
[32] HO-EUNPARK, KYUNG-HYODO, WAN-KYULEE. The immune-modulating effects of viable Weissella cibaria JW15 on RAW 264.7 macrophage cells[J]. Journal of Biomedical Research,2020,34(1):8.
[33] JIN S W, LEE G H, JANG M J, et al. Immunomodulatory activity of Lactococcus lactis GCWB1176 in cyclophosphamide-induced immunosuppression model[J]. Microorganisms,2020,8(8):1175. doi: 10.3390/microorganisms8081175
[34] EMAN K, MOHAMED A, MAHMOUD E, et al. The immune modulatory role of marjoram extract on imidacloprid induced toxic effects in thymus and spleen of adult rats[J]. Toxicology,2022,471(15):153174.
[35] 刘柘君, 刘振权, 孙文燕. 复方益生菌粉提高小鼠免疫力的实验研究[J]. 食品与药品,2023,25(5):456−461. [LIU T J, LIU Z Q, SUN W Y. Experimental study of compound probiotic powder on improvement of mice's immunity[J]. Food and Drug,2023,25(5):456−461.] LIU T J, LIU Z Q, SUN W Y. Experimental study of compound probiotic powder on improvement of mice's immunity[J]. Food and Drug, 2023, 25(5): 456−461.
[36] WANG Y, QI Q, LI A, et al. Immuno-enhancement effects of Yifei Tongluo Granules on cyclophosphamide-induced immunosuppression in Balb/c mice[J]. Journal of Ethnopharmacology,2016,194:72−82. doi: 10.1016/j.jep.2016.08.046
[37] 李玟玟, 马微微, 马青, 等. 复合益生菌对免疫低下模型小鼠的保护作用[J]. 中国食品学报,2023,23(8):124−131. [LI W W, MA W W, MA Q, et al. Protective effect of compound probiotics on immunocompromised mice[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(8):124−131.] LI W W, MA W W, MA Q, et al. Protective effect of compound probiotics on immunocompromised mice[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(8): 124−131.
[38] 蒙月月, 陆婧婧, 占萌, 等. 植物乳杆菌KLDS 1.0318产酸、耐酸、耐胆盐能力及其免疫特性研究[J]. 食品工业科技,2018,39(15):70−76. [MENG Y Y, LU J J, ZHAN M, et al. Study on the acid producing ability, acid and bile salt tolerance of Lactobacillus plantarum KLDS 1.0318 and its immunologic properties[J]. Science and Technology of Food Industry,2018,39(15):70−76.] MENG Y Y, LU J J, ZHAN M, et al. Study on the acid producing ability, acid and bile salt tolerance of Lactobacillus plantarum KLDS 1.0318 and its immunologic properties[J]. Science and Technology of Food Industry, 2018, 39(15): 70−76.
[39] BORJA S, C U M. Extracellular proteins from Lactobacillus plantarum BMCM12 prevent adhesion of enteropathogens to mucin[J]. Current Microbiology,2012,64(6):592−596. doi: 10.1007/s00284-012-0115-6
[40] JUNG Y J, KIM H S, JAYGAL G, et al. Postbiotics enhance NK cell activation in stress-induced mice through gut microbiome regulation[J]. Journal of Microbiology and Biotechnology,2022,32(5):612−620. doi: 10.4014/jmb.2111.11027
[41] XIAO X J, DILIDAXI D, LIU L, et al. P38 Immunoregulatory effects and mechanisms of four milk-borne probiotics in immunocompromised Balb/c mice[J]. Biochemical Pharmacology,2017,139:138.
[42] SUZUKI H, OHSHIO K, FUJIWARA D. Lactococcus lactis subsp. lactis JCM 5805 activates natural killer cells via dendritic cells[J]. Journal of the Agricultural Chemical Society of Japan,2016,80(4):798−800.





 下载:
下载:
 下载:
下载:



