Influence of Vacuum Precooling Pressure on SOD Enzyme Activity of Fresh Lycium barbarum and Molecular Dynamics Simulation
-
摘要: 为探究真空预冷处理对鲜枸杞超氧化物歧化酶(superoxide dismutase,SOD)活性的影响及其分子水平机理,本研究将宁夏新鲜枸杞置于真空预冷900、1100 Pa压强下处理,提取粗酶液进行SOD酶活性测定,并进行150 ns分子动力学模拟研究SOD酶在不同真空预冷压强处理下的内部变化,分析均方根误差、回旋半径、总能量、势能、动能、键角能、均方根涨落、氢键数量、表面结构、溶剂可及表面积的改变,进而筛选出真空预冷处理的最佳压强条件。结果显示,900 Pa处理下SOD酶活最高。分子动力学模拟结果表明,体系总能量、势能、动能及键角能均处于平衡稳定状态,压强增大使得蛋白质表面结构改变,氢键数量减少,溶剂可及表面积不断减小。在900 Pa处理下,蛋白质结构最紧密,活性口袋变宽且易与蛋白结合。而1100 Pa处理下酶蛋白活性降低,蛋白结构破坏,活性口袋变小。本研究可为研究鲜枸杞保鲜及加工提供科学参考。Abstract: In order to investigate the effect of vacuum precooling on superoxide dismutase (SOD) enzyme activity of fresh Lycium barbarum and its molecular level mechanism, this paper explored the activity of SOD enzyme in crude enzyme liquid extracted from fresh Lycium barbarum of Ningxia was determined under 900 Pa and 1100 Pa vacuum precooling final pressure. The structural changes of SOD enzyme under different vacuum precooling pressure treatments were studied using molecular dynamics simulation for 150 ns, which included the changes of root mean square deviation (RMSD), radius of gyration (Rg), total energy, potential energy, kinetic energy, bond angle energy, root mean square fluctuation (RMSF), number of hydrogen bonds, surface structure and solvent accessible surface area (SASA). Then the optimum pressure conditions for vacuum precooling treatment were selected. The results of experiments showed that the activity of SOD enzyme was the highest under 900 Pa. The results of molecular dynamics simulation showed that the total energy, potential energy, kinetic energy and bond angle energy of SOD enzyme were in a balanced and stable state. An increase in pressure could cause changes in the surface structure of proteins, reduced the number of hydrogen bonds, and continuously decreased the solvent accessible surface area. Under the condition of 900 Pa, the protein structure was the most compact, and binding pocket became wider and easier to bind to the protein. The activity of SOD enzyme protein decreased under 1100 Pa, the protein structure was damaged, and binding pocket became smaller. This study could provide a scientific reference for the study of fresh Lycium barbarum preservation and processing.
-
枸杞(Lycium barbarum L)别名枸杞果,其果实、根皮及嫩叶皆可入药[1]。枸杞鲜果富含多糖、黄酮、甜菜碱、维生素等多种营养成分,具有保肝润肺、软化血管、治疗慢性肾衰竭等疗效[1−2]。此外,鲜枸杞中含有SOD酶,是植物体内抗氧化酶之一,可维持活性氧平衡和抑制酶促褐变,进而延缓果蔬衰老[3−4]。经研究证明,提高SOD酶活性可增强果蔬抗逆性,降低氧化应激所造成的损伤[5]。SOD酶作为一种新型药用酶,可以清除人体内过多的自由基,具有极强的抗炎症作用,可用于抗辐射和抗肿瘤[6]。因此,研究枸杞中的SOD酶可用于医学领域及保健食品的开发研究,具有广阔的应用前景。
近年来,枸杞新品种选育不断取得进展,新品种果实粒大饱满,内含物丰富,口感更佳,枸杞鲜果在市场中备受消费者青睐[2]。然而,鲜枸杞皮薄易软化,易发生机械损伤,贮藏期短[7],不断改进鲜枸杞保鲜技术成为新热点与话题。采用真空预冷技术对鲜枸杞进行保鲜加工最为广泛[8]。真空预冷技术主要应用于果蔬采摘后快速冷却,利用不同的压强条件降低水的沸点[9],物料的表面和组织内的水分蒸发进而吸收热量,从而达到降温目的,是迄今为止最快的制冷方法[10]。此技术极大地保证了果蔬内部的营养成分,延长果蔬在运输和贮藏过程中的保鲜时间[11]。针对真空预冷压强处理对鲜枸杞质构变化及生理生化活性的影响方面也相继开展了实验研究,鲁玲等[12]研究了鲜枸杞真空预冷和微孔膜包装后对其贮藏品质的影响,筛选出最优工艺参数。He等[13]通过将鲜枸杞进行真空预冷与酸性电解水结合处理,结果显示SOD酶活性增加,抗氧化性能得到提高。何小玲[14]研究了不同真空预冷压力(600~800 Pa、800~1000 Pa、1000~1200 Pa)对鲜枸杞生理生化特性的影响,结果表明,在1000~1200 Pa组SOD酶活性高于其他真空预冷组。
目前,有学者模拟木瓜蛋白酶在高压下的分子动力学变化规律[15],进行了超高压结合热处理对β-乳球蛋白结构的分子动力学模拟[16−17],对超氧化物歧化酶[18−19]、过氧化氢酶[20]、多酚氧化酶[21]等酶蛋白也进行了分子动力学研究,但未探讨植物中蛋白酶的分子动力学研究。相关研究未涉及抗氧化酶活性变化的内部机理,抗氧化酶蛋白分子水平的探索少有研究,缺乏真空预冷技术对浆果类组织分子层面的研究,压强变化过程中蛋白酶表面结构变化尚未明了。鉴于此,有必要进一步在900 Pa和1100 Pa真空预冷压强下开展实验。本文以前期测定实验为基础,在CK、900、1100 Pa处理下,对SOD酶进行150 ns分子动力学模拟,揭示不同真空预冷压强下鲜枸杞的SOD酶活性变化及分子水平研究,为鲜枸杞预处理技术提供科学的可操作性理论依据和技术保证。
1. 材料与方法
1.1 材料与仪器
成熟的枸杞果实(宁杞5号,带果柄) 采自宁夏回族自治区中卫市中宁县,4 h内运至实验室,选择成熟度、大小、色泽相近并且无明显机械损伤的枸杞,每盒50 g,共九盒样品,分为九组;BC0170超氧化物歧化酶试剂盒 北京索莱宝生物技术有限公司。
XZD-300移动式真空预冷机 东莞市科美斯科技实业有限公司;RDL480P气调包装机 成都罗迪波尔机械设备有限公司;5804R台式离心机 湘仪离心机仪器有限公司;T6紫外可见分光光度计 上海舜宇恒平科学仪器有限公司;HH-8恒温水浴锅 上海比朗仪器有限公司。
1.2 实验方法
1.2.1 预处理
将挑选后的鲜枸杞放入真空预冷机中,参照鲁玲等[12]与He等[13]的实验设计分组结果,设置了两组不同真空预冷压强(900 Pa、1100 Pa),进行真空预冷30 min。空白对照组(CK)无真空预冷处理,于常压、4 ℃状态下放置。鲜枸杞在真空预冷机内所受压强为900 Pa和1100 Pa,真空预冷处理组的终温均为4 ℃(277.15 K)。真空预冷后使用气调包装机进行密封处理。放置冰箱中4 ℃下冷藏3 d。每组样品准备三组,测量三次,取平均值。
1.2.2 粗酶液的提取
称取0.1 g鲜枸杞组织放入研钵,另取BC0170超氧化物歧化酶试剂盒中的提取液1 mL,进行冰浴匀浆并置于离心管。在8000 r/min、4 ℃下离心10 min后,取制得的上清液置于冰上待测。
1.2.3 超氧化物歧化酶(SOD)酶活性的测定
使用BC0170超氧化物歧化酶试剂盒进行酶活测定。按照试剂盒说明书的使用说明(NBT法),将样本与试剂盒中的试剂充分混匀,37 ℃水浴30 min后,置于1 mL玻璃比色皿测定560 nm下的吸光度,分别记为A测定、A对照、A1空白、A2空白,重复三次,求取平均值。计算公式如下:
抑制百分率(%)=ΔA空白−ΔA测定ΔA空白×100 (1) SOD活性(U/g)=11.4×抑制百分率×F(1−抑制百分率)×W (2) 式中:ΔA空白,A1空白-A2空白的差值;ΔA测定,A测定- A对照的差值;W,样品质量(g);F,样本的稀释倍数。
1.2.4 分子动力学模拟
参照于嘉祥等[22]对枸杞的分子动力学研究,枸杞为茄属,从RCSB网站(https://www.rcsb.org/)中下载SOD酶蛋白(ID号:3HOG),采用Gromacs(2020.2)软件[23−24],在Swiss-PdbViewer 4.1.0软件中查看是否有多余残基及氨基酸序列是否完整,去除多余的钾离子(K155)。使用PyMOL软件去除多余的结晶水[25]。模拟选用AMBER99SB力场[26],设置SPC(simple point charge)水模型,将蛋白放入立方体盒子中,盒子与蛋白相距最短距离为1 nm,添加6个Na+中和电荷,使体系达到电中性,使用最快下降法进行能量最小化[27]。进行400 ps的NVT平衡和NPT平衡,体系温度达到277.15 K,修改运行参数文件中的压力值,分别为CK、900、1100 Pa。进行SOD酶蛋白150 ns的MD模拟计算。选用LINCS(linear constraint solver)算法约束所有键,使用PME(particle-mesh-Ewald)方法计算静电作用[28],范德华相互作用使用截断半径为1.2 nm进行计算。选用Berendsen压浴方式、Isotropic控压方式、V-rescale控温方式。模拟步长为2 fs,每10 ps储存1次数据。模拟结束后,去除周期性边界条件,然后使用Gromacs软件自备的相应命令分析不同处理条件下模拟过程中体系的均方根偏差(root mean square deviation,RMSD)、蛋白残基均方根涨落(root mean square fluctuation,RMSF)、回旋半径(radius of gyration,Rg)、氢键数量、键角能、总能量、动能、势能、蛋白质溶剂可及表面积(solvent accessible surface area,SASA)、表面结构。其中RMSD、RMSF、Rg的数据为1500个数据点,每0.1 ns提取一次。溶剂可及表面积及蛋白质表面结构只选取100 ns到150 ns的500个数据。
1.3 数据处理
鲜枸杞SOD酶活性在不同真空预冷压强处理后重复测定三次,使用Origin 8.0软件计算标准差和作图。蛋白质溶剂可及表面积采用SPSS 26软件进行统计。分子动力学模拟所得数据结果选用Origin 8.0系统软件比较多组数据的差异性。蛋白质表面结构的绘制使用PyMOL软件。
2. 结果与分析
2.1 鲜枸杞SOD酶活性测定
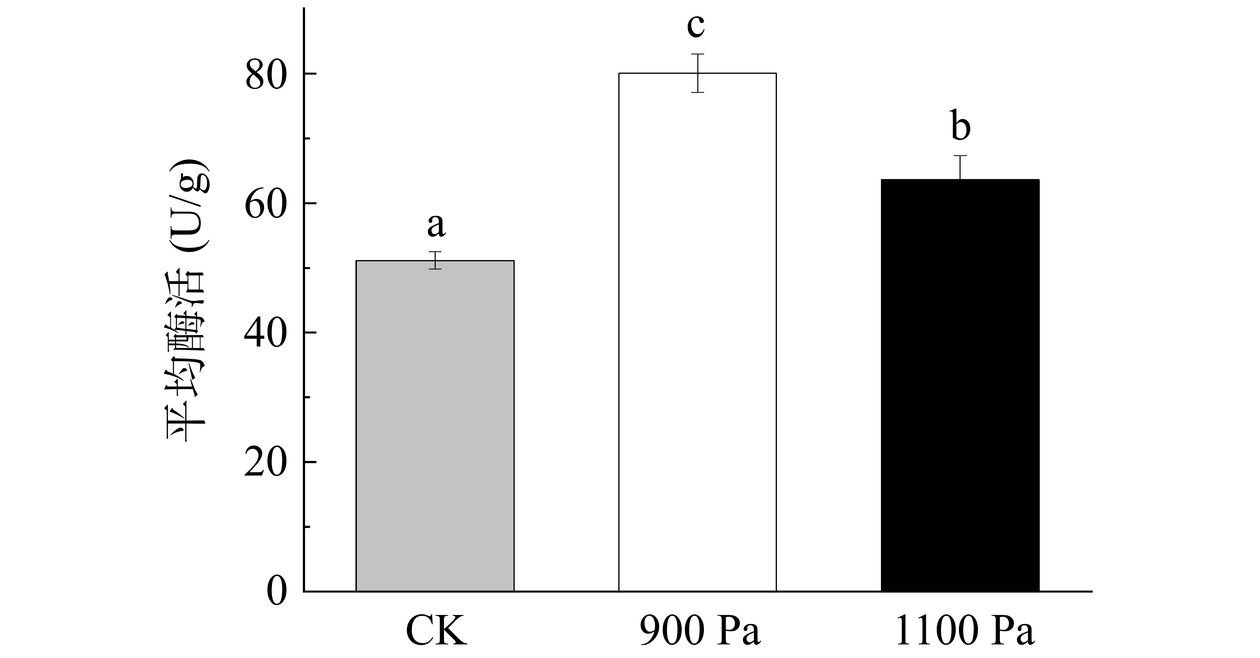
超氧化物歧化酶是植物体内重要的抗氧化酶,植物发生衰老时酶活通常会下降。SOD酶活性的提高有利于O2−清除,可以将O2−催化为H2O2[29]。如图1所示,鲜枸杞样品经不同真空预冷压强处理后,对SOD酶活性变化进行显著性分析。各组SOD酶活性均随着真空预冷压强的增大而发生变化,并在900 Pa时酶活最大。各组酶活分别为52.41 U/g(CK)、83.12 U/g(900 Pa)、63.75 U/g(1100 Pa)。这三组数据对比可知,900 Pa下处理后的SOD酶活性比CK组显著升高58.59%(P<0.05)。1100 Pa压强处理下,酶活有所下降,但仍显著高于CK组(P<0.05),与900 Pa处理组相比,酶活下降了23.3%。在1100 Pa压强下,酶活与其他组相比下降更多,其原因可能是在1100Pa压强处理下枸杞采后呼吸作用会释放更多的呼吸热,呼吸率升高导致酶活下降。何小玲[14]研究发现鲜枸杞在真空预冷终压为800~1000 Pa下贮藏抑制呼吸率上升,酶活低于1000~1200 Pa组。其原因是真空预冷终压在800~1000 Pa处理下,影响细胞膜完整性,导致细胞膜渗透率不断增加,促进丙二醛和超氧阴离子的积累,同时加速水分含量的流失。安容慧[30]对上海青在不同冷链运输中SOD酶活性变化,结果表明真空预冷处理可以维持较高的SOD酶活性,延缓衰老。因此,在真空预冷压强为900 Pa处理下,枸杞受到的氧化损伤最小,细胞功能结构及功能的破坏程度最低,这可能与果肉组织为减缓氧化胁迫损伤的自我调控相关。
2.2 不同真空预冷压强处理对SOD酶蛋白RMSD的影响
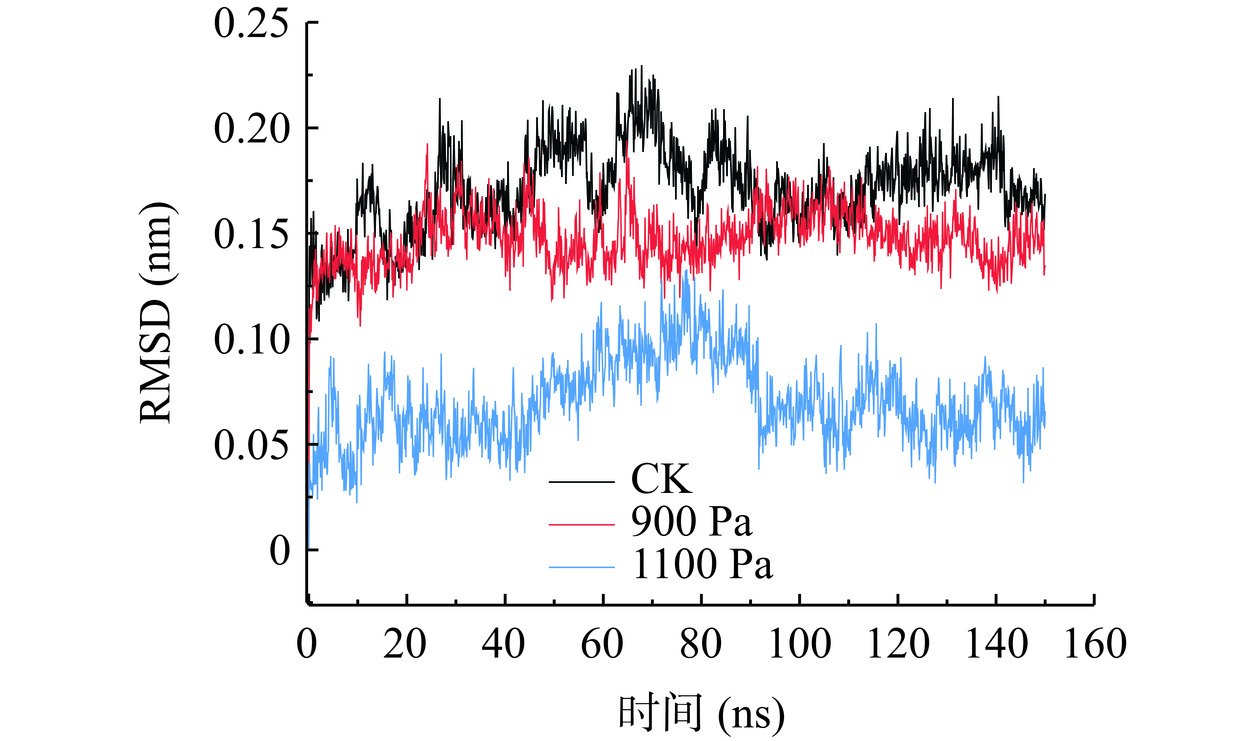
进行SOD酶蛋白的分子动力学模拟后,所获得的运动体系轨迹数据随时间变化,利用RMSD公式,绘制出相关曲线[19]。RMSD可以预测由外部压力引起的原子偏差,可以反映蛋白质结构的变化情况与体系是否稳定[22]。如图2所示,反映了在CK、900 Pa、1100 Pa下RMSD随时间的变化。在模拟开始之后的一段时间,RMSD值不稳定且变化剧烈,属于正常现象。在0~150 ns之间1100 Pa处理组的RMSD值相对波动起伏较大且数值最小。不同学者研究不同压强下蛋白的RMSD结果不一致,孔庆新等[16]结果表明,在500 MPa和800 MPa下的β-乳球蛋白波动起伏大于常压。黄业传等[15]研究高压处理对木瓜蛋白酶活性的影响,发现在200 MPa下可以减少酶蛋白结构的波动。总体而言,1100 Pa与900 Pa相比,压强增大的同时RMSD的数值减小,这可能是因为果蔬处于逆境环境或受到氧化应激时,SOD酶在活性氧清除系统中最先发挥作用。三种处理组相比,900 Pa处理下整体起伏较小,较为平稳,且与CK组相差不大。
2.3 不同真空预冷压强处理对SOD酶蛋白RMSF的影响
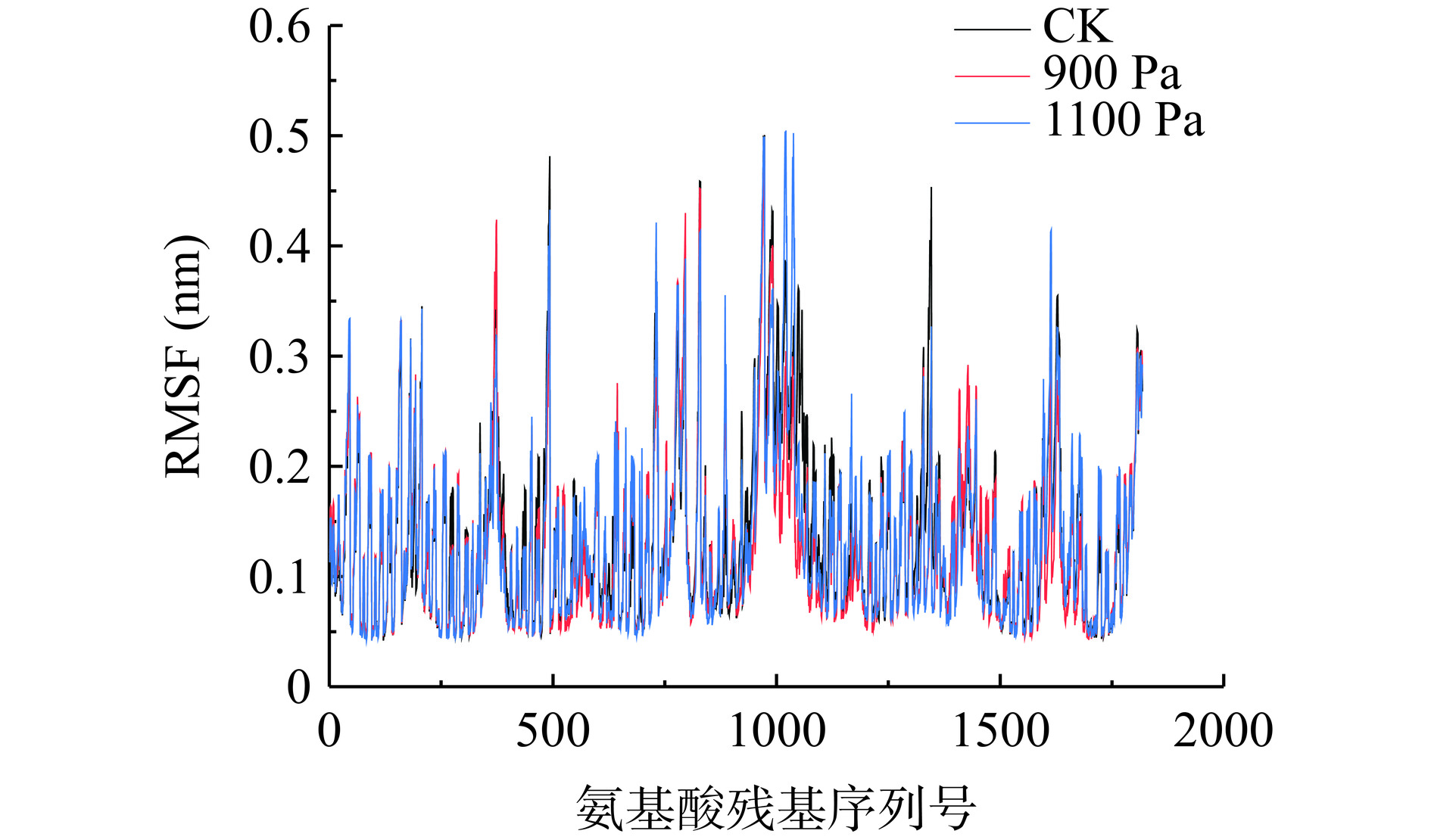
RMSF指原子相对于其平均位置的涨落,反映蛋白质结构的稳定性或柔性,也反映了蛋白中每一个氨基酸残基的均方根位移[19]。如图3所示,氨基酸序列号在901~1051之间的波动较大,其自由度较大,是部分结构不规则的氨基酸[31]。三种压强处理下的RMSF基本重合,波动范围在0~0.6之间,三者均波动性相对较小,整体处于稳定状态。因此可得,氨基酸残基的运动程度较为稳定。在CK、900 Pa、1100 Pa下的平均波动值分别为0.1394、0.1347、0.1282。可以表明,在真空预冷机舱内,随着压强的增加,残基的平均波动减小,酶蛋白的RMSF逐渐减少。
2.4 不同真空预冷压强处理对SOD酶蛋白回旋半径(Rg)的影响
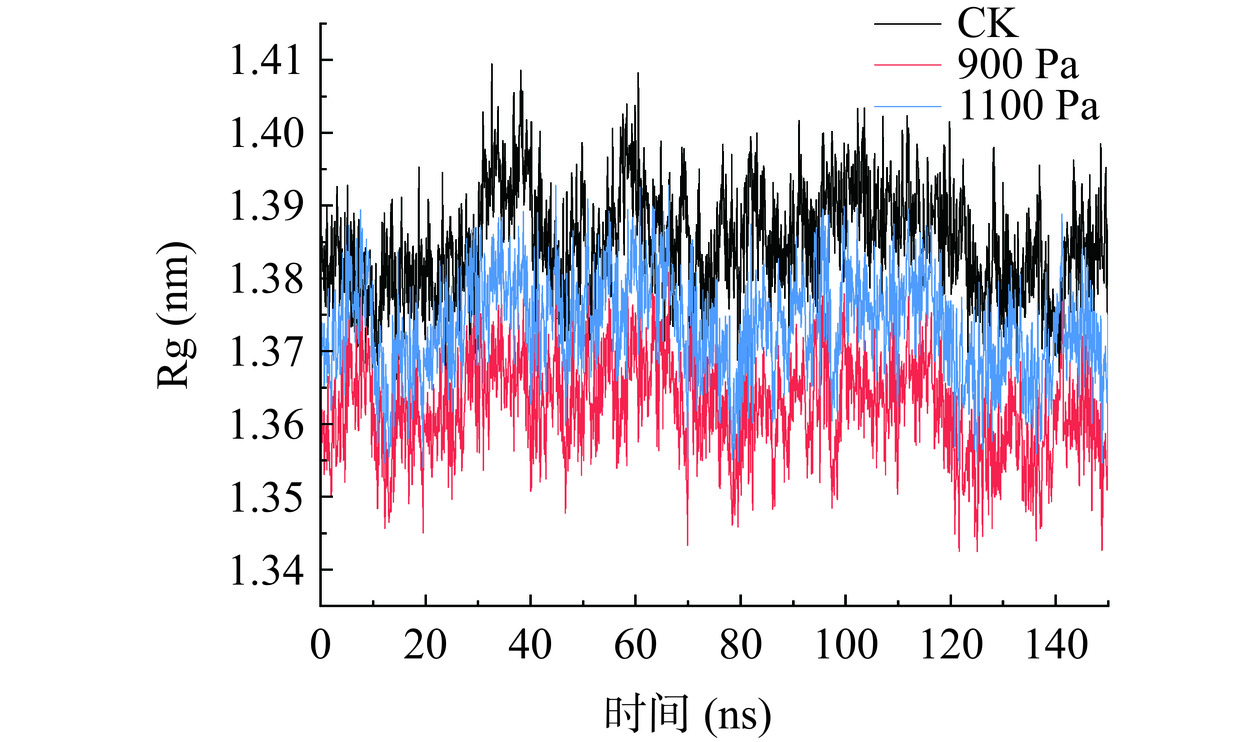
Rg可以反映蛋白质结构的可塑性潜力[32]。Rg越小,蛋白质结构越紧密[15]。由图4可以看出,在150 ns的模拟中,三种压强的Rg都稳定在1.34~1.42之间,整体状态基本稳定,说明体系中蛋白质整体骨架稳定。CK下的Rg均值为1.3775,而900 Pa处理下Rg均值为1.3743,1100 Pa处理下Rg均值为1.3732。随着压强增大,回旋半径不断减小,这与黄业传等[15]模拟高压处理对木瓜蛋白酶Rg影响的结果一致,说明在真空预冷机舱内,压力与回旋半径的变化呈反比。这说明所施加的压强越大,SOD酶更易形成紧密结构。这与本研究RMSD和RMSF的分析结果一致。枸杞成熟后硬度降低,易发生软化,而真空预冷处理会适当减缓枸杞硬度值的下降,这表明900 Pa处理下枸杞不易软化,SOD酶结构的紧密度提高。
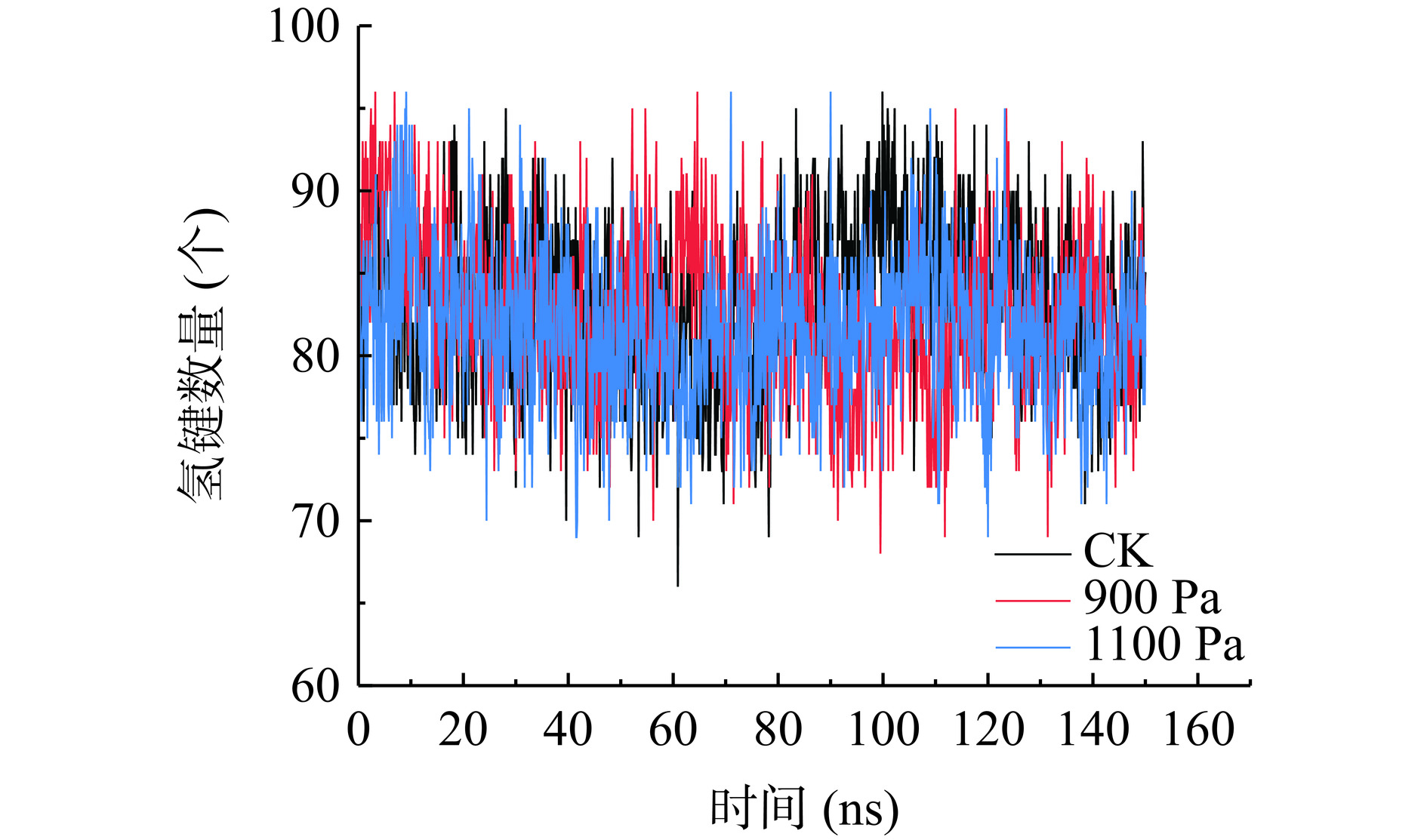
2.5 不同真空预冷压强处理对SOD酶蛋白氢键的影响
氢键作为稳定二级结构的主要非共价作用力,可以进一步反映体系二级结构是否达到平衡状态[14]。如图5所示,SOD酶在三种压强下氢键数量的变化,体系基本属于平衡状态。模拟开始60 ns以后进行计算,在CK、900 Pa、1100 Pa处理下蛋白质氢键数量的平均值分别为83.5、81.5、77.5个,可以看出随着真空预冷机舱内压强的增大,蛋白质氢键数量不断减少。900 Pa处理下,与CK组相比,氢键个数平均减少了2个。1100 Pa处理下,氢键个数与900 Pa处理组相比平均减少了4个,这可能是1100 Pa处理组SOD酶活低于900 Pa处理组的原因之一。简清梅等[17]高压处理β-乳球蛋白其氢键数量也不断减少,蛋白质结构受到破坏。其原因可能是不断增大压强会降低果实的细胞膜渗透率[16],从而降低蛋白质结构的稳定性。
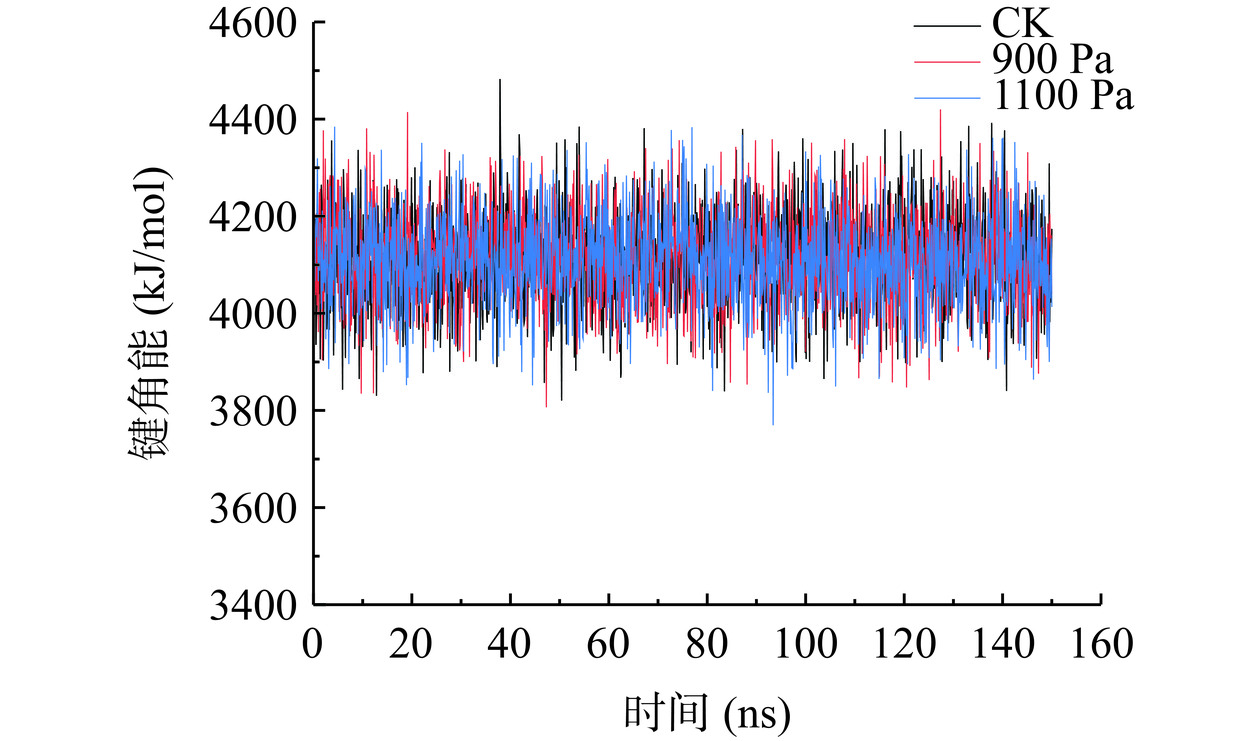
2.6 不同真空预冷压强处理对SOD酶蛋白键角能的影响
键角能是反映分子空间结构的重要因素,蛋白的键角能可以得出键之间距离随时间的变化以及距离的分布[20]。由图6可以看出,在0~150 ns的模拟中,各组键角能整体趋于稳定。整体平均值在3800~4400 kJ/mol之间。CK组键角能的平均值为4113.37 kJ/mol。在900 Pa处理下,键角能的平均值为4112.58 kJ/mol。在1100 Pa处理下,键角能的平均值为4109.22 kJ/mol。上述数据表明,该体系在模拟运行过程中保持平衡稳定状态。这与杨晓宇[31]的模拟结果变化趋势相似,键角能的能量体系处于平衡状态。
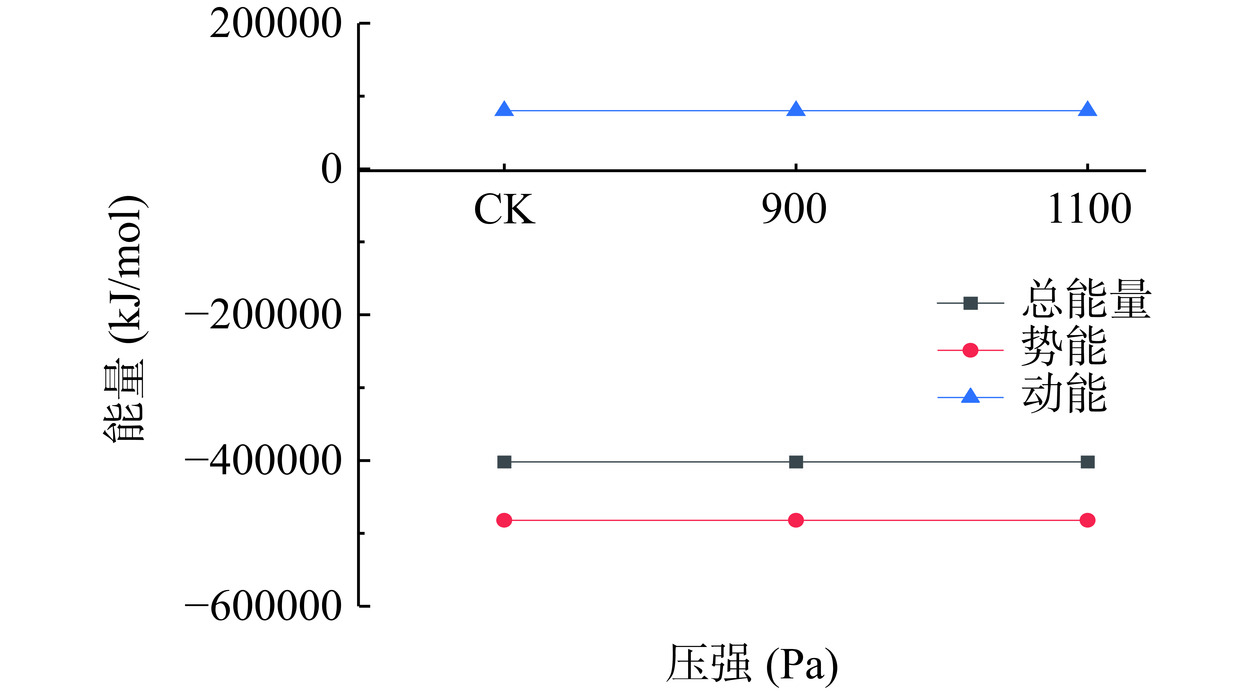
2.7 不同真空预冷压强处理对SOD酶蛋白总能量、势能、动能的影响
酶蛋白的总能量、势能和动能都能够体现整体是否体系达到平衡[31]。图7反映了三种压强下在0~150 ns内总能量、动能、势能的均值变化图,可以清楚的看出在CK、900 Pa、1100 Pa均为稳定状态,具有极小波动性,无明显变化,所以总能量、势能、动能均处于平衡稳定状态。在CK、900 Pa、1100 Pa处理下,体系的总能量平均值为−401823.07、−401851.33、−401874.88 kJ/mol,而体系的平均总势能分别为−481955.47、−481951.82、−481986.67 kJ/mol。除此以外,体系的平均总动能在CK、900 Pa、1100 Pa下分别为80132.4、80100.49、80111.27 kJ/mol。无论是总能量还是动能、势能都是处于平稳的状态,这与键角能的变化状态一致。而杨晓宇[31]在过氧化氢酶的分子动力学研究结果分析中也表明,总能量、动能、势能保持不变。
2.8 不同真空预冷压强处理对SOD酶蛋白溶剂可及表面积的影响
SASA指溶剂可接触的蛋白质表面积,是描述蛋白质疏水性的重要因素[33]。表1中的数据为100~150 ns的平均值。由表1可知,真空预冷处理组在压强不断增大的情况下,总溶剂可及表面积与亲水面积、疏水面积均显著减少(P<0.05),这与黄业传等[15]的模拟结果相近,压强不断增大时,溶剂可及表面积减小。有学者表示,疏水表面积不断减少可能是由于水分子进入蛋白质内部,使得疏水区域暴露[21]。表1显示,亲水面积和疏水面积相比,前者面积大于后者,说明SOD酶为水溶性蛋白。而在真空预冷机内压强增大的同时,蛋白的亲水面积与疏水面积均显著降低,这可能与压强增大后H2O2的积累量不断增加、枸杞的耐逆性降低有关。一些学者采用试验方式得出压强增大会增加蛋白的疏水性,但分子模拟与试验存在差异,不能完全一致等同[34]。
表 1 不同压强处理对SOD酶蛋白溶剂可及表面积的影响Table 1. Effect of different pressure on the SASA of SOD enzyme protein不同压强
处理条件总溶剂可及
表面积(nm2)亲水面积
(nm2)疏水面积
(nm2)CK 75.25±2.23a 49.15±1.62a 26.11±1.43a 900 Pa 74.63±1.36a 48.81±1.21a 25.82±0.89a 1100 Pa 69.47±2.35b 43.95±0.84b 21.52±1.69b 注:同列小写字母不同表示差异显著(P<0.05)。 2.9 不同真空预冷压强处理对SOD酶蛋白表面结构的影响
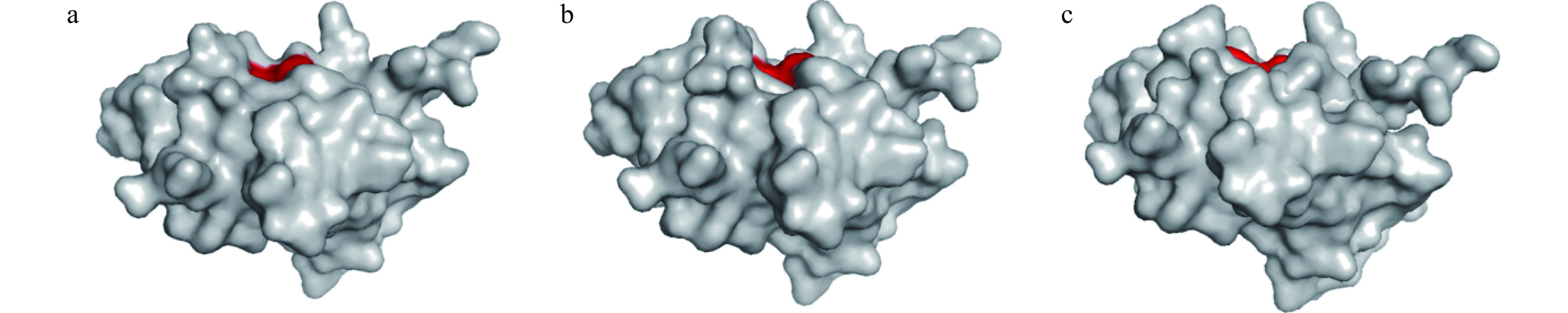
本研究的SOD酶为CuZn-SOD酶,也称为SOD 1。CuZn-SOD的活性部分是一个椭圆形的口袋,选取44、46、118位的氨基酸残基作为活性中心[29]。使用PyMOL软件,得到以下三个在不同压强处理下的酶蛋白分子[35],如图8所示。图8a为CK组SOD酶的表面结构。红色处为活性口袋位置。图8b为900 Pa处理下的表面结构,由于压强的增大,活性口袋暴露,接触面相对变大,有利于蛋白相结合。图8c是在1100 Pa处理下的表面结构变化,结构更加扁平且窄小,活性口袋在更大压强的作用下通道变窄,使其不宜结合,活性口袋附近的氨基酸残基受到挤压,发生倾斜[36]。在高压处理多酚氧化酶的分子动力学研究中,结果与之一致[33]。
3. 结论
真空预冷技术对采后鲜枸杞的果实品质、抗氧化酶活具有较好的维持效果,提高了果实抗氧化能力,有效延长了鲜枸杞的货架寿命。通过测定酶活,结果表明,在900 Pa处理下,SOD酶活性显著升高。本研究进行了150 ns的分子动力学模拟,模拟了SOD酶活性在分子水平改变的内部状态,明确了不同压强处理下蛋白酶的内部分子构象。分子动力学模拟结果分析显示,900 Pa处理下,酶蛋白的表面结构发生改变,活性口袋处通道变宽,利于更好的与配体或者目标蛋白结合。而1100 Pa处理下,酶蛋白由于受到较大压强变化,溶剂可及表面积显著减小。此外,在900 Pa处理下,RMSF的平均波动值最小,表明蛋白质结构最紧密。总体体系基本趋于稳定状态,三种压强处理下,总能量、势能、动能及键角能都处于相对平衡状态下。综合实验探讨发现,在900 Pa处理下,SOD酶活最高,蛋白质结构及性能最为稳定。这为枸杞保鲜中选用最适压强处理提供了科学依据,为深入探讨枸杞等果蔬在分子动力学模拟中的研究提供参考,有望在之后应用于枸杞精深加工,不断探索鲜枸杞的贮藏保鲜技术。
-
表 1 不同压强处理对SOD酶蛋白溶剂可及表面积的影响
Table 1 Effect of different pressure on the SASA of SOD enzyme protein
不同压强
处理条件总溶剂可及
表面积(nm2)亲水面积
(nm2)疏水面积
(nm2)CK 75.25±2.23a 49.15±1.62a 26.11±1.43a 900 Pa 74.63±1.36a 48.81±1.21a 25.82±0.89a 1100 Pa 69.47±2.35b 43.95±0.84b 21.52±1.69b 注:同列小写字母不同表示差异显著(P<0.05)。 -
[1] 王晓菁. 宁夏枸杞产业发展存在的问题与挑战及对策研究[J]. 宁夏农林科技,2023,64(11):32−35. [WANG X J. Research on problems, challenges and countermeasures of the development of Wolfberry industry in Ningxia[J]. Ningxia Agriculture and Forestry Science and Technology,2023,64(11):32−35.] doi: 10.3969/j.issn.1002-204x.2023.11.009 WANG X J. Research on problems, challenges and countermeasures of the development of Wolfberry industry in Ningxia[J]. Ningxia Agriculture and Forestry Science and Technology, 2023, 64(11): 32−35. doi: 10.3969/j.issn.1002-204x.2023.11.009
[2] 闫亚美, 米佳, 秦垦, 等. 宁夏枸杞品质响应因素研究进展[J]. 宁夏农林科技,2023,64(11):28−31. [YAN Y M, MI J, QIN K, et al. Research progress on quality response factors of Lycium barbarum in Ningxia[J]. Ningxia Agriculture and Forestry Science and Technology,2023,64(11):28−31.] doi: 10.3969/j.issn.1002-204x.2023.11.008 YAN Y M, MI J, QIN K, et al. Research progress on quality response factors of Lycium barbarum in Ningxia[J]. Ningxia Agriculture and Forestry Science and Technology, 2023, 64(11): 28−31. doi: 10.3969/j.issn.1002-204x.2023.11.008
[3] 林继辉, 陈莎莎, 陈梓嫔, 等. 余甘子果超氧化物歧化酶提取工艺优化及抗氧化性研究[J]. 云南民族大学学报(自然科学版),2023,32(2):199−208. [LIN J H, CHEN S S, CHEN Z P, et al. Study on the optimization of extraction process of superoxide dismutase from Phyllanthus emblica and its antioxidant activity[J]. Journal of Yunnan Minzu University (Natural Science Edition),2023,32(2):199−208.] doi: 10.3969/j.issn.1672-8513.2023.02.009 LIN J H, CHEN S S, CHEN Z P, et al. Study on the optimization of extraction process of superoxide dismutase from Phyllanthus emblica and its antioxidant activity[J]. Journal of Yunnan Minzu University (Natural Science Edition), 2023, 32(2): 199−208. doi: 10.3969/j.issn.1672-8513.2023.02.009
[4] JIN X, LIU Z, WU W F. POD, CAT and SOD enzyme activity of corn kernels as affected by low plasma pretreatment[J]. International Journal of Food Properties,2023,26(1):38−48. doi: 10.1080/10942912.2022.2151619
[5] GONG H G, REHMAN F, MA Y, et al. Germplasm resources and strategy for genetic breeding of Lycium species:A review[J]. Frontiers in Plant Science,2022,13:802936. doi: 10.3389/fpls.2022.802936
[6] 朱秀敏. 超氧化物歧化酶的生理活性[J]. 当代医学,2011,17(15):26−27. [ZHU X M. Physiological activity of superoxide dismutase[J]. Contemporary Medicine,2011,17(15):26−27.] doi: 10.3969/j.issn.1009-4393.2011.15.017 ZHU X M. Physiological activity of superoxide dismutase[J]. Contemporary Medicine, 2011, 17(15): 26−27. doi: 10.3969/j.issn.1009-4393.2011.15.017
[7] 尹俊杰. 鲜枸杞真空预冷过程热质传递的数值模拟[D]. 银川:宁夏大学, 2022. [YIN J J. Numerical Simulation of heat and mass Transfer during vacuum precooling of fresh wolfberry[D]. Yinchuan:Ningxia University, 2022.] YIN J J. Numerical Simulation of heat and mass Transfer during vacuum precooling of fresh wolfberry[D]. Yinchuan: Ningxia University, 2022.
[8] AN R H, LUO S F, ZHOU H S, et al. Effects of hydrogen-rich water combined with vacuum precooling on the senescence and antioxidant capacity of pakchoi (Brassica rapa subsp. Chinensis)[J]. Scientia Horticulturae,2021,289:110469. doi: 10.1016/j.scienta.2021.110469
[9] 廖彩虎. 基于微观结构研究优化真空预冷技术对西式火腿品质及安全的影响[D]. 广州:华南理工大学, 2020. [LIAO C H. Effect of innovative vacuum cooling on the quality and safety of cooked meat product-based on the prespective of microstructure [D]. Guangzhou:South China University of Technology, 2020.] LIAO C H. Effect of innovative vacuum cooling on the quality and safety of cooked meat product-based on the prespective of microstructure [D]. Guangzhou: South China University of Technology, 2020.
[10] 鲁焱兴. 真空预冷技术与气调包装延长香菇保藏期的研究[D]. 哈尔滨:哈尔滨商业大学, 2020. [LU Y X. Extending shelf life of Lentinus edodes by vacuum precooling and modified atmosphere packaging[D]. Harbin:Harbin University of Commerce, 2020.] LU Y X. Extending shelf life of Lentinus edodes by vacuum precooling and modified atmosphere packaging[D]. Harbin: Harbin University of Commerce, 2020.
[11] 梁豪, 田怀文, 杨文哲. 真空预冷技术及其在果蔬方面的应用和发展前景[J]. 科技创新与生产力,2020(11):75−77. [LIANG H, TIAN H W, YANG W Z. Vacuum precooling technology and its application and development prospect in fruits and vegetables[J]. Science and Technology innovation and Productivity,2020(11):75−77.] doi: 10.3969/j.issn.1674-9146.2020.11.075 LIANG H, TIAN H W, YANG W Z. Vacuum precooling technology and its application and development prospect in fruits and vegetables[J]. Science and Technology innovation and Productivity, 2020(11): 75−77. doi: 10.3969/j.issn.1674-9146.2020.11.075
[12] 鲁玲, 康宁波, 刘贵珊, 等. 真空预冷结合微孔膜包装对鲜枸杞贮藏品质的影响[J]. 农业工程学报,2021,37(10):245−252. [LU L, KANG N B, LIU G S, et al. Storage quality of fresh Lycium barbarum by vacuum precooling and microporous membrane packaging[J]. Transactions of the Chinese Society of Agricultural Engineering,2021,37(10):245−252.] doi: 10.11975/j.issn.1002-6819.2021.10.029 LU L, KANG N B, LIU G S, et al. Storage quality of fresh Lycium barbarum by vacuum precooling and microporous membrane packaging[J]. Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(10): 245−252. doi: 10.11975/j.issn.1002-6819.2021.10.029
[13] HE X L, WU C, LU L, et al. Influence of acidic electrolyzed water combined with vacuum precooling treatment on quality and antioxidant performance of fresh Lycium barbarum L.[J]. Journal of Food Processing and Preservation, 2022, 46(12).
[14] 何小玲. 真空预冷对鲜枸杞力学及生理特性的影响研究[D]. 银川:宁夏大学, 2023. [HE X L. The study of the effects of vacuum precooling on the mechanical and physiological properties of fresh goji berries[D]. Yinchuan:Ningxia University, 2023.] HE X L. The study of the effects of vacuum precooling on the mechanical and physiological properties of fresh goji berries[D]. Yinchuan: Ningxia University, 2023.
[15] 黄业传, 张喜才, 曾奕秀, 等. 高压处理对木瓜蛋白酶活性的影响及分子动力学模拟[J]. 食品工业科技,2023,44(12):102−107. [HUANG Y C, ZHANG X C, ZENG Y X, et al. Effect of high pressure treatment on papain activity and molecular dynamics simulation[J]. Food Industry Science and Technology,2023,44(12):102−107.] HUANG Y C, ZHANG X C, ZENG Y X, et al. Effect of high pressure treatment on papain activity and molecular dynamics simulation[J]. Food Industry Science and Technology, 2023, 44(12): 102−107.
[16] 孔庆新, 罗丽梅, 黄业传, 等. 分子动力学探究高压对β-乳球蛋白与多酚结合的影响[J]. 食品与发酵工业,2022,48(3):107−114. [KONG Q X, LUO L M, HUANG Y C, et al. The effect of high pressure on the combination of β-lactoglobulin and polyphenol using molecular dynamic model[J]. Food and Fermentation Industry,2022,48(3):107−114.] KONG Q X, LUO L M, HUANG Y C, et al. The effect of high pressure on the combination of β-lactoglobulin and polyphenol using molecular dynamic model[J]. Food and Fermentation Industry, 2022, 48(3): 107−114.
[17] 简清梅, 索化夷, 张喜才, 等. 分子动力学模拟超高压结合热处理对β-乳球蛋白结构的影响[J]. 食品科学,2021,42(23):57−63. [JIAN Q M, SUO H Y, ZHANG X C, et al. Effect of combined high pressure and thermal on structure of β-lactoglobulin evaluated by molecular dynamics simulation[J]. Food Science,2021,42(23):57−63.] doi: 10.7506/spkx1002-6630-20210427-378 JIAN Q M, SUO H Y, ZHANG X C, et al. Effect of combined high pressure and thermal on structure of β-lactoglobulin evaluated by molecular dynamics simulation[J]. Food Science, 2021, 42(23): 57−63. doi: 10.7506/spkx1002-6630-20210427-378
[18] 赵泽丰, 亢恺雯, 年梦, 等. 杜仲中超氧化物歧化酶1抑制成分的虚拟筛选及分子动力学研究[J]. 西北药学杂志,2023,38(1):124−132. [ZHAO Z F, KANG K W, NIAN M, et al. Virtual screening and molecular dynamics simulation studies of effective superoxide dismutase 1 inhibitory constituents from Eucommia ulmoides[J]. Northwestern Journal of Pharmacy,2023,38(1):124−132.] doi: 10.3969/j.issn.1004-2407.2023.01.022 ZHAO Z F, KANG K W, NIAN M, et al. Virtual screening and molecular dynamics simulation studies of effective superoxide dismutase 1 inhibitory constituents from Eucommia ulmoides[J]. Northwestern Journal of Pharmacy, 2023, 38(1): 124−132. doi: 10.3969/j.issn.1004-2407.2023.01.022
[19] BAGEWADI Z K, KHAN T M Y, GANGADHARAPPA B, et al. Molecular dynamics and simulation analysis against superoxide dismutase (SOD) target of micrococcus luteus with secondary metabolites from Bacillus licheniformis recognized by genome mining approach[J]. Saudi Journal of Biological Sciences,2023,30(9):103753. doi: 10.1016/j.sjbs.2023.103753
[20] 吴鹏娟. 过氧化氢酶和葡萄糖氧化酶双酶连接的分子动力学研究[D]. 北京:北京化工大学, 2013. [WU P J. Molecular dynamics study of dual-enzyme system of catalase and glucose oxidase[D]. Beijing:Beijing University of Chemical Technology, 2013.] WU P J. Molecular dynamics study of dual-enzyme system of catalase and glucose oxidase[D]. Beijing: Beijing University of Chemical Technology, 2013.
[21] ZHOU H L, WANG F H, NIU H H, et al. Structural studies and molecular dynamic simulations of polyphenol oxidase treated by high pressure processing.[J]. Food Chemistry,2021,372:131243.
[22] 于嘉祥, 张瀚文, 曲超, 等. 基于生信分析、分子对接及分子动力学研究枸杞子中活性成分改善胰岛素抵抗的作用机制[J]. 世界科学技术-中医药现代化,2021,23(11):3997−4008. [YU J X, ZHANG H W, QU C, et al. Study on the mechanism of active ingredients in wolfberry to improve insulin resistance based on biogenic analysis, molecular docking and molecular dynamics[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2021,23(11):3997−4008.] doi: 10.11842/wst.20210105009 YU J X, ZHANG H W, QU C, et al. Study on the mechanism of active ingredients in wolfberry to improve insulin resistance based on biogenic analysis, molecular docking and molecular dynamics[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2021, 23(11): 3997−4008. doi: 10.11842/wst.20210105009
[23] MARTINS L C, CINO E A, FERREIRA R S. PyAutoFEP:An automated free energy perturbation workflow for GROMACS integrating enhanced sampling methods[J]. Journal of Chemical Theory and Computation,2021,17(7):4262−4273. doi: 10.1021/acs.jctc.1c00194
[24] HESS B, KUTZNER C, VAN DER SPOEL D, et al. GROMACS 4:Algorithms for highly efficient, load-balanced, and scalable molecular simulation[J]. Journal of Chemical Theory and Computation,2008,4(3):435−447. doi: 10.1021/ct700301q
[25] MOOERS H B M, MARINA B. Templates for writing PyMOL scripts.[J]. Protein Science,2020,30(1):262−269.
[26] 张驭洲, 曹武迪, 卜景德, 等. GROMACS 2020在ROCm平台上的移植与优化[J]. 计算机工程与科学,2021,43(11):1901−1909. [ZHANG Y Z, CAO W D, BU J D, et al. Porting and optimization of GROMACS 2020 on ROCm platform[J]. Computer Engineering and Science,2021,43(11):1901−1909.] doi: 10.3969/j.issn.1007-130X.2021.11.001 ZHANG Y Z, CAO W D, BU J D, et al. Porting and optimization of GROMACS 2020 on ROCm platform[J]. Computer Engineering and Science, 2021, 43(11): 1901−1909. doi: 10.3969/j.issn.1007-130X.2021.11.001
[27] VANGA S K, SINGH A, RAGHAVAN V. Changes in soybean trypsin inhibitor by varying pressure and temperature of processing:A molecular modeling study[J]. Innovative Food Science & Emerging Technologies,2018,49:31−40.
[28] ZHANG X J, YI W G, LIU G S, et al. Colour and chlorophyll level modelling in vacuum-precooled green beans during storage[J]. Journal of Food Engineering,2021,301:110523. doi: 10.1016/j.jfoodeng.2021.110523
[29] 章轶锋, 唐善虎, 秦文玲, 等. 铜锌超氧化物歧化酶的研究进展[J]. 四川畜牧兽医,2008(1):33−35. [ZHANG Y F, TANG S H, QIN W L, et al. Research progress of Cu-Zn superoxide dismutase[J]. Sichuan Animal Husbandry and Veterinary Science,2008(1):33−35.] doi: 10.3969/j.issn.1001-8964.2008.01.015 ZHANG Y F, TANG S H, QIN W L, et al. Research progress of Cu-Zn superoxide dismutase[J]. Sichuan Animal Husbandry and Veterinary Science, 2008(1): 33−35. doi: 10.3969/j.issn.1001-8964.2008.01.015
[30] 安容慧. 富氢水结合真空预冷对采后上海青营养品质的影响[D]. 沈阳:沈阳农业大学, 2020. [AN R H. Effect of hydrogen-rich water combined with vacuum precooling on the nutritional quality of postharvest Shangqing[D]. Shenyang:Shenyang Agricultural University, 2020.] AN R H. Effect of hydrogen-rich water combined with vacuum precooling on the nutritional quality of postharvest Shangqing[D]. Shenyang: Shenyang Agricultural University, 2020.
[31] 杨晓宇. 过氧化氢酶在电场下的分子动力学研究[D]. 郑州:郑州大学, 2019. [YANG X Y. Molecular dynamics of catalase under electric field[D]. Zhengzhou:Zhengzhou University, 2019.] YANG X Y. Molecular dynamics of catalase under electric field[D]. Zhengzhou: Zhengzhou University, 2019.
[32] 高进. 木瓜蛋白酶加工过程中的性质及结构研究[D]. 天津:天津科技大学, 2018. [GAO J. Study on the properties and structure of papain in processing [D]. Tianjin:Tianjin University of Science and Technology, 2018.] GAO J. Study on the properties and structure of papain in processing [D]. Tianjin: Tianjin University of Science and Technology, 2018.
[33] BORGSTAHL G E O, OBERLEY-DEEGAN R E. Superoxide dismutases (SODs) and SOD Mimetics[J]. Antioxidants,2018,7(11):156−156. doi: 10.3390/antiox7110156
[34] 李维忠, 刘小兰, 王谨玲, 等. 修饰Cu, Zn超氧化物歧化酶的分子动力学模拟[J]. 南开大学学报(自然科学版),1996(1):90−94. [LI W Z, LIU X L, WANG J L, et al. Molecular dynamics simulation of modified copper and zing superoxide dismutase[J]. Journal of Nankai University (Natural Science Edition),1996(1):90−94.] LI W Z, LIU X L, WANG J L, et al. Molecular dynamics simulation of modified copper and zing superoxide dismutase[J]. Journal of Nankai University (Natural Science Edition), 1996(1): 90−94.
[35] 史龙. 三氟乙醇对超氧化物歧化酶和酪氨酸酶活力与结构的影响:酶动力学和计算机模拟研究[D]. 广州:南方医科大学, 2011. [SHI L. Effects of trifluoroethanol on the activities and structures of superoxide dismutase and tyrosinase:enzyme kinetics and computer simulation studies[D]. Guangzhou:Southern Medical University, 2011.] SHI L. Effects of trifluoroethanol on the activities and structures of superoxide dismutase and tyrosinase: enzyme kinetics and computer simulation studies[D]. Guangzhou: Southern Medical University, 2011.
[36] JAHAN I, NAYEEM S M. Conformational dynamics of superoxide dismutase (SOD 1) in osmolytes:A molecular dynamics simulation study[J]. RSC Advances,2020,10(46):27598−27614. doi: 10.1039/D0RA02151B





 下载:
下载:
 下载:
下载:



