Extraction, Purification, Functional Properties and Antioxidant Activity Analysis of Donkey Serum Albumin from Asini Corii Colla
-
摘要: 目的:优化阿胶中驴血清白蛋白(Donkey Serum Albumin,DSA)的提取、纯化工艺参数,鉴定纯化后DSA的纯度,比较纯化前后DSA的乳化性、起泡性等功能特性及抗氧化活性。方法:本研究以阿胶为原料,以DSA提取率为响应值,通过单因素及Box-Behnken响应曲面设计确定盐析-超声波辅助提取法最佳提取工艺;采用葡聚糖凝胶SephadexG-75法纯化阿胶中DSA浓度,其次用SDS-PAGE凝胶电泳法鉴定纯化后阿胶中DSA的纯度;对比纯化前后阿胶中DSA的持水性、持油性、乳化性及起泡性;利用DSA对超氧阴离子自由基、ABTS+自由基、DPPH自由基和羟自由基的清除能力分析其体外抗氧化活性。结果:阿胶中DSA最佳提取工艺参数为:溶解液配比1:11 g/mL,料液比1:8.3 g/mL,超声功率400 W,超声时间31 min,在此条件下DSA提取率为49.57%,纯化后DSA纯度可达到83.7%;功能特性结果表明,不同pH条件下纯化后的DSA较纯化前在持水性、持油性、乳化性和起泡性方面均有所增强;体外抗氧化结果表明,DSA具有较强的体外抗氧化活性,当DSA浓度为10.0 mg/mL时,其对超氧阴离子自由基、ABTS+自由基、DPPH自由基和羟自由基的清除率分别为73.39%、83.61%、71.24%、83.79%。结论:阿胶中DSA采用的提取、纯化及鉴定技术简单快捷,可行度高,为阿胶的高值化利用和功能食品的开发提供一定的参考。Abstract: Objectives: This study was to optimize the extraction and purification process parameters of donkey serum albumin (DSA) from Asini Corii Colla, to compare the emulsification, foaming properties and antioxidant activity of DSA before and after purification, and to identify the purity of DSA. Methods: In this study, Asini Corii Colla was used as raw material and DSA extraction rate was used as the response value, the optimum extraction process of salting-out-ultrasonic assisted extraction was determined by single factor and Box-Behnken response surface design. The concentration of DSA in Asini Corii Colla was purified by Sephadex G-75, and the purity of DSA in purified Asini Corii Colla was identified by SDS-PAGE gel electrophoresis. The water holding capacity, oil holding capacity, emulsification and foaming properties of DSA in Asini Corii Colla before and after purification were compared. Finally, DSA was used to analyze its antioxidant activity in vitro by scavenging ability of superoxide anion radical, ABTS+ radical, DPPH radical and hydroxyl radical. Results: The optimum extraction process parameters of DSA in Asini Corii Colla were as follows: The ratio of dissolved solution was 1:11 g/mL, the ratio of material to liquid was 1:8.3 g/mL, the ultrasonic power was 400 W, and the ultrasonic time was 31 minutes. Under these conditions, the extraction rate of DSA was 49.57%, and the purity of DSA after purification could reach 83.7%. The results of functional properties showed that the water holding capacity, oil holding capacity, emulsification and foaming properties of DSA purified under different pH conditions were enhanced compared with those before purification. The results of antioxidant activity in vitro showed that DSA had strong antioxidant activity in vitro. When the concentration of DSA was 10.0 mg/mL, the scavenging rates of superoxide anion radical, ABTS+ radical, DPPH radical and hydroxyl radical were 73.39%, 83.61%, 71.24% and 83.79%, respectively. Conclusions: The extraction, purification and identification techniques of DSA in Asini Corii Colla are simple, rapid, and high feasibility, which provides a certain reference for the high-value utilization of Asini Corii Colla and the development of functional food.
-
Keywords:
- Asini Corii Colla /
- donkey serum albumin /
- purification /
- antioxidation /
- functional properties
-
阿胶(Asini Corii Colla)始载于《神农本草经》,列为上品,被誉为“补血圣药”[1]。《中华人民共和国药典》2020年版规定阿胶为马科动物驴(Equus asinus L.)的干燥皮或鲜皮经煎煮、浓缩而制成的固体胶[2]。阿胶与人参、鹿茸并称为中药三宝,其最主要的化学成分为氨基酸、多肽和蛋白质。阿胶味甘、性平,归肺、肝、肾经,具有补血止血和滋阴润燥的功效[3]。随着人们保健意识的增强,有养血滋补功效的阿胶更加受到大家的关注。阿胶中有3种主要蛋白质:驴胶原蛋白α1(Ⅰ)型、驴胶原蛋白α2(Ⅰ)型和驴血清白蛋白(Donkey Serum Albumin,DSA),其中DSA的含量最高[4]。蛋白的提取方法主要包括水提法[5]、盐析法[6]、碱溶法[7]、酶解法等[8],但这些方法各有优缺点,考虑到成本及蛋白活性等因素,本试验选择盐析法结合超声波辅助提取DSA。有研究表明,阿胶中的DSA存在于驴真皮中,是其中的主要蛋白组分,且具有广泛的药理作用,如抑制高血压、促进骨髓造血细胞增殖[9]、抗氧化[10]、抗疲劳[11]等。梁荣等[12]通过酶解法制备阿胶蛋白肽,并对阿胶蛋白肽抗氧化活性进行了分析,结果表明随阿胶蛋白肽浓度的增加,ABTS+自由基清除能力和 DPPH自由基清除能力均增强。李昊等[13]通过研究发现源于DSA的肽具有刺激造血系统相关细胞增殖、抗肿瘤及抑制血管紧张素转换酶(ACE)的作用。
药食同源产品是我国大健康产业的重要组成部分,也是当前中药新产品研发的热点之一,而阿胶作为我国第一批“药食同源”中药材,目前却鲜有对阿胶中DSA的提取工艺、纯化、抗氧化活性及功能特性的报道,因此本研究以阿胶为原料,通过单因素及Box-Behnken响应曲面设计确定盐析-超声波辅助提取法最佳提取工艺,采用透析和SephadexG-75凝胶层析提高DSA纯度,同时测定其纯化前后蛋白的功能特性及体外抗氧化活性,提高其附加值,实现阿胶的综合利用,对阿胶产业的发展提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
阿胶 山东东阿润合生阿胶制品有限公司;牛血清白蛋白标准品、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、PBS缓冲液、葡聚糖凝胶G-75、10% SDS溶液、Tris-HCl缓冲液 北京索莱宝科技有限公司;碘化汞钾、三氯乙酸、焦没食子酸、硫酸铵、抗坏血酸(Vitamin C,VC) 上海麦克林生化科技股份有限公司;磷酸氢二钠 天津科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(2,2-Diphenyl-1-picrylhydrazyl,DPPH) 合肥博美生物科技有限公司;蛋白Marker 北京博奥森生物技术有限公司;透析袋(截留量30 kDa) 湖南翊博生物科技有限公司;本研究所用试剂均为分析纯。
DE-500多功能粉碎机 浙江红景天工贸有限公司;10RTEX-5涡旋振荡器 海门市其林贝尔仪器制造有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;Ultra-3660紫外可见分光光度计 北京普源精电科技有限公司;CJJ79-1恒温磁力搅拌器 金坛市杰瑞尔电器有限公司;KQ-800E数控超声波清洗器 昆山市超声仪器有限公司;pHS-3C酸度计 成都实际方舟科技有限公司;HH-1电热恒温水浴锅 北京科技伟永兴仪器有限公司;HGK-50自动凯氏定氮仪 上海赫冠仪器有限公司。
1.2 实验方法
1.2.1 DSA的提取
用高速多功能粉碎机将块状阿胶粉碎成粉末状固体,过80目筛后,取2 g阿胶细粉,加入16 mL溶解液(三氯乙酸、丙酮质量体积比=1:10,g/mL)溶解30 min,收集沉淀,冷冻干燥粉碎后加入6 mL尿素裂解液,经Votex振荡器混匀后,在25 ℃,480 W的条件下超声30 min,过滤得到蛋白溶液,加入6 mL饱和硫酸铵溶液反应10 min,结束后离心15 min(4 ℃,3000 r/min),弃去沉淀,收集上清液,放入30 kDa透析袋中透析24 h,真空冷冻干燥即可得到DSA粗蛋白。
1.2.2 单因素实验设计
以DSA提取率为指标,以超声功率、超声时间、溶解液配比和料液比4个因素进行单因素实验,固定提取条件:超声功率480 W、超声时间30 min、溶解液配比1:10(g/mL)、料液比1:8(g/mL);分别设置考察超声功率(320、400、480、560、640 W),超声时间(10、20、30、40、50 min),溶解液配比(1:6、1:8、1:10、1:12、1:14 g/mL),料液比(1:4、1:6、1:8、1:10、1:12 g/mL)4个因素对DSA提取率的影响,每个水平测3次,取平均值。
1.2.3 响应面试验设计
以单因素实验结果为基础,以DSA提取率为响应值,设计响应面试验,优化DSA的提取工艺条件,因素水平见表1。
表 1 响应面试验因素水平表Table 1. Response surface test factor level table水平 因素 A溶解液配比
(g/mL)B料液比
(g/mL)C超声时间
(min)−1 1:8 1:6 20 0 1:10 1:8 30 1 1:12 1:10 40 1.2.4 阿胶中DSA提取率的测定
阿胶经粉碎过80目筛后,参照《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5-2016)中的凯氏定氮法测定阿胶中蛋白总含量为75.9%,参考李昊等[13]的方法测得阿胶中DSA占蛋白总含量的20.8%,并用此数据计算DSA提取率。采用考马斯亮蓝法[14]对DSA含量进行测定,以牛血清蛋白为标准溶液,得到其标准曲线方程为y=0.9891x−0.035,R2=0.9997。用移液枪精确移取离心后的上清液50 µL,加入去离子水定容至10 mL,取待测样液0.1 mL,加入G-250染液4 mL,在波长595 nm处测定吸光度。按公式(1)计算DSA提取率。
(1) 式中:Y1表示DSA提取率,%;C1表示上清液中蛋白浓度,g/mL;V1表示上清液的体积,mL;m1表示取样阿胶中DSA总质量,g。
1.2.5 蛋白纯化
1.2.5.1 SephadexG-75凝胶过滤层析
将冷冻干燥后的DSA粗蛋白配制成质量浓度为10 mg/mL的蛋白溶液,上样于SephadexG-75层析柱(2.5 cm×50 cm),采用(0~1.0 mol/L)NaCl洗脱,洗脱流速控制在0.5 mL/min,每管定量收集5 mL,以收集的管数为横坐标,用紫外分光光度计于280 nm处测量的吸光度值为纵坐标,绘制DSA洗脱曲线,之后收集吸收峰的样品,计算蛋白纯度,真空冷冻干燥后得到纯化后DSA[15]。按公式(2)计算DSA蛋白纯度。
(2) 式中:Y2表示DSA蛋白纯度,%;C2表示溶液中DSA蛋白浓度,g/mL;V2表示溶液体积,mL;m2表示DSA粗蛋白质量,g。
1.2.5.2 SDS-PAGE电泳
配制10%的分离胶和5%的浓缩胶[16],首先将3 mg/mL的DSA溶液与SDS-PAGE上样缓冲液(5×)按3:2(V/V)混合,沸水浴5 min,之后将Marker和蛋白溶液各取出5 µL进行点样,初始电压设定在80 V,持续大概40 min。当样本被送到分离胶中之前,把电压设定为120 V,之后继续电泳大概1 h。当样本与胶层接触1 cm处,停止电泳,使用考马斯亮蓝R-250在室温下浸泡24 h,之后使用脱色剂对其进行6 h的脱色处理。
1.2.6 DSA等电点(pI)的测定
取适量纯化后DSA溶于蒸馏水中,用氢氧化钠和盐酸标准液将样品溶液pH分别调至2.8、3.2、3.6、4、4.4、4.8、5.2、5.6、6、6.4,于595 nm处测定吸光值,吸光值最低时的pH即为DSA等电点。
1.2.7 纯化前后蛋白功能特性研究
1.2.7.1 持水性测定
准确称取适量DSA样品,配制成质量分数为2.5%蛋白溶液,用氢氧化钠和盐酸标准液将样品溶液pH分别调至2、4、6、8、10、12,漩涡混合6 min后于30 ℃恒温箱恒温30 min,在4000 r/min条件下离心30 min,除去上层清液后称重[17]。持水性(Water holding capacity,WHC)按照公式(3)进行计算。
(3) 式中:m2为除去上层清液后离心管残留物质量,g;m1为样品质量,g。
1.2.7.2 持油性测定
准确称取适量DSA样品,加入5 mL大豆油,用氢氧化钠和盐酸标准液将样品溶液pH分别调至2、4、6、8、10、12,均匀混合6 min后于30 ℃恒温箱恒温30 min,在4000 r/min条件下离心30 min,除去上层清液后称重[18]。持油性(Oil holding capacity,OHC)按照公式(4)进行计算。
(4) 式中:m2为除去上层清液后离心管残留物质量,g;m1为样品质量,g。
1.2.7.3 乳化性测定
准确称取适量DSA样品,配制成质量分数为2.5%蛋白溶液,用氢氧化钠和盐酸标准液将样品溶液pH分别调至2、4、6、8、10、12,取6 mL蛋白溶液与2 mL大豆油混合,用高速搅拌器在10000 r/min条件下搅打90 s,之后从溶液最下层取80 μL乳状液,使用0.1%的SDS(w/v)来进一步稀释乳化液,在500 nm处测定吸光度值[19]。乳化性(Emulsifying activity index,EAI)按照公式(5)进行计算。
(5) 式中:A0为吸光度值;C为DSA溶液的浓度,g/mL;φ是乳化液中油相的比例;L为比色皿的光径,1 cm;N为稀释倍数。
1.2.7.4 起泡性测定
准确称取适量DSA样品,使用匀浆器在10000 r/min条件下搅动60 s,使其形成泡沫并记录泡沫体积[20]。起泡性(Foaming ability,FA)按照公式(6)进行计算。
(6) 式中:V1为溶液初始的体积,mL;V2为搅打后泡沫的体积,mL。
1.2.8 DSA体外抗氧化活性研究
1.2.8.1 DSA对超氧阴离子自由基的清除
取4.5 mL Tris-HCl缓冲液(50 mmol/L,pH8.2)与1 mL浓度梯度分别为2、4、6、8、10 mg/mL的DSA样品溶液混合,25 ℃条件下水浴30 min,同时在相同温度条件下预热0.4 mL浓度为45 mmol/L的邻苯三酚溶液,混匀后于25 ℃水浴反应5 min,加入0.1 mL 8 mmol/L HCl终止反应,均匀混合后常温放置1 min于325 nm处测定吸光度[21],记为A1。以纯水代替邻苯三酚测定吸光值记为A2,以纯水代替样品溶液测定吸光值记为A3,于325 nm处测定吸光度值,VC作为阳性对照,超氧阴离子自由基清除率按照公式(7)进行计算。
(7) 1.2.8.2 DSA对ABTS+自由基的清除
ABTS+自由基储备液配制完毕后,在避光、室温条件下反应过夜。测定前用70%乙醇将储备液稀释为ABTS工作液,使样本的吸光度为0.7±0.02。量取0.1 mL的ABTS工作液,分别与0.1 mL浓度梯度为2、4、6、8、10 mg/mL的DSA样品溶液混合,放置6 min后,于734 nm处测定吸光度[22],记为A1,无水乙醇代替样品的吸光度记为A2,蒸馏水代替样品的吸光度记为A3,VC作为阳性对照,ABTS+自由基清除率按照公式(8)进行计算。
(8) 1.2.8.3 DSA对DPPH自由基的清除
准确量取2 mL浓度梯度分别为2、4、6、8、10 mg/mL的DSA样品溶液,依次加入2 mL DPPH溶液,摇匀,室温条件下静置30 min后于517 nm测定吸光度[23],记为A1,无水乙醇代替DPPH的吸光度记为A2,无水乙醇代替样品的吸光度记为A3,VC作为阳性对照,DPPH自由基清除率按照公式(9)进行计算。
(9) 1.2.8.4 DSA对羟自由基的清除
准确量取2 mL浓度梯度分别为2、4、6、8、10 mg/mL的DSA样品溶液,依次加入0.5 mL水杨酸-乙醇溶液(9 mmol/L)和FeSO4溶液(9 mmol/L),再加入5 mL H2O2溶液(9 mmol/L)启动反应,均匀混合,37 ℃条件下水浴加热30 min后于510 nm处测定吸光度[24],记为A1;蒸馏水代替H2O2的吸光度记为A2;蒸馏水代替样品的吸光度记为A3。VC作为阳性对照,羟自由基清除率按照公式(10)进行计算。
(10) 1.3 数据处理
所有实验设3次重复,实验数据以平均值±标准差表示,运用IBS SPSS Statistics 20进行单因素显著性分析,显著性水平为P<0.05,Prism8.0.2软件进行图形绘制,Design-Expert 8.0.6进行响应面试验结果分析。
2. 结果与分析
2.1 单因素实验结果
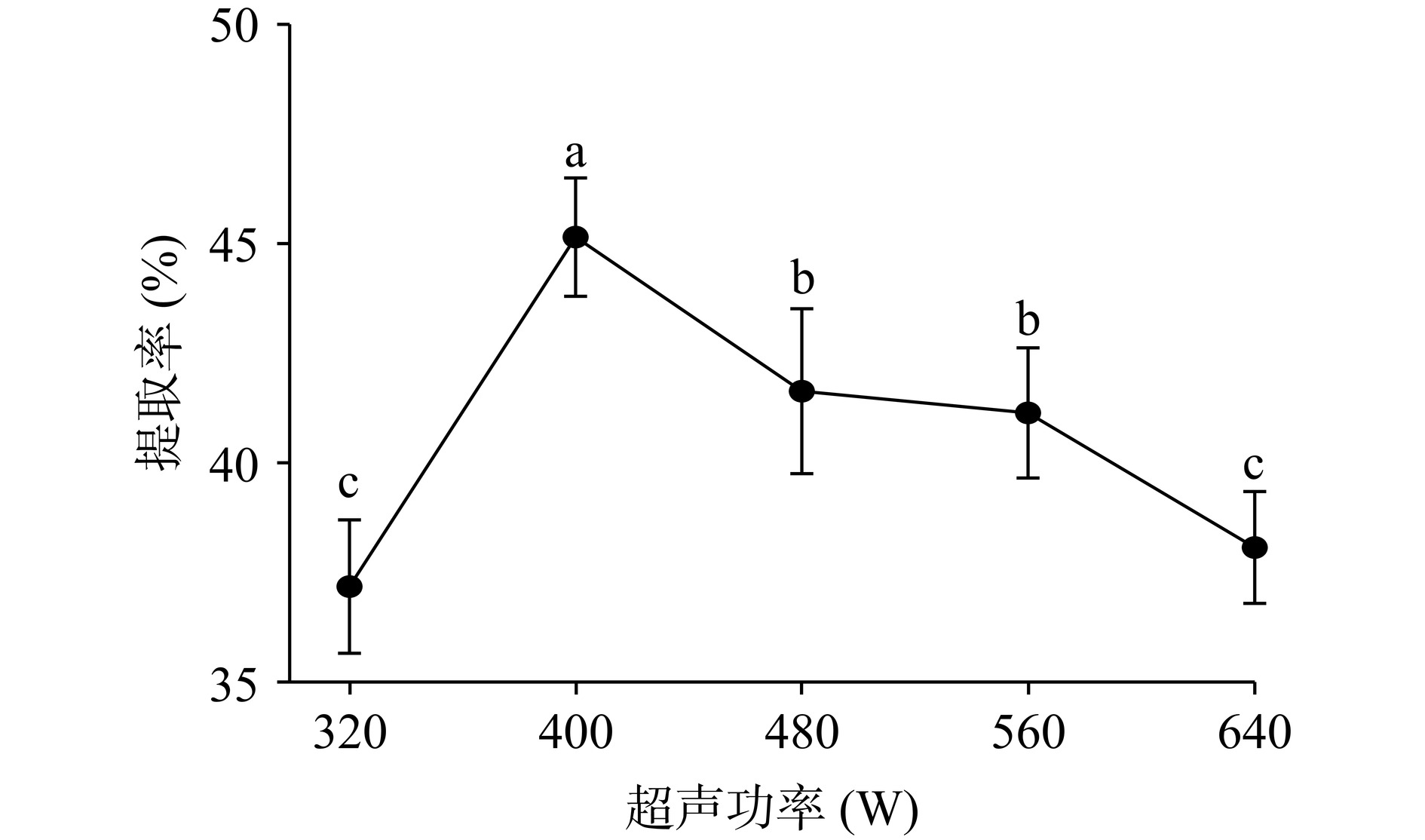
2.1.1 超声功率对阿胶中DSA提取率的影响
如图1所示,随着超声功率的增大,DSA的提取率表现出先上升后下降的趋势。在超声功率为400 W时,DSA的提取率达到最大值为45.35%,随后,DSA的提取率下降。原因是增大超声功率,超声波机械震荡作用增强,空化效应也随之增强,物料膨胀,空隙增大,使溶解液与物料充分接触[25],提取率显著升高(P<0.05)。但随着超声功率的增加,在400 W之后提取率显著降低(P<0.05);这是由于高强度超声波会导致气泡过于密集并且破裂,减弱了超声波在溶解液中的传播效率,导致提取率降低,因此选择超声处理的功率为400 W。
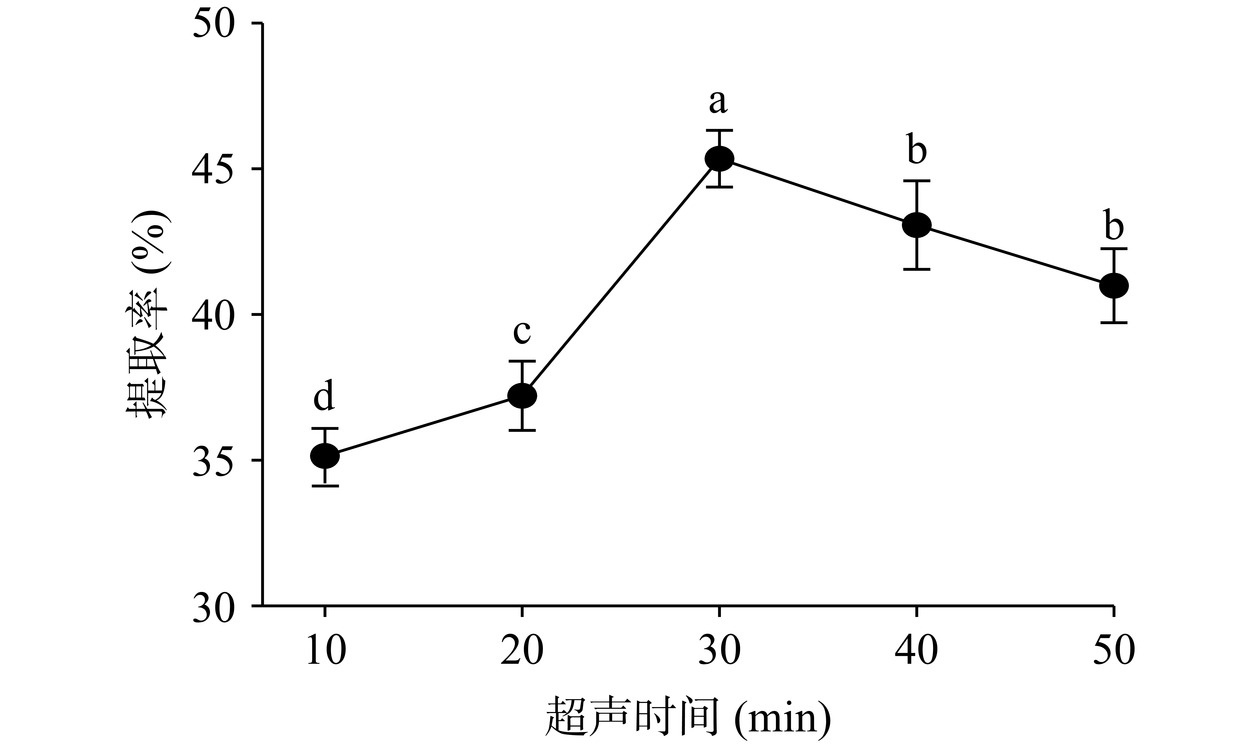
2.1.2 超声时间对阿胶中DSA提取率的影响
如图2所示,提取率随着超声时间的增加先升高再降低,在超声时间为30 min时,DSA的提取率达到最高,为45.53%。随后,DSA的提取率显著下降(P<0.05)。原因是超声时间短,蛋白未能有效溶出,随着超声时间的增加,超声波能量在溶解液中产生空化效应使原料破损度增加,蛋白溶出量增加,提取率显著升高(P<0.05);当时间大于30 min后,可能是超声对阿胶粉的空泡效应逐渐增强,促使部分蛋白质变性或水解[26],蛋白提取率下降,因此选择超声处理的时间为30 min。
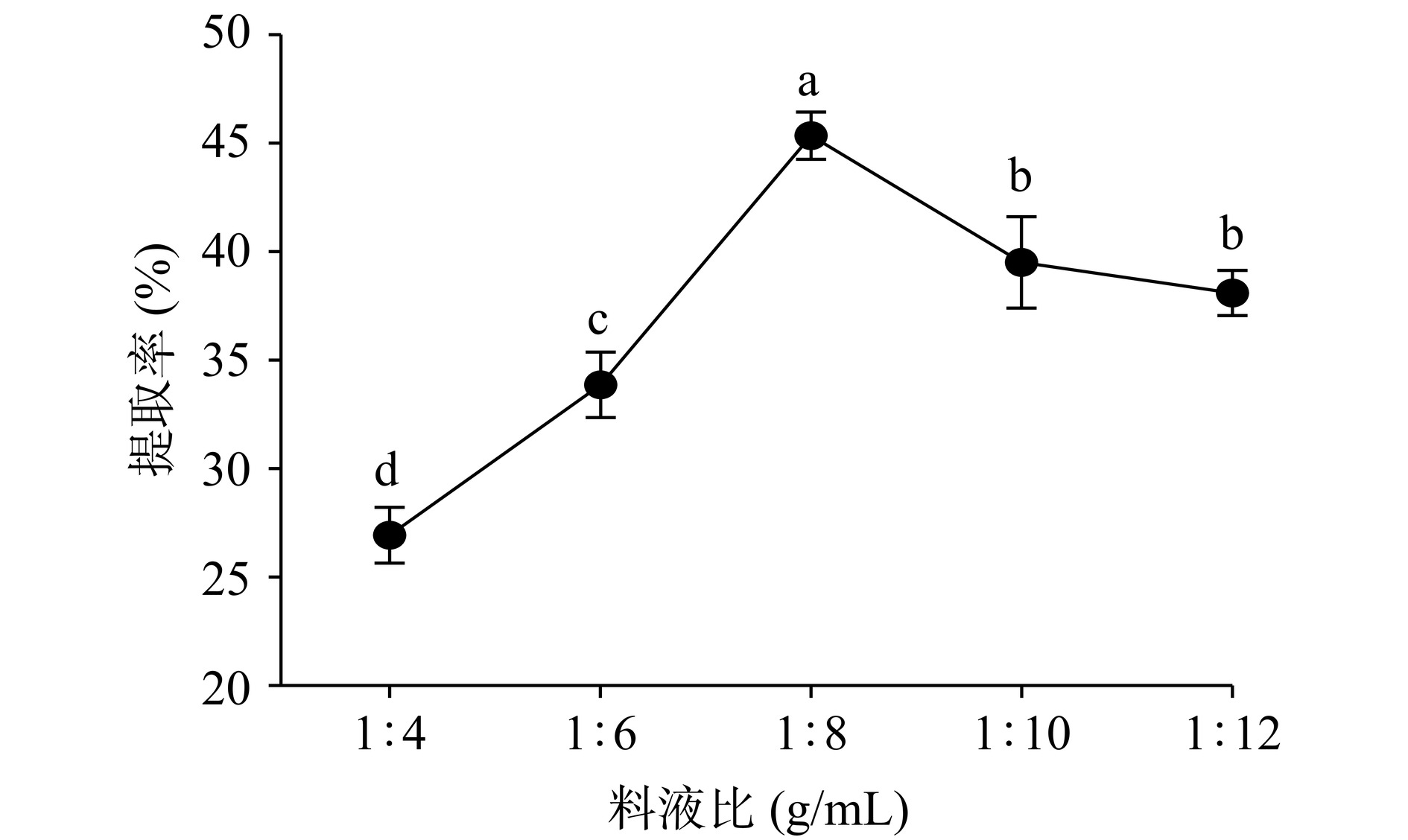
2.1.3 料液比对阿胶中DSA提取率的影响
如图3所示,随着料液比的增加,DSA的提取率表现出先上升后下降的趋势。在料液比为1:8 g/mL时,DSA的提取率达到最大值为45.61%,随后提取率显著下降(P<0.05)。原因是液料比过低时,物料与溶解液未能充分接触,导致沉淀不完全,随着料液比的增加且在超声的作用下,物料充分分散于溶解液中,提取率显著升高(P<0.05);但料液比过大会导致溶液中蛋白浓度降低,阻碍了蛋白质的沉淀,降低了蛋白提取率[27],因此选择料液比为1:8 g/mL。
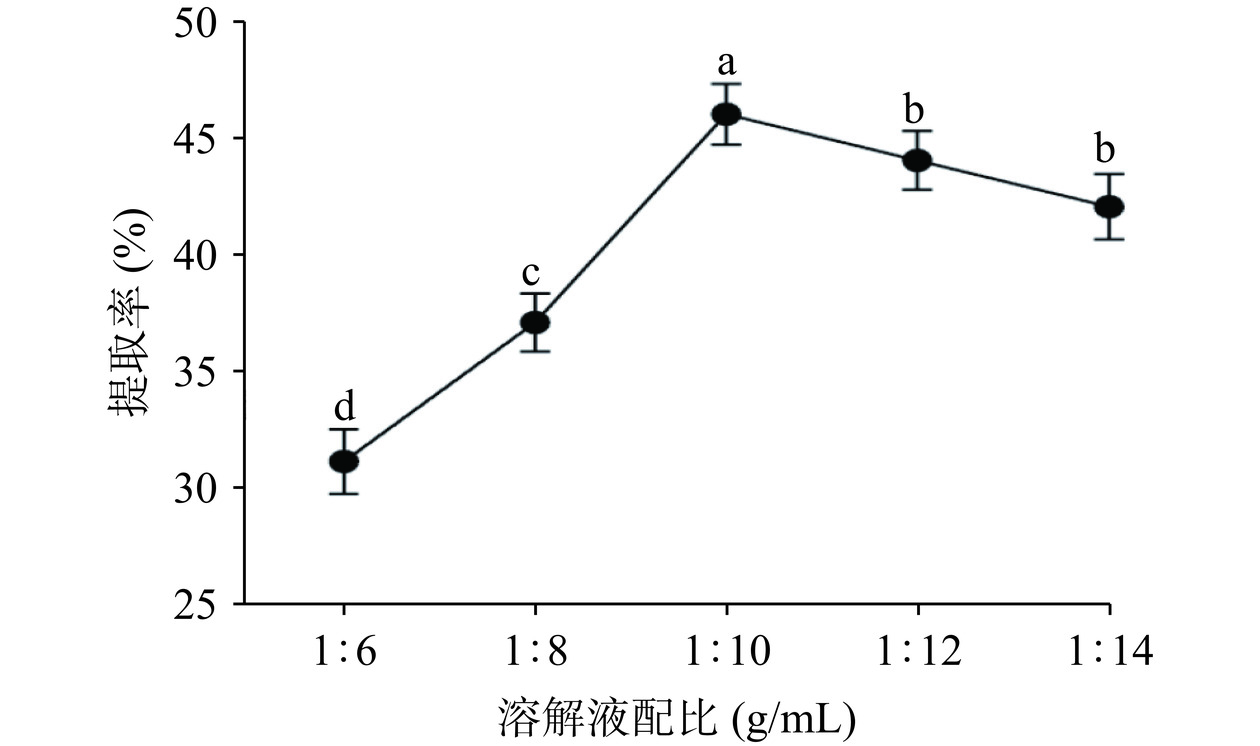
2.1.4 溶解液配比对阿胶中DSA提取率的影响
由图4可知,随着溶解液配比的增加,DSA的提取率表现出先上升后下降的趋势。当溶解液配比为1:10 g/mL时,DSA的提取率达到最高为45.94%。但随着溶解液配比的继续增大,DSA的提取率显著下降(P<0.05)。原因是三氯乙酸属于极酸性物质[28],如果溶解液中三氯乙酸浓度较高,会促使蛋白解离,从而破坏蛋白完整性,随着丙酮的增加,三氯乙酸浓度随之下降,提取率显著升高(P<0.05);但丙酮的增加也会导致溶解液介电常数增加,使蛋白更易进入溶解液中[29],丙酮的浓度过高会使蛋白沉淀量降低,提取率下降,因此选择溶解液配比为1:10 g/mL。
2.2 响应面优化工艺
2.2.1 响应面试验设计结果
根据单因素实验结果,选取溶解液配比(A)、料液比(B)、超声时间(C)3个影响较显著的因素为自变量,以DSA提取率(Y)为响应因子,进行响应面试验设计,试验设计及实验结果见表2,回归模型的方差分析结果见表3。
表 2 Box-Behnken试验设计及结果Table 2. Box-Behnken trial design and results试验号 A溶解液配比 B料液比 C超声时间 Y DSA提取率(%) 1 0 1 −1 37.67 2 0 1 1 38.55 3 0 0 0 45.53 4 0 −1 −1 36.26 5 1 1 0 42.55 6 0 0 0 45.25 7 1 0 −1 39.55 8 −1 0 1 37.23 9 0 0 0 45.66 10 −1 −1 0 39.54 11 −1 1 0 38.53 12 1 −1 0 38.79 13 −1 0 −1 37.59 14 0 0 0 45.97 15 1 0 1 41.56 16 0 0 0 45.39 17 0 −1 1 36.58 表 3 方差分析Table 3. Analysis of variance来源 平方和 自由度 均值 F值 P值 显著性 模型 204.27 9 22.7 104.59 <0.0001 *** A-溶解液配比 11.42 1 11.42 52.65 0.0002 ** B-料液比 4.7 1 4.7 21.65 0.0023 ** C-超声时间 1.02 1 1.02 4.68 0.0673 AB 5.69 1 5.69 26.21 0.0014 ** AC 1.4 1 1.4 6.47 0.0384 * BC 0.078 1 0.078 0.36 0.5667 A2 16.76 1 16.76 77.23 <0.0001 *** B2 58.03 1 58.03 267.43 <0.0001 *** C2 88.42 1 88.42 407.46 <0.0001 *** 残差 1.52 7 0.22 失拟项 1.21 3 0.4 5.33 0.0699 不显著 净误差 0.3 4 0.076 总离差 205.79 16 注:*为差异显著(P<0.05);**为差异较显著(P<0.01);***为差异极显著(P<0.0001)。 对表2中数据进行拟合回归分析得到二元多项回归模型为:Y=45.56+1.2A−0.77B+0.36C−1.19AB+0.59AC−0.14BC−2A2−3.71B2−4.58C2。采用方差分析对DSA提取率进行显著性检验分析[30]。由表3可知:模型P<0.0001,说明该模型具有极显著性;失拟项型P=0.0699>0.05,说明模型失拟不显著,说明回归模型可以接受;模型的决定系数R2和校正决定系数R2Adj分别为0.9926和0.9831,说明DSA提取率与该模型拟合程度较高,可以很好地反映各因素与响应值(Y)之间的关系,可用该模型对DSA提取率进行分析和预测。另外,F值大,说明对实验结果的影响也大,因此可知此三种因素对DSA提取率的影响程度依次为A>B>C,即溶解液配比>料液比>超声时间。
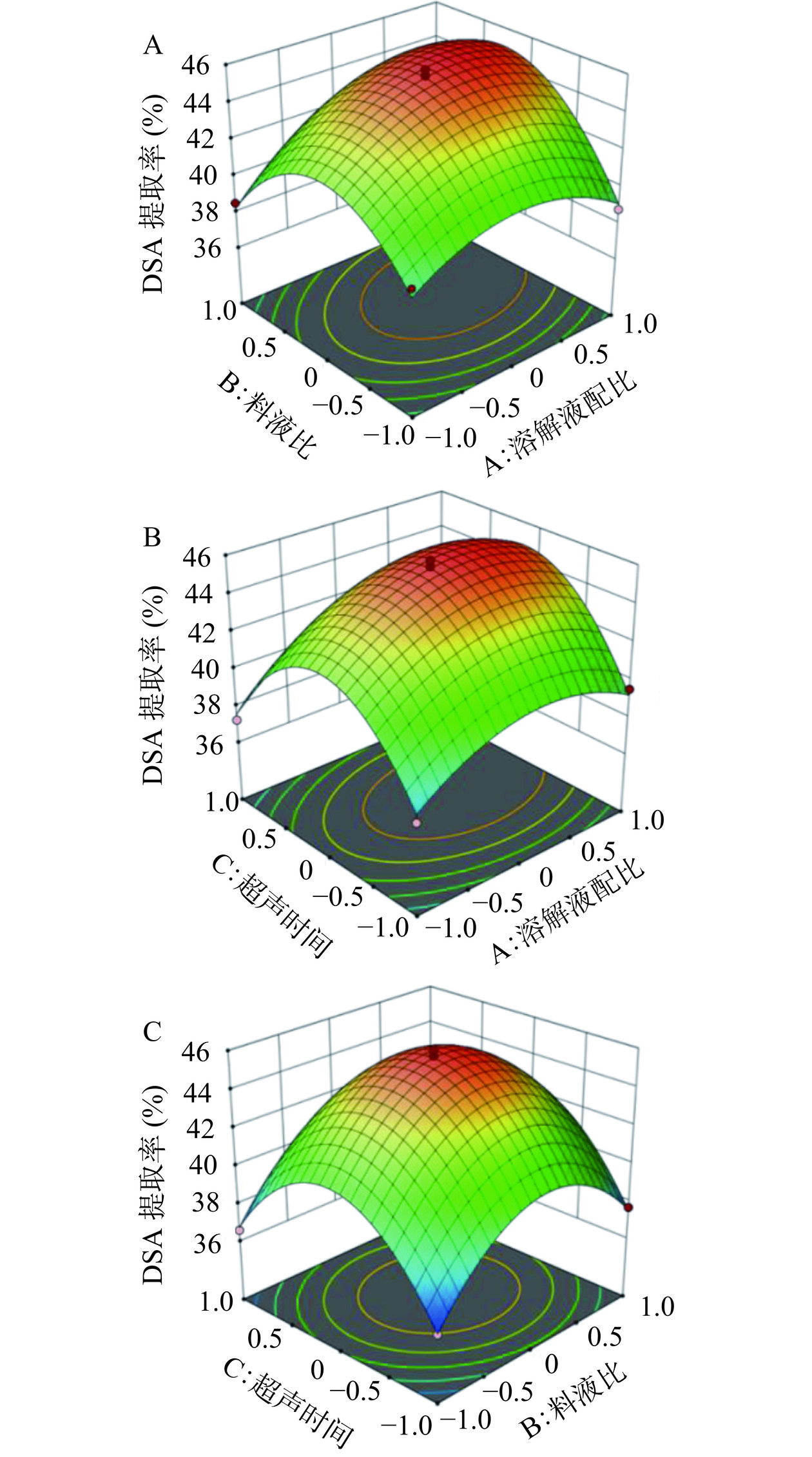
2.2.2 响应面分析
各因素交互作用对响应值的影响见图5,三维响应面直观地反映了3个因素对DSA提取率的影响,曲面的倾斜度反映了影响因素的影响大小,曲面越倾斜表明影响越大,反之越小。DSA提取率随溶解液配比和料液比的增大,呈先增大后减小的趋势,溶解液配比的响应曲面相比料液比更为陡峭,等高线更为密集,说明溶解液配比对DSA提取率的影响更为显著;DSA提取率随料液比和超声时间的增大,呈先快速升高后逐渐降低的趋势,料液比的响应曲面较陡峭,对DSA提取率的影响作用大于超声时间,所得实验结果与表3结果一致。
2.2.3 最佳工艺验证实验
通过回归模型优化得出的DSA提取率的最佳工艺条件分别是溶解液配比为1:10.72 g/mL,料液比为1:8.32 g/mL,超声时间为30.6 min。为验证该模型预测的准确性,和实际操作的方便性,对实验条件稍作调整,确定的最佳工艺条件为溶解液配比1:11 g/mL,料液比为1:8.3 g/mL,超声时间为31 min,实验重复3次测得DSA提取率为49.57%,与预测结果49.653%基本相符,说明通过响应面优化得到的模型参数准确可靠,具有实际应用价值。
2.3 蛋白纯化结果
2.3.1 SephadexG-75凝胶柱层析结果
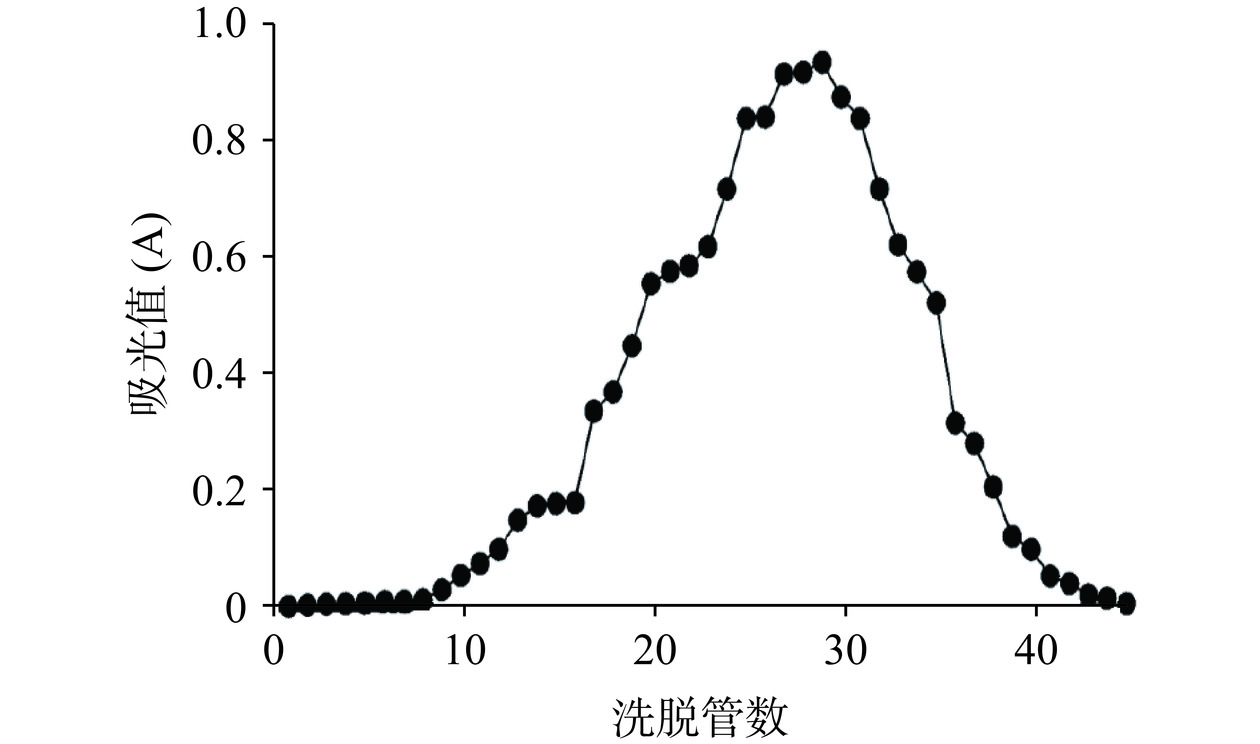
DSA利用葡聚糖凝胶G-75的柱层析纯化洗脱曲线见图6。蛋白经洗脱液洗脱后,形成一个较大的单峰,按公式(2)计算蛋白纯度达到83.7%,收集20~35管吸收峰样品,冷冻干燥后得到纯化后DSA,用于进一步研究其体外抗氧化活性及功能特性。
2.3.2 SDS-PAGE凝胶电泳分析
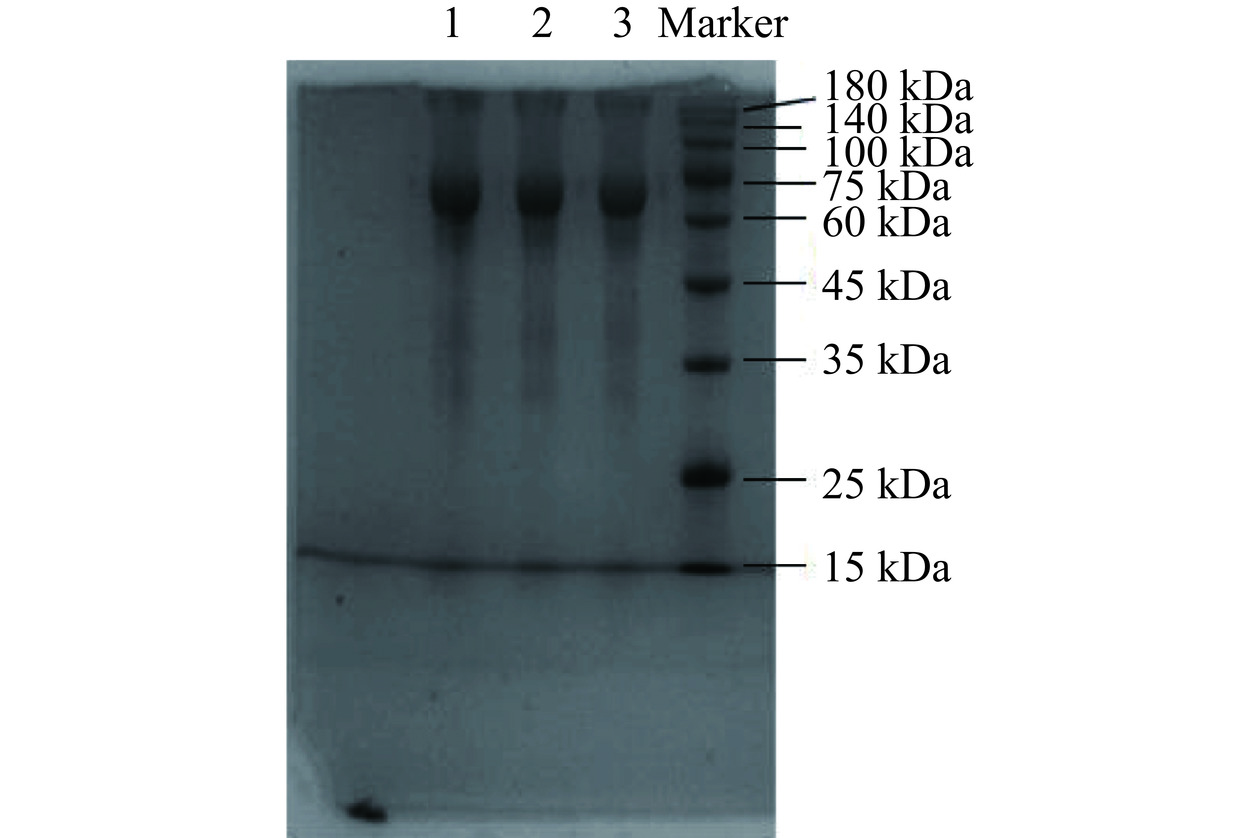
DSA鉴定结果如图7,其中1、2、3为纯化后DSA样品,通过蛋白染色条带可以发现,只有一个条带,说明样品纯度较高,达到电泳纯。由图7可知样品条带位于60~75 kDa之间,与DSA理论分子量66.0 kDa差距较小。
2.4 DSA等电点测定结果
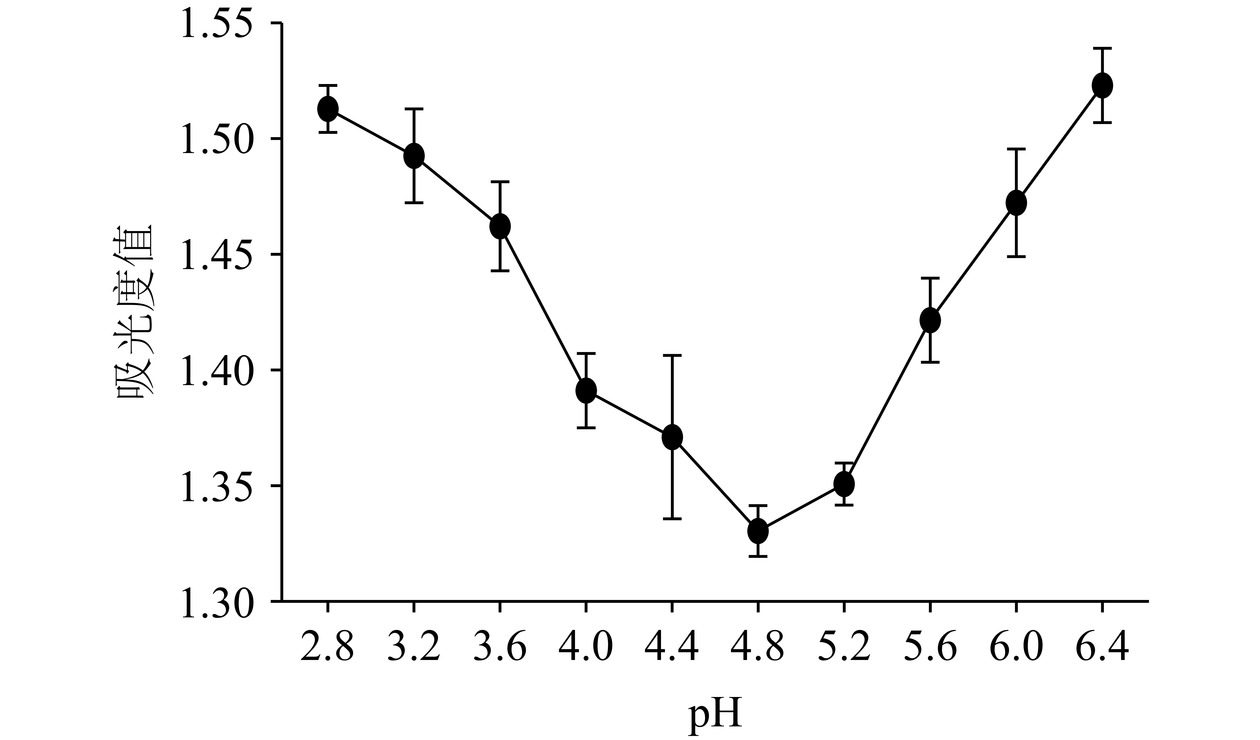
由图8可知,随着溶液pH的增大,蛋白吸光度值呈先下降后上升趋势,当pH为4.8 时,蛋白吸光度值达到最低值,此时蛋白正、负电荷数相等,净电荷为零,出现了蛋白聚合沉淀,则DSA的等电点为pH4.8。
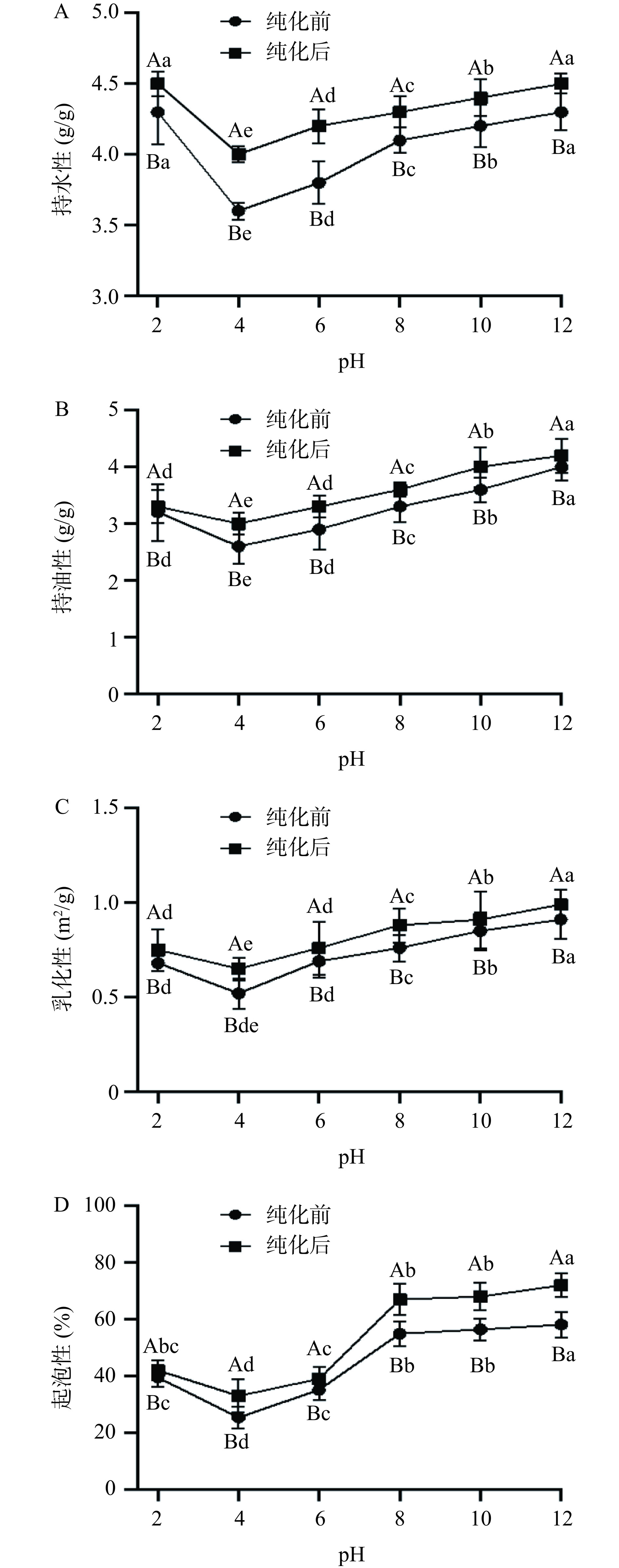
2.5 功能特性分析
2.5.1 持水性测定结果
由图9A可知,当pH4时,纯化前后DSA持水性均为最低值,为3.6和4 g/g;当pH在4~12范围内时,蛋白的持水性显著升高(P<0.05),在pH12时达到最大值,为4.3和4.5 g/g。这是由于当pH接近于等电点时,蛋白质分子总电荷接近于零,分子间相互作用较大,蛋白出现缔合和收缩,呈现较低的膨胀和水化,在pH为4时,纯化前后DSA持水性均出现最低值,而随着pH的增大,蛋白质膨胀和水化性能也随之增加,且远离等电点后蛋白间的相互作用变小,结合水的能力增大,使持水能力增强。结果表明纯化前后DSA的持水性具有显著性差异(P<0.05),纯化后的DSA的持水性对比纯化前有一定的提高。
2.5.2 持油性测定结果
由图9B可知,pH4时纯化前后DSA持油性均达到最低,为2.6和3.1 g/g;随着pH的增大,蛋白的持油性显著升高(P<0.05),在pH12时达到最大值,为4和4.2 g/g。这是由于当pH在蛋白等电点附近时,蛋白易聚集沉淀,持油性最小;随着pH的增大,蛋白分子发生伸展和解离,内部非极性键暴露,结合油脂的能力增强[31],使蛋白持油性提高。结果表明纯化前后DSA的持油性具有显著性差异(P<0.05),纯化后的DSA的持油性较纯化前有明显提高。
2.5.3 乳化性测定结果
由图9C可知,随着pH的增加,纯化前后DSA的乳化性均为先减小后增大,当pH为4时达到最小,为0.52和0.65 m2/g;随着pH的增大,DSA的乳化性显著升高(P<0.05),在pH12时达到最大值,为0.91和0.99 m2/g。这是由于蛋白在等电点附近时净电荷接近于零,蛋白之间静电排斥力接近最小值,蛋白溶解性较差,导致溶液不能迅速固定在油与水界面上;之后随着pH的增大,蛋白与水分子之间相互作用增强,静电斥力增大,油/水界面的吸附能力增强,界面张力降低,从而增加了蛋白的乳化性[32]。在同一条件下,纯化后DSA的起泡性显著大于纯化前(P<0.05),说明纯化对DSA的乳化性具有提升作用。
2.5.4 起泡性测定结果
由图9D可知,当pH4时,纯化前后DSA起泡性均为最低值,为25%和33%;之后随着pH的增大,起泡性显著增大(P<0.05),在pH12时达到最大值,为58%和72%。这可能是因为当 pH 在蛋白等电点附近时,蛋白容易聚集沉淀,参与形成泡沫的蛋白质量浓度较低,使其起泡能力最弱,起泡性最差,随着pH的增大,蛋白质的净电荷增加,减弱了疏水相互作用力,使得蛋白质容易分散到水与空气界面,促进泡沫的形成[33]。结果表明纯化前后DSA的起泡性具有显著性差异(P<0.05),纯化后的DSA的起泡性有一定的提高。
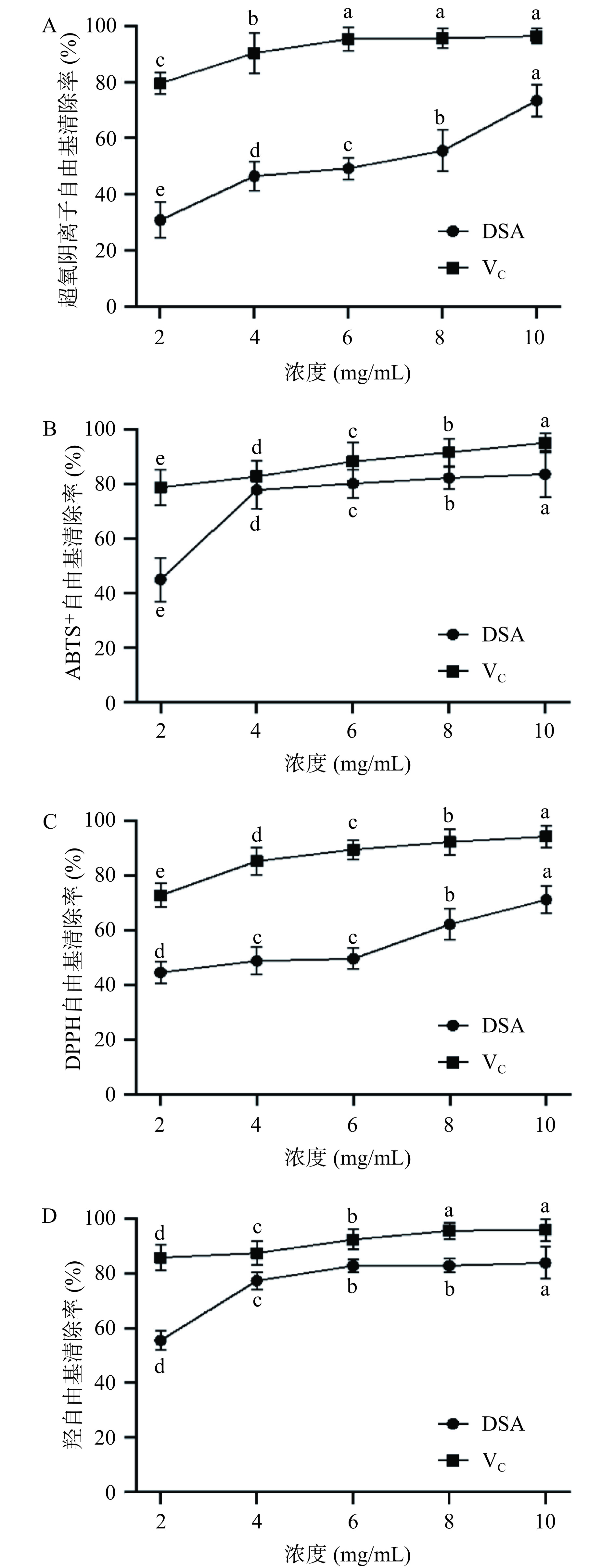
2.6 体外抗氧化活性分析
2.6.1 超氧阴离子自由基清除能力
超氧阴离子自由基是一种在生物体代谢过程中产生的自由基。它是物质自由基连锁反应中的初始物质,与-OH结合,产生破坏细胞DNA和损害人体功能的产物,与人类的衰老和身体部位的病变有着非常紧密的联系[34]。由图10A可知,DSA质量浓度与超氧阴离子自由基清除能力呈正相关,随着DSA质量浓度的增加,超氧阴离子自由基清除能力显著增强(P<0.05)。当DSA浓度为10 mg/mL时,超氧阴离子自由基的清除率达到73.39%。结果表明,DSA具有较好的超氧阴离子自由基清除能力,但其效果弱于VC。
2.6.2 ABTS+自由基清除能力
ABTS+自由基清除能力常作为抗氧化物质总抗氧化能力的测定指标,对天然化合物进行抗氧化活性评价[35]。由图10B可知,随着DSA质量浓度的增加,ABTS+自由基清除能力显著增强(P<0.05),当DSA浓度为10 mg/mL时,ABTS+自由基的清除率达到83.61%,显示出较高的ABTS+自由基清除能力,接近于VC,说明DSA中含有与ABTS+自由基清除相关的活性成分。
2.6.3 DPPH自由基清除能力
DPPH自由基清除能力是评价蛋白体外抗氧化活性强弱的重要指标[36]。由图10C可知,DSA质量浓度与DPPH自由基清除能力呈正相关,随着DSA质量浓度的增加,DPPH自由基清除能力显著增强(P<0.05),当DSA浓度为10 mg/mL时,DPPH自由基的清除率达到最大为71.24%。结果表明DSA具有一定的DPPH自由基清除能力,但其效果弱于VC。
2.6.4 羟自由基清除能力
羟自由基作为一种强氧化剂,可以穿过细胞膜与大多数生物大分子发生反应,如碳水化合物、脂类、蛋白质和DNA等,会引起细胞死亡和组织损伤,其清除率是评价抗氧化活性的重要指标[37]。由图10D可知,DSA质量浓度与羟自由基清除能力呈正相关,随着DSA质量浓度的增加,羟自由基清除能力显著增强(P<0.05),略低于阳性对照组VC。当DSA浓度为10 mg/mL时,羟自由基的清除率达到最大83.79%。结果表明,DSA具有较好的羟自由基清除能力。
3. 结论
通过盐析法和超声波辅助提取法结合,采用响应面法优化得出最优的提取工艺条件:溶解液配比为1:11 g/mL,料液比为1:8.3 g/mL,超声功率为400 W,超声时间为31 min,裂解液添加量为6 mL,在此条件下DSA提取率为49.57%,将最优条件下提取的DSA经Sephadex G-75凝胶过滤层析后,得到的DSA纯度可达到83.7%,经SDS-PAGE凝胶电泳分析所提取的DSA分子量为60~75 kDa,与理论大66.0 kDa较为接近。功能特性实验结果表明,纯化前后DSA在不同pH条件下的持水性、持油性、乳化性和起泡性均具有显著性差异(P<0.05)。体外抗氧化活性结果表明,DSA对超氧阴离子自由基、ABTS+自由基、DPPH自由基和羟自由基均表现出良好的清除能力,在10 mg/mL时分别达到了73.39%、83.61%、71.24%和83.79%,由此可见,DSA具有较好的体外抗氧化活性。综上,本研究确定了阿胶中DSA最佳提取工艺,明确了其体外抗氧化作用及不同pH条件下纯化前后蛋白功能特性的变化,为高效利用与开发阿胶中DSA提供一定的理论基础。
-
表 1 响应面试验因素水平表
Table 1 Response surface test factor level table
水平 因素 A溶解液配比
(g/mL)B料液比
(g/mL)C超声时间
(min)−1 1:8 1:6 20 0 1:10 1:8 30 1 1:12 1:10 40 表 2 Box-Behnken试验设计及结果
Table 2 Box-Behnken trial design and results
试验号 A溶解液配比 B料液比 C超声时间 Y DSA提取率(%) 1 0 1 −1 37.67 2 0 1 1 38.55 3 0 0 0 45.53 4 0 −1 −1 36.26 5 1 1 0 42.55 6 0 0 0 45.25 7 1 0 −1 39.55 8 −1 0 1 37.23 9 0 0 0 45.66 10 −1 −1 0 39.54 11 −1 1 0 38.53 12 1 −1 0 38.79 13 −1 0 −1 37.59 14 0 0 0 45.97 15 1 0 1 41.56 16 0 0 0 45.39 17 0 −1 1 36.58 表 3 方差分析
Table 3 Analysis of variance
来源 平方和 自由度 均值 F值 P值 显著性 模型 204.27 9 22.7 104.59 <0.0001 *** A-溶解液配比 11.42 1 11.42 52.65 0.0002 ** B-料液比 4.7 1 4.7 21.65 0.0023 ** C-超声时间 1.02 1 1.02 4.68 0.0673 AB 5.69 1 5.69 26.21 0.0014 ** AC 1.4 1 1.4 6.47 0.0384 * BC 0.078 1 0.078 0.36 0.5667 A2 16.76 1 16.76 77.23 <0.0001 *** B2 58.03 1 58.03 267.43 <0.0001 *** C2 88.42 1 88.42 407.46 <0.0001 *** 残差 1.52 7 0.22 失拟项 1.21 3 0.4 5.33 0.0699 不显著 净误差 0.3 4 0.076 总离差 205.79 16 注:*为差异显著(P<0.05);**为差异较显著(P<0.01);***为差异极显著(P<0.0001)。 -
[1] 张国伟, 马俊华, 梁玉景, 等. 阿胶化学成分及保健作用研究进展[J]. 食品科技,2021,46(3):39−43. [ZHANG G W, MA J H, LIANG Y J, et al. Advances in the chemical components and health effects of Asini Colla Corii[J]. Food Science and Technology,2021,46(3):39−43.] ZHANG G W, MA J H, LIANG Y J, et al. Advances in the chemical components and health effects of Asini Colla Corii[J]. Food Science and Technology, 2021, 46(3): 39−43.
[2] 杜怡波, 樊慧蓉, 阎昭. 阿胶的化学成分及药理作用研究进展[J]. 天津医科大学学报,2018,24(3):267−270. [DU Y B, FAN H R, YAN Z. Research progress on the chemical composition and pharmacological effects of Asini Colla Corii[J]. Journal of Tianjin Medical University,2018,24(3):267−270.] DU Y B, FAN H R, YAN Z. Research progress on the chemical composition and pharmacological effects of Asini Colla Corii[J]. Journal of Tianjin Medical University, 2018, 24(3): 267−270.
[3] 孔浩, 田汝芳, 曹桂云, 等. 阿胶质量安全分析研究进展[J]. 畜牧与饲料科学,2023,44(4):109−115. [KONG H, TIAN R F, CAO G Y, et al. Research progress in quality and safety evaluation of Asini Corii Colla[J]. Animal Husbandry and Feed Science,2023,44(4):109−115.] doi: 10.12160/j.issn.1672-5190.2023.04.015 KONG H, TIAN R F, CAO G Y, et al. Research progress in quality and safety evaluation of Asini Corii Colla[J]. Animal Husbandry and Feed Science, 2023, 44(4): 109−115. doi: 10.12160/j.issn.1672-5190.2023.04.015
[4] 徐菲菲, 陈茂深, 常冰玉, 等. 化皮和浓缩工艺对驴皮胶原蛋白降解产物特性的影响[J]. 中国食品学报,2019,19(6):90−97. [XU F F, CHEN M S, CHANG B Y, et al. Effect of skinning and concentration process on the characteristics of collagen degradation products in donkey skin[J]. Chinese Journal of Food Science,2019,19(6):90−97.] XU F F, CHEN M S, CHANG B Y, et al. Effect of skinning and concentration process on the characteristics of collagen degradation products in donkey skin[J]. Chinese Journal of Food Science, 2019, 19(6): 90−97.
[5] 曲媛鑫, 付英杰. 阿胶化学成分、质量控制及药理作用研究进展[J]. 特产研究,2023,45(3):136−143. [QU Y X, FU Y J. Research progress on chemical composition, quality control and pharmacological effects of Asini Corii Colla[J]. Specialty Research,2023,45(3):136−143.] QU Y X, FU Y J. Research progress on chemical composition, quality control and pharmacological effects of Asini Corii Colla[J]. Specialty Research, 2023, 45(3): 136−143.
[6] 徐铭悦, 刘清浩, 谢龙, 等. 超声辅助提取对藜麦麸皮蛋白结构及功能特性的影响[J]. 中北大学学报(自然科学版),2023,44(4):427−436. [XU M H, LIU Q H, XIE L, et al. Effect of ultrasound-assisted extraction on the structure and functional properties of quinoa bran protein[J]. Journal of North University of China (Natural Science Edition),2023,44(4):427−436.] doi: 10.3969/j.issn.1673-3193.2023.04.014 XU M H, LIU Q H, XIE L, et al. Effect of ultrasound-assisted extraction on the structure and functional properties of quinoa bran protein[J]. Journal of North University of China (Natural Science Edition), 2023, 44(4): 427−436. doi: 10.3969/j.issn.1673-3193.2023.04.014
[7] 刘小红, 田星慧, 周雨琪, 等. 超声辅助碱法提取豆粕蛋白工艺优化及其功能特性[J]. 粮食与油脂,2023,36(7):119−123,133. [LIU X H, TIAN X H, ZHOU Y Q, et al. Optimization of ultrasonic-assisted alkali extraction process for soybean meal protein and its functional characteristics[J]. Grains and Oils,2023,36(7):119−123,133.] doi: 10.3969/j.issn.1008-9578.2023.07.026 LIU X H, TIAN X H, ZHOU Y Q, et al. Optimization of ultrasonic-assisted alkali extraction process for soybean meal protein and its functional characteristics[J]. Grains and Oils, 2023, 36(7): 119−123,133. doi: 10.3969/j.issn.1008-9578.2023.07.026
[8] 王梓杭, 范秀芝, 姚芬, 等. 香菇蛋白的提取工艺优化、功能特性及氨基酸评价[J]. 现代食品科技,2023,39(6):186−194. [WANG Z H, FAN X Z, YAO F, et al. Optimization of extraction, functional characteristic, and amino acid evaluation of Lentinula edodes protein[J]. Modern Food Science and Technology,2023,39(6):186−194.] WANG Z H, FAN X Z, YAO F, et al. Optimization of extraction, functional characteristic, and amino acid evaluation of Lentinula edodes protein[J]. Modern Food Science and Technology, 2023, 39(6): 186−194.
[9] 衣程远, 孙冰玉, 刘琳琳, 等. 超声处理对大豆蛋白结构及性质的影响研究进展[J]. 中国调味品,2022,47(12):197−200. [YI C Y, SUN B Y, LIU L L, et al. Research progress on the effect of ultrasonic treatment on structure and properties of soybean protein[J]. China Condiment,2022,47(12):197−200.] doi: 10.3969/j.issn.1000-9973.2022.12.036 YI C Y, SUN B Y, LIU L L, et al. Research progress on the effect of ultrasonic treatment on structure and properties of soybean protein[J]. China Condiment, 2022, 47(12): 197−200. doi: 10.3969/j.issn.1000-9973.2022.12.036
[10] 卢秋玲, 李琅, 杨敏, 等. 超声处理对文冠果种粕蛋白结构及性质的影响[J/OL]. 食品与发酵工业, 2024:1−10. DOI:10.13995/j.cnki.11-1802/ts.037719. [LU Q L, LI L, YANG M, et al. Effect of ultrasound treatment on structure and properties of Xanthoceras sorbifolium bunge seeds meal protein[J/OL]. Food and Fermentation Industry, 2024:1−10. DOI: 10.13995/j.cnki.11-1802/ts.037719.] LU Q L, LI L, YANG M, et al. Effect of ultrasound treatment on structure and properties of Xanthoceras sorbifolium bunge seeds meal protein[J/OL]. Food and Fermentation Industry, 2024: 1−10. DOI: 10.13995/j.cnki.11-1802/ts.037719.
[11] ASIF N M, IMRAN M, AHMAD H M, et al. Physicochemical and functional properties of moringa seed protein treated with ultrasound[J]. ACS Omega,2024,9(3):4102−4110.
[12] 梁荣, 徐乐, 樊琛, 等. 酶解法制备阿胶蛋白肽工艺条件优化及抗氧化活性分析[J]. 食品工业科技,2024,45(10):217−224. [LIANG R, XU L, FAN C, et al. Optimization of enzymatic hydrolysis process for preparing peptides from Asini Corii Colla and its antioxidant activity[J]. Science and Technology of Food Industry,2024,45(10):217−224.] LIANG R, XU L, FAN C, et al. Optimization of enzymatic hydrolysis process for preparing peptides from Asini Corii Colla and its antioxidant activity[J]. Science and Technology of Food Industry, 2024, 45(10): 217−224.
[13] 李昊, 黄美娟, 张少权, 等. 驴真皮中主要蛋白的组成及其相互作用的研究[J]. 中国中药杂志,2006(8):659−663. [LI H, HUANG M J, ZHANG S Q, et al. Study on the composition and interaction of major proteins in donkey dermis[J]. Chinese Journal of Traditional Chinese Medicine,2006(8):659−663.] doi: 10.3321/j.issn:1001-5302.2006.08.011 LI H, HUANG M J, ZHANG S Q, et al. Study on the composition and interaction of major proteins in donkey dermis[J]. Chinese Journal of Traditional Chinese Medicine, 2006(8): 659−663. doi: 10.3321/j.issn:1001-5302.2006.08.011
[14] 毕海鑫, 林雨泽, 孟桥, 等. 黑木耳胶原蛋白酶法提取及分离纯化研究[J]. 中国食品添加剂,2023,34(9):56−65. [BI H X, LIN Y Z, MENG Q, et al. Optimization of enzymatic extraction, separation and purification of collagen from black fungus[J]. China Food Additives,2023,34(9):56−65.] BI H X, LIN Y Z, MENG Q, et al. Optimization of enzymatic extraction, separation and purification of collagen from black fungus[J]. China Food Additives, 2023, 34(9): 56−65.
[15] 辛炫英, 李美瑶, 张雨嫣, 等. 明太鱼胶原蛋白提取工艺优化及其体外抗氧化活性[J]. 食品研究与开发,2023,44(21):114−122. [XIN X Y, LI M Y, ZHANG Y Y, et al. Theragra chalcogramma collagen extraction process optimization and its in vitro antioxidant activity[J]. Food Research and Development,2023,44(21):114−122.] doi: 10.12161/j.issn.1005-6521.2023.21.016 XIN X Y, LI M Y, ZHANG Y Y, et al. Theragra chalcogramma collagen extraction process optimization and its in vitro antioxidant activity[J]. Food Research and Development, 2023, 44(21): 114−122. doi: 10.12161/j.issn.1005-6521.2023.21.016
[16] MOGHADAM M, SALAMI M, MOHAMMADIAN M, et al. Walnut protein-curcumin complexes:Fabrication, structural characterization, antioxidant properties, and in vitro anticancer activity[J]. [J]. Journal of Food Measurement and Characterization,2020,14(2):876−885. doi: 10.1007/s11694-019-00336-9
[17] 李霞, 蔡悦蓓, 甄宏伟, 等. 水提和碱提西番莲叶多糖的结构表征及体外抗氧化活性的对比研究[J]. 中国食品添加剂,2023,34(10):87−94. [LI X, CAI Y B, ZHEN H W, et al. Comparative study on structure characterization of the polysaccharides from Passiflora edulis Sims leaves by water-extraction and alkaline-extraction and their antioxidant activity in vitro[J]. China Food Additives,2023,34(10):87−94.] LI X, CAI Y B, ZHEN H W, et al. Comparative study on structure characterization of the polysaccharides from Passiflora edulis Sims leaves by water-extraction and alkaline-extraction and their antioxidant activity in vitro[J]. China Food Additives, 2023, 34(10): 87−94.
[18] 江含秀, 曾芳, 邬晓霞, 等. 不同品种苦荞蛋白的复合酶解及其多肽抗氧化活性[J]. 食品研究与开发,2023,44(9):43−51. [JIANG H X, ZENG F, WU X X, et al. Double enzymatic hydrolysis of tartary buckwheat proteins of different varieties and the antioxidant activity of the polypeptides[J]. Food Research and Development,2023,44(9):43−51.] doi: 10.12161/j.issn.1005-6521.2023.09.007 JIANG H X, ZENG F, WU X X, et al. Double enzymatic hydrolysis of tartary buckwheat proteins of different varieties and the antioxidant activity of the polypeptides[J]. Food Research and Development, 2023, 44(9): 43−51. doi: 10.12161/j.issn.1005-6521.2023.09.007
[19] 刘晓飞, 侯艳, 马京求, 等. 发芽糙米提取物抗氧化性及活性成分分析[J]. 食品研究与开发,2021,42(13):40−47. [LIU X F, HOU Y, MA J Q, et al. Analysis of antioxidant properties and active components of germinated brown rice extracts[J]. Food Research and Development,2021,42(13):40−47.] doi: 10.12161/j.issn.1005-6521.2021.13.007 LIU X F, HOU Y, MA J Q, et al. Analysis of antioxidant properties and active components of germinated brown rice extracts[J]. Food Research and Development, 2021, 42(13): 40−47. doi: 10.12161/j.issn.1005-6521.2021.13.007
[20] 李若敏, 张焕新, 盘赛昆, 等. 牡丹籽粕蛋白提取工艺优化和功能性质分析[J]. 食品工业科技,2023,44(8):197−204. [LI R M, ZHANG H X, PAN S K, et al. Optimization of protein extraction process and functional properties analysis of peony seed meal[J]. Science and Technology of Food Industry,2023,44(8):197−204.] LI R M, ZHANG H X, PAN S K, et al. Optimization of protein extraction process and functional properties analysis of peony seed meal[J]. Science and Technology of Food Industry, 2023, 44(8): 197−204.
[21] 张琦, 朱绚绚, 熊佳丽, 等. 枸杞营养功能特性及其产品开发现状[J]. 食品与发酵工业,2024,50(15):398−408. [ZHANG Q, ZHU X X, XIONG J L, et al. Research progress of functional properties of wolfberry and development of its products[J]. Food and Fermentation Industry,2024,50(15):398−408.] ZHANG Q, ZHU X X, XIONG J L, et al. Research progress of functional properties of wolfberry and development of its products[J]. Food and Fermentation Industry, 2024, 50(15): 398−408.
[22] 卢家维, 李甜甜, 吴淼, 等. 琥珀酰化改性对鹰嘴豆分离蛋白结构和功能特性的影响[J]. 食品与发酵工业,2024,50(17):169−177. [LU J W, LI T T, WU M, et al. Effect of succinylation modification on structure and functional properties of chickpea protein isolate[J]. Food and Fermentation Industry,2024,50(17):169−177.] LU J W, LI T T, WU M, et al. Effect of succinylation modification on structure and functional properties of chickpea protein isolate[J]. Food and Fermentation Industry, 2024, 50(17): 169−177.
[23] 王娜, 谢强, 陈小红, 等. 功能性乳制品功能特性及潜在机制研究进展[J]. 食品与发酵工业,2024,50(3):345−356. [WANG N, XIE Q, CHEN X H, et al. Research progress on functional properties and potential mechanisms of functional dairy products[J]. Food and Fermentation Industry,2024,50(3):345−356.] WANG N, XIE Q, CHEN X H, et al. Research progress on functional properties and potential mechanisms of functional dairy products[J]. Food and Fermentation Industry, 2024, 50(3): 345−356.
[24] 孔志强, 赵玉红. 沙棘降解多糖结构表征和功能特性研究[J]. 食品科学技术学报,2023,41(6):65−74,138. [KONG Z Q, ZHAO Y H. Structural characterization and functional properties of sea buckthorn degraded polysaccharides[J]. Journal of Food Science and Technology,2023,41(6):65−74,138.] doi: 10.12301/spxb202200901 KONG Z Q, ZHAO Y H. Structural characterization and functional properties of sea buckthorn degraded polysaccharides[J]. Journal of Food Science and Technology, 2023, 41(6): 65−74,138. doi: 10.12301/spxb202200901
[25] 刘钊含, 杨同香, 许韩山, 等. 干燥方式对百香果皮理化、功能及抗氧化特性的影响[J]. 食品与机械,2023,39(10):166−174. [LIU Z H, YANG T X, XU H S, et al. The influence of drying methods on the physicochemical, functional, and antioxidant properties of passion fruit peel[J]. Food & Machinery,2023,39(10):166−174.] LIU Z H, YANG T X, XU H S, et al. The influence of drying methods on the physicochemical, functional, and antioxidant properties of passion fruit peel[J]. Food & Machinery, 2023, 39(10): 166−174.
[26] 李伟民, 董行, 郑丽娟, 等. 山药蛋白三氯乙酸-丙酮提取方法优化[J]. 粮食与油脂,2021,34(12):99−102. [LI W M, DONG X, ZHENG L J, et al. Optimize of Chinese yam protein extraction method with trichloroacetic acid-acetone[J]. Grains and Oils,2021,34(12):99−102.] doi: 10.3969/j.issn.1008-9578.2021.12.024 LI W M, DONG X, ZHENG L J, et al. Optimize of Chinese yam protein extraction method with trichloroacetic acid-acetone[J]. Grains and Oils, 2021, 34(12): 99−102. doi: 10.3969/j.issn.1008-9578.2021.12.024
[27] 吴月红. 超声波辅助碱法提取藜麦蛋白的工艺研究[J]. 食品安全导刊,2023(24):143−147. [WU Y H. Study on ultrasonic-assisted alkaline extraction of quinoa protein[J]. Food Safety Guide,2023(24):143−147.] WU Y H. Study on ultrasonic-assisted alkaline extraction of quinoa protein[J]. Food Safety Guide, 2023(24): 143−147.
[28] 王化田, 董卓凡, 李亮, 等. 牡丹籽粕蛋白的提取工艺优化及其性质研究[J]. 食品工业科技,2023,44(19):217−224. [WANG H T, DONG Z F, LI L, et al. Optimization of extraction process and properties of protein from peony seed meal[J]. Science and Technology of Food Industry,2023,44(19):217−224.] WANG H T, DONG Z F, LI L, et al. Optimization of extraction process and properties of protein from peony seed meal[J]. Science and Technology of Food Industry, 2023, 44(19): 217−224.
[29] CHEN Y Y, LIN S Y, YEH Y Y, et al. A modified protein precipitation procedure for efficient removal of albumin from serum[J]. Electrophoresis,2005,26(11):2117−27. doi: 10.1002/elps.200410381
[30] 代晹鑫, 徐莹, 毕爽, 等. 核桃粕蛋白提取纯化工艺优化及其功能性质分析[J]. 食品工业科技,2023,44(2):241−252. [DAI X X, XU Y, BI S, et al. Extraction and purification process optimization and functional properties analysis of walnut meal protein[J]. Science and Technology of Food Industry,2023,44(2):241−252.] DAI X X, XU Y, BI S, et al. Extraction and purification process optimization and functional properties analysis of walnut meal protein[J]. Science and Technology of Food Industry, 2023, 44(2): 241−252.
[31] PROSSER COLIN G. Compositional and functional characteristics of goat milk and relevance as a base for infant formula[J]. Journal of Food Science,2021,86(2):257−265. doi: 10.1111/1750-3841.15574
[32] TERESA L, JOANNA K, EWA P. New perspectives in chemical and functional properties of natural products[J]. Applied Sciences,2022,12(19):9634−9634. doi: 10.3390/app12199634
[33] 周雷, 隋勇, 梅新, 等. 富硒糙米不同碾磨级分米糠蛋白的硒含量及其功能特性[J]. 现代食品科技,2023,39(12):20−28. [ZHOU L, SUI Y, MEI X, et al. Selenium content and functional properties of rice bran protein in different milling grades of selenium-rich brown rice[J]. Modern Food Science and Technology,2023,39(12):20−28.] ZHOU L, SUI Y, MEI X, et al. Selenium content and functional properties of rice bran protein in different milling grades of selenium-rich brown rice[J]. Modern Food Science and Technology, 2023, 39(12): 20−28.
[34] 吴玉娟, 陈壹刘, 张靖松, 等. 超高压辅助酶解豌豆蛋白工艺优化研究[J]. 粮食与油脂,2023,36(11):90−94. [WU Y J, CHEN Y L, ZHANG J S, et al. Research on process optimization of pea protein hydrolysis assisted by ultra-high pressure[J]. Grains and Oils,2023,36(11):90−94.] doi: 10.3969/j.issn.1008-9578.2023.11.020 WU Y J, CHEN Y L, ZHANG J S, et al. Research on process optimization of pea protein hydrolysis assisted by ultra-high pressure[J]. Grains and Oils, 2023, 36(11): 90−94. doi: 10.3969/j.issn.1008-9578.2023.11.020
[35] 马趣环, 王信, 石晓峰, 等. 雪松松针多糖的醇沉、脱蛋白工艺及抗氧化活性研究[J]. 林产化学与工业,2023,43(5):81−88. [MA Q H, WANG X, SHI X F, et al. Study on alcohol precipitation, deproteinization process and antioxidant activity of cedar pine needle polysaccharides[J]. Chemistry and Industry of Forest Products,2023,43(5):81−88.] doi: 10.3969/j.issn.0253-2417.2023.05.011 MA Q H, WANG X, SHI X F, et al. Study on alcohol precipitation, deproteinization process and antioxidant activity of cedar pine needle polysaccharides[J]. Chemistry and Industry of Forest Products, 2023, 43(5): 81−88. doi: 10.3969/j.issn.0253-2417.2023.05.011
[36] 李舒雨, 杨启鑫, 左安娜, 等. 鲜广地龙纯化蛋白的制备及其体外抗肺纤维化活性评价[J]. 南方医科大学学报,2022,42(4):618−625. [LI S Y, YANG Q X, ZUO A N, et al. Preparation of purified proteins from fresh pheretima and their inhibitory effect against pulmonary fibrosis in mice[J]. Journal of Southern Medical University,2022,42(4):618−625.] LI S Y, YANG Q X, ZUO A N, et al. Preparation of purified proteins from fresh pheretima and their inhibitory effect against pulmonary fibrosis in mice[J]. Journal of Southern Medical University, 2022, 42(4): 618−625.
[37] 郭浩, 白雪媛, 陈宇, 等. 人参醇溶蛋白提取工艺优化、结构表征及体外抗氧化活性分析[J]. 食品工业科技,2024,45(8):1−10. [GUO H, BAI X Y, CHEN Y, et al. Optimization of the extraction process, structural characterization and antioxidant activity of ginseng alcohol soluble proteins[J]. Science and Technology of Food Industry,2024,45(8):1−10.] GUO H, BAI X Y, CHEN Y, et al. Optimization of the extraction process, structural characterization and antioxidant activity of ginseng alcohol soluble proteins[J]. Science and Technology of Food Industry, 2024, 45(8): 1−10.
-
期刊类型引用(1)
1. 赵梦瑶,王法云,张立攀,王俊朋,李冰. 谷物低GI食品的研究进展. 现代食品. 2024(22): 165-169 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



