Whole-cell Catalyzed Production of L-tyrosine in Recombinant Bacillus subtilis
-
摘要: 目的:本研究构建一株重组枯草芽孢杆菌工程菌,实现以苯酚、丙酮酸和氨为底物全细胞生成L-酪氨酸(L-tyrosine,L-Tyr),并优化其细胞培养条件和催化反应条件,以期提高L-Tyr的产量。方法:将来源于Pantoea agglomerans的酪氨酸酚裂解酶(Tyrosine Phenol-Lyase,TPL)经密码子优化后在枯草芽孢杆菌中异源表达,通过单因素实验优化了重组菌诱导表达条件和全细胞转化条件,旨在提高L-Tyr产量。结果:重组枯草芽孢杆菌在20 ℃,2.0 g/L木糖诱导培养36 h时TPL活性最高达到4.65±0.15 U·g−1,在75 mmol/L苯酚、75 mmol/L丙酮酸钠、487 mmol/L氯化铵、2.0 g/L亚硫酸钠、2.0 g/L EDTA、0.08 g/L 磷酸吡哆醛(Pyridoxal Phosphat,PLP)、湿菌体50 g/L、pH=8.0、35 ℃的全细胞转化条件下,L-Tyr达到9.38 g/L,转化率为73.24%。为了进一步改善高浓度苯酚导致TPL酶活力下降问题,在全细胞转化环节采用分批补料方式,20 h后得到15.12 g/L L-Tyr,转化率为75.51%。结论:研究结果表明重组枯草芽孢杆菌可以成功转化苯酚、丙酮酸钠合成L-酪氨酸,为全细胞生物制备食品级L-酪氨酸提供了理论和技术基础,具有良好的应用前景。Abstract: Objective: This study conducted a recombinant Bacillus subtilis strain capable of producing L-Tyr utilizing phenol, sodium pyruvate, and ammonia. Moreover, the conditions of cell culture and catalytic reaction were optimized to improve L-Tyr production. Methods: The tyrosine phenol-lyase (TPL) gene from Pantoea agglomerans was codon-optimized and successfully over-expressed in B. subtilis. The conditions of induction and whole-cell transformation were optimized using single-factor experiments for L-Tyr production. Results: The highest TPL enzyme activity was achieved 4.65±0.15 U·g−1 in the recombinant B. subtilis at 20 ℃ with 2.0 g/L xylose after 36 hours. Under the whole-cell transformation conditions of 75 mmol/L phenol, 75 mmol/L sodium pyruvate, 487 mmol/L ammonium chloride, 2.0 g/L sodium sulfite, 2.0 g/L EDTA, 0.08 g/L pyridoxal phosphate (PLP), wet cell mass of 50 g/L, pH8, and 35 ℃, the L-Tyr production increased to 9.38 g/L with a conversion rate of 73.24%. Coping with the issue of decreased TPL enzyme activity caused by phenol resistance, a batch feeding strategy was implemented during the whole-cell transformation, resulting in a final L-Tyr production of 15.12 g/L with a conversion rate of 75.51% after 20 hours. Conclusion: These findings demonstrate the successful conversion of phenol and sodium pyruvate into L-Tyr by the recombinant B. subtilis strain. The study would provide a theoretical and technical foundation for the production of food-grade L-Tyr using whole-cell biocatalysis, highlighting its potential for practical applications.
-
Keywords:
- L-tyrosine /
- B. subtilis /
- tyrosine phenol-lyase /
- whole-cell catalysis
-
L-酪氨酸(L-tyrosine,L-Tyr)是一种酚羟基α-芳香族氨基酸,在体内由苯丙氨酸羟基化生成[1],可以在动植物和微生物中从头合成,属于半必需氨基酸,又是许多蛋白质合成的前体物质,所以也属于营养必须氨基酸[2]。L-Tyr对内分泌激素具有调节作用,它是多巴胺、肾上腺素、去甲肾上腺素以及甲状腺素等激素[3]生物合成的前体,当人们长期处在压力的情况下,补充酪氨酸被认为可以增加这些激素的水平,从而改善压力状况下的记忆力和表现,因此,L-Tyr可用作膳食补充剂[4]。此外,吴梦迪[5]的研究证实了L-Tyr和血红素混合物在有氧条件下具有协同抗氧化作用,这表明L-Tyr在抗氧化和抗衰老化妆品领域具有重要的应用价值。L-酪氨酸还可以作为酪醇[6]、左旋多巴[7]、香豆素[8]的合成中间体,而酪醇、左旋多巴和香豆素则是保健品和香料的主要成分[9]。
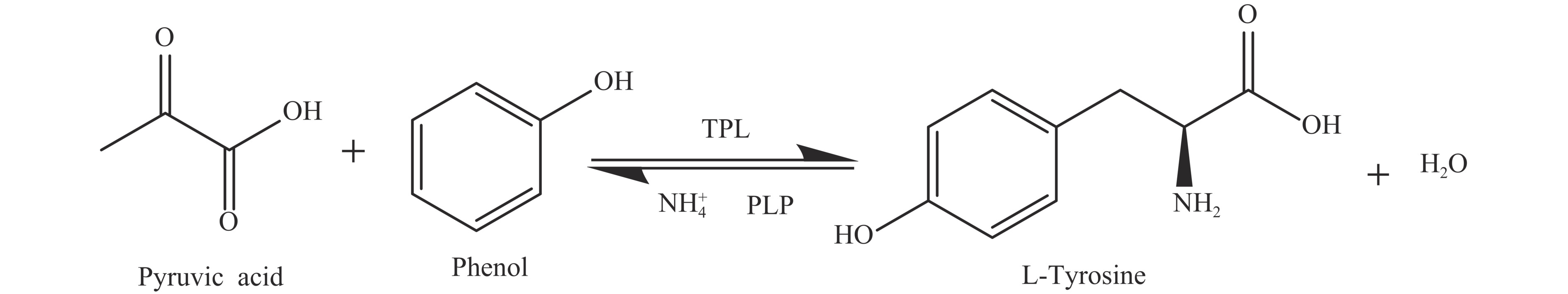
目前,国内外L-Tyr的生产仍然依靠从天然蛋白质中提取制得,即利用天然蛋白资源为原料,将其进行水解、浓缩、结晶、脱色等步骤的处理,分离提取L-Tyr,蛋白质水解法存在着生产原料有限、产品和工艺复杂、污染严重等缺点[10]。除了蛋白质水解法,L-Tyr的生产方式还包括化学合成法、发酵法和酶催化法。其中化学合成法制备的产物为外消旋的DL-酪氨酸,须进一步拆分。化学合成法的工艺流程复杂、效率低,一般不适用工业生产[11−12]。发酵法是指以生物质碳源为原料,通过优良的微生物菌种在合适的条件下发酵来累积L-酪氨酸,在Ping等[13]的研究中,通过调控大肠杆菌代谢途径和关键酶的表达,成功将碳通量导向莽草酸途径。再经过48 h的培养后得到7.11 g/L的L-Tyr。也有人尝试对谷氨酸棒杆菌进行代谢改造,使其碳通量更多地向L-酪氨酸的方向进行,实现可再生碳源生产L-Tyr,也只得到3.1 g/L L-Tyr[14],发酵法生产的L-Tyr产量不高,不具备工业应用价值。酶催化法是指利用微生物细胞内酪氨酸酚裂解酶将苯酚、丙酮酸和氨转化为L-酪氨酸[15],反应方程式如图1所示。该方法绿色环保、对环境无污染且反应条件温和、便于操作,但也存在酶稳定性差、活性不高的问题。所以常俊俊等[16]在大肠杆菌中表达TPL后,用生物全细胞代替酶分子,通过全细胞转化的方式得到16.17 g/L L-Tyr。而Xu等[17]先筛选出催化性能优异的TPL并在大肠杆菌内表达,再通过底物分批补料获得了48.5 g/L的L-Tyr。Li等[18]也将L-乳酸氧化酶和TPL在大肠杆菌中共表达制备L-酪氨酸及其类似物。相较于其他方法酶催化法可以大规模制备L-Tyr,也更符合绿色发展的理念,在未来L-Tyr生产市场有良好前景。目前,生物酶法生产L-Tyr的研究都集中于大肠杆菌,大肠杆菌基因表达体系的调控机理研究透彻,培养物廉价。但大肠杆菌作为L-酪氨酸的生产工程菌存在着噬菌体污染和内毒素[19]等安全问题,这都将限制酶催化法制得的L-Tyr在食品、医药领域的应用。
枯草芽孢杆菌是一种公认安全的、可用于食品工业领域的食品安全生产菌株。枯草芽孢杆菌异源表达系统有许多优点,如易于遗传操作、在廉价底物上的高生长率以及发酵周期短等。该表达系统已经被广泛接受并应用于各种化学品、药品、食品、蛋白质和酶的生产[20]。本研究将来源于Pantoea agglomerans的酪氨酸酚裂解酶(GenBank:AAB24234.1)在枯草芽孢杆菌B. subtilis164T7P中克隆表达[21],构建重组菌株B. subtilis164T7P-pMK4T7/TPL。将重组枯草芽孢杆菌B. subtilis164T7P-pMK4T7/TPL作为全细胞催化剂转化丙酮酸、苯酚和氨生成L-酪氨酸。同时为了提高L-Tyr的产量对诱导培养条件和全细胞转化条件进行研究。这是首次将枯草芽孢杆菌全细胞转化方式应用于L-Tyr的生产,为后续重组枯草芽孢杆菌全细胞生物催化制备L-酪氨酸的工业化应用提供了理论基础。
1. 材料与方法
1.1 材料与仪器
枯草芽孢杆菌B. subtilis164T7P、质粒pMK4-T7[21]、质粒pET-28a(+)/TPL 为实验室保藏;大肠杆菌DH5α感受态细胞、高保真酶2ⅹphanta Master Mix、同源重组试剂盒 诺唯赞生物科技(南京)股份有限公司;限制性核酸内切酶 TaKaRa公司;AxyPrep TM Plasmid Miniprep Kit、AxyPrep PCR TM Cleanup Kit 爱思进生物技术(杭州)有限公司;改良型BCA蛋白浓度测定试剂盒 生工(上海)生物股份有限公司;苯酚、丙酮酸钠、D-木糖、磷酸吡哆醛、亚硫酸钠、氯化铵、乙二胺四乙酸(EDTA)、考马斯亮蓝R-250 麦克林生化科技(上海)有限公司;十六烷基三甲基溴化铵(CTAB)、磷酸二氢钾、磷酸氢二钠 泰坦科技(上海)股份有限公司;L-酪氨酸 分析纯,索莱宝科技(北京)有限公司。
DK-8D型三孔电热恒温水浴锅 上海飞域实业国际贸易有限公司;EPS-100核酸电泳仪 上海天能科技有限公司;H1750R高速台式冷冻离心机 湖南湘仪实验室仪器开发有限公司;GET3XG基因扩增仪 杭州柏恒科技有限公司;LC-20A高效液相色谱仪 Shimadzu(日本)公司;MLS-3780高压蒸汽灭菌器 SANYO(日本)公司;ZQZY-78BES振荡培养箱 上海知楚仪器有限公司。
1.2 实验方法
1.2.1 培养基的配制
枯草芽孢杆菌培养基和发酵培养基均为LB培养基,其组分为5.0 g/L酵母粉、10 g/L蛋白胨、10 g/L氯化钠,双蒸水溶解,固体培养基在其基础上添加2%琼脂粉。
1.2.2 引物设计
以保藏的质粒pET-28a(+)/TPL为PCR模板,T7和T7t为引物,PCR扩增。PCR反应条件如下:95 ℃预变性5 min,循环1次;95 ℃变性15 s,循环30次;55 ℃退火15 s,循环30次;72 ℃延伸30次,2 kb/min;最后72 ℃延伸3 min,循环1次;16 ℃循环1次。将扩增产物送至上海杰李生物技术有限公司测序后进行Blast序列比对。根据比对结果显示的基因组信息,选择EcoRⅠ、BamHⅠ为酶切位点,设计并合成一对带有同源臂引物pMK4-TPL-F/pMK4-TPL-R,序列参考表1。
表 1 本研究中用到的引物Table 1. Primers used in this study引物名称 引物序列(5’-3’) 大小(bp) T7 TAATACGACTCACTATAGGG 20 T7t GCTAGTTATTGCTCAGCGG 19 pMK4-TPL-F GAAAGGAGGATATACCGGATCCATGAACTATCCTGCCGAGCCT 43 pMK4-TPL-R CGGGCTTTGTTAGCAGGAATTCTTAAATAAAGTCAAAACGCGCAG 45 T7N-TesF GTGAGCGGATAACAATTCCCCTCTAG 26 T7N-TesR GTACTGAGAGTGCACCATATGATCCG 26 注:酶切位点用下划线表示。 1.2.3 构建重组表达菌株
以质粒pET-28a(+)/TPL为模板,pMK4-TPL-F和pMK4-TPL-R为引物,PCR扩增。将质粒pMK4-T7用限制性内切酶EcoRⅠ/BamHⅠ切割。酶切产物和PCR产物都用AxyPrep PCRTM清洁试剂盒纯化回收DNA。然后按照同源重组试剂盒说明方法进行一步克隆连接。将连接产物转入E. coil DH5α 感受态细胞,涂布于100 mg/L氨苄抗性平板。37 ℃恒温培养过夜,E. coil DH5α 感受态细胞转化方式参考萨姆布鲁克[22]的方法。用引物T7N-TesF/T7N-TesR对阳性转化子PCR验证,PCR结果送至上海杰李测序生物技术有限公司,以验证重组质粒pMK4-T7/TPL是否成功构建。挑取测序结果正确的菌株提取质粒pMK4-T7/TPL,转入B. subtilis164T7P感受态中,涂布于100 mg/L氯霉素抗性平板,37 ℃过夜培养,B. subtilis164T7P感受态细胞的制备和转化方式参考Ji等[21]的方法。重新挑取阳性转化子进行PCR验证,验证结果送至上海杰李生物技术有限公司,将测序结果正确的重组菌株 B. subtilis164T7P-pMK4-T7/TPL命名为KC-TPL。
1.2.4 重组菌诱导培养及表达验证
选择原始表达菌株B. subtilis164T7P、空白质粒对照菌株B. subtilis164T7P-pMK4-T7和诱导表达菌株KC-TPL同时进行诱导表达验证,具体步骤如下。
1.2.4.1 菌体培养
将B. subtilis164T7P、B. subtilis164T7P-pMK4-T7、KC-TPL划线,挑取单克隆于3 mL的试管LB中,放在37 ℃恒温振荡培养箱、200 r/min培养10~11 h。以1%(V/V)的接种量转接100 mL LB培养基中,当OD600达到0.8~1.0后,加入终浓度为1 g/L的D-木糖诱导,接着在37 ℃、200 r/min培养箱中诱导培养24 h,培养结束后4 ℃, 8000 r/min离心 5 min收集菌体。
1.2.4.2 菌体破碎及电泳条件
KC-TPL的破碎方法参照梁栋等[23]的报道。在破碎细菌之前,需要进行三次反复冻融以提高破碎效率。冻融完成后,将样品以5000 r/min的速度离心30 min,取得沉淀后用1 mol/L pH7.0的HEPES缓冲液重悬。整个破碎过程需要在冰浴条件下进行,超声破碎参数为:超声3 s,间隔5 s,共进行4次20 min,功率为130 W。破碎完成后,样品以12000 r/min的速度在4 ℃离心30 min。上清液使用生工改良型BCA蛋白浓度测定试剂盒检测蛋白浓度并将其稀释至相同浓度。将上清液与蛋白上样缓冲液混合后加热5 min,每孔添加10 μL样品到12%分离胶和5%浓缩胶中。电泳条件为先90 V运行20 min,然后切换到160 V电泳100 min。电泳结束后使用考马斯亮蓝溶液染色1 h,随后使用脱色液进行过夜处理。
1.2.5 酶活测定
TPL酶活力测定参照陈明亮等[24]报道的方法进行。取0.1 g KC-TPL湿菌体,加入10 mL反应体系:丙酮酸钠质量分数1%,苯酚质量分数1%,0.125 g/L PLP,氨水调pH7.4,温度为30 ℃,200 r/min条件下进行酶促反应,30 min后用浓盐酸终止酶促反应,利用高效液相色谱法(HPLC)检测反应液中L-Tyr的浓度。酶活定义为在上述条件下每分钟内催化生成1 μmol L-酪氨酸所需要的酶量为一个酶活单位(U)。
HPLC检测条件为:色谱柱Agilent C18柱(4.6×250 nm,5 μm);流动相V(8.5 mmol/L乙酸钠溶液(磷酸调至pH=4)):V(甲醇)=4:1;紫外检测波长为230 nm;流速0.6 mL/min;进样量20 μL;柱温为室温[25]。
每克湿菌体所含酶活单位数为:A(U)=nT×m 式中:n为反应结束时反应液中L-Tyr的微摩尔数,μmol;T为反应时间,min;m为加入反应体系中湿菌体量,g;
1.2.6 酪氨酸酚裂解酶在枯草芽孢杆菌中表达优化
在木糖诱导阶段,选取对TPL表达影响较大的因素进行研究,分别是培养温度(20~40 ℃)、培养时间(12~60 h)和诱导剂浓度(0.5~2.5 g/L)。
1.2.7 全细胞转化合成L-酪氨酸反应体系建立及优化
将发酵24 h后的菌体离心收集菌体,冷藏16~24 h后在37 ℃摇床用1.0 g/L的CTAB处理1 h后洗涤两次放−20 ℃备用。全细胞转化反应体系(10 mL):将100 mmol/L苯酚、100 mmol/L丙酮酸钠、650 mmol/L氯化铵、2.0 g/L Na2SO3、2.0 g/L EDTA、0.125 g/L PLP和50 g/L KC-TPL湿细胞投入0.1 mol/L磷酸缓冲液中,反应条件:T=30 ℃、pH=7.4,反应10 h后加入1.0 mol/L NaOH溶解沉淀,用HPLC检测反应液中L-Tyr的含量。全细胞转化阶段优化方案:苯酚毒性浓度(25~150 mmol/L)、湿细胞浓度(20~70 g/L)、反应温度(20~45 ℃)、反应初始pH(6~9)和最佳PLP浓度(0.06~0.14 g/L)。
1.3 数据处理
所有实验重复3次,液相数据导出后采用Excel 2019进行数据统计,利用IBM SPSS 25的单因素方差分析中的沃勒-邓肯多重比较进行显著性分析(P<0.05),用Origin 2022软件绘图。
2. 结果与分析
2.1 重组枯草芽孢杆菌KC-TPL的鉴定
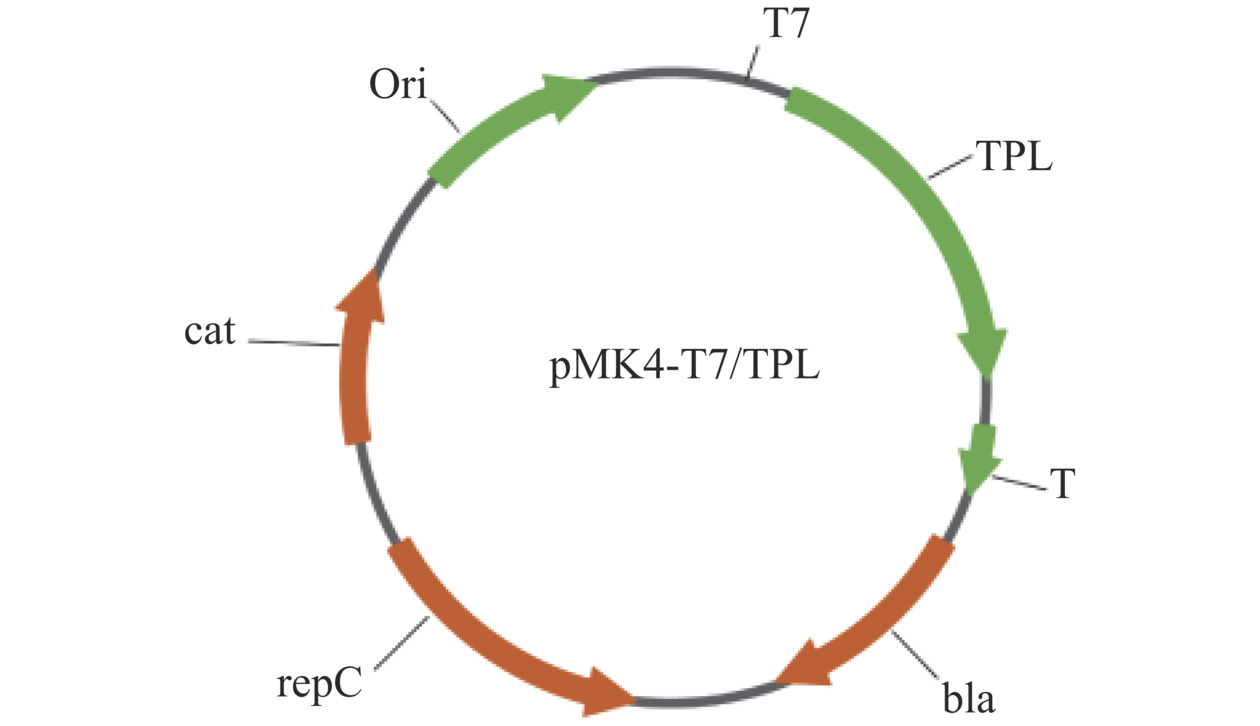
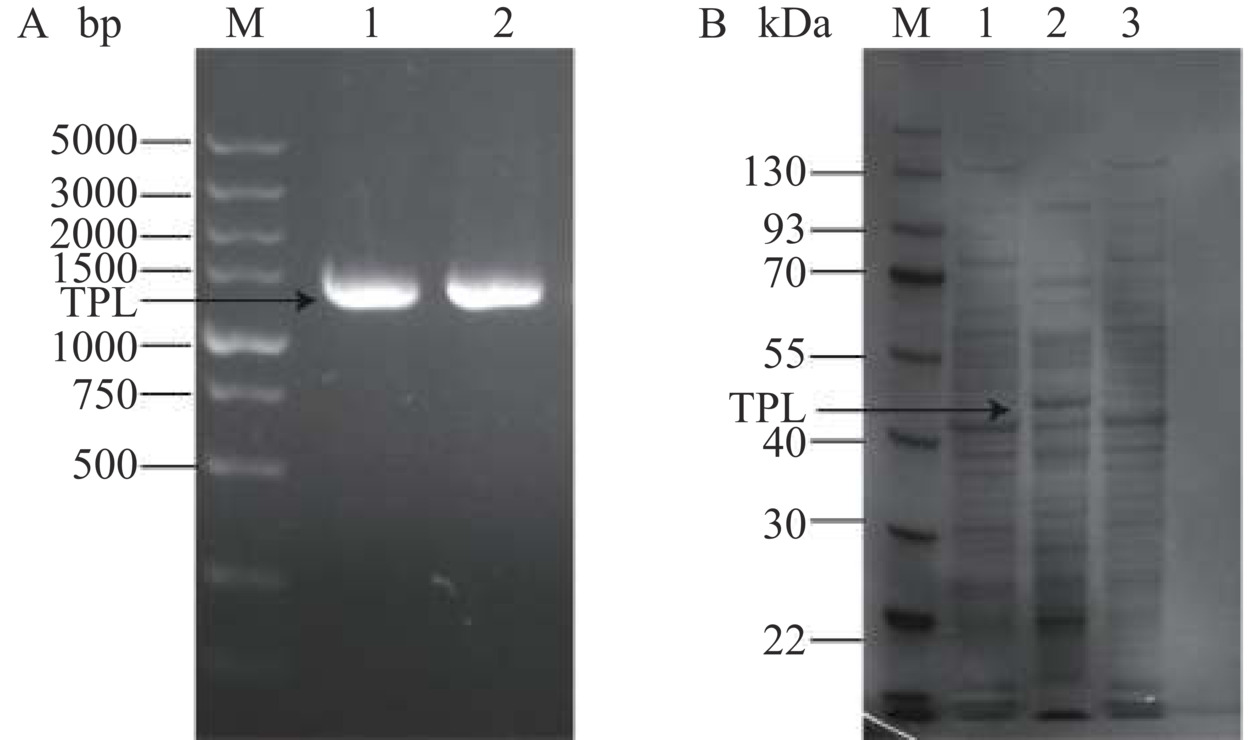
按照方法1.2.2所述方法扩增出TPL基因片段,Blast结果显示酪氨酸酚裂解酶长度为1371 bp,将TPL片段插入到pMK4-T7载体的EcoRⅠ、BamHⅠ酶切位点之间,得到质粒pMK4-T7/TPL,如图2所示。同时以未异源表达TPL基因的质粒pMK4-T7为对照,分别转化至B. subtilis164T7P中表达,核酸电泳结果如图3A所示,重组枯草芽孢杆菌特异性条带位置和目标片段大小相同,测序结果也显示未发生突变。接着将B. subtilis164T7P、B. subtilis164T7P-pMK4-T7、KC-TPL按照方法1.2.4诱导和破碎,SDS-PAGE结果图3B所示,与空白对照相比,重组菌在50 kDa位置有明显的特异性蛋白条带,与理论值基本一致,表明TPL基因在B. subtilis164T7P中成功表达。
2.2 酪氨酸酚裂解酶在重组枯草芽孢杆菌中表达优化结果
2.2.1 培养温度对酪氨酸酚裂解酶的表达影响
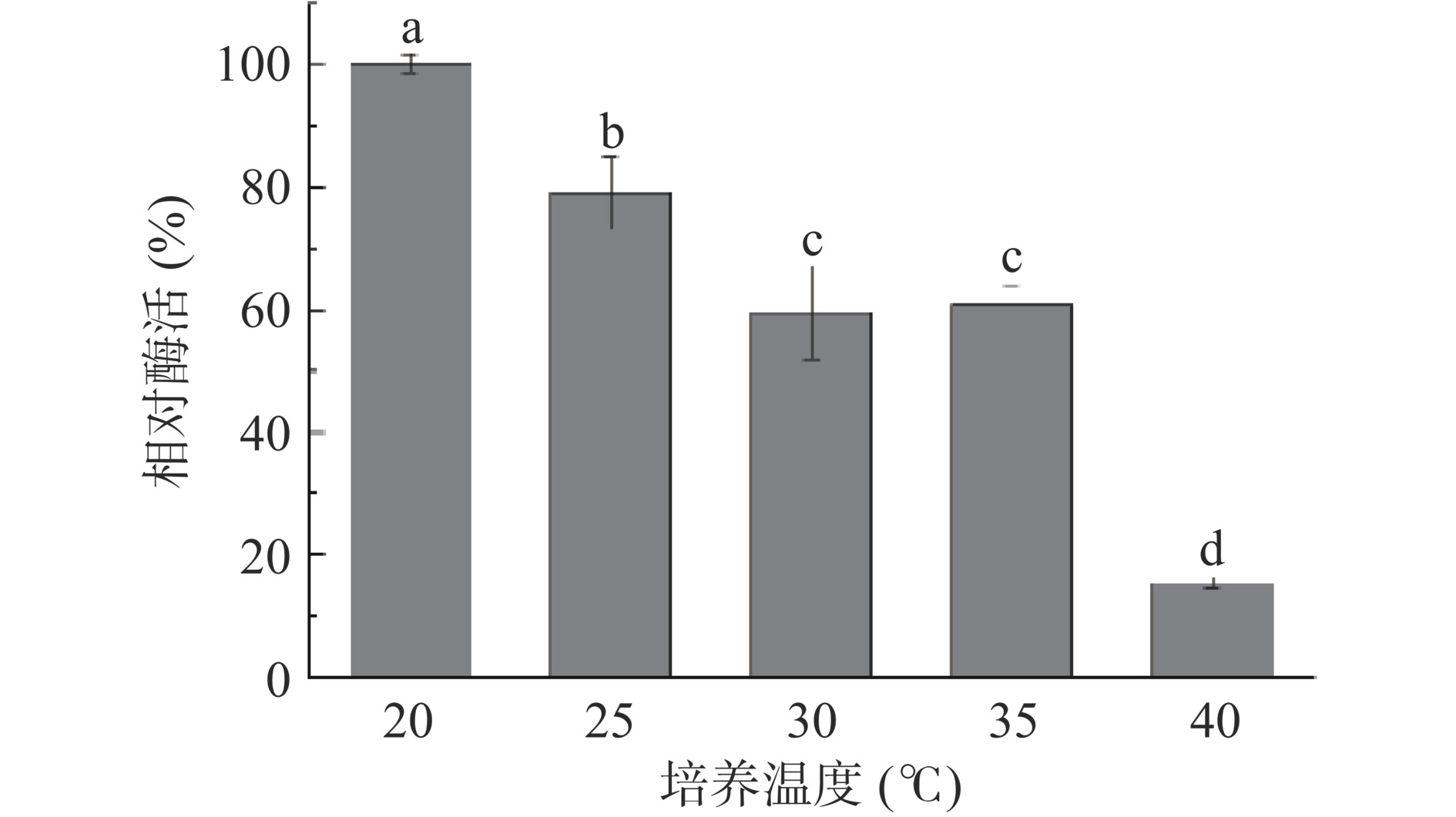
培养温度对酶蛋白的转录翻译以及细菌的生长速率有较大影响。温度升高可加速蛋白质的扩散和碰撞速率,但温度上升到某一值后,酶蛋白逐渐变性,同样,温度过低也可能导致蛋白质的去折叠、聚集等问题。因此按照方法1.2.4.1加入诱导剂后,分别在温度20、25、30、35、40 ℃条件下诱导蛋白表达。比较TPL在不同温度诱导下的酶活,结果如图4所示。当培养温度为20 ℃时(酶活定为100%),TPL酶活明显高于其他温度,酶活从20 ℃到40 ℃随着培养温度的升高而降低,因此20 ℃为重组枯草芽孢杆菌最适培养温度。
2.2.2 培养时间对酪氨酸酚裂解酶的表达影响
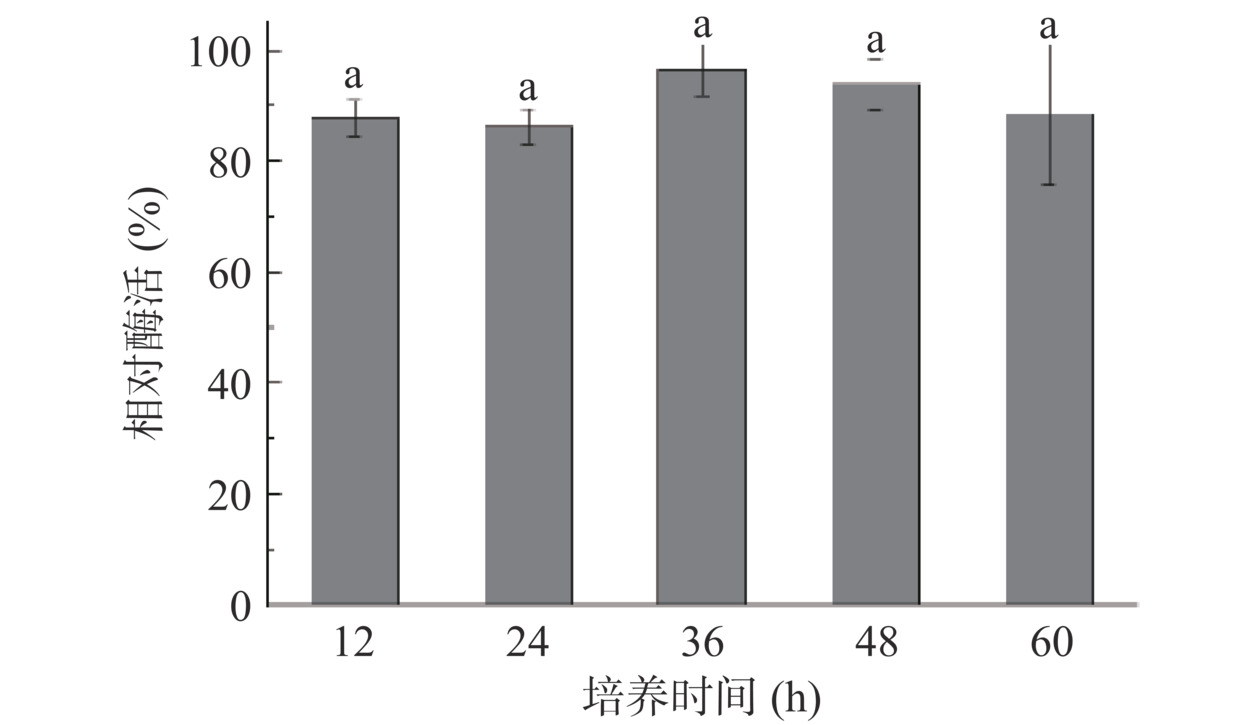
培养时间影响菌体的生长状态,对于重组蛋白的积累效率起着直接的影响。如果培养时间过短,酶蛋白积累量将会减少。而如果诱导时间过长,菌体的生长状态会受到影响,并且菌体自溶和宿主内源性蛋白酶的产生都会降低目标蛋白的积累,从而对酶活产生影响[26]。按照方法1.2.4.1加入诱导剂后,分别在12、24、36、48、60 h不同的诱导时间取一定量的菌体进行酶活测定,结果如图5所示。当培养时间低于36 h时,TPL酶活逐渐增加,36 h时达到最大值(酶活定义为100%),随后超过36 h后TPL酶活开始降低,可能是诱导蛋白表达后期的代谢副产物积累影响酶蛋白表达,因此将诱导表达36 h的重组枯草芽孢杆菌用于后续全细胞实验。
2.2.3 诱导剂浓度对酪氨酸分裂解酶的表达影响
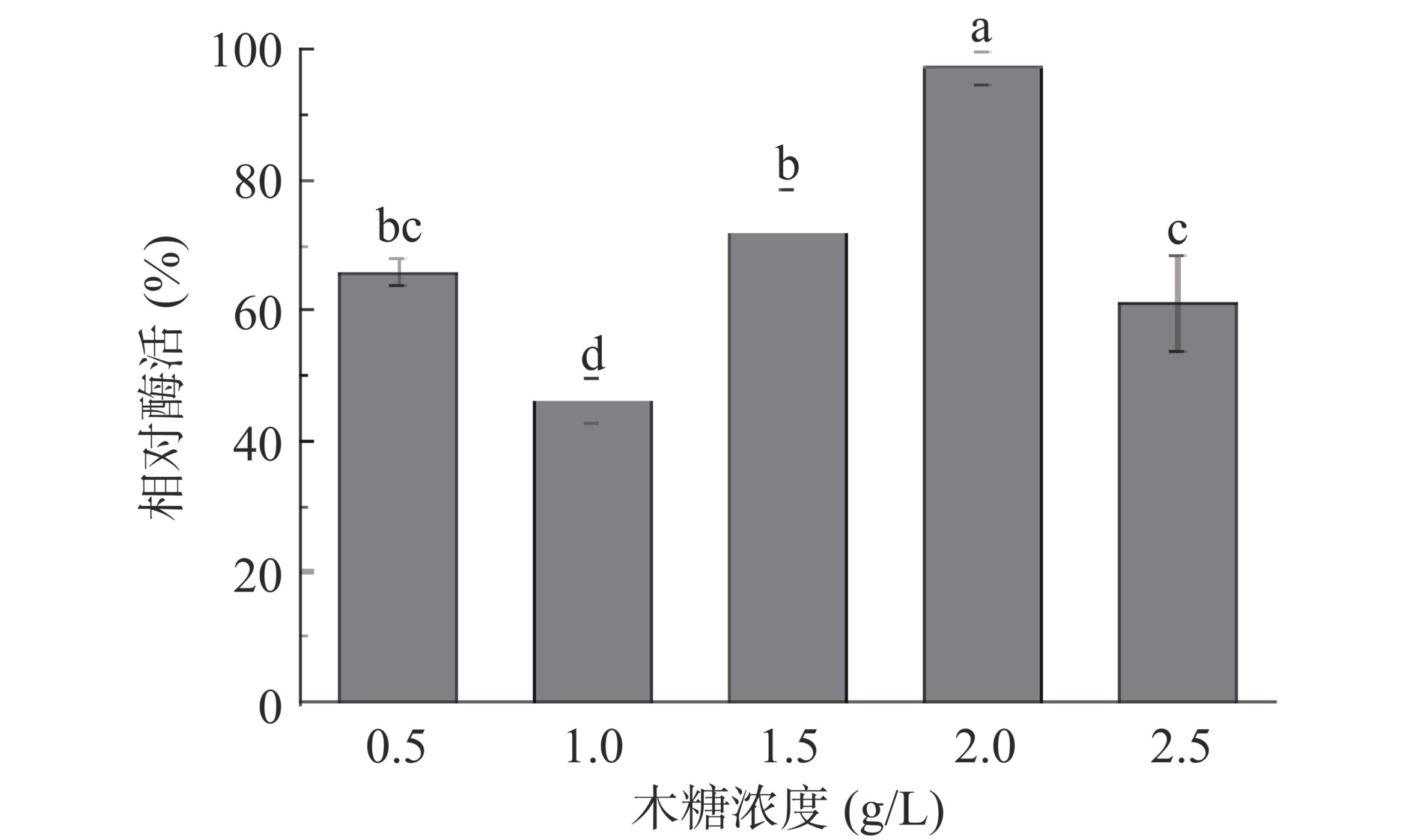
D-木糖作为诱导剂,一方面D-木糖浓度过低会达不到与阻遏蛋白结合的饱和浓度,另一方面浓度过高会导致酶蛋白折叠不完全形成包涵体,并抑制菌体生长,为了防止包涵体的生成[27]。按照方法1.2.4.1分别加入0.5、1.0、1.5、2.0、2.5 g/L终浓度的D-木糖诱导,测量重组枯草芽孢杆菌在不同浓度D-木糖诱导条件下的酶活,结果如图6所示。随着D-木糖浓度提高,TPL酶活也随之增加,当D-木糖浓度达到2.0 g/L(酶活定义为100%)时TPL的活性最高,此后随着D-木糖浓度加大,TPL的活性反而下降。
2.3 全细胞转化条件优化结果
2.3.1 苯酚毒性浓度对全细胞催化合成L-酪氨酸的影响
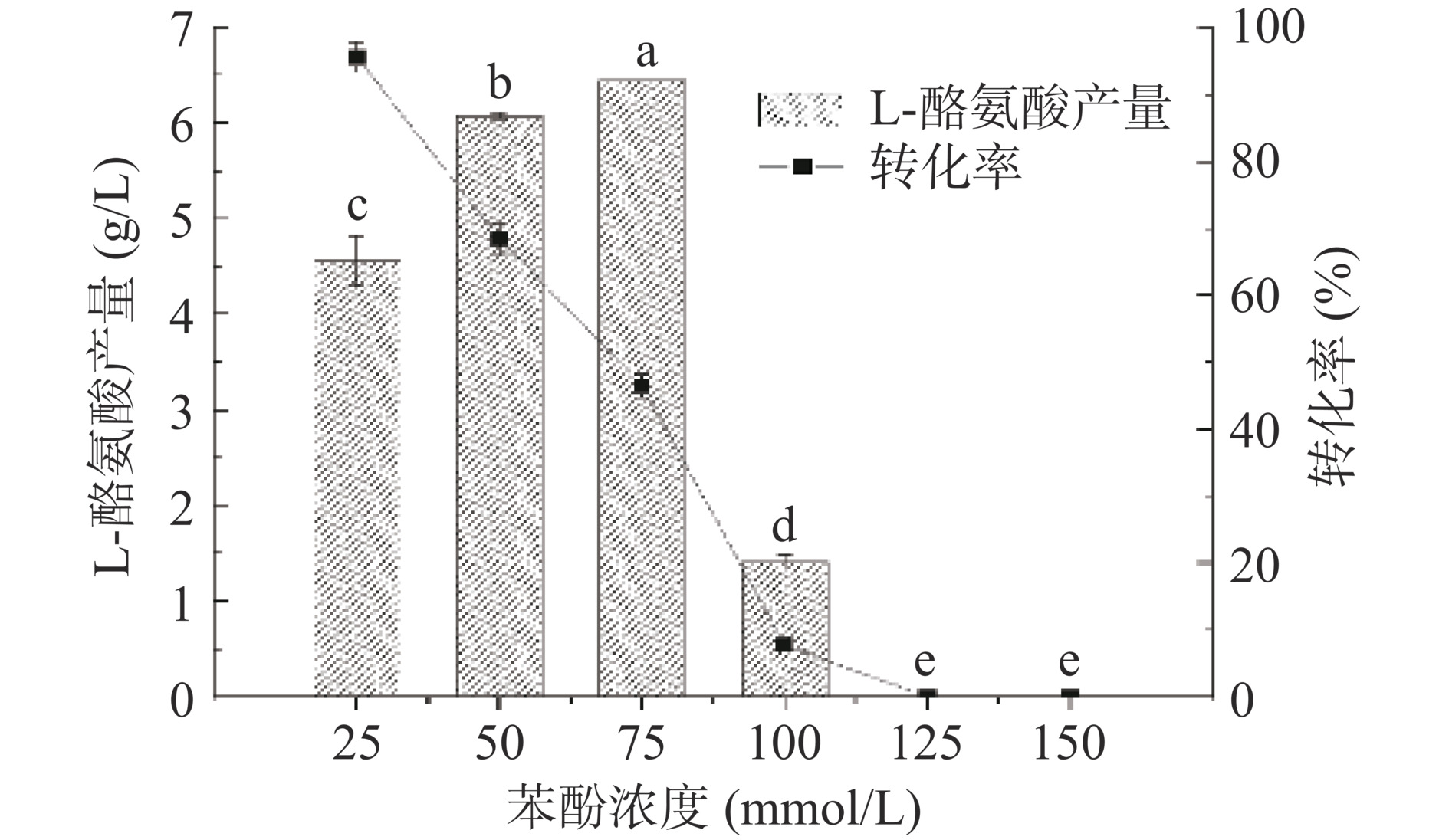
一些文章报道指出,高浓度的苯酚会使蛋白质发生变质和沉淀,对细胞有直接损伤[28−29],因此苯酚浓度是影响酶催化法生成L-Tyr的关键因素,为了研究苯酚浓度对全细胞转化体系的影响,按照方法1.2.7,在反应体系中加入不同浓度的苯酚后检测L-Tyr的产量,结果如图7所示。苯酚浓度在75 mmol/L时的L-Tyr产量最高达到6.5 g/L,当苯酚浓度高于75 mmol/L时,苯酚会对L-Tyr的合成产生明显抑制,苯酚浓度大于125 mmol/L时没有L-Tyr生成。
2.3.2 细胞浓度对全细胞催化合成L-酪氨酸的影响
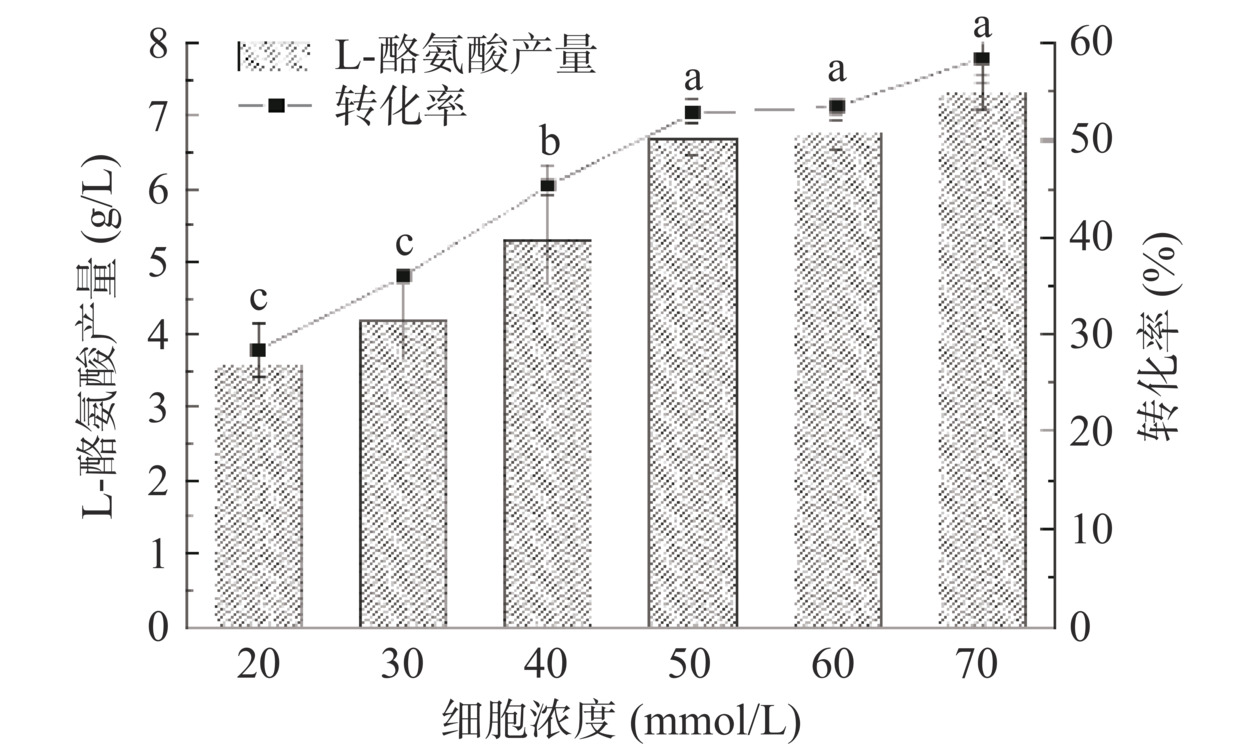
为了满足实际工业生产的效率需求并降低生产成本,需要对全细胞反应体系中的细胞浓度进行优化。不同细胞浓度代表不同的酶添加量,细胞浓度对于全细胞酶促反应起着正向的促进作用,但转化效率不会和菌体量成正比。为了控制成本和高效经济性,按照方法1.2.7,控制苯酚浓度为75 mmol/L,在全细胞转化体系中加入不同浓度的湿细胞,结果如图8所示。随着细胞浓度的提高L-Tyr产量也随之增加,当细胞浓度达到50 g/L后,进一步提高细胞浓度L-Tyr产量并没有明显提升,考虑到成本因素,全细胞转化细胞浓度确定为50 g/L。
2.3.3 转化温度对全细胞合成L-酪氨酸的影响
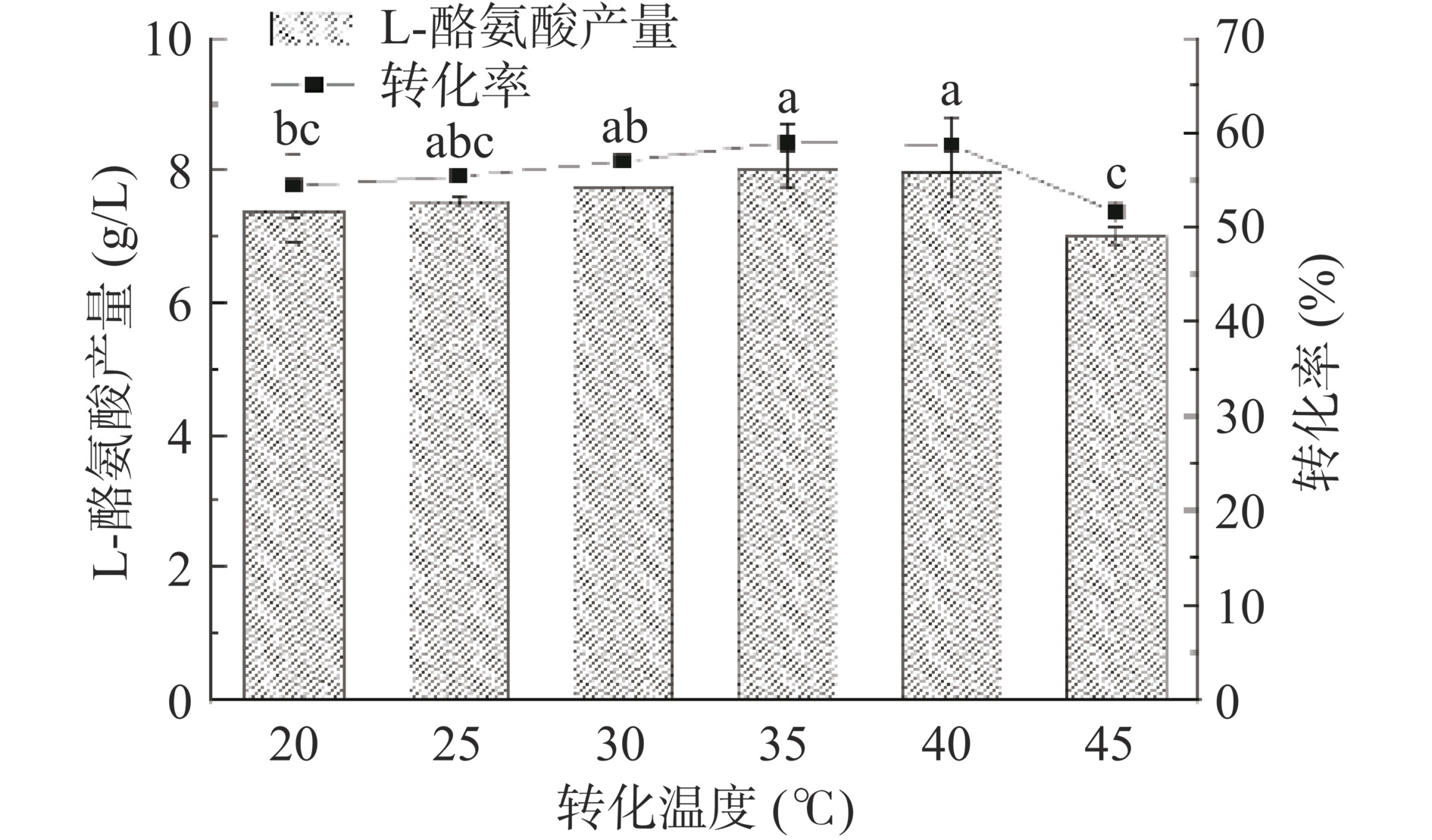
温度对于酶的状态和稳定性都有重要影响,在一定范围内酶促反应速率随着温度的升高而增加,当温度升高到一定程度后,酶的结构会受到破坏而丧失活性,温度同时也是工业应用中需要控制的重要成本之一。按照方法1.2.7,同时控制湿细胞浓度为50 g/L、苯酚浓度为75 mmol/L,在不同温度环境下进行全细胞转化,结果如图9所示。随着转化温度梯度的变化,L-Tyr的产量呈现先升高再降低的趋势,反应温度在20~40 ℃时,L-Tyr产量都能保持在较高水平,当反应温度为35 ℃时L-Tyr的产量最高,约为8.02 g/L。当温度大于40 ℃时,L-Tyr产量开始下降。最佳转化温度和Kumagai等[30]研究中的酶最适温度相比偏低,可能是因为全细胞转化合成L-Tyr的时间较长,温度过高会加速苯酚的氧化和TPL的活性丧失。
2.3.4 反应初始pH对全细胞合成L-酪氨酸的影响
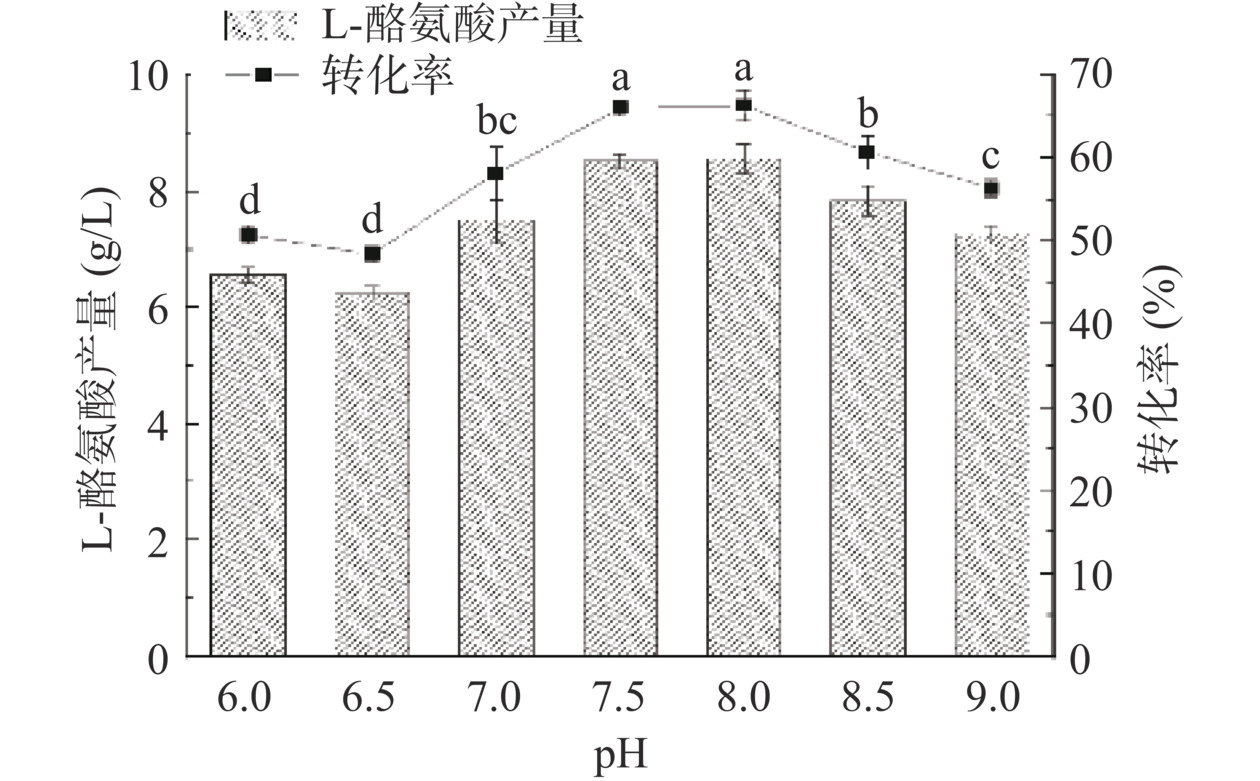
pH可以改变酶活性部位有关基团的解离状态,进而影响酶活性部位与底物的结合,为了使全细胞转化反应更加高效,按照方法1.2.7,同时控制细胞浓度为50 g/L、苯酚浓度75 mmol/L、反应温度35 ℃,对反应初始pH进行研究,结果如图10所示。重组枯草芽孢杆菌在弱碱性条件下表现出很强的催化能力,在转化pH为6~7.5时,L-Tyr产量随着pH升高而增加,当pH=8.0时L-Tyr的产量达到最高的8.5 g/L,之后当pH>8.0时L-Tyr产量逐渐减少。
2.3.5 PLP浓度对全细胞合成L-酪氨酸的影响
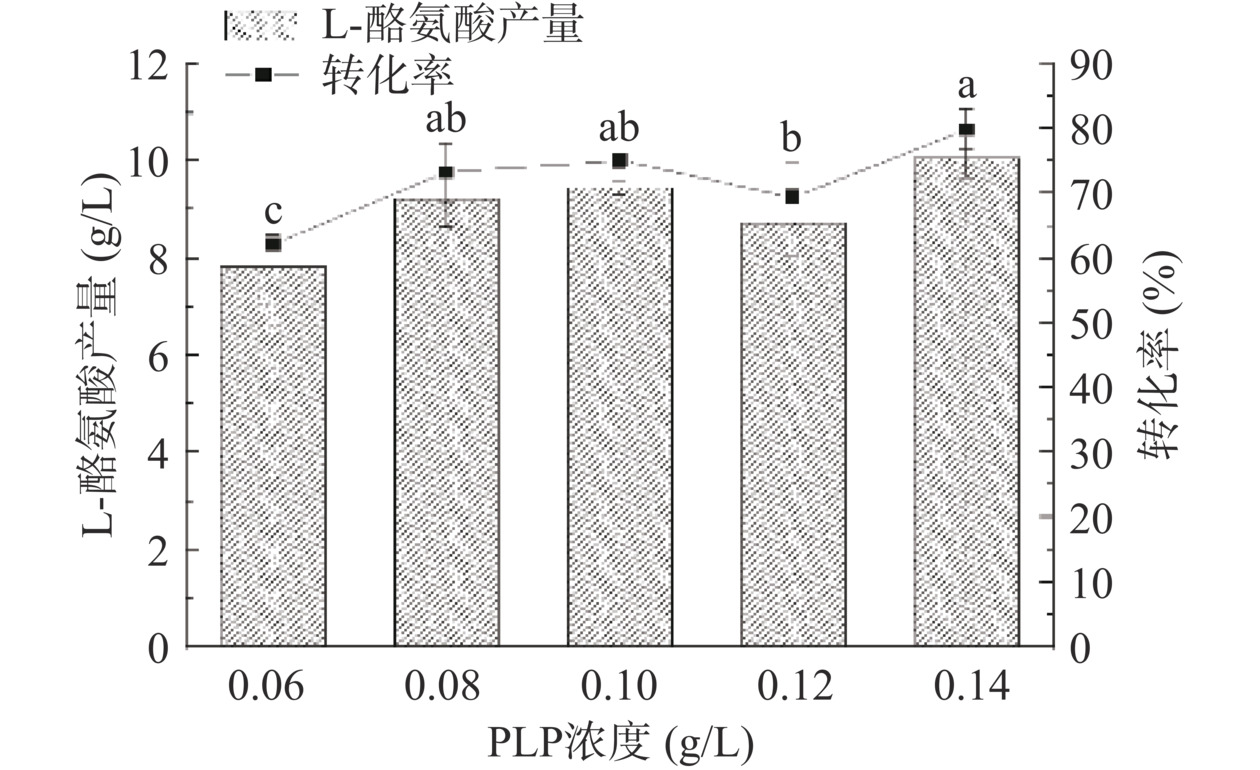
PLP是一种重要的辅酶,在酪氨酸酶酚裂解酶催化的反应中,PLP起到“中间桥梁”的作用,可以与TPL活性中心形成内醛亚胺结构,维持底物α羧基的稳定[18]。适宜浓度的PLP可以有效保证TPL酶活,为了控制成本的同时保证酶活性,按照方法1.2.7,控制细胞浓度为50 g/L、底物浓度为75 mmol/L、反应温度35 ℃、反应初始pH8.0,在全细胞转化反应中加入不同浓度的PLP进行研究,结果如图11所示。当PLP浓度达到0.08 g/L后,L-Tyr基本维持在9.38 g/L左右,因此考虑到成本因素,PLP在全细胞转化反应中的添加浓度为0.08 g/L。
2.3.6 苯酚分批补料合成L-酪氨酸
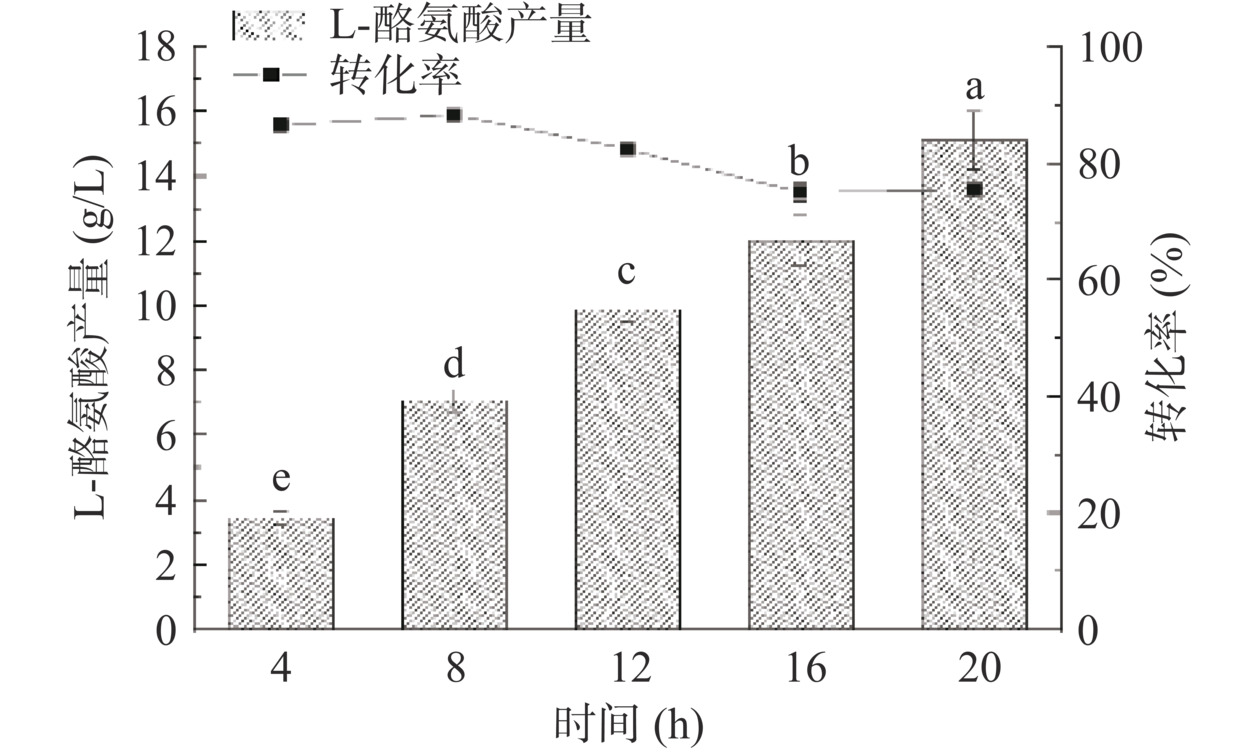
分批补料是指将补充的物料分成若干份加入到反应体系中。当底物的浓度降低到一定水平时,开始第一次补料,补料以后该底物浓度会有所升高,由于酶促反应的消耗,该底物浓度将再次降低,于是进行第二次补料,以此类推,直至全细胞转化结束[31],分批补料可以有效减少底物抑制的影响。在TPL催化的全细胞反应中,苯酚对于TPL的抑制作用是影响全细胞转化反应的关键因素,尤其是当初始苯酚浓度达到125 mmol/L时L-酪氨酸的产量为零,因此将苯酚维持在一个较低的浓度可以保持酶的催化能力。在其他条件都为最优情况下,首次投料25 mmol/L苯酚和丙酮酸钠,分4次补料,每隔4 h补加25 mmol/L,共投料125 mmol/L底物。反应20 h后结果如图12所示,L-酪氨酸的产量达到15.12 g/L,转化率为75.51%。
3. 结论
本次研究将TPL基因在枯草芽孢杆菌中克隆表达,成功构建重组枯草芽孢杆菌B. subtilis 164T7P-pMK4-T7/TPL,首先通过培养条件优化实现了TPL在重组枯草芽孢杆菌中的高效表达,接着对重组枯草芽孢杆菌全细胞转化条件优化,最终在35 ℃、pH8、细胞浓度为50 g/L、底物苯酚75 mmol/L、丙酮酸钠75 mmol/L、氯化铵487 mmol/L、亚硫酸钠2.0 g/L、EDTA 2.0 g/L和PLP 0.08 g/L条件下全细胞转化得到9.38 g/L L-Tyr,转化率为73.24%。进一步为了解除高浓度底物苯酚对于TPL的抑制,通过分批补料策略,在20 h内分批补料4次,每次补料25 mmol/L苯酚,最终获得15.12 g/L的L-Tyr,转化率为75.51%。不同于以往用大肠杆菌作为L-Tyr生产工程菌,本研究首次将TPL在枯草芽孢杆菌中异源表达,开发了一种食品安全级酶催化生产L-Tyr的方法,通过全细胞转化方式生产L-Tyr,保证L-Tyr安全性的同时,也避免了酶反应的复杂操作,简化了工艺流程。本次研究得到的L-酪氨酸产量相对较低,后续需要对补料间隔时间和补料量做进一步研究,更好发挥重组工程菌的生产潜力。
-
表 1 本研究中用到的引物
Table 1 Primers used in this study
引物名称 引物序列(5’-3’) 大小(bp) T7 TAATACGACTCACTATAGGG 20 T7t GCTAGTTATTGCTCAGCGG 19 pMK4-TPL-F GAAAGGAGGATATACCGGATCCATGAACTATCCTGCCGAGCCT 43 pMK4-TPL-R CGGGCTTTGTTAGCAGGAATTCTTAAATAAAGTCAAAACGCGCAG 45 T7N-TesF GTGAGCGGATAACAATTCCCCTCTAG 26 T7N-TesR GTACTGAGAGTGCACCATATGATCCG 26 注:酶切位点用下划线表示。 -
[1] 张乐, 陈润花, 门靖. 酪氨酸分析检测研究进展[J]. 精细化工中间体,2022,52(2):1−4. [ZHANG Le, CHEN Runhua, MEN Jing. Research progress in the analysis and detection of tyrosine[J]. Fine Chemical Intermediates,2022,52(2):1−4.] ZHANG Le, CHEN Runhua, MEN Jing. Research progress in the analysis and detection of tyrosine[J]. Fine Chemical Intermediates, 2022, 52(2): 1−4.
[2] SCHENCK C A, MAEDA H A. Tyrosine biosynthesis, metabolism, and catabolism in plants[J]. Phytochemistry,2018,149:82−102. doi: 10.1016/j.phytochem.2018.02.003
[3] LEHRER S, RHEINSTEIN P H. α-Synuclein enfolds tyrosine hydroxylase and dopamine β-hydroxylase, potentially reducing dopamine and norepinephrine synthesis[J]. Journal of Proteins and Proteomics,2022,13(2):109−115. doi: 10.1007/s42485-022-00088-z
[4] LEHNERT H, REINSTEIN D K, STROWBRIDGE B W, et al. Neurochemical and behavioral consequences of acute, uncontrollable stress:Effects of dietary tyrosine[J]. Brain Research,1984,303:215−223. doi: 10.1016/0006-8993(84)91207-1
[5] 吴梦迪. 铁卟啉催化活性及其应用研究[D]. 西安:西北大学, 2018. [WU Mengdi. A study on the catalytic activity of iron porphyrin and its application[D]. Xi'an:Northwest University, 2018.] WU Mengdi. A study on the catalytic activity of iron porphyrin and its application[D]. Xi'an: Northwest University, 2018.
[6] RUAN X, ZHANG S, SONG W, et al. Efficient synthesis of tyrosol from L-tyrosine via heterologous Ehrlich pathway in Escherichia coli[J]. Chinese Journal of Chemical Engineering,2022,47:18−30. doi: 10.1016/j.cjche.2021.05.026
[7] ALI S, SHULTZ J L, IKRAM UL H. High performance microbiological transformation of L-tyrosine to L-dopa by Yarrowia lipolytica NRRL-143[J]. BMC Biotechnology,2007,7(1):50. doi: 10.1186/1472-6750-7-50
[8] LI Y, MAO J, SONG X, et al. Optimization of the l-tyrosine metabolic pathway in Saccharomyces cerevisiae by analyzing p-coumaric acid production[J]. 3 Biotech,2020,10(6):258. doi: 10.1007/s13205-020-02223-3
[9] GUO X, WU X, MA H, et al. Yeast:A platform for the production of L-tyrosine derivatives[J]. Yeast,2023,40(5-6):214−230. doi: 10.1002/yea.3850
[10] 姚元锋. L-酪氨酸代谢平台构建及其在丹参素合成中的应用[D]. 天津:天津大学, 2013. [YAO Yuanfeng. Constructing the L-Tyrosine metabolic platform and its application on the production of Danshensu[D]. Tianjin:Tianjin University, 2013.] YAO Yuanfeng. Constructing the L-Tyrosine metabolic platform and its application on the production of Danshensu[D]. Tianjin: Tianjin University, 2013.
[11] 李秀华, 王自瑛, 王后方. L-酪氨酸的合成研究[J]. 科技信息,2007(33):23−24. [LI Xiuhua, WANG Ziying, WANG Houfang. Study on the synthesis of L-Tyrosine[J]. Science & Technology Information,2007(33):23−24.] doi: 10.3969/j.issn.1001-9960.2007.33.012 LI Xiuhua, WANG Ziying, WANG Houfang. Study on the synthesis of L-Tyrosine[J]. Science & Technology Information, 2007(33): 23−24. doi: 10.3969/j.issn.1001-9960.2007.33.012
[12] 吴敏. 化学--酶法合成L-酪氨酸[D]. 南京:南京工业大学, 1999. [WU Min. Studies on synthesis of L-Tyrosine by chemico-enzymatic pathway[D]. Nanjing:Nanjing Tech University, 1999.] WU Min. Studies on synthesis of L-Tyrosine by chemico-enzymatic pathway[D]. Nanjing: Nanjing Tech University, 1999.
[13] PING J, WANG L, QIN Z, et al. Synergetic engineering of Escherichia coli for efficient production of L-tyrosine[J]. Synthetic and Systems Biotechnology,2023,8(4):724−731. doi: 10.1016/j.synbio.2023.10.005
[14] KURPEJOVIĆ E, BURGARDT A, BASTEM G M, et al. Metabolic engineering of Corynebacterium glutamicum for L-tyrosine production from glucose and xylose[J]. Journal of Biotechnology,2023,363:8−16. doi: 10.1016/j.jbiotec.2022.12.005
[15] SEISSER B, ZINKL R, GRUBER K, et al. Cutting long syntheses short:Access to non-natural tyrosine derivatives employing an engineered tyrosine phenol lyase[J]. Advanced Synthesis & Catalysis,2010,352(4):731−736.
[16] 常俊俊, 刘均忠, 刘茜, 等. 重组酪氨酸酚裂解酶全细胞催化合成L-酪氨酸[J]. 精细化工,2013,30(10):1112−1116,1137. [CHANG Junjun, LIU Junhong, LIU Xi, et al. Synthesis of L-Tyrosine by whole cell with recombinant tyrosine phenol lyase[J]. Fine Chemicals,2013,30(10):1112−1116,1137.] CHANG Junjun, LIU Junhong, LIU Xi, et al. Synthesis of L-Tyrosine by whole cell with recombinant tyrosine phenol lyase[J]. Fine Chemicals, 2013, 30(10): 1112−1116,1137.
[17] XU S, ZHANG Y, LI Y, et al. Production of L-tyrosine using tyrosine phenol-lyase by whole cell biotransformation approach[J]. Enzyme and Microbial Technology,2019,131:109430. doi: 10.1016/j.enzmictec.2019.109430
[18] LI G, LIAN J, XUE H, et al. Biocascade synthesis of L-Tyrosine derivatives by coupling a thermophilic tyrosine phenol-lyase and L-lactate oxidase[J]. European Journal of Organic Chemistry,2020,2020(8):1050−1054. doi: 10.1002/ejoc.202000061
[19] TANJI Y, HATTORI K, SUZUKI K, et al. Spontaneous deletion of a 209-kilobase-pair fragment from the escherichia coli genome occurs with acquisition of resistance to an assortment of infectious phages[J]. Applied and Environmental Microbiology,2008,74(14):4256−4263. doi: 10.1128/AEM.00243-08
[20] EJAZ S, KHAN H, SARWAR N, et al. A review on recent advancement in expression strategies used in Bacillus subtilis[J]. Protein & Peptide Letters,2022,29(9):733−743.
[21] JI M, LI S, CHEN A, et al. A wheat bran inducible expression system for the efficient production of α-L-arabinofuranosidase in Bacillus subtilis[J]. Enzyme and Microbial Technology,2021,144:109726. doi: 10.1016/j.enzmictec.2020.109726
[22] 萨姆布鲁克. 分子克隆实验指南[M]. 北京:科学出版社, 2002:87−92. [JOSEPH S. Molecular cloning[M]. Beijing:Science Press, 2002:87−92.] JOSEPH S. Molecular cloning[M]. Beijing: Science Press, 2002: 87−92.
[23] 梁栋, 陈芳, 张良, 等. 枯草芽孢杆菌中胞壁肽的分离纯化及其对芽孢的影响[J]. 中国食品学报,2021,21(3):369−374. [LIANG Dong, CHEN Fang, ZHANG Liang, et al. The isolation and purification of muropeptides from the Bacillus subtilis and its effect on spore germination[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(3):369−374.] LIANG Dong, CHEN Fang, ZHANG Liang, et al. The isolation and purification of muropeptides from the Bacillus subtilis and its effect on spore germination[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(3): 369−374.
[24] 陈明亮, 张利坤, 杨卫华, 等. 三酶偶联全细胞生物合成L-酪氨酸[J]. 精细化工,2019,36(3):455−460. [CHEN Mingliang, ZHNAG Likun, YANG Weihua, et al. Biosynthesis of L-tyrosine with aldolase, d-serine dehydratase and tyrosine phenol-lyase[J]. Fine Chemicals,2019,36(3):455−460.] CHEN Mingliang, ZHNAG Likun, YANG Weihua, et al. Biosynthesis of L-tyrosine with aldolase, d-serine dehydratase and tyrosine phenol-lyase[J]. Fine Chemicals, 2019, 36(3): 455−460.
[25] HEBERLING M M, MASMAN M F, BARTSCH S, et al. Ironing out their differences:Dissecting the structural determinants of a phenylalanine aminomutase and ammonia lyase[J]. ACS Chemical Biology,2015,10(4):989−997. doi: 10.1021/cb500794h
[26] 解静聪, 蒋剑春, 高月淑, 等. 重组木聚糖酶的诱导表达及其定向制备低聚木糖的研究[J]. 林产化学与工业,2020,40(5):99−106. [XIE Jingcong, JIANG Jianchun, GAO Yueshu, et al. Induced expression of recombinant β-1,4-xylanase and its directional preparation of xylo-oligosaccharide[J]. Chemistry and Industry of Forest Products,2020,40(5):99−106.] doi: 10.3969/j.issn.0253-2417.2020.05.014 XIE Jingcong, JIANG Jianchun, GAO Yueshu, et al. Induced expression of recombinant β-1,4-xylanase and its directional preparation of xylo-oligosaccharide[J]. Chemistry and Industry of Forest Products, 2020, 40(5): 99−106. doi: 10.3969/j.issn.0253-2417.2020.05.014
[27] SOEJIMA K, MIMURA N, YONEMURA H, et al. An efficient refolding method for the preparation of recombinant human prethrombin-2 and characterization of the recombinant-derived-thrombin[J]. The Journal of Biochemistry,2001,130(2):269−277. doi: 10.1093/oxfordjournals.jbchem.a002982
[28] KIM D Y, RHA E, CHOI S L, et al. Development of bioreactor system for L-tyrosine synthesis using thermostable tyrosine phenol-lyase[J]. Journal of Microbiology and Biotechnology,2007,17(1):116−122.
[29] XU S, WANG Q, ZENG W, et al. Construction of a heat-inducible Escherichia coli strain for efficient de novo biosynthesis of L-tyrosine[J]. Process Biochemistry,2020,92:85−92. doi: 10.1016/j.procbio.2020.02.023
[30] KUMAGAI H, KASHIMA N, TORII H, et al. Purification, crystallization and properties of tyrosine phenol lyase from erwinia herbicola[J]. Agricultural and Biological Chemistry,1972,36(3):472−482. doi: 10.1080/00021369.1972.10860265
[31] MEARS L, STOCKS S M, SIN G, et al. A review of control strategies for manipulating the feed rate in fed-batch fermentation processes[J]. Journal of Biotechnology,2017,245:34−46. doi: 10.1016/j.jbiotec.2017.01.008
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:
 下载:
下载:



