Screening, Identification and Growth Characterization of Strains Inhibiting the Growth and Synthesis of Ochratoxin A by Aspergillus niger in Hams
-
摘要: 赭曲霉毒素A(Ochratoxin A,OTA)是干腌火腿中常见的真菌毒素之一,对消费者健康构成极大威胁。黑曲霉(Aspergillus niger)A-8是贵州盘县火腿中OTA的主要产生菌,为筛选出有效抑制A. niger A-8产OTA的菌株,以具有潜在生防能力的菌株QF3、KF4和RS18为试验菌株,研究其抗真菌活性,NaCl含量对其生长及抗真菌活性的影响,以及3株菌在火腿培养基中抑制A. niger A-8产OTA的能力。对3株菌进行溶血性,形态学和16S rDNA鉴定以及生长特性研究。结果表明,3株菌对A. niger A-8均具有较强抗真菌活性。高浓度(8%)的NaCl能抑制3株菌的生长,但不影响其抗真菌活性。28 ℃时,3株菌能抑制A. niger A-8在火腿培养基中合成OTA。模拟火腿发酵温度18 ℃时,只有菌株RS18对A. niger A-8产OTA抑制效果显著(P<0.05)。菌株QF3、KF4和RS18均不具有溶血性。经过鉴定,菌株QF3为耐盐魏斯氏菌(Weissella halotolerans),菌株KF4和RS18为植物乳植杆菌(Lactiplantibacillus plantarum)。3株乳酸菌在17~42 ℃和pH5~9时都表现出良好的生长特性。综上所述,菌株RS18在火腿发酵温度同样具有抑制OTA产生的活性,有潜力成为防控自然发酵干腌火腿中OTA污染的生防菌。此外,关于耐盐魏斯氏菌抑制黑曲霉生长和OTA合成的效应为首次报道。这项研究为中式干腌火腿自然发酵过程中OTA污染防控提供了重要的生防思路。Abstract: Ochratoxin A (OTA) was a common mycotoxin in dry-cured hams, posing a significant threat to consumer health. Aspergillus niger A-8 serves as the primary OTA-producing fungus in ham in Panxian County, Guizhou Province. To identify strains capable of inhibiting OTA production by A. niger A-8, three strains (QF3, KF4, and RS18) were selected to assess their potential biocontrol ability, including antifungal activity, the impact of NaCl content on growth and antifungal activity, and their ability to inhibit OTA production in ham media. Simultaneously, the three strains underwent haemolytic, morphological and 16S rDNA identification, along with growth characterization. Results showed that all three strains exhibited robust antifungal activity against A. niger A-8. Although a high NaCl concentration (8%) hindered their growth, it did not compromise their antifungal efficacy. These strains effectively (P<0.05) suppressed the synthesis of OTA by A. niger A-8 in ham medium. Notably, only strain RS18 inhibited OTA production under simulated ham fermentation temperature conditions, and none exhibited hemolytic activity. Further analysis revealed that strain QF3 belonged to Weissella halotolerans, while strains KF4 and RS18 were identified as Lactiplantibacillus plantarum. All three strains displayed favorable growth characteristics within the temperature range of 17~42 ℃ and pH5~9. In conclusion, RS18 strong antifungal and OTA-producing inhibitory activities, showcasing its potential as a biocontrol bacterium capable of preventing and controlling OTA contamination in naturally fermented dry-cured hams. Additionally, this study reported the inhibitory effect of W. halotolerans on the growth and OTA synthesis of A. niger for the first time, that would provide the valuable insights for novel biocontrol management against OTA contamination during the natural fermentation of Chinese dry-cured hams.
-
Keywords:
- dry-cured ham /
- Aspergillus niger /
- ochratoxin A /
- lactic acid bacteria /
- antifungal
-
传统的干腌火腿一般由新鲜猪后腿经过盐腌制、干燥、发酵和熟化制成,其独特风味、色泽和口感是由内源酶和微生物共同作用形成的[1−2]。然而,在长期自然发酵和成熟过程中,火腿表面覆盖的霉菌可能包括一些产毒素真菌,造成食品安全隐患。赭曲霉毒素A(Ochratoxin A,OTA)是干腌火腿和发酵香肠中最常见的霉菌毒素,OTA污染也是全球面临的重要的食品安全问题之一[3]。OTA是由青霉属和曲霉属霉菌产生的一种次级代谢物,例如黑曲霉(Aspergillus niger),赭曲霉(Aspergillus ochraceus),西曲霉(Aspergillus westerdijkiae),北欧青霉(Penicillium nordicum),公共青霉(Penicillium commune),产黄青霉(Penicillium chrysogenum),疣状青霉(Penicillium verrucosum)等[1,4]。OTA具有肾毒性、肝毒性、致畸性、致突变性、致癌性和免疫抑制等生物效应从而被国际癌症机构列为人类潜在致癌物(2B类致癌物)[5]。干腌火腿中的OTA污染主要由于自然发酵环境中的火腿表面有害霉菌的定植[6]。一旦食品受到OTA污染,由于OTA具有强的热稳定性而很难被清除。食用受污染的食品,OTA可能会在人体内积累[7]。国外研究报道,在意大利市售40个干腌火腿样品中,OTA污染率高达100%,OTA平均浓度为3.27 μg/kg,浓度范围为1.14~6.29 μg/kg[8]。本课题组前期调研贵州省传统工艺自然发酵的盘县火腿中真菌毒素污染情况时发现OTA污染严重(2.2~14.4 μg/kg),亟需探索防控其中OTA污染的有效措施。
目前去除食品中OTA的方法包括物理、化学和生物措施。物理法包括加热挤压、吸附、紫外线(ultraviolet,UV)和伽马射线以及冷等离子体等[9]。吸附作为一种简单易行的物理方法虽能有效去除食品原料中的OTA,但也会对食品中营养素进行非特异性吸附从而导致产品营养组分的降低[10]。辐照和冷等离子体去除OTA的效果较好,但需要配备专门的设备,限制了其应用范围[11]。化学法常通过亚硫酸氢钠、氨、氢氧化钠和次氯酸钠等化学试剂去除OTA,成本低且效果好[12−13],但与目前食品工业和消费者普遍追求的“Clean label”目标相矛盾且消费者担忧其存在化学残留。生物法是利用微生物或其代谢产物来抑制病原菌的生长和繁殖,其中乳酸菌和酵母菌是食品中常见的功能微生物且多具有拮抗功能[14−15]。
乳酸菌(Lactic acid bacteria,LAB)是一类能发酵葡萄糖产生乳酸的细菌,被美国食品药品管理局(Food and Drug Administration,FDA)认定为“公认安全(Generally Recognized as Safe,GRAS)”,并被欧洲食品安全局(European Food Safety Authority,EFSA)认定为“安全资格认证(Qualified Presumption of Safety,QPS)”[16]。除发酵作用外,乳酸菌还具有广谱抗菌特性,包括能抑制部分产毒素真菌的生长及毒素合成。研究发现,副干酪乳杆菌(Lactobacillus paracasei)、干酪乳杆菌(Lactobacillus casei)、植物乳植杆菌(Lactiplantibacillus plantarum)、戊酸乳球菌(Pediococcus pentosaceus)等乳酸菌能抑制产毒真菌生长及OTA合成[17−18]。植物乳杆菌(Lactobacillus plantarum)和德尔布鲁贝克乳杆菌亚种(Lactobacillus delbrueckii subsp. Lactis)能抑制寄生曲霉(Aspergillu parasiticus)的生长并减少总黄曲霉毒素的产生,并抑制aflR基因的表达[19]。植物乳植杆菌FJS003对黄曲霉(Aspergillus flavus)CICC41469菌丝和孢子的体外抑制率分别达到42.8%和100%,对黄曲霉毒素B1(Aflatoxin B1,AFB1)的去除率高达89.5%[20]。
目前,乳酸菌抑制/去除真菌毒素含量的可能机制主要有:乳酸菌活菌通过空间和养分竞争直接抑制产毒真菌的生长进而抑制其合成毒素,或通过菌体细胞壁中的磷脂和多糖等成分吸附毒素,达到去除毒素的目的[21]。乳酸菌的代谢物可能包含抗真菌化合物(如脂肪酸、羧酸等有机酸、细菌素、环状二肽)直接抑制产毒素真菌的生长和产毒或间接通过改变产毒素真菌的外部环境条件而抑制其生长和产毒[22−25]。
作为干腌火腿和发酵香肠中常见的发酵菌种,乳酸菌对干腌火腿和发酵香肠中产毒真菌的抗真菌活性被广泛关注[26−27]。但已有的研究常使用乳酸菌上清液而不是直接使用乳酸菌活菌进行体外实验。此外,以往的研究主要集中于欧美国家干腌或发酵肉类中几种常见的OTA产生菌,如帕尔马火腿中的Penicillium nordicum[28]、发酵香肠中的Penicillium verrucosum[29]、短期调味干腌火腿中的Aspergillus westerdijkiae[30],未见针对亚洲干腌或发酵肉制品中真菌毒素产生菌的研究。盘县火腿产自具有典型喀斯特地貌和气候特征的贵州省盘州市,于2012年取得国家地理标志产品称号,是中国西南地区干腌火腿的典型代表之一。盘县火腿至今依然延续传统粗放的加工工艺,通常经历自然环境中1~3年的发酵和后熟,在此过程中火腿表面会经历微生物群落的覆盖和更替。课题组前期调研盘县火腿中OTA污染情况时发现,黑曲霉(Aspergillus niger)是盘县火腿中最主要的OTA产生菌,这与国外广泛报道不同,可能是由于不同国家地区发酵的自然环境条件差异所致。为筛选可用于防控盘县火腿中OTA污染的生防菌,课题组前期用49株来源于发酵肉和干腌肉制品的细菌菌株在模式产毒培养基进行初筛,本研究将对其中3株具有生防潜力的菌株进行如下研究:抗真菌活性,NaCl含量对其生长及抗真菌活性的影响,以及3株菌在火腿培养基中抑制A. niger A-8产OTA的能力;溶血性,形态学和16S rDNA鉴定以及生长特性研究。本研究成果将为开发中式干腌火腿中OTA污染的生物防控措施提供重要的理论指导。
1. 材料与方法
1.1 材料与仪器
盘县火腿 贵州杨老奶食品有限公司;Aspergillus niger A-8菌株 本课题组前期从盘县火腿中分离、纯化和鉴定得到一株盘县火腿中的最主要的OTA产生菌;生防试验菌株 课题组前期分离自遵义黔五福风肉的菌株QF3、凯里风肉的菌株KF4、榕江酸肉的菌株RS18;金黄色葡萄球菌(Staphylococcus aureus)ATCC25923 购买自广东省微生物菌种保藏中心;MRS肉汤培养基、MRS琼脂培养基、马铃薯葡萄糖琼脂培养基(PDA) 上海博微生物科技有限公司;革兰氏染色试剂盒 北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒,哥伦比亚血琼脂平板 生工生物工程(上海)股份有限公司;赭曲霉毒素A残留酶联免疫检测试剂盒 北京勤邦生物技术公司。
SW-CJ-1FB超净工作台、LGJ-18真空冷冻干燥机 上海豫明仪器责任有限公司;SPX-300生化培养箱 浙江托普云农科技股份有限公司;LS-75LD全自动高压灭菌锅 江阴滨江医疗设备有限公司;DMEX20光学显微镜 宁波舜宇仪器有限公司;SU8100扫描电子显微镜 HITACHI;PHS-3E pH计 上海仪电科学仪器股份有限公司;QE-100高速粉碎机 浙江屹立工贸有限公司;Thermoscientiffic酶标仪1500 新加坡生命科技股份有限公司。
1.2 实验方法
1.2.1 菌种活化
菌株A. niger A-8接种于PDA平板中,28 ℃培养7 d。向平板中加入0.9%的NaCl水溶液振荡,收集孢子悬浮液后计数并将浓度调整为1×107 spores/mL。菌株QF3、KF4和RS18接种到MRS肉汤培养基中,于37 ℃下培养24 h,进行两次传代培养,达到浓度为109 CFU/mL。
1.2.2 菌株的抗真菌活性测定
参照Magnusson等[31]方法研究QF3、KF4和RS18的抗真菌活性。先将菌株QF3、KF4和RS18分别接种至MRS琼脂培养基中,于37 ℃培养48 h。然后将1 mL A. niger A-8孢子悬液(1×104 spores/mL)与9 mL PDA培养基混匀后覆盖在MRS琼脂平板上。所有平板于28 ℃恒温培养24 h观察抑菌效果。
1.2.3 菌株耐盐性测定
参照YANG等[32]方法测定NaCl对菌株QF3、KF4和RS18生长及其抗菌活性的影响。将菌液分别接种至10 mL NaCl含量为0、20、50和80 g/L的MRS肉汤培养基中,于37 ℃培养24 h后,用酶标仪在吸光度600 nm处测定其OD。制备双层培养基,底层为MRS琼脂培养基,放置4个牛津杯,里面加入100 μL在不同盐浓度培养24 h的菌液。上层为20 mL含有2 mL A. niger A-8孢子悬浮液(1×104 spores/mL)的PDA培养基。以相同体积的不含细菌的MRS肉汤培养基用作对照。所有平板均在28 ℃培养24 h后,观察并拍照。
1.2.4 菌株对A. niger A-8菌株产OTA的抑制效果评估
制备火腿培养基:盘县火腿切成肉丁,在真空冷冻干燥机冷冻干燥 48 h后用高速粉碎机(28000 r/min,30 s)研磨成粉末;称取9 g火腿粉和0.6 g琼脂装入250 mL锥形瓶,加入30 mL超纯水搅拌均匀,121 ℃灭菌20 min。待火腿培养基冷却,分别将1 mL QF3、KF4和RS18菌液和1 mL A. niger A-8孢子悬浮液(1×107 spores/mL)混合后加入其中,在18 ℃和28 ℃培养15 d。对照组加入相同体积的MRS肉汤培养基。培养结束后,将所有样品冷冻干燥48 h并研磨成粉末,然后进行OTA含量检测。
1.2.5 OTA含量测定
使用赭曲霉毒素A残留酶联免疫检测试剂盒检测火腿培养基中的OTA含量。首先,制备OTA标准曲线(0、0.4、0.8、1.6、3.2和6.4 μg/kg)。在50 mL离心管中将3 g火腿培养基样品与10 mL甲醇混合后先剧烈振荡5 min,然后离心(10 min,3000×g)以提取火腿培养基中的OTA。使用酶标仪读取波长为450/630 nm下的样品OD值。所有样品均稀释在标准曲线范围内。该方法的检出限(LOD)和定量限(LOQ)分别为1.63 和2.42 μg/kg。
1.2.6 菌株安全性评估
将QF3、KF4和RS18接种至哥伦比亚血琼脂平板,37 ℃培养48 h,以评估其溶血活性。检查血琼脂平板是否出现α溶血(菌落周围出现绿色带)、β溶血(菌落周围出现透明带)或γ溶血(菌落周围无溶血带)迹象。金黄色葡萄球菌ATCC25923用作阳性对照[33]。
1.2.7 形态学和分子鉴定
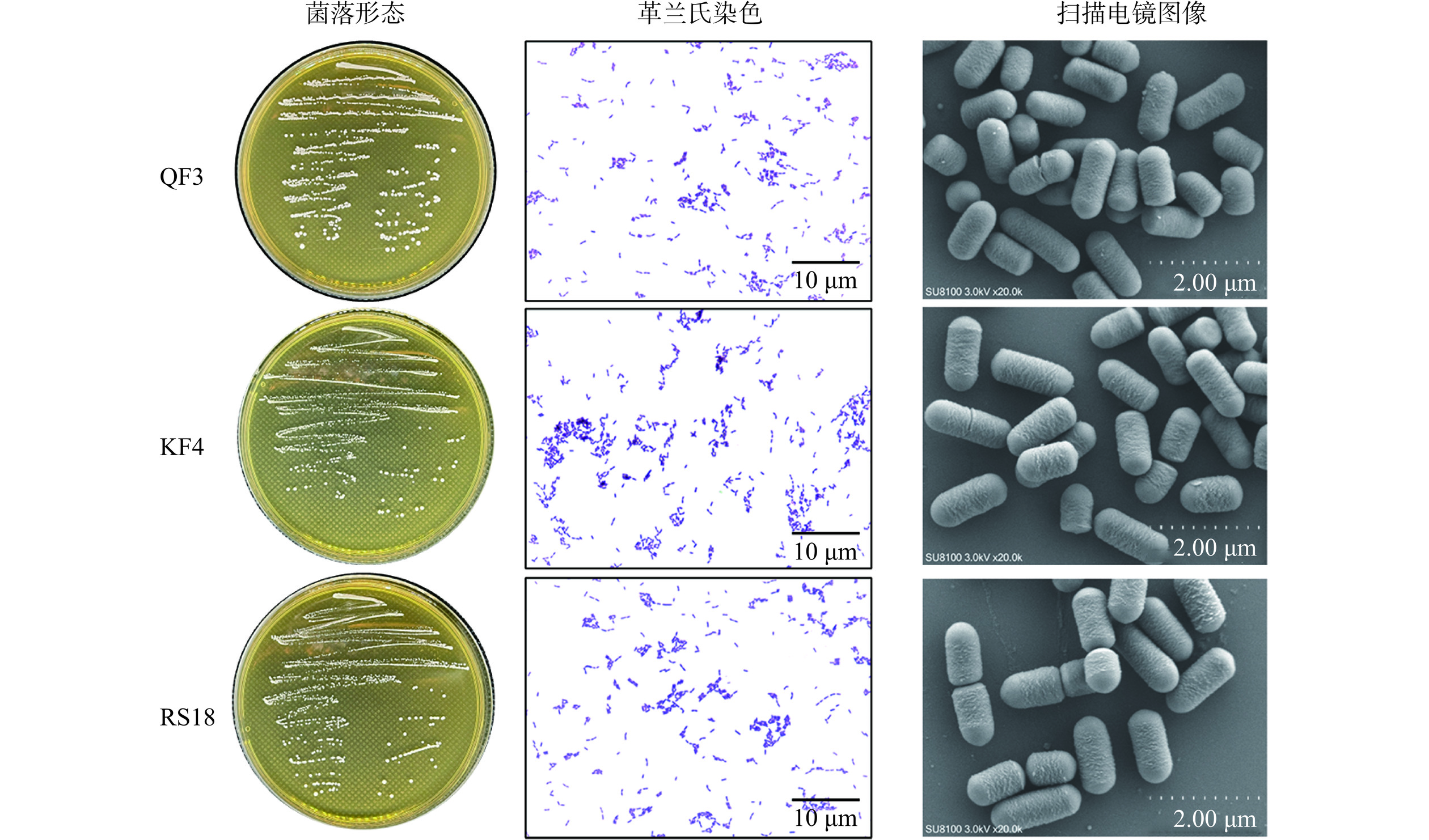
将菌株QF3、KF4和RS18接种至MRS琼脂培养基,37 ℃培养48 h后,挑取单菌落进行革兰氏染色。利用扫描电子显微镜观察细菌的微观形态结构。
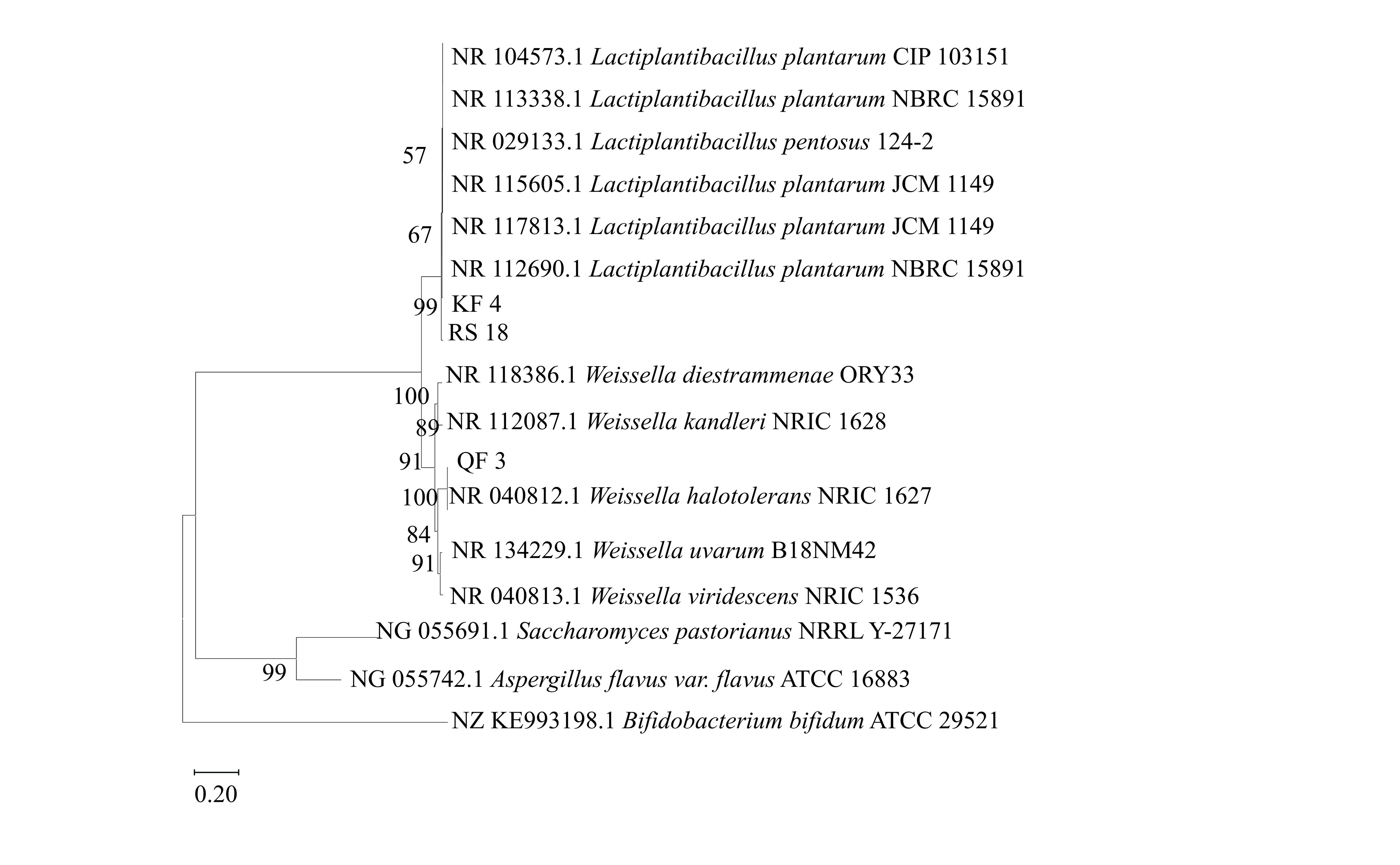
用细菌基因组DNA提取试剂盒提取3株菌的DNA,并以此为模板进行PCR扩增16S rDNA,引物为27F(5′-AGTTTGATCMTGGCTCAG-3′)和1492R(5′-TACGGYTACCTTGTTACGACTT-3′)[34]。扩增反应体系的体积为20 μL,具体如下:10 μL 2×EsTaqMasterMix(染料)、每种引物各1 μL、模板DNA 1 μL和ddH2O 7 μL。程序如下:预变性(94 ℃,5 min);变性(94 ℃,30 s),退火(52 ℃,30 s),延伸(72 ℃,50 s);30个循环;最后延伸(72 ℃,10 min)。PCR扩增产物经琼脂糖电泳后送至生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI数据库中使用BLAST进行同源性比较,并使用MEGA11软件构建系统发育树。
1.2.8 菌株生长特性
将QF3、KF4和RS18接种至MRS肉汤培养24 h,每隔2 h用酶标仪和pH计分别测定样品的OD600 nm和pH。此外,测定菌株QF3、KF4和RS18在17、22、27、32、37、42和47 ℃温度下培养24 h和不同初始pH(1~9)下的生长能力(OD600 nm)。
1.3 数据处理
所有实验至少设置3个重复,结果以平均值±标准偏差进行报告。数据分析采用方差分析和Tukey检验,使用IBM SPSS统计软件27(IBM Corporation)进行,结果以P<0.05为差异显著。
2. 结果与分析
2.1 菌株的抗真菌活性
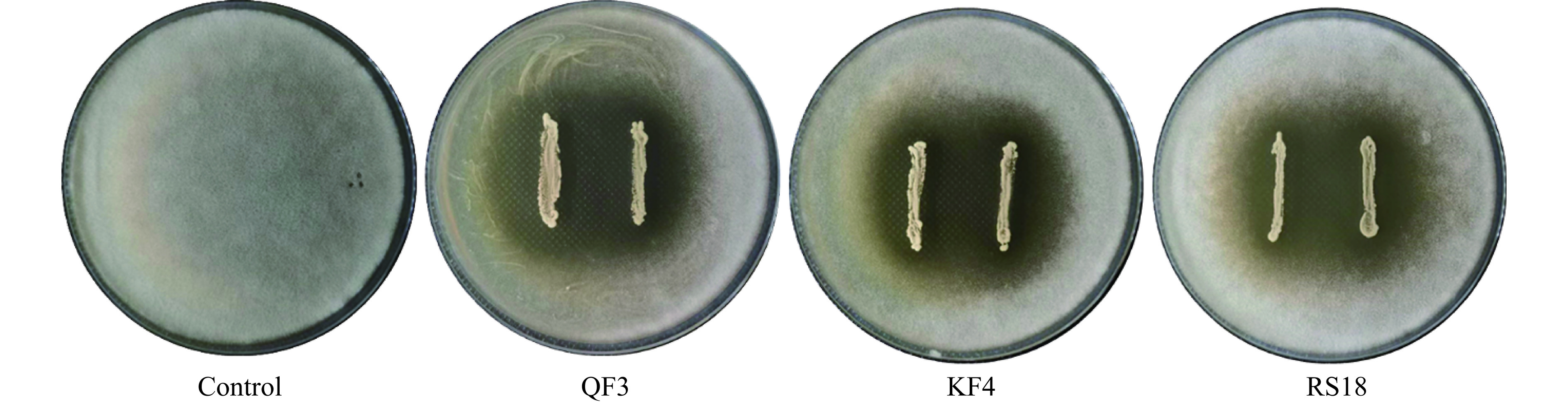
同源食物原料或食品的菌株通常是生防菌株的主要来源。考虑到干腌火腿加工过程中的OTA毒素防控需求,发酵肉制品来源的菌株是本实验的研究对象。通过体外平板抑菌实验,可大致了解其是否具有抗真菌活性。如图1所示,与对照组相比,在菌株QF3、KF4和RS18周围均可以看到清晰的抑菌圈,表明这3株菌对A. niger A-8的菌丝生长具有较强的抑制作用。
2.2 NaCl对菌株生长及抗菌活性的影响
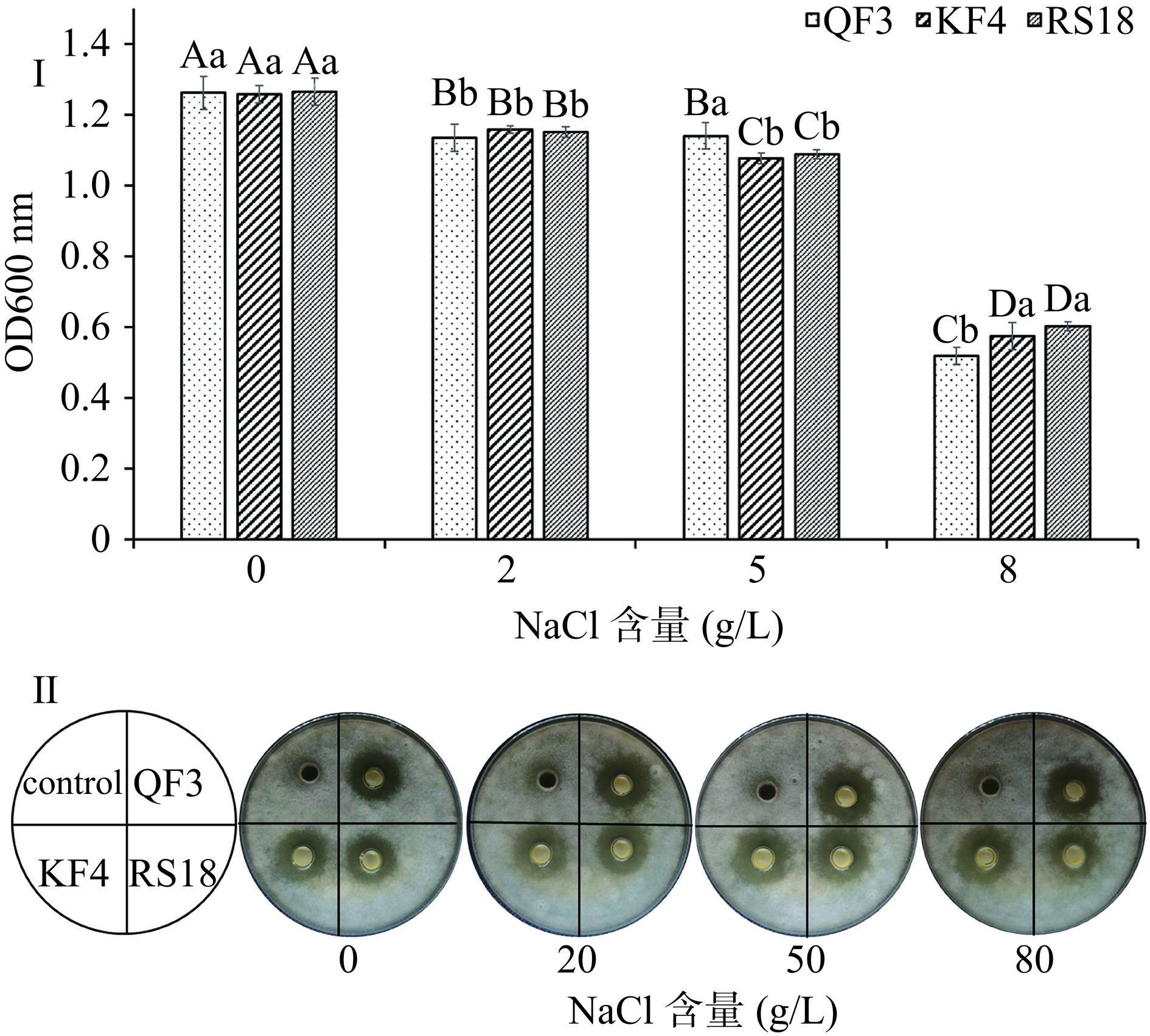
在传统的盘县火腿生产过程中,食盐(NaCl)是唯一的食品添加剂。由于火腿加工需要经历长时间暴露在自然环境中的发酵和后熟阶段,在腌制火腿时常采用较高的用盐量(6%~8%,鲜肉质量)以防止腌制期相对高含水量的火腿腐烂变质。此外,火腿的水分活度和水分含量在发酵和后熟过程中逐渐降低是后期火腿抑菌的关键。因此,应用于干腌火腿的外源生防菌须耐受一定范围的高盐环境。本实验首先探究了菌株QF3、KF4和RS18在不同盐浓度环境下的生长情况。如图2Ⅰ所示,随着MRS肉汤培养基中NaCl含量的增加,3株菌的生长量降低,与对照组相比均有显著性差异(P<0.05)。当NaCl含量为8%(80 g/L)时,菌株QF3、KF4和RS18的生长分别被抑制了58.97%,54.36%和52.41%,菌株QF3的生长显著低于KF4和RS18(P<0.05),表明菌株的生长受到了高盐含量的抑制,推测其抗菌活性可能也会受到影响。因此,采用牛津杯法进一步评估了在不同盐浓度的MRS肉汤培养基中生长24 h的3株菌的抗真菌活性(图2Ⅱ)。然而,与推测相反的是,在不同盐浓度的MRS肉汤培养基中培养的QF3、KF4和RS18依然显示出对A. niger A-8菌丝生长的明显抑制作用。上述结果共同表明,高盐浓度虽然在一定程度上影响3株菌的生长但并不影响其抗菌活性。该研究结果与前人研究结果一致。Prabawati等[35]发现奶酪中的盐含量虽然会影响植物乳杆菌的生长,但不会影响其对腐败霉菌Penicillium commune的抗真菌活性。在本研究中,3株菌在NaCl含量为8%时,依然具有良好的抗菌活性,可能是由于菌株在培养基中积累的抗真菌代谢物达到了抑制A. niger A-8最小抑菌浓度。考虑到盘县火腿的实际腌制过程,腌制时的食盐添加量虽为鲜猪腿质量的6%~8%,但是火腿在腌制结束后要经过浸泡和清洗以去除表面杂质和脏污,这个过程同时降低了火腿表面的盐含量。因此,盘县火腿在实际发酵过程中的NaCl含量低于8%,通常为2.27~7.06 g/100 g[36]。因此,3株菌表现出耐受盘县火腿的高盐浓度环境并发挥抗菌效应的潜能。
2.3 菌株对A. niger A-8产OTA的影响
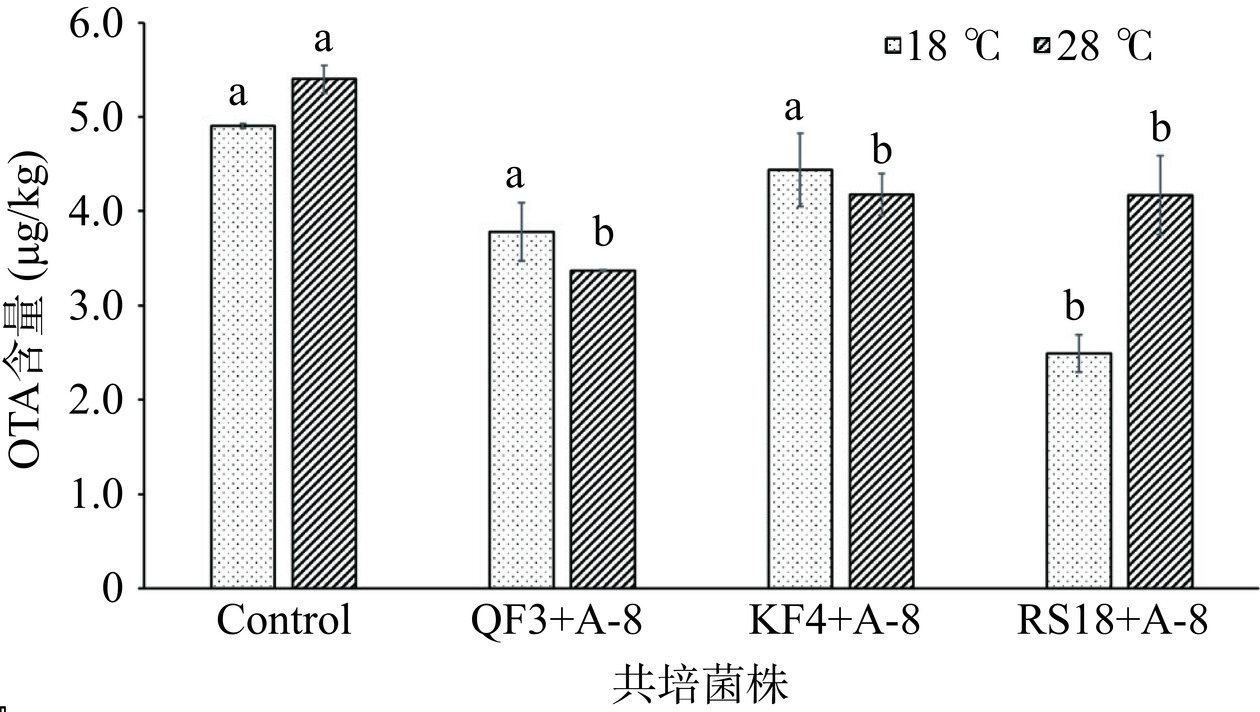
虽然火腿表面微生物对风味和香气的形成至关重要,但火腿表面霉菌产生的OTA污染是造成火腿食品安全的重要风险因子。本研究中的菌株QF3、KF4和RS18在OTA产毒模式培养基上虽表现出抑制效应,但是否在火腿培养基上依然表现良好是未知的,因为产毒模式培养基中高碳水化合物的组成对产毒和抑制均有促进效果。因此,本部分通过将3株菌与A. niger A-8在火腿培养基中共培养从而研究其对OTA生物合成的影响。此外,共培养温度参照盘县火腿发酵期的平均温度(18 ℃)和A. niger A-8的最适生长温度(28 ℃)而设定。如图3所示,在两种共培养温度条件下,3株菌都能抑制A. niger A-8产生OTA。在18 ℃培养条件下,菌株QF3、KF4和RS18对A. niger A-8产生OTA的抑制率分别达到12.83%、9.61%和49.23%。与对照组相比,只有菌株RS18的抑制活性有显著性差异(P<0.05)。在28 ℃时,菌株QF3、KF4和RS18对A. niger A-8产生OTA的抑制率分别达到37.69%、22.63%和22.92%,与对照组相比均有显著性差异(P<0.05)。由以上结果可知,菌株QF3和KF4的抑制效果随着温度升高而增强,温度较低时,微生物生长缓慢,可能影响营养物质的吸收与抗真菌代谢产物的分泌,进而降低其抗真菌活性。菌株RS18能在两个温度条件下都较好的抑制火腿培养基中A. niger A-8合成OTA,并且在火腿发酵条件下抑制产毒能力较佳,有潜力成为干腌火腿发酵过程中防治黑曲霉产OTA的生防菌株。
2.4 菌株的溶血性
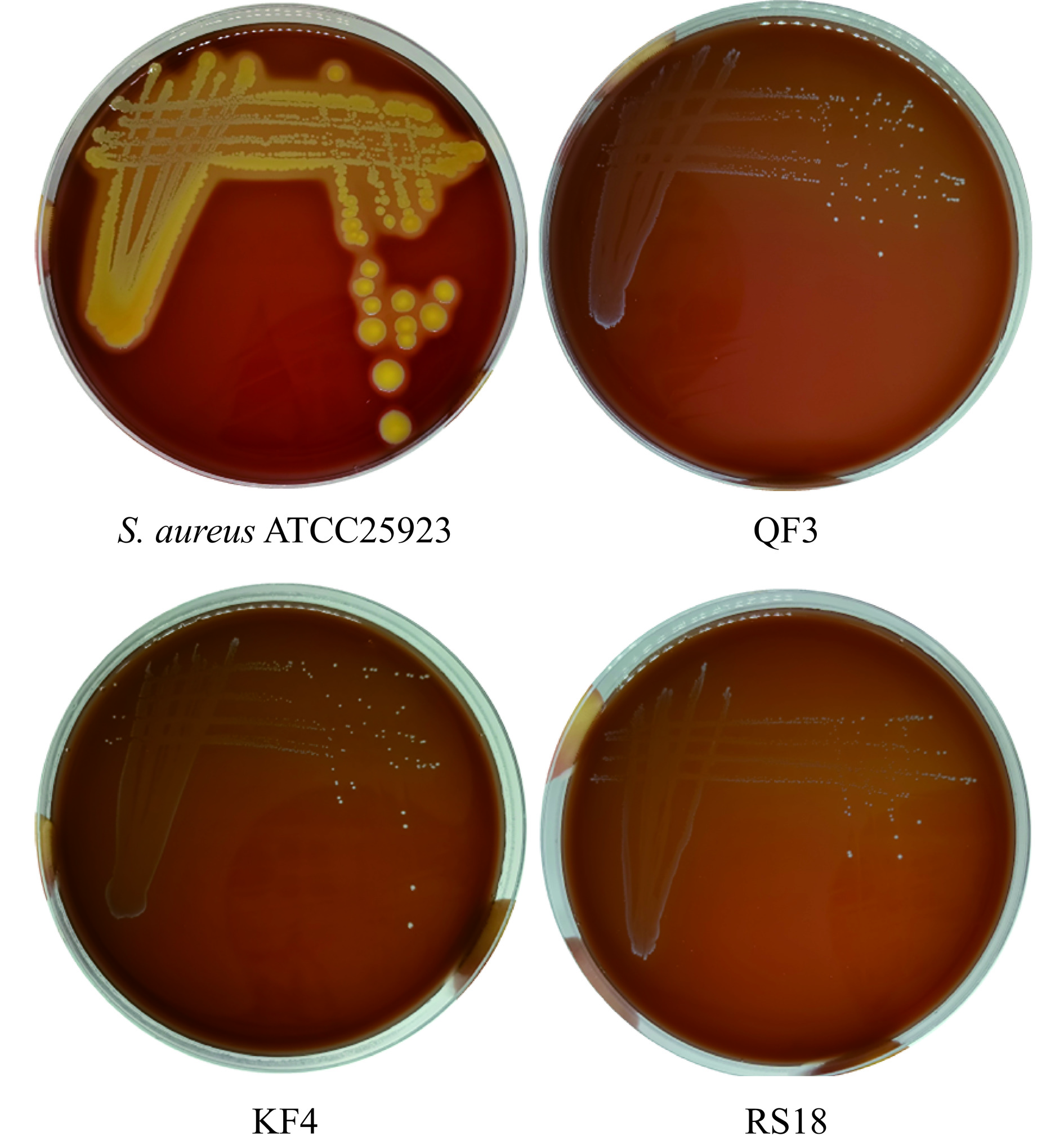
发酵肉制品来源的生防菌,由于对发酵肉的生长适应性较强,且对肉类品质(包括香气和风味特征)的负面影响较小,因此非常适合应用于同类型的肉制品,如发酵香肠和干腌火腿。然而,应用于食品中的菌株需要考虑其自身的安全性。以金黄色葡萄球菌ATCC25923为阳性对照,对3株菌进行溶血试验(图4)。结果表明,阳性对照金黄色葡萄球菌ATCC25923表现出β-溶血性,而菌株QF3、KF4和RS18都呈现γ-溶血(即无溶血性)。无溶血性是益生菌的主要安全标准之一[33]。
2.5 菌株的鉴定
菌株QF3、KF4和RS18对A. niger A-8具有较强抗真菌活性,并且能降低A. niger A-8在火腿培养基中OTA的合成量,因此对3株菌进行了形态学和分子鉴定。菌株的菌落形态、革兰氏染色和微观形态结构见图5。在MRS琼脂培养基中,菌株QF3、KF4和RS18的菌落呈圆形,凸起,略带白色。菌株经革兰氏染色后均呈紫色,表明这些菌株为革兰氏阳性菌。扫描电子显微镜图像显示3株菌株都呈杆状。进一步对3株菌进行16S rDNA测序,并通过NCBI对序列进行比较,使用MEGA11构建了系统发育树(图6)。结果表明,菌株QF3(GenBank登录号:OQ608806)为耐盐魏斯氏菌(Weissella halotolerans),KF4(GenBank登录号:OQ608809)和RS18(GenBank登录号:OQ621423)属于植物乳植杆菌(Lactiplantibacillus plantarum)。
乳酸菌具有超过60个属,食品发酵工业中常用的有乳杆菌属、乳球菌属、肠球菌属、明串球菌属、魏斯氏菌属等,以改善食品的感官特性并延长保质期[13]。植物乳植杆菌可用作发酵奶酪[37]和干腌火腿[38]的发酵剂。此外,植物乳杆菌是多种生物活性成分生产者,例如γ-氨基丁酸、胞外多糖(Exopolysaccharides,EPS)、维生素、叶酸、细菌素、核黄素和有机酸[39]。在抗菌活性方面,Prabawati等[35]发现在切达干酪生产中植物乳杆菌能抑制青霉的生长并延长真菌腐败时间。源于意大利香肠的植物乳植杆菌VLT01对念珠曲霉(Aspergillus candidus)和纳尔吉奥文青霉菌(Penicillium nalgiovense)都有很强的抑制效应[40]。Ramos-Pereira等[17]从牛奶中筛选出的植物乳植杆菌对北欧青霉有很强的抑制作用。魏氏菌早期被归类于副肠系膜明串珠菌属 (Leuconostoc paramesenteroides),1993年才被重新分类并命名为魏斯氏菌属[41]。魏斯氏菌是腌制类发酵食品中微生物的重要组成之一,广泛存在于酱油、发酵豆制品、鱼酱和咸鱼等发酵食品中,其中最具代表性的是融合魏斯氏菌(Weissella confusa)和食窦魏斯氏菌(Weissella cibaria)和类肠膜魏斯氏菌(Weissella paramesenteroides)[42]。Demir等[43]从不同发酵食品来源的耐盐魏斯氏菌中纯化出1种植酸酶,被广泛用作食品和饲料添加剂,以减少动物饲料中的磷污染。Fhoula等[44]从蚂蚁的肠道和沙漠植物中分离得到的3株耐盐魏斯氏菌对大肠杆菌、单核细胞增生李斯特菌、鼠伤寒沙门氏菌、粪肠球菌等致病菌均具有广谱抗菌活性。
2.6 菌株的生长特性研究
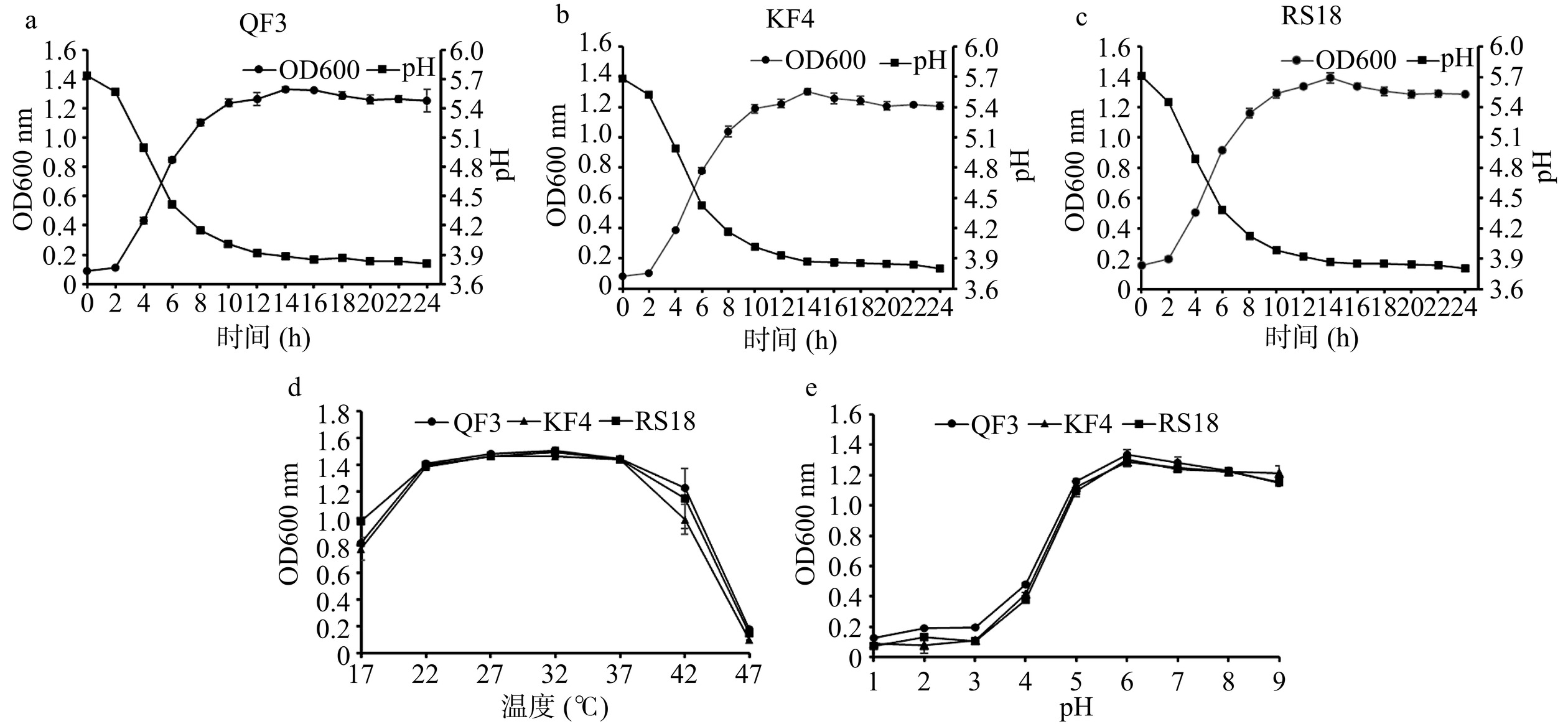
如图7所示,3株乳酸菌表现出相似的生长趋势,在0~2 h,菌株生长缓慢,处于延滞期;2 h后进入指数期,细胞数量迅速增加;14 h后,菌株进入生长稳定期。随着菌株的生长,培养基的pH也发生了变化。培养24 h后,3株乳酸菌的pH约为3.8。能否快速产酸是乳酸菌是否具有良好发酵性能的重要指标。在发酵肉中,乳酸菌产酸能抑制有害微生物生长,帮助其成为优势菌种,缩短发酵周期,提高产品安全性[34]。韩竞旭等[45]从发酵酸肉中筛选出的优质发酵菌种香肠乳杆菌L36培养24 h,pH降至3.81。由于3株菌具有产酸特性,还需考虑其产生的酸类化合物是否影响盘县火腿风味。实际上,乳酸菌是干腌火腿发酵过程中重要的菌株之一,母雨等[46]研究发现,接种木糖葡糖球菌和植物乳杆菌作为发酵剂,火腿中醛、醇、酸、酚类物质的种类和含量均明显提高,而烃类和醚类物质含量显著降低,改善了火腿的风味品质。同时,自然发酵盘县火腿的风味物质中本就存在酸类物质。在自然发酵1年和2年的盘县火腿的风味物质成分分析中,有机酸种类和含量都是最多的风味物质。其中,1年火腿中检测38种风味物质,其中14种为有机酸,有机酸物质百分含量最高,占总风味物质的77.3%。2年火腿检出42种风味物质,其中有机酸类物质有16种,占总风味物质的81.5%[47]。总的来说,接种乳酸菌作为火腿发酵剂,能提高风味物质的含量,然而是否会影响火腿风味,不能只看风味物质含量多少,还需要结合专业感官评定的结果进行判断。
菌株在特定温度或pH范围内的生长能力是乳酸菌的一个重要生理特征。本研究考察了3株菌对一定温度和pH范围的耐受能力。如图7d所示,3株菌在17~42 ℃的较宽温度范围内均表现出良好的生长特性。在17 ℃时,菌株RS18的OD值大于QF3和KF4,表明RS18在低温条件下生长能力更强。图7e显示了pH(1~9)对菌株QF3、KF4和RS18生长的影响。在不同的pH条件下,3株乳酸菌的生长趋势相似,均在pH为6.0时获得最高生长率。总的来说,3株乳酸菌在中性/弱碱性区域(pH5~9)生长良好,而在强酸性区域(pH1~4)生长较弱。在盘县火腿的生产过程中,发酵期内的平均温度为18 ℃,发酵初期火腿表面的pH为6左右[36]。因此,这3株乳酸菌表现出适应盘县火腿的发酵期环境条件的潜能,可以考虑其作为抑制盘县火腿中OTA污染的生防菌。
3. 结论
贵州典型发酵肉制品来源的菌株QF3、KF4和RS18对A. niger A-8具有较强的体外抗真菌活性,能够抑制干腌火腿中OTA产生菌A. niger A-8的生长。高盐环境(8%)虽然部分抑制菌株QF3、KF4和RS18的生长,但并不影响其抗真菌活性。28 ℃时,菌株QF3、KF4和RS18在干腌火腿培养基中能显著抑制A. niger A-8产生OTA。在模拟火腿发酵温度18 ℃时,只有菌株RS18保持抑制A. niger A-8产OTA的能力。此外,菌株QF3、KF4和RS18均不具有溶血性。经形态学观察和分子鉴定,菌株QF3为耐盐魏氏菌(Weissella halotolerans),菌株KF4和RS18属于植物乳植杆菌(Lactiplantibacillus plantarum)。3株乳酸菌在较宽的温度范围(17~42 ℃)和pH(5~9)下都表现出良好的生长特性,表明3株乳酸菌可能适应盘县火腿发酵期的环境条件。综上所述,菌株RS18有潜力成为防控自然发酵盘县火腿中OTA污染的生防菌。本研究为探索干腌火腿中黑曲霉产生的OTA污染的生物防控技术提供重要思路。
-
-
[1] CHEN Y S, CHEN J, ZHU Q J, et al. Ochratoxin A in dry-cured ham:OTA-producing fungi, prevalence, detection methods, and biocontrol strategies-A review[J]. Toxins,2022,14(10):693. doi: 10.3390/toxins14100693
[2] PETROVA I, AASEN I M, RUSTAD T, et al. Manufacture of dry-cured ham:A review. Part 1. Biochemical changes during the technological process[J]. European Food Research and Technology,2015,241(5):587−599. doi: 10.1007/s00217-015-2490-2
[3] 张楠, 杨勇, 孙霞, 等. 肉制品中真菌毒素污染现状与控制研究进展[J]. 食品与发酵工业,2016,42(10):243−249. [ZHANG N, YANG Y, SUN X, et al. Current status of mycotoxin contamination in meat products and progress of research on its control[J]. Food and Fermentation Industry,2016,42(10):243−249.] ZHANG N, YANG Y, SUN X, et al. Current status of mycotoxin contamination in meat products and progress of research on its control[J]. Food and Fermentation Industry, 2016, 42(10): 243−249.
[4] WEI S, HU C J, NIE P, et al. Insights into the underlying mechanism of Ochratoxin A production in Aspergillus niger CBS 513.88 using different carbon sources[J]. Toxins,2022,14(8):551. doi: 10.3390/toxins14080551
[5] World Health Organization, International Agency for Research on Cancer. Some naturally occurring substances:Food items and constituents, heterocyclic aromatic amines and mycotoxins[M]. Lyon, France:IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans, 1993, 56:489.
[6] 郭柯宇, 王松, 唐林, 等. 腌腊肉制品中真菌毒素污染现状及防控研究进展[J]. 食品科学,2021,42(21):315−321. [GUO K Y, WANG S, TANG L, et al. Mycotoxins pollution and prevention measures in dry-cured meats:A review[J]. Food Science,2021,42(21):315−321.] doi: 10.7506/spkx1002-6630-20200721-274 GUO K Y, WANG S, TANG L, et al. Mycotoxins pollution and prevention measures in dry-cured meats: A review[J]. Food Science, 2021, 42(21): 315−321. doi: 10.7506/spkx1002-6630-20200721-274
[7] 张柏林, 张若鸿, 吴风亮, 等. 乳酸菌抗真菌活性及其抑制真菌毒素的效果[J]. 中国乳品工业,2005,33(6):31−37. [ZHANG B L, ZHANG R H, WU F L, et al. Antifungal activity and antimycotoxins from latic acid bacteria[J]. China Dairy Industry,2005,33(6):31−37.] doi: 10.3969/j.issn.1001-2230.2005.06.009 ZHANG B L, ZHANG R H, WU F L, et al. Antifungal activity and antimycotoxins from latic acid bacteria[J]. China Dairy Industry, 2005, 33(6): 31−37. doi: 10.3969/j.issn.1001-2230.2005.06.009
[8] PIETRI A, GUALLA A, RASTELLI S, et al. Enzyme-assisted extraction for the HPLC determination of Ochratoxin A in pork and dry-cured ham[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment,2011,28(12):1717−1723.
[9] WANG L, HUA X, SHI J, et al. Ochratoxin A:Occurrence and recent advances in detoxification[J]. Toxicon,2022,210:11−18. doi: 10.1016/j.toxicon.2022.02.010
[10] NAN M, BI Y, QIANG Y, et al. Electrostatic adsorption and removal mechanism of Ochratoxin A in wine via a positively charged nano-MgO microporous ceramic membrane[J]. Food Chemistry,2022,371:131157. doi: 10.1016/j.foodchem.2021.131157
[11] CASAS-JUNCO P P, SOLÍS-PACHECO J R, RAGAZZO-SÁNCHEZ J A, et al. Cold plasma treatment as an alternative for Ochratoxin A detoxification and inhibition of mycotoxigenic fungi in roasted coffee[J]. Toxins,2019,11(6):337. doi: 10.3390/toxins11060337
[12] JALILI M, JINAP S. Role of sodium hydrosulphite and pressure on the reduction of aflatoxins and Ochratoxin A in black pepper[J]. Food Control,2012,27(1):11−15. doi: 10.1016/j.foodcont.2012.02.022
[13] JALILI M, JINAP S, SON R. The effect of chemical treatment on reduction of aflatoxins and Ochratoxin A in black and white pepper during washing[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment,2011,28(4):485−493.
[14] HIROZAWA M T, ONO M A, SUGUIURA I M D S, et al. Lactic acid bacteria and Bacillus spp. as fungal biological control agents[J]. Journal of Applied Microbiology,2023,134(2):1−13.
[15] BANGAR S P, SHARMA N, KUMAR M, et al. Recent developments in applications of lactic acid bacteria against mycotoxin production and fungal contamination[J]. Food Bioscience,2021,44:101444. doi: 10.1016/j.fbio.2021.101444
[16] LEUSCHNER R G K, ROBINSON T P, HUGAS M, et al. Qualified presumption of safety (QPS):A generic risk assessment approach for biological agents notified to the European Food Safety Authority (EFSA)[J]. Trends In Food Science & Technology,2010,21(9):425−435.
[17] RAMOS-PEREIRA J, MAREZE J, FERNÁNDEZ D, et al. Antifungal activity of lactic acid bacteria isolated from milk against Penicillium commune, P. nordicum, and P. verrucosum[J]. International Journal of Food Microbiology,2021,355:109331. doi: 10.1016/j.ijfoodmicro.2021.109331
[18] BELKACEM-HANFI N, FHOULA I, SEMMAR N, et al. Lactic acid bacteria against post-harvest moulds and ochratoxin A isolated from stored wheat[J]. Biological Control,2014,76:52−59. doi: 10.1016/j.biocontrol.2014.05.001
[19] GHANBARI R, AGHAEE E M, REZAIE S, et al. The inhibitory effect of lactic acid bacteria on aflatoxin production and expression of aflR gene in Aspergillus parasiticus[J]. Journal of Food Safety,2018,38(1):e12413. doi: 10.1111/jfs.12413
[20] ZHU Y L, XU Y Y, YANG Q L. Antifungal properties and AFB1 detoxification activity of a new strain of Lactobacillus plantarum[J]. Journal of Hazardous Materials,2021,414:125569. doi: 10.1016/j.jhazmat.2021.125569
[21] SADIQ F A, YAN B W, TIAN F W, et al. Lactic acid bacteria as antifungal and anti-mycotoxigenic agents:A comprehensive review[J]. Comprehensive Reviews in Food Science and Food Safety,2019,18(5):1403−1436. doi: 10.1111/1541-4337.12481
[22] GUIMARAES A, VENANCIO A, ABRUNHOSA L. Antifungal effect of organic acids from lactic acid bacteria on Penicillium nordicum[J]. Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure & Risk Assessment,2018,35(9):1803−1818.
[23] SANGMANEE P, HONGPATTARAKERE T. Inhibitory of multiple antifungal components produced by Lactobacillus plantarum K35 on growth, aflatoxin production and ultrastructure alterations of Aspergillus flavus and Aspergillus parasiticus[J]. Food Control,2014,40:224−233. doi: 10.1016/j.foodcont.2013.12.005
[24] XU C, FU Y Y, LIU F, et al. Purification and antimicrobial mechanism of a novel bacteriocin produced by Lactobacillus rhamnosus 1.0320[J]. LWT-Food Science and Technology,2021,137:110338. doi: 10.1016/j.lwt.2020.110338
[25] GUIMARÃES A, SANTIAGO A, TEIXEIRA J, et al. Anti-aflatoxigenic effect of organic acids produced by Lactobacillus plantarum[J]. International Journal of Food Microbiology,2018,264:31−38. doi: 10.1016/j.ijfoodmicro.2017.10.025
[26] CEBRIAN E, RODRIGUEZ M, PEROMINGO B, et al. Efficacy of the combined protective cultures of Penicillium chrysogenum and Debaryomyces hansenii for the control of ochratoxin a hazards in dry-cured ham[J]. Toxins,2019,11(12):710. doi: 10.3390/toxins11120710
[27] NAZARETH T D, CALPE J, LUZ C, et al. Manufacture of a potential antifungal ingredient using lactic acid bacteria from dry-cured sausages[J]. Foods,2023,12(7):1427. doi: 10.3390/foods12071427
[28] VIRGILI R, SIMONCINI N, TOSCANI T, et al. Biocontrol of Penicillium nordicum growth and Ochratoxin A production by native yeasts of dry cured ham[J]. Toxins,2012,4(2):68−82. doi: 10.3390/toxins4020068
[29] ÁLVAREZ M, RODRÍGUEZ A, PEROMINGO B, et al. Enterococcus faecium:A promising protective culture to control growth of ochratoxigenic moulds and mycotoxin production in dry-fermented sausages[J]. Mycotoxin Research,2020,36(2):137−145. doi: 10.1007/s12550-019-00376-6
[30] IACUMIN L, ARNOLDI M, COMI G. Effect of a Debaryomyces hansenii and Lactobacillus buchneri starter culture on Aspergillus westerdijkiae ochratoxin A production and growth during the manufacture of short seasoned dry-cured ham[J]. Microorganisms,2020,8(10):1623. doi: 10.3390/microorganisms8101623
[31] MAGNUSSON J, RER J S. Lactobacillus coryniformis subsp. coryniformis strain Si3 produces a broad-spectrum proteinaceous antifungal compound[J]. Applied and Environmental Microbiology,2001,67(1):1−5. doi: 10.1128/AEM.67.1.1-5.2001
[32] YANG J P WANG J, YANG K, et al. Antibacterial activity of selenium-enriched lactic acid bacteria against common food-borne pathogens in vitro[J]. Journal of Dairy Science,2018,101(3):1930−1942. doi: 10.3168/jds.2017-13430
[33] 尹梦雯, 周倩, 雷婵, 等. 产纤溶酶乳酸菌筛选及安全性评估[J]. 食品与机械,2017,33(10):28−33. [YIN M W, ZHOU Q, LEI C, et al. Screening and safety evaluation of lactic acid bacteria producing fibrinolytic enzyme[J]. Food & Machinery,2017,33(10):28−33.] YIN M W, ZHOU Q, LEI C, et al. Screening and safety evaluation of lactic acid bacteria producing fibrinolytic enzyme[J]. Food & Machinery, 2017, 33(10): 28−33.
[34] 周洁, 李洪英, 朱秋劲, 等. 贵式肉品中乳酸菌的选育及其对发酵里脊火腿风味品质的影响[J]. 食品科学,2022,43(8):175−183. [ZHOU J, LI H Y, ZHU Q J, et al. Isolation and characterization of lactic acid bacteria from Guizhou-style meat products and its effect on flavor and quality of fermented loin ham[J]. Food Science,2022,43(8):175−183.] ZHOU J, LI H Y, ZHU Q J, et al. Isolation and characterization of lactic acid bacteria from Guizhou-style meat products and its effect on flavor and quality of fermented loin ham[J]. Food Science, 2022, 43(8): 175−183.
[35] PRABAWATI E K, TURNER M S, BANSAL N. Lactiplantibacillus plantarum as an adjunct culture exhibits antifungal activity in shredded Cheddar cheese[J]. Food Control,2023,144:109330. doi: 10.1016/j.foodcont.2022.109330
[36] 母雨, 苏伟, 母应春. 盘县火腿深度腐败的微生物及挥发性风味化合物表征[J]. 食品科学,2021,42(8):221−228. [MU Y, SU W, MU Y C. Characterization of microbial community and volatile flavor compounds of deep spoiled Panxian dry-cured ham[J]. Food Science,2021,42(8):221−228.] doi: 10.7506/spkx1002-6630-20191111-143 MU Y, SU W, MU Y C. Characterization of microbial community and volatile flavor compounds of deep spoiled Panxian dry-cured ham[J]. Food Science, 2021, 42(8): 221−228. doi: 10.7506/spkx1002-6630-20191111-143
[37] KAMARINOU C S, PAPADOPOULOU O S, DOULGERAKI A I, et al. Mapping the key technological and functional characteristics of indigenous lactic acid bacteria isolated from Greek traditional dairy products[J]. Microorganisms,2022,10(2):246. doi: 10.3390/microorganisms10020246
[38] TIAN Z Q, ZHU Q J, CHEN Y S, et al. Studies on flavor compounds and free amino acid dynamic characteristics of fermented pork loin ham with a complex starter[J]. Foods,2022,11(10):1501. doi: 10.3390/foods11101501
[39] XIONG J, LIU D M, HUANG Y Y. Exopolysaccharides from Lactiplantibacillus plantarum:isolation, purification, structure–function relationship, and application[J]. European Food Research and Technology,2023,249(6):1431−1448. doi: 10.1007/s00217-023-04237-6
[40] COLORETTI F, CARRI S, ARMAFORTE. E et al. Antifungal activity of lactobacilli isolated from salami[J]. FEMS Microbiology Letters,2007,271(2):245−250. doi: 10.1111/j.1574-6968.2007.00723.x
[41] AHMED S, SINGH S, SINGH V, et al. The weissella genus:Clinically treatable bacteria with antimicrobial/probiotic effects on inflammation and cancer[J]. Microorganisms,2022,10(12):2427. doi: 10.3390/microorganisms10122427
[42] 李巧玉, 方芳, 堵国成, 等. 魏斯氏菌在发酵食品中的应用[J]. 食品与发酵工业,2017,43(10):241−247. [LI Q Y, FANG F, DU G C, et al. The application of Weissella strains in fermented food[J]. Food and Fermentation Industries,2017,43(10):241−247.] LI Q Y, FANG F, DU G C, et al. The application of Weissella strains in fermented food[J]. Food and Fermentation Industries, 2017, 43(10): 241−247.
[43] DEMIR Y, KOTAN M Ş, DIKBAŞ N, et al. Phytase from Weissella halotolerans:Purification, partial characterisation and the effect of some metals[J]. International Journal of Food Properties,2017,20(S2):2127−2137.
[44] FHOULA I, BOUMAIZA M, TAYH G, et al. Antimicrobial activity and safety features assessment of Weissella spp. from environmental sources[J]. Food Sci Nutr,2022,10(9):2896−2910. doi: 10.1002/fsn3.2885
[45] 韩竞旭, 邢路娟, 张万刚. 贵州侗族酸肉中优质发酵菌株的筛选及鉴定[J]. 食品与发酵工业,2023,49(10):85−90. [HAN J X, XING L J, ZHANG W G. Screening and identification of high-quality strains in sour meat of the Dong minority[J]. Food and Fermentation Industries,2023,49(10):85−90.] HAN J X, XING L J, ZHANG W G. Screening and identification of high-quality strains in sour meat of the Dong minority[J]. Food and Fermentation Industries, 2023, 49(10): 85−90.
[46] 母雨, 苏伟, 母应春. 直投式发酵剂的优化及其对火腿风味的影响[J]. 现代食品科技,2019,11(35):212−222. [MU Y, SU W, MU Y C. Preparation of direct vat starter and its effect on flavor quality of fermented ham[J]. Modern Food Science and Technology,2019,11(35):212−222.] MU Y, SU W, MU Y C. Preparation of direct vat starter and its effect on flavor quality of fermented ham[J]. Modern Food Science and Technology, 2019, 11(35): 212−222.
[47] 杨树江, 董榕贵. 不同年份盘县火腿风味物质分析[J]. 中南农业科技,2023,44(9):56−58. [YANG S J, DONG R G. Analysis of flavour substances of Panxian ham in different years[J]. South-Central Agricultural Science and Technology,2023,44(9):56−58.] doi: 10.3969/j.issn.1007-273X.2023.09.013 YANG S J, DONG R G. Analysis of flavour substances of Panxian ham in different years[J]. South-Central Agricultural Science and Technology, 2023, 44(9): 56−58. doi: 10.3969/j.issn.1007-273X.2023.09.013





 下载:
下载:
 下载:
下载:



