Effects of Sulfated Modification on the Structural Characterization and Antioxidant Activities of Coconut (Cocos nucifera L.)Haustorium Polysaccharide
-
摘要: 为探讨硫酸化修饰对椰子吸器多糖(Coconut Haustorium Polysaccharide,CHP)结构功能的影响,以椰子吸器为原料,提取多糖后分别用含有不同比例的氯磺酸-吡啶(v/v,mL/mL:1/2、1/3和1/4)的硫酸化试剂制备3种硫酸化椰子吸器多糖(SCHP-2、SCHP-3、SCHP-4),并对其基本化学组成、结构特征和体外抗氧化活性进行对比分析。结果表明,三种硫酸化试剂都能对CHP进行分子修饰(红外光谱中1100~1250 cm−1和820 cm−1附近分别有S=O和C-O-S的特征峰),且氯磺酸/吡啶为1:2时的取代度(Degree of Substitution,DS)最高,达0.75。三种SCHP的总糖、糖醛酸含量和分子量大小较CHP都有所降低,单糖摩尔含量也有所改变,热稳定性略微减弱(多糖降解温度分别由CHP的211.17 ℃和282.01 ℃降低到SCHP的194.86~207.70 ℃和233.35~262.46 ℃)。体外抗氧化实验结果显示,SCHP对DPPH和羟基自由基的清除活性都低于CHP,且DS越大,活性降低程度越明显;而对ABTS+自由基的清除能力和亚铁离子螯合能力而言,增加DS却可以提高其活性,8 mg/mL时,SCHP-2对ABTS+自由基的清除率(54.82%)和亚铁离子的螯合率(15.59%)显著(P<0.05)高于CHP(33.67%和8.86%)。研究结果可为椰子吸器多糖的改性修饰和功能化应用提供支撑。Abstract: To investigate the effect of sulfated modification on the structure and function of coconut haustorium polysaccharide (CHP), three kinds of sulfated coconut haustorium polysaccharides (SCHP-2, SCHP-3, and SCHP-4) were prepared using sulfation reagents containing different ratios of chlorosulfonic acid and pyridine (v/v, mL/mL: 1/2, 1/3, and 1/4) after extracting CHP from the raw materials of coconut haustorium, and their basic chemical compositions, structural characteristics and antioxidant activity in vitro were compared and analyzed. Results showed that all three sulfation reagents were able to modify CHP (characteristic peaks of S=O and C-O-S were observed near 1100~1250 cm−1 and 820 cm−1 in infrared spectra, respectively), and the degree of substitution (DS) was the highest (0.75) at the ratio of chlorosulfonic acid and pyridine for 1/2. The total sugar, uronic acid content, and molecular weight of the three SCHP decreased, and the molar content of monosaccharides also changed when comparing with that of CHP. The thermal stability had slightly weakened as well (the degradation temperature of polysaccharides decreased from 211.17 ℃ and 282.01 ℃ of CHP to 194.86~207.70 ℃ and 233.35~262.46 ℃ of SCHP, respectively). The results of antioxidant experiments in vitro showed that the scavenging activity of SCHP on DPPH and hydroxyl radicals was lower than that of CHP, and the larger the DS was, the more obvious the decrease in activity was. In terms of the ABTS+ radicals scavenging ability and ferrous ions chelating activity, increasing DS could enhance the activity of SCHP. At 8 mg/mL, the ABTS+ radicals scavenging rate (54.82%) and ferrous ions chelating rate (15.59%) of SCHP-2 were significantly (P<0.05) higher than CHP (33.67% and 8.86%). These results would provide the support for the modification and functional application of coconut haustorium polysaccharides.
-
椰子(Cocos nucifera L.)萌发过程中会形成一种海绵状吸收器官——吸器,它能够分泌高活性的脂肪酶、纤维素酶和蛋白酶等,从胚乳中吸收营养,为胚芽的萌发提供营养物质[1−3]。目前,国内外对椰子吸器的研究还比较少,主要集中在萌发过程中吸器的微观结构、形态特征和基本成分变化等方面。如Yukio[4]和陈良秋等[5]发现椰子萌发过程中,吸器的表皮组织会形成与降解椰肉紧密相连的波状结构,积累较多的蔗糖和淀粉并形成淀粉粒和油滴。李静等[6]研究发现随着高种椰子萌发时间的延长,吸器中多酚和可溶性蛋白的含量分别由410.00 μg/g和0.34 g/L降低到185.29 μg/g和0.12 g/L。Arivalagan等[7]证实用椰子吸器粉末部分替代大米和玉米粉可提高膨化食品的营养品质和抗氧化活性。另外,吸器富含糖类、蛋白、矿物质等营养成分,尤其是可溶性糖含量高达44.2%[8],是制备植物多糖的潜在原料。课题组前期发现,椰子吸器粗多糖是一种以葡萄糖为主的酸性杂多糖,6 mg/mL时对DPPH自由基和羟自由基的清除率分别为82.49%和85.83%,同时具有一定的α-葡萄糖苷酶抑制能力(100 mg/mL时的抑制率为69.91%),但其活性仍然显著弱于抗坏血酸(VC)和阿卡波糖,同时存在易潮解、热稳定性差等缺点[9],有必要进行分子修饰以提高其开发利用价值。
当前,植物多糖的分子修饰方法主要包含超声波和离子辐射等物理改性和硫酸化、磷酸化、羧甲基化等化学改性两大类[10]。其中,硫酸化修饰是将硫酸化试剂中的硫酸根离子接枝到多糖链的某些羟基上的一种化学修饰方法,应用最为广泛[11]。如Cao等[12]发现,与山慈姑(Amana edulis)多糖相比,硫酸化修饰后的多糖对DPPH自由基、ABTS+自由基的清除率和还原力均有很大程度地改善,而总糖和蛋白质含量,以及对羟基自由基的清除能力和Fe2+螯合能力却有所降低。Li等[13]证实硫酸化修饰可提高绿菇(Russula virescens)多糖的水解性以及体外抗氧化、抑菌、抗凝血和抗肿瘤作用,但也会导致多糖和蛋白质含量降低,并且在取代度(DS)超过0.34时,多糖的三股螺旋结构也会降解为线性。另外,硫酸化修饰还可改善小球藻(Chlorella sp.22)多糖的体外抗氧化和抗肿瘤活性,修饰多糖对DPPH自由基和宫颈癌细胞增殖的半数清除/抑制浓度(IC50)分别由原来的29.28 mg/mL和960.16 μg/mL降低至14.49 mg/mL和658.19 μg/mL[14]。Zhang等[15]也指出硫酸化修饰可以提高植物乳杆菌胞外多糖的体外自由基清除活性,并有效降低蜡状芽孢杆菌肠毒素诱导的Caco-2细胞损伤。而关于椰子多糖分子修饰的研究鲜有报道,硫酸化修饰对吸器多糖的构效关系变化尚不清楚。
因此,本研究拟以前期制备的椰子吸器多糖(CHP)为原料,利用氯磺酸-吡啶法制备不同取代度的硫酸化椰子吸器多糖(SCHP),并借助红外光谱、热重分析和离子色谱等技术评价硫酸化修饰对多糖化学组成(多糖、蛋白质、糖醛酸等),分子量大小、单糖组成、热稳定性等结构特征以及体外抗氧化活性的影响,评估硫酸化修饰改善CHP理化功能性质的潜力,为拓宽其适用范围,提高椰子吸器的附加值提供依据。
1. 材料与方法
1.1 材料与仪器
椰子吸器 由文昌市东郊镇椰子加工厂提供;岩藻糖、鼠李糖、葡萄糖、半乳糖醛酸等单糖标准品 均为色谱级,纯度>98%,购自美国Sigma公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-氮化氮(3-乙基苯并噻唑啉-6-磺酸)(ABTS)、牛血清白蛋白、N,N-二甲基甲酰胺、氯仿、正丁醇、AB-8大孔树脂、氯磺酸、吡啶等 均为分析纯,购于上海泰坦科技有限公司。
UV-1600紫外可见分光光度计 上海翱艺仪器有限公司;DAWN HELEOS-II 18角度激光光散射仪 美国怀雅特公司;Nicolet67傅里叶红外光谱仪 美国赛默飞世尔公司;ICS-3000离子色谱仪 美国戴安公司;TGA 8000热重分析仪 上海珀金埃尔默企业管理有限公司。
1.2 实验方法
1.2.1 多糖样品的制备
1.2.1.1 椰子吸器粗多糖(CHP)制备
将新鲜椰子吸器用蒸馏水洗涤后,于50 ℃鼓风干燥48 h,粉碎过60目筛,得到吸器粉末。取吸器粉末与3倍体积的95%乙醇(m/v,g/mL)在70 ℃回流脱脂8 h,将脱脂粉末于50 ℃干燥至恒重。然后按照1:20料液比(m/m,g/g)将脱脂粉末与去离子水混合后于90 ℃提取2 h,4000 r/min离心20 min,收集上清液,取残渣重复提取两次后合并上清液,在55 ℃下减压浓缩至原体积的1/4,取浓缩液用Savage试剂脱蛋白后,重复多次直到无肉眼可见的蛋白质为止;将提取液于55 ℃减压蒸发去除残留Savage试剂,以15:1的质量比与AB-8大孔树脂(m/m,g/g)混合,于4 ℃振荡脱色12 h;滤除树脂并加入4倍体积的无水乙醇,4 ℃沉淀24 h,4000 r/min离心20 min收集沉淀,冷冻干燥后得到吸器多糖(CHP)[16]。
1.2.1.2 硫酸化椰子吸器多糖(SCHP)的制备
首先,按照1:2、1:3和1:4的比例(v/v,mL/mL)将氯磺酸在冰浴条件下缓慢加入到吡啶溶液中,并在室温下搅拌30 min,得到不同类型的硫酸化试剂。然后,将150 mg的CHP与30 mL的无水N,N-二甲基甲酰胺混匀,室温下超声波振荡30 min,再分别加入17.5 mL上述三种硫酸化试剂,70 ℃搅拌2 h后,冷却至室温,加入100 mL冰水,并用1 mol/L的 NaOH溶液调节pH至7.0;用3500 Da透析袋透析48 h后,减压浓缩后冷冻干燥,得到三种SCHP[17]。按照硫酸化试剂中氯磺酸和吡啶比例(1:2、1:3和1:4),将上述三种硫酸化吸器多糖分别命名为SCHP-2、SCHP-3和SCHP-4。
1.2.2 化学成分分析
分别采用苯酚-硫酸法、咔唑-硫酸法和考马斯亮蓝法测定CHP和SCHP的多糖、糖醛酸和蛋白质含量[18];采用BaCl2-明胶法[16]测定取代度(DS),并按式(1)~式(3)计算:
w(SO−24)=C×V/W×100 (1) w(S)=32×w(SO−24)/96 (2) DS=1.62×w(S)32−1.02×w(S) (3) 式中:C为样品测定质量浓度,μg/mL;V为样品溶液体积,mL;W为称量样品质量,mg;w(SO4-2)为硫酸根含量,%;w(S)为硫元素含量,%。
1.2.3 基本结构表征
1.2.3.1 分子量测定
配制1 mg/mL的样品溶液,过0.22 μm滤膜,用DAWN HELEOS-II 18角度激光光散射仪与高效凝胶渗透排阻色谱(HPSEC)对多糖的分子量及其分布进行测定。色谱条件为:流动相为0.1 mol/L氯化钠水溶液,流速为0.5 mL/min,上样量为200 μL,柱温25 ℃。
1.2.3.2 单糖组成的测定
取样品10 mg于水解管中,加入4 mol/L的三氟乙酸4.0 mL,充氮气1 min排出管内空气,旋紧螺旋盖,于120 ℃水解2 h,待冷却后氮气吹干水解液,除去过量的三氟乙酸,加超纯水定容至10 mL。稀释20倍,并用0.2 μm滤膜过滤后,取滤液20 μL用配备Dionex CarbopacTM PA20(3 mm×150 mm)色谱柱和电化学检测器的ICS-3000离子色谱仪测定样品的单糖组成。色谱条件如下:流动相A为水,B为250.0 mmol/L的氢氧化钠,C为1.0 mol/L的乙酸钠;流速0.5 mL/min;进样体积10 μL;柱温:35 ℃;洗脱条件为0~20 min,94% A和6% B;20~20.1 min,89% A、6% B和5% C;20.1~35 min,74% A、6% B和20% C;35.1~45 min,20% A和80% B;45.1~55min,94% A和6% B。
1.2.3.3 红外光谱测定
将样品粉末与KBr按照1:100质量比(m/m,g/g)混匀,压成薄片,用Nicolet67傅里叶红外光谱仪测定样品的红外光谱,波数范围为4000~400 cm−1。
1.2.3.4 热力学性质测定
利用TGA 8000热重分析仪测定样品的热稳定性。测试条件为:载气N2,流速50 mL/min;温度范围25~495℃;升温速率10 ℃/min。
1.2.4 体外抗氧化活性测定
1.2.4.1 DPPH自由基清除能力
参照张玉锋等[9]的方法并稍作修改,将0.2 mL的多糖水溶液(0.5、1.0、1.5、2.0、4.0 mg/mL)与0.2 mL的DPPH乙醇溶液(0.2 mmol/L)混匀后,于37 ℃避光反应30 min,取反应液在517 nm处测吸光度。DPPH自由基清除率按下式计算:
DPPH自由基清除率(%)=(1−A1−A2A3−A0)×100 (4) 式中,A0、A1、A2和A3分别表示蒸馏水和无水乙醇混合的空白组、样品组、无水乙醇替代DPPH溶液的样品空白组和蒸馏水替代样品的对照组的吸光值。
1.2.4.2 ABTS+自由基清除能力
参照曹长靓等[16]的方法并稍作修改,将1.0 mL多糖水溶液(1、2、4、6、8和10 mg/mL)与4.0 mL ABTS工作液(7 mmol/L)充分混匀,30 ℃水浴反应10 min后于734 nm处测吸光值。羟基自由基清除率按下式计算:
ABTS+自由基清除率(%)=A0−A1+A2A0×100 (6) 式中,A0、A1和A2分别表示ABTS工作液、样品组和用蒸馏水替代ABTS工作液的样品空白组的吸光值。
1.2.4.3 羟基自由基清除能力
参照曹长靓[16]的方法并稍作修改,将0.2 mL多糖水溶液(1.0、2.0、4.0、8.0、10.0和20.0 mg/mL)、0.2 mL的FeSO4水溶液(6 mmol/L)、0.2 mL的水杨酸乙醇溶液(6 mmol/L)和0.2 mL的H2O2水溶液(6 mmol/L)混合后,室温静置反应1 h后,于510 nm处测定吸光度。羟基自由基清除率按下式计算:
羟基自由基清除率(%)=(1−A1−A2A3−A0)×100 (5) 式中,A0、A1、A2和A3分别表示用蒸馏水和无水乙醇混合的空白组、样品组、以蒸馏水替代H2O2溶液的样品空白组和以蒸馏水替代样品的对照组的吸光值。
1.2.4.4 亚铁离子螯合能力测定
参照Yan等[19]的方法并稍作修改,取1.0 mL多糖水溶液(0.5、1.0、2.0、4.0、8.0和10 mg/mL)与1.0 mL 的FeSO4水溶液(0.1 mmol/L)、1.0 mL的菲啰嗪水溶液(0.2 mmol/L)充分混匀,室温静置10 min后于562 nm处测吸光值。亚铁离子螯合率按下式计算:
亚铁离子螯合率(%)=(1−A1−A2A3−A0)×100 (7) 式中,A0、A1、A2和A3分别代表用蒸馏水替代样品和试剂的空白组、样品组、用蒸馏水替代试剂的样品空白组和以蒸馏水替代样品的对照组的吸光值。
1.3 数据处理
每组实验至少有三次平行,结果以平均值±标准偏差表示,用Office 2010和Origin 2021软件进行数据分析和图表制作,SPSS 25.0软件进行单因素方差分析(ANOVA)和Duncan 检验比较各组间的差异,显著性水平设为(P<0.05)。
2. 结果与分析
2.1 硫酸化修饰对椰子吸器多糖化学成分的影响
硫酸酯化剂的种类和用量是影响多糖硫酸化产物及其取代度(DS)的关键因素[20]。利用氯磺酸与吡啶比例分别为1:2、1:3和1:4的硫酸化试剂制备了SCHP-2、SCHP-3和SCHP-4三种硫酸化椰子吸器多糖(SCHP),其基本化学成分如表1所示。可以看出,随着硫酸化试剂中氯磺酸占比的增加,多糖的DS从SCHP-4的0.61增加到SCHP-2的0.75,说明提高硫酸化试剂中氯磺酸的比例可提高CHP的硫酸化程度。然而,三种SCHP的总糖和糖醛酸含量均较CHP有明显降低(P<0.05),且DS越大,降低程度越明显著,这与Li等[13]、Cao等[12]和Xiao等[17]报道的研究结果相一致,如随着取代度由0.19增加到1.19,硫酸化马尾藻多糖的总糖含量会从60.41%降低到33.35%[20]。类似的研究结果显示:硫酸化修饰会使兰花(Orchis chusua D. Don)多糖的糖醛酸含量从19.36%降低至13.89%[11]。而对蛋白质而言,硫酸化修饰后,三种SCHP的蛋白质含量均高于CHP(P<0.05),这可能是硫酸化修饰引入的硫酸根集团提高了多糖中蛋白质的相对含量的缘故,这与Nuerxiati等[21]的研究结果相吻合。另外,SCHP-2的蛋白质含量与SCHP-3之间并无显著性差异(P>0.05)。
表 1 椰子吸器多糖及其硫酸化多糖的化学成分Table 1. Chemical composition of CHP and SCHP成分 CHP SCHP-2 SCHP-3 SCHP-4 总糖(%) 56.87±2.35a 21.88±1.24c 23.19±1.37c 32.9±1.19b 糖醛酸(%) 23.64±1.57a 4.29±0.63c 4.42±0.15c 5.27±0.37b 蛋白质(%) 0.38±0.08c 1.23±0.08a 1.18±0.05a 0.55±0.05b DS / 0.75±0.02a 0.64±0.03b 0.61±0.01b 注:同一行中不同字母表示差异显著(P<0.05)。 2.2 硫酸化修饰对椰子吸器多糖结构特征的影响
2.2.1 分子量分析
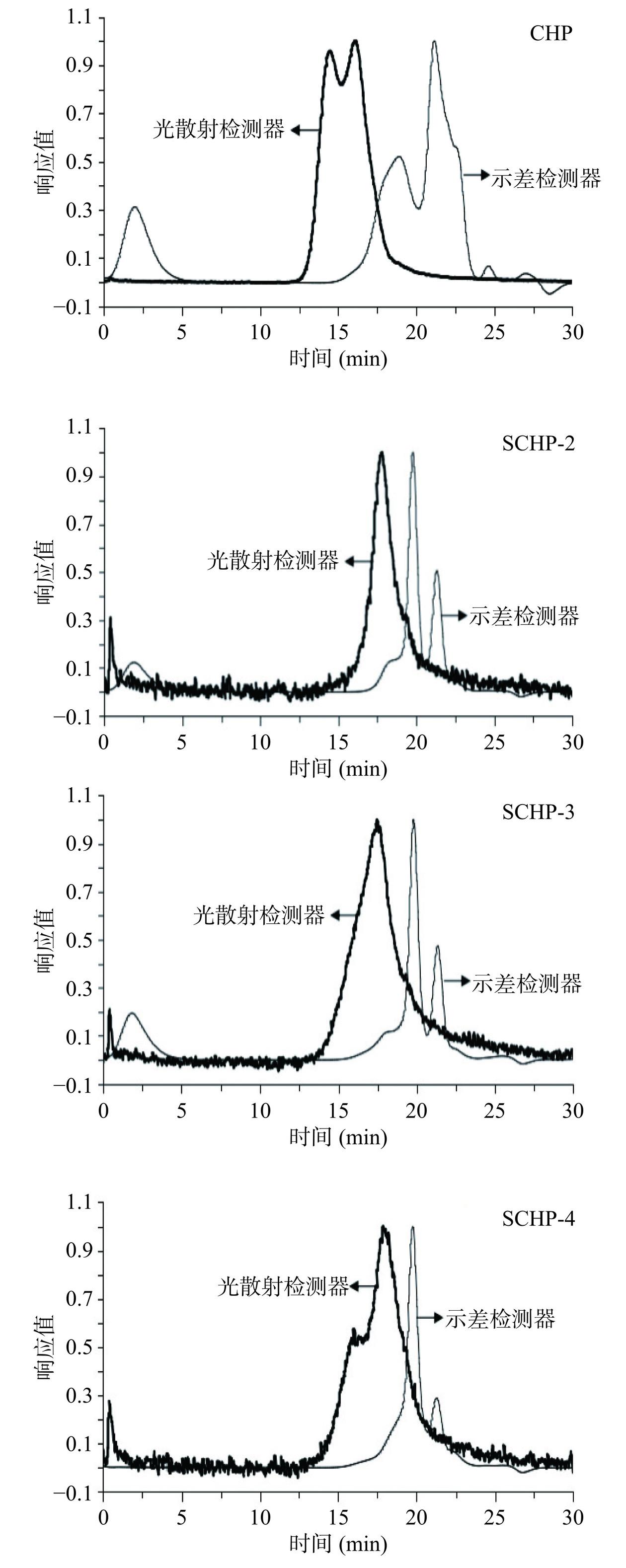
CHP和SCHP的分子量及其分布的测试结果显示,在光散射检测器(LS)中,CHP由2个“等高”峰组成,而经硫酸化修饰后的SCHP-2和SCHP-3仅表现出1个单峰,SCHP-4呈现“一低一高”的两个峰;在示差检测器(dRI)中,4种多糖虽然都出现了2个峰,但峰高发生了明显变化:CHP呈“先低后高”状,SCHP表现为“先高后低”形态(图1)。通常来讲,HPSEC中聚合物组分的出峰顺序为先高后低,出峰时间越晚,分子量越小[9]。由图1和表2可知,3种SCHP在LS中的出峰时间明显晚于CHP,尤其是SCHP-2的出峰时间延后至13.43 min,结合dRI中峰组分的高度和面积变化,都说明硫酸化修饰会降低CHP的分子量大小。
表 2 椰子吸器多糖及其硫酸化多糖的分子参数与单糖组成Table 2. Molecular parameter and monosaccharide composition of CHP and SCHP名称 CHP SCHP-2 SCHP-3 SCHP-4 分子参数 出峰时间
(min)12.13~22.48 13.43~23.31 12.87~23.61 12.88~23.62 Mn(g/mol) 5185 529.10 1148 1173 Mp(g/mol) 2520 366.6 662.5 661.7 Mw(g/mol) 59250 1967 5187 4358 Mw/Mn 11.43 3.72 4.52 3.72 单糖组成
(mol%)Fuc 0.13±0.05c 0.40±0.38a 0.18±0.002b 0.12±0.003d Rha 0.92±0.01a 0.67±0.07c 0.68±0.35c 0.82±0.001b Ara 4.41±0.05a 1.05±0.76b 4.09±0.36a 4.19±0.13a Gal 7.55±0.05ab 7.77±0.09a 7.17±0.15b 7.58±0.07ab Glu 83.54±0.29a 84.19±2.06a 83.53±0.19a 82.85±0.05a Xyl 0.94±0.15c 3.03±1.17a 1.82±0.11b 1.71±0.03b GalA 2.41±0.11c 3.10±0.16a 2.52±0.08c 2.68±0.18b GlcA 0.24±0.04a 0.18±0.05b 0.19±0.003b 0.18±0.01b 注:Mw:重均分子量;Mn:数均分子量;Mp:峰均分子量;Mw/Mn为多分散性指数;Fuc、Rha、Ara、Gal、Glu、Xyl、GalA和GlcA分别代表岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、果糖、半乳糖醛酸和葡萄糖醛酸;同一行中不同字母表示差异显著(P<0.05)。 进一步利用ASTRA5.3.4软件计算CHP和SCHP的分子参数,结果如表2所示。CHP、SCHP-2、SCHP-3和SCHP-4的MW分别为59250、1967、5187和4358 g/moL,也即硫酸化程度最高(DS最大)的SCHP-2表现出最小的分子量,与Li等[13]的研究结果一致,DS由0.34增加到0.7时,硫酸化绿菇(Russula virescens)多糖的分子量会从3.8×105 Da降低到2.5×105 Da,这可能是较高的氯磺酸含量更有利于多糖降解的原因。多分散性指数(Mw/Mn)是衡量多糖分子量分布的重要参数,其值越接近于1,则分子量分布越窄[9]。由表2可知,CHP的分子量分布最为分散(Mw/Mn为11.43),SCHP的Mw/Mn值较CHP有明显降低(3.72~4.52),但也远大于1,提示其分子量分布仍较为分散。
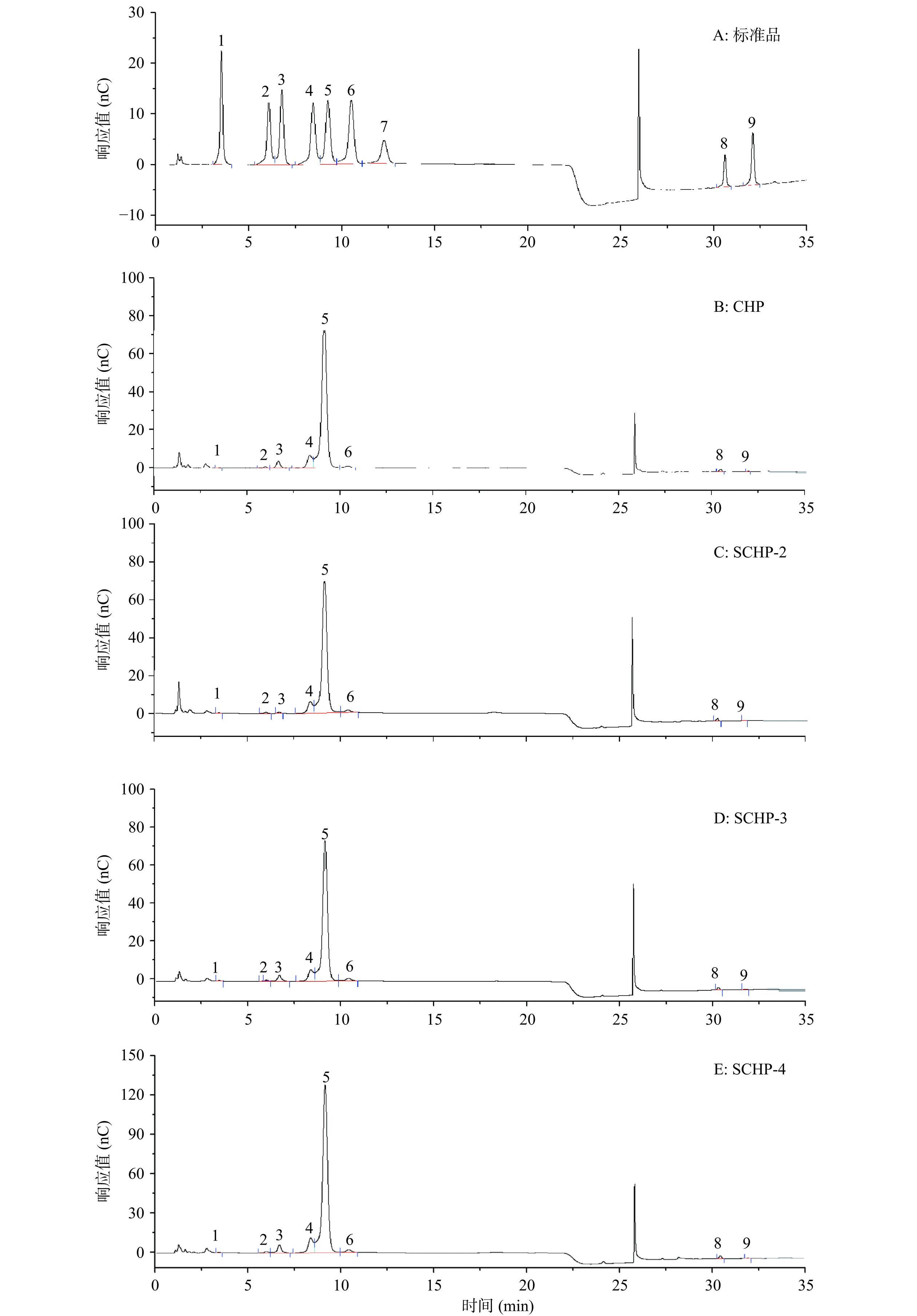
2.2.2 单糖组成分析
利用离子色谱仪对CHP和SCHP进行单糖组成测定,结果如图2和表2所示。可以看出:4种多糖都由岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、半乳糖醛酸和葡萄糖醛酸8种单糖组成,其中葡萄糖的摩尔百分含量均在80%以上,提示CHP和SCHP均是以葡萄糖为主的杂多糖。SCHP-2、SCHP-3、SCHP-4的木糖和半乳糖醛酸含量较CHP呈增加趋势,而鼠李糖和葡萄糖醛酸则表现出一定程度的降低,其他单糖的变化未呈规律性。这与Li等[13]和巩晓佩等[21]报道的硫酸化修饰会影响绿菇、红枣多糖的单糖含量,但不会改变其单糖种类的研究结果相一致。
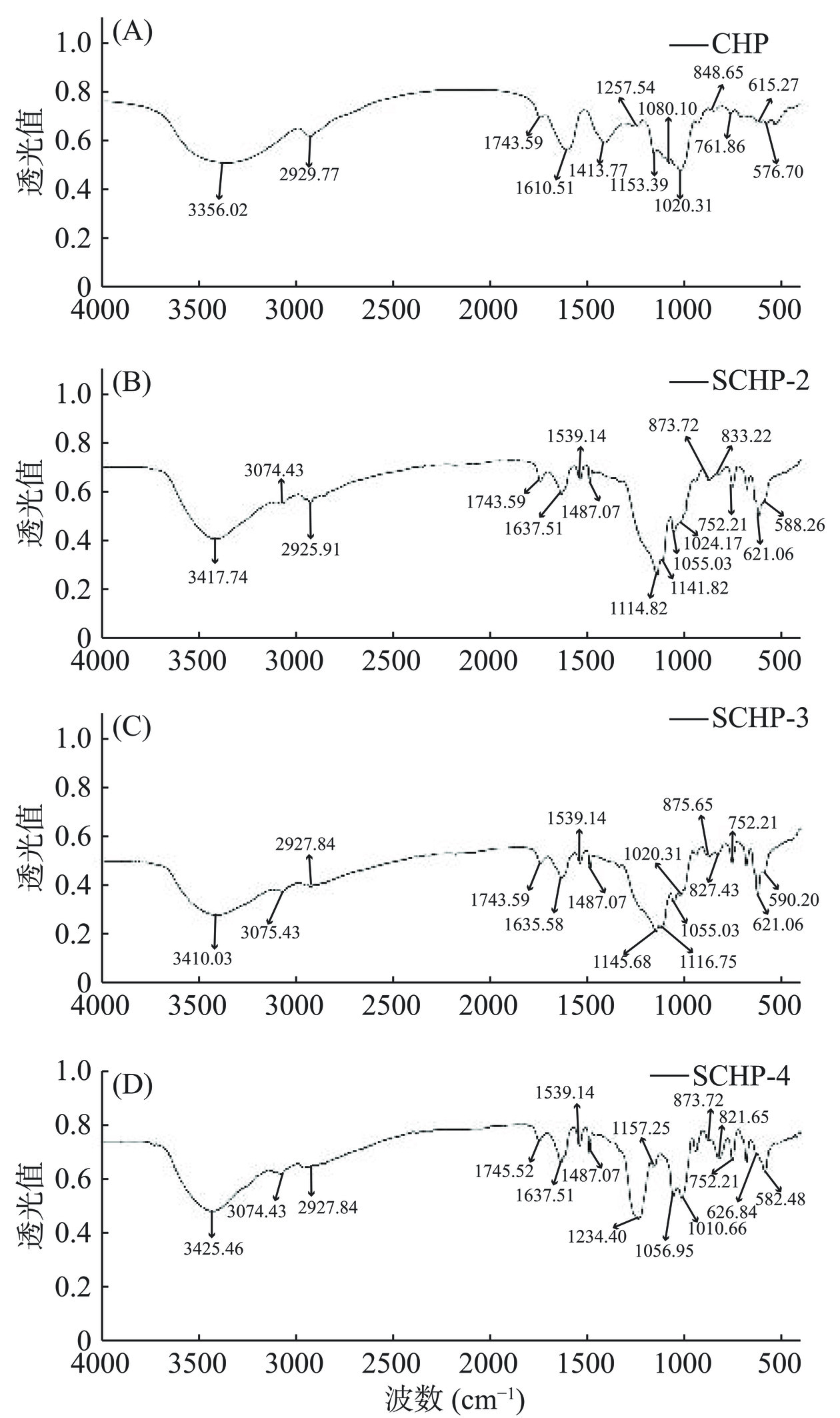
2.2.3 红外光谱分析
红外光谱(IR)是多糖结构分析的重要工具,能提示其官能团和构型构象等结构特征。CHP和SCHP的红外光谱如图3所示,4种多糖红外光谱的主体轮廓相似,但在部分区域内仍有差异,提示硫酸化修饰部分改变了多糖的结构。尤其是1100~1250 cm−1和800~850 cm−1内吸收峰的明显变化均提示多糖中存在有硫酸基团,即1140 cm−1和1230 cm−1附近的强吸收为S=O的不对称伸缩振动,820 cm−1和830 cm−1附近的弱吸收代表C-O-S的拉伸振动[22]。另外,845、830和810 cm−1处的吸收峰分别代表硫酸基团取代了多糖中半乳糖单元的C-3、C-2和C-6位置[10,13−14],也即SCHP的硫酸基取代位基本位于C-2上,这与孙寒等[14]的研究结果类似。在3300~3500 cm−1和2925 cm−1附近的吸收峰分别是-OH和C-H的伸缩缩振[12,14,23],是多糖的特征基团吸收峰,且SCHP在3420 cm−1附近透光值的降低代表氯磺酸中的硫酸基成功取代了CHP中的羟基,提示硫酸化修饰成功[21]。1743、1635 cm−1和1487 cm−1附近的吸收峰分别为羰基和酰胺基中C=O的伸缩振动和去质子化羰基,提示多糖中存在糖醛酸和蛋白质[21,23−24],这均与表1中的结果相吻合。1050 cm−1和1020 cm−1处吸收峰多由醚键C-O-C振动产生,830~850 cm−1和750~760 cm−1处为α型糖苷键的特征吸收,两者揭示CHP和SCHP均是以α-吡喃糖为主的多糖[14,18,24]。
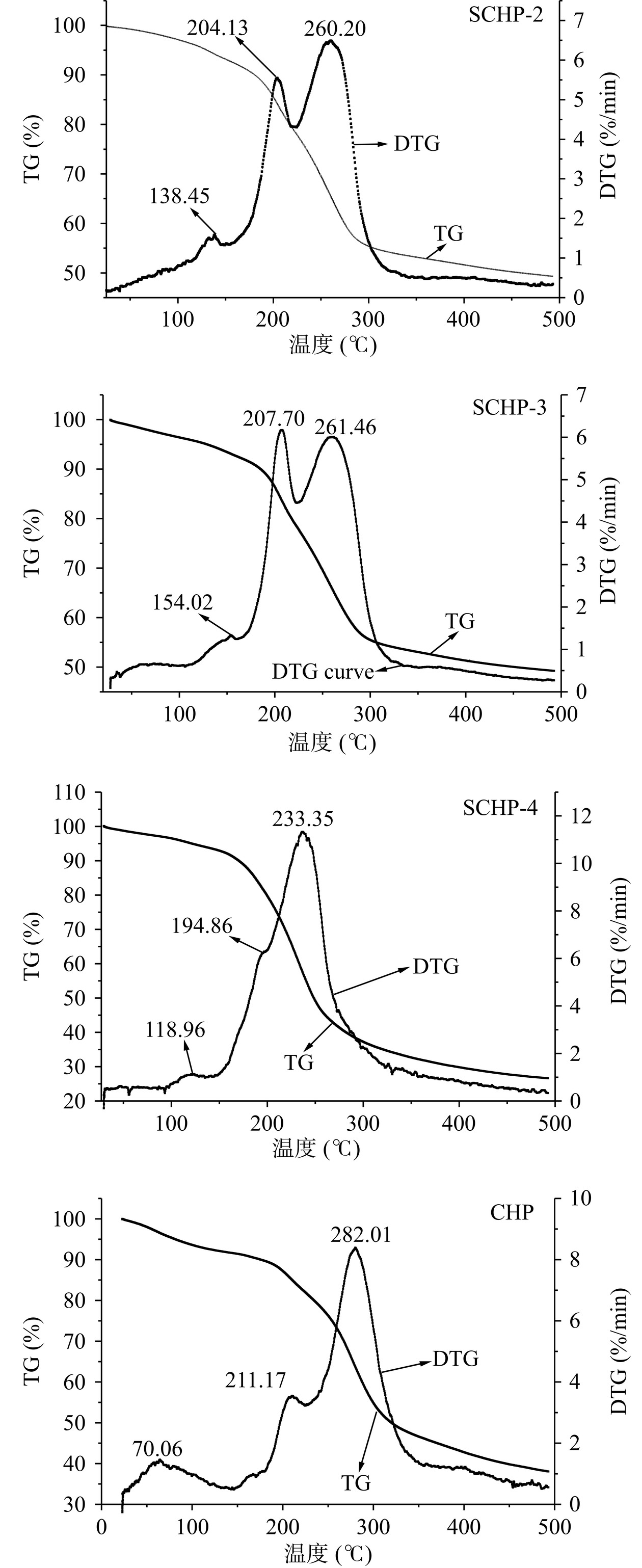
2.2.4 热力学特征分析
热重分析仪(TGA)是评价聚合物热稳定性和降解行为的一种简单而有效的工具,其热重(TG)和热重微分(DTG)曲线分别代表聚合物的质量和质量变化速率随时间和温度的变化趋势[18]。由图4可知,CHP和SCHP的TG曲线基本类似,根据失重速率都可以分为3个阶段:第一阶段代表多糖中水分的蒸发(CHP和SCHP质量损失分别为9.03%和5.9%~7.35%);第二阶段指示多糖的降解(CHP和SCHP的质量损失分别为43.37%和38.37%~59.15%);第三阶段通常为多糖解聚片段的进一步断裂(CHP和SCHP的质量损失分别为9.01%和4.64%~8.47%)[25−26]。4种多糖在DTG曲线的第二阶段出现的2个峰说明它们都含有两个组分,这与分子量测定中dRI图谱的结果相吻合,且小分子多糖组分2的耐热性更佳。
然而,四种多糖在DTG曲线中3个阶段的峰值温度却有明显不同:CHP依次为70.06 ℃、211.17和282.01 ℃、381.29 ℃;SCHP则为118.96~150.04 ℃、194.86~207.70 ℃和233.35~261.46 ℃、386.29~393.59 ℃,说明硫酸化修饰能有效阻止SCHP分子内水分蒸发,但会加快糖苷键的热分解,这可能是因为硫酸基团取代多糖的羟基后,会引起水分子间的氢键变少,同时诱发C-O电子云向硫酸基团转移并降低其键合力,从而导致SCHP的热分解温度有所降低[27]。
2.3 硫酸化修饰对椰子吸器多糖体外抗氧化活性的影响
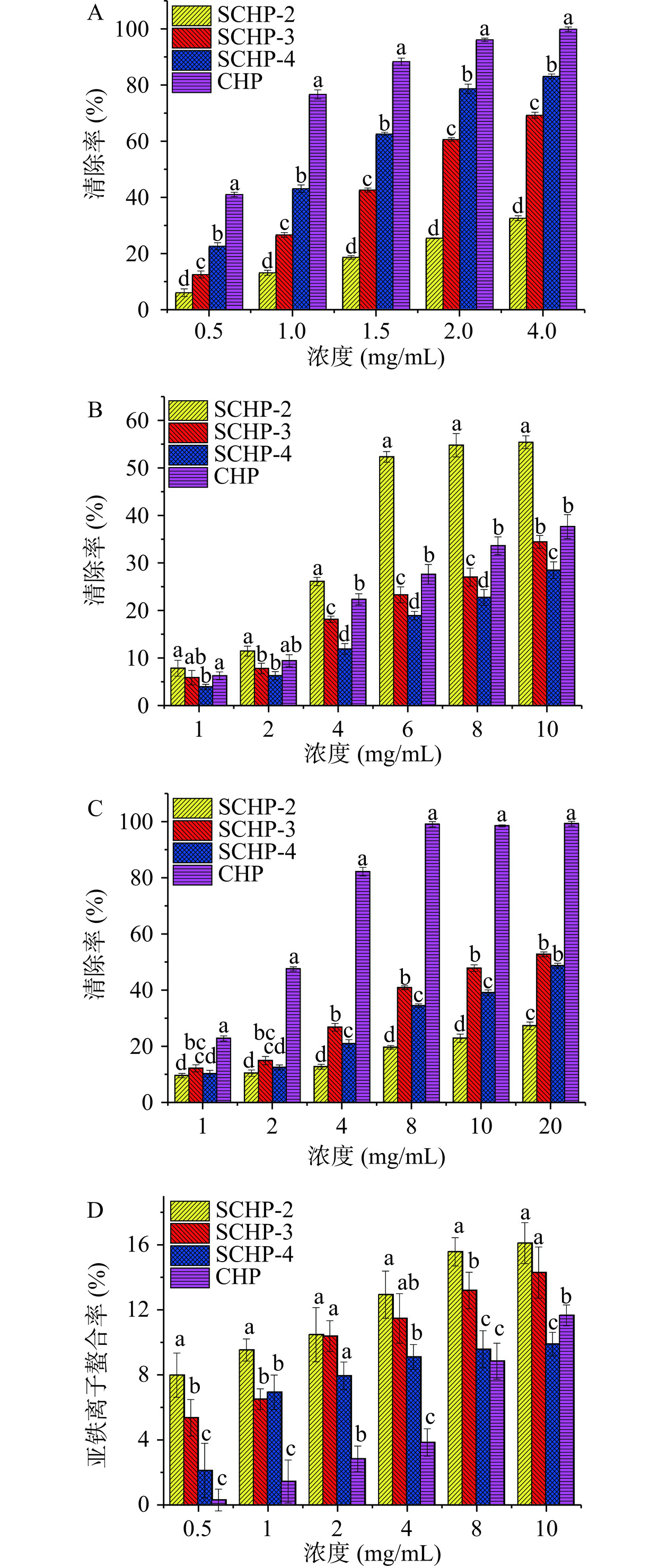
当自由基超过机体清除能力而积累后会诱导氧化应激,导致糖尿病、心血管疾病、高血压和其他退行性疾病等[1,9,15]。目前,DPPH自由基、ABTS+自由基和羟基自由基清除率、亚铁离子络合模型是评价多糖等天然活性物质体外抗氧化活性的最常用方法。从图5的结果可以看出,SCHP和CHP的抗氧化活性之间有显著差异。
从图5A可知,在实验浓度范围内,四种多糖对DPPH自由基的清除率均呈“剂量效应”,也即浓度越大,清除率越高,4 mg/mL时的CHP、SHP-2、SCHP-3和SCHP-4对DPPH自由基的清除率最大,分别为99.43%±0.81%、32.11%±0.86%、68.77%±1.07%和82.65%±0.85%。相同浓度下,三种SCHP对DPPH自由基的清除率显著低于CHP(P<0.05),且整体表现出随DS增大而降低的趋势,这与Li等[13]的研究结果一致,原因可能是-OSO3H基团的引入降低了SCHP总糖和糖醛酸含量,从而削弱了其供氢能力的缘故。
ABTS+自由基清除活性如图5B所示,在1~10 mg/mL范围内,CHP、CHP-2和CHP-3、CHP-4对ABTS+自由基的清除率大小依次为:CHP-2>CHP>CHP-3>CHP-4。可以看出,取代度(DS)的大小可能与多糖对ABTS+自由基的清除能力有一定的关联,随着DS的增加,SCHP对ABTS+自由基的清除能力也呈递增趋势。例如,10 mg/mL的SCHP-4、SCHP-3和SCHP-2对ABTS+自由基的清除率分别为28.52%±1.76%、34.47%±1.29%和55.43%±1.35%。这与邱昆成等[27]报道的硫酸化修饰会降低炮天雄多糖的DPPH自由基清除能力,并增加其ABTS+自由基清除能力的研究结果相一致。可能是因为硫酸化修饰引入了-OSO3H基团导致SCHP的分子量变小、水溶性增强,同时使溶剂中质子基团数量和种类增加,从而更加有利于与总糖、糖醛酸的协同作用快速有效的阻断水溶性自由基反应。
在1~20 mg/mL范围内,CHP和SCHP对羟基自由基清除能力也呈“剂量效应”,20 mg/mL时SCHP的羟基自由基清除率在27.38%~52.85%,显著低于CHP的99.36%±0.84%(P<0.05)。并且,随DS的增加,SCHP清除羟基自由基的能力也逐渐下降(图5D),这可能是因为硫酸化修饰导致SCHP的总糖和糖醛酸含量较CHP降低,无法提供更多的羟基与自由基结合生成新的C-O键的缘故[21,28−29]。这与前人研究报道的硫酸化会增强多糖对羟自由基的清除能力的结果有所不同[12,17,20],但具体是多糖本身特性、络合的多酚或黄酮类等活性物质含量亦或是分子量范围等差异还有待进一步研究。
在哈珀-维斯(Haber Weiss)反应中,亚铁离子能够催化H2O2生成毒性更强的羟基自由基,进一步导致机体损伤[9,18],故螯合金属离子也是反映物质抗氧化能力的指标之一。由图5D可知,4种多糖对亚铁离子的螯合能力均比较弱(10 mg/mL下螯合率在9.91%~16.12%)。但整体来看,硫酸化修饰有利于改善CHP对亚铁离子的螯合能力,且DS越大,改善效果越显著。如4 mg/mL时,SCHP-4、SCHP-3和SCHP-2对亚铁离子的螯合率分别为9.12%±0.76%、11.49%±1.52%和12.95%±1.45%,显著高于CHP的3.86%±0.84%(P<0.05)。这可能是随着DS的增大,SCHP中的-OSO3H基团增多,分子量更小,从而能够与更多的亚铁离子发生络合反应的原因,这与前人报道的“低分子量多糖对亚铁离子的螯合能力优于高分子量多糖”的研究结果相吻合[30]。
3. 结论
本文利用含有不同比例氯磺酸和吡啶的硫酸化试剂制备了3种硫酸化椰子吸器多糖(SCHP-2、SCHP-3、SCHP-4),DS值在0.61~0.75的范围内。与CHP相比,硫酸化修饰后的SCHP中总糖、糖醛酸含量和分子量大小显著降低,且DS越大降低程度越显著。但SCHP与CHP具有相同的单糖种类,而各单糖的摩尔百分含量有较大改变。同时,SCHP的热力学性质也较CHP发生了变化,其中分子内水分蒸发温度增高,而糖苷键的降解温度略微降低。
目前研究证明多糖的抗氧化活性通常与其基本结构、总糖和糖醛酸含量、分子量大小以及官能团的种类等因素密切相关:酯化度(红外光谱中1700~1750 cm−1与1600~1640 cm−1特征峰面积的比值)和含水量越低、分子量越小、糖醛酸及其络合的多酚类物质的含量越高,多糖的抗氧化活性也越好。但到目前为止,究竟是哪个因素在抗氧化活性中起主导作用的具体机制仍不清楚。从本文的研究结果来看,从本文的研究结果来看,硫酸化修饰会增强CHP对亚铁离子的螯合能力以及ABTS+的自由基清除能力,并造成DPPH、羟基自由基的清除能力下降,且DS越大,DPPH和羟基自由基清除能力的降低程度越高,ABTS+自由基清除活性和亚铁离子螯合能力越强。相同浓度下的SCHP-2对ABTS+自由基的清除率已明显高于CHP。具体分析可知,CHP具有最高的DPPH和羟自由基清除活性可能归结于其最高的糖醛酸含量;而随着DS的增加,SCHP对亚铁离子的螯合能力和对ABTS+自由基的清除能力也逐渐增大的原因可能与硫酸根集团的引入导致多糖的分子量降低和溶解性增强有主要关系,但具体机制仍需进一步深入研究。另外,热力学特征和分子量测试结果均表明多糖内可能存在2个组分,故有必要在后续的研究中对CHP和SCHP进行分离纯化和活性跟踪,并探索硫酸修饰对SCHP免疫调节、抗炎、降血糖等活性的影响,为椰子吸器多糖的在功能性食品或药品等领域的应用以及椰子吸器的高值化开发提供依据。
-
表 1 椰子吸器多糖及其硫酸化多糖的化学成分
Table 1 Chemical composition of CHP and SCHP
成分 CHP SCHP-2 SCHP-3 SCHP-4 总糖(%) 56.87±2.35a 21.88±1.24c 23.19±1.37c 32.9±1.19b 糖醛酸(%) 23.64±1.57a 4.29±0.63c 4.42±0.15c 5.27±0.37b 蛋白质(%) 0.38±0.08c 1.23±0.08a 1.18±0.05a 0.55±0.05b DS / 0.75±0.02a 0.64±0.03b 0.61±0.01b 注:同一行中不同字母表示差异显著(P<0.05)。 表 2 椰子吸器多糖及其硫酸化多糖的分子参数与单糖组成
Table 2 Molecular parameter and monosaccharide composition of CHP and SCHP
名称 CHP SCHP-2 SCHP-3 SCHP-4 分子参数 出峰时间
(min)12.13~22.48 13.43~23.31 12.87~23.61 12.88~23.62 Mn(g/mol) 5185 529.10 1148 1173 Mp(g/mol) 2520 366.6 662.5 661.7 Mw(g/mol) 59250 1967 5187 4358 Mw/Mn 11.43 3.72 4.52 3.72 单糖组成
(mol%)Fuc 0.13±0.05c 0.40±0.38a 0.18±0.002b 0.12±0.003d Rha 0.92±0.01a 0.67±0.07c 0.68±0.35c 0.82±0.001b Ara 4.41±0.05a 1.05±0.76b 4.09±0.36a 4.19±0.13a Gal 7.55±0.05ab 7.77±0.09a 7.17±0.15b 7.58±0.07ab Glu 83.54±0.29a 84.19±2.06a 83.53±0.19a 82.85±0.05a Xyl 0.94±0.15c 3.03±1.17a 1.82±0.11b 1.71±0.03b GalA 2.41±0.11c 3.10±0.16a 2.52±0.08c 2.68±0.18b GlcA 0.24±0.04a 0.18±0.05b 0.19±0.003b 0.18±0.01b 注:Mw:重均分子量;Mn:数均分子量;Mp:峰均分子量;Mw/Mn为多分散性指数;Fuc、Rha、Ara、Gal、Glu、Xyl、GalA和GlcA分别代表岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、果糖、半乳糖醛酸和葡萄糖醛酸;同一行中不同字母表示差异显著(P<0.05)。 -
[1] 张玉锋, 宋菲. 椰子活性物质的研究与利用[M]. 海口:南海出版社,2020. [ZHANG Y F, SONG F. Research and utilization of coconut active substances[M]. Haikou:Nanhai Publishing Company,2020.] ZHANG Y F, SONG F. Research and utilization of coconut active substances[M]. Haikou: Nanhai Publishing Company, 2020.
[2] 蔡尔德 R, 著. 张诒仙, 译. 椰子[M]. 北京:农业出版社, 1984:17−88. [CHILD R. Translated by ZHANG Y X. Coconut[M]. Beijing:Agricultural Press, 1984:17−88.] CHILD R. Translated by ZHANG Y X. Coconut[M]. Beijing: Agricultural Press, 1984: 17−88.
[3] LI J, HTWE Y M, WANG Y, et al. Analysis of sugars and fattyacids during haustorium development and seedling growth of coconut[J]. Agronomy Journal,2019,111(5):2341−2349. doi: 10.2134/agronj2019.02.0137
[4] YUKIO S. Ultrastructural observation of the haustoriumin germinating coconut[J]. Japanese Journal of Tropical Agriculture,1998,42(3):179−181.
[5] 陈良秋, 万玲. 椰子吸器发育规律研究[J]. 现代农业科技,2007(5):12. [CHEN L Q, WAN L. Study on the development of(Cocos nucifera L.) haustorium[J]. Modern Agricultural Scienceand Technology,2007(5):12.] doi: 10.3969/j.issn.1007-5739.2007.05.006 CHEN L Q, WAN L. Study on the development of(Cocos nucifera L.) haustorium[J]. Modern Agricultural Scienceand Technology, 2007(5): 12. doi: 10.3969/j.issn.1007-5739.2007.05.006
[6] 李静, 王仁才, 杨耀东, 等. 椰子萌发过程中吸器内含物的变化规律[J]. 南方农业学报,2017,48(12):2163−2168. [LI J, WANG R C, YANG Y D. et al. Variation regulation of haustorium inclusion during coconut germination[J]. Journal of Southern Agriculture,2017,48(12):2163−2168.] LI J, WANG R C, YANG Y D. et al. Variation regulation of haustorium inclusion during coconut germination[J]. Journal of Southern Agriculture, 2017, 48(12): 2163−2168.
[7] ARIVALAGAN M, MANIKANTAN M R, YASMEEN A M, et al. Physiochemical and nutritional characterization of coconut (Cocosnucifera L.) haustorium based extrudates[J]. LWT-Food Scienceand Technology,2018,89:171−178. doi: 10.1016/j.lwt.2017.10.049
[8] MANIVANNAN A, BHARDWAJ R, PADMANABHAN S, et al. Biochemical and nutritional characterization of coconut (Cocos nucifera L. ) haustorium[J]. Food Chemistry,2018,238:153−159. doi: 10.1016/j.foodchem.2016.10.127
[9] 张玉锋, 陈颖娴, 温远芬, 等. 椰子吸器多糖的结构和体外生物学活性分析[J]. 食品工业科技,2021,42(17):78−84. [ZHANG Y F, CHEN Y X, WEN Y F, et al. Structure and biological activities in vitro analysis of polysaccharide from xoconut (Cocos nucifera L.) haustorium[J]. Science and Technology of Food Industry,2021,42(17):78−84.] ZHANG Y F, CHEN Y X, WEN Y F, et al. Structure and biological activities in vitro analysis of polysaccharide from xoconut (Cocos nucifera L.) haustorium[J]. Science and Technology of Food Industry, 2021, 42(17): 78−84.
[10] 张子木, 黄秀芳, 张琴, 等. 壶瓶碎米荠多糖硫酸化结构修饰及抗氧化活性研究[J]. 中国粮油学报,2021,36(12):28−33. [ZHANG Z M, HUANG X F, ZHANG Q, et al. Sulfated structure modification and antioxidant activity of Cardamine hupingshanensis polysaccharide[J]. Journal of the Chinese Cereals and Oils Association,2021,36(12):28−33.] doi: 10.3969/j.issn.1003-0174.2021.12.006 ZHANG Z M, HUANG X F, ZHANG Q, et al. Sulfated structure modification and antioxidant activity of Cardamine hupingshanensis polysaccharide[J]. Journal of the Chinese Cereals and Oils Association, 2021, 36(12): 28−33. doi: 10.3969/j.issn.1003-0174.2021.12.006
[11] REHEBATI N, PAIHEERDING M, AYTURSUN A, et al. Effects of different chemical modifications on the structure and biological activities of polysaccharides from Orchis chusua D. Don[J]. Journal of Food Science,2021,86:2434−2444. doi: 10.1111/1750-3841.15734
[12] CAO Y Y, JI Y H, LIAO A M, et al. Effects of sulfated, phosphorylated and carboxymethylated modifications on the antioxidant activities in-vitro of polysaccharides sequentially extracted from Amana edulis[J]. International Journal of Biological Macromolecules,2020,146:887−896. doi: 10.1016/j.ijbiomac.2019.09.211
[13] LI H, WANG X, XIONG Q, et al. Sulfated modification, characterization, and potential bioactivities of polysaccharide from the fruiting bodies of Russula virescens[J]. International Journal of Biological Macromolecules:Structure,2020,154:1438−1447. doi: 10.1016/j.ijbiomac.2019.11.025
[14] 孙寒, 藏颖, 刘松, 等. 硫酸化修饰对小球藻胞内多糖抗氧化及抗肿瘤活性的影响[J]. 食品工业科技,2023,44(7):82−88. [SUN H, ZANG Y, LIU S, et al. Effect of sulfation modification on antioxidation and anti-tumor activity of intracellular polysaccharide from Chlorella vulgaris[J]. Science and Technology of Food Industry,2023,44(7):82−88.] SUN H, ZANG Y, LIU S, et al. Effect of sulfation modification on antioxidation and anti-tumor activity of intracellular polysaccharide from Chlorella vulgaris[J]. Science and Technology of Food Industry, 2023, 44(7): 82−88.
[15] ZHANG Z H, LIU Z Q, TAO X Y, et al. Characterization and sulfated modification of an exopolysaccharide from Lactobacillus plantarum ZDY2013 and its biological activities[J]. Carbohydrate Polymers,2016,153:25−33. doi: 10.1016/j.carbpol.2016.07.084
[16] 曹长靓. 海蒿子多糖的分离纯化、降血糖活性及其体外消化酵解研究[D]. 广州:华南理工大学,2021. [CAO C L. Study on the isolation and purification of polysaccharides from Artemisia annua and its hypoglycemic activity and enzymatic digestion in vitro [D]. Guangdong:South China University of Technology,2021.] CAO C L. Study on the isolation and purification of polysaccharides from Artemisia annua and its hypoglycemic activity and enzymatic digestion in vitro [D]. Guangdong: South China University of Technology, 2021.
[17] XIAO H, FU X, CAO C L, et al. Sulfated modification, characterization, antioxidant and hypoglycemic activities of polysaccharides from Sargassum pallidum[J]. International Journal of Biological Macromolecules,2019,121(7):462−471.
[18] ZHANG Y F, TANG M M, SONG F. et al. The effects of different drying methods on the structural characteristics and bioactivities in vitro of polysaccharides from coconut (Cocos nucifera L.) water[J]. Journal of Food Measurement and Characterization,2022,16(4):2499−2509. doi: 10.1007/s11694-022-01346-w
[19] YAN C, CHEN X, LI T, et al. Structural characterization and osteogenic bioactivities of a novel Humulus lupulus polysaccharide[J]. Food & Function,2020,11(1):412−419.
[20] WANG Z J, XIE J H, SHEN M Y, et al. Sulfated modification of polysaccharides:synthesis, characterization and bioactivities[J]. Trends in Food Science & Technology,2018,74:147−157.
[21] 巩晓佩, 张建, 郭筱兵, 等. 硫酸化修饰对红枣多糖结构及抗氧化活性的影响[J]. 食品与机械,2022,38(4):29−34,120. [GONG X P, ZHANG J, GUO X B, et al. Effect of sulfate modificate on the structure and antioxidant activity of jujube polysaccharide[J]. Food and Machinery,2022,38(4):29−34,120.] GONG X P, ZHANG J, GUO X B, et al. Effect of sulfate modificate on the structure and antioxidant activity of jujube polysaccharide[J]. Food and Machinery, 2022, 38(4): 29−34,120.
[22] OLASEHINDEl T A, MABINYA L V, OLANIRAN A O, et al. Chemical characterization of sulfated polysaccharides from Gracilaria gracilis and Ulva lactuca and their radical scavenging, metal chelating, and cholinesterase inhibitory activities[J]. International Journal of Food Properties,2019,22(1):100−110. doi: 10.1080/10942912.2019.1573831
[23] FENG J W, TIN H, CHEN X C, et al. Interaction between fish gelatin and tremella polysaccharides from aqueous solutions to complex coacervates:Structure and rheological properties[J]. Food Hydrocolloids, 2023, 138:108439.
[24] 叶美芝, 伍紫仪, 吴金松, 等. 山药皮多糖的分离纯化、结构特征及体外抗氧化活性研究[J]. 食品工业科技,2023,44(19):78−85. [YE M Z, WU Z Y, WU J S, et al. Study on separation, purification, structural characteristics and in vitro antioxidant activity of polysaccharides from Chinese yam peel[J]. Science and Technology of Food Industry,2023,44(19):78−85.] YE M Z, WU Z Y, WU J S, et al. Study on separation, purification, structural characteristics and in vitro antioxidant activity of polysaccharides from Chinese yam peel[J]. Science and Technology of Food Industry, 2023, 44(19): 78−85.
[25] VIJAY D M, LAUKIK A S, OMKAR K. Modulation of the anti-cancer activity of sulfated polysaccharides, synthesized in spirulinaplatensis, due to varying degree of sulfation induced by nutrient and physical stress[J]. Journal of Biologically Active Products from Nature,2020,10(4):275−284. doi: 10.1080/22311866.2020.1806729
[26] SABET S, RASHIDINEJAD A, MELTON L D, et al. The interactions between the two negatively charged polysaccharides:Gum Arabic and alginate[J]. Food Hydrocolloids,2021,112(3):1−14.
[27] 邱昆成, 卢仲禹, 张忠德, 等. 炮天雄多糖硫酸酯衍生物的制备及生物活性研究[J]. 中药新药与临床药理,2022,33(3):349−355. [QIU K C, LU Z Y, ZHANG Z D, et al. Preparation and biological activity of sulfated polysaccharide derivatives from PaoTian Xiong[J]. Traditional Chinese Drug Research and Clinical Pharmacology,2022,33(3):349−355.] QIU K C, LU Z Y, ZHANG Z D, et al. Preparation and biological activity of sulfated polysaccharide derivatives from PaoTian Xiong[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2022, 33(3): 349−355.
[28] LEI W, PAN Z, CHAO L, et al. Antioxidant and digestion properties of polysaccharides from Rosa roxburghii Tratt. fruit and polysacchride-iron (Ⅲ) complex[J]. Journal of Food Processing and Preservation,2021,45(7):1−11.
[29] CHANG S H, WU C H, TSAI G J. Effects of chitosan molecular weight on its antioxidant and antimutagenic properties[J]. Carbohydrate polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2018,181(18):135−146.
[30] TU J Q, LIU H P, WEN Y H, et al. A novel polysaccharide from Hericium erinaceus:Preparation, structural characteristics, thermal stabilities, and antioxidant activities in vitro[J]. Journal of Food Biochemistry,2021,45(9):217−223.
-
期刊类型引用(2)
1. 陈衍真,满文娟,程雷娜,王淑娴,魏鉴腾,曾祥俊. 响应面法优化肉苁蓉多糖提取液的脱色工艺及其抗氧化活性研究. 食品安全质量检测学报. 2025(05): 94-103 .  百度学术
百度学术
2. 魏鉴腾,申奥,张丹阳,陈衍真,周万聪,王淑娴. 高速剪切辅助提取蕨麻多糖工艺优化及抗氧化活性研究. 食品安全质量检测学报. 2024(23): 115-124 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



