Simultaneous Determination of 13 Mycotoxins in Plant Solid Beverages by UPLC-MS/MS Combined with Modified QuEChERS
-
摘要: 本研究建立了一种基于QuEChERS前处理结合超高效液相色谱串联质谱(UPLC-MS/MS)定量分析的高通量检测方法,用于测定植物固体饮料中的13种真菌毒素。样品均质加水溶解后,采用QuEChERS法进行前处理,以2%甲酸-乙腈溶液超声提取,十八烷基硅烷键合硅胶(C18)进行除杂净化。提取液经Kinetex F5色谱柱分离后,采用串联质谱多反应监测模式(MRM)进行检测,基质匹配标准曲线法进行定量。结果显示,13种真菌毒素在测试范围内均呈现良好的线性关系(r>0.9916),检出限在0.04~16.9 μg/kg之间,定量限在0.12~38.2 μg/kg之间,精密度(RSD)小于9.0%,且在植物固体饮料中的加标回收率在82.2%到103.3%之间。利用该方法对18份植物固体饮料样品进行筛查,其中检出4份样品含有真菌毒素,包括脱氧雪腐镰刀菌烯醇和伏马毒素B3。该方法具有操作简便、成本低、灵敏度高和准确度高的优势,可满足植物固体饮料中多种真菌毒素的高通量筛查。
-
关键词:
- QuEChERS /
- 超高效液相色谱串联质谱法 /
- 真菌毒素 /
- 植物固体饮料 /
- 高通量
Abstract: This work aimed to develop a high-throughput analytical method based on QuEChERS coupled with ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) for the determination of 13 mycotoxins in plant-solid beverages. The samples were homogenized and dissolved in water. QuEChERS method was used for pretreatment, ultrasonic extraction with 2% formic acid-acetonitrile solution, and purification with octadecylsilane bonded silica gel (C18). The extraction solution was then separated by a Kinetex F5 column, detected by a tandem mass spectrometry detector in multiple reaction monitoring mode (MRM), and quantified by matrix-matched standard calibration. The optimum conditions achieved limits of detections (LODs) in the range of 0.04~16.9 μg/kg, with correlation coefficient over 0.9916. The limit of quantifications (LOQs) were in the range 0.12~38.2 μg/kg. The recoveries in real plant-solid beverages ranged from 82.2% to 103.3%, with relative standard deviations (RSDs) below 9.0%. Moreover, the proposed method was applied to analyze mycotoxins in 18 plant-solid beverage samples, a positive detection rate of 4/18 was obtained, and the detected analytes included deoxynivalenol and fumonisin B3. This proposed method has the advantages of simple operation, low cost, high sensitivity and accuracy, which can be used for the high-throughput screening of multiple mycotoxins in plant-solid beverages. -
植物固体饮料是以植物及其提取物为主要原料经加工制成的冲泡型饮料,因携带方便、风味独特、具有营养或保健功能等独特优势而备受消费者青睐[1]。在行业逐渐加速发展的同时,其质量安全问题也日益凸显。植物固体饮料原料在种植收获、初加工及储存运输等环节均可能受到真菌毒素的污染,致使最终产品受到污染。长期食用残留真菌毒素的植物固体饮料,会产生细胞毒性、致畸性、致癌性、致突变性等多种毒性[2−4],给消费者的身体健康造成严重危害。因此,对植物固体饮料中的真菌毒素进行监测和防控显得尤为重要。
目前,国家标准方法以及文献报道的真菌毒素的检测方法主要采用薄层色谱法(TLC)[5]、酶联免疫吸附法(ELISA)[6−7]、高效液相色谱法(HPLC)[8]和超高效液相色谱串联质谱法(UPLC-MS/MS)[9−12]等,薄层色谱法在真菌毒素检测方面应用历史较为久远,但在大范围的检测中已逐步被其他新型检测方法代替[13],酶联免疫吸附法是基于抗原-抗体反应原理的一种常见免疫检测技术,方法简便,特异性强[14],多用于快速定性筛查,而高效液相色谱法和超高效液相色谱串联质谱法因其准确度和灵敏度高的特点,是目前应用于真菌毒素检测最普遍的方法。高效液相色谱法适用于检测化学性质相近的真菌毒素,难以实现多种类真菌毒素同时测定。超高效液相色谱串联质谱法不仅分离性能好,定性能力强,且兼具高准确度和高灵敏度,适用于多种真菌毒素的定性定量分析[15−16]。
可靠的样品前处理净化方法是提高检测准确度和灵敏度的关键,目前净化技术主要有固相萃取柱[17]、多功能净化柱[18]、免疫亲和柱[19−20]以及QuEChERS方法[21]等。而其中QuEChERS法最初是为检测蔬菜和水果中农药残留而开发的,随后在真菌毒素、环境污染物等方向检测也迅速流行起来[22]。近年来,有关QuEChERS结合UPLC-MS/MS技术实现多种真菌毒素同时检测的研究也有所报道。徐子婷等[23]采用QuEChERS-SPE液质联用法测定调味面制品中12种真菌毒素,通过SPE与QuEChERS二次净化方式实现12种真菌毒素检测,李媛等[24]采用QuEChERS结合UPLC-MS/MS法测定土鳖虫及其成方制剂中9种真菌毒素,RAUSCH等[25]基于QuEChERS开发的测定谷物中38种天然和改性真菌毒素。这些已经报道的方法因基质的不同所采取的前处理方式也略有差别,适用范围也仅限于研究中的食品种类,无法直接应用于其他食品类型,并且有的方法使用的同位素内标定量法检测成本较高,不利于大批量检测。
本研究利用QuEChERS前处理结合UPLC-MS/MS技术的优势,并参考和借鉴文献中有关多种真菌毒素同时分析的样品前处理以及分析条件的基础上,进一步优化和改进提取、净化以及色谱质谱等条件,建立植物固体饮料中13种真菌毒素同时测定的简便、快速、灵敏、高通量检测方法,以提高检测效率和降低分析成本,为监测和评估植物固体饮料中多种真菌毒素的污染风险提供技术支持。
1. 材料与方法
1.1 材料与仪器
实验用18份植物固体饮料样品 市售;黄曲霉毒素B1(Aflatoxin B1,AFB1)、黄曲霉毒素B2(Aflatoxin B2,AFB2)、黄曲霉毒素G1(Aflatoxin G1,AFG1)、黄曲霉毒素G2(Aflatoxin G2,AFG2)标准品 25 μg/mL 青岛普瑞邦(Pribolab)生物工程有限公司;10 μg/mL伏马毒素B1(Fumonisin B1,FB1)、伏马毒素B2(Fumonisin B2,FB2)、伏马毒素B3(Fumonisin B3,FB3)标准品、100 μg/mL T-2 毒素(T-2 toxin,T-2)标准品 上海安谱璀世标准技术服务有限公司;杂色曲霉素(Sterigmatocystin,ST)标准品 100 μg/mL,北京坛墨质检科技有限公司;桔青霉素(Citrinin,CIT)、玉米赤霉烯酮(Zearalenone,ZEN)标准品 98.00%,TRC-CANADA(加拿大多伦多研究化学);赭曲霉毒素A(Ochratoxin A,OTA)标准品 100 μg/mL,上海安谱实验科技股份有限公司;脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)标准品 200 μg/mL,o2si smart solutions;乙腈、甲醇 色谱纯,西格玛奥德里奇(上海)贸易有限公司;甲酸、乙酸铵、无水硫酸镁(MgSO4)、氯化钠 分析纯,广州化学试剂有限公司;十八烷基硅烷键合硅胶(C18)、乙二胺-N-丙基硅烷化硅胶(primary secondary amine,PSA)、石墨化碳黑吸附剂(graphitized carbon black adsorbent,GCB) 分析纯,上海安谱实验科技股份有限公司。
AB SCIEX Q-Trap 5500超高效液相色谱-质谱仪 美国Applied Biosystem公司;N-EVAP112氮吹仪 美国 Organomation 公司;H1850R离心机 湖南湘仪离心机仪器有限公司;WIGGENS Vortex涡旋振荡仪 北京桑翌实验仪器研究所;S22H超声波清洗机 致微(厦门)仪器有限公司;Milli-Q 超纯水仪 美国密理博公司。
1.2 实验方法
1.2.1 标准溶液配制
真菌毒素单标(AFB1、AFB2、AFG1、AFG2浓度为0.2 mg/L;FB1、FB2、FB3浓度为1 mg/L;T-2、ST、OTA、ZEN浓度为10 mg/L;DON浓度为20 mg/L;CIT浓度为100 mg/L)储备溶液配制于乙腈溶液中,分别移取一定体积的13种真菌毒素单标溶液并用乙腈稀释配制得到混合标准溶液(其中AFB1、AFB2、AFG1、AFG2浓度为0.05 mg/L;FB1、FB2、FB3、T-2、ST、OTA、ZEN浓度为0.5 mg/L;CIT、DON浓度为5 mg/L)。所有储备溶液均储存在−20 ℃冰箱中避光保存。
1.2.2 样品前处理
样品前处理方法借鉴和参考文献已报道的方法[23−25]并进行适当调整和改进:称取2 g植物固体饮料样品置于50 mL离心管中,加入5 mL水,涡旋5 min,再加入10 mL 2%的甲酸乙腈溶液,涡旋3 min后超声提取30 min;加入1 g氯化钠,涡旋3 min,于12000 r/min条件下离心5 min。吸取6 mL上清液置于内含1 g MgSO4、200 mg C18填料的10 mL离心管中,涡旋振荡3 min,于12000 r/min下离心5 min;移取2.5 mL上清液在40 ℃氮气条件下吹干,用1 mL 10%甲醇水溶液溶液复溶,涡旋振荡3 min,于14000 r/min条件下离心30 min,上清液上机测定。
1.2.3 色谱条件
所用色谱柱为Kinetex F5色谱柱(2.6 μm,2.1×100 mm i.d.,Phenomenex)。流动相A相为0.1%甲酸-5 mmol/L乙酸铵水溶液,B相为甲醇。流动相流速为0.4 mL/min;柱温箱温度设为40 ℃;进样体积为5 μL;流动相梯度洗脱程序见表1。
表 1 流动相梯度洗脱程序Table 1. Mobile phase gradient elution procedure时间(min) 流动相A(%) 流动相B(%) 0 95 5 6.0 80 20 8.0 80 20 15.0 10 90 18.0 10 90 18.1 95 5 20.0 95 5 1.2.4 质谱条件
电离采用电喷雾离子源(Electron spray ionization,ESI),检测采用多反应监测(Multiple reaction monitoring,MRM)模式,扫描采用正、负离子两种方式同时进行。其他相关质谱参数设置为:电喷雾电压为5500 V,离子源温度为550 ℃;气帘气压力为275.8 kPa,碰撞气档位于中档;喷雾气压力为344.8 kPa,辅助加热气压力为344.8 kPa,接口加热为开。13种真菌毒素的质谱参数见表2。
表 2 13种真菌毒素质谱参数Table 2. Mass spectrometry parameters of 13 mycotoxins分析物 母离子 去簇电压(V) 子离子 碰撞能量(eV) AFB1 313.1 (+H) 150 285.0*/241.0 31/45 AFB2 315.1 (+H) 150 287.0*/259.0 35/40 AFG1 329.0 (+H) 150 243.0*/283.0 37/34 AFG2 331.0 (+H) 150 245.0*/285.0 40/37 FB1 722.4 (+H) 110 334.3*/352.3 59/54 FB2 706.4 (+H) 117 336.4*/354.3 57/49 FB3 706.4 (+H) 115 336.2*/354.4 54/47 T-2 489.2 (+NH4+) 210 245.1*/387.1 36/26 ST 325.0 (+H) 210 281.0*/309.9 50/33 CIT 251.0 (+H) 160 233.0*/191.0 21/35 OTA 402.0 (−H) −150 358.1*/211.0 −27/−37 DON 297.0 (+H) 120 203.0*/157.0 18/27 ZEN 317.1 (−H) −100 175.0*/273.1 −34/−27 注:*为定量离子。 1.3 数据处理
方法重复性及回收率试验均为6次平行试验,数据采用Analyst1.7.2软件处理分析,通过WPS对数据进行统计分析和绘图。
2. 结果与分析
2.1 质谱条件优化
取适当浓度(0.1~1 μg/L)的每种真菌毒素的标准溶液直接进样,分别在正、负离子模式下通过全扫描模式寻找和确定各真菌毒素的母离子。确定母离子质荷比之后,利用子离子扫描模式对母离子进行二级质谱碎裂,寻找和选择两个响应好且稳定的碎片离子作为子离子,组成MRM离子对,进行去簇电压和碰撞能量的优化,确定各真菌毒素的质谱参数。实验发现OTA和ZEN在负离子模式下响应更好,分子离子峰为[M-H]−;其它11种真菌毒素在正离子模式下响应更好,其中T-2分子离子峰为[M+NH4]+,其余均为[M+H]+。13种真菌毒素的MRM质谱参数如表2所示。
2.2 液相条件优化
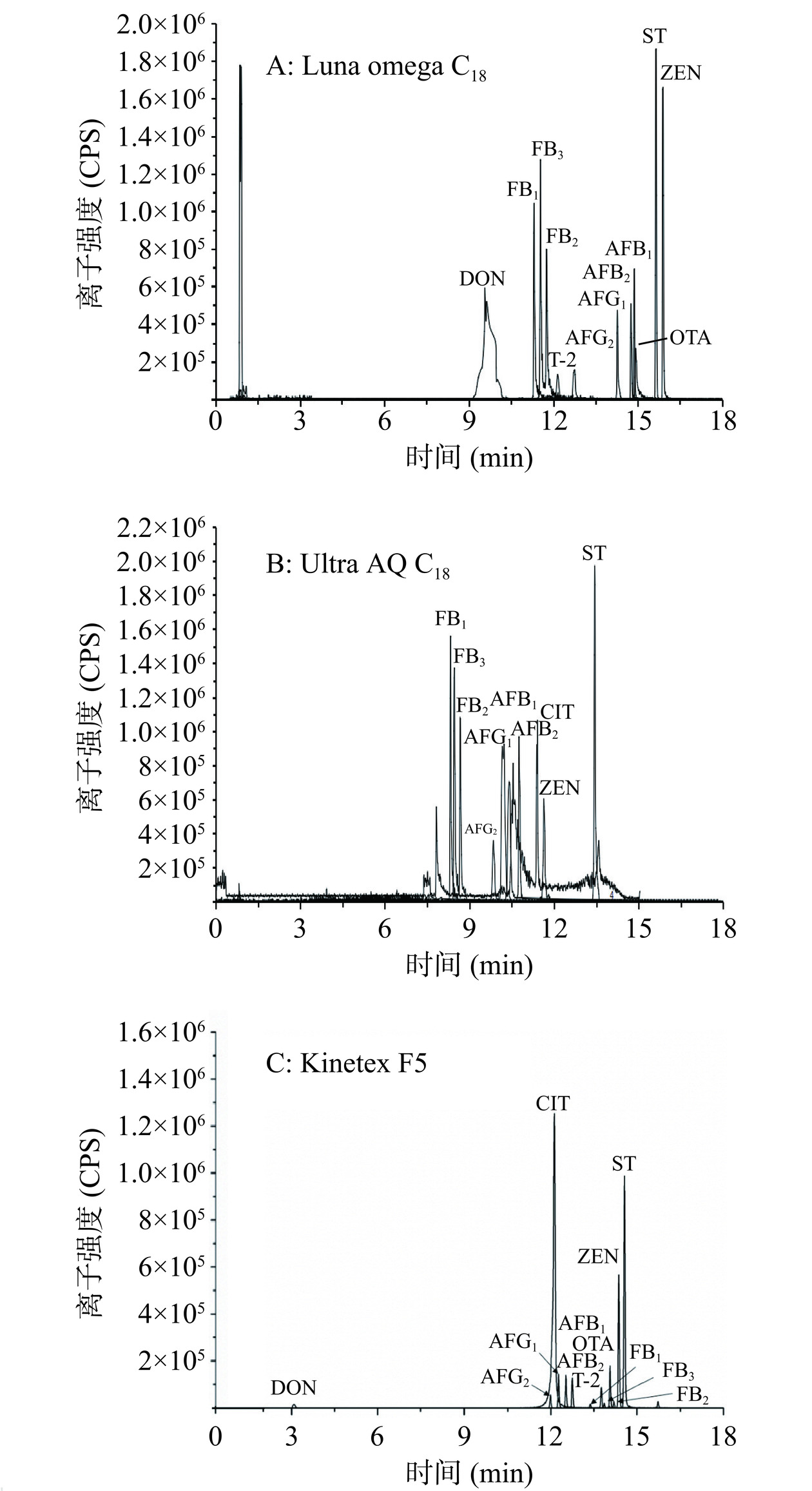
影响色谱分离的主要因素有色谱柱、洗脱液、添加剂(如甲酸、乙酸和乙酸铵等)、洗脱梯度、流速和柱温等。本研究比较了Kinetex F5色谱柱(2.6 μm,2.1×100 mm i.d.,Phenomenex)、Ultra AQ C18色谱柱(3 μm,2.1×100 mm i.d., RESTEK)和Luna Omega C18色谱柱(1.6 μm,2.1×100 mm i.d.,Phenomenex)对13种真菌毒素的分离效果。由图1可知,在使用Luna Omega C18色谱柱时,CIT不出峰、DON峰型较差(图1A)且FB2和FB3分离效果不好;使用Ultra AQ C18色谱柱时,DON、OTA、T-2这三种真菌毒素均不出峰(图1B);使用Kinetex F5色谱柱时,13种真菌毒素均能在20 min内出峰,且峰型对称(图1C)。所以选择Kinetex F5色谱柱作为分析色谱柱进行后续实验。
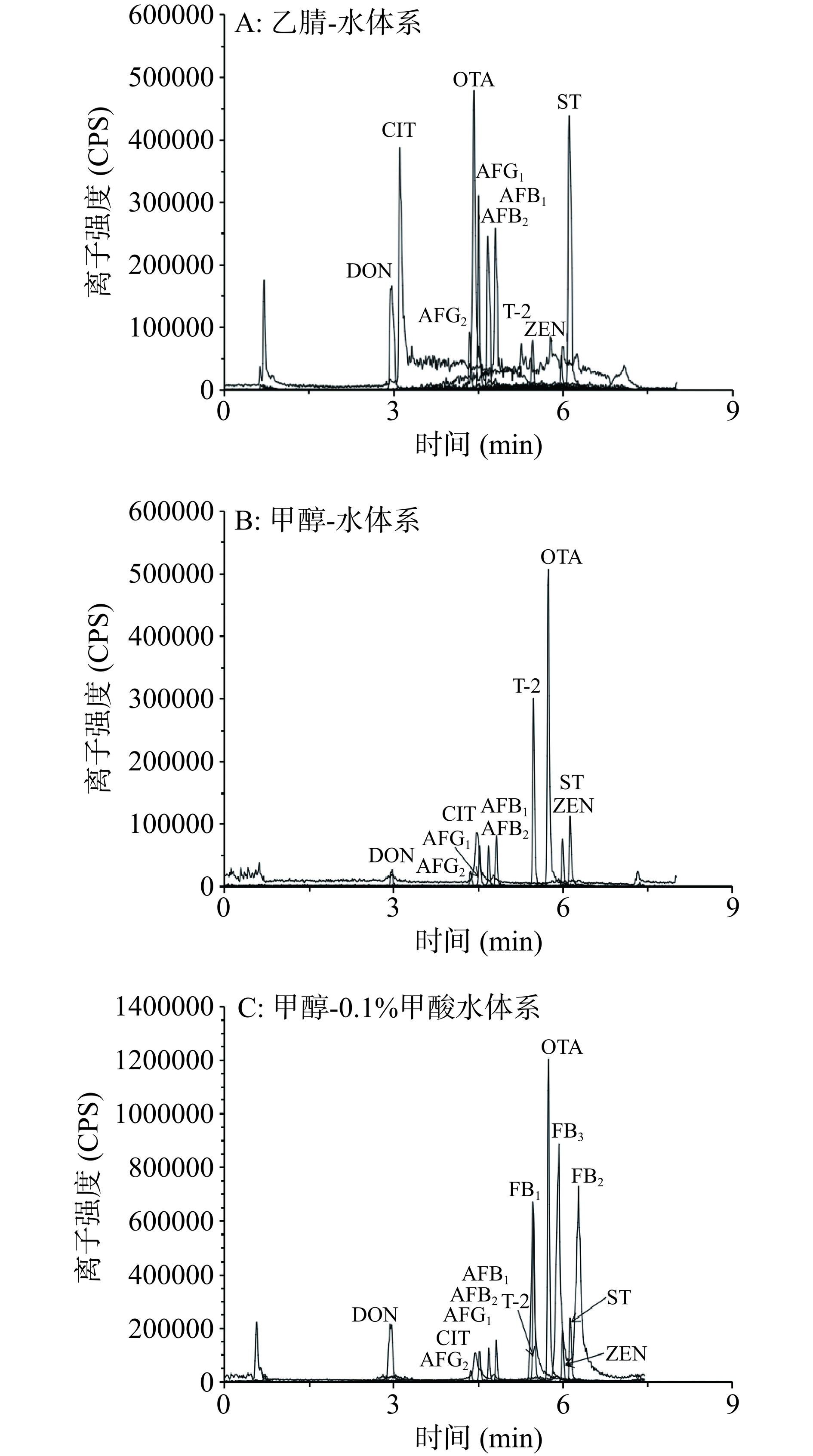
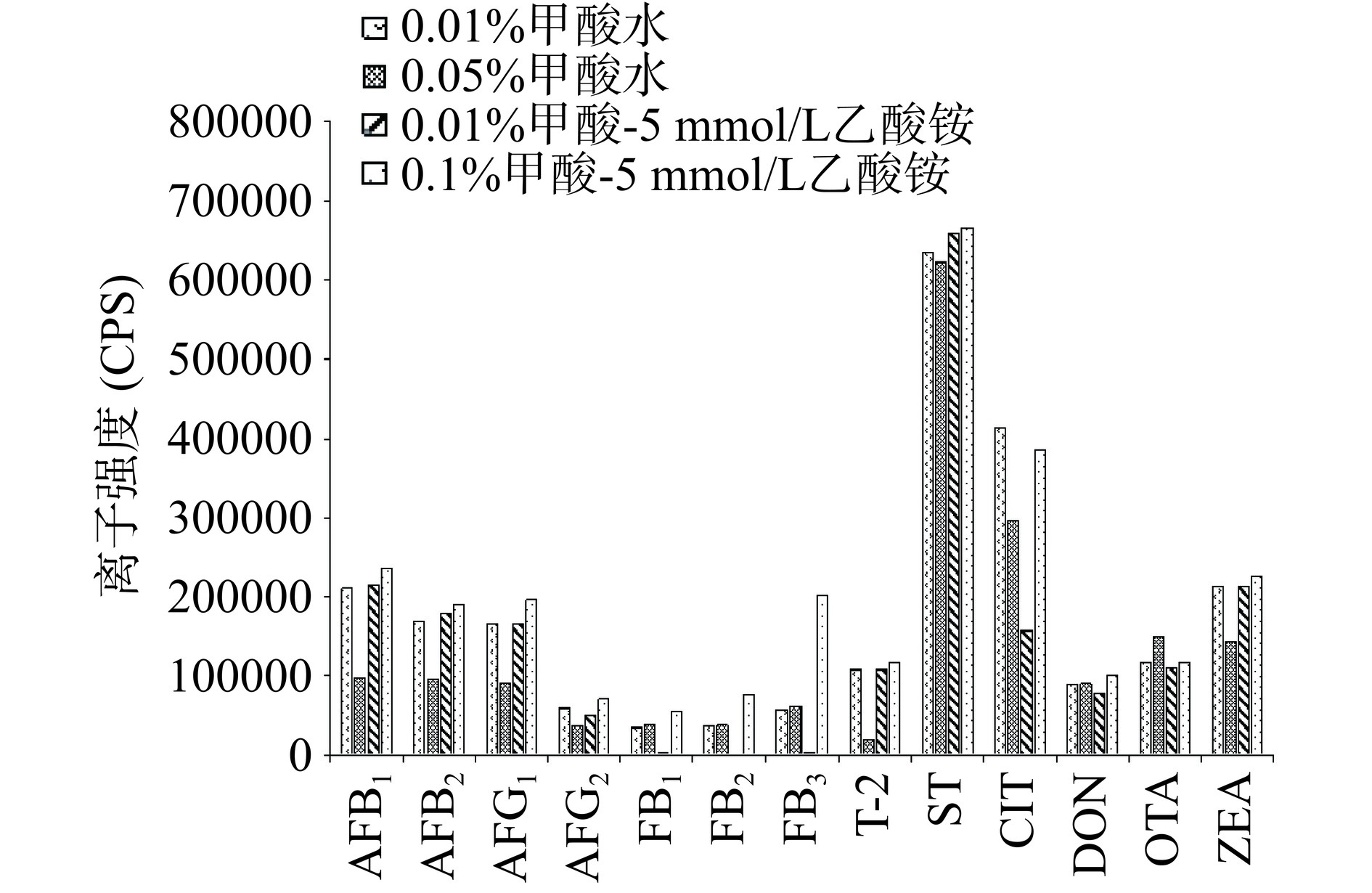
为了得到较好的分离效率和较高的检测灵敏度,对流动相的组成及梯度进行了优化,包括对使用的有机相种类以及添加剂(盐类、有机酸)种类和浓度进行对比优化。本文对比了乙腈-水,甲醇-水、甲醇-0.1%甲酸水作为流动相体系对13种真菌毒素分离效果的影响。如图2所示,13种真菌毒素在使用甲醇-水体系比使用乙腈-水体系的条件下保留时间更晚,峰形更对称和尖锐,响应更高,因此后续选择甲醇作为有机相。并且发现在甲醇-水流动相体系下,未检测到伏马毒素的信号;而在甲醇-0.1%甲酸水流动相体系下,可以检测到很强的伏马毒素的信号,说明甲酸可以显著增强伏马毒素的信号。为了寻找13种真菌毒素能同时分离检测的流动相体系,进一步考察了不同水相(包括0.01%甲酸水、0.05%甲酸水、0.01%甲酸-5 mmol/L乙酸铵和0.1%甲酸-5 mmol/L乙酸铵等)对分离效果的影响。由图3可知,伏马毒素在添加甲酸的情况下,信号强度随着甲酸浓度的增加而增加;并且添加乙酸铵比不添加乙酸铵情况下各分析物分离效果更好。因此后续实验选择流动相为:A相为0.1%甲酸-5 mmol/L乙酸铵水溶液,B相为甲醇,质谱检测模式为正离子模式和负离子模式同时进行监测,流动相洗脱梯度见表1。
2.3 前处理条件优化
2.3.1 提取溶剂优化
不同真菌毒素结构差异大,有的水溶性强,有的脂溶性强,极性差异大,提取溶剂的优化需要兼顾所有分析物均能同时得到有效的提取。目前文献报道的多种真菌毒素的提取溶剂主要采用甲醇或乙腈与水的混合溶液,其中乙腈与水的混合溶液对真菌毒素的提取效率更高,对杂质的提取效率更低,适用范围更广[26−27],因此选择乙腈与水的混合溶液作为提取溶剂,采用先加入水后加入乙腈的方式对实际样品进行提取。
当采用先加入水后加入乙腈的方式对样品进行提取之后,需要加入氯化钠进行盐析分层,使目标分析物进入有机相,去除极性较强的水溶性杂质(留在水相中)。部分真菌毒素含有羧基基团包括伏马毒素类、桔青霉素和赭曲霉毒素A,水溶性强,需要在提取溶剂中加入酸使羧基质子化,提高这些目标分析物的疏水性,促进酸性真菌毒素在盐析分层过程中更多地分配至有机相。因此提取溶剂采用加入甲酸的方式,提高这些酸性真菌毒素的提取效率。在提取溶剂乙腈中加入不同甲酸浓度(1%、2%、5%、10%)进行考察,结果发现当使用2%甲酸乙腈作为提取溶剂时,13种真菌毒素的回收率达到77.4%~106.4%范围(表3),因此后续实验选择2%甲酸乙腈作为提取溶剂。
表 3 不同提取剂下真菌毒素的回收率(%,n=6)Table 3. Recoveries rate of mycotoxins by different extractants (%, n=6)毒素 回收率 1%甲酸乙腈 2%甲酸乙腈 5%甲酸乙腈 10%甲酸乙腈 AFB1 82.7 87.6 76.2 68.6 AFB2 86.3 98.1 89.4 82.5 AFG1 103.6 106.4 102.9 88.6 AFG2 99.7 105.7 84.0 110.8 FB1 73.4 77.4 88.2 97.9 FB2 70.6 85.2 56.8 76.4 FB3 77.1 86.3 89.4 83.6 T-2 79.2 104.2 75.2 83.3 ST 80.8 77.4 66.4 66.1 CIT 81.2 78.3 71.2 69.5 DON 67.2 79.4 71.8 77.6 OTA 93.8 92.6 76.0 95.5 ZEA 87.1 82.8 73.5 66.7 2.3.2 净化填料优化
实际样品经过提取与盐析过程之后,提取液不仅含有目标分析物,也同时含有疏水性较强的杂质例如脂质等,这些杂质不仅会影响痕量真菌毒素的检测,也会造成色谱和质谱系统的污染。为了减少样品基质的干扰,降低基质效应,采用QuEChERS法对提取液进行进一步地净化除杂。QuEChERS法常用的净化填料包括C18、PSA、GCB和中性氧化铝等。参考和借鉴文献[28−30]所优化的净化填料配比,对以下三组净化填料进行了考察:1 g MgSO4+200 mg C18;300 mg MgSO4+150 mg C18+150 mg PSA;900 mg MgSO4+300 mg C18+150 mg PSA+30 mg GCB。结果发现,使用净化填料包含PSA时对伏马毒素类和桔青霉素均有较强吸附,检测不到目标物信号;使用净化填料同时包含PSA和GCB时,对黄曲霉毒素类、伏马毒素类、桔青霉素、杂色曲霉素、OTA和ZEN均具有较强吸附,其中ZEN回收率为49.1%,而其余真菌毒素均未检测到质谱信号。当使用1 g MgSO4和200 mg C18作为净化填料时,13种真菌毒素的回收率最优,达到86.5%~105.6%范围,因此选择1 g MgSO4和200 mg C18作为QuEChERS净化填料对提取液进行净化和除杂。
2.4 方法学评价
2.4.1 线性范围和检出限
在最优的前处理以及色谱质谱条件下对线性进行考察。为降低或消除基质效应对检测结果的影响,采用基质匹配标准曲线法进行定量分析。称取空白植物固体饮料,分别加入一系列不同浓度的13种真菌毒素混合标准储备液,按照1.2.2节所述的步骤进行样品前处理,配制不同线性范围的系列基质混合标准溶液(质量浓度为0.1~5.0 μg/L的AFB1、AFB2、AFG1、AFG2;1.0~50 μg/L的FB1、FB2、FB3、T-2、ST、OTA、ZEN;10~500 μg/L的CIT、DON),进行UPLC-MS/MS分析。以添加的真菌毒素的浓度为横坐标,真菌毒素的质谱信号强度为纵坐标,建立13种真菌毒素的工作曲线,结果如表4所示。13种真菌毒素工作曲线的线性关系良好,相关系数(r)均大于0.9916。以3倍和10倍的信噪比确定方法的检出限和定量限,13 种真菌毒素的检出限和定量限分别介于 0.04~16.9 μg/kg 和 0.12~38.2 μg/kg 之间,可以满足实际样品的检测需求。
表 4 13种真菌毒素的线性、检出限及定量限Table 4. Linear、detection limit and quantitation linit of 13 mycotoxins分析物 线性范围(μg/L) 线性方程 相关系数(r) 检出限(μg/kg) 定量限(μg/kg) AFB1 0.1~5.0 y=1.29×105x+3.64×103 0.9994 0.08 0.32 AFB2 0.1~5.0 y=1.49×105x+3.53×103 0.9990 0.10 0.36 AFG1 0.1~5.0 y=1.4×105x+8.51×103 0.9998 0.09 0.35 AFG2 0.1~5.0 y=4.71×104x+7.25×103 0.9994 0.12 0.37 FB1 1.0~50 y=2.94×103x+6.05×103 0.9992 1.52 4.46 FB2 1.0~50 y=2.16×103x+1.84×104 0.9967 1.33 4.06 FB3 1.0~50 y=4.12×103x+9.25×103 0.9916 1.38 4.24 T-2 1.0~50 y=1.05×104x+4.09×103 0.9991 1.37 4.17 ST 1.0~50 y=1.78×105x+747 1.0000 0.05 0.13 OTA 1.0~50 y=3.74×104x−1.51×104 1.0000 1.55 3.70 ZEN 1.0~50 y=7.4×104x−1.06×103 0.9998 0.04 0.12 CIT 10~500 y=2.75×104x+209 0.9965 4.35 11.1 DON 10~500 y=802x+5.87×103 0.9998 16.9 38.2 2.4.2 回收率和精密度
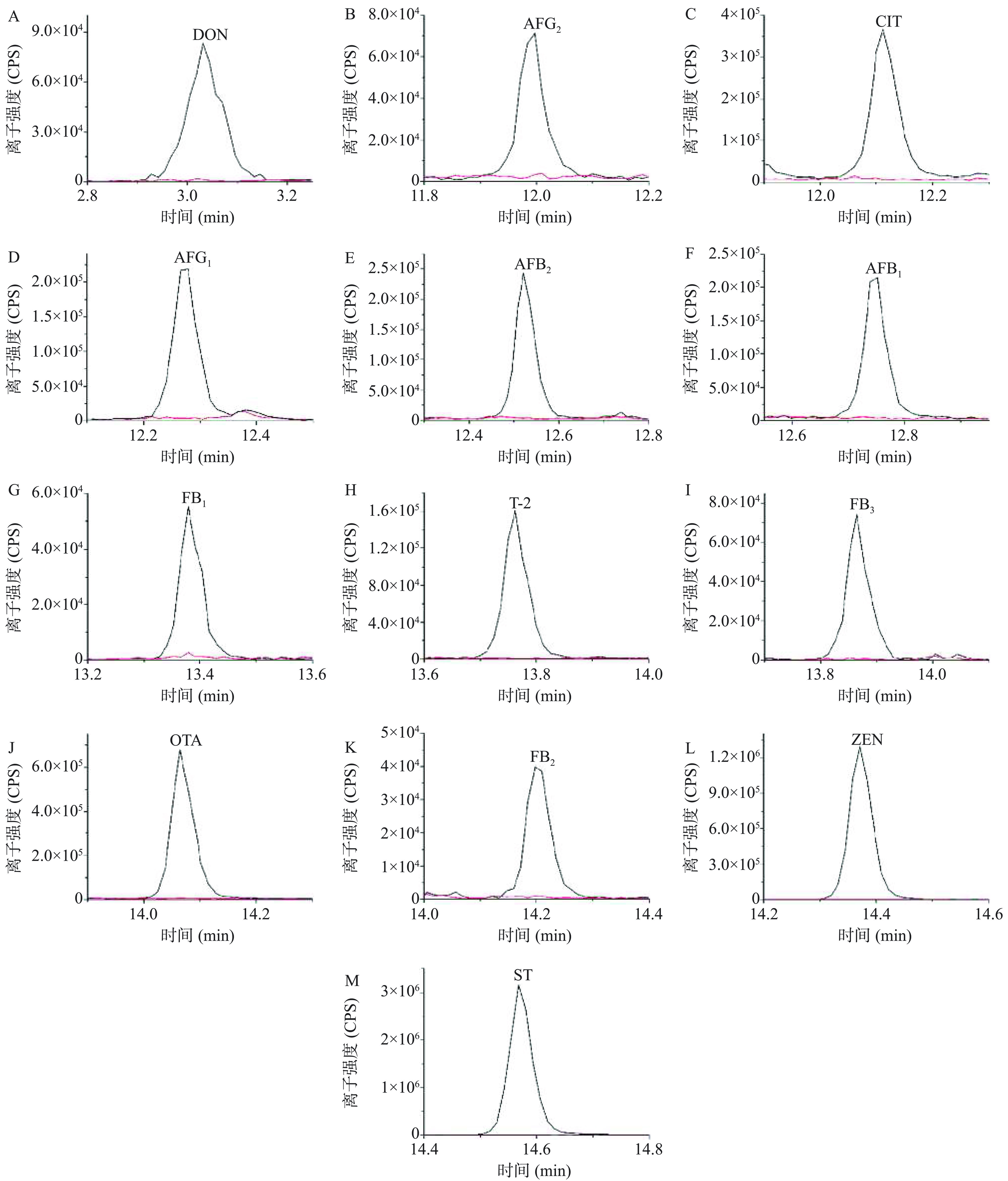
为了考察所建立方法的回收率和精密度,取空白植物固体饮料样品,在标准曲线的中低浓度范围内,选取三个浓度水平添加13种真菌毒素的混合标准溶液至空白样品中,按照1.2.2节所述的步骤进行样品前处理后,进行UPLC-MS/MS测定。如图4所示,在各目标分析物的离子通道中同一保留时间没有干扰峰,说明没有内源性杂质的干扰,表明所建立的方法选择性较好。精密度是通过对添加标准品的植物固体饮料样品进行6次平行定量实验,以测定结果的相对标准偏差(RSD)计算的。如表5所示,13种真菌毒素的平均回收率在82.2%~103.3%范围之间,精密度在0.9%~9.0%范围之间,表明该方法较为准确,且重现性较好,符合植物固体饮料中多种真菌毒素的测定要求。
表 5 13种真菌毒素的回收率和精密度(n=6)Table 5. Recovery and precision of 13 mycotoxins (n=6)分析物 加标量(μg/kg) 回收率(%) RSD(%) AFB1 0.5 92.5 7.7 1.0 100.8 2.7 5.0 98.7 2.5 AFB2 0.5 94.9 0.9 1.0 91.3 6.5 5.0 103.3 1.3 AFG1 0.5 95.9 2.7 1.0 94.0 3.9 5.0 99.5 1.6 AFG2 0.5 98.5 3.7 1.0 93.7 9.0 5.0 101.4 0.9 FB1 5.0 97.7 3.9 10 88.6 6.9 50 99.1 6.1 FB2 5.0 88.0 4.1 10 94.8 1.2 50 97.3 1.4 FB3 5.0 86.6 2.1 10 94.0 1.3 50 93.1 1.3 T-2 5.0 89.7 6.9 10 86.1 5.0 50 102.4 3.8 ST 5.0 92.0 1.7 10 85.6 1.9 50 82.2 4.7 OTA 5.0 91.0 4.8 10 86.4 3.2 50 91.6 8.5 ZEN 5.0 96.8 2.6 10 90.1 5.3 50 94.1 5.6 CIT 50 94.5 1.1 100 89.4 1.5 500 92.2 1.4 DON 50 94.5 1.2 100 96.1 2.2 500 95.3 1.5 2.5 实际样品的检测
利用所建立的QuEChERS前处理结合UPLC-MS/MS分析方法对18份植物固体饮料样品中的真菌毒素进行检测,共4份样品检出真菌毒素,其中3份样品检出DON,含量分别为7447、7453、7640 μg/kg;1份检出FB3,含量为2.50 μg/kg。通过对比查看样品的配料表,检出DON的3份样品中,可能是由于其原料中的陈皮或部分中药材储存不当以及生产过程中导致的真菌毒素污染。检测结果表明,植物固体饮料存在一定的真菌毒素污染风险,应给予关注和重视。
3. 结论
本研究通过对样品前处理的提取溶剂与净化条件以及色谱质谱条件进行改进和优化,建立基于QuEChERS样品前处理结合UPLC-MS/MS检测的方法用于同时测定植物固体饮料中的13种真菌毒素,方法前处理简单迅速,有效解决了植物固体饮料这类复杂基质的提取及净化问题。利用该方法对18份植物固体饮料样品进行检测,在4份样品中检出两种真菌毒素(DON和FB3),因此需要加强植物固体饮料中真菌毒素的监测与防护,保障消费者的健康安全。总的来说,本研究所提出的方法具有操作简便快速、成本低、覆盖真菌毒素种类多、准确度高和灵敏度高等优势,适用于植物固体饮料中多种真菌毒素的高通量检测,为监测和评估真菌毒素污染风险提供有效的技术支撑。
-
表 1 流动相梯度洗脱程序
Table 1 Mobile phase gradient elution procedure
时间(min) 流动相A(%) 流动相B(%) 0 95 5 6.0 80 20 8.0 80 20 15.0 10 90 18.0 10 90 18.1 95 5 20.0 95 5 表 2 13种真菌毒素质谱参数
Table 2 Mass spectrometry parameters of 13 mycotoxins
分析物 母离子 去簇电压(V) 子离子 碰撞能量(eV) AFB1 313.1 (+H) 150 285.0*/241.0 31/45 AFB2 315.1 (+H) 150 287.0*/259.0 35/40 AFG1 329.0 (+H) 150 243.0*/283.0 37/34 AFG2 331.0 (+H) 150 245.0*/285.0 40/37 FB1 722.4 (+H) 110 334.3*/352.3 59/54 FB2 706.4 (+H) 117 336.4*/354.3 57/49 FB3 706.4 (+H) 115 336.2*/354.4 54/47 T-2 489.2 (+NH4+) 210 245.1*/387.1 36/26 ST 325.0 (+H) 210 281.0*/309.9 50/33 CIT 251.0 (+H) 160 233.0*/191.0 21/35 OTA 402.0 (−H) −150 358.1*/211.0 −27/−37 DON 297.0 (+H) 120 203.0*/157.0 18/27 ZEN 317.1 (−H) −100 175.0*/273.1 −34/−27 注:*为定量离子。 表 3 不同提取剂下真菌毒素的回收率(%,n=6)
Table 3 Recoveries rate of mycotoxins by different extractants (%, n=6)
毒素 回收率 1%甲酸乙腈 2%甲酸乙腈 5%甲酸乙腈 10%甲酸乙腈 AFB1 82.7 87.6 76.2 68.6 AFB2 86.3 98.1 89.4 82.5 AFG1 103.6 106.4 102.9 88.6 AFG2 99.7 105.7 84.0 110.8 FB1 73.4 77.4 88.2 97.9 FB2 70.6 85.2 56.8 76.4 FB3 77.1 86.3 89.4 83.6 T-2 79.2 104.2 75.2 83.3 ST 80.8 77.4 66.4 66.1 CIT 81.2 78.3 71.2 69.5 DON 67.2 79.4 71.8 77.6 OTA 93.8 92.6 76.0 95.5 ZEA 87.1 82.8 73.5 66.7 表 4 13种真菌毒素的线性、检出限及定量限
Table 4 Linear、detection limit and quantitation linit of 13 mycotoxins
分析物 线性范围(μg/L) 线性方程 相关系数(r) 检出限(μg/kg) 定量限(μg/kg) AFB1 0.1~5.0 y=1.29×105x+3.64×103 0.9994 0.08 0.32 AFB2 0.1~5.0 y=1.49×105x+3.53×103 0.9990 0.10 0.36 AFG1 0.1~5.0 y=1.4×105x+8.51×103 0.9998 0.09 0.35 AFG2 0.1~5.0 y=4.71×104x+7.25×103 0.9994 0.12 0.37 FB1 1.0~50 y=2.94×103x+6.05×103 0.9992 1.52 4.46 FB2 1.0~50 y=2.16×103x+1.84×104 0.9967 1.33 4.06 FB3 1.0~50 y=4.12×103x+9.25×103 0.9916 1.38 4.24 T-2 1.0~50 y=1.05×104x+4.09×103 0.9991 1.37 4.17 ST 1.0~50 y=1.78×105x+747 1.0000 0.05 0.13 OTA 1.0~50 y=3.74×104x−1.51×104 1.0000 1.55 3.70 ZEN 1.0~50 y=7.4×104x−1.06×103 0.9998 0.04 0.12 CIT 10~500 y=2.75×104x+209 0.9965 4.35 11.1 DON 10~500 y=802x+5.87×103 0.9998 16.9 38.2 表 5 13种真菌毒素的回收率和精密度(n=6)
Table 5 Recovery and precision of 13 mycotoxins (n=6)
分析物 加标量(μg/kg) 回收率(%) RSD(%) AFB1 0.5 92.5 7.7 1.0 100.8 2.7 5.0 98.7 2.5 AFB2 0.5 94.9 0.9 1.0 91.3 6.5 5.0 103.3 1.3 AFG1 0.5 95.9 2.7 1.0 94.0 3.9 5.0 99.5 1.6 AFG2 0.5 98.5 3.7 1.0 93.7 9.0 5.0 101.4 0.9 FB1 5.0 97.7 3.9 10 88.6 6.9 50 99.1 6.1 FB2 5.0 88.0 4.1 10 94.8 1.2 50 97.3 1.4 FB3 5.0 86.6 2.1 10 94.0 1.3 50 93.1 1.3 T-2 5.0 89.7 6.9 10 86.1 5.0 50 102.4 3.8 ST 5.0 92.0 1.7 10 85.6 1.9 50 82.2 4.7 OTA 5.0 91.0 4.8 10 86.4 3.2 50 91.6 8.5 ZEN 5.0 96.8 2.6 10 90.1 5.3 50 94.1 5.6 CIT 50 94.5 1.1 100 89.4 1.5 500 92.2 1.4 DON 50 94.5 1.2 100 96.1 2.2 500 95.3 1.5 -
[1] 欧阳新华. 我国固体饮料产业的安全问题与监管建议[J]. 食品安全导刊,2022,16(32):22−24. [OUYANG X H. Safety problems and supervision suggestions of solid beverage industry[J]. China Food Safety Magazine,2022,16(32):22−24.] doi: 10.3969/j.issn.1674-0270.2022.32.spaqdk202232019 OUYANG X H. Safety problems and supervision suggestions of solid beverage industry[J]. China Food Safety Magazine, 2022, 16(32): 22−24. doi: 10.3969/j.issn.1674-0270.2022.32.spaqdk202232019
[2] ALSHANNAQ A, YU J H. Occurrence, toxicity, and analysis of major mycotoxins in food[J]. International Journal of Environmental Research and Public Health,2017,14(6):632. doi: 10.3390/ijerph14060632
[3] KESKIN E, EYUPOGLU O E. Determination of mycotoxins by HPLC, LC-MS/MS and health risk assessment of the mycotoxins in bee products of Turkey[J]. Food Chemistry,2023,400:134086. doi: 10.1016/j.foodchem.2022.134086
[4] DO T H, TRAN S C, LE C D, et al. Dietary exposure and health risk characterization of aflatoxin B1, ochratoxin A, fumonisin B1, and zearalenone in food from different provinces in Northern Vietnam[J]. Food Control,2020,112:107108. doi: 10.1016/j.foodcont.2020.107108
[5] 徐一达, 袁晓, 王海鸣, 等. 色谱法检测真菌毒素的研究进展[J]. 粮油食品科技,2018,26(6):54−61. [XU Y D, YUAN X, WANG H M, et al. Research progress in detection of mycotoxins by chromatography[J]. Science and Technology of Cereals, Oils and Foods,2018,26(6):54−61.] XU Y D, YUAN X, WANG H M, et al. Research progress in detection of mycotoxins by chromatography[J]. Science and Technology of Cereals, Oils and Foods, 2018, 26(6): 54−61.
[6] YAN J X, HU W J, YOU K H, et al. Biosynthetic mycotoxin conjugate mimetics-mediated green strategy for multiplex mycotoxin immunochromatographic assay[J]. Journal of Agricultural and Food Chemistry,2020,68(7):2193−2199. doi: 10.1021/acs.jafc.9b06383
[7] 王海彬, 李培武, 张奇, 等. 粮油产品真菌毒素抗体制备研究进展[J]. 中国油料作物学报,2012,34(3):336−342. [WANG H B, LI P W, ZHANG Q, et al. A review on progress of preparation of antibodies against mycotoxins in foodstuff and oilseeds[J]. Chinese Journal of Oil Crop Sciences,2012,34(3):336−342.] WANG H B, LI P W, ZHANG Q, et al. A review on progress of preparation of antibodies against mycotoxins in foodstuff and oilseeds[J]. Chinese Journal of Oil Crop Sciences, 2012, 34(3): 336−342.
[8] 吴定芳, 王磊, 戴佩珍, 等. 高效液相色谱法测定茶叶中6种真菌毒素[J]. 分析仪器,2023,54(1):32−38. [WU D F, WANG L, DAI P Z, et al. Simultaneous detection of six mycotoxins in tea by HPLC with purification on immunoaffinity column[J]. Analytical Instrumentation,2023,54(1):32−38.] doi: 10.3969/j.issn.1001-232x.2023.01.006 WU D F, WANG L, DAI P Z, et al. Simultaneous detection of six mycotoxins in tea by HPLC with purification on immunoaffinity column[J]. Analytical Instrumentation, 2023, 54(1): 32−38. doi: 10.3969/j.issn.1001-232x.2023.01.006
[9] AREO O M, ABAFE O A, GBASHI A S, et al. Detection of multi-mycotoxins in rooibos and other consumed teas in South Africa by a modified QuEChERS method and ultra-high performance liquid chromatography tandem mass spectrometry[J]. Food Control,2023,143:109255. doi: 10.1016/j.foodcont.2022.109255
[10] ZHOU H Y, YAN Z, YU S, et al. Development of a novel UPLC-MS/MS Method for the simultaneous determination of 16 mycotoxins in different tea categories[J]. Toxins,2022,14(3):169. doi: 10.3390/toxins14030169
[11] 韦迪哲, 王蒙, 翟文磊. 基于磁性ZIF-67纳米材料的QuEChERS-超高效液相色谱-串联质谱技术同时检测小麦中17种真菌毒素[J]. 食品安全质量检测学报,2022,13(23):7563−7572. [WEI D Z, WANG M, ZHAI W H. Simultaneous determination of 17 kinds of mycotoxins in wheat by QuEChERS-ultrra performance liquid chromatography-tandem mass spectrometry based on magnetic ZIF-67 nanomaterials[J]. Journal of Food & Quality,2022,13(23):7563−7572.] WEI D Z, WANG M, ZHAI W H. Simultaneous determination of 17 kinds of mycotoxins in wheat by QuEChERS-ultrra performance liquid chromatography-tandem mass spectrometry based on magnetic ZIF-67 nanomaterials[J]. Journal of Food & Quality, 2022, 13(23): 7563−7572.
[12] QIU N N, SUN D L, ZHOU S, et al. Rapid and sensitive UHPLC-MS/MS methods for dietary sample analysis of 43 mycotoxins in China total diet study[J]. Journal of Advanced Research,2022,39:15−47. doi: 10.1016/j.jare.2021.10.008
[13] 黄铭仕. 关于粮油中真菌毒素检测技术分析及其应用探讨[J]. 现代食品,2020,6(18):162−164. [HUANG M S. Analysis and application of mycotoxin detection technology in cereals and oils[J]. Modern Food,2020,6(18):162−164.] HUANG M S. Analysis and application of mycotoxin detection technology in cereals and oils[J]. Modern Food, 2020, 6(18): 162−164.
[14] 李靖靖. 酶联免疫吸附法在食品安全检测中的应用[J]. 食品安全导刊,2023,17(30):154−156. [LI J J. Application of enzyme-linked immunosorbent assay in food safety detection[J]. China Food Safety Magazine,2023,17(30):154−156.] LI J J. Application of enzyme-linked immunosorbent assay in food safety detection[J]. China Food Safety Magazine, 2023, 17(30): 154−156.
[15] 李子琨, 史晓梅, 何卓霖, 等. QuEChERS-高效液相色谱串联质谱法测定粮谷中20种真菌毒素[J]. 中国粮油学报,2023,38(5):1−9. [LI Z K, SHI X M, HE Z L, et al. Determination of 20 mycotoxins in grains by QuEChERS and high perfomance of liquid chromatography tandem mass spectrometry[J]. Journal of the Chinese Cereals and Oils Association,2023,38(5):1−9.] doi: 10.3969/j.issn.1003-0174.2023.05.002 LI Z K, SHI X M, HE Z L, et al. Determination of 20 mycotoxins in grains by QuEChERS and high perfomance of liquid chromatography tandem mass spectrometry[J]. Journal of the Chinese Cereals and Oils Association, 2023, 38(5): 1−9. doi: 10.3969/j.issn.1003-0174.2023.05.002
[16] 廉慧锋, 赵笑天, 王蓉珍, 等. 超高效液相色谱-串联质谱法同时测定玉米、花生、麦仁中的9种真菌毒素[J]. 食品科学,2010,31(20):360−366. [LIAN H F, ZHAO X T, WANG R Z, et al. Simultaneous determination of 9 kinds of mycotoxins in maize, peanut and wheat by ultrra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2010,31(20):360−366.] LIAN H F, ZHAO X T, WANG R Z, et al. Simultaneous determination of 9 kinds of mycotoxins in maize, peanut and wheat by ultrra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Science, 2010, 31(20): 360−366.
[17] TANG Z T, HAN Q R, YU G, et al. Fe3O4@PDA/MIL-101(Cr) as magnetic solid-phase extraction sorbent for mycotoxins in licorice prior to ultrahigh-performance liquid chromatography-tandem mass spectrometry analysis[J]. Food Science & Nutrition,2022,10:2224−2235.
[18] 孙卫明, 王权帅. 多功能净化柱-超高效液相色谱-串联质谱法测定挂面、方便面中4种真菌毒素[J]. 中国卫生检验杂志,2021,31(6):662−665. [SUN W M, WANG Q S. Determination of 4 kinds of mycotoxins in dried noodles and instant noodles by multifunctional columns-ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Health Laboratory Technology,2021,31(6):662−665.] SUN W M, WANG Q S. Determination of 4 kinds of mycotoxins in dried noodles and instant noodles by multifunctional columns-ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Health Laboratory Technology, 2021, 31(6): 662−665.
[19] 张烁, 周爽, 裴晓燕, 等. 免疫亲和柱结合超高效液相色谱-串联质谱法测定牛奶中的16种真菌毒素比较研究[J]. 食品安全质量检测学报,2023,14(3):234−242. [ZHANG S, ZHOU S, PEI X Y, et al. Comparative study of immunoaffinity columns combined with ultra performance liquid chromatography-tandem mass spectrometry for determination of 16 kinds of mycotoxins in milk[J]. Journal of Food & Quality,2023,14(3):234−242.] doi: 10.3969/j.issn.2095-0381.2023.3.spaqzljcjs202303029 ZHANG S, ZHOU S, PEI X Y, et al. Comparative study of immunoaffinity columns combined with ultra performance liquid chromatography-tandem mass spectrometry for determination of 16 kinds of mycotoxins in milk[J]. Journal of Food & Quality, 2023, 14(3): 234−242. doi: 10.3969/j.issn.2095-0381.2023.3.spaqzljcjs202303029
[20] 陈悦铭, 黄景初, 徐婷, 等. 多功能免疫亲和柱净化-超高效液相色谱串联质谱法快速检测咖啡豆中的11种真菌毒素[J]. 食品工业科技,2021,42(16):285−293. [CHEN Y M, HUANG J C, XU T, et al. Rapid determination of 11 mtcotoxins in coffee bean through multifunctional purification and immunoaffinity column coupled to high-performance liquid chromatography tandem mass spectrometry[J]. Science and Technology of Food Industry,2021,42(16):285−293.] CHEN Y M, HUANG J C, XU T, et al. Rapid determination of 11 mtcotoxins in coffee bean through multifunctional purification and immunoaffinity column coupled to high-performance liquid chromatography tandem mass spectrometry[J]. Science and Technology of Food Industry, 2021, 42(16): 285−293.
[21] 程晓宏, 杨清华, 杨娟, 等. QuEChERS技术在食品安全中的应用进展[J]. 食品工业,2022,43(2):264−269. [CHENG X H, YANG Q H, YANG J, et al. Advances in application of QuEChERS for food safety[J]. The Food Industry,2022,43(2):264−269.] CHENG X H, YANG Q H, YANG J, et al. Advances in application of QuEChERS for food safety[J]. The Food Industry, 2022, 43(2): 264−269.
[22] PERESTRELO R, SILVAP, PORTO-FIGUEIRA P, et al. QuEChERS - fundamentals, relevant improvements, applications and future trends[J]. Anal Chim Acta, 2019, 1070:1-28.
[23] 徐子婷, 郝莉花, 马静, 等. QuEChERS-SPE-超高效液相色谱-串联质谱法测定调味面制品中的12种真菌毒素[J]. 食品工业科技,2022,43(6):311−319. [XU Z T, HAO L H, MA J, et al. Determination of 12 mycotoxins in seasoning flour products by QuEChERS-SPE-ultra performance liquid chromatography-tandem mass spectrometry[J]. Science and Technology of Food Industry,2022,43(6):311−319.] XU Z T, HAO L H, MA J, et al. Determination of 12 mycotoxins in seasoning flour products by QuEChERS-SPE-ultra performance liquid chromatography-tandem mass spectrometry[J]. Science and Technology of Food Industry, 2022, 43(6): 311−319.
[24] 李媛, 张楠, 张亚锋, 等. QuEChERS结合UHPLC-MS同时测定土鳖虫及其成方制剂中9种真菌毒素含量[J]. 中国现代中药,2022,24(1):142−146. [LI Y, ZHANG N, ZHANG Y F, et al. Simultaneous determination of nine mycotoxins in eupolyphaga steleophaga and six kinds of chinese medicinal prerations containing eupolyphaga steleophaga by UHPLC-MS combined with QuEChERS[J]. Modern Chinese Medicine,2022,24(1):142−146.] LI Y, ZHANG N, ZHANG Y F, et al. Simultaneous determination of nine mycotoxins in eupolyphaga steleophaga and six kinds of chinese medicinal prerations containing eupolyphaga steleophaga by UHPLC-MS combined with QuEChERS[J]. Modern Chinese Medicine, 2022, 24(1): 142−146.
[25] RAUSCH A K, BROCKMEYER R, SCHWERDTLE T. Development and validation of a QuEChERS-based liquid chromatography tandem mass spectrometry multi-Method for the determination of 38 native and modified mycotoxins in cereals[J]. Journal of Agricultural and Food Chemistry,2020,68(16):4657−4669. doi: 10.1021/acs.jafc.9b07491
[26] 崔东伟. 谷物及其制品中真菌毒素的检测技术研究[D]. 沈阳:中国医科大学, 2022. [CUI D W. Research on precise detection technology of mycotoxins in grains and their products[D]. Shenyang:China Medical University, 2022.] CUI D W. Research on precise detection technology of mycotoxins in grains and their products[D]. Shenyang: China Medical University, 2022.
[27] 戴海蓉, 梁思慧, 王春民, 等. 同时检测食品中多种类真菌毒素的研究进展[J]. 中国食品学报,2022,22(8):398−415. [DAI H R, LIANG S H, WANG C M, et al. Research progress on simultaneous detection of multiple mycotoxins in food[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(8):398−415.] DAI H R, LIANG S H, WANG C M, et al. Research progress on simultaneous detection of multiple mycotoxins in food[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(8): 398−415.
[28] 俊超, 秦学磊, 吴圣江, 等. QuEChERS前处理方法在食品检测中的应用进展[J]. 食品研究与开发,2021,42(24):206−212. [JUN C, QIN X L, WU S J, et al. Progress in the applications of the QuEChERS method in the food determination process[J]. Food Research and Development,2021,42(24):206−212.] doi: 10.12161/j.issn.1005-6521.2021.24.030 JUN C, QIN X L, WU S J, et al. Progress in the applications of the QuEChERS method in the food determination process[J]. Food Research and Development, 2021, 42(24): 206−212. doi: 10.12161/j.issn.1005-6521.2021.24.030
[29] 蒋林惠, 周易枚, 陈煜, 等. QuEChERS结合LC-MS/MS法在粮谷有机污染物检测中的研究进展[J]. 粮食与食品工业,2021,28(3):64−68. [JIANG L H, ZHOU Y M, CHEN Y, et al. Research progress in the detection of grains'organic pollutants by QuEChERS &LC-MS/MS[J]. Cereal & Food Industry,2021,28(3):64−68.] doi: 10.3969/j.issn.1672-5026.2021.03.019 JIANG L H, ZHOU Y M, CHEN Y, et al. Research progress in the detection of grains'organic pollutants by QuEChERS &LC-MS/MS[J]. Cereal & Food Industry, 2021, 28(3): 64−68. doi: 10.3969/j.issn.1672-5026.2021.03.019
[30] 唐振涛, 于刚, 刘菲, 等. 超高效液相色谱-三重四级杆质谱同时检测苦荞中10种真菌毒素[J]. 安徽农业科学,2021,49(1):188−193. [TANG Z T, YU G, LIU F, et al. Simultaneous determination of 10 mycotoxins in buckwheat with ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Anhui Agricultural Sciences,2021,49(1):188−193.] doi: 10.3969/j.issn.0517-6611.2021.01.051 TANG Z T, YU G, LIU F, et al. Simultaneous determination of 10 mycotoxins in buckwheat with ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Anhui Agricultural Sciences, 2021, 49(1): 188−193. doi: 10.3969/j.issn.0517-6611.2021.01.051
-
期刊类型引用(2)
1. 王海萍,李爽,李慧,王伟光,秦鹏. 同位素稀释HPLC-MS法测定爆米花中7种真菌毒素. 食品安全导刊. 2025(07): 89-91 .  百度学术
百度学术
2. 祝伟霞,于卓然,郁露,刘亚风,魏蔚. 液相色谱-四极杆/静电场轨道阱高分辨质谱测定植物油中8种真菌毒素. 中国口岸科学技术. 2024(11): 48-53 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



