Optimization of the Ultrasonic-assisted Extraction Process of Polysaccharides from the Peels of Wild Bitter Melon (Momordica charantia Linn. Var. Abbreviata Ser.) and a Preliminary Study on Their Antioxidant and Hypoglycemic Activities
-
摘要: 本研究拟探究金铃子多糖的提取工艺、理化性质、抗氧化和降糖活性。以新鲜金铃子果实的果皮为原料,基于单因素实验结果,对超声辅助提取(UAE)过程中的液料比、超声时间和超声功率进行Box-Behnken响应面优化,并以最佳条件进行超声萃取。分级醇沉得到两个多糖组分WBP50和WBP75,对其理化性质、体外抗氧化和降血糖能力进行评价。结果表明:在液料比16 mL/g,超声时间16 min,超声功率312 W的条件下,金铃子粗多糖实际得率8.33%±0.13%;WBP50和WBP75的总糖、蛋白质、总酚、总黄酮和糖醛酸含量分别为76.73%/73.38%、4.78%/0.35%、0.36%/0.25%、2.06%/0.86%和72.85%/49.58%;WBP50和WBP75平均分子量分别为27.59 kDa和23.20 kDa,主要由半乳糖醛酸、半乳糖、鼠李糖、阿拉伯糖、葡萄糖组成;两种金铃子多糖对DPPH、ABTS+和羟基自由基的清除能力分别为11.28/11.40 μg Trolox/mg、40.87/44.42 μg Trolox/mg和52.47/99.89 U/mg。在降血糖方面,WBP50和WBP75都具有一定的α-淀粉酶活性抑制能力和较强的α-葡萄糖苷酶活性抑制能力,在浓度750 μg/mL时对α-葡萄糖苷酶的抑制率可高达93.34%±1.11%和79.04%±0.76%。超声辅助提取金铃子多糖的工艺具有省时方便、高效率耗能低的优点,且所提取的金铃子多糖具有天然的抗氧降糖功能活性,本研究为未来金铃子多糖的结构解析及功能活性作用机制研究奠定基础,为金铃子多糖的降糖产品开发及高值化利用提供理论参考。Abstract: This study intends to explore the extraction process, physical and chemical properties, antioxidant and hypoglycemic activities of polysaccharides from wild bitter melon (WBM). Using the peel of fresh WBM fruit as raw material, based on the single factor experimental results, the liquid-to-material ratio, ultrasonic time and ultrasonic power in the ultrasound-assisted extraction (UAE) process were optimized by Box-Behnken response surface. Two polysaccharide components of WBP50 and WBP75 were obtained through UAE of the optimal conditions and gradient alcohol precipitation, and their physical and chemical properties, in vitro antioxidant and hypoglycemic abilities were evaluated. The results showed that: under the conditions of liquid-to-material ratio of 16 mL/g, ultrasonic time of 16 min, and ultrasonic power of 312 W, the actual yield of crude WBM polysaccharide (WBP) was 8.33%±0.13%. The total sugar, protein, total phenols, total flavonoids, and uronic acid contents of WBP50 and WBP75 were 76.73%/73.38%, 4.78%/0.35%, 0.36%/0.25%, 2.06%/0.86% and 72.85%/49.58%, respectively. The average molecular weights were 27.59 kDa and 23.20 kDa, respectively. WBPs were mainly composed of galacturonic acid, galactose, rhamnose, arabinose, and glucose. The DPPH, ABTS+ and hydroxyl radicals scavenging abilities of WBP50 and WBP75 were 11.28/11.40 μg Trolox/mg, 40.87/44.42 μg Trolox/mg, and 52.47/99.89 U/mg, respectively. Regarding hypoglycemic ability, both WBPs had certain α-amylase inhibitory ability and strong α-glucosidase inhibitory ability. The α-glucosidase inhibition rate of WBP50 and WBP75 reached 93.34%±1.11% and 79.04%±0.76% at a concentration of 750 μg/mL. The UAE of WBP has the advantages of time saving, convenience, high efficiency and low energy consumption, and the extracted WBPs have natural antioxidant and hypoglycemic functional activities. This study lays the foundation for future structural analysis and functional mechanism research of WBPs and provides theoretical references for developing hypoglycemic products and high-value utilization of WBPs.
-
Keywords:
- wild bitter melon /
- polysaccharide /
- response surface test /
- antioxidant activity /
- α-glucosidase
-
随着经济水平的提高,人们的饮食结构发生改变,不健康的饮食方式也愈发普遍,由此引起了高脂血症、糖尿病、脂肪肝、肥胖、动脉硬化性心脑血管病等一系列慢性疾病[1]。我国目前18岁及以上居民出现胰岛素抵抗等糖尿病前期征兆的比率为13.4%,糖尿病患病率为11.9%[2−3]。糖代谢紊乱的主要诱因是肥胖和高脂饮食等非先天性因素,相较于药物,食疗具有安全性高、取材便利等优势。许多药食同源类的植物具有良好的调节血糖的功能,如绿茶、芦荟等,而苦瓜更是家喻户晓的一种天然降糖食材[4−5]。
金铃子(Momordica charantia L. Var. Abbreviata Ser),俗名癞葡萄或山苦瓜,为苦瓜的变种,与苦瓜的生物遗传相似性在80%~98%[6],在东亚和东南亚各国均有种植,于明清时期传入我国[7],由于其独特的外形与果穰清甜的味道深受大众喜爱。研究发现,金铃子整果或其有机溶剂提取物具有较强的降血糖和改善糖脂紊乱的功能[8−10]。饮食中加入金铃子可有效增强败血症小鼠的脂肪代谢,改善血糖,并减轻小鼠的炎症压力[8]。Wu等[10]的研究发现金铃子的水提物与醇提物具有DPPH自由基清除能力与铁螯合能力。但目前对金铃子的研究中缺乏对其具体功能成分的提取分离、结构解析及功能探究。多糖是广泛存在于植物细胞中的天然功能成分,苦瓜多糖具有调节糖代谢紊乱的功能活性[11],而针对金铃子多糖的提取工艺与活性研究却鲜有报道。金铃子的主要部分黄色果皮虽有较强的功能活性却味苦无法食用,因此探究并提取其果皮的多糖可以有助于提升金铃子的食用和药用价值。
超声波辅助提取法具有简单省时、耗能低的优势,在植物多糖及其他功能成分提取方面应用广泛[12]。目前尚无关于金铃子多糖的制备工艺条件的研究报道。参考苦瓜多糖的制备,新鲜苦瓜作为原料相较于干粉的多糖提取率更高[13],并且有利于多糖的规模化生产[14]。因此,本文通过响应面法对超声辅助提取金铃子多糖的各参数进行工艺优化,首次探究了金铃子多糖的体外抗氧化及降血糖活性,以期为金铃子的高值化利用及降糖产品开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
金铃子果实 青岛琅琊台集团股份有限公司,采收于2022年11月,完全成熟时开始提取;苯酚、硫酸、乙醇、甲醇、乙腈、三氯甲烷、正丁醇、N,N-二甲基甲酰胺、1-苯基-3-甲基-5-吡唑啉酮(PMP)、三氟乙酸(TFA) 均为分析纯,国药集团化学试剂有限公司;单糖标准品 上海麦克林生化科技股份有限公司;葡聚糖标品(分子量为3620、12600、30200、63300、126000、287000、496000 Da)、氨基磺酸、氢氧化钾、咔唑、氯化钠、溴化钾 Sigma-Aldrich公司;BCA蛋白浓度测定试剂盒 北京索莱宝科技有限公司;总黄酮试剂盒、总酚试剂盒 上海碧云天生物技术有限公司;DPPH试剂盒、ABTS试剂盒、羟基自由基试剂盒 南京建成生物科技有限公司;α-淀粉酶(14 U/mg)、可溶性淀粉、3,5-二硝基水杨酸(DNS)、阿卡波糖、α-葡萄糖苷酶(50 U/mg)、硝基苯酚吡喃葡萄糖苷(PNPG) 上海源叶生物科技有限公司。
XH-300A电脑微波超声波组合合成萃取仪 北京祥鹄科技发展有限公司;FD-1B-80冷冻干燥机 南京普森仪器设备有限公司;IKA T18 digital ULTRA-TURRAX数显型高速分散机 德国IKA有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;UV-2700紫外分光光度计、LC-20AD型液相色谱、BL-2200 H电子分析天平 岛津(上海)实验器材有限公司;Nicolet 6700傅里叶红外光谱仪(FT-IR) 美国热电Fisher科技有限公司;SpectraMax M2e多功能酶标仪 美国Molecular Devices公司;1260 Infinity II高效液相色谱-示差折光仪 安捷伦科技(中国)有限公司。
1.2 实验方法
1.2.1 金铃子粗多糖制备
为后期计算金铃子多糖的提取率,首先参考Yang等[13]的方法检测金铃子干重率,取少量黄色果皮称重,放入烘箱中恒温105 ℃烘干6 h,至重量稳定不变后称重,计算其干重率。
将金铃子黄色果皮切块,加入纯水后均质,超声提取多糖,离心(10000 r/min,15 min)后将上清液旋蒸浓缩,冷却至室温,加入分析级乙醇至75% ABV,4 ℃过夜静置12 h,后离心收集沉淀物,纯水复溶,定容至10 mL。
1.2.2 单因素实验
称取适量新鲜金铃子黄色果皮放入100 mL烧杯中,按液料比5:1 mL/g加入去离子水均质(15000 r/min,15 min),在50 ℃以200、250、300、350、400 W功率超声提取10 min,提取结束后离心(10000 r/min,15 min,20 ℃),将上清液旋蒸浓缩(50 ℃、0.0 MPa),冷却至室温,加入乙醇至75%,4 ℃醇沉过夜。离心(10000 r/min,15 min,20 ℃)后得到沉淀,用去离子水复溶至20 mL,苯酚硫酸法测其含糖量[15]并计算粗多糖提取率;在最佳超声功率、液料比5:1 mL/g的条件下考察超声时间5、10、15、20、25 min对粗多糖提取率的影响;在最佳超声功率、超声时间的条件下考察液料比5:1、10:1、15:1、20:1和25:1 mL/g对粗多糖提取率的影响。参考Yang等[13]的方法计算新鲜金铃子果皮粗多糖的提取率:
DW(%)=WdW0×100 (1) X(%)=C×VDW×W (2) 式中:DW为金铃子干重率,%;W0为金铃子湿重,g;Wd为干燥后金铃子重量,g;X为金铃子粗多糖的提取率,%;C为由标准曲线计算所得的多糖浓度,g/L;V为复溶时定容体积,L;W为称取的金铃子果皮重量,g。
1.2.3 响应面设计试验
根据单因素实验结果,以金铃子粗多糖提取率为响应值,采用Design Expert 8.0软件根据Box-Behnken设计原则进行实验,优化金铃子粗多糖的超声辅助提取工艺,因素水平设计表如表1所示。
表 1 响应面优化设计因素水平表Table 1. Response surface optimization test factor level水平 A:液料比(mL/g) B:超声时间(min) C:超声功率(W) −1 10:1 10 250 0 15:1 15 300 1 20:1 20 350 1.2.4 金铃子粗多糖的纯化
在响应面优化后的最佳条件下超声辅助提取金铃子粗多糖,离心浓缩后对上清液进行分级醇沉(50%、75%)。去离子水复溶后用Sevage法去除蛋白质与色素,即将多糖溶液与Sevage试剂(三氯甲烷:正丁醇=3:1,V/V)按3:1比例混合振荡,离心取上层水相,重复至两相界面处无明显蛋白质残留,旋蒸浓缩去除残留的Sevage试剂。将多糖溶液转移至3500 Da透析袋,在4 ℃去离子水中透析48 h,真空冷冻干燥后得到两个金铃子多糖组分WBP50和WBP75,称重后计算多糖得率。
纯化多糖得率(%)=mDW×W (3) 式中:DW为金铃子干重率,%;W为称取的金铃子果皮重量,g;m为多糖重量,g。
1.2.5 化学组成分析
1.2.5.1 多糖含量
采用苯酚硫酸法检测多糖含量[15],绘制标准曲线y=0.9278x+0.0589 (R2=0.9994),x为半乳糖醛酸标准品浓度,单位为mg/mL,y为吸光度值。
1.2.5.2 糖醛酸含量
采用硫酸咔唑法[16]测定,以半乳糖醛酸为标准品,绘制标准曲线y=1.2208x+0.0339(R2=0.9924),x为糖醛酸浓度,单位为mg/mL,y为吸光度值。
1.2.5.3 蛋白质含量
采用BCA试剂盒测定,以牛血清白蛋白(BSA)为标准品,按试剂盒说明书定量金铃子多糖中的蛋白质含量,绘制标准曲线y=2.4201x+0.6857(R2=0.991),x为蛋白质含量,单位为mg/mL,y为吸光度值。
1.2.5.4 总酚含量
采用商用总酚试剂盒,以没食子酸为标准品,按试剂盒说明书定量金铃子多糖中的总酚类含量,绘制标准曲线y=0.0052x+0.0519(R2=0.995),x为总酚含量,单位为mg/mL,y为吸光度值。
1.2.5.5 总黄酮含量
采用总黄酮试剂盒,以芦丁为标准品,按试剂盒说明书定量金铃子多糖中的黄酮类含量,绘制标准曲线y=0.0011x+0.0453(R2=0.9989),x为黄酮类含量,单位为mg/mL,y为吸光度值。
1.2.6 分子量分布及单糖组成
1.2.6.1 分子量分布
采用高效液相凝胶色谱法(HPGPC)[17],将金铃子多糖用0.1 mol/L的NaCl溶液配制成8 mg/mL的样品溶液,0.45 μm水系膜过滤后进样。色谱条件:凝胶色谱柱为TSK-Gel G4000 PWXL (7.8 mm×300 mm),流动相为0.1 mol/L NaCl溶液,流速为0.5 mL/min,洗脱时间40 min,进样量为10 μL,柱温为35 ℃。5 mg/mL的葡聚糖标品溶液进样后以其分子量对数值为纵坐标,出峰时间为横坐标拟合得到标准曲线,y=−0.6986x+14.949(R2=0.9953),y为分子量对数(log Mw),x为保留时间(min)。
1.2.6.2 单糖组成
采用PMP柱前衍生化HPLC法并稍加改进[18],精确称取10 mg多糖样品至安培瓶中,加入2.0 mL TFA (2 mol/L),充氮封管,于120 ℃酸解4 h。取出加入甲醇氮吹挥干TFA,加3.0 mL水复溶。精确吸取250 μL样品溶液或混标溶液到5 mL EP管中,加入250 μL NaOH(0.6 mol/L),500 μL PMP-甲醇溶液(0.4 mol/L),70 ℃反应1 h。冷却后加入500 μL HCl(0.3 mol/L)中和,再加入1 mL三氯甲烷涡旋混匀,离心(3000 r/min,10 min)取上清液,萃取3次后用0.45 μm滤膜过滤后进样。色谱条件:色谱柱Xtimate C18柱(4.6 mm×200 mm),流动相A为0.05 mol/L磷酸二氢钾溶液(pH6.70),流动相B为乙腈,比例为83%和17%,检测波长为紫外250 nm,柱温为30 ℃,进样量为20 μL,流速为1.0 mL/min,检测时间50 min。
1.2.7 紫外及红外光谱分析
1.2.7.1 紫外光谱分析
参考Tan等[18]的方法,配制浓度为2 mg/mL的两种金铃子多糖溶液,在200~600 nm波长范围内扫描多糖溶液的紫外吸收光谱。
1.2.7.2 红外光谱分析
采用溴化钾(KBr)压片法[19],将金铃子多糖分别与干燥KBr混合(1:200),研磨后压片,在450~4000 cm−1范围内扫描红外光谱。
1.2.8 体外活性分析
1.2.8.1 抗氧化活性
采用DPPH、ABTS及羟基自由基检测试剂盒测定两种多糖对DPPH、ABTS+及羟基自由基的清除能力。
1.2.8.2 α-淀粉酶抑制活性
参考Wu等[20]的方法,向100 μL的多糖溶液(12.5、25、50、125、250、500 μg/mL)中加入100 μL的α-淀粉酶(30 U/mL,pH6.8 PBS),37 ℃振荡孵育10 min。加入200 μL淀粉溶液(0.5%,w/v)后继续37 ℃孵育10 min。取100 μL混合液,加入400 μL DNS试剂,沸水浴加热5 min。冷却后在540 nm处测紫外吸光值。以阿卡波糖为阳性对照。
α-淀粉酶抑制活性(%)=(1−Asample−AcontrolAblank−Acontrol)×100 (4) 式中:Asample为样品、淀粉溶液、α-淀粉酶和DNS试剂的反应液的吸光值;Acontrol为PBS、淀粉溶液和DNS试剂的反应液的吸光值;Ablank为PBS、淀粉溶液、α-淀粉酶和DNS试剂的反应液的吸光值。
1.2.8.3 α-葡萄糖苷酶抑制活性测定
参考Wu等[20]的方法,向200 μL的多糖溶液(50、125、250、500、750、1000 μg/mL)加入40 μL的α-葡萄糖苷酶(0.5 U/mL,pH6.8 PBS),30 ℃振荡孵育10 min。加入100 μL PNPG(4 mmol/L,pH6.8 PBS)后继续在37 ℃孵育10 min。冷却后在405 nm处测紫外吸光值。以阿卡波糖为阳性对照。
α-葡萄糖苷酶抑制活性(%)=(1−Asample−AcontrolAblank−Acontrol)×100 (5) 式中:Asample为样品、PNPG、α-葡萄糖苷酶的反应液的吸光值;Acontrol为PBS和PNPG的反应液的吸光值;Ablank为PBS、PNPG、α-葡萄糖苷酶的反应液的吸光值。
1.3 数据处理
上述实验进行三次重复。使用Excel 2016(Microsoft)进行数据初步分析,使用SPSS 17.0(SPSS Inc.,Chicago,IL,USA)对单因素实验结果进行单因素方差分析(one-way ANOVA)和Tukey’s test检验,对抗氧化实验结果进行t-test分析,显著性水平P<0.05。数据以平均值±标准偏差形式表示。使用Design Expert 8.0软件进行响应面试验设计和数据分析。使用OriginPro 9.0进行绘图。
2. 结果与分析
2.1 单因素实验结果
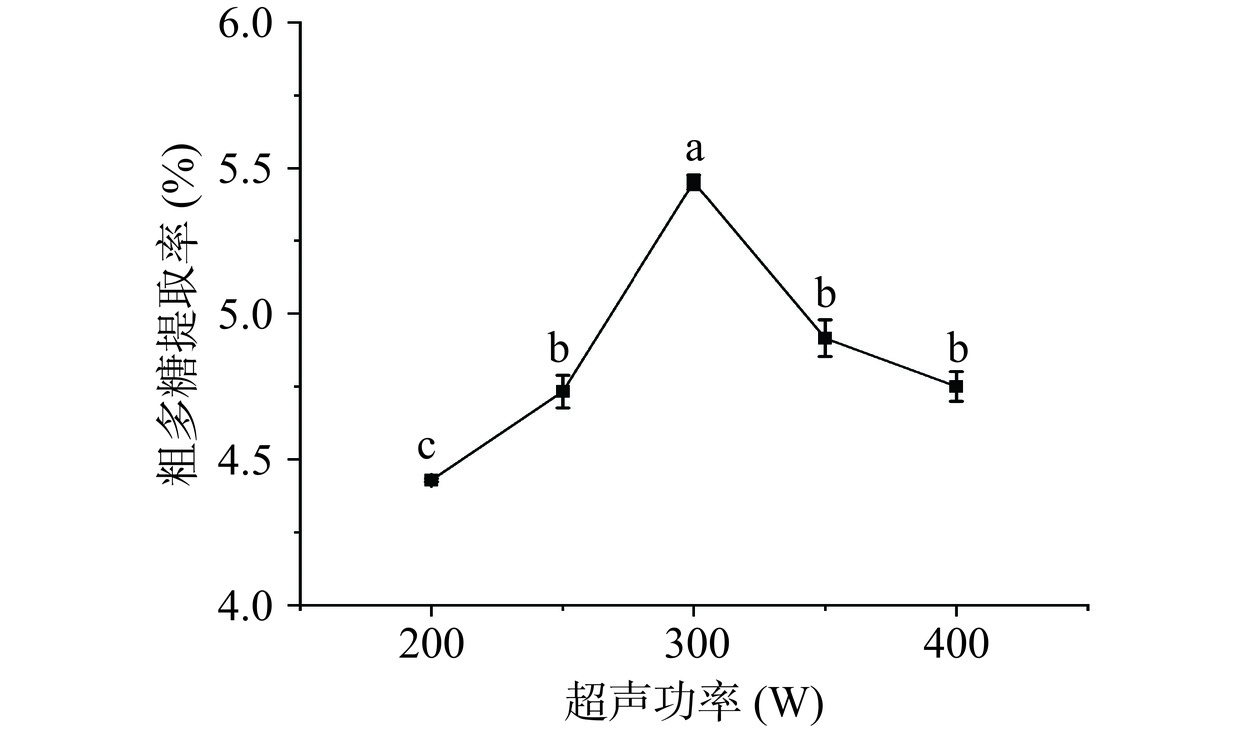
2.1.1 超声功率对金铃子粗多糖提取率的影响
超声功率是影响超声辅助提取多糖提取率的重要因素之一,如图1所示,多糖提取率随着超声功率的增长呈现先升高后下降的趋势,在超声功率达到300 W时提取率为最高。超声通过空化效应和机械效应促进植物组织破碎,从而提高多糖的溶解度[21]。而粗多糖提取率在超声功率达到300 W后逐渐下降可能是由于较高的超声功率导致大量无用气泡产生,导致散射衰减增加,空化强度降低,提取率下降[19]。也可能是大功率的机械效应使得糖苷键断裂,破坏多糖结构,也会降低提取率。单因素实验结果表明金铃子粗多糖提取的最佳超声功率为300 W。
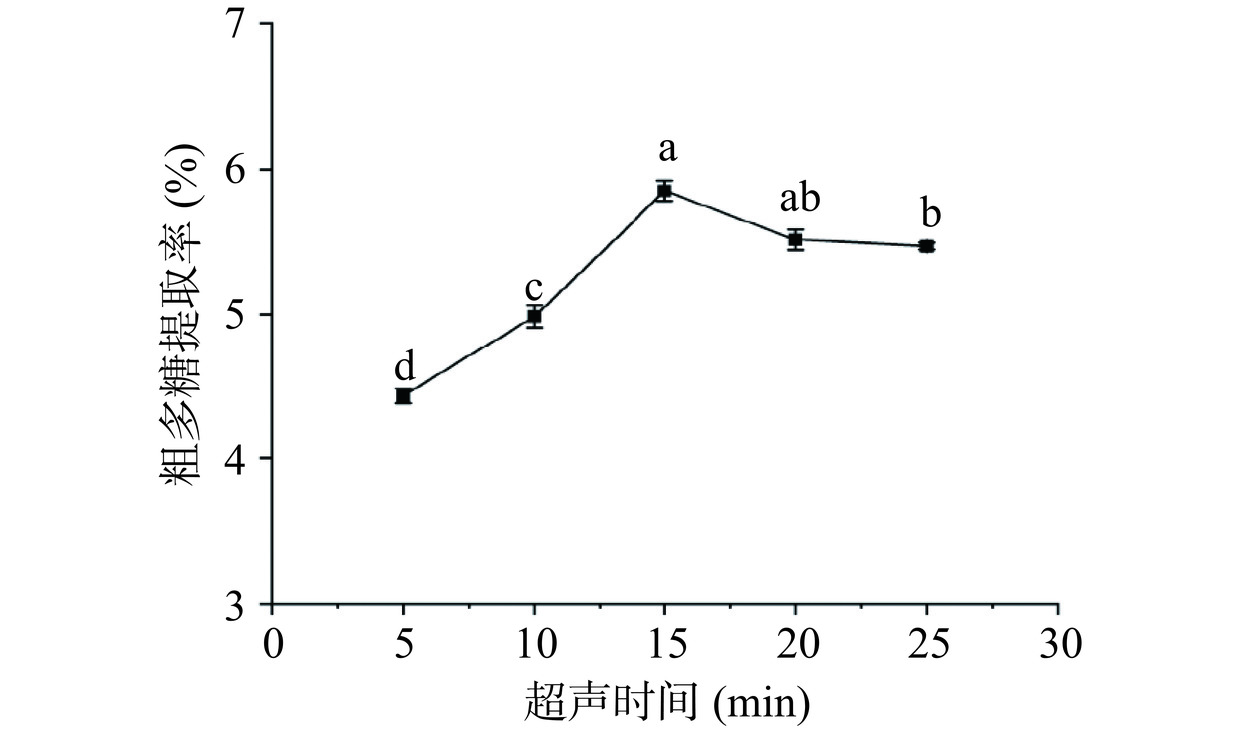
2.1.2 超声时间对金铃子粗多糖提取率的影响
超声处理可以增加植物细胞壁破裂的机会,从而促进了更多多糖的释放。而超声时间过长可能导致目标多糖发生热降解,反而降低提取效率。如图2所示,多糖提取率随着超声时间的增长呈现先缓慢升高后下降的趋势,在超声时间达到15 min时提取率为最高。刚开始随着超声时间增加,超声引起的空化效应和热效应增大,所以多糖的溶解度和在水中的扩散速率越大。15 min后由于超声波具有较强的机械剪切作用,长时间超声可能会使多糖结构遭到破坏,使得提取率下降[21]。单因素实验结果表明金铃子粗多糖提取的最佳超声时间为15 min。
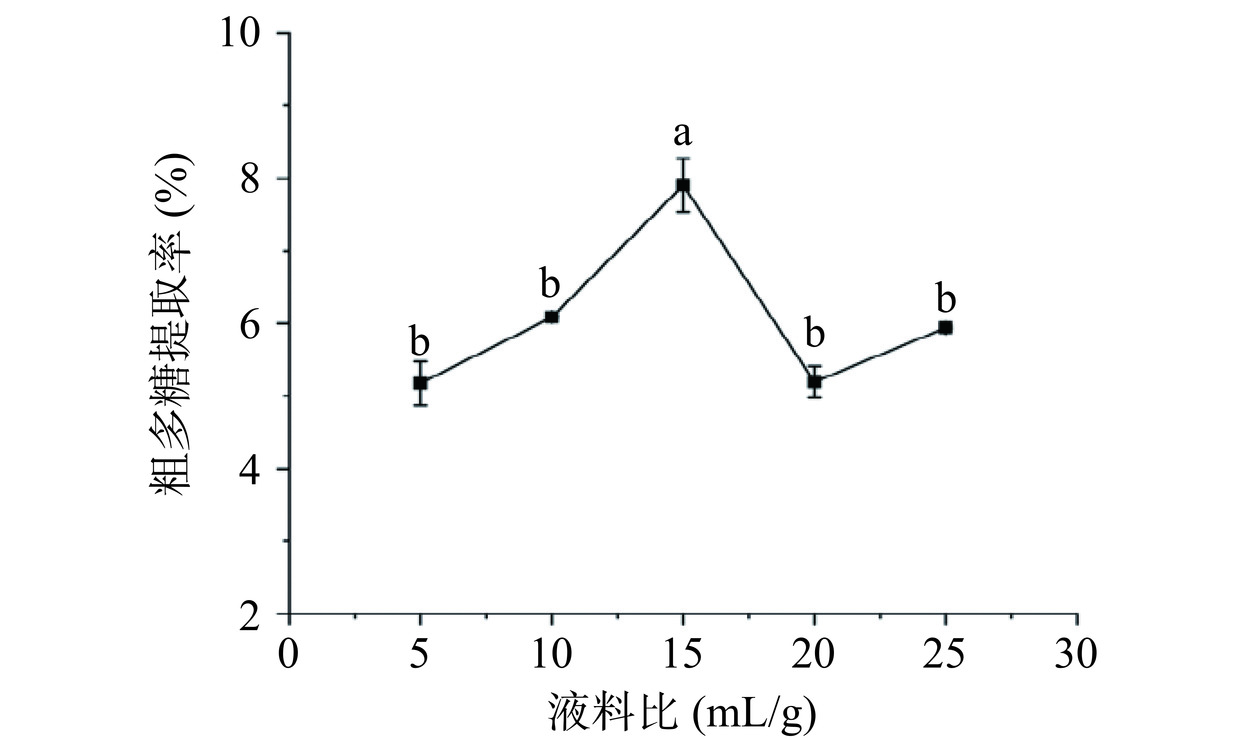
2.1.3 液料比对金铃子粗多糖提取率的影响
适度提升液料比可以使更多的溶剂更有效地渗透植物材料,有助于提高多糖的提取率。如图3所示,金铃子粗多糖的提取率随着液料比的变化呈现先升高后下降的趋势,在液料比为15 mL/g时提取率为最高。刚开始由于增加液料比会提升植物组织内外的多糖浓度差,从而增加多糖的扩散和溶出速率,多糖提取率随着液料比的增加而提升。而在达到最佳液料比后加大水量,反而可能会延长后续浓缩时长,增加多糖被破坏的几率,从而导致提取率下降。单因素实验结果表明金铃子粗多糖提取的最佳液料比为15:1 mL/g。
2.2 响应面优化试验
响应面试验结果如表2所示。以A液料比、B超声时间、C超声功率为自变量,以金铃子粗多糖提取率为响应值Y,利用Design Expert 8.0软件对试验数据进行二次响应面分析及拟合,得到回归方程为:Y=8.55+1.00A+0.90B+0.58C−0.81AB+0.34AC+0.46BC−1.67A2−1.95B2−1.53C2。
表 2 金铃子粗多糖提取响应面优化试验设计与结果Table 2. Response surface test design and results of crude WBP extraction optimization试验号 A
液料比B
超声时间C
超声功率Y
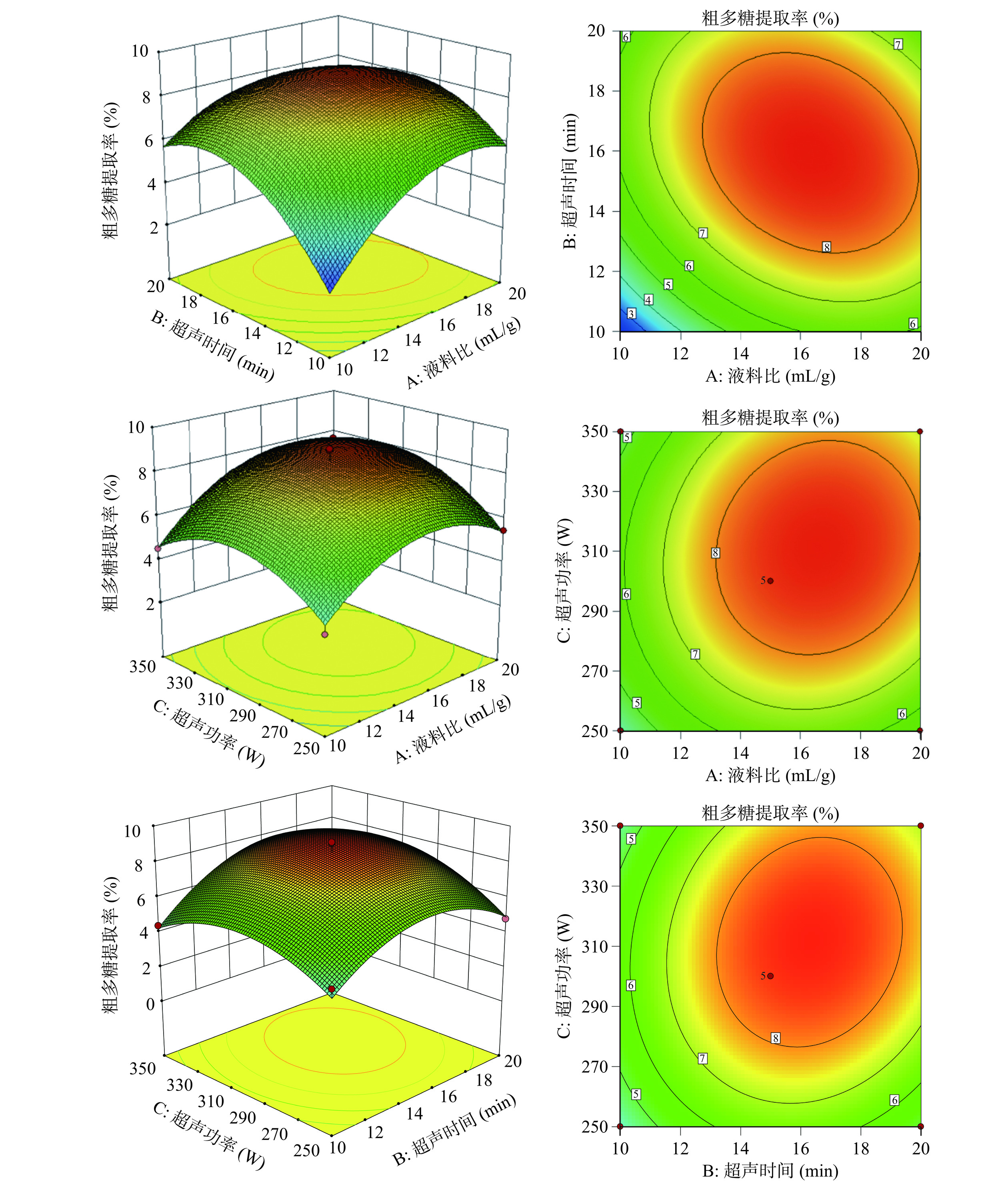
提取率(%)1 1 1 0 6.09 2 0 0 0 9.10 3 0 −1 1 4.41 4 0 1 −1 4.80 5 −1 0 1 4.54 6 −1 0 −1 3.72 7 1 −1 0 5.32 8 0 1 1 6.54 9 0 0 0 8.04 10 −1 −1 0 2.14 11 1 0 −1 5.47 12 0 −1 −1 4.50 13 0 0 0 8.03 14 −1 1 0 6.16 15 1 0 1 7.65 16 0 0 0 9.05 17 0 0 0 8.53 如表3所示,回归模型对金铃子粗多糖提取率的影响达到极显著水平(P<0.001);失拟项P=0.3251>0.05,不显著,模型选用合理;模型的决定系数R2=0.9633,表明该回归模型具有较好的拟合效果及良好的代表性;模型的校正决定系数R2adj=0.9161,使用该模型可解释91.61%的多糖提取率的变化,表明该回归模型能够准确预测实际值,实验误差小,可用于分析和预测超声辅助提取金铃子多糖的流程和工艺优化。由P值可知,A2、B2、C2达到极显著水平(P<0.001),A、B达到非常显著水平(P<0.01),C、AB达到显著水平(P<0.05)。各因素对金铃子粗多糖提取率影响为液料比最大,超声时间和超声功率次之。
表 3 金铃子粗多糖提取率二项式回归模型的方差分析Table 3. Variance analysis of quadratic regression model for the extraction rate of crude WBP来源 平方和 自由度 均方 F值 P值 显著性 模型 63.20 9 7.02 20.40 0.0003 *** A 7.93 1 7.93 23.05 0.0020 ** B 6.53 1 6.53 18.97 0.0033 ** C 2.70 1 2.70 7.84 0.0266 * AB 2.65 1 2.65 7.71 0.0275 * AC 0.47 1 0.47 1.38 0.2793 ns BC 0.83 1 0.83 2.41 0.1643 ns A2 11.75 1 11.75 34.13 0.0006 *** B2 16.05 1 16.05 46.63 0.0002 *** C2 9.92 1 9.92 28.82 0.0010 *** 失拟项 1.31 3 0.44 1.59 0.3251 ns 残差 1.10 4 0.28 ns 注:*表示影响显著(P<0.05),**表示影响非常显著(P<0.01),***表示影响极显著(P<0.001),ns表示不显著。 如图4所示,AB具有显著交互作用,其曲面有极大值且坡面较陡峭,等高线图呈椭圆形,另外从图中可看出AC、BC也存在一定的交互作用,但并不显著,与表3中金铃子粗多糖提取率二项式回归模型方差分析的结论一致。
通过Design-Expert 8.0软件对二项式模型进行预测,超声辅助提取金铃子粗多糖的最佳工艺参数为:液料比16.37 mL/g、超声功率312.469 W、超声时间16.017 min。在此条件下,金铃子粗多糖提取率的理论值可达8.852%。考虑实验的可操作性,将最优工艺条件修正为液料比16 mL/g,超声功率312 W,超声时间16 min。在最优条件下重复3次平行实验,得到提取率平均值为8.33%±0.13%,与理论值的相对误差为5.92%,表明本模型下可以取得较好的金铃子粗多糖提取率。
2.3 金铃子多糖的制备
两个多糖组分WBP50、WBP75得率分别是4.77%±0.23%和1.42%±0.08%,WBP50呈韧性很强的白色柳絮状,WBP75呈更具粉末感的白色棉花状。
2.4 金铃子多糖的化学组成
金铃子多糖的化学组成结果见表4, 根据预实验结果发现多糖中的糖醛酸含量较高,如大多数研究中以葡萄糖作为总糖检测标准品会造成误差,因此本研究以半乳糖醛酸作为总糖检测的标准品。通过苯酚硫酸法检测金铃子多糖的总糖含量,WBP50和WBP75的总糖含量分别为76.73%、73.38%,纯度均较高,可以用于之后的结构检测和功能活性研究。采用BCA蛋白试剂盒检测到蛋白质含量分别为4.78%、0.35%,蛋白质去除较为彻底;采用商用试剂盒检测到金铃子多糖的总酚和总黄酮含量较少,分别为0.36%、0.25%和2.06%、0.86%,也进一步说明多糖纯度较高,其后续体现的生物活性主要是其中的多糖组分发挥作用;通过硫酸咔唑法检测到金铃子多糖的糖醛酸含量较高,WBP50和WBP75的糖醛酸含量分别为72.85%和49.58%,表示结构中的酸性基团含量较高。果胶是广泛存在于植物细胞壁的一类酸性多糖,主要由半乳糖醛酸单元组成,具有调节肠道菌群、增强免疫等生理活性[22−23]。果胶多糖的糖醛酸含量可高达50%~80%,其含量主要取决于果胶来源和提取工艺[24−25]。鉴于金铃子果皮中提取的多糖具有极高的糖醛酸含量,它们很可能属于果胶多糖的范畴。
表 4 金铃子多糖的化学组成Table 4. Chemical composition of polysaccharides from wild bitter melons化学组成 WBP50 WBP75 总糖(%) 76.73±2.40 73.38±2.02 蛋白质(%) 4.78±0.02 0.35±0.04 总酚(%) 0.36±0.02 0.25±0.02 总黄酮(%) 2.06±0.07 0.86±0.01 糖醛酸(%) 72.85±0.02 49.58±0.01 2.5 分子量分布及单糖组成
2.5.1 分子量分布
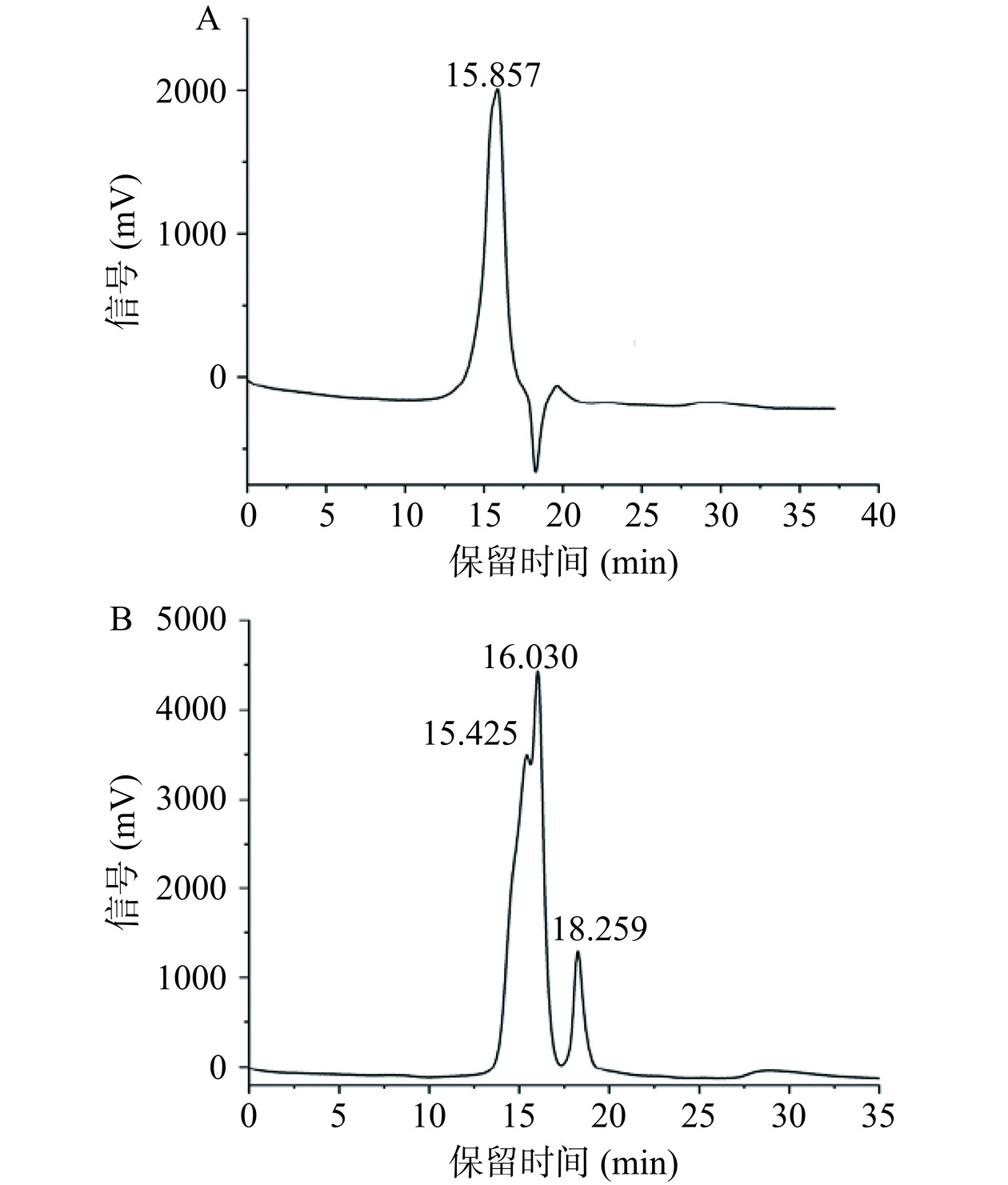
本研究采用HPGPC检测金铃子多糖的纯度与平均分子量,如图5所示,WBP50主峰的保留时间为15.857 min;WBP75主峰的保留时间为16.030、15.425和18.259 min,根据标准曲线(R²=0.9953)计算得平均分子量分别为27.59 kDa和23.20 kDa,符合分级醇沉先大后小的规律;由此可知两种多糖并未达到均一,如需分析其结构则需要进一步分离纯化。
2.5.2 单糖组成
本研究采用PMP柱前衍生化HPLC法检测金铃子多糖的单糖组成,结果见表5。金铃子多糖的主要单糖组成与苦瓜多糖较为相似[26],但是各单糖的含量较为不同。与Gao等[27]对苦瓜多糖的研究相似的是,金铃子多糖中的半乳糖醛酸的含量同样很高,这与2.4中测得糖醛酸含量较高结果一致。在低浓度乙醇沉淀下得到的多糖糖醛酸含量较高,随着乙醇浓度增加,糖醛酸的含量逐渐减少[28]。
表 5 金铃子多糖的单糖分布Table 5. Monosaccharide composition of WBPs单糖组成(摩尔比) WBP50 WBP75 甘露糖 6.77 3.33 核糖 1.00 1.00 鼠李糖 49.10 24.06 葡萄糖醛酸 14.87 12.48 半乳糖醛酸 347.96 77.11 葡萄糖 21.45 30.60 半乳糖 54.59 85.15 木糖 15.09 25.57 阿拉伯糖 31.52 34.83 岩藻糖 5.86 2.42 2.6 紫外及红外光谱分析
2.6.1 紫外光谱分析
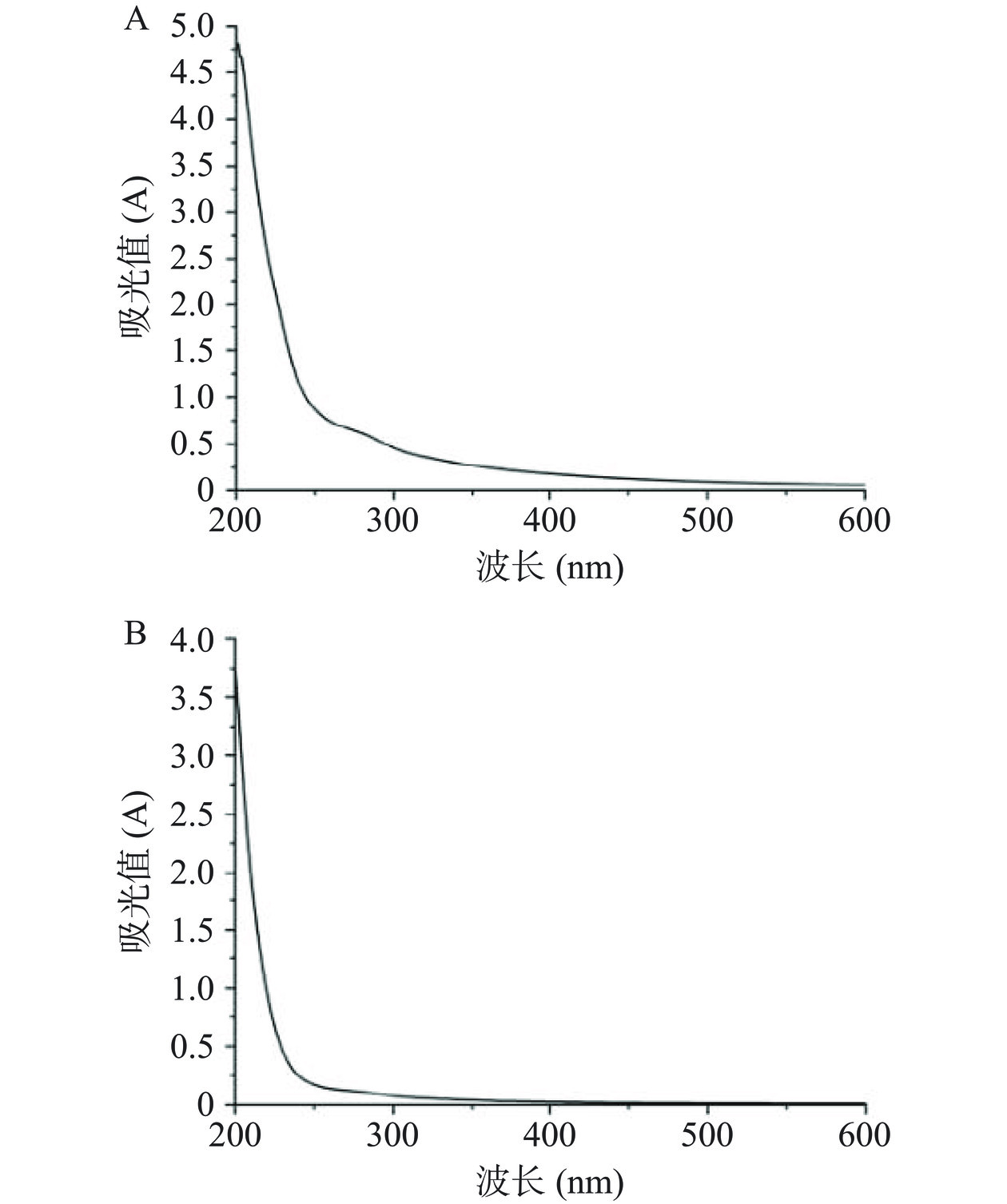
多糖不具备紫外吸收特征,因此通常采用紫外光谱检测多糖纯度,是否在提取过程中有蛋白质残留。如图6所示,WBP75于260 nm和280 nm处并没有明显的紫外吸收峰,表明WBP75几乎不含核酸和蛋白质,纯度较高,蛋白质去除较为彻底;而WBP50于280 nm有紫外吸收峰,这与2.4中化学组成测定结果基本一致。如需进一步分析WBP50多糖结构则需继续分离纯化。
2.6.2 红外光谱分析
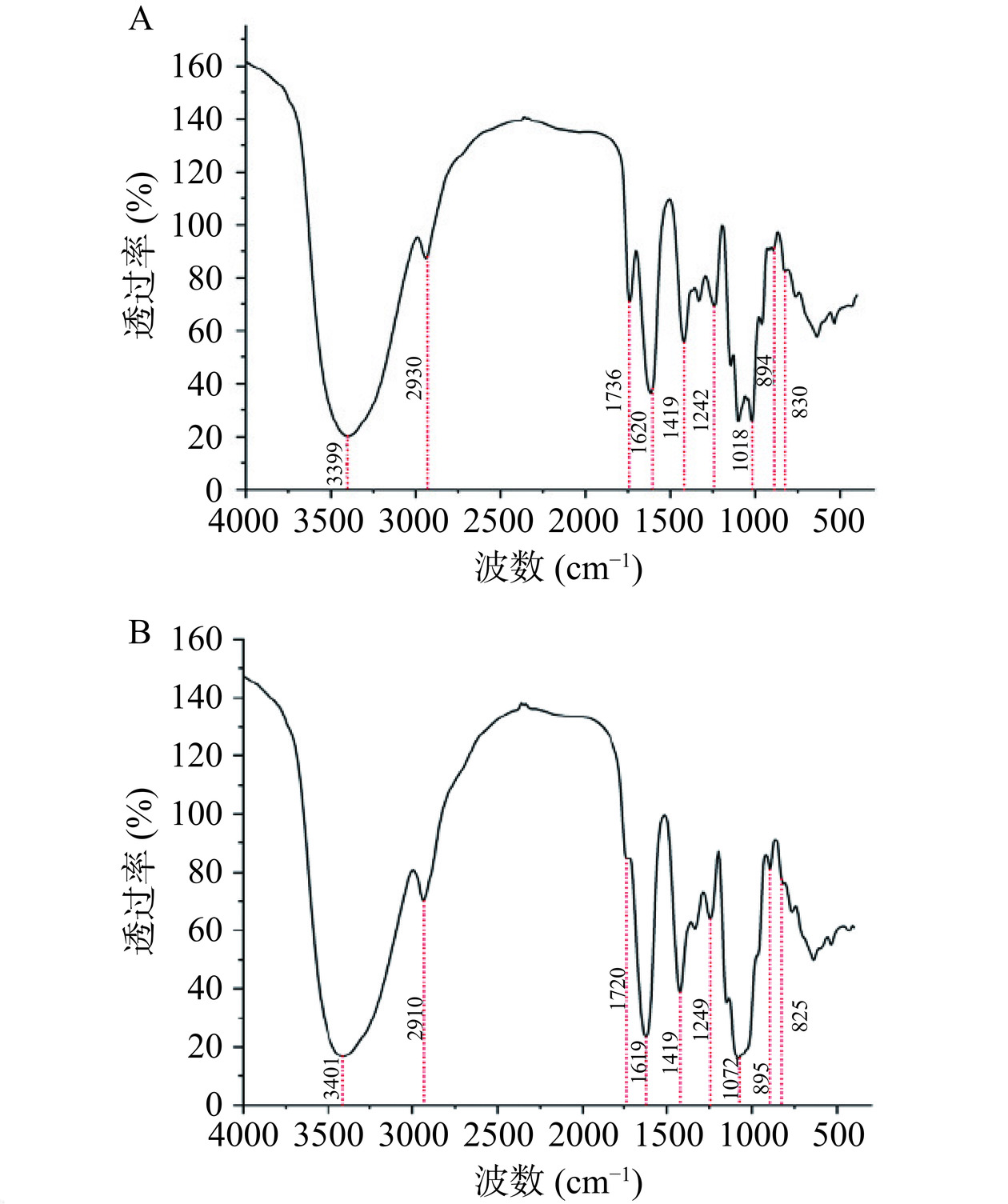
一般采用红外光谱法解析多糖的初级结构,通过得到的红外特征峰来识别多糖的各种官能团,确定多糖具有哪些糖苷键类型与构型。如图7所示,WBP50和WBP75显示出多个多糖的典型信号峰:在3399/3401 cm−1和2930/2910 cm−1处的吸收峰分别代表多糖上O-H键和C-H键的伸缩振动信号[29];1620/1619 cm−1和1419 cm−1处的吸收峰分别代表多糖上羧基与C-H键的弯曲振动,再次证明其为酸性多糖[30];1242/1249 cm−1附近的吸收峰代表多糖上羧基内C=O键的伸缩振动[31],也有可能为S=O键的伸缩振动,该多糖可能具有硫酸根[30];1018/1072 cm−1处的吸收峰代表多糖上吡喃环的C-O-C键和羟基[32];894/895 cm−1处的吸收峰对应β-构型,而830/825 cm−1处的吸收峰对应α-构型,表示该多糖同时具有α-和β-端基碳[33]。
2.7 体外活性分析
2.7.1 抗氧化活性
氧化应激与人体糖脂代谢紊乱密切相关,是导致胰岛素抵抗和高血糖症的重要原因之一[34],因此抗氧化活性也是挖掘天然降血糖功能因子的重要指标。如表6所示,金铃子多糖WBP50和WBP75对DPPH、ABTS+和羟自由基均具有一定的清除能力,分别为11.28/11.40 μg Trolox/mg、40.87/44.42 μg Trolox/mg和52.47/99.89 U/mg。U为抑制羟自由基能力单位:规定每毫升样品在37 ℃下反应1 min,使反应体系中H2O2浓度降低1 mmol/L为1 U。WBP75的抗氧化能力更高,分级醇沉多糖具有分子量先大后小的规律,WBP75的高抗氧活性可能由于其分子量比WBP50更低[35]。
表 6 金铃子多糖WBP50和WBP75的抗氧化活性Table 6. Antioxidant activities of WBP50 and WBP75样品 DPPH自由基清除
能力(μg Trolox/mg)ABTS+自由基清除
能力(μg Trolox/mg)羟自由基清除
能力(U/mg)WBP50 11.28±0.43a 40.87±0.21a 52.47±0.89b WBP75 11.40±0.51a 44.42±1.35a 99.89±0.19a 注:同列不同字母上标表示在P<0.05水平上具有显著性差异。 2.7.2 降糖活性
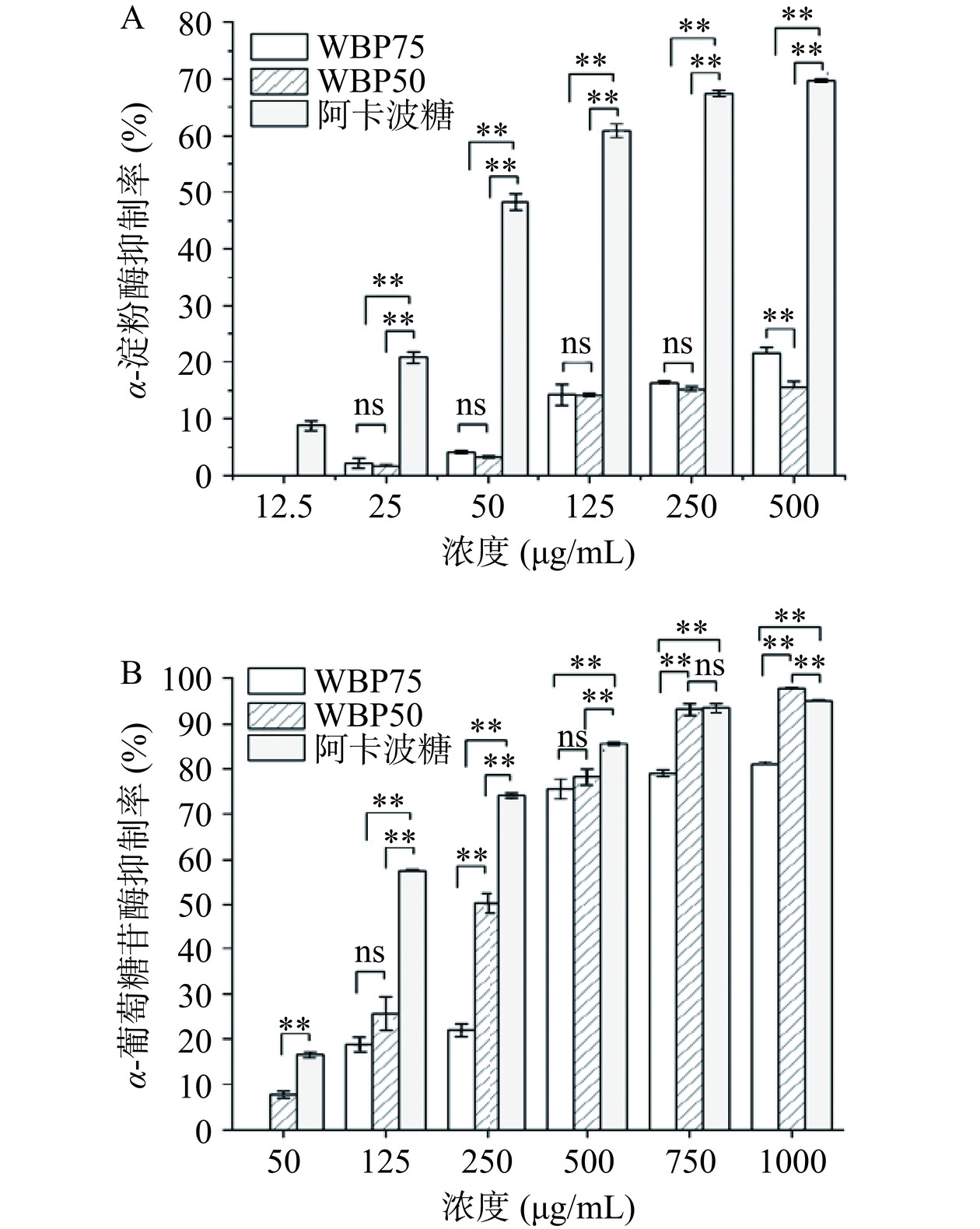
α-淀粉酶和α-葡萄糖苷酶能水解淀粉和糖原的α-1,4-糖苷键,以及低聚糖的α-1,6-糖苷键,帮助人体将食用的碳水化合物转化成葡萄糖被肠道吸收[36]。而对于两种消化酶活性的抑制作用一直是体外降血糖活性的重要评价指标,降低碳水化合物分解成葡萄糖的转化速率,从而减缓餐后血糖上升。如图8所示,两种多糖具有一定的α-淀粉酶抑制能力和较强的α-葡萄糖苷酶抑制能力。WBP50和WBP75在浓度500 μg/mL时的α-淀粉酶抑制率分别为15.54%±0.95%和21.58%±0.93%;α-葡萄糖苷酶抑制率分别为78.45%±1.49%和75.62%±2.23%。WBP50在浓度750 μg/mL时对α-葡萄糖苷酶的抑制率可达93.34%±1.11%,与阳性对照无显著性差异(P>0.05),而在1000 μg/mL时对α-葡萄糖苷酶的抑制率显著高于阳性对照(P<0.01)。研究表明,α-淀粉酶和α-葡萄糖苷酶的抑制活性与多糖中游离羧基和羟基的存在有关,游离羧基和羟基可能与消化酶的氨基酸残基相互作用,从而导致酶失活[37]。高糖醛酸含量的多糖一般具有较强的抗氧化及降血糖活性[38],金铃子多糖的体外抗氧化与降糖活性可能与其高糖醛酸含量高度相关。由此可见金铃子多糖是一种具有降血糖潜力的天然植物多糖。
3. 结论
本文以金铃子鲜果为原料,对三个影响金铃子粗多糖提取率的显著条件液料比、超声时间和超声功率进行了单因素实验,并进一步通过响应面试验对多糖制备条件进行了优化,获得最佳液料比16 mL/g,超声时间16 min,超声功率312 W,该条件下粗多糖的提取率可达8.33%±0.13%。在最佳提取条件下进行超声辅助萃取、分级醇沉、去蛋白、透析冻干后得到两个多糖组分WBP50和WBP75,并且检测了其总糖、蛋白质、总酚、总黄酮和糖醛酸含量。两个多糖组分的平均分子量分别为27.59 kDa和23.20 kDa,主要由半乳糖醛酸、半乳糖、鼠李糖、阿拉伯糖、葡萄糖组成。两个金铃子多糖组分均为酸性多糖,都具有一定的抗氧化能力,而WBP75具有更强的羟基自由基清除能力;在降糖活性方面,两种多糖的α-葡萄糖苷酶抑制能力都较强,因此具有开发成降血糖的功能性食品的潜力。本研究局限于金铃子多糖的提取工艺优化与体外活性初探,缺乏对多糖结构的解析以及进一步的体内活性评价和作用机制研究,这将会是今后研究的重点内容。
-
表 1 响应面优化设计因素水平表
Table 1 Response surface optimization test factor level
水平 A:液料比(mL/g) B:超声时间(min) C:超声功率(W) −1 10:1 10 250 0 15:1 15 300 1 20:1 20 350 表 2 金铃子粗多糖提取响应面优化试验设计与结果
Table 2 Response surface test design and results of crude WBP extraction optimization
试验号 A
液料比B
超声时间C
超声功率Y
提取率(%)1 1 1 0 6.09 2 0 0 0 9.10 3 0 −1 1 4.41 4 0 1 −1 4.80 5 −1 0 1 4.54 6 −1 0 −1 3.72 7 1 −1 0 5.32 8 0 1 1 6.54 9 0 0 0 8.04 10 −1 −1 0 2.14 11 1 0 −1 5.47 12 0 −1 −1 4.50 13 0 0 0 8.03 14 −1 1 0 6.16 15 1 0 1 7.65 16 0 0 0 9.05 17 0 0 0 8.53 表 3 金铃子粗多糖提取率二项式回归模型的方差分析
Table 3 Variance analysis of quadratic regression model for the extraction rate of crude WBP
来源 平方和 自由度 均方 F值 P值 显著性 模型 63.20 9 7.02 20.40 0.0003 *** A 7.93 1 7.93 23.05 0.0020 ** B 6.53 1 6.53 18.97 0.0033 ** C 2.70 1 2.70 7.84 0.0266 * AB 2.65 1 2.65 7.71 0.0275 * AC 0.47 1 0.47 1.38 0.2793 ns BC 0.83 1 0.83 2.41 0.1643 ns A2 11.75 1 11.75 34.13 0.0006 *** B2 16.05 1 16.05 46.63 0.0002 *** C2 9.92 1 9.92 28.82 0.0010 *** 失拟项 1.31 3 0.44 1.59 0.3251 ns 残差 1.10 4 0.28 ns 注:*表示影响显著(P<0.05),**表示影响非常显著(P<0.01),***表示影响极显著(P<0.001),ns表示不显著。 表 4 金铃子多糖的化学组成
Table 4 Chemical composition of polysaccharides from wild bitter melons
化学组成 WBP50 WBP75 总糖(%) 76.73±2.40 73.38±2.02 蛋白质(%) 4.78±0.02 0.35±0.04 总酚(%) 0.36±0.02 0.25±0.02 总黄酮(%) 2.06±0.07 0.86±0.01 糖醛酸(%) 72.85±0.02 49.58±0.01 表 5 金铃子多糖的单糖分布
Table 5 Monosaccharide composition of WBPs
单糖组成(摩尔比) WBP50 WBP75 甘露糖 6.77 3.33 核糖 1.00 1.00 鼠李糖 49.10 24.06 葡萄糖醛酸 14.87 12.48 半乳糖醛酸 347.96 77.11 葡萄糖 21.45 30.60 半乳糖 54.59 85.15 木糖 15.09 25.57 阿拉伯糖 31.52 34.83 岩藻糖 5.86 2.42 表 6 金铃子多糖WBP50和WBP75的抗氧化活性
Table 6 Antioxidant activities of WBP50 and WBP75
样品 DPPH自由基清除
能力(μg Trolox/mg)ABTS+自由基清除
能力(μg Trolox/mg)羟自由基清除
能力(U/mg)WBP50 11.28±0.43a 40.87±0.21a 52.47±0.89b WBP75 11.40±0.51a 44.42±1.35a 99.89±0.19a 注:同列不同字母上标表示在P<0.05水平上具有显著性差异。 -
[1] PAN X F, WANG L M, PAN A. Epidemiology and determinants of obesity in China[J]. Lancet Diabetes Endocrinol,2021,9:373−392. doi: 10.1016/S2213-8587(21)00045-0
[2] 中国居民营养与慢性病状况报告(2020年)[R]. 国家卫生和计划生育委员会疾病预防控制局. 北京:人民卫生出版社, 2020. [Report on Chinese residents’ chronic diseases and nutrition (2020)[R]. National Health and Family Planning Commission of the People's Republic of China. Beijing:People's Medical Publishing House, 2020.] Report on Chinese residents’ chronic diseases and nutrition (2020)[R]. National Health and Family Planning Commission of the People's Republic of China. Beijing: People's Medical Publishing House, 2020.
[3] International diabetes federation. IDF diabetes atlas (10th edition)[R]. Brussels:Belgium, 2021.
[4] NAZARIAN S Z, SEWELL R D E, LORIGOOINI Z, et al. Medicinal plants with multiple effects on diabetes mellitus and its complications:A systematic review[J]. Curr Diab Rep,2018,18(10):72. doi: 10.1007/s11892-018-1042-0
[5] BEIDOKHTI M N, JAGER A K. Review of antidiabetic fruits, vegetables, beverages, oils and spices commonly consumed in the diet[J]. J Ethnopharmacol,2017,201:26−41. doi: 10.1016/j.jep.2017.02.031
[6] HSIAO C Y, CHEN Y M, HSU Y J, et al. Supplementation with Hualian No. 4 wild bitter gourd (Momordica charantia Linn. var. abbreviata Ser.) extract increases anti-fatigue activities and enhances exercise performance in mice[J]. J Vet Med Sci,2017,79(6):1110−1119. doi: 10.1292/jvms.17-0079
[7] FU A, ZHENG Y, GUO J, et al. Telomere-to-telomere genome assembly of bitter melon (Momordica charantia L. var. abbreviata Ser.) reveals fruit development, composition and ripening genetic characteristics[J]. Horticulture Research,2022,10(1):1−16.
[8] CIOU S Y, HSU C C, KUO Y H, et al. Effect of wild bitter gourd treatment on inflammatory responses in BALB/c mice with sepsis[J]. Biomedicine (Taipei),2014,4(3):7−13.
[9] HUANG T N, LU K N, PAI Y P, et al. Role of GLP-1 in the hypoglycemic effects of wild bitter gourd[J]. Evid Based Complement Alternat Med,2013,2013(625892):1−13.
[10] WU S J, NG L T. Antioxidant and free radical scavenging activities of wild bitter melon (Momordica charantia Linn. var. abbreviata Ser.) in Taiwan[J]. LWT-Food Science and Technology,2008,41(2):323−330. doi: 10.1016/j.lwt.2007.03.003
[11] TSAI C H, CHEN E C, TSAY H S, et al. Wild bitter gourd improves metabolic syndrome:A preliminary dietary supplementation trial[J]. Nutr J,2012,11(4):1−3.
[12] JIA S, SHEN M, ZHANG F, et al. Recent advances in Momordica charantia:Functional components and biological activities[J]. Int J Mol Sci,2017,18(2555):1−25.
[13] YANG J K, YU Y B, WANG C, et al. Production, physicochemical characteristics, and in vitro biological activities of polysaccharides obtained from fresh bitter gourd (Momordica charantia L.) via room temperature extraction techniques[J]. Food Chemistry,2021,337:127798. doi: 10.1016/j.foodchem.2020.127798
[14] 杨税. 基于苦瓜多糖规模化提取影响因素的考察及工艺的优化[J]. 药学研究,2020,39(11):641−675. [YANG S. Investigation and optimization of the factors influencing the scale extraction of polysaccharide from Momordica charantia[J]. Journal of Pharmaceutical Research,2020,39(11):641−675.] YANG S. Investigation and optimization of the factors influencing the scale extraction of polysaccharide from Momordica charantia[J]. Journal of Pharmaceutical Research, 2020, 39(11): 641−675.
[15] XIE S Z, ZHANG W J, LIU W, et al. Physicochemical characterization and hypoglycemic potential of a novel polysaccharide from Polygonatum sibiricum Red through PI3K/Akt mediated signaling pathway[J]. Journal of Functional Foods,2022,93:1−12.
[16] LI J B, KISARA K, DANIELSSON S, et al. An improved methodology for the quantification of uronic acid units in xylans and other polysaccharides[J]. Carbohydrate Research,2007,342(11):1442−1449. doi: 10.1016/j.carres.2007.03.031
[17] TAN M H, CHANG S L, LIU J N, et al. Physicochemical properties, antioxidant and antidiabetic activities of polysaccharides from quinoa (Chenopodium quinoa Willd.) seeds[J]. Molecules,2020,25(17):1−18.
[18] TAN M H, ZHAO Q S, ZHAO B. Physicochemical properties, structural characterization and biological activities of polysaccharides from quinoa (Chenopodium quinoa Willd.) seeds[J]. International Journal of Biological Macromolecules,2021,193:1635−1644. doi: 10.1016/j.ijbiomac.2021.10.226
[19] CAO W Y, WANG C X, MAYHESUMU X, et al. Isolation, structural elucidation, antioxidant and hypoglycemic activity of polysaccharides of Brassica rapa L[J]. Molecules,2022,27(9):1−16.
[20] WU D T, HE Y, HU M X, et al. Structural characteristics and biological activities of a pectic-polysaccharide from okra affected by ultrasound assisted metal-free Fenton reaction[J]. Food Hydrocolloids,2022,122:107085. doi: 10.1016/j.foodhyd.2021.107085
[21] LI P C, XUE H K, XIAO M, et al. Ultrasonic-assisted aqueous two-phase extraction and properties of water-soluble polysaccharides from Malus hupehensis[J]. Molecules,2021,26(8):1−13.
[22] 沈宇, 李野, 张翼, 等. 植物果胶多糖结构与免疫活性研究进展[J]. 中医药学报,2021,49(5):107−110. [SHEN Y, LI Y, ZHANG Y, et al. Research progress on structure and immune activity of plant pectin polysaccharides[J]. Acta Chinese Medicine and Pharmacology,2021,49(5):107−110.] SHEN Y, LI Y, ZHANG Y, et al. Research progress on structure and immune activity of plant pectin polysaccharides[J]. Acta Chinese Medicine and Pharmacology, 2021, 49(5): 107−110.
[23] 易建勇, 赵圆圆, 毕金峰, 等. 果胶精细结构与其肠道微生物酵解特性的构效关系[J]. 中国食品学报,2021,21(11):337−348. [YI J Y, ZHAO Y Y, BI J F, et al. The structure-fuction relaitonship between pectin and intestinal micobial fermentation characteristics[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(11):337−348.] YI J Y, ZHAO Y Y, BI J F, et al. The structure-fuction relaitonship between pectin and intestinal micobial fermentation characteristics[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(11): 337−348.
[24] LIANG W L, LIAO J S, QI J R, et al. Physicochemical characteristics and functional properties of high methoxyl pectin with different degree of esterification[J]. Food Chemistry,2022,375:131806. doi: 10.1016/j.foodchem.2021.131806
[25] RODSAMRAN P, SOTHORNVIT R. Microwave heating extraction of pectin from lime peel:Characterization and properties compared with the conventional heating method[J]. Food Chemistry,2019,278:364−372. doi: 10.1016/j.foodchem.2018.11.067
[26] 严学迎, 梁秋萍. 苦瓜多糖的制备、理化特征及降血糖作用[J]. 中国食品添加剂,2023,34(3):135−141. [YAN X Y, LIANG Q P. Preparation, physicochemical characteristics and hypoglycemic effect of polysaccharides from Momordica charantia[J]. China Food Additives,2023,34(3):135−141.] YAN X Y, LIANG Q P. Preparation, physicochemical characteristics and hypoglycemic effect of polysaccharides from Momordica charantia[J]. China Food Additives, 2023, 34(3): 135−141.
[27] GAO H, WEN J J, HU J L, et al. Polysaccharide from fermented Momordica charantia L. with Lactobacillus plantarum NCU116 ameliorates type 2 diabetes in rats[J]. Carbohydr Polym,2018,201:624−633. doi: 10.1016/j.carbpol.2018.08.075
[28] 胡润锋, 李浚哲, 李鹏飞, 等. 桑叶多糖结构特征及其对α-葡萄糖苷酶活性的抑制作用[J]. 林业工程学报,2022,7(6):100−106. [HU R F, LI J Z, LI P F, et al. Study on the structure of mulberry leaf polysaccharide and its inhibitory activity of α-glucosidase[J]. Journal of Forestry Engineering,2022,7(6):100−106.] HU R F, LI J Z, LI P F, et al. Study on the structure of mulberry leaf polysaccharide and its inhibitory activity of α-glucosidase[J]. Journal of Forestry Engineering, 2022, 7(6): 100−106.
[29] LI Q, YU N, WANG Y, et al. Extraction optimization of Bruguiera gymnorrhiza polysaccharides with radical scavenging activities[J]. Carbohydrate Polymers,2013,96(1):148−155. doi: 10.1016/j.carbpol.2013.03.054
[30] 王威振, 杨盼盼, 遆永瑞, 等. 龙牙百合多糖的超声辅助提取及其抗氧化、降血脂活性分析[J]. 食品工业科技,2023,44(18):251−257. [WANG W Z, YANG P P, TI Y R, et al. Ultrasound-assisted extraction and analysis of antioxidation and hypolipidemia activities of polysaccharides from Lilium brownii var. viridulum J]. Science and Technology of Food Industry,2023,44(18):251−257.
[31] 王静杰, 杜鑫, 钟强, 等. 超声辅助酶法制备海参性腺多糖的结构特性及抗氧化活性[J]. 食品科学,2021,42(21):97−104. [WANG J J, DU X, ZHONG Q, et al. Structural characteristics and antioxidant activity of polysaccharides prepared from sea cucumber gonad by ultrasound-assisted enzymatic hydrolysis[J]. Food Science,2021,42(21):97−104.] doi: 10.7506/spkx1002-6630-20201215-186 WANG J J, DU X, ZHONG Q, et al. Structural characteristics and antioxidant activity of polysaccharides prepared from sea cucumber gonad by ultrasound-assisted enzymatic hydrolysis[J]. Food Science, 2021, 42(21): 97−104. doi: 10.7506/spkx1002-6630-20201215-186
[32] 毛美林, 邓子言, 李万晴, 等. 一种榆黄蘑菌丝体多糖的结构表征及其降血糖作用[J]. 食品科学,2023,44(11):115−123. [MAO M L, DENG Z Y, LI W Q, et al. Structural characterization and hypoglycemic effect of a polysaccharide from Pleurotus citrinopileatus mycelia[J]. Food Science,2023,44(11):115−123.] doi: 10.7506/spkx1002-6630-20220715-178 MAO M L, DENG Z Y, LI W Q, et al. Structural characterization and hypoglycemic effect of a polysaccharide from Pleurotus citrinopileatus mycelia[J]. Food Science, 2023, 44(11): 115−123. doi: 10.7506/spkx1002-6630-20220715-178
[33] ZHANG X, LIANG Z, WATERHOUSE G I N, et al. Structural characteristics, anticoagulant and antithrombotic mechanism of a novel polysaccharide from Rosa Chinensis Flos[J]. Food Science and Human Wellness,2023,12(2):407−415. doi: 10.1016/j.fshw.2022.07.042
[34] AVIGNON A, HOKAYEM M, BISBAL C, et al. Dietary antioxidants:Do they have a role to play in the ongoing fight against abnormal glucose metabolism?[J]. Nutrition,2012,28(7-8):715−721. doi: 10.1016/j.nut.2012.01.001
[35] ZHU J X, ZHOU H, ZHANG J Y, et al. Valorization of polysaccharides obtained from dark tea:Preparation, physicochemical, antioxidant, and hypoglycemic properties[J]. Foods,2021,10(10):1−21.
[36] LI X, WANG X H, DONG Y, et al. Preparation, structural analysis, antioxidant and digestive enzymes inhibitory activities of polysaccharides from Thymus quinquecostatus Celak. leaves[J]. Industrial Crops and Products,2022,175.
[37] FANG C C, CHEN G J, KAN J Q. Comparison on characterization and biological activities of Mentha haplocalyx polysaccharides at different solvent extractions[J]. International Journal of Biological Macromolecules,2020,154:916−928. doi: 10.1016/j.ijbiomac.2020.03.169
[38] WANG L, ZHANG P, CHEN Y X, et al. Physicochemical characterization and in vitro biological activities of water-extracted polysaccharides fractionated by stepwise ethanol precipitation from Rosa roxburghii Tratt fruit[J]. Journal of Food Measurement and Characterization,2022,16(1):38−48. doi: 10.1007/s11694-021-01125-z
-
期刊类型引用(1)
1. 姜雨欣,赵金艳,赵博,张国财. 碱液提取榆树钱多糖工艺优化及其抗氧化活性研究. 现代畜牧兽医. 2024(12): 18-23 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



