Effect of Magnetic Field Assisted Freezing on the Properties and Quality Characteristics of Myofibrillar Protein in Prepared Pork
-
摘要: 为明确磁场辅助(magnetic field-assisted,MF)冷冻对调理猪肉蛋白特性和品质特性的影响。以生制调理猪肉作为实验原料,对比分析了常规冷冻(冰箱冷冻,温度−20±2 ℃)与其他三种磁场辅助冷冻(磁场强度为3、4、5 mT,温度−20±2 ℃)对调理猪肉冷冻速率、解冻损失、离心损失、pH、TBARS值以及肌原纤维蛋白(myofibrillar protein,MP)特性的影响。结果表明:MF处理下冷冻时间明显少于对照组(238 min),分别缩短了132.25、143.75、115.25 min,且各MF处理组在不同程度上抑制了蛋白质的氧化变性:总巯基含量均显著高于对照组,羰基含量、表面疏水性均显著低于对照组(P<0.05),MP二级结构中α-螺旋相对含量更高(MF4组为55.36%,对照组为16.33%),MF各组总蛋白质溶解度显著高于对照组(P<0.05)。相较于对照组(解冻损失6.82%,离心损失26.11%),MF处理后肌肉保水性显著提升(MF4解冻损失4.43%,离心损失18.88%)(P<0.05)。此外,当磁场强度为4 mT时蛋白质、脂质氧化程度最低及冻结时间最短,相较于其余冻结组蛋白质二级结构更稳定,综上所述,4 mT磁场辅助冷冻处理更适宜调理猪肉的冷冻。Abstract: To investigate the effects of magnetic field-assisted (MF) freezing on the protein properties and quality characteristics of prepared pork, experiments used fresh prepared pork as the experimental material. The effects of conventional freezing (refrigerator freezing at −20±2 ℃) and three types of magnetic field-assisted freezing (at magnetic field intensities of 3, 4, and 5 mT, at a temperature of −20±2 ℃) on freezing rate, thawing loss, centrifugal loss, pH, TBARS value and myofibrillar protein (MP) characteristics of the prepared pork were compared. The results showed that the freezing time was significantly reduced under MF treatment compared to the control group (238 min), with reductions of 132.25, 143.75, and 115.25 min, respectively. Additionally, the various MF treatment groups exhibited a significant inhibition of protein oxidative denaturation. Specifically, total sulfhydryl content was significantly higher than that in the control group, while carbonyl content and surface hydrophobicity were significantly lower than that in the control group (P<0.05). Moreover, the relative of α-helix in the MP secondary structure was notably higher, reaching 55.36% for the MF4 group, compared to 16.33% for the control group. The total protein solubility for the MF groups was also significantly higher than that of the control group (P<0.05). In comparison to the control group (with thawing loss of 6.82% and centrifugal loss of 26.11%), the water-holding capacity of the muscle significantly increased after MF treatment (thawing loss of 4.43% for MF4, centrifugal loss of 18.88%) (P<0.05). Moreover, at a magnetic field intensity of 4 mT, both protein and lipid oxidation levels were at their lowest, and the freezing time was also minimized. In comparison to the other freezing methods, the protein's secondary structure exhibited greater stability. Consequently, the 4 mT magnetic field-assisted freezing treatment is more suitable for the freezing of prepared pork.
-
随着人民生活水平不断提高,食品工业不断发展,预制菜由于其烹饪过程简单、食用方便等特点,逐渐受到消费者的青睐[1]。冷冻是目前肉及肉制品保鲜最常用的手段,低温能够抑制酶活性及微生物生长,从而保证肉制品品质[2]。当前,传统的冷冻方式主要依靠冰箱冷冻,然而,这种冷冻方式降温速度慢,效率不高,且冷冻过程中通常会改变水分在肌肉中的分布,并在冻结过程中产生不均匀且尺寸较大的冰晶,进而使肌肉组织产生不可逆的机械损伤,降低解冻后的持水力,造成蛋白质、脂质氧化,进而影响肉制品品质[2−3]。随着预制菜行业的不断发展,冷冻过程中造成的肉制品汁液流失严重,产品品质不够稳定等问题亟待解决。
磁场辅助冻结技术近年来受到广泛关注,被应用于肉及肉制品的保鲜、冷冻等领域的研究中。Zhou等[4]研究发现,20 mT磁场能够延长卵形鲳鲹的冻结时间,降低蒸煮和离心损失,并促使生成最小的冰晶,使细胞水分分布更均匀、含水量更高。Lin等[5]研究结果显示,磁场辅助过冷保鲜有效降低了牛肉贮藏过程中的滴水损失、离心损失,同时抑制了水分迁移和蛋白质变性。Sun等[6]研究指出,60 mT磁场可以缩短冷冻时间,提高对凡纳滨对虾的保水性和质构特性,降低水分迁移率,并促进细小冰晶的生成。杨冰等[7]利用静磁场辅助冻结鮰鱼肉发现其冷冻时间显著缩短,减少了汁液损失和组织结构破坏。马国娇[8]发现,相比于冰箱冷冻,1 mT静磁场冷冻猪肉和牛肉相变时间和冻结时间均明显缩短,汁液损失有所降低。Hu等[9]在猪里脊的冻结过程中施加静磁场发现猪肉冻结时间相较于常规冻结缩短40.04%,解冻损失降低至2.4%,肌原纤维蛋白热稳定性明显提升。蛋白质是肉及肉制品中重要营养物质,其中肌原纤维蛋白是主要成分,冷冻诱导的肌原纤维蛋白氧化是造成肌肉保水性下降的重要原因,因此选择适宜的方法有利于提高冻结效率,降低蛋白氧化程度,减少汁液流失,提高肉制品品质[10]。以上研究已经证明,适宜强度的磁场辅助冷冻能够有效提升冻结效率,但目前对于该技术对调理猪肉肌原纤维蛋白特性和品质特性变化的影响尚不清楚,且在肉制品中的研究多集中于原料肉类,在调理肉制品中的有关报道较少。
因此,本次试验以生制调理猪肉为样品,对比分析了几种不同的冻结方式:常规冰箱冻结(温度−20±2 ℃)、三种磁场强度(3、4、5 mT,温度−20±2 ℃)冻结,对冷冻调理猪肉的冻结速率、解冻损失、离心损失、pH、TBARS值以及肌原纤维蛋白特性的影响,为该项技术在调理肉制品中的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
新鲜猪里脊肉 于宜宾市永辉超市购买,猪肉在购买后1 h内运回实验室,在4 ℃冰箱中冷却备用,随后进行调理猪肉样品的制作;氯化钠(分析纯) 国药集团化学试剂有限公司;无水磷酸氢二钠(分析纯) 广东光华科技股份有限公司;牛血清蛋白(BSA)(生物试剂)、氢氧化钠、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine)、5,5’-二硫代双(2-硝基苯甲酸) (5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、溴酚蓝、盐酸胍、乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)、三氯乙酸(trichloroacetic acid,TCA)(分析纯) 上海麦克林生化科技有限公司;磷酸二氢钠、磷酸氢二钾、磷酸二氢钾、硫酸铜(五水)、盐酸、碘化钾、氯化钾、乙醇、乙酸乙酯 均为分析纯,成都市科隆化学有限公司。
EFI-A1智能静电场冷冻冷藏试验箱 英都斯特(无锡)感应科技有限公司;pHS-3E pH计 上海仪电科学仪器股份有限公司;BC/BD-323NE, N, A澳柯玛冷柜 澳柯玛股份有限公司;MGL-16MA高速冷冻离心机 美瑞克仪器(上海)有限公司;N5000PLUS紫外分光光度计 上海科佑仪器仪表有限公司;Chirascan圆二色谱仪 英国应用光物理公司;FSH-2A高速分散均质机 杭州旌斐仪器科技有限公司;JK-804温度测试仪 常州市金艾联电子科技有限公司。
1.2 实验方法
1.2.1 样品制备
将猪肉分割成2 cm×2 cm×4 cm大小,加入玉米淀粉2%、磷酸盐保水剂0.4%、生抽1.5%、料酒1.5%、水45%,滚揉腌制120 min。
1.2.2 分组冻结
将腌制完成后的样品随机分成4组,每组9条,冷冻时单层平铺。以温度为−20±2 ℃冰箱自然冷冻作为对照组;实验组采用磁场辅助冻藏装置分别在磁场强度为3、4、5 mT中冷冻(−20±2 ℃),分别标记为:MF3、MF4、MF5。
1.2.3 冻结曲线测定
使用温度记录仪进行测定,冻结前先将探头插进肉样的几何中心,冻结期间每隔15 s记录一次温度变化,记录范围为4~−18 ℃。待肉样中心温度达−18 ℃时即视为达到冻结终点,根据温度记录仪记录数据绘制各冻结条件下肉样的冻结曲线。冻结完成后的样品以聚乙烯自封袋包装好放入温度为−20±2 ℃的冰箱中稳定24 h,取出解冻后进行相关指标的测定。
1.2.4 保水性(WHC)测定
本次试验中以解冻损失、离心损失作为评价肉样WHC的指标。
1.2.4.1 解冻损失
取不同冻结处理组的肉样,解冻前称取质量记为m1,放入自封袋中进行恒温静水解冻(25 ℃)。使用温度记录仪探头记录肉样中心温度的变化,当中心温度达到4 ℃时,结束解冻,使用滤纸吸干表面水分后称取质量记为m2。将肉样放入4 ℃冰箱中暂存进行后续实验。解冻损失计算公式:
解冻损失(%)=m1−m2m1×100 (1) 1.2.4.2 离心损失
离心损失参考Jiang等[11]的方法并作一定修改。解冻完成的肉样切成0.5 cm×0.5 cm×4 cm的小块,分别称取质量W1。包裹在滤纸中,离心条件为4000 r/min离心15 min,擦干表面水分后称取质量W2,离心损失按下列公式计算:
离心损失(%)=W1−W2W1×100 (2) 1.2.5 pH的测定
参考余小领等[12]的方法并作一定修改,解冻后取切碎的肉样0.5 g,加入超纯水4.5 mL,充分涡旋混匀后使用pH计测定,每组3次平行,结果取平均值。
1.2.6 硫代巴比妥酸值(TBARS)测定
参考Xia等[13]的方法,取2 g解冻后切碎的肉样于试管中,依次加入1%硫代巴比妥酸3 mL,2.5%三氯乙酸17 mL,混合后沸水浴30 min,将冷却后的反应样液与三氯甲烷1:1充分混合,并在3000 r/min下离心10 min。取上清液,在532 nm处测量吸光度值。TBARS值计算公式如下:
TBARS(mgMDA/kg)=A532Ms×9.48 (3) 式中:A532:样液在532 nm处的吸光度;Ms:样品质量,g;9.48:由硫代巴比妥酸反应产物的稀释因子和摩尔消光系数。
1.2.7 肌原纤维蛋白提取
参考Li等[14]的方法,将解冻完成的肉样切碎后称取4 g,加入4体积缓冲液(0.1 mol/L KCl,20 mmol/L K2HPO4/KH2PO4,1 mmol/L EGTA,pH6.9),混合后匀浆,在4 ℃下以4300 r/min离心15 min,弃上清液,重复以上步骤两次,以4倍体积0.1 mol/L KCl溶液洗涤两次,并在最后一次洗涤后,在离心前使用2层纱布过滤,最终离心后所得提取物即为肌原纤维蛋白。并使用含0.6 mol/L NaCl的磷酸盐缓冲液(pH6.0)进行蛋白溶液浓度稀释,采用双缩脲法测定蛋白溶液浓度。
1.2.8 总巯基含量的测定
参考Liu等[15]的方法,将MP溶液稀释至2 mg/mL,取1 mL稀释后的MP溶液与8 mL缓冲液(0.086 mol/L Tris-HCl,0.09 mol/L甘氨酸,4 mmol/L乙二胺四乙酸(EDTA),8 mol/L尿素,pH8)混合,在10000×g下离心15 min。取4.5 mL上清液加入0.5 mL Ellman试剂(10 mmol/L DTNB)中,置于40 ℃下反应25 min。使用分光光度计在412 nm处测定吸光度,摩尔消光系数用13600 L/(mol·cm),结果以nmol/mg蛋白质总巯基表示。
总巯基含量(nmol/mg)=A×dε×2 (4) 式中:A:溶液吸光度;ε:摩尔消光系数;d:稀释倍数;2:MP浓度,mg/mL。
1.2.9 羰基含量的测定
参考Zhang等[16]的方法。将MP浓度调整至2 mg/mL,取1 mL至离心管中,加入1 mL 10 mmol/L 2,4-二硝基苯肼(DNPH),以1 mL 2 mol/L HCl作为空白对照,避光反应1 h,期间每隔15 min振荡一次。反应完成后加入1 mL 20%三氯乙酸(TCA)充分混合反应15 min,随后在4 ℃下转速10000×g离心15 min,弃上清液。加入1 mL乙酸乙酯:乙醇(1:1)溶液,充分混合洗涤3次至完全脱色。向所得沉淀中加入3 mL盐酸胍溶液(6 mol/L),充分混合溶解后于37 ℃水浴中反应15 min。离心除去沉淀,取上清液在370 nm下测定吸光度,以空白组为对照,计算羰基含量,摩尔消光系数为22000 L/(mol·cm),公式如下。
羰基含量(nmol/mg)=A×dε×2 (5) 式中:A:溶液吸光度;ε:摩尔消光系数;d:稀释倍数;2:MP浓度,mg/mL。
1.2.10 蛋白质溶解度
参考Joo等[17]的方法,取1 g解冻后肉样,加入20 mL含1.1 mol/L KI的0.1 mol/L磷酸钾缓冲液(pH7.2)中,匀浆3次,4 ℃抽提12 h。以3000 r/min离心20 min后,用双缩脲法测定上清液蛋白质浓度,使用牛血清白蛋白作为标准品建立标准曲线进行计算。标准曲线方程:y=0.0474x−0.0008,R2=0.9982。
1.2.11 表面疏水性
表面疏水性的测定参考Chelh等[18]的方法。调整MP浓度为2 mg/mL,向1 mL MP溶液中加入200 μL 1 mg/mL溴酚蓝(BPB)溶液,充分混合15 min。以磷酸盐缓冲液作为空白对照组。4000 r/min离心15 min后,取上清液稀释10倍。在波长595 nm处测各组吸光度,以结合态的疏水BPB结合量(总BPB与游离BPB的差值)作为表面疏水性指数,计算公式如下。
溴酚蓝结合量(μg)=200μg×(A对照−A样品)A对照 (6) 式中:A对照:对照组吸光度;A样品:样品吸光度。
1.2.12 圆二色谱测定
根据Jia等[19]的方法,使用圆二色谱仪测定肌原纤维蛋白圆二色性。稀释MP浓度至0.2 mg/mL,参数设定为:扫描波长范围:200~260 nm,扫描速度120 nm/min,扫描3次,测定样品的紫外吸收光谱,利用Chirascan软件进行数据处理,并通过CDNN软件计算相应构象的相对含量。
1.3 数据处理
实验数据采用IBM的SPSS Statistics 25进行处理,并通过沃勒-邓肯法进行多重对比以分析数据显著性(P<0.05)。绘图使用Origin Pro 2021软件,将数据结果以3次平均值±标准差表示。
2. 结果与分析
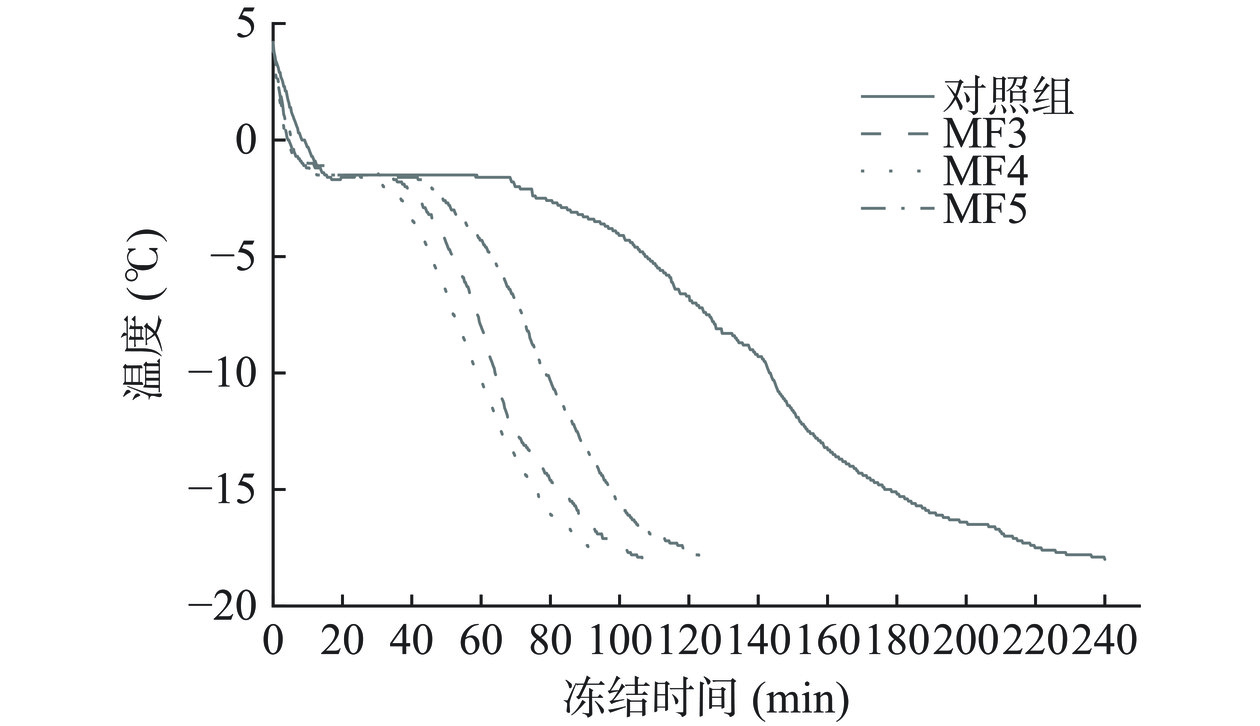
2.1 不同冻结方式对调理猪肉冷冻时间的影响
图1为不同冻结方式下调理猪肉的冻结曲线。如图所示,预冷阶段(4~−1 ℃),该过程肌肉温度迅速下降至冰点附近,对照组所用时间为12.25 min,温度下降速率略小于MF各组,说明MF对调理猪肉的预冷阶段有着一定的影响。此外,对照组通过相变阶段(−1~−5 ℃)所用时间为94.25 min,MF3、MF4、MF5该阶段相较于对照组所用时间分别缩短52.75、55.75、40.45 min,表明在磁场辅助冷冻下调理猪肉相变时间明显缩短,冻结效率显著提升。整体来看,相较于对照组(238 min),MF3、MF4、MF5冻结时间分别缩短了:132.25、143.75、115.25 min,冻结效率明显提升,其中MF4组冻结时间最短。研究表明,在相变阶段施加磁场可以破坏自由水分子间基团氢键,此时,水的大分子团可能被分成小分子团甚至单个水分子,同时缩短了冻结时间,有利于提高冻结效率,MF4处理组相变阶段所用时间最短,可能是该强度的磁场对水分子间基团氢键作用更强,因此冻结效率最高[20]。Mok等[21]研究发现,NaCl溶液的冷冻过程中使用强度为50 mT的静磁场,相变时间比传统方式缩短了32.10%。马国娇[8]研究中,1 mT磁场辅助冷冻牛肉和猪肉分别比冰箱冷冻相变时间缩短50.00%和60.00%,效果显著,与本次实验结果相似。结果表明,相对于传统冷冻方式,磁场辅助冻结明显缩短了调理猪肉冻结所用时间,提升了调理猪肉的冻结效率。
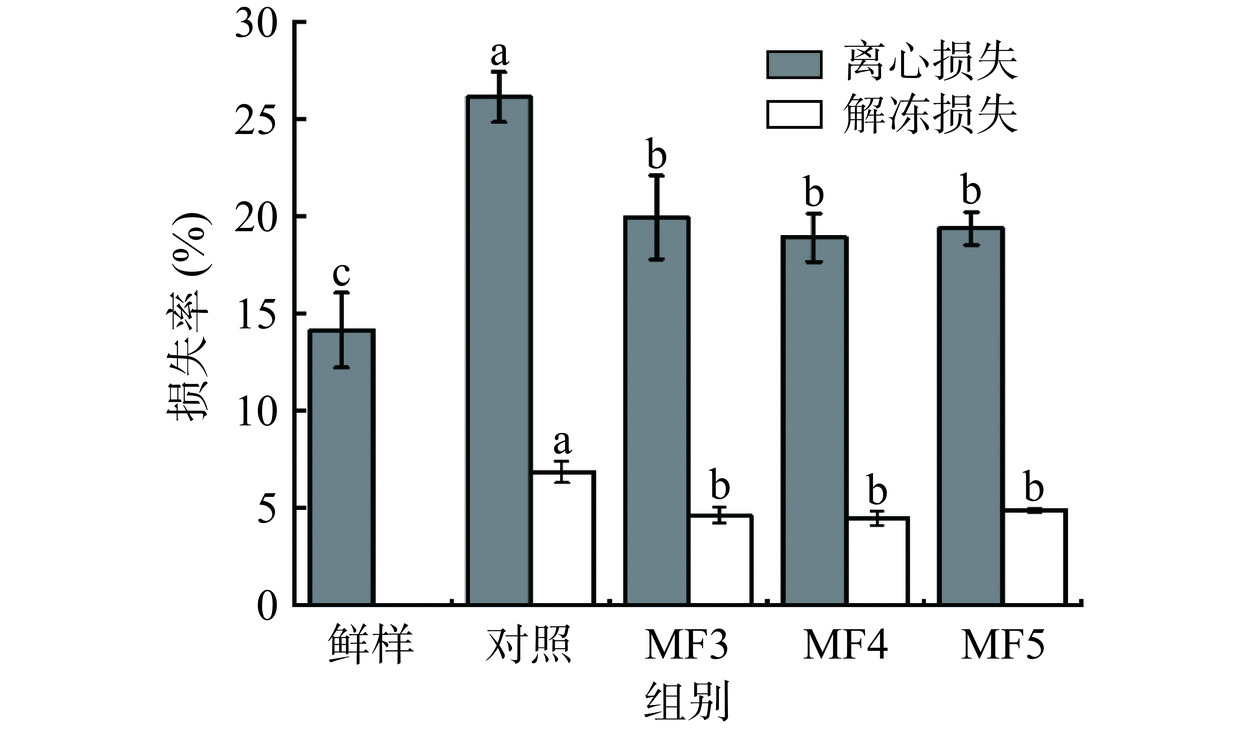
2.2 不同冻结方式对调理猪肉保水性的影响
不同冻结方式对调理猪肉WHC的影响如图2所示。冷冻过程中冰晶的生长会造成肌肉组织破坏,导致冷冻肉在解冻后汁液流失和品质下降。由图可知,MF3、MF4、MF5组解冻损失分别为4.60%、4.43%、4.85%,显著低于对照组6.82%(P<0.05),而MF组间没有显著差异(P>0.05)。结果表明,相较于对照组,MF处理组调理猪肉解冻损失明显降低,肌肉保水性更佳。MF更高的冷冻速率能够使肌肉更加快速通过最大冰晶生成带,对肌肉组织的破坏更小,从而减少了解冻后肌肉的汁液流失[22]。另外,对照组离心损失为26.11%,显著高于MF各组(P<0.05),但MF组间没有显著差异(P>0.05),与解冻损失规律基本一致。MF处理离心损失降低可能是由于相较于对照组样品冷冻诱导的蛋白质氧化变性程度降低所致。
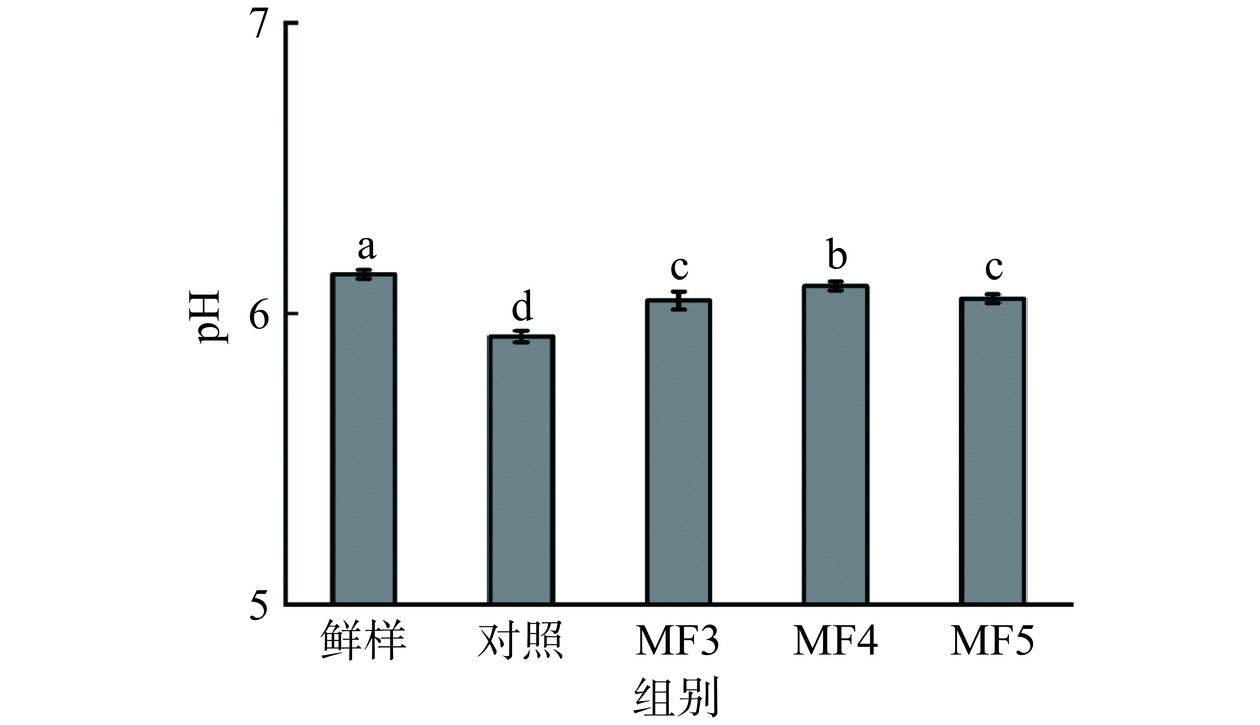
2.3 不同冻结方式对调理猪肉pH的影响
pH通常与肉制品保水性、蛋白质特性等品质特性密切相关。不同冻结方式对调理猪肉pH的影响如图3所示,鲜样pH为6.14,高于各冷冻组,对照组样品pH为5.92,显著低于MF各组(P<0.05),其中MF4组显著高于MF3和MF5组(P<0.05)。有研究认为,经过冻融后的肉pH通常会低于冷冻前的肉,与本次实验规律一致[23]。pH是溶液中游离H+含量的重要衡量标准,肉制品在经历冷冻-解冻过程中产生的渗出物可能导致缓冲蛋白变性、H+的释放以及pH的降低[23]。另外,这一现象还可以解释为,冻融过程中造成的肌肉组织液体流失使得溶质浓度增加[24]。Masha等[25]研究发现,在80 Hz交变磁场作用下,虹鳟鱼片汁液流失较低,相较于其他组样品pH更高。结合前节保水性的结果可以看出,相较于对照组缓慢冷冻,MF各组解冻后的汁液流失更小,因而肌肉中溶质浓度更低,这可能是造成MF各组pH相对于对照组更高的原因。
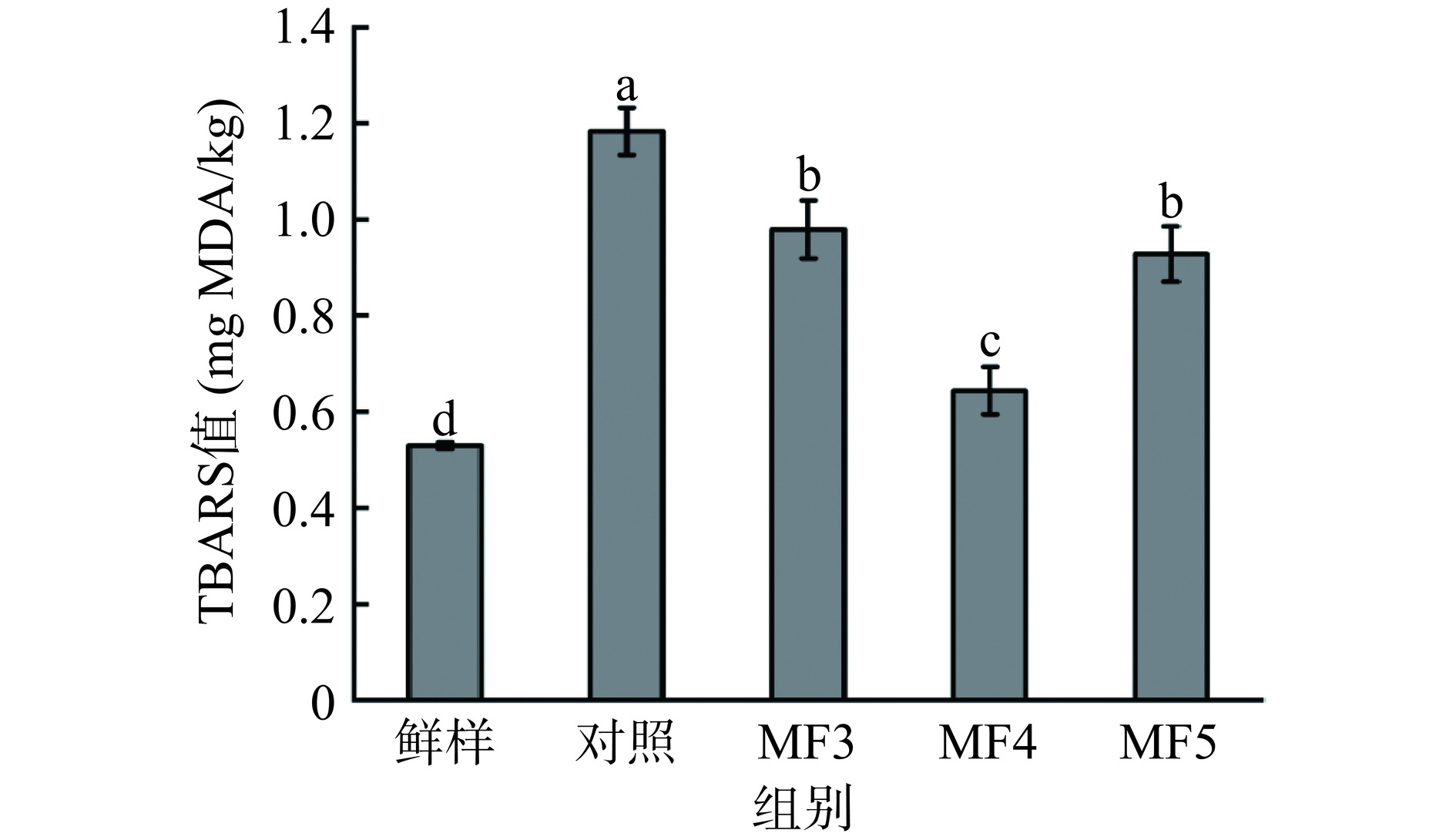
2.4 不同冻结方式对调理猪肉TBARS值的影响
TBARS值通常用被用来代表脂质氧化程度,冷冻引起的肌细胞损伤可能导致促氧化因子的释放,从而加速脂质的氧化[26−27]。不同冻结方式对调理猪肉的脂质氧化具有显著影响(P<0.05)。如图4所示,各组TBARS值分别为0.53、1.18、0.98、0.64、0.93 mg MDA/kg。其中,鲜样TBARS值显著低于各冻结组(P<0.05),说明此时脂质氧化程度最低,各冷冻方式均造成了样品中脂质不同程度的氧化。对照组TBARS值显著高于磁场辅助冻结各组(P<0.05),说明传统自然冻结方式下,调理猪肉脂质氧化程度严重,MF处理下脂质氧化程度更低,其中磁场强度为4 mT时具有最低值,这可能是由于磁场辅助冷冻速率更快,期间肌纤维结构破坏更小,促氧化剂的释放量更小。除自由基诱导的蛋白质氧化外,脂质过氧化同样能够间接介导蛋白质的氧化修饰,脂质过氧化过程中过氧化氢等促氧化剂的生成加剧了蛋白质的氧化,因此,脂质氧化和蛋白质氧化往往同时发生且脂质氧化在一定程度上具有促进蛋白质氧化的作用,更低的脂质氧化程度能够在一定程度上减缓蛋白质氧化[28]。江俊波[29]研究发现,使用适当强度的磁场辅助解冻可以显著抑制牛肉的脂质氧化,与本研究结果一致。结果表明,MF处理能够显著抑制调理猪肉脂质氧化,可能进一步减缓了冷冻过程中的蛋白质氧化。
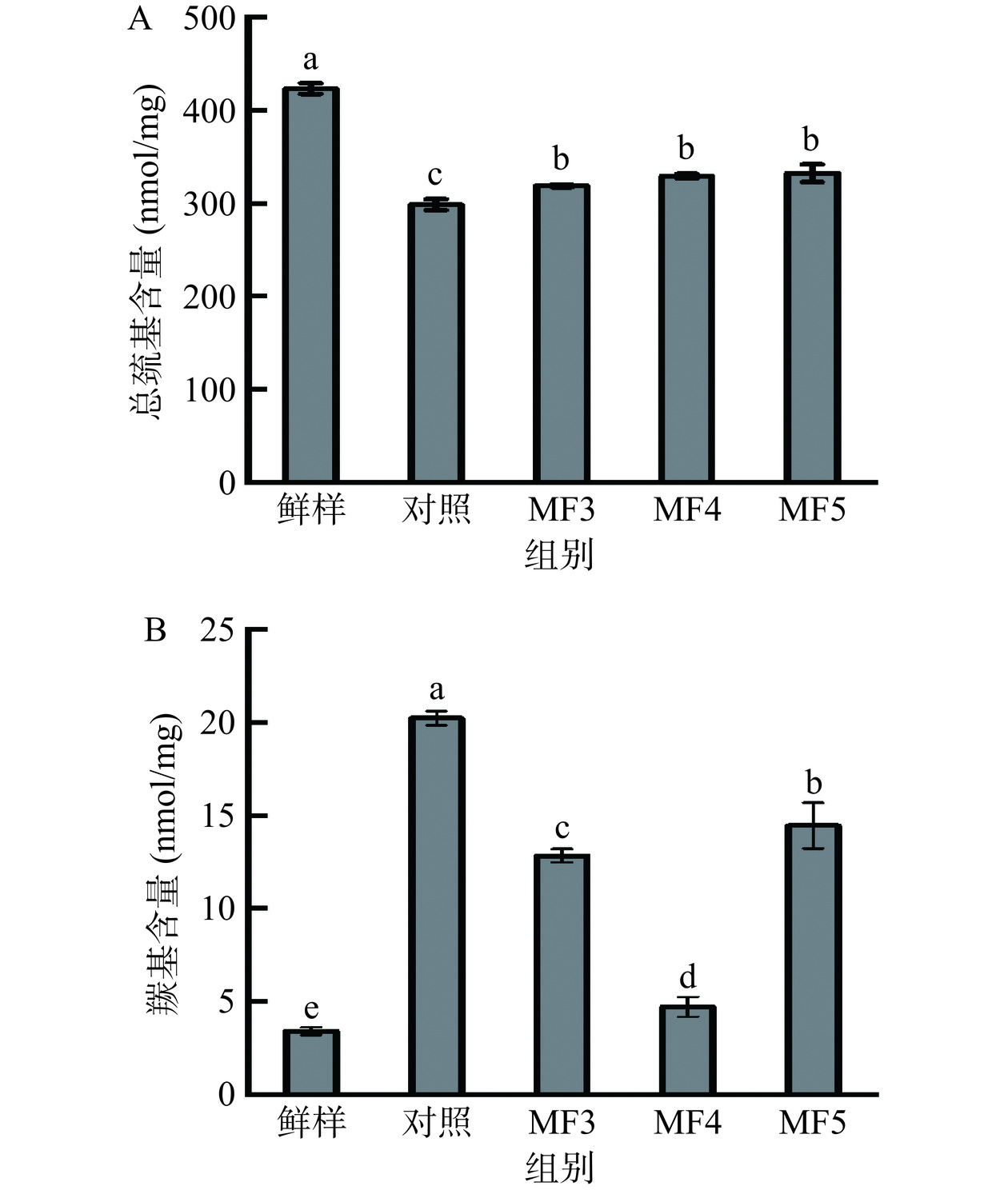
2.5 不同冻结方式对调理猪肉MP总巯基含量、羰基含量的影响
肌球蛋白和肌动蛋白是肌原纤维蛋白的主要成分,而巯基大量存在于这两种蛋白质中,冷冻诱导的蛋白质氧化造成巯基含量降低,常用巯基含量衡量蛋白质氧化水平[30]。不同冻结方式对调理猪肉MP巯基含量影响如图5A所示。对照组与实验组样品巯基含量有显著差异(P<0.05),而实验组间MP巯基含量差异不显著(P>0.05)。对照组、MF3、MF4、MF5样品MP巯基含量分别为298.46、318.69、329.06、332.32 nmol/mg。对照组巯基含量最低,表明MP氧化最严重,而MF显著抑制了巯基含量的下降,降低了试样的MP氧化水平。羰基含量是衡量蛋白质氧化程度最常用的指标之一[31]。不同冻结方式对调理猪肉MP羰基含量的变化影响如图5B所示,对照组与各实验组均出现显著差异(P<0.05)。对照组、MF3、MF4、MF5羰基含量分别为20.23、12.84、4.72、14.47 nmol/mg。其中对照组试样中羰基含量显著高于各实验组(P<0.05),MP氧化程度最高;而实验组中MF4羰基含量显著低于其余组(P<0.05),说明此时MP氧化程度最低。羰基的生成导致蛋白质发生交联、聚集,使蛋白结构发生改变[32]。羰基含量的增加和巯基含量的减少可能形成蛋白质交联,从而影响MP的结构和空间排列,并降低MP的WHC,这可能也是导致肌肉保水性下降的原因之一[33]。有研究认为,脂质氧化的发生通常先于蛋白质氧化,且脂质氧化对蛋白质氧化具有促进作用,本次研究中,MF处理显著降低了调理猪肉脂质氧化程度,这可能在一定程度上也减缓了MP氧化[28]。
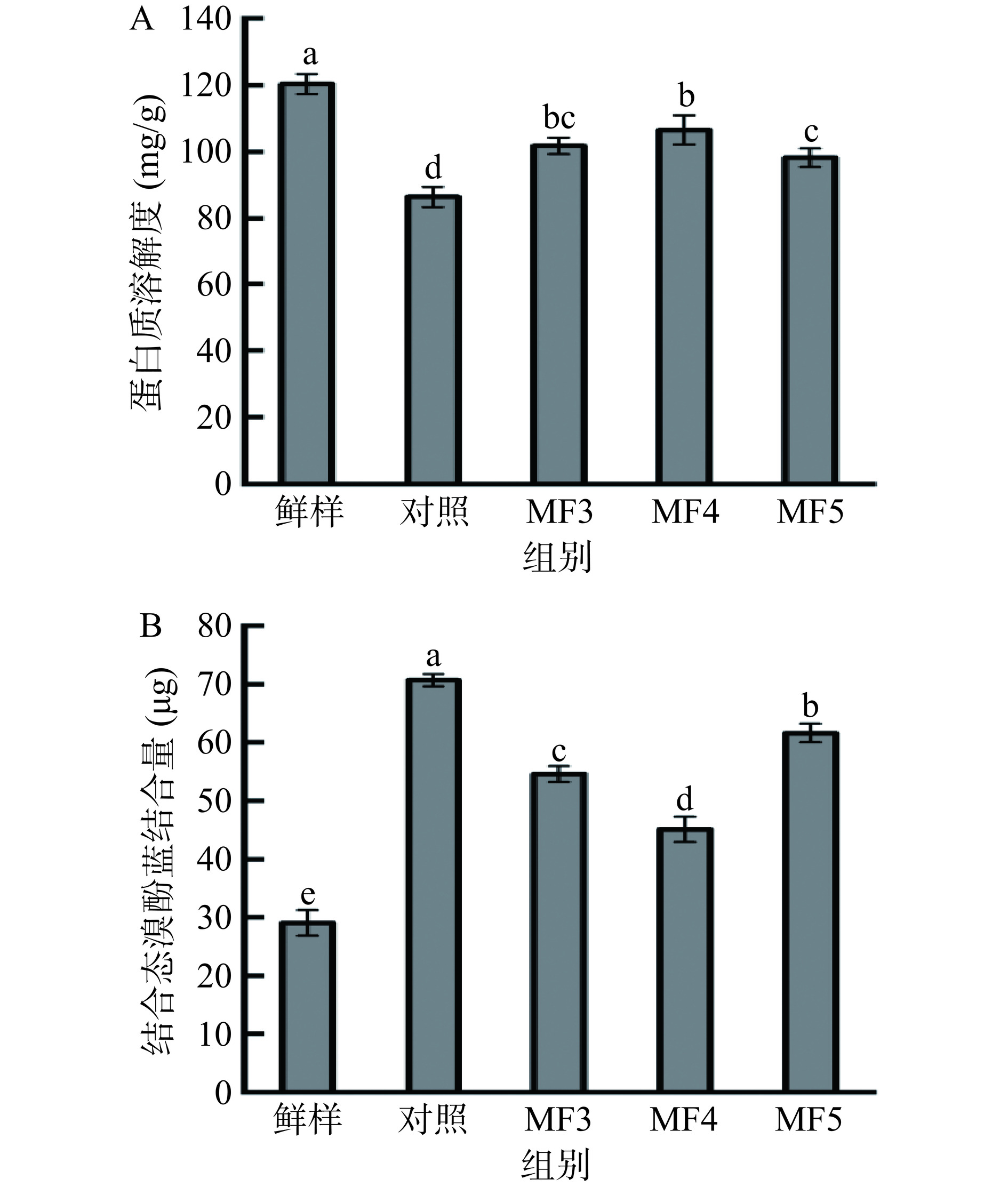
2.6 不同冻结方式对调理猪肉总蛋白质溶解度、MP表面疏水性的影响
蛋白质溶解度直接反映了蛋白质的变性和聚集程度[34]。各处理蛋白质溶解度如图6A所示,鲜样蛋白质溶解度显著高于各冻结组(P<0.05),说明冷冻造成了蛋白质的变性,MF3、MF4、MF5蛋白质溶解度显著高于对照组(P<0.05),MF4处理组呈最高值,MF3与MF4之间没有显著差异(P>0.05),MF3与MF5之间没有显著差异(P>0.05),但MF5蛋白质溶解度显著低于MF4(P<0.05),造成MF5蛋白质溶解度更低的原因可能是该磁场强度下蛋白质发生了解折叠,导致疏水基团的暴露,从而一定程度上影响了蛋白质溶解度[35]。冷冻过程中冰晶的生长造成细胞破损,导致细胞内溶质浓度增大,离子强度增加,水分向细胞外迁移,pH降低,引起蛋白质的变性[24]。MF处理的样品在冷冻后pH更高,这可能降低了蛋白氧化和变性,提高了蛋白质溶解度。表面疏水性常被用来指示蛋白质因冷冻和解冻而引起的变性[10]。蛋白质解折叠或肌球蛋白丝中疏水核心的破裂通常导致内部疏水基团暴露于表面,从而导致表面疏水性升高[36]。如图6B所示为不同冻结方式对调理猪肉MP表面疏水性的影响,鲜样、对照组、MF3、MF4、MF5组试样肌原纤维蛋白结合态BPB的结合量分别为29.06、70.67、54.55、45.08、61.61 μg。鲜样组表面疏水性显著低于冷冻组(P<0.05),说明几种冷冻均造成了MP不同程度的变性。对照组结合态BPB结合量显著高于MF3、MF4、MF5(P<0.05)。对照组MP表面疏水性最高,此时蛋白变性程度最严重,MF组试样表面疏水性更低,说明蛋白变性得到抑制,其中MF4试样呈最低值。冷冻过程蛋白质分子被破坏,进而导致蛋白质构象在肌肉解冻后变得松散[37]。
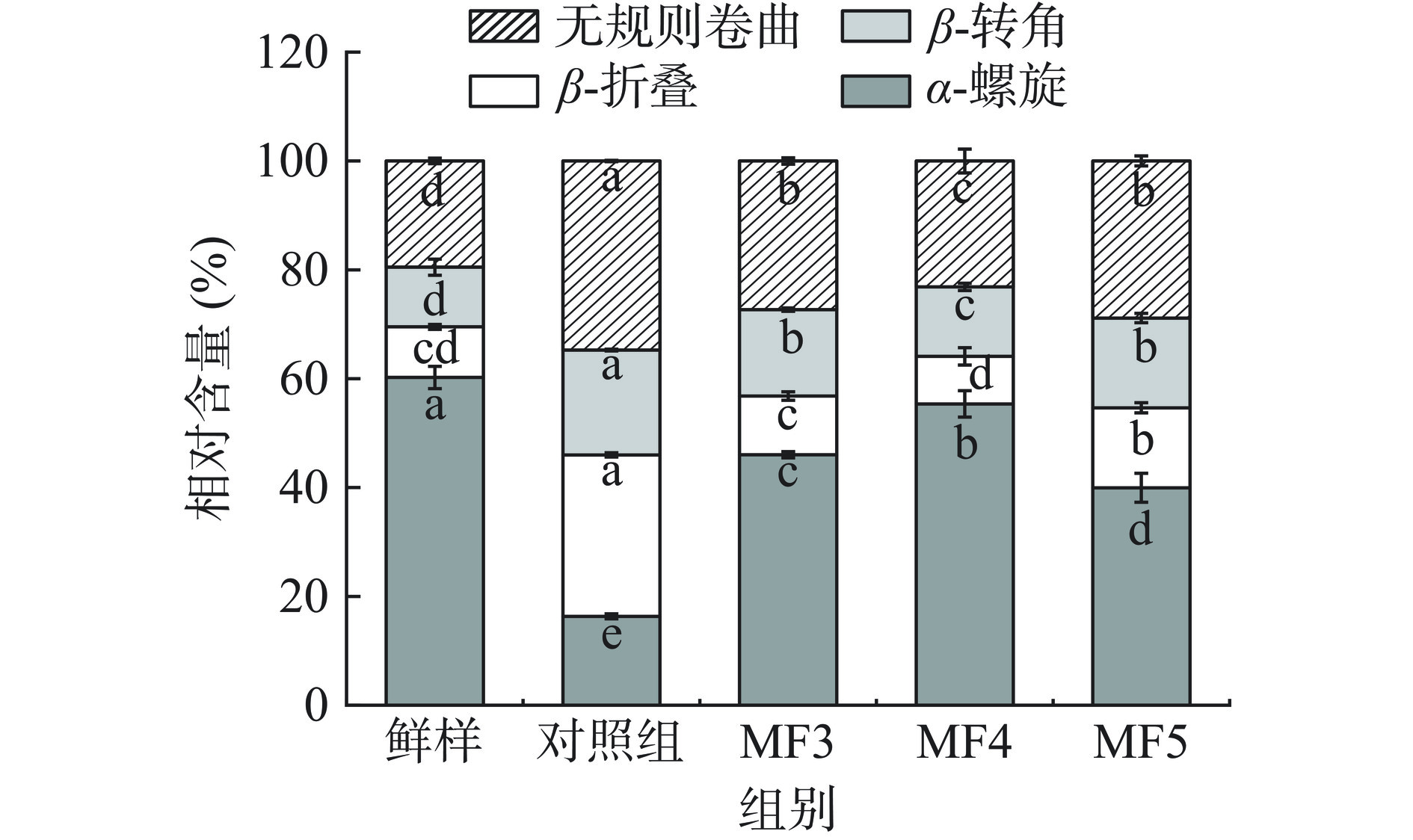
2.7 不同冻结方式对调理猪肉MP二级结构的影响
不同冻结方式对调理猪肉MP二级结构的影响如图7所示。一般认为,α-螺旋相对比例越高,表明蛋白质结构越稳定,β-转角和无规则卷曲相对比例越大,表明蛋白质结构越松散[38]。如图7所示,相较于未冻结鲜样,各处理组间MP二级结构α-螺旋构象均出现明显下降,说明不同冻结方式均对调理猪肉MP二级结构产生了破坏。冷冻诱导的蛋白质变性可造成蛋白质分子的展开,氢键被破坏,有序结构变为无序状态[39]。对照组中α-螺旋结构相对含量16.33%,呈最低值,显著低于MF各处理组(P<0.05),且β-折叠相对含量更高,说明此时由于缓慢冷冻使蛋白质二级结构受到破坏,α-螺旋可能发生了向β-折叠的转变。另外,MF5处理组中α-螺旋相对含量显著低于MF3、MF4(P<0.05),有研究表明,适宜的磁场强度能够在一定程度上维持蛋白质二级结构,但随着磁场强度的增加,蛋白质可能发生过度解折叠,造成α-螺旋断裂,含量下降,这可能是MF5蛋白质二级结构稳定性降低的原因[40]。结果表明,MF处理下蛋白质二级结构受到破坏更小,其中,不同冷冻方式处理后MF4处理组α-螺旋相对含量最高,与未冻结鲜样最为接近,同时无规则卷曲、β-转角相对含量最低,表明此时蛋白质二级结构更稳定。
3. 结论
本研究探讨了自然冷冻与不同强度MF(3、4、5 mT)冷冻处理对调理猪肉蛋白特性和品质特性的影响,并从冷冻诱导蛋白氧化变性的角度阐述其对肌肉保水性的影响机制。研究结果表明,与自然冷冻方式相比,在冷冻过程中施加磁场能够显著缩短调理猪肉的冷冻时间,加快冻结速率;蛋白质的氧化变性是造成肌肉保水性下降的重要原因,相较于对照组,MF各组更快的冷冻速率有效抑制了脂质氧化,蛋白质的氧化变性,维持了蛋白质二级结构稳定,从而有效提高了调理猪肉样品的保水性,且MF4冻结速率最快,蛋白氧化程度最低,蛋白质二级结构最稳定,效果相对最佳。因此,磁场辅助冷冻技术能够作为一种提高调理猪肉冷冻效率并减少其解冻后汁液流失的一种方法。
-
-
[1] 安俊文, 方梓蓥, 高希西, 等. 我国预制菜产业的发展现状、影响因素及发展趋势[J]. 食品与发酵工业,2024,50(5):388−394. [AN J W, FANG Z Y, GAO X X, et al. Development status, influence factors, and trend of prepared dishes in China[J]. Food and Fermentation Industries,2024,50(5):388−394.] AN J W, FANG Z Y, GAO X X, et al. Development status, influence factors, and trend of prepared dishes in China[J]. Food and Fermentation Industries, 2024, 50(5): 388−394.
[2] HU R, ZHANG M, LIU W C, et al. Novel synergistic freezing methods and technologies for enhanced food product quality:A critical review[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(2):1979−2001. doi: 10.1111/1541-4337.12919
[3] JIA G, HE X, NIRASAWA S, et al. Effects of high-voltage electrostatic field on the freezing behavior and quality of pork tenderloin[J]. Journal of Food Engineering,2017,204(9):18−26.
[4] ZHOU J Q, DONG X P, KONG B H, et al. Effects of magnetic field-assisted immersion freezing at different magnetic field intensities on the muscle quality of golden pompano (Trachinotus ovatus)[J]. Food Chemistry,2023,407:135092.1−135092.12.
[5] LIN H X, HE X X, LIU C H, et al. Static magnetic field-assisted supercooling preservation enhances water-holding capacity of beef during subzero storage[J]. Innovative Food Science and Emerging Technologies,2022,80:103106. doi: 10.1016/j.ifset.2022.103106
[6] SUN Q X, ZHANG H H, YANG X Q, et al. Insight into muscle quality of white shrimp (Litopenaeus vannamei) frozen with static magnetic-assisted freezing at different intensities[J]. Food Chemistry:X,2023,17:100518.
[7] 杨冰, 齐子修, 许瑞红, 等. 静磁场辅助冷冻对鮰鱼肉品质的影响[J]. 食品研究与开发,2023,44(6):13−20. [YANG B, QI Z X, XU R H, et al. Effect of static magnetic field-assisted freezing on the quality of Ictalurus punctatus[J]. Food Research and Development,2023,44(6):13−20.] doi: 10.12161/j.issn.1005-6521.2023.06.003 YANG B, QI Z X, XU R H, et al. Effect of static magnetic field-assisted freezing on the quality of Ictalurus punctatus[J]. Food Research and Development, 2023, 44(6): 13−20. doi: 10.12161/j.issn.1005-6521.2023.06.003
[8] 马国骄. 磁场对冷冻猪肉和牛肉品质的影响研究[D]. 无锡:江南大学, 2021. [MA G J. Study on the effects of magnetic field treatment on frozen pork and frozen beef[D]. Wuxi:Jiangnan University, 2021.] MA G J. Study on the effects of magnetic field treatment on frozen pork and frozen beef[D]. Wuxi: Jiangnan University, 2021.
[9] HU R, ZHANG M, MUJUMDAR ARUN S. Novel assistive technologies for efficient freezing of pork based on high voltage electric field and static magnetic field:A comparative study[J]. Innovative Food Science and Emerging Technologies,2022,80:103087. doi: 10.1016/j.ifset.2022.103087
[10] ZHANG Y, KIM Y H B, PUOLANNE E, et al. Role of freezing-induced myofibrillar protein denaturation in the generation of thaw loss:A review[J]. Meat Science,2022,190:108841. doi: 10.1016/j.meatsci.2022.108841
[11] JIANG Q, NAKAZAWA N, HU Y, et al. Changes in quality properties and tissue histology of lightly salted tuna meat subjected to multiple freeze-thaw cycles[J]. Food Chemistry,2019,293(Sep.30):178−186.
[12] 余小领, 李学斌, 赵良, 等. 常规冷冻冻藏对猪肉保水性和组织结构的影响[J]. 农业工程学报,2008,24(12):264−268. [YU X L, LI X B, ZHAO L, et al. Effects of conventional freezing processing and frozen storage on pork water-holding capacity and structure[J]. Transactions of the CSAE,2008,24(12):264−268.] doi: 10.3321/j.issn:1002-6819.2008.12.054 YU X L, LI X B, ZHAO L, et al. Effects of conventional freezing processing and frozen storage on pork water-holding capacity and structure[J]. Transactions of the CSAE, 2008, 24(12): 264−268. doi: 10.3321/j.issn:1002-6819.2008.12.054
[13] XIA X, KONG B, LIU Q, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science,2009,83(2):239−245. doi: 10.1016/j.meatsci.2009.05.003
[14] LI Y, LI X, WANG J Z, et al. Effects of oxidation on water distribution and physicochemical properties of porcine myofibrillar protein gel[J]. Food Biophysics,2014,9(2):169−178. doi: 10.1007/s11483-013-9329-9
[15] LIU Q, CHEN Q, KONG B, et al. The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp (Cyprinus carpio) surimi[J]. LWT-Food Science & Technology,2014,57(2):603−611.
[16] ZHANG B, FANG C D, HAO G J, et al. Effect of kappa-carrageenan oligosaccharides on myofibrillar protein oxidation in peeled shrimp (Litopenaeus vannamei) during long-term frozen storage[J]. Food Chemistry,2018,245(Apr.15):254−261.
[17] JOO S T, KAUFFMAN R G, KIM B C. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle[J]. Meat Science,1999,52(3):291−297. doi: 10.1016/S0309-1740(99)00005-4
[18] CHELH I, GATELLIER P, SANTE-LHOUTELLIER V. Technical note:A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science,2006,74(4):681−683. doi: 10.1016/j.meatsci.2006.05.019
[19] JIA G, NIRASAWA S, JI X, et al. Physicochemical changes in myofibrillar proteins extracted from pork tenderloin thawed by a high-voltage electrostatic field[J]. Food Chemistry,2018,240(Feb.1):910−916.
[20] WANG Z, TAN Y, YANG N, et al. Influence of oscillating uniform magnetic field and iron supplementation on quality of freeze-thawed surimi[J]. RSC Advances,2019,9(57):33163−33169. doi: 10.1039/C9RA05365D
[21] MOK J H, CHOI W, PARK S H, et al. Emerging pulsed electric field (PEF) and static magnetic field (SMF) combination technology for food freezing[J]. International Journal of Refrigeration,2015,50:137−145. doi: 10.1016/j.ijrefrig.2014.10.025
[22] 吴炜俊, 程丽娜, 徐玉娟, 等. 液氮喷雾速冻及梯度解冻在荔枝品质保鲜上的优势[J]. 现代食品科技,2022,38(3):105−114. [WU W J, CHENG L N, XU Y J, et al. Advantages of spray liquid nitrogen quick freezing and gradient thawing for quality preservation of litchi[J]. Modern Food Science and Technology,2022,38(3):105−114.] WU W J, CHENG L N, XU Y J, et al. Advantages of spray liquid nitrogen quick freezing and gradient thawing for quality preservation of litchi[J]. Modern Food Science and Technology, 2022, 38(3): 105−114.
[23] LEYGONIE C, BRITZ T J, HOFFMAN L C. Oxidative stability of previously frozen ostrich Muscularis iliofibularis packaged under different modified atmospheric conditions[J]. International Journal of Food Science & Technology,2011,46(6):1171−1178.
[24] LI F, DU X, WANG B, et al. Inhibiting effect of ice structuring protein on the decreased gelling properties of protein from quick-frozen pork patty subjected to frozen storage[J]. Food Chemistry,2021,353(Aug.15):129104.1−29104.8.
[25] MAHSA M, MOLOUD N, REZA E. Effect of thawing under an alternating magnetic field on rainbow trout (Oncorhynchus mykiss) fillet characteristics[J]. Food Chemistry,2023,402:134255−134255. doi: 10.1016/j.foodchem.2022.134255
[26] CHEN Q, XIE Y, XI J, et al. Characterization of lipid oxidation process of beef during repeated freeze-thaw by electron spin resonance technology and Raman spectroscopy[J]. Food Chemistry,2018,243(Mar.15):58−64.
[27] PAN N, DONG C, DU X, et al. Effect of freeze-thaw cycles on the quality of quick-frozen pork patty with different fat content by consumer assessment and instrument-based detection[J]. Meat Science,2021,172:108313. doi: 10.1016/j.meatsci.2020.108313
[28] RUBÉN D, MIRIAN P, S M P E, et al. Protein oxidation in muscle foods:A comprehensive review[J]. Antioxidants,2021,11(1):60. doi: 10.3390/antiox11010060
[29] 江俊波. 电磁场辅助肌肉解冻过程影响的研究[D]. 合肥:安徽医科大学, 2022. [JIANG J B. Study on the effect of eletrmagnetic field assisted thawing of muscle[D]. Hefei:Anhui Medical University, 2022.] JIANG J B. Study on the effect of eletrmagnetic field assisted thawing of muscle[D]. Hefei: Anhui Medical University, 2022.
[30] 朱文慧, 郭慧芳, 单春雨, 等. 微波纳米解冻对秘鲁鱿鱼保水性和蛋白结构的影响[J]. 中国食品学报,2022,22(8):145−152. [ZHU W H, GUO H F, SHAN C Y, et al. Effects of microwave nanoparticles thawing on water holding capacity and protein structure of jumbo squid (Dosidicus gigas)[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(8):145−152.] ZHU W H, GUO H F, SHAN C Y, et al. Effects of microwave nanoparticles thawing on water holding capacity and protein structure of jumbo squid (Dosidicus gigas)[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(8): 145−152.
[31] LUNDI M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods:A review[J]. Molecular Nutrition & Food Research,2011,55(1):83−95.
[32] LI F, WANG B, LIU Q, et al. Changes in myofibrillar protein gel quality of porcine longissimus muscle induced by its structural modification under different thawing methods[J]. Meat Science,2019,147:108−115. doi: 10.1016/j.meatsci.2018.09.003
[33] BAO Y L, ERTBJERG P. Effects of protein oxidation on the texture and water-holding of meat:A review[J]. Critical Reviews in Food Science and Nutrition,2019,59(22):3564−3578. doi: 10.1080/10408398.2018.1498444
[34] DONG M, XU Y, ZHANG Y, et al. Physicochemical and structural properties of myofibrillar proteins isolated from pale, soft, exudative (PSE)-like chicken breast meat:A molecular dynamics study[J]. Innovative Food Science & Emerging Technologies,2020,59:128306.
[35] DU X J, SUN Y Y, PAN D D, et al. et al. The effect of structural change on the digestibility of sarcoplasmic proteins in Nanjing dry-cured duck during processing[J]. Poultry Science,2018,97(12):4450−4457. doi: 10.3382/ps/pey316
[36] LIN T M, PARK J W. Solubility of salmon myosin as affected by conformational changes at various ionic strengths and pH[J]. Journal of Food Science,1998,63(2):215−218. doi: 10.1111/j.1365-2621.1998.tb15712.x
[37] QIAN S, HU F, MEHMOOD W, et al. The rise of thawing drip:Freezing rate effects on ice crystallization and myowater dynamics changes[J]. Food Chemistry, 2022, 373(Mar. 30 Pt. B):131461.1-131461.9.
[38] ZHANG Z, YANG Y, ZHOU P, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry,2017,217:678−686. doi: 10.1016/j.foodchem.2016.09.040
[39] QIAN S, LI X, WANG H, et al. Effects of low voltage electrostatic field thawing on the changes in physicochemical properties of myofibrillar proteins of bovine longissimus dorsi muscle[J]. Journal of Food Engineering,2019,261(Nov.):140−149.
[40] GUO J, ZHOU Y, YANG K, et al. Effect of low-frequency magnetic field on the gel properties of pork myofibrillar proteins[J]. Food Chemistry,2018,274:775−781.
-
期刊类型引用(2)
1. 陈衍真,满文娟,程雷娜,王淑娴,魏鉴腾,曾祥俊. 响应面法优化肉苁蓉多糖提取液的脱色工艺及其抗氧化活性研究. 食品安全质量检测学报. 2025(05): 94-103 .  百度学术
百度学术
2. 魏鉴腾,申奥,张丹阳,陈衍真,周万聪,王淑娴. 高速剪切辅助提取蕨麻多糖工艺优化及抗氧化活性研究. 食品安全质量检测学报. 2024(23): 115-124 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:
 下载:
下载:



