Effect of Lipid Peroxyl Radicals on the Structure and Processing Properties of Egg Yolk Protein
-
摘要: 为明确脂质过氧自由基(ROO·)对蛋黄蛋白结构和加工性能的影响,在有氧条件下分别以0、0.04、0.2、0.5、1、5、10 mmol/L 2,2'-偶氮二(2-甲基丙基咪)二盐酸盐(2,2'-Azobis (2-amidinopropane) dihydrochloride,AAPH)产生的ROO·作用于蛋黄蛋白,研究蛋黄蛋白结构、理化性质以及功能特性的变化。结果表明:随AAPH浓度增加,蛋黄蛋白的羰基含量显著增加(P<0.05),总巯基含量显著减少(P<0.05);随着氧化反应加剧,蛋黄蛋白的二、三级结构明显改变,蛋白质发生了聚集;表面疏水性表现出先增强后减弱的趋势;Zeta电位的绝对值呈现先减少后增加随后递减的趋势;此外,持续的氧化导致蛋黄蛋白溶解度下降,乳化性能分析发现0.5 mmol/L的AAPH可实现蛋黄蛋白的最佳乳化性能。主成分分析(Principal component analysis,PCA)发现,不同氧化程度下产生的ROO·对蛋黄蛋白的影响差异明显。本研究深入揭示了蛋黄蛋白在AAPH氧化体系下的变化规律,为鸡蛋加工过程中的氧化控制、品质调控提供一定的参考依据。Abstract: To clarify the effect of lipid peroxyl radicals on the structure and processing properties of egg yolk protein, peroxyl radicals produced at different concentrations of 2,2'-Azobis (2-methylpropylimide) dihydrochloride (AAPH) was applied to egg yolk proteins under aerobic conditions to study the changes of structure, physicochemical properties and functional properties of egg yolk protein. The results showed that the carbonyl content of egg yolk protein was significantly increased (P<0.05) and the total number of sulfhydryl groups was significantly reduced (P<0.05) with increasing AAPH concentration. Meanwhile, the secondary and tertiary structure of egg yolk protein changed obviously, and protein aggregation occurred with the intensification of oxidation reaction. The surface hydrophobicity showed apparent increased and then decreased. The absolute value of zeta potential showed a tendency to decrease firstly and then increasibng, and finally decreasing. In addition, the continuous oxidation resulted in the decrease of solubility of yolk protein, and the emulsification performance analysis indicated that 0.5 mmol/L of AAPH could achieve the best emulsification performance of yolk protein. Principal component analysis (PCA) showed that the effects of peroxy radical produced under different oxidation degrees on egg yolk protein varied obviously. This study revealed the changes of egg yolk protein under AAPH oxidation system, which would provide a certain reference basis for the oxidation control and quality control in egg processing.
-
Keywords:
- egg yolk proteim /
- peroxy radical /
- lipid oxidation /
- structure /
- processing performance
-
鸡蛋蛋黄是一个复杂的脂质-蛋白质体系,具有极高的营养价值。其中,蛋黄蛋白质具备优良的溶解性、乳化性和凝胶性等功能特性,是一种极具发展前景的动物性蛋白质[1]。研究发现,受贮藏时间、温度、湿度等因素的影响[2],鸡蛋蛋黄在贮藏过程中发生显著变化,如pH增大、蛋黄指数减小、水分含量增加等,导致鸡蛋品质下降。
脂质氧化和蛋白质氧化是鸡蛋质量和营养价值下降的主要原因[3]。研究表明,脂质氧化和蛋白质氧化在食品体系中是相辅相成的,都可以通过自由基链式反应来实现[4],且可以在脂质和蛋白质之间相互转移[5−6]。然而也有研究证明,食品体系中脂质氧化先于蛋白质氧化。因此,在脂质和蛋白质介导的氧化过程中,脂质氧化产生的自由基和氢过氧化物可能会促进蛋白质氧化[7],并且促使蛋白质结构产生变化发生共价交联,一旦蛋白质的结构改变,其功能特性也将改变[8]。
目前关于蛋黄脂质氧化产物对卵黄蛋白影响的研究较少,本研究利用过氧化自由基构建脂质氧化产物-蛋黄蛋白质体系,以探究脂质氧化产物对蛋黄蛋白质理化性质与功能特性的影响,明确脂质氧化产物对蛋白质的作用,为鸡蛋加工过程中的氧化控制、品质调控提供相应的理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜鸡蛋 石河子市宏鑫生物有限公司提供;2,2'-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、5,5'-二硫代-双(硝基苯甲酸)(5,5'-Dithiobis (2-nitrobenzoic acid),DTNB)、2,4-二硝基苯肼(2,4-Dinitrophenylhydrazine,DNPH)、1-苯氨基萘-8-磺酸(8-Anilino-1-naphthalenesulfonic acid,ANS) 上海麦克林生化科技有限公司;三羟甲基氨基甲烷(Tris (hydroxymethyl) aminomethane,Tris) 天津市渤化化学试剂有限公司;R-250考马斯亮蓝 电泳纯,武汉华翔科洁生物技术有限公司;溴酚蓝 武汉华翔科洁生物技术有限公司;盐酸胍、甘氨酸 天津市精细化工有限公司;其余试剂均为分析纯。
Bench Top Pro冷冻干燥机 美国SP Scientific;150SD恒温恒湿培养箱 上海一恒科学仪器有限公司;KH19A冷冻离心机 湖南凯达科学仪器有限公司;X7酶标仪 上海闪谱生物科技有限公司;SH21-1恒温磁力搅拌器 上海梅颖浦仪器仪表制造有限公司;T2A凝胶成像仪 Bio-Red公司;DYY-8C电泳仪 北京市六一仪器厂;Bruker Senterra拉曼光谱仪 德国Bruker Technology公司;Nano-ZS型激光光散射仪 英国nanoZS公司。
1.2 实验方法
1.2.1 蛋黄蛋白提取
使用Liu等[9]描述的方法提取蛋黄蛋白,并稍作修改。鸡蛋去壳后,留取蛋黄置于滤纸上,用超纯水缓慢冲洗残留的蛋清及系带,冲净后缓缓转移到另一张干净的滤纸上,用滴管划破蛋黄膜,取蛋黄液于烧杯中,并在冰水浴下涡旋混合10 min,于4 ℃下避光保存,备用。用9倍体积去离子水稀释蛋黄,取一定量稀释蛋黄液,用盐酸将蛋黄液pH调至5,冰浴条件下搅拌1 h,然后在4 ℃下离心30 min(6000 r/min)。所得上清液为蛋黄蛋白质,随后使用冷冻干燥机进行冻干,并保存。
1.2.2 ROO·体系构建
根据Cheng等[10]的方法,稍作修改。用10 mmol/L 磷酸钠缓冲液(pH7.4)配制蛋黄蛋白溶液(10 mg/mL),向蛋白溶液中加入AAPH,使其溶液中的AAPH终浓度分别为0、0.04、0.2、0.5、1、5、10 mmol/L。将制备出的溶液于37 ℃在黑暗中连续振荡培养24 h,迅速冰浴(0~4 ℃)停止反应。随后在4 ℃下离心15 min(转速为6000 r/min),以除去少量不溶性物质,得到的上清液在4 ℃下透析(10000 Da)48 h,以除去残留的AAPH,冷冻干燥并储存在4 ℃下,保存备用。
1.2.3 指标测定
1.2.3.1 羰基含量测定
羰基含量的测量方法如Yuan等[11]所述,并稍作修改。取1 mg氧化后的蛋黄蛋白冻干粉溶解于磷酸钠缓冲液(10 mmol/L,pH 7.4,1 mg/mL)作为样品溶液备用。取1 mL的样品溶液(1 mg/mL)与3 mL 10 mmol/L DNPH溶液充分混匀,于暗室静置1 h。随后加入4 mL 20%的三氯乙酸,搅拌1 min,静置10 min后离心(5000 r/min,10 min),弃上清液收集沉淀,用1 mL的乙酸乙酯-乙醇混合溶液(v/v=1:1)充分洗涤,离心并收集沉淀,去除残留试剂。沉淀加入3 mL 6 mol盐酸胍,37 ℃条件下水浴15 min后5000 r/min离心10 min,取上清液于370 nm波长下测定溶液吸光度[12],并根据以下公式计算:
羰基含量(nmol/mg)=A370×10622000×C 式中:A370为370 nm下的吸光度;106为摩尔基础单位;C为测得的蛋白浓度,mmol/L。
1.2.3.2 总巯基含量测定
参照Wang等[13]的方法,取1 mL样品溶液(1 mg/mL)加入到2 mL Tris-Gly缓冲液中(含尿素,pH为8),并加入20 μL DTNB溶液,涡旋混匀,在室温下静置25 min后,于412 nm下测定其吸光值,并根据以下公式计算:
巯基含量(nmol/mg)=A412×10613600×C 式中:A412为412 nm下的吸光度;106为摩尔基础单位;C为测得的蛋白浓度,mmol/L。
1.2.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)分析
参照袁湖川等[14]的方法,并稍作修改。用SDS-PAGE缓冲液将样品溶解,沸水加热10 min,均质,上样量为10 μL。采用恒电流凝胶电泳,在120 V的起始电压下,待条带跑至分离胶再调整到160 V,直至染料的前端移动到胶体的底部,完成电泳。
1.2.3.4 拉曼光谱分析
参照Wang等[15]的方法,采用Bruker Senterra拉曼光谱仪对样品进行测定,工作波长为532 nm,激光功率为50 mw,每个样品扫三遍,并用软件记录下位移范围在1600~1700 cm−1的拉曼光谱。
1.2.3.5 内源荧光性测定
根据Bao等[16]的方法,稍作修改。用10 mmol/L pH7.4的磷酸盐缓冲液溶解1 mg氧化后的蛋黄蛋白冻干粉,配制出样品溶液(1 mg/mL)。测量参数为:激发波长:295 nm,扫描范围:300~400 nm,激发和发射狭缝宽度:5 nm。
1.2.3.6 表面疏水性测定
选用荧光探针法进行测定。参照Bao等[16]的方法,稍作修改。使用10 mmol/L pH7.4磷酸盐缓冲液将样品溶液(1 mg/mL)分别稀释成浓度为0.0001、0.001、0.002、0.01、0.1 mg/mL的蛋白质溶液。随后将20 µL ANS分别添加至4 mL不同浓度的蛋白质稀释液中,涡旋振荡10 s,于室温黑暗处反应30 min,将激发和发射波长分别设定为395、475 nm,狭缝设定为5 nm,进行测定,用蛋白质浓度(x轴)与荧光强度(y轴)做回归曲线,以初始斜率表示S0。
1.2.3.7 Zeta电位测定
参照Zhang等[17]的方法,并稍作修改。采用Nano-ZS型激光光散射仪在常温下对蛋黄蛋白Zeta电位进行测定,具体操作如下。取1 mg氧化后的蛋黄蛋白冻干粉溶解于磷酸钠缓冲液(10 mmol/L,pH 7.4,1 mg/mL)作为样品溶液。取1 mL样品溶液置于室温下的样品池中60 s进行测定。
1.2.3.8 溶解度测定
蛋黄蛋白溶解度根据Yuan等[11]的方法进行测定,蛋白溶液于6000 r/min离心15 min后,根据离心前后蛋白浓度计算蛋黄蛋白溶解度。
溶解度(%)=离心后上清液中的蛋白浓度离心前样品溶液中的蛋白浓度×100 1.2.3.9 乳化性能的测定
参照Yuan等[11]的方法,并稍作更改。取9 mL蛋白溶液加入3 mL大豆油(水相与油相体积比为3:1)一起转移到100 mL离心管中,使用高速均质器(10000 r/min)高速混合1 min。分别于0 min与15 min时取底部乳液50 μL,用加25 mL 1 g/L SDS溶液稀释后测定500 nm处吸光度。根据以下公式计算出样品的乳化活性(Emulsifying activity,EA)和乳化稳定性(Emulsification Stability,ES):
EA=A0 ES=A0×ΔTA0−A15 式中:ΔT为时间间隔,其中时间间隔为15 min;A0为0 min的吸光度值;A15为15 min的吸光度值。
1.3 数据处理
每个指标测定三组平行。显著水平为P<0.05,数据采用Microsoft excel 2016、SPSS19.0、Origin 2022进行分析及图表绘制,结果用平均值±标准差来表示。用化学计量学软件Pirouette 4.5对蛋黄蛋白进行主成分分析(Principal component analysis,PCA)分析。
2. 结果与分析
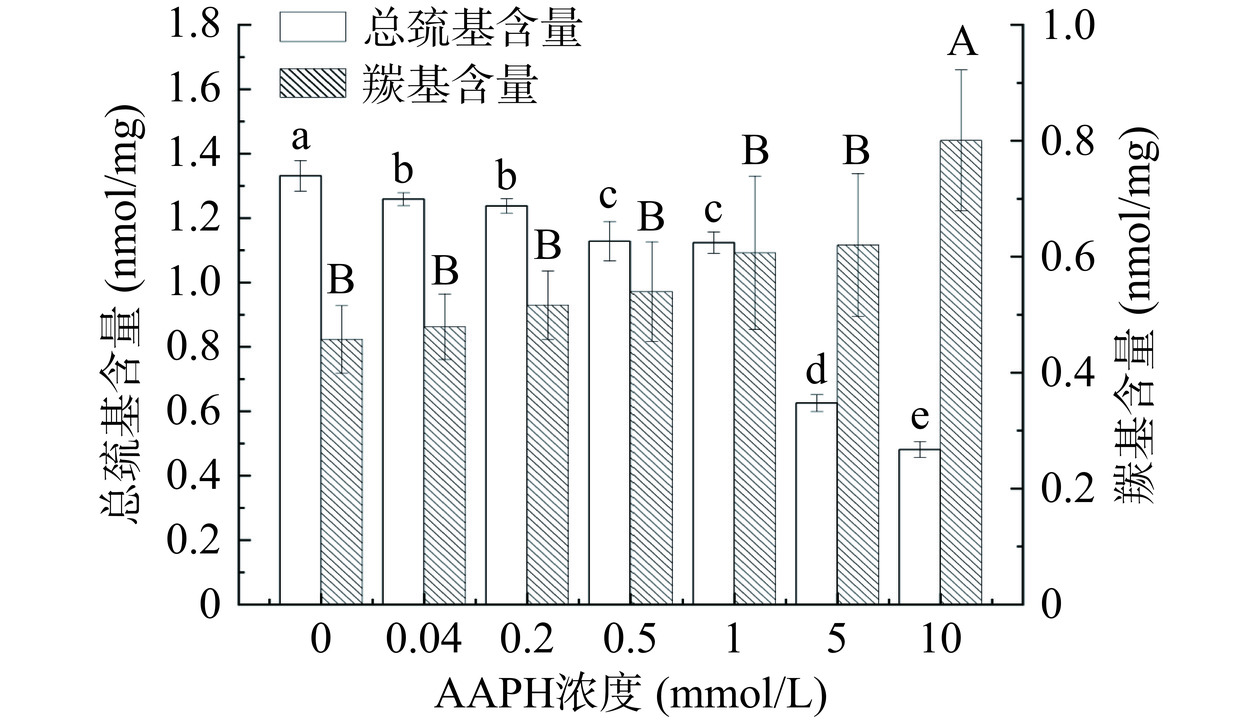
2.1 ROO·氧化对蛋黄蛋白羰基含量和总巯基含量的影响
羰基含量与氧化损伤程度密切相关,可用其含量的高低来表示蛋黄蛋白受氧化损伤程度的大小[18]。巯基则在保持蛋白质的结构中起着关键作用。
由图1可知,蛋黄蛋白羰基含量随AAPH浓度的增加而逐渐增大,但在AAPH浓度为0~5 mmol/L时,蛋黄蛋白的羰基含量变化不显著(P>0.05),这可能是由于ROO·对蛋黄蛋白产生的氧化反应强度低,暴露在空气中的氨基酸残基相对较少,故而羰基化反应不够剧烈[19]。当浓度达到10 mmol/L时,蛋黄蛋白羰基含量达到最大值为0.8007 nmol/mg,相比0 mmol/L时增加了0.8倍且变化显著(P<0.05)。说明蛋黄蛋白在此浓度下遭受了剧烈的氧化,且羰基衍生物不断累积[19]。王兆明等[20]通过对兔肉肌浆蛋白进行氧化,发现随着AAPH浓度的增大,肌浆蛋白羰基含量显著增加(P<0.05),并呈现出线性增长趋势,支持了本研究结果。而蛋黄蛋白的总巯基含量随AAPH浓度的增加而显著下降(P<0.05),此趋势与羰基含量所呈现的趋势相反,可能原因为ROO·氧化诱导使得蛋黄蛋白质中的部分巯基基团转变为二硫键,与此同时ROO·会使蛋白质发生变性聚集,产生的聚集体又能促进巯基基团的相互作用,最终导致其含量减少[21]。此外,与对照组相比发现,在较低浓度下(0.04 mmol/L)时,ROO·也会对于蛋黄蛋白总巯基含量产生显著影响(P<0.05)。在10 mmol/L时,总巯基含量为最小值0.4813 nmol/mg,相比0 mmol/L时降低了1.8倍,表明ROO·使蛋黄蛋白结构发生了改变。
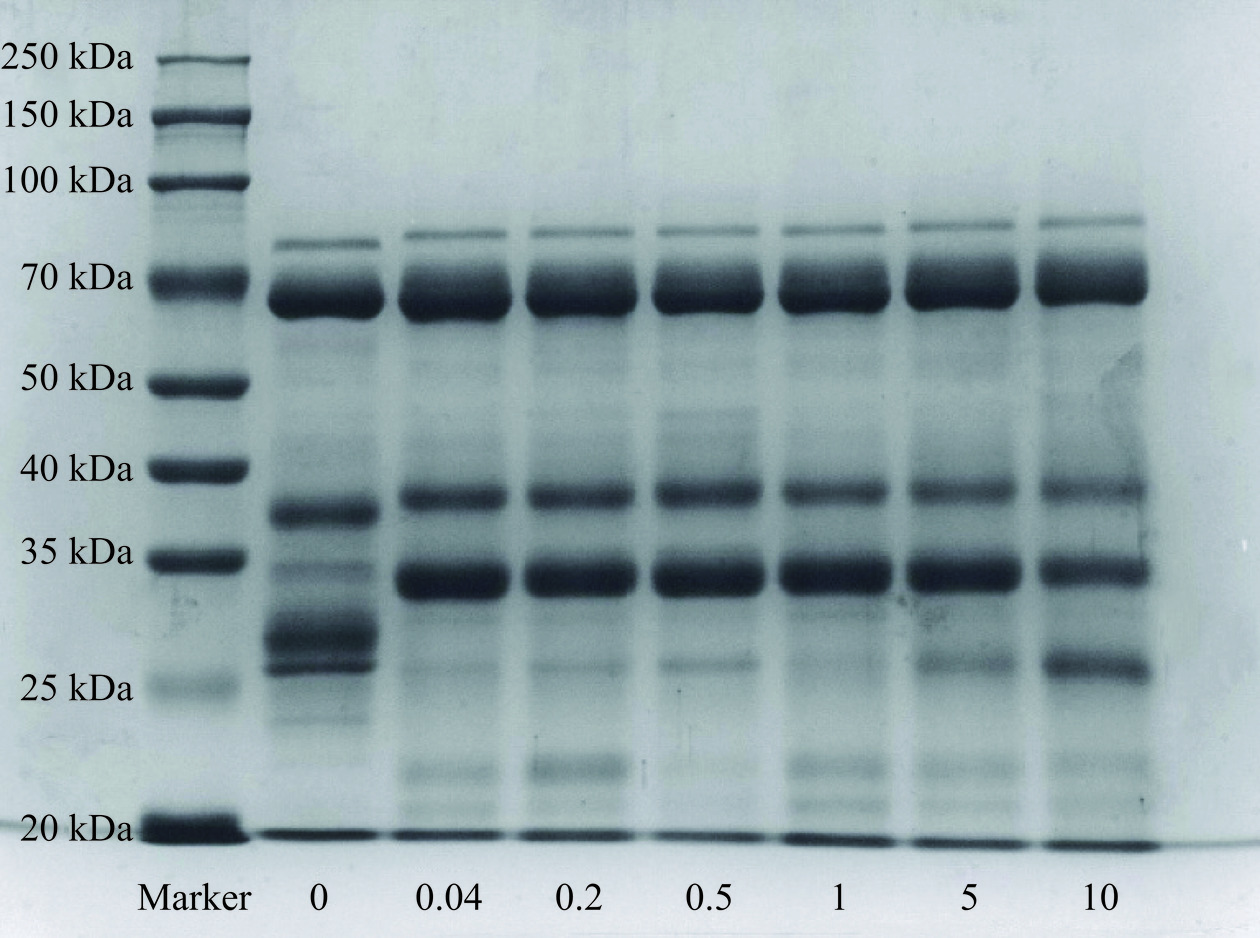
2.2 SDS-PAGE分析
如图2所示,蛋黄蛋白在不同浓度AAPH下的分子质量主要分布在20~90 kDa之间,分别为80 kDa(卵转铁蛋白、HDL载脂蛋白片段等)、66 kDa(γ-球蛋白重链、α-卵黄球蛋白)、38 kDa(卵黄高磷蛋白、β-卵黄球蛋白、HDL载脂蛋白片段等)、31.5 kDa(LDL载脂蛋白片段)、28 kDa、26 kDa(γ-球蛋白轻链)、22 kDa[22−24]。随着AAPH浓度的加深,部分条带颜色变浅(66、38、31.5 kDa),包含α-卵黄球蛋白、卵黄高磷蛋白、HDL载脂蛋白等蛋黄蛋白,其原因可能是随着氧化加剧而发生了降解。在25~35 kDa之间,相较于0 mmol/L时,高浓度下的蛋黄蛋白条带明显减少,这可能是因为随着ROO·浓度升高氧化反应加剧,使蛋白质发生了聚集。此外,AAPH浓度为10 mmol/L时蛋白质总含量与低浓度相比略低。
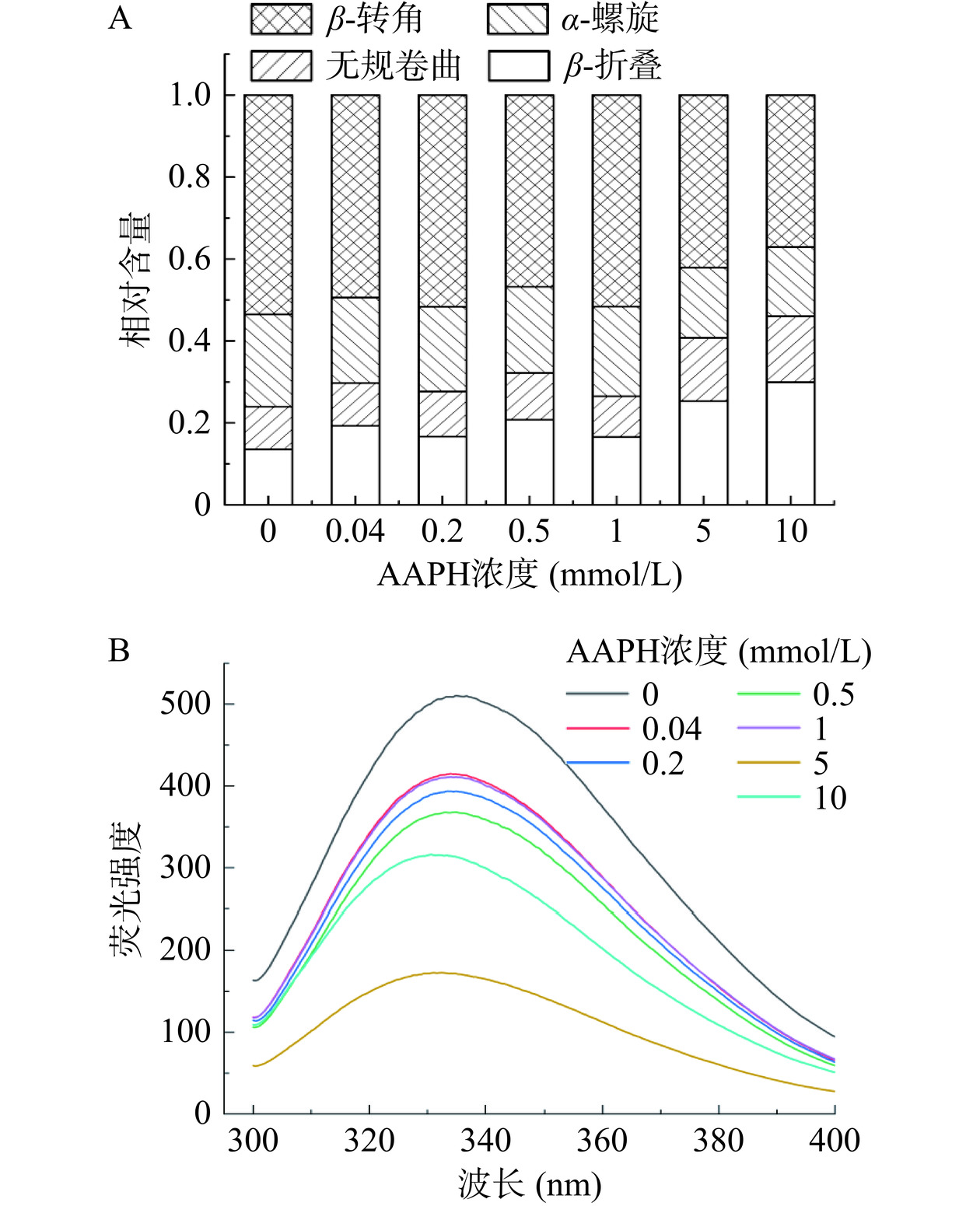
2.3 ROO·氧化对蛋黄蛋白二、三级结构的影响
拉曼光谱中的酰胺I带(1600~1700 cm−1)可以准确反映出蛋白质主链结构的变化,也可用于蛋白质二级结构相对含量的定量分析[25]。由图3A可知,随着AAPH浓度的增加,β-折叠和无规卷曲结构总体表现出增多的趋势,α-螺旋和β-转角结构总体表现出减少的趋势,说明ROO·氧化使蛋黄蛋白的二级结构发生了改变。与对照组相比,AAPH的浓度为10 mmol/L时,β-折叠和无规卷曲结构含量分别增加了16.33%、5.78%,而α-螺旋和β-转角结构含量减少了5.64%、18.47%。蛋白质二级结构主要靠氢键尤其是α-螺旋结构来维持稳定[26]。随着AAPH浓度升高,α-螺旋结构含量减少,其原因可能是ROO·攻击蛋黄蛋白分子间的氢键,使得蛋白质分子展开,相互作用逐渐降低,被解开的α-螺旋结构最终转变为无规则卷曲,使得蛋黄蛋白结构朝着不稳定的方向进行[27]。Feng等[28]发现脂质氧化过程中形成的ROO·破坏了蛋白质结构内形成的氢键,并展开α-螺旋结构,产生更多的β-折叠结构,支持了本研究结果。
内源荧光光谱不仅可以反映蛋白质三级结构和构象的变化,其强度的降低也一定程度上表明了色氨酸的变化程度,进而可表征蛋黄蛋白氧化损伤的程度。由图3B所示,0 mmol/L时,蛋黄蛋白荧光强度最大为510.47,所对应的波长范围在330~350 nm之间。随着浓度增加,内源荧光强度显示出持续降低的趋势,降至172.82,最大降幅为82%,荧光强度降低的主要原因可能是蛋黄蛋白被过氧自由基攻击而发生去折叠现象,同时会发生共价交联和聚集。此外,色氨酸的直接氧化会导致荧光强度的下降。其最大峰位逐渐蓝移是因为随着氧化程度的加剧,色氨酸被转移到更加疏水的非极性环境中[29−30]。王丹丹等[31]在研究氧化修饰对核桃蛋白的影响中也得到此规律,并得出暴露在外的色氨酸残基在经过ROO·的氧化后会被掩藏,从而致使蛋白质发生聚集。上述结果都进一步说明了ROO·氧化会导致蛋黄蛋白的聚集及结构的变化。
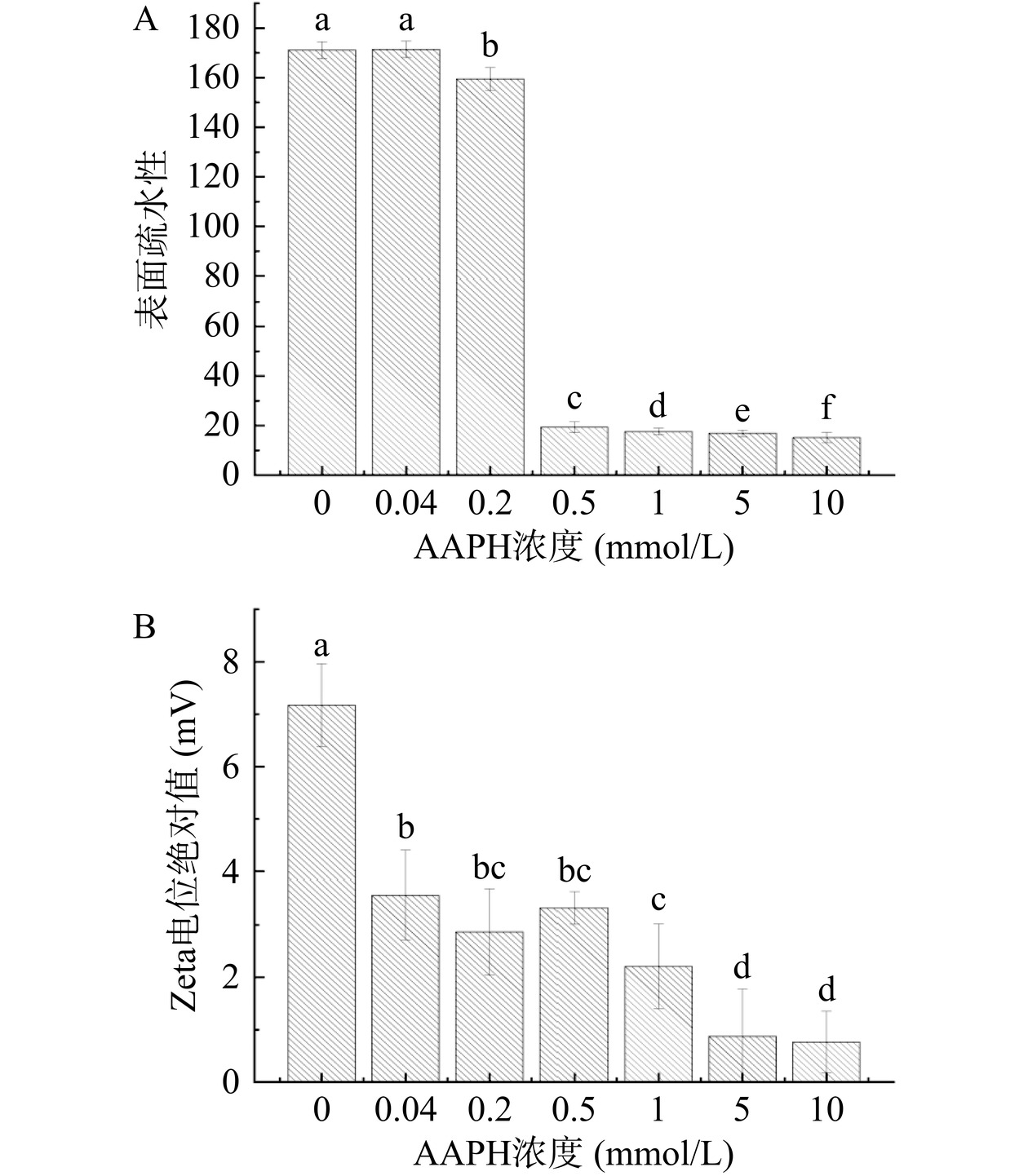
2.4 ROO·氧化对蛋黄蛋白表面疏水性和Zeta电位的影响
表面疏水性反映了蛋白质与水的相互排斥关系,它不仅可以间接地反应蛋白质的构象,还可以反映其溶解度、稳定性和自缔合能力[32−33]。由图4A可知,随着AAPH浓度的增加蛋黄蛋白表面疏水性呈现出先上升后显著下降的趋势(P<0.05)。当浓度从0 mmol/L升至0.04 mmol/L时,蛋黄蛋白的表面疏水性增加,达到最大值173.67 μg,这可能是由于蛋黄蛋白的结构随着氧化程度的增加而逐渐展开所致[32];当氧化程度进一步加大时(AAPH浓度超过0.04 mmol/L),展开的蛋白质分子重新聚集[31],从而导致蛋白表面疏水性下降。当AAPH浓度达到0.5 mmol/L时,强氧化导致原先暴露的疏水基团被包埋,并且形成新的亲水组分(例如羰基群),从而致使蛋黄蛋白的表面疏水性显著下降[34]。此实验结果表明ROO·氧化改变了蛋黄蛋白的分子构象。范婷等[35]在研究ROO·对大豆分离蛋白表面疏水性影响时发现,随AAPH浓度的增加,大豆分离蛋白表面疏水性呈现先上升后下降的趋势,与本实验研究结果一致。
本研究所测得的蛋黄蛋白的Zeta电位均为负值。由图4B可知,当AAPH浓度为0 mmol/L时,蛋黄蛋白Zeta电位绝对值为7.17 mV。随着AAPH浓度的增加,Zeta电位绝对值均呈现先减少后增加随后递减的趋势,这是由于轻微氧化破坏了蛋黄蛋白原有结构,蛋黄蛋白稳定性略微下降,随后Zeta电位绝对值上升的原因可能是ROO·氧化使蛋黄蛋白变性且结构逐步展开,部分原来就包埋在蛋白质分子内部的带电氨基酸残基逐渐暴露,从而使蛋白质表面电荷增多[32]。而较高浓度(1~10 mmol/L)的AAPH使蛋白质发生聚集,聚集体会将一些带电的氨基酸残基包裹,从而降低了蛋白质表面电荷[32]。此外,还可以看出蛋黄蛋白被氧化修饰后Zeta电位绝对值都比0 mmol/L时低,其原因可能是ROO·氧化改变了蛋黄蛋白表面电荷和氨基酸残基的分布,使得蛋白质表面静电作用力失衡[32],这一结果与魏娜[21]研究过氧自由基氧化对鸭肉肌原纤维蛋白Zeta电位的影响一致。
2.5 ROO·氧化对蛋黄蛋白功能特性的影响
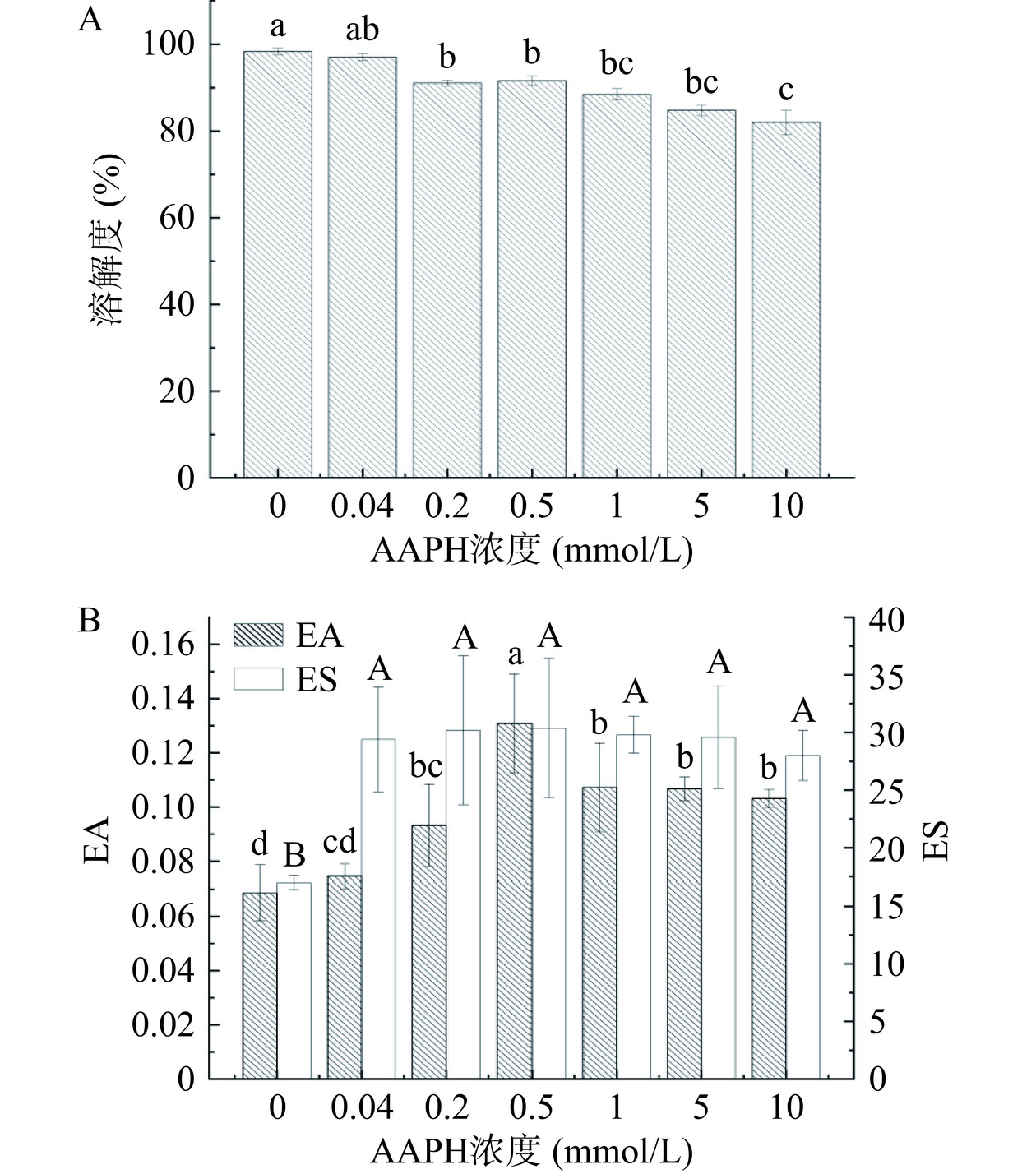
良好的溶解性是蛋白质发挥其加工特性的基础。蛋白质溶解度的变化可以直接反应蛋白质的结构转变[36]。如图5A所示,蛋黄蛋白的溶解度呈显著下降趋势(P<0.05)。0~0.5 mmol/L AAPH所致的低氧化主要使疏水性基团从蛋白内部结构暴露出来,形成可溶性聚集体,而较高的氧化程度(10 mmol/L)可能会使这些可溶性聚集体通过疏水或交联进一步聚集,最终形成不溶性聚集体,导致溶解性下降[37]。
蛋白质的乳化性能在食品系统中起着至关重要的作用[38],乳化性能包括EA和ES[39−40]。由图5B可知,蛋黄蛋白的乳化性能总体呈先上升后下降的趋势,但相较于EA,AAPH浓度的变化对蛋黄蛋白的ES产生的影响变化趋势略不显著。当AAPH的浓度为0.5 mmol/L时,蛋黄蛋白的乳化性能达到最高,分别为0.1308 m2/g(EA)和30.3774 min(ES)。由此可得,低浓度的ROO·对蛋黄蛋白乳化性能的改善有益,但在高浓度下,蛋黄蛋白的乳化性能会受到抑制。因此,适当的氧化可以改善蛋黄蛋白的乳化性能。当AAPH浓度较低(0~0.5 mmol/L)时,蛋黄蛋白乳化性能有所上升,可能是因为氧化形成了聚集体,使表面积增大,蛋白质与油滴充分结合,从而提高其乳化性能[18];而随着浓度升高,ROO·强烈攻击使蛋黄蛋白变性,稳定性变差,结合油滴的能力也有所减弱,从而致使乳化性能降低。
2.6 主成分分析
对不同浓度ROO·氧化蛋黄蛋白结构及功能特性进行主成分分析,在分析过程中,PCA可以非常直观地看出各个样本之间的相似性。由图6可知,主成分1和主成分2分别占47.47%和26.73%,可以解释总变异的74.20%。这7组不同浓度AAPH样本所对应的散点在组内呈现相互聚集的情况,说明同组样本数据较接近,而组间则具有较好的区分度。在PC1与PC2轴上以原点为界限可将这七组样本划分为四个部分。PCA结果表明在不同氧化程度下产生的ROO·对蛋黄蛋白的影响差异显著。
3. 结论
本研究发现,AAPH氧化系统以浓度依赖性的方式改变蛋黄蛋白的结构和理化性质。过氧化自由基氧化使得蛋黄蛋白羰基含量升高总巯基含量减少,同时蛋黄蛋白结构发生改变,逐渐向不稳定的方向发展。此外,随着AAPH浓度的增加,蛋黄蛋白加工性能也发生了改变,蛋黄蛋白的溶解性下降,同时发现适度的氧化能提高蛋黄蛋白的乳化性能,该结果为蛋黄蛋白及其相关产品的加工和品质调控提供了有益的见解。本研究阐明了脂质ROO·对蛋黄蛋白结构和加工性能产生显著的影响,明确鸡蛋中的脂质氧化产物对蛋白质的作用,对提高鸡蛋的营养价值和安全性能具有借鉴意义。
-
-
[1] 尤翔宇, 黄慧敏, 吴晓娟, 等. 过氧自由基氧化对米糠蛋白结构和功能性质的影响[J]. 食品科学,2019,40(4):34−41. [YOU X Y, HUANG H M, WU X J, et, al. Effects of oxidative modification by peroxyl radicals on the structueral and functional properties of rice bran protein[J]. Food Science,2019,40(4):34−41.] YOU X Y, HUANG H M, WU X J, et, al. Effects of oxidative modification by peroxyl radicals on the structueral and functional properties of rice bran protein[J]. Food Science, 2019, 40(4): 34−41.
[2] 刘钰, 赵孟斌, 于浩坤, 等. 鸡蛋贮藏过程中脂质氧化与内源酶活性的相关性[J]. 食品科学,2020,41(7):198−202. [LIU Y, ZHAO M B, YU H K, et al. Correlation between lipid oxidation and the activity of endogenous enzymes during egg storage[J]. Food Science,2020,41(7):198−202.] LIU Y, ZHAO M B, YU H K, et al. Correlation between lipid oxidation and the activity of endogenous enzymes during egg storage[J]. Food Science, 2020, 41(7): 198−202.
[3] MAO X Y, WANG D D, SUN L G, et al. Effect of Peroxyl-Radicals-Induced oxidative modification in the physicochemical and emulsifying properties of walnut protein[J]. Journal of the American Oil Chemists' Society,2021,98(9):903−910. doi: 10.1002/aocs.12367
[4] 颜廷旋, 余霞, 邹莉芳, 等. 药食同源植物提取物对肉制品品质影响研究进展[J]. 肉类研究,2021,35(11):57−63. [YAN T X, YU X, ZOU L F, ea al. Progress in research on the effect from edible and medicinal plants on the quality of meat products[J]. Meat Research,2021,35(11):57−63.] YAN T X, YU X, ZOU L F, ea al. Progress in research on the effect from edible and medicinal plants on the quality of meat products[J]. Meat Research, 2021, 35(11): 57−63.
[5] 尤翔宇. 过氧自由基和丙二醛氧化对米糠蛋白结构、功能性质和消化性质的影响[D]. 长沙:中南林业科技大学,2019. [YOU X Y. Effect of oxidative modification on structuer functional properties and digestibility of rice bran protein by peroxyl radicals and malondialdehyde[D]. Changsha:Central South University of Forestry and Technology,2019.] YOU X Y. Effect of oxidative modification on structuer functional properties and digestibility of rice bran protein by peroxyl radicals and malondialdehyde[D]. Changsha: Central South University of Forestry and Technology, 2019.
[6] 王兆明, 贺稚非, 李洪军. 脂质和蛋白质氧化对肉品品质影响及交互氧化机制研究进展[J]. 食品科学,2018,39(11):295−301. [WANG Z M, HE Z F, LI H J. A review of the effect of lipid and protein oxidation on meat quality and their interrelationship[J]. Food Science,2018,39(11):295−301.] WANG Z M, HE Z F, LI H J. A review of the effect of lipid and protein oxidation on meat quality and their interrelationship[J]. Food Science, 2018, 39(11): 295−301.
[7] LIU Q, LU Y, HAN J C, et al. Structure-modification by moderate oxidation in hydroxyl radical-generating systems promote the emulsifying properties of soy protein isolate[J]. Food Structure,2015,6:21−28. doi: 10.1016/j.foostr.2015.10.001
[8] YANG Y, ZHAO Y, XU M S, et al. Effects of strong alkali treatment on the physicochemical properties, microstructure, protein structures, and intermolecular forces in egg yolks, plasma, and granules[J]. Food Chemistry,2020,311:125998. doi: 10.1016/j.foodchem.2019.125998
[9] LIU Y, SHENG L, MA M, et al. Proteome-based identification of chicken egg yolk proteins associated with antioxidant activity on the Qinghai-Tibetan Plateau[J]. International Journal of Biological Macromolecules,2020,150:1093−1103. doi: 10.1016/j.ijbiomac.2019.10.115
[10] CHENG Y, CHI Y, GENG X H, et al. Effect of 2,2′-azobis (2-amidinopropane) dihydrochloride (AAPH) induced oxidation on the physicochemical properties, in vitro digestibility, and nutritional value of egg white protein[J]. LWT,2021,143:111103. doi: 10.1016/j.lwt.2021.111103
[11] YUAN H C, LIU Y, LUO R F, et al. Effects of lutein-phospholipids emulsion on oxidatively stressed egg yolk protein[J]. LWT-Food Science and Technology,2021,152:112187. doi: 10.1016/j.lwt.2021.112187
[12] 孙慧琳, 代媛媛, 孟兰奇, 等. 牛肉低温储藏过程中水分迁移与蛋白质氧化的相关性研究[J]. 保鲜与加工,2021,21(5):28−33,46. [SUN H L, DAI Y Y, MENG L Q, et al. Correlation research between water migration and protein oxidation of beef under cryopreservation[J]. Storage and Process,2021,21(5):28−33,46.] SUN H L, DAI Y Y, MENG L Q, et al. Correlation research between water migration and protein oxidation of beef under cryopreservation[J]. Storage and Process, 2021, 21(5): 28−33,46.
[13] WANG Z M, HE Z F, GAN X, et al. Interrelationship among ferrous myoglobin, lipid and protein oxidations in rabbit meat during refrigerated and superchilled storage[J]. Meat Science,2018,146:131−139. doi: 10.1016/j.meatsci.2018.08.006
[14] 袁湖川, 刘钰, 冉丽丹, 等. 鸡蛋贮藏过程中蛋黄内源抗氧化组分与氧化进程的关系[J]. 食品科学,2021,42(13):233−240. [YUAN H C, LIU Y, RAN L D, et al. Potential relationship between endogenous antioxidant components and egg yolk oxidation process during hen egg storage[J]. Food Science,2021,42(13):233−240.] doi: 10.7506/spkx1002-6630-20200604-063 YUAN H C, LIU Y, RAN L D, et al. Potential relationship between endogenous antioxidant components and egg yolk oxidation process during hen egg storage[J]. Food Science, 2021, 42(13): 233−240. doi: 10.7506/spkx1002-6630-20200604-063
[15] WANG Y Y, WANG C Y, WANG S T, et al. Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr. ) seed protein hydrolysates obtained with different proteases[J]. Food Chemistry,2021,345:128765. doi: 10.1016/j.foodchem.2020.128765
[16] BAO Z, KANG D, XU X, et al. Variation in the structure and emulsification of egg yolk high-density lipoprotein by lipid peroxide[J]. Journal of Food Biochemistry,2019,43(11):e13019.
[17] ZHANG Y L, CHEN Y, XIONG Y T, et al. Preparation of high internal phase Pickering emulsions stabilized by egg yolk high density lipoprotein:Stabilizing mechanism under different pH values and protein concentrations[J]. LWT,2022,157:113091. doi: 10.1016/j.lwt.2022.113091
[18] 徐笑. 添加茯砖茶促进糯米发酵及抗氧化活性的研究[D]. 南京:南京农业大学, 2018. [XU X. The effect of Fu Brick Tea addition on fermentation characteristics and functional activities of fermented glutinous rice[D]. Nanjing:Nanjing Agricultural University, 2018.] XU X. The effect of Fu Brick Tea addition on fermentation characteristics and functional activities of fermented glutinous rice[D]. Nanjing: Nanjing Agricultural University, 2018.
[19] 杨曦, 程群, 常陆望, 等. 羟自由基和过氧自由基氧化对美藤果蛋白功能性质的影响[J]. 中国油脂,2020,45(10):35−40. [YANG X, CHENG Q, CHANG L W, et al. Effect of hydroxyl radical and peroxy radical oxidation on functional properties of sacha inchi protein[J]. China Oils and Fats,2020,45(10):35−40.] YANG X, CHENG Q, CHANG L W, et al. Effect of hydroxyl radical and peroxy radical oxidation on functional properties of sacha inchi protein[J]. China Oils and Fats, 2020, 45(10): 35−40.
[20] 王兆明, 徐宝才, 李洪军. 脂质过氧自由基诱导兔肉肌浆蛋白聚集机制[J]. 食品科学,2021,42(19):28−35. [WANG Z M, XU B C, LI H J. Mechanism underlying the aggregation of rabbit meat sarcoplasmic proteins induced by lipid peroxyl radicals[J]. Food Science,2021,42(19):28−35.] doi: 10.7506/spkx1002-6630-20200822-298 WANG Z M, XU B C, LI H J. Mechanism underlying the aggregation of rabbit meat sarcoplasmic proteins induced by lipid peroxyl radicals[J]. Food Science, 2021, 42(19): 28−35. doi: 10.7506/spkx1002-6630-20200822-298
[21] 魏娜. 羟自由基和过氧自由基氧化对鸭肉肌原纤维蛋白结构及凝胶特性的影响[D]. 重庆:西南大学,2021. [WEI N. Effects of hydroxyl radical and peroxy radical oxidation on the structure and gel properties of duck myofibrillar protein[D]. Chongqing:Xi’nan University,2021.] WEI N. Effects of hydroxyl radical and peroxy radical oxidation on the structure and gel properties of duck myofibrillar protein[D]. Chongqing: Xi’nan University, 2021.
[22] 郝丽芳. 鸡蛋贮藏期间蛋黄比较蛋白质组学研究[D]. 武汉:华中农业大学,2014. [HAO L F. Study on the egg yolk comparative proteomics during egg storage[D]. Wuhan:Huazhong Agricultural University,2014.] HAO L F. Study on the egg yolk comparative proteomics during egg storage[D]. Wuhan: Huazhong Agricultural University, 2014.
[23] 王宁. 鸡蛋LDL结构、脂质组分析及对小鼠血脂代谢的影响研究[D]. 武汉:华中农业大学,2018. [WANG N. Structure and lipidomics analysis of hen egg LDL and its effect on mice lipid metabolism[D]. Wuhan:Huazhong Agricultural University,2018.] WANG N. Structure and lipidomics analysis of hen egg LDL and its effect on mice lipid metabolism[D]. Wuhan: Huazhong Agricultural University, 2018.
[24] 于智慧. 鸡蛋高密度脂蛋白对脂质代谢的影响及机制研究[D]. 武汉:华中农业大学, 2019. [YU Z H. Effect on lipid metabolism of high-density liporotein from egg yolk and its regulation mechanism[D]. Wuhan:Huazhong Agricultural University, 2019.] YU Z H. Effect on lipid metabolism of high-density liporotein from egg yolk and its regulation mechanism[D]. Wuhan: Huazhong Agricultural University, 2019.
[25] 徐楠, 赵英, 迟玉杰. 热处理对酶改性蛋黄液乳化性的影响及拉曼光谱分析[J]. 食品科学,2019,40(21):28−34. [XU N, ZHAO Y, CHI Y J. Effect of heat treatment on emulsifying properties and raman spectroscopic characteristics of enzymatically modified egg yolk liquid[J]. Food Science,2019,40(21):28−34.] doi: 10.7506/spkx1002-6630-20180925-270 XU N, ZHAO Y, CHI Y J. Effect of heat treatment on emulsifying properties and raman spectroscopic characteristics of enzymatically modified egg yolk liquid[J]. Food Science, 2019, 40(21): 28−34. doi: 10.7506/spkx1002-6630-20180925-270
[26] 刘芳芳, 林婉玲, 李来好, 等. 海鲈鱼糜加工及凝胶形成过程中蛋白质的变化机理[J]. 食品科学,2020,41(14):15−22. [LIU F F, LIN W L, LI L H, et al. Mechanism underlying protein changes during processing and gelation of sea bass surimi[J]. Food Sience,2020,41(14):15−22.] doi: 10.7506/spkx1002-6630-20190620-232 LIU F F, LIN W L, LI L H, et al. Mechanism underlying protein changes during processing and gelation of sea bass surimi[J]. Food Sience, 2020, 41(14): 15−22. doi: 10.7506/spkx1002-6630-20190620-232
[27] LI C Q, XIONG Y L. Disruption of secondary structure by oxidative stress alters the cross-linking pattern of myosin by microbial transglutaminase[J]. Meat Science,2015,108:97−105. doi: 10.1016/j.meatsci.2015.05.024
[28] FENG X, WU D, YANG K, et al. Effect of sarcoplasmic proteins oxidation on the gel properties of myofibrillar proteins from pork muscles[J]. Journal of Food Science,2021,86(5):1835−1844. doi: 10.1111/1750-3841.15687
[29] GE X Y, XU Y, CHEN D, et al. Effects of AAPH on structure, allergenicity and physicochemical properties of shrimp myofibrillar protein[J]. LWT,2023,187:115306. doi: 10.1016/j.lwt.2023.115306
[30] 曾谦, 黄星雨, 何嘉敏, 等. 羟自由基氧化对鹰嘴豆蛋白的结构及溶解性的影响研究[J]. 农产品加工,2021(19):1−5,8. [ZENG Q, HAUNG X Y, HE J M, et al. Effect of hydroxyl radical oxidation on the structure and solubility of chickpea protein[J]. Farm Products Processing,2021(19):1−5,8.] ZENG Q, HAUNG X Y, HE J M, et al. Effect of hydroxyl radical oxidation on the structure and solubility of chickpea protein[J]. Farm Products Processing, 2021(19): 1−5,8.
[31] 王丹丹, 毛晓英, 孙领鸽, 等. 氢过氧化物氧化对核桃蛋白结构和乳化特性的影响[J]. 中国食品学报,2019,19(12):60−68. [WANG D D, MAO X Y, SUN L G, et al. Effect of oxidation by hydrogen peroxide on the structure and emulsifing properties of walnut protein[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(12):60−68.] WANG D D, MAO X Y, SUN L G, et al. Effect of oxidation by hydrogen peroxide on the structure and emulsifing properties of walnut protein[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(12): 60−68.
[32] 李学鹏, 刘慈坤, 王金厢, 等. 烷过氧自由基氧化对草鱼肌原纤维蛋白热聚集行为的影响[J]. 食品科学,2020,41(17):9−16. [LI X P, LIU C K, WANG J X, et al. Effect of alkylperoxyl radical oxidation on heat-induced aggregation behavior of myofibrillar protein from grass carp(Ctenopharyngodon idellus)[J]. Food Science,2020,41(17):9−16.] doi: 10.7506/spkx1002-6630-20190824-254 LI X P, LIU C K, WANG J X, et al. Effect of alkylperoxyl radical oxidation on heat-induced aggregation behavior of myofibrillar protein from grass carp(Ctenopharyngodon idellus)[J]. Food Science, 2020, 41(17): 9−16. doi: 10.7506/spkx1002-6630-20190824-254
[33] 叶凤凌, 池玉闽, 周敏之, 等. 氧化对兔肉肌原纤维蛋白结构、乳化性和凝胶性的影响研究[J]. 食品工业科技,2020,41(24):22−30. [YE F L, CHI Y M, ZHOU Minzhi, et al. Effect of oxidation on the structure, emulsification and gelability od rabbit meat myofibrillar protein[J]. Science and Technology of Food Industry,2020,41(24):22−30.] YE F L, CHI Y M, ZHOU Minzhi, et al. Effect of oxidation on the structure, emulsification and gelability od rabbit meat myofibrillar protein[J]. Science and Technology of Food Industry, 2020, 41(24): 22−30.
[34] WANG J M, TAN Y Y, XU H, et al. Effect of 2, 2-azobis (2-amidinopropane) dihydrochloride oxidized casein on the microstructure and microrheology properties of emulsions[J]. Food Science and Biotechnology,2016,25(5):1283−1290. doi: 10.1007/s10068-016-0202-8
[35] 范婷, 赵强, 赵小莉, 等. 脂质自由基AAPH体外氧化对富硒大豆分离蛋白性质和结构的影响[J]. 现代食品科技,2016,32(2):100−106,92. [FAN T, ZHAO Q, ZHAO X L, et al. Effect of peroxyl radical produced by in vitro oxidation by lipid radical AAPH on properties and structure of selenium-enriched SPI[J]. Modern Food Science and Technology,2016,32(2):100−106,92.] FAN T, ZHAO Q, ZHAO X L, et al. Effect of peroxyl radical produced by in vitro oxidation by lipid radical AAPH on properties and structure of selenium-enriched SPI[J]. Modern Food Science and Technology, 2016, 32(2): 100−106,92.
[36] MIRZAEI H, REGNIER F. Protein:Protein aggregation induced by protein oxidation[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2008,873(1):8−14.
[37] SUN J, ZENG Q, YANG X, et al. Effects of peroxyl radicals on the structural characteristics and fatty acid composition of high-density lipoprotein from duck egg yolk[J]. Foods,2022,11(11):1634. doi: 10.3390/foods11111634
[38] TIAN L J, HU S T, JIA J, et al. Effects of short-term fermentation with lactic acid bacteria on the characterization, rheological and emulsifying properties of egg yolk[J]. Food Chemistry,2021,341:128163. doi: 10.1016/j.foodchem.2020.128163
[39] 盖晴晴. 水酶法提取牡丹籽油工艺改进及水相蛋白特性研究[D]. 无锡:江南大学,2020. [GAI Q Q. Process improvement on aqueous enzymatic extraction of peony seed oil and investigation on protein properties[D]. Wuxi:Jiangnan University,2020.] GAI Q Q. Process improvement on aqueous enzymatic extraction of peony seed oil and investigation on protein properties[D]. Wuxi: Jiangnan University, 2020.
[40] LI W W, HU Q, CHAN W. Mass Spectrometric and spectrofluorometric studies of the interaction of aristolochic acids with proteins[J]. Scientific Reports,2015,5(1):15192. doi: 10.1038/srep15192





 下载:
下载:

 下载:
下载:



