Screening, Identification and Conditions Optimization of High Chitosanase Producing Strains, and Analysis of Its Enzymatic Properties
-
摘要: 为了筛选出高产壳聚糖酶的菌株,并对其最优产酶条件及酶学性质进行研究。本研究从广西北海养殖虾塘底泥采样,经初筛、复筛选出高产壳聚糖酶菌株,并进行鉴定,再通过单因素实验、Plackett-Burman 及正交试验优化产酶工艺,最后对其酶学性质及产物进行研究。结果表明,筛选到1株高产壳聚糖酶的菌株Gxun-5.3.3,鉴定为蜡样芽孢杆菌(Bacillus cereus);菌株Gxun-5.3.3产酶的最优工艺为:麦芽糖5 g/L、酵母粉3 g/L、壳聚糖 15 g/L、初始pH6.0、发酵时间84 h,优化后酶活可达62.03±1.18 U/mL,较优化前(39.87±1.24 U/mL)提高了55.58%;酶学性质研究表明,该酶最适反应温度为60 ℃,最适反应pH为5.0,金属离子中Fe2+、Mn2+对壳聚糖酶有显著(P<0.05)的激活作用,而Al3+、Cu2+则有较强的抑制作用;酶解壳聚糖产物经薄层层析(Thin Layer Chromatography,TLC)测定为聚合度2~4的壳寡糖,表明菌株所产壳寡糖酶为内切型。本研究为B. cereus Gxun-5.3.3壳聚糖酶的生产和壳寡糖的酶法制备提供了理论依据。Abstract: To screen and identify high chitosanase producing strains and to optimize the fermentation condition and analyze the enzymatic properties of the target strain. In this study, high chitosanase-producing strain was screened from the sediment of shrimp ponds in Beihai, Guangxi through primary and secondary screening. The strain underwent identification, the enzyme production process of the strain was optimized through single-factor, Plackett-Burman and orthogonal optimization methods. The enzymatic properties and products of chitosanase produced by the strain were studied. The results showed that the strain of Gxun-5.3.3 with high chitosanase production was obtained by screening and was identified as Bacillus cereus. The optimal components for the enzyme-producing medium of B. cereus Gxun-5.3.3 was maltose 5 g/L, yeast powder 3 g/L, chitosan 15 g/L, and the initial pH and fermentation time were 6.0 and 84 h, respectively. Under the optimized conditions, the chitosanase activity reached 62.03±1.18 U/mL, which was 55.58% higher before optimization (39.87±1.24 U/mL). The protease produced by strain Gxun-5.3.3 had maximum activity at 60 ℃ and optimum pH at 5.0, respectively. Metal ions Fe2+ and Mn2+ had a significant (P<0.05) activation effect on chitosanase, but Al3+ and Cu2+ had a strong inhibition. The enzymatic chitosan products were determined by TLC (thin layer chromatography) as chito-oligosaccharides with polymerization degree 2~4, indicating that the chitosanase produced by the strain was acting on endo-oligosaccharides. This study would provide a theoretical basis for the chitosanase production of B. cereus Gxun-5.3.3 and the enzymatic preparation of chito-oligosaccharides.
-
甲壳素是自然界中仅次于纤维素的第二大天然高分子物质,广泛存在于海洋中的虾蟹壳、陆生昆虫[1]。甲壳素脱乙酰基后称为壳聚糖,壳聚糖中含有不稳定的糖苷键,可通过水解得到水溶性、相容性和安全性较好的壳寡糖。壳寡糖在较短的N-葡萄糖胺(N-Glc)单元上暴露出阳离子基团,因此具有较高的细胞传导性,可通过肠上皮细胞进行吸收[2]。壳寡糖在医学上表现出抗糖尿病[3]、抗HIV-1[4]和调节机体免疫活性[5]等功能,在食品应用上,可作为食品天然防腐产品替代苯甲酸钠等化学防腐剂[6],并且具有良好的吸湿保湿能力,对果蔬起到保鲜作用[7]。总之,壳寡糖在许多方面具有广阔的应用前景。
目前,壳寡糖的生产主要有化学酸解法、物理降解法、生物酶解法。化学酸解壳聚糖过程中O-糖苷键、N-乙酰键都会被水解,存在条件控制难、活性丧失等问题[8];物理降解法产物纯度高,但产量低,大规模生产受限制[9];生物酶解法无毒可控,对产物结构影响较小[10],且酶解过程具有反应条件温和、稳定性高、无环境污染、可在经济上实现大规模可持续生产等优点[11]。因此,酶解法生产壳寡糖成为当前的研究热点之一。
壳聚糖酶又称壳聚糖N-乙酰氨基葡糖水解酶,可专一性催化壳聚糖生成壳寡糖或氨基葡萄糖,由Monaghan等[12]1973年首次提出。根据其在底物上的切割方式不同可分为内切壳聚糖酶和外切壳聚糖酶。自然界中许多微生物都可以产壳聚糖酶,Aktuganov等[13]的研究表明苏云金杆菌(Bacillus thuringiensis var.dendrolimus)B-387产壳聚糖内切酶活性为3~12.5 U/mL。Wang等[14]研究的水状杆菌属(Aquabacterium sp.)A7-Y产壳聚糖内切酶能够降解真菌细胞壁,产酶活性为18 U/mg。陈小娥[15]研究的曲霉属(Aspergillus sp.)CJ22-3产外切酶壳聚糖酶活性为3.06 U/mL。尽管目前对产壳聚糖酶菌株的筛选取得一定的进展,但仍存在酶活水平低,抗逆性差等问题,严重影响壳寡糖的酶法生产。因此,亟需筛选出产壳聚糖酶活性高、抗逆性强的菌株。
本研究旨在筛选出高产壳聚糖酶的菌株,并进行鉴定及产酶条件优化,进一步对菌株产酶性质及产物进行分析,以期为利用该菌株所产壳聚糖酶生产壳寡糖提供理论依据。
1. 材料与方法
1.1 材料与仪器
菌株 由本实验室从广西北海海虾养殖场底泥中分离获得;葡萄糖、麦芽糖、粉末壳聚糖 上海源叶生物科技有限公司;酵母粉、大豆粉、革兰氏染色试剂盒、芽孢染色试剂盒 青岛海博生物科技有限公司;K2HPO4、KH2PO4、MgSO4·7H2O、NaCl、(NH4)2SO4 均为国产分析纯。
Epoch酶标仪 美国BioTek公司;Fresco 21微量离心机 金博仕生物技术有限公司;T100 PCR仪 上海超敏生物科技有限公司;WD-9413C凝胶成像分析仪 济南来宝医疗器械有限公司;SUPRA 55 Sapphire场发射扫描电子显微镜 德国卡尔蔡司公司。
1.2 实验方法
1.2.1 培养基配制
富集培养基(g/L):壳聚糖5,KH2PO4 0.1,(NH4)2SO4 10,MgSO4·7H2O 0.7,K2HPO4·3H2O 0.2,NaCl 5,pH7.0;筛选培养基(g/L)[16]:A液:K2HPO4·3H2O 1.4,KH2PO4 0.6,MgSO4·7H2O 1,NaCl 7,酵母粉 4,琼脂 40,pH 8.5;B液:胶体壳聚糖 10。A液和B液灭菌冷却至60 ℃后等体积混合。种子培养基(g/L):酵母粉3,蛋白胨5,葡萄糖3,(NH4)2SO4 10,K2HPO4·3H2O 0.7,NaCl 5,MgSO4·7H2O 0.5,KH2PO4 0.3,pH7.0;发酵培养基(g/L):壳聚糖10,(NH4)2SO4 10,K2HPO4·3H2O 1.4,NaCl 5,MgSO4·7H2O 1.3,KH2PO4 0.3,酵母粉3,pH7.0。以上培养基均121 ℃灭菌20 min。
1.2.2 菌株的筛选
1.2.2.1 初筛
取采集样品10 g与20 mL无菌水混合,35 ℃、200 r/min避光振荡30 min,稀释涂布至LB培养基,35 ℃培养48 h后挑选单菌落接至初筛培养基,35 ℃培养72 h后测量透明圈直径(D)和菌落直径(d),计算圈径比值(D/d),圈径比大小能够反应菌株产酶能力,根据D/d值大小初步筛选出产壳聚糖酶能力较强的菌株[17]。
1.2.2.2 复筛
将圈径比较大的菌株接种至种子液,按照2%(v/v)接种量接种至发酵培养基,35 ℃、200 r/min发酵72 h,测定不同菌株产壳聚糖酶酶活进行复筛,选酶活最大的菌株进行下一步研究。
1.2.3 菌株的鉴定
1.2.3.1 形态学鉴定
取出保藏好的菌株在LB固体培养基进行划线,35 ℃恒温培养24 h后,挑取菌体进行革兰氏染色、芽孢染色。通过光学显微镜及扫描电子显微镜观察菌株形态结构。
1.2.3.2 生理生化鉴定
参照《常见细菌系统鉴定手册》[18]及《伯杰细菌鉴定手册(第八版)》[19]对菌株进行生理生化鉴定。
1.2.3.3 分子生物学鉴定
挑取LB培养基上的单菌落,置于100 µL EP管中,加入35 µL Chelex-100,螺旋振荡仪中振荡30 s,99 ℃恒温水浴20 min,离心取上清液做PCR体系中的模板。使用16S rRNA通用引物(27F和1492R)进行PCR扩增,测序结果利用Ezbiocloud数据库进行比对;使用MEGA 7.0 软件Neighbor-Joining法(自展数为1000)构建菌株系统发育进化树。
1.2.4 壳聚糖酶粗酶液的制备
取发酵液2 mL,12000 r/min离心5 min,取上清液缓慢加入硫酸铵粉末至饱和度为70%,于4 ℃过夜,10000 r/min,低温离心30 min,收集沉淀,加入等体积磷酸盐缓冲液(pH7.2)溶解后得到粗酶液,放入4 ℃冰箱备用[20]。
1.2.5 壳聚糖酶活力测定
3,5-二硝基水杨酸(DNS)法,并配制1 mg/mL的N-乙酰氨基葡萄糖标准溶液绘制标准曲线[21]。分别取400 µL 粗酶液置于2 mL的EP管中,做为试验组和对照组,其中对照组沸水浴灭活10 min,再分别加入400 µL 10 g/L胶体壳聚糖,50 ℃反应15 min,取反应液200 µL与300 µL DNS混合,沸水浴10 min,12000 r/min离心3 min,取200 µL测540 nm吸光值,根据标曲公式计算壳寡糖含量。壳聚糖酶活定义[13]:上述反应条件下1 mL 粗酶液在1 min 内反应产生1 µmol还原糖所需的酶量为1 个酶活单位(U/mL)。
1.2.6 菌株Gxun-5.3.3产壳聚糖酶条件优化
1.2.6.1 单因素实验
在发酵培养基的基础上,研究不同因素对菌株Gxun-5.3.3产壳聚糖酶的影响。碳源及浓度:分别添加10 g/L可溶性淀粉、葡萄糖、蔗糖、木薯淀粉、麦芽糖、果糖;确定最适碳源后再进行浓度优化(0、1、2、5、10、15、20 g/L)。氮源及浓度:10 g/L 玉米浆、蛋白胨、大豆粉、尿素、氯化铵、酵母粉;确定最适氮源后再进行浓度优化(0、2、5、10、15、20 g/L)。无机盐种类:0.15 g/L MnSO4、KCl、MgSO4、CaCl2、FeSO4。发酵初始pH:4.0、5.0、6.0、7.0、8.0、9.0。底物浓度(壳聚糖):2、5、10、15、20 g/L。发酵时间:24、36、48、60、72、84、96 h。培养条件为:接种量2%(v/v),发酵温度35 ℃,转速200 r/min,发酵时间72 h,测定壳聚糖酶活,确定各因素最适合条件。
1.2.6.2 Plackett-Burman(PB)优化试验
对单因素筛选出影响酶活较大的6个因素(碳源、氮源、初始pH、温度、NaCl、时间)进行PB优化试验,每个因素取高、低2个水平(表1)。
表 1 Plackett-Burman(PB)试验设计Table 1. Experimental design of Plackett-Burman (PB)序号 因素 低水平 高水平 A 麦芽糖(g/L) 1 2 B 酵母粉(g/L) 2 5 C 初始pH 6 7 D 温度(℃) 32 35 E NaCl(g/L) 2 5 F 时间(h) 72 84 1.2.6.3 正交试验
对PB试验结果进行显著性分析,选取显著性最高的3个因素(氮源、碳源、初始pH),进行下一步L9(34)正交优化试验(表2)。
表 2 L9(34)正交试验因素水平设计Table 2. Factors and levels of orthogonal experiments design of L9(34)水平 因素 A:氮源(g/L) B:碳源(g/L) C:初始pH 1 2 1 6 2 5 2 7 3 8 3 8 1.2.7 菌株Gxun-5.3.3产壳聚糖酶粗酶液酶学性质分析
1.2.7.1 温度对酶活性及稳定性的影响
将反应体系在30、40、50、60、70、80 ℃条件下反应15 min,测定壳聚糖酶活力,确定最佳反应温度。同时,将粗酶液分别置于上述温度梯度恒温孵育2 h后,测定壳聚糖酶活力,以最高酶活力为100%,计算不同反应温度下的相对酶活,计算公式如下:
相对酶活(%)=AA0×100 式中:A表示各实验组酶活;A0表示实验组中最高酶活。
1.2.7.2 pH对酶活性及稳定性的影响
将反应体系pH设置在3.0、4.0、5.0、6.0、7.0、8.0、9.0,测定粗酶液在不同pH缓冲液下的酶活性,确定最佳反应pH。将粗酶液置于上述pH缓冲液中最适温度下恒温孵育2 h后,测定壳聚糖酶活力,计算不同pH条件下的相对酶活。
1.2.7.3 金属离子对酶活性的影响
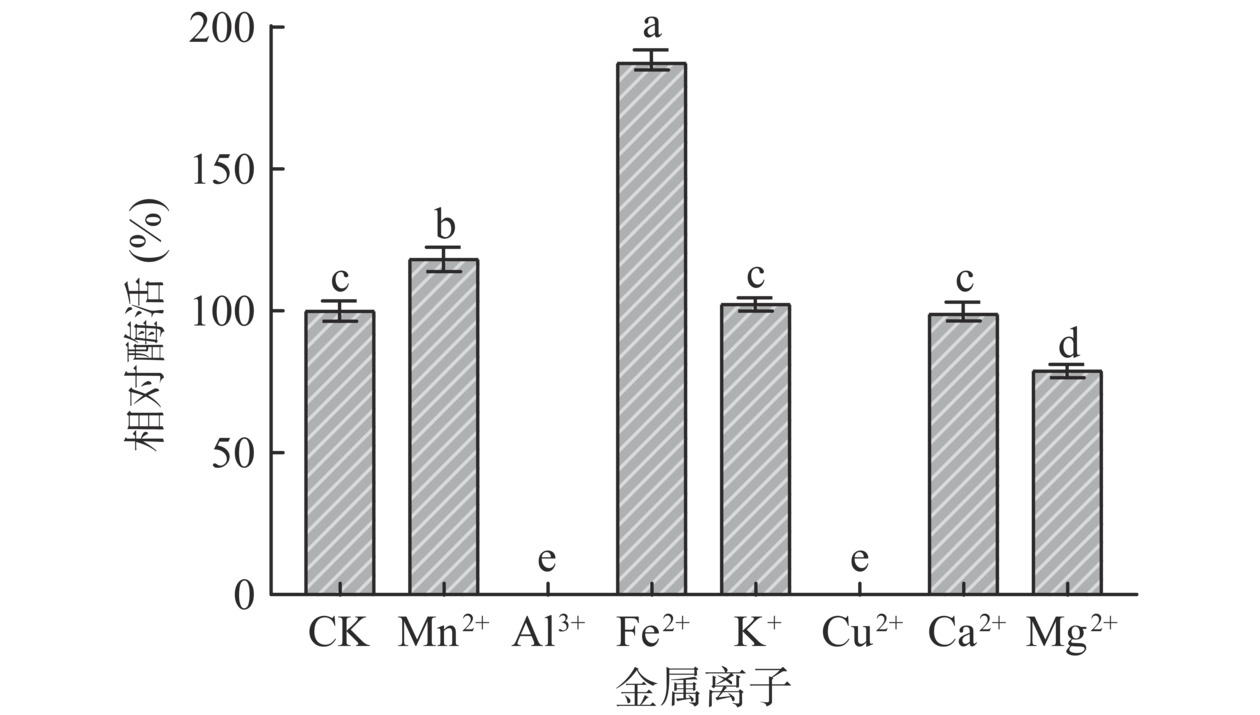
将粗酶液置于终反应金属离子浓度为10 mg/mL的 Mn2+、Al3+、Fe2+、K+、Cu2+、Ca2+、Mg2+中孵育2 h,测定壳聚糖酶活力,以未加金属离子酶活为100%,计算添加不同金属离子的相对酶活。
1.2.7.4 酶的底物特异性
将粗酶液分别与10 g/L的胶体壳聚糖、羧甲基纤维素钠、可溶性淀粉、粉末壳聚糖、葡萄糖等底物进行反应,测定壳聚糖酶活力,以最高底物酶活为100%,计算其他底物相对酶活。
1.2.8 薄层层析法(Thin Layer Chromatography,TLC)测定酶解产物
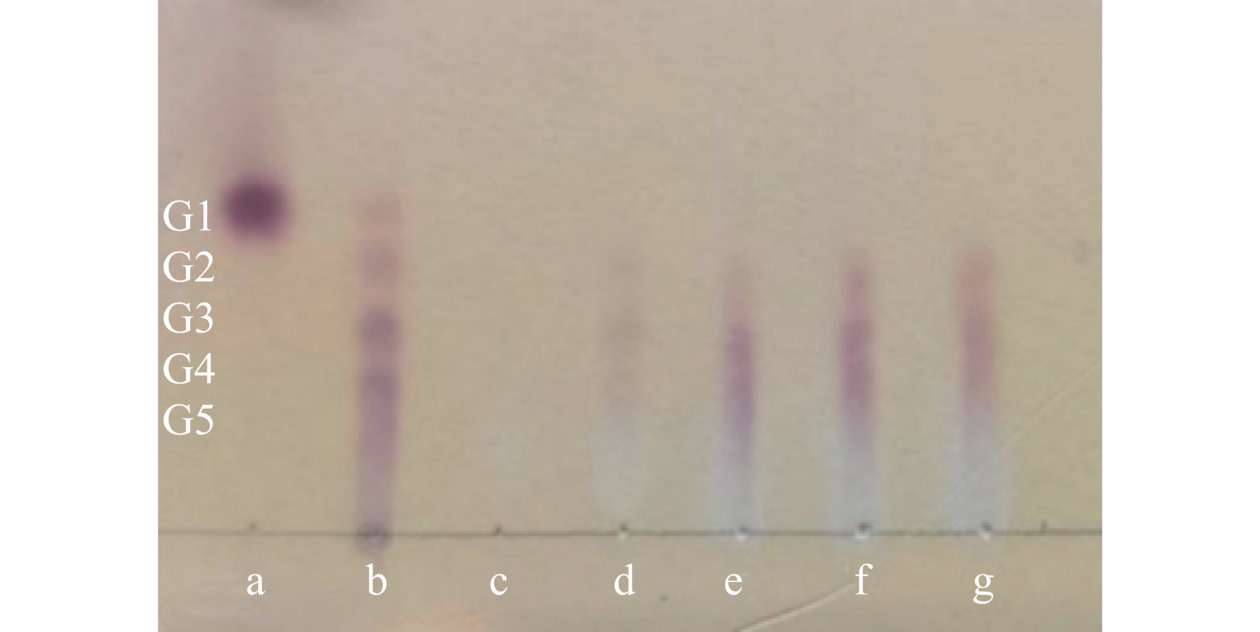
以10 g/L胶体壳聚糖为底物,与粗酶液1:1(v/v)混合,60 ℃条件下,分别反应0、5、10、15、20 min后,沸水浴5 min,8000 r/min离心10 min,取上清用毛细管于硅胶板上点样,以壳寡糖及盐酸氨基葡萄糖为标样,将硅胶板置于层析杠中,加入展层剂(异丙醇:氨水=2:1,v/v)缓慢展开。层析液离硅胶板上边缘1 cm处时层析结束,将硅胶板从层析杠中取出吹干,均匀喷涂10 g/L茚三酮溶液后进行高温烘干显色[22]。通过酶解产物在硅胶板上分离的位置,与标样壳寡糖及盐酸氨基葡萄糖薄层位置比对,判断酶解产物为内切型壳聚糖酶或外切型壳聚糖酶。
1.3 数据处理
本研究每个样品设置三个生物学重复,结果取平均值。采用Excel 2019 进行数据处理,用Design Expert 10对PB试验进行分析,用IBM SPSS statistics 21.0 对单因素实验、酶学性质的实验数据进行显著性分析(多重比较用S-N-K法)及对正交实验进行方差分析(单变量交互分析),用GraphPad Prism 8进行图形绘制。
2. 结果与分析
2.1 产壳聚糖酶菌株的筛选、鉴定
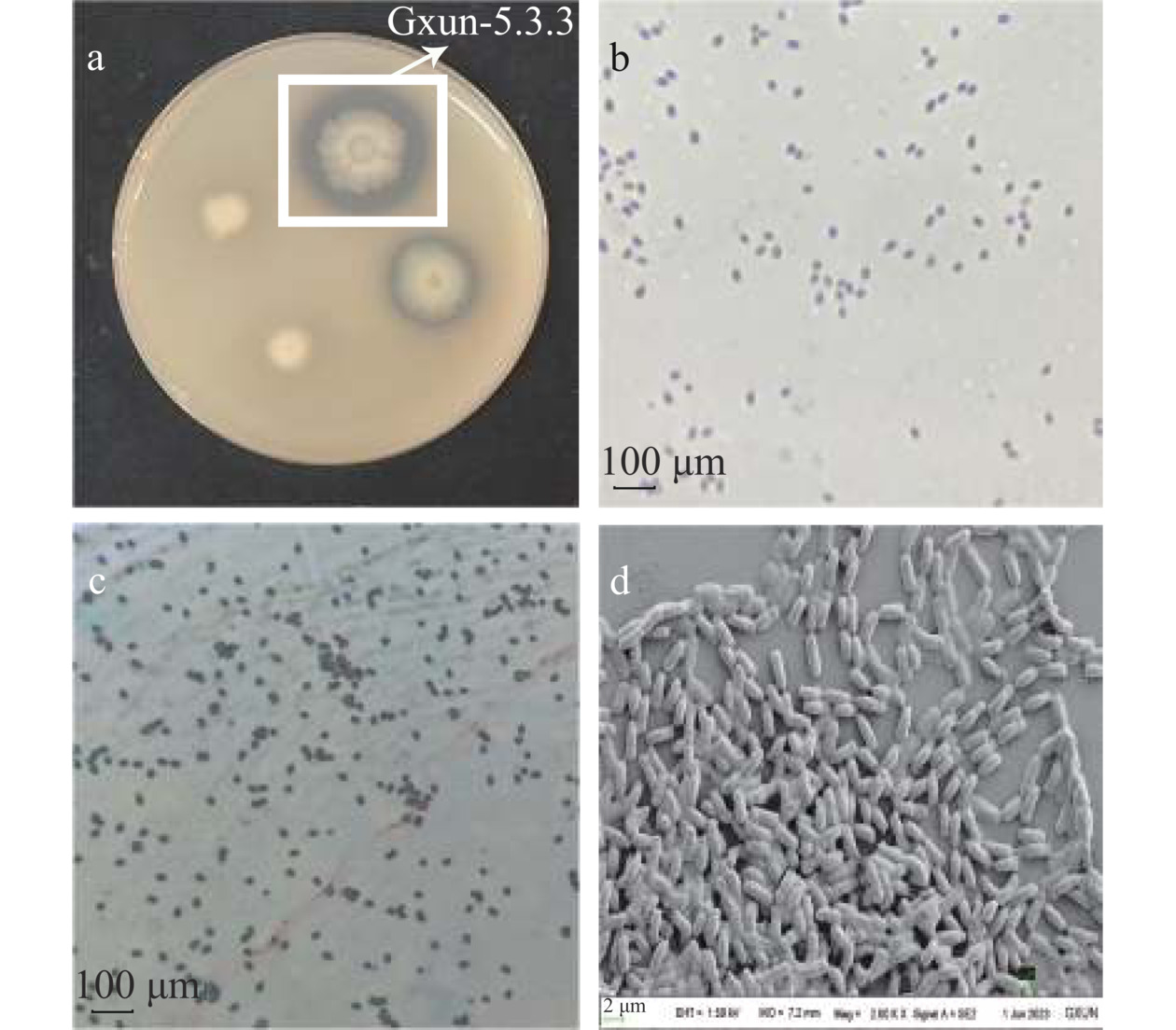
从采集的14份海虾养殖场底泥样品中筛选到96株菌株,可在壳聚糖平板产明显透明圈,其中有7株圈径比(D/d)≥1.1,菌株Gxun-5.3.3的D/d最大为1.67±0.13(表3、图1a)。进一步对7株圈径比较大的菌株进行复筛测定酶活,菌株Gxun-5.3.3酶活最高,可达39.87±1.24 U/mL(表3)。这说明圈径比可以做为壳聚糖酶初筛的依据,圈径比越大说明菌株分泌胞外壳聚糖酶能力越强。因此,将酶活最高的Gxun-5.3.3作为后续试验菌株。
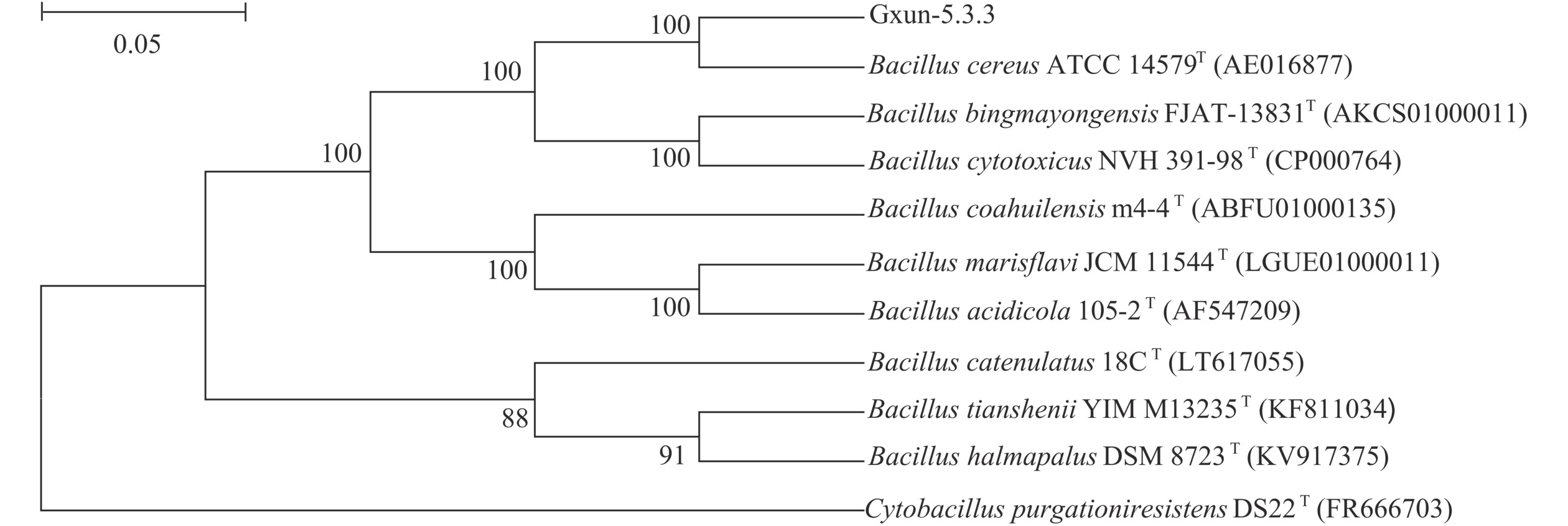
表 3 菌株圈径比及酶活结果Table 3. Results of strain cycle diameter ratio and enzyme activity菌株 圈径比 (D/d) 酶活 (U/mL) Gxun-5.3.3 1.67±0.13a 39.87±1.24a Gxun-21.7.1 1.46±0.03b 35.33±1.91b Gxun-3.3.2 1.20±0.09cd 34.32±0.95b Gxun-TX2.1.3 1.27±0.12c 34.13±1.36b Gxun-6.3.1 1.34±0.01bc 31.14±0.65c Gxun-1.2X 1.23±0.05cd 30.58±0.76c Gxun-21.1.1 1.10±0.04d 25.14±0.84d 注:同列不同字母表示存在显著性差异(P<0.05)。 将菌株Gxun-5.3.3划线于LB平板35 ℃培养48 h,菌落表面呈现蜡状,颜色为乳白色且不透明,菌落边缘不规则;进一步生理生化鉴定结果为:革兰氏染色阳性(图1b),产芽孢(图1c);扫描电镜显示菌株为短杆状、长约2.5 µm(图1d);由表4可知,甲基红(MR)试验、靛基质试验(吲哚试验)、β-半乳糖苷酶试验、明胶液化试验鉴定结果均为阳性,而氧化发酵试验(OF试验)、硫化氢试验、氨基酸脱羧酶试验、淀粉水解酶试验鉴定结果均为阴性,说明该菌株为芽孢杆菌属。菌株16S rRNA比对结果与蜡样芽孢杆菌(Bacillus cereus) ATCC 14579相似性最高,达到99%。用MEGA7.0软件对菌株Gxun-5.3.3的16S rRNA序列进行比对分析并构建系统发育树,菌株Gxun-5.3.3与B. cereus的亲缘关系最近(图2),综合形态学鉴定、生理生化鉴定、16S rRNA序列分析,菌株Gxun-5.3.3鉴定命名为B. cereus Gxun-5.3.3,现保藏于广东省微生物菌种保藏中心(GDMCC),保藏号为GDMCC NO:62890。
表 4 生理生化鉴定结果Table 4. Results of physiological and biochemical characterization项目名称 结果 项目名称 结果 革兰氏染色 + 芽孢染色 + 硫化氢试验 − 氧化发酵试验(OF试验) − 甲基红试验(MR试验) + 明胶液化试验 + 靛基质试验(吲哚试验) + 淀粉水解酶试验 − β-半乳糖苷酶试验 + 氨基酸脱羧酶试验 − 注:“+”结果为阳性;“−”结果为阴性。 2.2 菌株Gxun-5.3.3产酶条件优化
2.2.1 单因素实验结果
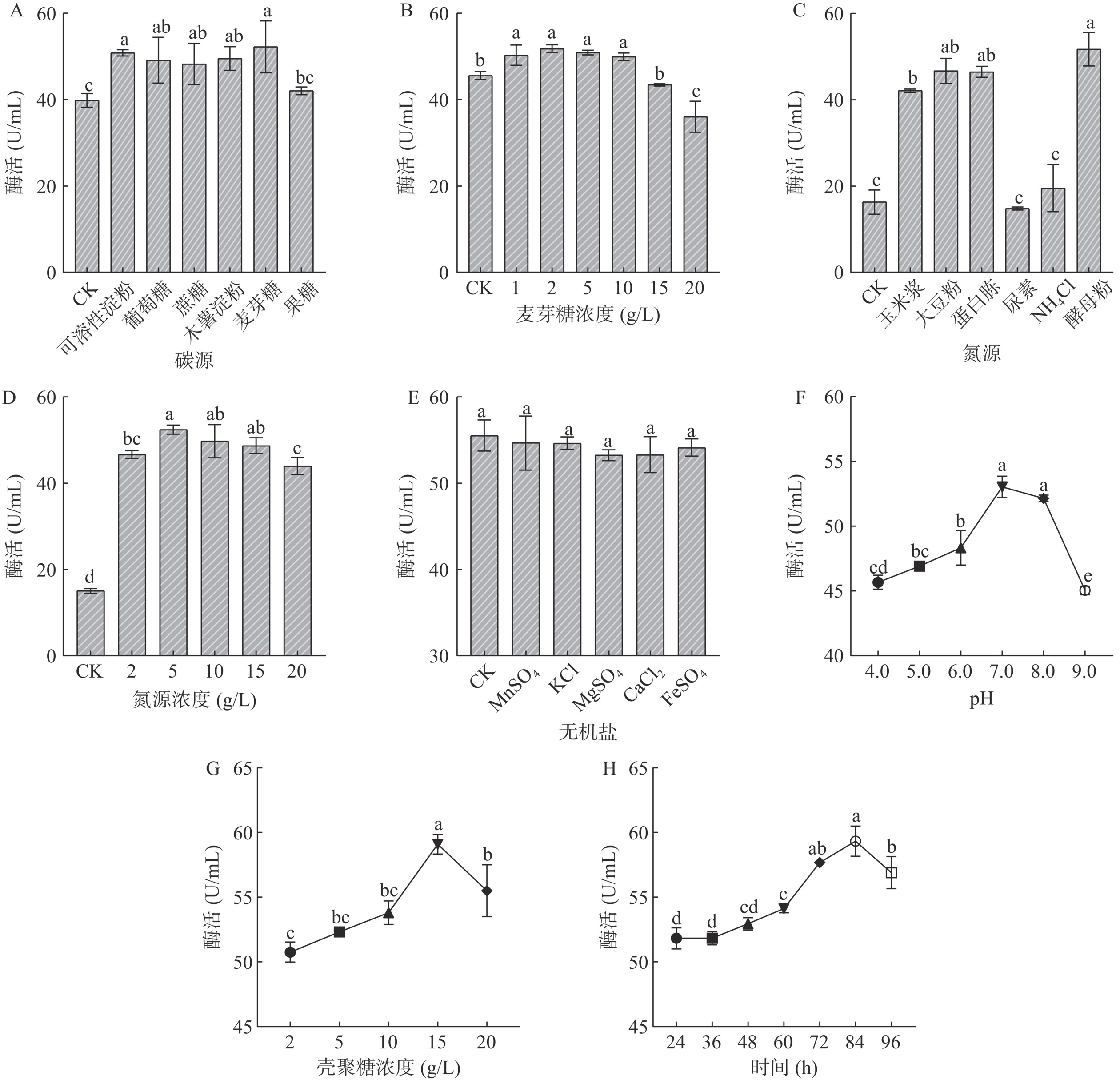
碳源优化结果表明(图3A),与对照相比,除添加果糖组对酶活无显著促进外(P>0.05),添加其他不同碳源对酶活均起到显著促进作用(P<0.05),其中麦芽糖对菌株产酶促进作用最强。麦芽糖浓度优化结果表明,当浓度0~2 g/L时,酶活随浓度的增加而增大,添加浓度为2 g/L时,酶活达到最大为52.25±0.83 U/mL。当添加浓度为2~10 g/L,对酶活影响较小(P>0.05)。但当浓度高于15 g/L时,酶活随着麦芽糖浓度增加而显著降低(P<0.05)(图3B),这表明添加过多的麦芽糖会对菌株产酶产生抑制。因此,菌株Gxun-5.3.3产壳聚糖酶的最适碳源为2 g/L 的麦芽糖。
由图3C可知,添加酵母粉、玉米浆、大豆粉、蛋白胨有机氮源均对菌株产酶起到显著促进作用(P<0.05),其中酵母粉促进作用最强,而添加无机氮源尿素和氯化铵对酶活影响效果不显著(P>0.05)。进一步对酵母粉浓度优化结果表明(图3D),当添加量为5 g/L时,酶活最高可达52.49±1.00 U/mL。但当添加量为20 g/L时,对菌株产酶产生显著抑制作用(P<0.05),可能是高浓度酵母粉会使菌体生长旺盛,不利于酶的积累。因此,菌株Gxun-5.3.3产酶的最适氮源为5 g/L酵母粉。
添加无机盐对菌株产酶无显著影响(P>0.05)(图3E)。因此,菌株Gxun-5.3.3产酶过程中无需额外添加无机盐,可降低发酵成本。
菌株发酵培养基初始pH为4.0~7.0时,酶活随着pH增加逐渐增大,pH为7.0时酶活最高为53.03±0.83 U/mL;但当pH为7.0~9.0时,酶活随着pH的增加反而降低,表明过高或过低的pH不适合菌株产酶(图3F)。因此,菌株Gxun-5.3.3产酶最适初始pH为7.0。
当底物浓度低于15 g/L时,酶活随底物浓度增加而逐渐增大,当底物浓度为15 g/L时,酶活达到最高为59.08±0.75 U/mL;但当底物浓度高于15 g/L时,酶活随浓度升高而迅速下降,可能是过高底物浓度对菌株生长和产酶产生抑制作用。因此,菌株Gxun-5.3.3产酶最适底物浓度为15 g/L壳聚糖,此时酶活最高可达59.08±0.75 U/mL(图3G)。
发酵时间优化结果表明(图3H),当发酵时间小于84 h时,酶活随着发酵时间的增加而增大,发酵84 h时酶活最高可达59.33±1.16 U/mL;但当发酵时间大于84 h时,酶活随时间延长反而降低,可能是酶在长时间发酵过程中被降解或失活。因此,菌株Gxun-5.3.3产壳聚糖酶最适发酵时间为84 h。
2.3 Plackett-Burman(PB)试验
根据Plackett-Burman试验设计及结果(表5),经由Design Expert 10软件分析得到B(氮源)、C(初始pH)对Gxun-5.3.3产酶水平具有显著影响(P<0.05)(表6),因此选取B(氮源)、C(初始pH)及较显著的A(碳源)进行下一步的正交试验。
表 5 Plackett-Burman试验设计及结果Table 5. Design and results of Plackett-Burman experimental实验号 A碳源
(g/L)B氮源
(g/L)C初始
pHD温度
(℃)E NaCl
(g/L)F时间
(h)酶活
(U/mL)1 1 5 7 32 2 84 4.54±0.58 2 1 2 7 32 5 72 1.84±0.83 3 1 5 6 35 5 72 20.59±2.49 4 2 2 7 32 5 84 3.02±0.83 5 1 2 6 35 5 84 12.60±3.99 6 2 5 7 35 5 72 16.77±0.75 7 2 2 7 35 2 72 2.33±0.71 8 2 5 6 32 2 72 48.86±7.07 9 1 5 7 35 2 84 8.83±0.16 10 2 2 6 35 2 84 3.02±2.08 11 1 2 6 32 2 72 11.95±0.42 12 2 5 6 32 5 84 38.57±0.47 表 6 Plackett-Burman试验分析结果Table 6. Results of Plackett-Burman experimental analysis方差来源 平方和 自由度 平方和均 F值 P值 显著性 模型 2189.17 6 364.86 5.58 0.0394 ** A 227.17 1 227.17 3.48 0.1212 * B 891.38 1 891.38 13.64 0.0141 ** C 804.64 1 804.64 12.31 0.0171 ** D 166.13 1 166.13 2.54 0.1717 E 15.99 1 15.99 0.24 0.6418 F 84.05 1 84.05 1.29 0.3081 误差 326.67 5 65.33 总和 2515.84 11 注:**代表显著(P<0.05);*代表除显著因素外影响较大的因素。 2.4 正交试验
综合正交试验结果及方差分析(表7、表8),R表示各因素对菌株Gxun-5.3.3产酶活性的影响程度,R越大影响越显著,因此在碳源、氮源、初始pH三个因素中对菌株Gxun-5.3.3产酶活性影响的主次关系为A>B>C。各因子最佳发酵组合为5 g/L酵母粉(A2)、3 g/L麦芽糖(B3)、初始pH6.0(C1)。对正交试验获得最佳条件进行验证试验,测得酶活为62.03±1.18 U/mL,优于6号实验组酶活最佳值,表明正交试验的准确性。优化后壳聚糖酶活较优化前(39.87±1.24 U/mL)提高了55.58%。
表 7 正交试验结果Table 7. Results of orthogonal experimental实验号 A氮源 (g/L) B碳源 (g/L) C初始pH 酶活(U/mL) 1 2 1 6 44.30±6.76 2 2 2 8 48.68±3.02 3 2 3 7 53.03±2.55 4 5 1 8 50.02±2.27 5 5 2 7 51.07±1.68 6 5 3 6 59.46±2.87 7 8 1 7 33.21±2.92 8 8 2 6 39.67±3.37 9 8 3 8 40.53±1.82 k1 48.67 42.51 47.81 k2 53.52 46.48 45.77 k3 37.80 51.01 46.41 R 15.72 8.50 2.04 主次 A>B>C 最优组合 A2 B3 C1 表 8 正交试验方差分析Table 8. Orthogonal experimental analysis of variance变异来源 平方和 自由度 平方和均 F值 P值 修正模型 1510.696 6 251.783 22.125 0.000 氮源浓度 1165.371 2 582.685 51.204 0.000 碳源浓度 325.777 2 162.888 14.314 0.000 pH 19.548 2 9.774 0.859 0.439 误差 227.596 20 总计 60544.171 27 2.5 菌株Gxun-5.3.3产壳聚糖粗酶液的酶学性质
2.5.1 温度对酶活性及稳定性的影响
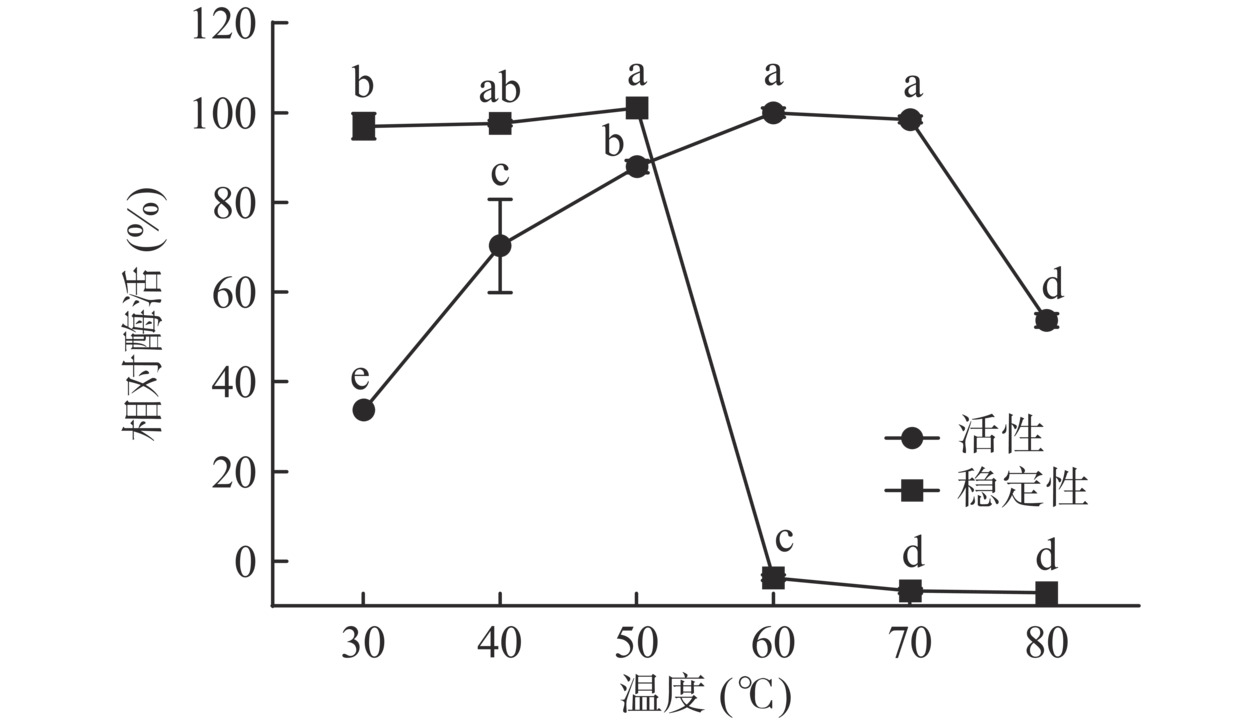
温度对酶促反应起关键作用,因此对酶的最适反应温度及稳定性的探究对酶法生产壳寡糖具有重要意义。当反应温度在30~60 ℃时,酶活随着温度的升高显著增加(P<0.05),60 ℃时达到最大。但当反应温度高于70 ℃时,酶活逐渐降低,80 ℃时,相对酶活显著降低(P<0.05),仅有50%左右(图4),可能是由于温度过高引起酶分子结构的改变,从而导致酶失活,因此,菌株Gxun-5.3.3产壳聚糖酶的最适反应温度为 60 ℃。酶温度稳定性结果表明,当温度高于50 ℃后,酶活性急剧下降,这与酶的最适反应温度不同,这是因为酶没有反应底物的保护,更容易受温度影响而失活[23]。Gxun-5.3.3产壳聚糖酶温度稳定性与多数研究报道壳聚糖酶在30~45 ℃热稳定性较好,而50~80 ℃热稳定性较差结果类似[24−25],因此,该酶更适合在30~50 ℃下保存。
2.5.2 pH对酶活性及稳定性的影响
pH对酶活性影响结果表明(图5),当pH为3.0~5.0时,相对酶活随pH升高而增大,pH为5.0达到最大。但当pH为5.0~9.0时,相对酶活随pH增加而迅速降低,可能是过高的pH影响了酶与底物结合或直接影响了酶的催化活性[26]。因此,酶的最适pH为5.0。pH稳定性结果表明,当pH为 6.0~7.0孵育2 h时,相对酶活维持在90%以上,表现出较强的稳定性;但当pH 为3.0~6.0和7.0~9.0时,相对酶活下降显著(P<0.05),酶的稳定性较差,可能是pH偏高或偏低会使酶本身变性失活,会改变及影响底物的解离或酶分子活性部位上相关基团的解离,进而影响酶的催化活性[24]。
2.5.3 金属离子对酶活性的影响
金属离子可以与酶结合,从而影响酶蛋白的中心构象,进而对酶起到促进或抑制作用[27]。本研究中,与未加金属离子相对酶活相比,Fe2+、Mn2+对酶活性具有显著激活作用(P<0.05),其中Fe2+效果最明显(图6),相对酶活大于173%。而Al3+、Cu2+、Mg2+对酶活性具有显著抑制作用(P<0.05),其中Al3+、Cu2+可使酶的活性几乎完全丧失。K+和Ca2+对壳聚糖酶活力无显著影响(P>0.05)。这与大多数微生物来源的壳聚糖酶一致[13,21,28],但也有部分金属离子对不同来源的壳聚糖酶活力起着相反的作用[20]。进一步表明不同来源的壳聚糖酶有一定的差异。今后利用该酶进行壳寡糖生产过程中需要考虑金属离子对酶活性的影响。金属离子对酶活的影响机制可能与金属离子和壳聚糖酶形成稳定的复合物有关,金属离子通过参与壳聚糖酶活性中心的构建,结合酶活性中心以外的部位,增大酶与底物之间的亲和力,使酶活力得到增强[25],或金属离子通过螯合作用,影响酶的构象,干扰酶对底物的降解作用,从而导致酶活力下降[29]。金属离子对该酶活的具体作用机制有待进一步深入研究。
2.5.4 菌株Gxun-5.3.3
产壳聚糖酶底物特异性探究 壳聚糖酶活性中心关键氨基酸只与氨基葡萄糖的氨基形成氢键,因此,大多数壳聚糖酶对壳聚糖有着高度的专一性[30]。底物特异性研究表明,菌株Gxun-5.3.3所产壳聚糖酶最适反应底物为胶体壳聚糖,其他天然高分子物质如羧甲基纤维素钠、可溶性淀粉、葡萄糖、粉末壳聚糖等为底物时相对酶活很低,这说明该酶对其他天然高分子物质酶解能力弱(图7)。因此,菌株Gxun-5.3.3所产壳聚糖酶具有专一性水解可溶性壳聚糖的能力。
2.6 菌株Gxun-5.3.3产壳聚糖酶的酶解产物测定
壳聚糖酶有2种类型,内切型壳聚糖酶是以内切方式催化水解部分乙酰化壳聚糖中的β-(1,4)-氨基葡萄糖苷键生成低聚糖;而外切型壳聚糖酶是从壳聚糖非还原端外切的方式水解β-(1,4)-氨基葡糖苷,产生壳聚糖单体 (GlcN)[31]。通过TLC薄层层析对酶降解壳聚糖的产物分析结果表明(图8),随着时间的增加壳聚糖逐渐被水解为壳寡糖,其中多数为壳二糖、壳三糖和壳四糖,并在水解过程中未出现单糖,这表明菌株Gxun-5.3.3产壳聚糖酶为内切型壳聚糖酶。这与来自芽孢杆菌属菌株所产壳聚糖酶为内切型酶结果一致 [20−21]。
3. 讨论
壳聚糖酶在工业生产壳寡糖上具有巨大的应用价值,目前利用微生物产壳聚糖酶水解壳聚糖生产壳寡糖是较为环保、高效的方法。谷亚茹等[32]研究的芽孢杆菌属(Bacillus sp.)产壳聚糖酶酶活为11.5 U/mL。Huynh等[33]研究的伦茨氏菌属(Lentzea sp.)OUR-I1产壳聚糖酶酶活为2.4 U/mL。张馨月等[34]研究的淡紫紫孢菌(Purpureocillium lilacinum)M7a产壳聚糖酶酶活为16.8 U/mL。本研究中,筛选获得的B. cereus Gxun-5.3.3菌株,酶活性高达39.87±1.24 U/mL,高于目前大多数文献报道菌株的酶活,产酶优势强,在工业生产壳寡糖上有较好的应用潜力。
当前利用微生物产壳聚糖酶依旧存在酶活低、稳定性差等问题。通过发酵工艺的优化提高菌株的产酶活性,为工业化高效生产壳寡糖提供潜在可能。卢波斯等[35]研究的松江菌属(Mitsuaria sp.) SH-50,优化前酶活为5.0 U/mL,通过PB试验及响应面优化产酶条件后,酶活达26.6 U/mL。Liaqat等[36]研究的莫哈韦芽孢杆菌(Bacillus mojavensis)EGE-B-5.2i,优化前酶活为2.2 U/mL通过PB试验及中心复合设计优化后,酶活达21.1 U/mL。本研究优化产酶条件后,酶活达62.03±1.18 U/mL,较优化前(39.87±1.24 U/mL)提高了55.58%,优化后的酶活高于大多数文献报道,为工业高效生产壳寡糖提供理论支持,具有较好的应用价值。
目前报道壳聚糖酶反应的最适温度一般在30~50 ℃之间,李佳茵等[37]研究的海洋真菌MF-08产壳聚糖酶最适反应温度为40 ℃。本研究中菌株Gxun-5.3.3产壳聚糖酶的最适反应温度(60 ℃)更高,具有更大的应用潜力,且该酶在30~50 ℃之间有较好的热稳定性,这与Wang等[38] 报道的贝莱斯芽孢杆菌(B. cereus)TKU031产壳聚糖酶在低于50 ℃时有良好的稳定性,而高于50 ℃时稳定性较差的研究结果类似。陈聪聪[39]研究的松江菌属(Mitsuaria sp.) C4产壳聚糖酶最适pH为7.2。而本研究中壳聚糖酶的最适pH为5.0,pH 6.0~7.0条件下稳定性较好,这表明不同菌株所产壳聚糖酶最适pH也不同,本研究壳聚糖酶更适于中性偏酸环境下与底物反应。此外,不同金属离子与壳聚糖酶螯合后,对酶活起到激活或抑制作用,本研究中一定浓度的Fe2+、Mn2+对菌株产壳聚糖酶有激活作用,而Al3+、Cu2+有抑制作用。这与严寅珲等[40]报道的Mn2+对来源于中村氏芽孢杆菌(Bacillus nakamurai)的壳聚糖酶具有较高激活作用结果类似。因此,今后将菌株应用于壳聚糖酶工业化生产过程中要考虑金属离子对酶活的影响。
目前,文献报道来源于芽孢杆菌的壳聚糖酶多为内切型。Chiang等[41]报道的枯草芽孢杆菌(B. subtilis)IMR-NK1产壳聚糖酶水解产物为壳二糖~壳四糖。Jiang等[42]报道的从巴伦氏类芽孢杆菌(Paenibacillus barengoltzii)克隆基因PbCsn8在枯草芽孢杆菌中表达后产壳聚糖酶水解产物为壳二糖、壳三糖。而本研究筛选的B. cereus Gxun-5.3.3所产壳聚糖酶也为内切型,这与大多数文献报道壳聚糖酶类型类似。
4. 结论
本研究从广西北海虾塘底泥中筛选出1株高产壳聚糖酶的菌株B. cereus Gxun-5.3.3。通过单因素实验、Plackett-Burman和正交优化试验得到菌株产酶最优发酵工艺为:麦芽糖5 g/L,酵母粉3 g/L,壳聚糖 15 g/L,初始pH6.0,发酵时间84 h,优化后酶活可达62.03±1.18 U/mL,较优化前提高了55.58%。酶学性质结果表明,菌株Gxun-5.3.3所产壳聚糖酶为内切酶,酶的最适温度为60 ℃,30~50 ℃时稳定性较好,最适pH为5.0,pH6.0~7.0稳定性较好,金属离子中Fe2+、Mn2+对壳聚糖酶有显著的激活作用,而Al3+、Cu2+则有较强抑制作用。本研究为B. cereus Gxun-5.3.3壳聚糖酶的生产和壳寡糖的酶法制备提供了重要的理论依据。
-
表 1 Plackett-Burman(PB)试验设计
Table 1 Experimental design of Plackett-Burman (PB)
序号 因素 低水平 高水平 A 麦芽糖(g/L) 1 2 B 酵母粉(g/L) 2 5 C 初始pH 6 7 D 温度(℃) 32 35 E NaCl(g/L) 2 5 F 时间(h) 72 84 表 2 L9(34)正交试验因素水平设计
Table 2 Factors and levels of orthogonal experiments design of L9(34)
水平 因素 A:氮源(g/L) B:碳源(g/L) C:初始pH 1 2 1 6 2 5 2 7 3 8 3 8 表 3 菌株圈径比及酶活结果
Table 3 Results of strain cycle diameter ratio and enzyme activity
菌株 圈径比 (D/d) 酶活 (U/mL) Gxun-5.3.3 1.67±0.13a 39.87±1.24a Gxun-21.7.1 1.46±0.03b 35.33±1.91b Gxun-3.3.2 1.20±0.09cd 34.32±0.95b Gxun-TX2.1.3 1.27±0.12c 34.13±1.36b Gxun-6.3.1 1.34±0.01bc 31.14±0.65c Gxun-1.2X 1.23±0.05cd 30.58±0.76c Gxun-21.1.1 1.10±0.04d 25.14±0.84d 注:同列不同字母表示存在显著性差异(P<0.05)。 表 4 生理生化鉴定结果
Table 4 Results of physiological and biochemical characterization
项目名称 结果 项目名称 结果 革兰氏染色 + 芽孢染色 + 硫化氢试验 − 氧化发酵试验(OF试验) − 甲基红试验(MR试验) + 明胶液化试验 + 靛基质试验(吲哚试验) + 淀粉水解酶试验 − β-半乳糖苷酶试验 + 氨基酸脱羧酶试验 − 注:“+”结果为阳性;“−”结果为阴性。 表 5 Plackett-Burman试验设计及结果
Table 5 Design and results of Plackett-Burman experimental
实验号 A碳源
(g/L)B氮源
(g/L)C初始
pHD温度
(℃)E NaCl
(g/L)F时间
(h)酶活
(U/mL)1 1 5 7 32 2 84 4.54±0.58 2 1 2 7 32 5 72 1.84±0.83 3 1 5 6 35 5 72 20.59±2.49 4 2 2 7 32 5 84 3.02±0.83 5 1 2 6 35 5 84 12.60±3.99 6 2 5 7 35 5 72 16.77±0.75 7 2 2 7 35 2 72 2.33±0.71 8 2 5 6 32 2 72 48.86±7.07 9 1 5 7 35 2 84 8.83±0.16 10 2 2 6 35 2 84 3.02±2.08 11 1 2 6 32 2 72 11.95±0.42 12 2 5 6 32 5 84 38.57±0.47 表 6 Plackett-Burman试验分析结果
Table 6 Results of Plackett-Burman experimental analysis
方差来源 平方和 自由度 平方和均 F值 P值 显著性 模型 2189.17 6 364.86 5.58 0.0394 ** A 227.17 1 227.17 3.48 0.1212 * B 891.38 1 891.38 13.64 0.0141 ** C 804.64 1 804.64 12.31 0.0171 ** D 166.13 1 166.13 2.54 0.1717 E 15.99 1 15.99 0.24 0.6418 F 84.05 1 84.05 1.29 0.3081 误差 326.67 5 65.33 总和 2515.84 11 注:**代表显著(P<0.05);*代表除显著因素外影响较大的因素。 表 7 正交试验结果
Table 7 Results of orthogonal experimental
实验号 A氮源 (g/L) B碳源 (g/L) C初始pH 酶活(U/mL) 1 2 1 6 44.30±6.76 2 2 2 8 48.68±3.02 3 2 3 7 53.03±2.55 4 5 1 8 50.02±2.27 5 5 2 7 51.07±1.68 6 5 3 6 59.46±2.87 7 8 1 7 33.21±2.92 8 8 2 6 39.67±3.37 9 8 3 8 40.53±1.82 k1 48.67 42.51 47.81 k2 53.52 46.48 45.77 k3 37.80 51.01 46.41 R 15.72 8.50 2.04 主次 A>B>C 最优组合 A2 B3 C1 表 8 正交试验方差分析
Table 8 Orthogonal experimental analysis of variance
变异来源 平方和 自由度 平方和均 F值 P值 修正模型 1510.696 6 251.783 22.125 0.000 氮源浓度 1165.371 2 582.685 51.204 0.000 碳源浓度 325.777 2 162.888 14.314 0.000 pH 19.548 2 9.774 0.859 0.439 误差 227.596 20 总计 60544.171 27 -
[1] MA J H, FAQIR Y, TAN C J, et al. Terrestrial insects as a promising source of chitosan and recent developments in its application for various industries[J]. Food Chemistry,2022,373:131407. doi: 10.1016/j.foodchem.2021.131407
[2] FU H Y, LIU H Z, GE Y F, et al. Chitosan oligosaccharide alleviates and removes the toxicological effects of organophosphorus pesticide chlorpyrifos residues[J]. Journal of Hazardous Materials,2023,446:130669. doi: 10.1016/j.jhazmat.2022.130669
[3] JU C X, YUE W, YANG Z H, et al. Antidiabetic effect and mechanism of chitooligosaccharides[J]. Biological and Pharmaceutical Bulletin,2010,33(9):1511−1516. doi: 10.1248/bpb.33.1511
[4] VO T S, KIM S K. Potential anti-HIV agents from marine resources:an overview[J]. Marine Drugs,2010,8(12):2871−2892. doi: 10.3390/md8122871
[5] WANG Y Y, ZHAO K, LI L, et al. A review of the immune activity of chitooligosaccharides[J]. Food Science and Technology,2023,43:e97822. doi: 10.1590/fst.97822
[6] SINGH A, MITTAL A, BENJAKUL S. Chitosan, chitooligosaccharides and their polyphenol conjugates:preparation, bioactivities, functionalities and applications in food systems[J]. Food Reviews International,2023,39(4):2297−2319. doi: 10.1080/87559129.2021.1950176
[7] ARANAZ I, ALCÁNTARA A R, CIVERA M C, et al. Chitosan:An overview of its properties and applications[J]. Polymers,2021,13(19):3256. doi: 10.3390/polym13193256
[8] BENJAKUL S, SINGH A, MITTAL A. Chitooligosaccharides:Preparation and applications in food and nutraceuticals[M]. Chitooligosaccharides:Prevention and Control of Diseases. Cham:Springer International Publishing, 2022:203−221.
[9] YUAN X B, ZHENG J P, JIAO S M, et al. A review on the preparation of chitosan oligosaccharides and application to human health, animal husbandry and agricultural production[J]. Carbohydrate Polymers,2019,220:60−70. doi: 10.1016/j.carbpol.2019.05.050
[10] 郭蔓, 赵华, 张朝正. 壳寡糖的制备及应用研究[J]. 中国食品添加剂,2022,33(10):267−271. [GUO M, ZHAO H, ZHANG C Z. Preparation and application of chitosan oligosaccharides[J]. China Food Additives,2022,33(10):267−271.] GUO M, ZHAO H, ZHANG C Z. Preparation and application of chitosan oligosaccharides[J]. China Food Additives, 2022, 33(10): 267−271.
[11] 杨苏亮, 闫冰雪, 李海静, 等. 壳寡糖的理化特性及制备方法[J]. 饲料博览,2016,291(7):27−30. [YANG S L, YAN B X, LI H J, et al. The physiochemical properties and preparation methods of chitooligosaccharides[J]. Feed Review,2016,291(7):27−30.] YANG S L, YAN B X, LI H J, et al. The physiochemical properties and preparation methods of chitooligosaccharides[J]. Feed Review, 2016, 291(7): 27−30.
[12] MONAGHAN R L, EVELEIGH D E, TEWARI R P, et al. Chitosanase, a novel enzyme[J]. Nature New Biology,1973,245(142):78−80. doi: 10.1038/newbio245078a0
[13] AKTUGANOV G E, SAFINA V R, GALIMZIANOVA N F, et al. Constitutive chitosanase from Bacillus thuringiensis B-387 and its potential for preparation of antimicrobial chitooligomers[J]. World Journal of Microbiology and Biotechnology,2022,38(10):167−192. doi: 10.1007/s11274-022-03359-5
[14] WANG Y X, LI D, LIU M X, et al. Preparation of active chitooligosaccharides with a novel chitosanase Aq CoA and their application in fungal disease protection[J]. Journal of Agricultural and Food Chemistry,2021,69(11):3351−3361. doi: 10.1021/acs.jafc.0c07802
[15] 陈小娥. 曲霉产壳聚糖酶酶学性质及作用机理研究[D]. 无锡:江南大学, 2005. [CHEN X E. Study on the characterization and mechanism of chitosanases from Aspergillus sp. [D]. Wuxi:Jiangnan University, 2005.] CHEN X E. Study on the characterization and mechanism of chitosanases from Aspergillus sp. [D]. Wuxi: Jiangnan University, 2005.
[16] ZHU X F, WU X Y, DAI Y. Fermentation conditions and properties of a chitosanase from Acinetobacter sp. C-17[J]. Bioscience, Biotechnology, and Biochemistry,2014,67:(2),284−290.
[17] 刘阳, 赵华, 郑雅元, 等. 产壳聚糖酶菌株的筛选、鉴定及发酵条件优化[J]. 中国食品添加剂,2017(2):106−111. [LIU Y, ZHAO H, ZHENG Y Y, et al. Screening and identification of a chitosanase-producing strain and optimization of its fermentation conditions[J]. China Food Additives,2017(2):106−111.] LIU Y, ZHAO H, ZHENG Y Y, et al. Screening and identification of a chitosanase-producing strain and optimization of its fermentation conditions[J]. China Food Additives, 2017(2): 106−111.
[18] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001. [DONG X Z, CAI M Y. Manual for the identification of common bacterial systems [M]. Beijing:Science Press, 2001.] DONG X Z, CAI M Y. Manual for the identification of common bacterial systems [M]. Beijing: Science Press, 2001.
[19] R. E. 布坎南, N. E. 吉本斯. 伯杰细菌鉴定手册(第八版)[M]. 北京:科学出版社, 1995. [BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. Beijing:Science Press, 1995.] BUCHANAN R E, GIBBONS N E. Bergey's manual of determinative bacteriology[M]. Beijing: Science Press, 1995.
[20] 刘进杰, 吕娟娟, 陈国忠, 等. 莫海威芽孢杆菌产壳聚糖酶的分离纯化及酶学性质分析[J]. 江苏农业科学,2019,47(14):231−235. [LIU J J, LÜ J J, CHEN G Z, et al. Isolation, purification and enzymatic properties of chitosanase produced by Bacillus mohaweis[J]. Jiangsu Agricultural Sciences,2019,47(14):231−235.] LIU J J, LÜ J J, CHEN G Z, et al. Isolation, purification and enzymatic properties of chitosanase produced by Bacillus mohaweis[J]. Jiangsu Agricultural Sciences, 2019, 47(14): 231−235.
[21] 李甜. 产耐酸性壳聚糖酶芽孢杆菌属CLT07菌株的筛选、鉴定及酶学性质研究[D]. 连云港:江苏海洋大学, 2022. [LI T. Screening, identification and enzymatic properties of Bacillus sp. CLT07 producing acid resistant chitosan enzyme[D]. Lianyungang:Jiangsu Ocean University, 2022.] LI T. Screening, identification and enzymatic properties of Bacillus sp. CLT07 producing acid resistant chitosan enzyme[D]. Lianyungang: Jiangsu Ocean University, 2022.
[22] 尹雅洁, 谭光迅, 胡远亮. Mitsraria sp. 1412产壳聚糖酶的分离纯化及性质研究[J]. 湖北师范大学学报(自然科学版),2019,39(1):70−75. [YIN Y J, TAN G X, HU Y L. Isolation, purification and characterization of chitosanase produced by Mitsraria sp. 1412[J]. Journal of Hubei University(Natural Science),2019,39(1):70−75.] YIN Y J, TAN G X, HU Y L. Isolation, purification and characterization of chitosanase produced by Mitsraria sp. 1412[J]. Journal of Hubei University(Natural Science), 2019, 39(1): 70−75.
[23] 袁建平, 侯晓强. 壳聚糖酶的分离纯化及性质研究[J]. 湖北农业科学,2013,52(15):3647−3649. [YUAN J P, HOU X Q. Study on Purification and Properties of Chitosanase[J]. Hubei Agricultural Sciences,2013,52(15):3647−3649.] YUAN J P, HOU X Q. Study on Purification and Properties of Chitosanase[J]. Hubei Agricultural Sciences, 2013, 52(15): 3647−3649.
[24] YANG G S, SUN H H, CAO R, et al. Characterization of a novel glycoside hydrolase family 46 chitosanase, Csn-BAC, from Bacillus sp. MD-5[J]. International Journal of Biological Macromolecules,2020,146:518−523. doi: 10.1016/j.ijbiomac.2020.01.031
[25] CAO S N, GAO P, XIA W S, et al. A novel chitosanase from Penicillium oxalicum M2 for chitooligosaccharide production:Purification, identification and characterization[J]. Molecular Biotechnology,2022,64(9):947−957. doi: 10.1007/s12033-022-00461-9
[26] LIU Y, LI Y L, TONG S, et al. Expression of a Beauveria bassiana chitosanase (BbCSN-1) in Pichia pastoris and enzymatic analysis of the recombinant protein[J]. Protein Expression and Purification,2020,166:105519. doi: 10.1016/j.pep.2019.105519
[27] ZHOU L, LIU W, TEREFE N S. The inactivation kinetics of soluble and membrane-bound polyphenol oxidase in pear during thermal and high-pressure processing[J]. Food and Bioprocess Technology,2018,11(5):1039−1049. doi: 10.1007/s11947-018-2070-0
[28] CAHYANINGTYAS H A A, SUYOTHA W, SUYOTHA, et al. Statistical optimization of halophilic chitosanase and protease production by Bacillus cereus HMRSC30 isolated from Terasi simultaneous with chitin extraction from shrimp shell waste[J]. Biocatalysis and Agricultural Biotechnology,2021,31:101918. doi: 10.1016/j.bcab.2021.101918
[29] DALTON T D, THOMAS A C, ANNA M S, et al. Design, heterologous expression, and application of an immobilized protein kinase[J]. Bioconjugate Chemistry,2023,34(1):204−211. doi: 10.1021/acs.bioconjchem.2c00485
[30] 季更生, 陈爱春. 微生物壳聚糖酶的研究进展[J]. 食品科学,2010,31(3):297−301. [JI G S, CHEN A C. Research progress of chitosanase from microorganisms[J]. Food Science,2010,31(3):297−301.] JI G S, CHEN A C. Research progress of chitosanase from microorganisms[J]. Food Science, 2010, 31(3): 297−301.
[31] 李振梅, 侯庆爱, 牛其东, 等. 壳聚糖酶的分子结构与作用机制的研究进展[J]. 齐鲁工业大学学报,2021,35(2):34−40. [LI Z M, HOU Q A, NIU Q D, et al. Advances in studies on molecular structure and mechanism of chitosanase[J]. Journal of Qilu University of Technology,2021,35(2):34−40.] LI Z M, HOU Q A, NIU Q D, et al. Advances in studies on molecular structure and mechanism of chitosanase[J]. Journal of Qilu University of Technology, 2021, 35(2): 34−40.
[32] 谷亚茹, 郝雅荞, 张硕, 等. 一种产壳聚糖酶野生菌株的筛选及产酶工艺优化[J]. 食品科技,2021,46(9):14−21. [GU Y R, HAO Y Q, ZHANG S, et al. Screening of a wild strain with chitosanase-producing ability and optimization of its production conditions[J]. Food Science and Technology,2021,46(9):14−21.] GU Y R, HAO Y Q, ZHANG S, et al. Screening of a wild strain with chitosanase-producing ability and optimization of its production conditions[J]. Food Science and Technology, 2021, 46(9): 14−21.
[33] HUYNH N T, SUYOTHA W, SHIGEKAZU Y, et al. Low-cost production of chitosanolytic enzymes from Lentzea sp. strain OUR-I1 for the production of antimicrobial substances against food-borne pathogens[J]. International Food Research Journal,2019,26(4):1293−1304.
[34] 张馨月, 岳晓洁, 李铮峥, 等. 淡紫紫孢菌的筛选、鉴定及产壳聚糖酶固体发酵条件优化[J]. 中国食品学报,2020,20(4):160−169. [ZHANG X Y, YUE X J, LI Z Z, et al. Isolation and identification of Purpureocillium lilacinum and optimization of it’s solid fermentation conditions for producing chitosanase[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(4):160−169.] ZHANG X Y, YUE X J, LI Z Z, et al. Isolation and identification of Purpureocillium lilacinum and optimization of it’s solid fermentation conditions for producing chitosanase[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(4): 160−169.
[35] 卢波斯, 崔丹丹, 李志明, 等. 高效产壳聚糖酶海洋菌株Mitsuaria sp. SH-50的筛选、鉴定及产酶条件优化[J]. 中国调味品,2022,47(7):1−9. [LU B S, CUI D D, LI Z M, et al. Screening, identification and optimization of enzyme production conditions of the chitosanase-producing marine strain Mitsuaria sp. SH-50 with high efficiency[J]. China Condiment,2022,47(7):1−9.] LU B S, CUI D D, LI Z M, et al. Screening, identification and optimization of enzyme production conditions of the chitosanase-producing marine strain Mitsuaria sp. SH-50 with high efficiency[J]. China Condiment, 2022, 47(7): 1−9.
[36] LIAQAT F, SÖZER BAHADIR P, et al. Optimization of chitosanase production by Bacillus mojavensis EGE-B-5.2i[J]. Journal of Basic Microbiology,2018,58(10):836−847. doi: 10.1002/jobm.201800132
[37] 李佳茵, 王慧敏, 祖国仁. 海洋真菌MF-08产壳聚糖酶诱导条件及酶学性质分析[J]. 湖北农业科学,2016,55(7):1778−1781. [LI J Y, WANG H M, ZU G R. Isolation, identification and enzyme characteristics of the chitosanase producing marine fungal MF-08[J]. Hubei Agricultural Sciences,2016,55(7):1778−1781.] LI J Y, WANG H M, ZU G R. Isolation, identification and enzyme characteristics of the chitosanase producing marine fungal MF-08[J]. Hubei Agricultural Sciences, 2016, 55(7): 1778−1781.
[38] WANG C L, SU J W, LIANG T W, et al. Production, purification and characterisation of a chitosanase from Bacillus cereus[J]. Research on Chemical Intermediates,2014,40(6):2237−2248. doi: 10.1007/s11164-014-1601-1
[39] 陈聪聪. 产壳聚糖酶Mitsuaria sp. C4菌株的研究[D]. 福州:福建师范大学, 2018. [CHEN C C. To produce chitosan enzyme Mitsuaria sp. C4 strain of research[D]. Fuzhou:Fujian Normal University, 2018.] CHEN C C. To produce chitosan enzyme Mitsuaria sp. C4 strain of research[D]. Fuzhou: Fujian Normal University, 2018.
[40] 严寅珲, 鲁晶娣, 黄锦翔, 等. 中村芽胞杆菌壳聚糖酶在大肠杆菌中重组表达及酶学性质[J]. 中国食品学报,2022,22(9):74−81. [YAN Y H, LU J D, HUANG J X, et al. Recombinant expression and enzymatic characterization of Bacillus nakamurai chitosanase in E. coli[J]. Journal of Chinese Insitute of Food Science and Technology,2022,22(9):74−81.] YAN Y H, LU J D, HUANG J X, et al. Recombinant expression and enzymatic characterization of Bacillus nakamurai chitosanase in E. coli[J]. Journal of Chinese Insitute of Food Science and Technology, 2022, 22(9): 74−81.
[41] CHIANG C L, CHANG C T, SUNG H Y. Purification and properties of chitosanase from a mutant of Bacillus subtilis IMR-NK1[J]. Enzyme and Microbial Technology,2003,32(2):260−267. doi: 10.1016/S0141-0229(02)00275-2
[42] JIANG Z Q, MA S, GUAN L Y, et al. Biochemical characterization of a novel bifunctional chitosanase from Paenibacillus barengoltzii for chitooligosaccharide production[J]. World Journal of Microbiology and Biotechnology,2021,37(5):83−95. doi: 10.1007/s11274-021-03051-0
-
期刊类型引用(1)
1. 杜文娟,阿瓦古丽·图尔荪,董志琴,马惠娟,马正海. 萎缩芽孢杆菌酸碱耐受性壳聚糖酶的表达及酶学性质分析. 生物工程学报. 2025(01): 352-362 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:


 下载:
下载:



