Transformation of Selenium Nanoparticles by Lactobacillus acidophilus and Biological Activities of Selenium Nanoparticles Produced
-
摘要: 乳酸菌具有还原亚硒酸钠为纳米硒的能力。为了采用更加环境友好的方式获得纳米硒颗粒,本研究首先探索了培养基中加硒浓度、加硒时间,以及培养时长对嗜酸乳杆菌(Lactobacillus acidophilus)合成纳米硒的影响,随后对所产的纳米硒颗粒的粒径、zeta电位及抑菌活性进行研究。结果表明,当培养基中硒含量为0~600 μg/mL时,硒浓度越高,转化得到的纳米硒越多;当培养基中硒浓度高于600 μg/mL时,发酵液中的纳米硒含量反而减少。在嗜酸乳杆菌生长的对数中前期,即第6 h时添加亚硒酸钠,更有利于纳米硒的合成。而培养至32 h后,纳米硒几乎不再继续合成。通过扫描电镜及粒径和电位仪分析发现,嗜酸乳杆菌所产的纳米硒颗粒呈球形,且超声破碎有助于其释放;纳米硒颗粒带负电荷,电位绝对值为40~50 mV,粒径大小较多分布于170~210 nm,具有良好的稳定性。抑菌实验结果表明,嗜酸乳杆菌还原亚硒酸钠所产的纳米硒对大肠杆菌、沙门氏菌、金黄色葡萄球菌和枯草芽孢杆菌的生长均具有抑制作用。综上,嗜酸乳杆菌可以将亚硒酸钠还原合成纳米硒,且所产的纳米硒颗粒具有良好的抑菌活性。Abstract: Lactic acid bacteria have the ability to reduce sodium selenite to selenium nanoparticles (SeNPs). To obtain SeNPs in a more environmentally friendly way, this study first explored the effects of selenium concentration in the medium, selenium addition time and cultivating duration on the synthesis of SeNPs by Lactobacillus acidophilus, followed by a study of the particle size, zeta potential and antibacterial activity of the SeNPs produced. The results showed that when the selenium content in the medium was 0~600 μg/mL, the higher the selenium concentration was, the more nano-selenium was obtained. When the selenium concentration in the medium was higher than 600 μg/mL, the content of SeNPs in the fermentation broth decreased. The addition of sodium selenite in the early logarithmic stage of bacterial growth was more conducive to the synthesis of SeNPs. After 32 h of culture, SeNPs were almost no longer synthesized. The analysis using scanning electron microscopy and particle size and zeta potential analyzer revealed that the SeNPs produced by L.acidophilus were spherical in shape. Ultrasound treatment contributed to their release. The SeNPs carried a negative charge, with an absolute potential value of 40~50 mV, and their particle size predominantly ranged from 170~210 nm, exhibiting good stability. The results of antibacterial experiments showed that the SeNPs produced by L.acidophilus had inhibitory effects on the growth of Escherichia coli, Salmonella, Staphylococcus aureus and Bacillus subtilis. In conclusion, L.acidophilus can transform sodium selenite into SeNPs, which have good antibacterial activity.
-
硒(Selenium,Se)是人体和动物必需的微量元素,其作为谷胱甘肽过氧化物酶(Glutathione Peroxidase,GPX)和硫氧还蛋白还原酶(Thioredoxin Reductase,TrxR)等的活性中心[1],参与了人体的抗氧化和免疫等多个生物学代谢过程,具有抗癌、增强免疫力、抗氧化等生理功能[2]。人体缺硒会引发多种疾病,如克山病、大骨节病以及心脑血管疾病等[3−4]。
硒有多种存在形式,包括无机硒、有机硒,以及单质纳米硒(Selenium Nanoparticles,SeNPs)。硒酸钠和亚硒酸钠等无机硒生物毒性较强,生物利用度较低,且易造成环境污染。相比而言,有机硒的毒性较弱,如硒多糖、硒代氨基酸以及硒代蛋白质等。而SeNPs的半数致死量LD50要高于无机硒和有机硒,更加低毒高效[5]。SeNPs不仅具有抗菌[6−7]、抗氧化[8−9]和抗癌[10−11]等生物性能,同时,作为一种纳米材料,还具有良好的半导体、光电、传感和催化性能,在医学、环境、农业、电子及光学等多领域中有较好的应用前景[12−13]。
SeNPs的合成分为物理、化学和生物法。物理法包括微波辅助、球磨和光感应等;化学法有高温分解、电化学及化学还原等,这些方法涉及危险的反应条件和有毒的化学试剂,生产率低且成本高,容易对环境造成污染。生物法是指利用细菌、真菌、藻类及植物等进行生物转化的方法,其对环境友好,高效且经济[14−15]。另一方面,物理、化学方法制得的SeNPs,在没有稳定剂的情况下,分散不稳定,容易导致聚集;而生物合成的SeNPs更加稳定、生物相容性更高、生物性能更好[16]。生物合成SeNPs可以通过微生物进行,而常用于食品发酵的乳酸菌,具有公认安全的优势,已有研究报道乳酸菌具有生物合成SeNPs的能力[17]。王金泽等[18]研究了乳酸乳球菌(Lactococcus lactis),发现其合成的SeNPs的表面包裹多糖和蛋白质等多种活性物质。El-Saadony等[19]从母乳中筛选出可以转化亚硒酸钠为SeNPs的副干酪乳杆菌(Lactobacillus paracasei),并且认为源自L. paracasei的SeNPs的抗真菌活性可能优于通过化学方法制备的SeNPs。王丽红等[20]研究发现,植物乳杆菌LP21(Lactobacillus plantarum LP21)转化的SeNPs分散性良好,具有一定抑菌活性,对溶藻弧菌的最低抑菌浓度为286 μg/mL。Spyridopoulou等[21]对干酪乳杆菌(Lactobacillus casei)合成的SeNPs颗粒的抗癌活性进行研究,发现其在体外可以抑制肿瘤的特异性增殖、诱导癌症细胞的凋亡并提高活性氧水平。综上可见,乳酸菌具有优良的转化无机硒为SeNPs的能力,且所得的SeNPs具有多种生物活性。
虽然目前有关乳酸菌生物合成SeNPs的研究较多,但不同菌株具有特异性,不同菌种还原亚硒酸钠为SeNPs的规律不同,且得到的SeNPs的生物活性也有一定差异。目前有关嗜酸乳杆菌(Lactobacillus acidophilus)生物合成SeNPs的研究较少。本文以L. acidophilus为研究对象,探索培养基中加硒(亚硒酸钠)浓度、加硒时间及培养时长对嗜酸乳杆菌合成SeNPs的影响,并对所得SeNPs的粒径大小、Zeta电位及抑菌活性进行研究,为生物合成SeNPs提供更多理论依据。
1. 材料与方法
1.1 材料与仪器
嗜酸乳杆菌(Lactobacillus acidophilus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella enteritidis)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis) 均由华南农业大学食品学院应用微生物实验室保藏;亚硒酸钠 分析纯,西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich);硫化钠 分析纯,福晨(天津)化学试剂有限公司。
MQD-B1T振荡培养箱 上海旻泉仪器有限公司;5804R冷冻离心机 Eppendorf公司;BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;Verios 460场发射扫描电子显微镜 FEI公司;Zatasizer Nano ZS 90纳米粒度及Zeta电位分析仪 Malvern公司。
1.2 实验方法
1.2.1 嗜酸乳杆菌生长曲线的测定
将保藏于−80 ℃冰箱的菌株取出,解冻后接种于液体MRS培养基中,37 ℃活化24 h。之后划线于MRS平板进行第二次活化,37 ℃培养48 h,待平板上长出单菌落后,挑取单菌落接于液体MRS培养基进行第三次活化,37 ℃培养12 h。菌株活化后,按2%的接种量接种于MRS培养基中,37 ℃培养,采用比浊法[22],每隔1 h测定培养液OD600直至48 h。
1.2.2 嗜酸乳杆菌合成SeNPs
1.2.2.1 单因素实验
菌株活化后,按2%的接种量接种于MRS培养基(100 mL/250 mL)中,37 ℃、150 r/min条件下培养。探究不同培养基加硒浓度(0、150、300、450、600、750 μg/mL,固定加硒时间为第6 h,培养时长为36 h)、不同加硒时间(0、3、6、9、12 h,固定加硒浓度为450 μg/mL,培养时长为36 h)以及不同培养时长(12、16、20、24、28、32、36 h,固定加硒浓度为450 μg/mL,加硒时间为第6 h)对菌液中菌体量及SeNPs含量的影响。
1.2.2.2 菌体量测定
取菌液在5000 r/min下离心10 min,菌体沉淀洗涤3次后,105 ℃烘干至恒重,称重。
1.2.2.3 SeNPs含量测定
采用参考文献[23]的方法测定菌液的SeNPs含量,并进行一定的改进。
标准曲线制作:建立0~800 μg SeNPs的标准曲线。取各组硒溶液0.5 mL,加上0.5 mL羟胺溶液,混合反应1 h。再加1 mol/L Na2S溶液2 mL,慢慢混合均匀,1 h后溶液为红棕色,在500 nm处测吸光度值。以SeNPs含量(μg)为横坐标,对应的吸光度值为纵坐标,建立校准曲线。
样品SeNPs测定:取10 mL菌液,在10000 r/min下离心10 min,菌体沉淀洗涤3次后,加入Na2S溶液,反应1 h,期间间歇摇晃溶液。离心后取上清液,在500 nm处测定吸光度值。将吸光度值代入标准曲线,计算对应的SeNPs含量。依据式(1)计算SeNPs的合成速率:
SeNPs合成速率(μg/(mL⋅h))=SeNPs增加量(μg/mL)/时长(h) (1) 1.2.3 SeNPs的表征
将菌株活化后,按2%的接种量接种于MRS培养基(100 mL/250 mL)中,37 ℃、150 r/min条件下培养。培养6 h后添加亚硒酸钠使培养基硒浓度为450 μg/mL,继续培养至32 h,获得含硒菌液,并以不含硒的菌液为对照。取部分菌液制样,用Verios 460场发射扫描电镜观察并拍照。
SeNPs的制备参照参考文献[20]的方法加以改良,发酵液10000 r/min离心10 min,得到沉淀后用0.1% SDS(w/v)/1 mol/L NaOH悬浮,超声波300 W,10 s/停10 s,处理20 min。3000 r/min离心10 min,上清液再于12000 r/mim 离心10 min,沉淀经蒸馏水洗涤3次重悬,然后通过0.45 μm微孔滤膜过滤,冷冻干燥制备得到SeNPs。将SeNPs颗粒重悬于蒸馏水中,用纳米粒度及Zeta电位分析仪测定粒径大小及Zeta电位。
1.2.4 SeNPs的释放
为确认超声破碎是否有助于SeNPs的释放,按照1.2.3步骤准备含硒菌液,进行超声处理,超声条件:功率300 W,时长20 min,间隔10 s。超声后在10000 r/min下离心10 min,得到沉淀,与不超声处理的沉淀进行对比。
1.2.5 SeNPs抑菌活性测定
4种指示菌(革兰氏阴性菌包括E. coli和S. enteritidis;革兰氏阳性菌包括S. aureus和B. subtilis)的活化:将保藏于−80 ℃冰箱的指示菌取出,接种于液体LB培养基中,37 ℃活化24 h。之后划线于LB平板进行第二次活化,37 ℃培养36 h,待平板上长出单菌落后,挑取单菌落接于液体LB培养基进行第三次活化,37 ℃培养12 h。
将活化好的指示菌按2%的接种量接种至LB培养基中,添加100 μg/mLSeNPs,同时加入对应体积生理盐水设置对照组(Con)。37 ℃、150 r/min 振荡培养,每隔1 h取样,600 nm波长处测定吸光度,绘制生长曲线。
1.3 数据处理
实验中的数据均为3次重复,结果以平均值±标准差的形式表示。采用IBM SPSS Statistics 24软件进行显著性差异分析(P<0.05),采用GraphPad Prism 9软件进行绘图。
2. 结果与分析
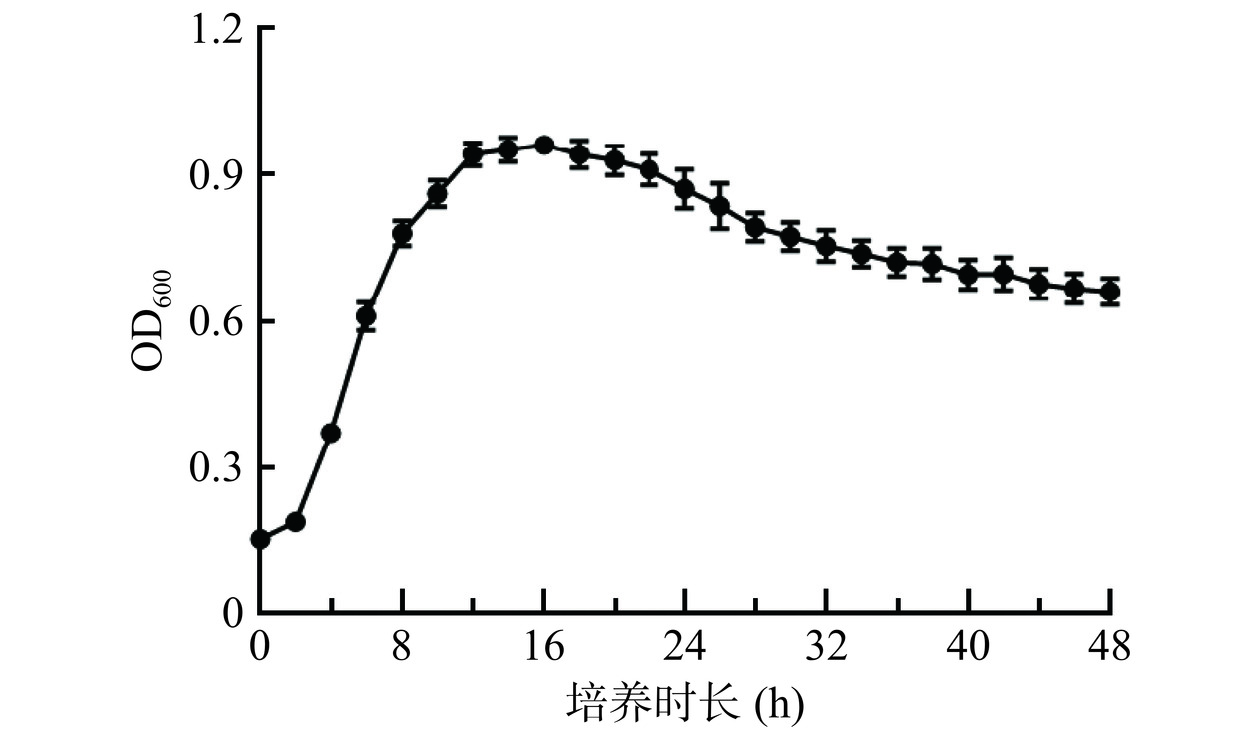
2.1 嗜酸乳杆菌生长曲线
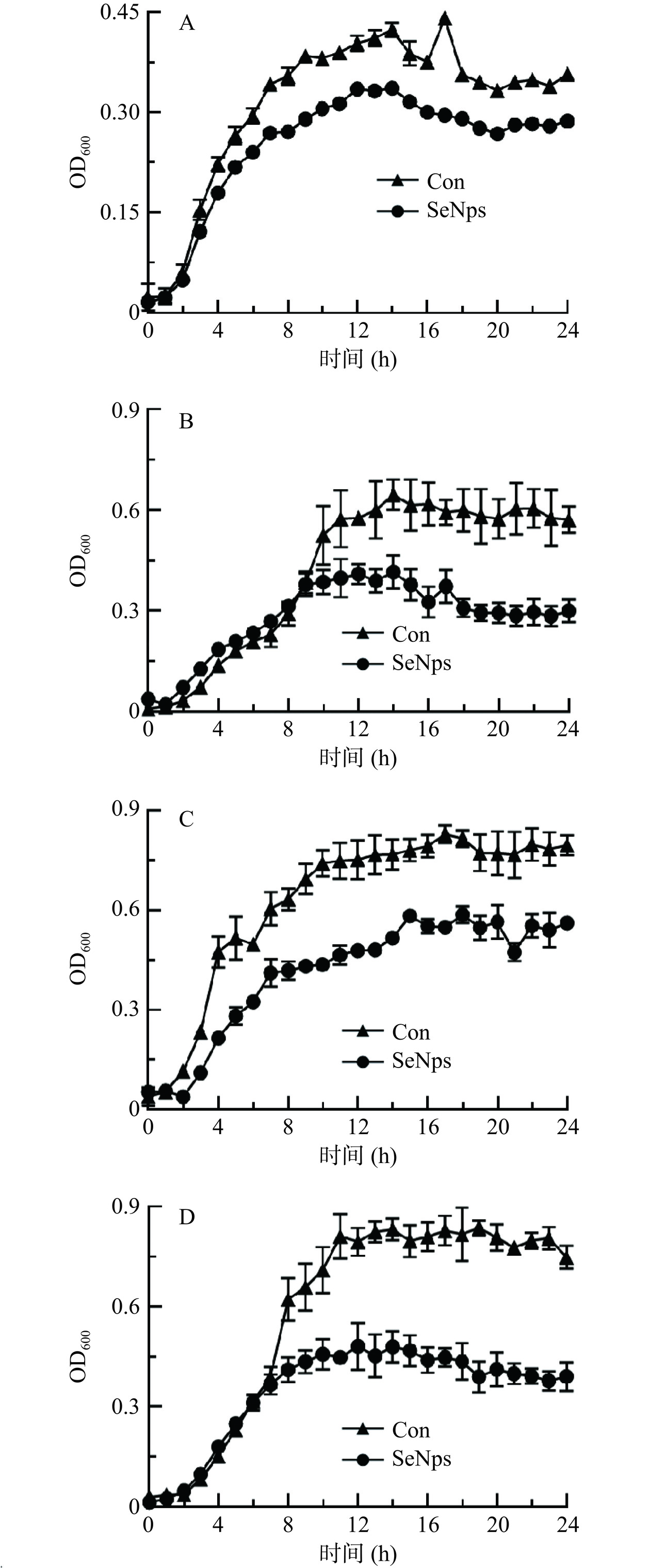
嗜酸乳杆菌的生长曲线如图1所示。在培养约3 h后,嗜酸乳杆菌的生长逐渐增快,进入对数期,直至12 h。12~22 h为稳定期,之后培养基营养物质减少,嗜酸乳杆菌的生长开始衰退。
2.2 嗜酸乳杆菌转化合成SeNPs
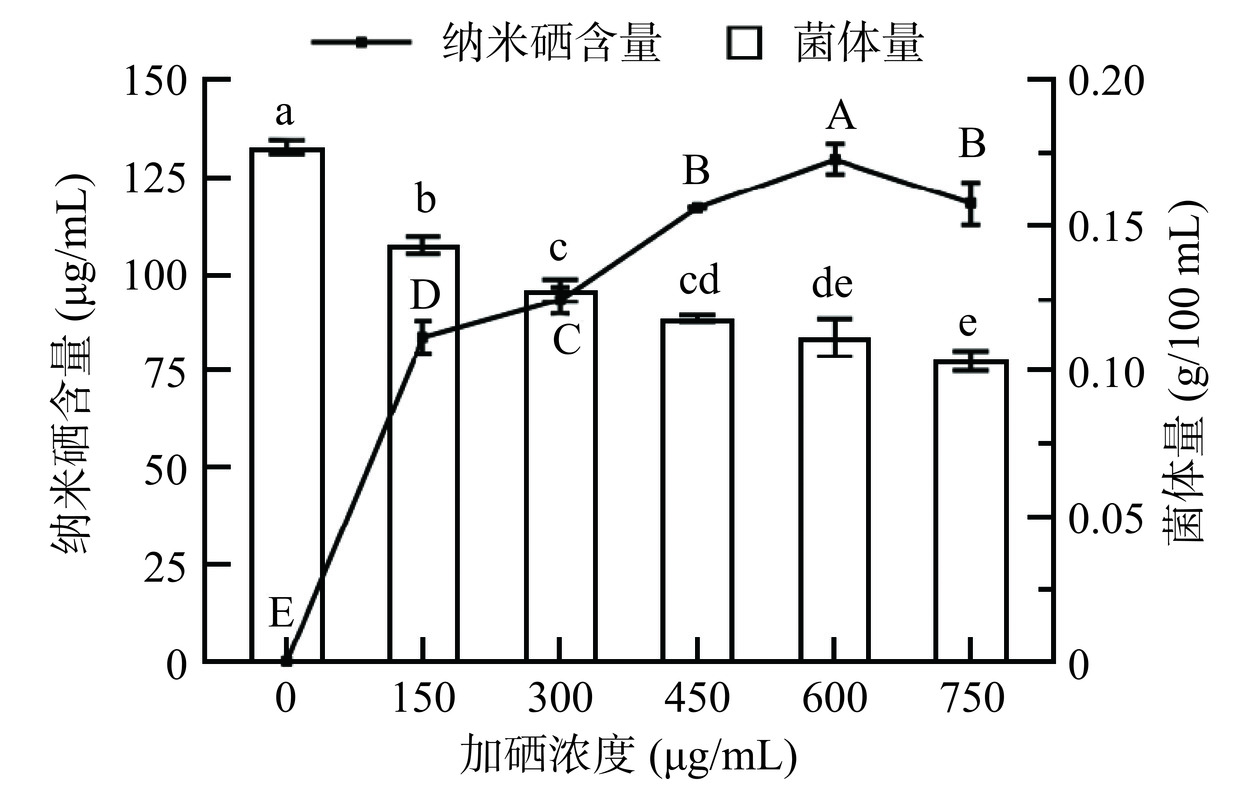
2.2.1 培养基硒浓度对菌体生物量及SeNPs生成量的影响
亚硒酸钠的生物毒性较强,随着其浓度的升高,微生物的生长逐渐被抑制。如图2所示,随着硒浓度的增加,嗜酸乳杆菌的菌体量逐渐减少,与空白对照组差异显著(P<0.05)。在此过程中,微生物可以生物转化无机硒为SeNPs。在一定浓度范围内,随着无机硒浓度的增加,微生物合成的SeNPs越多,菌液颜色越红。本研究发现,当无机硒添加浓度为150~600 μg/mL时,浓度越高,最终得到的嗜酸乳杆菌菌液红色越深,菌液中SeNPs含量越多;但当添加的无机硒浓度为750 μg/mL时,菌液红色变浅,SeNPs的合成量显著下降(P<0.05)。说明过高浓度的无机硒,会抑制微生物的生长,并削弱微生物合成SeNPs的能力。
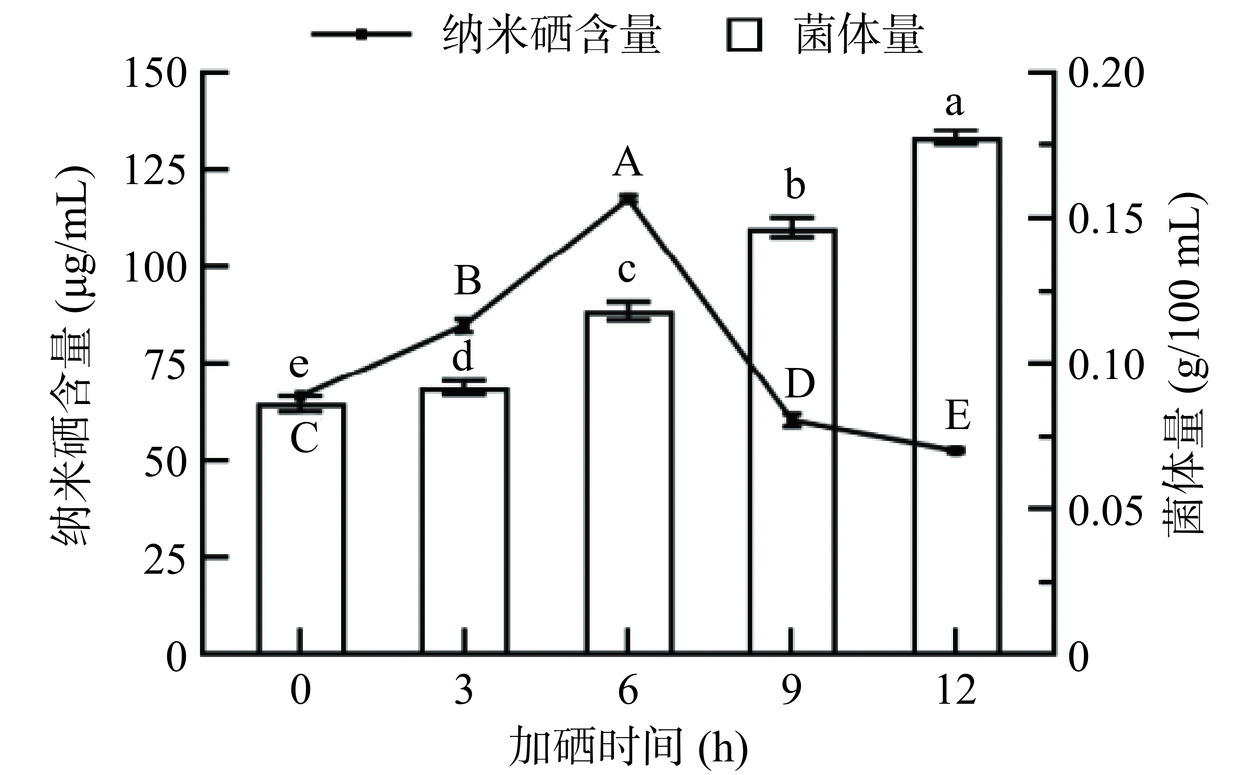
2.2.2 加硒时间对菌体生物量及SeNPs生成量的影响
在培养初期,微生物还未大量繁殖,生长缓慢,亚硒酸钠对其毒性更为明显。有研究发现,在对数期添加亚硒酸钠,更有利于SeNPs的合成。本研究在嗜酸乳杆菌培养初期(0 h)、对数前期(3 h)、对数中前期(6 h)、对数中后期(9 h)以及对数后期(12 h)分别添加亚硒酸钠,结果如图3所示。在对数期中后期添加硒,菌体量更高,即硒对嗜酸乳杆菌生长的毒性作用更弱,但不等同于合成的SeNPs越多。由结果可知,SeNPs的合成量随着加硒时间点的延后先增加后减少,在第6 h处添加亚硒酸钠,SeNPs的合成量最高。说明在嗜酸乳杆菌对数生长的中前期添加亚硒酸钠,更有利于还原产生SeNPs。
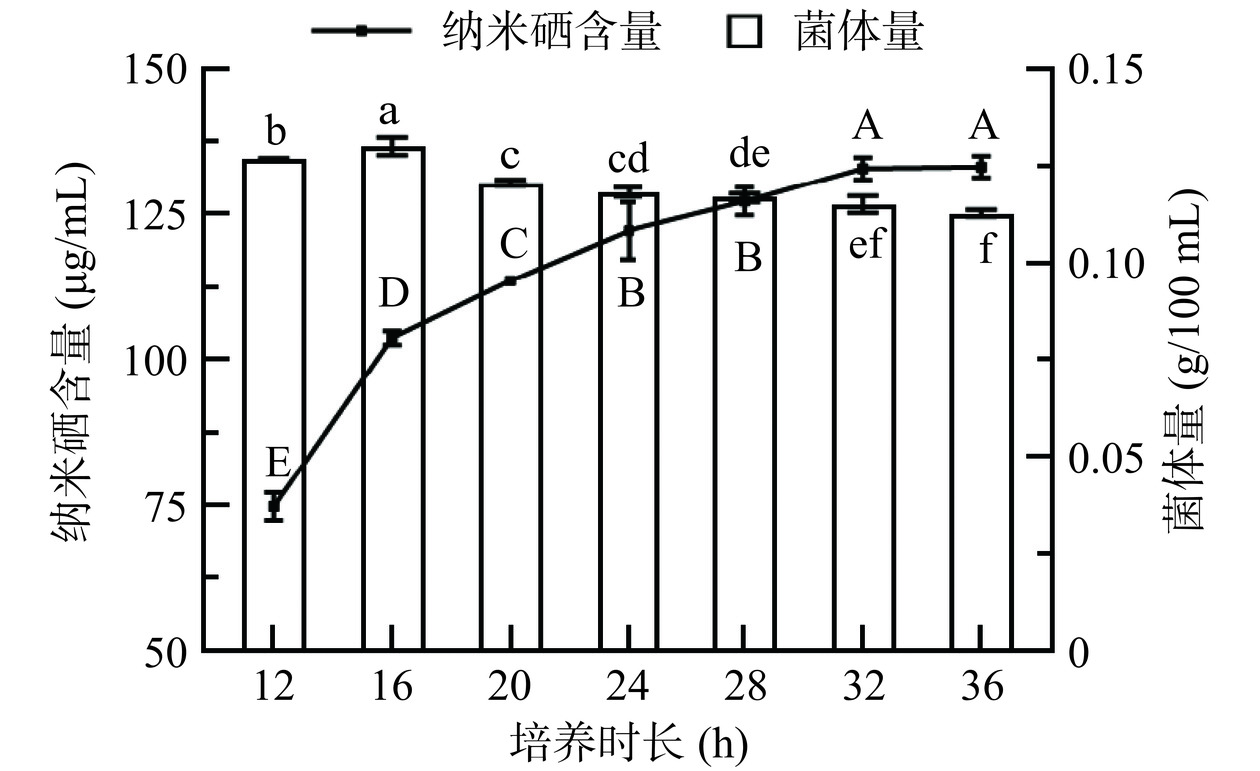
2.2.3 培养时长对菌体生物量及SeNPs生成量的影响
当嗜酸乳杆菌处于对数中前期时,菌体大量繁殖,此时(接种后第6 h)加入一定量的亚硒酸钠。由图4结果可以看出,嗜酸乳杆菌开始快速合成SeNPs。16 h后,菌体量开始减少,SeNPs合成速率越来越低,从7.24±0.40 μg/(mL·h)降至2.46±0.19 μg/(mL·h)。直至32 h后,SeNPs合成速率为0.29±0.14 μg/(mL·h),几乎不再继续合成。
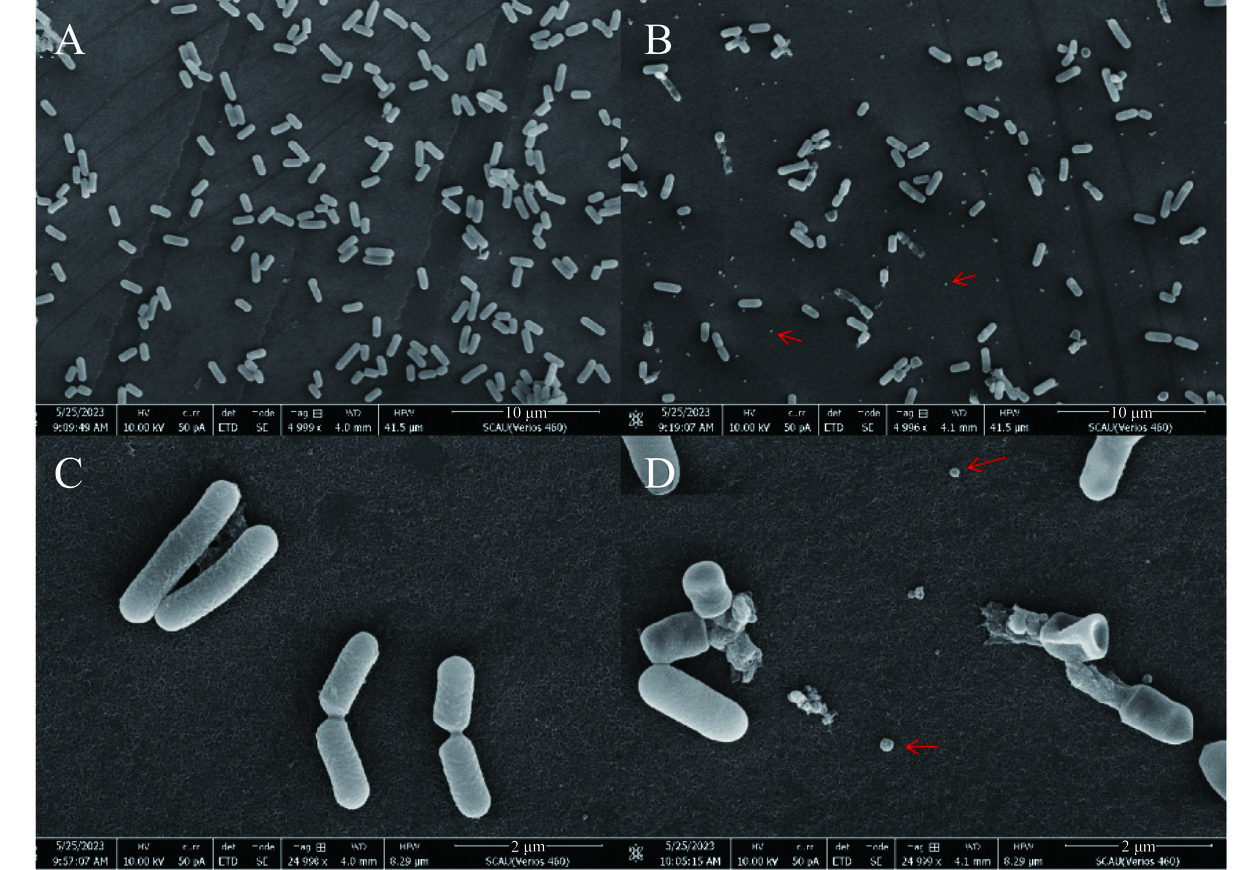
2.3 菌体扫描电镜分析
将嗜酸乳杆菌在添加硒和不添加硒两种条件下进行培养,获取其细胞,用扫描电镜观察其形态,结果如图5所示,嗜酸乳杆菌细胞呈杆状。不含硒组(图5A和图5C)的菌体完整,几乎无破裂现象;而含硒组(图5B和图5D)可以观察到有菌体破裂,内容物流出的现象。破裂菌体的长度明显短于完整菌体,而完整菌体长度(1.444±0.175 μm)相较于不含硒组的(1.543±0.125 μm)略短,但差异不显著(P>0.05)。从图5B和图5D中还可以观察到,菌体外存在SeNPs颗粒,呈球形。说明嗜酸乳杆菌可以将亚硒酸钠转化为SeNPs,并将其释放至胞外,并且此过程可能伴随着菌体的破裂。
2.4 SeNPs的粒径及Zeta电位
在培养基中添加不同浓度的亚硒酸钠(以硒计150~750 μg/mL),最终所得的SeNPs颗粒大小介于32.67~615.10 nm,且在170~210 nm之间分布较多。由Zeta电位结果可知(表1),SeNPs颗粒带负电荷,不同组别所测的电位绝对值平均介于40~50 mV。zeta电位可以反映颗粒之间相互排斥或吸引力的强度,其绝对值越高,体系越稳定。本文研究的嗜酸乳杆菌所产的SeNPs的电位绝对值高于40 mV,说明嗜酸乳杆菌转化合成的SeNPs具有良好的稳定性。
表 1 不同硒浓度下嗜酸乳杆菌所产SeNPs的粒径及Zeta电位Table 1. Particle sizes and zeta potentials of SeNPs produced by L. acidophilus under different selenium concentrations硒浓度(μg/mL) SeNPs平均粒径(nm) SeNPs Zeta电位(mV) 150 208.13±1.19a −44.10±0.36a 300 200.97±3.16b −49.03±0.42c 450 172.83±1.93d −46.93±0.74b 600 176.40±1.48cd −48.40±0.98bc 750 178.97±1.36c −42.87±1.03a 注:同列数据标有不同字母表示差异显著(P<0.05)。 2.5 含SeNPs菌泥超声前后对比
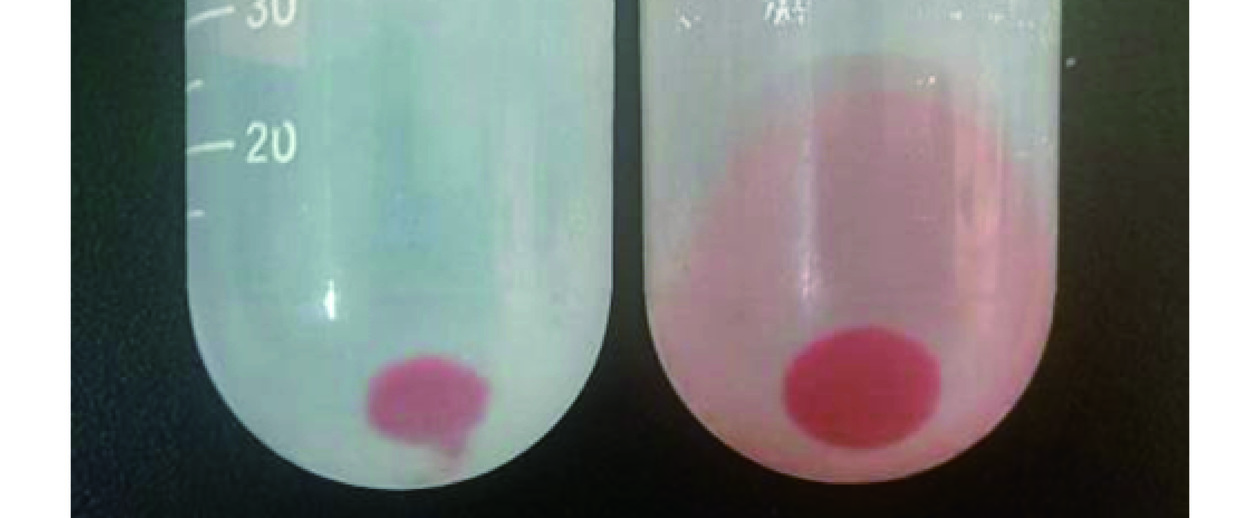
将已合成SeNPs的菌液离心,得到菌泥沉淀,与超声后离心的菌泥进行对比,结果如图6所示。将嗜酸乳杆菌超声破碎后,有更多的SeNPs释放出来,说明超声破壁处理有助于SeNPs的分离提取。
2.6 SeNPs的抑菌活性
如图7所示,嗜酸乳杆菌所产的SeNPs在一定程度上可以抑制大肠杆菌、沙门氏菌、枯草芽孢杆菌及金黄色葡萄球菌的生长。而且此抑制作用主要体现在对数中后期,当指示菌的生长进入对数中后期,其活性明显低于对照组。
3. 讨论
影响乳酸菌合成SeNPs的因素很多,培养基中添加亚硒酸浓度、添加时间等是较为关键的因素。除此之外,培养基的营养组成以及培养条件等也会对SeNPs的合成量造成影响。梁金钟等[22]以改良MRS为基础培养基对植物乳杆菌进行富硒培养,研究不同发酵时间、加硒时间、初始pH,以及接种量对菌体硒含量的影响,最终优化得到的硒含量高达839.635 μg/g,比优化前提高了1.28倍。Xu等[24]发现,培养鼠李糖乳杆菌ATCC 53103的培养基盐浓度高达8%时,硒的累积量增加了437.63 μg/g;同时,pH和培养温度在一定范围内,对硒累积量的影响也呈先增加后减少的影响,在pH6.0,37 ℃的为最优培养条件。目前培养乳酸菌多用MRS培养基,Zommara等[25]还对比了MRS培养基和牛奶渗透培养基对乳酸菌合成SeNPs的影响,发现虽然MRS培养基更适合乳酸菌的生长,但两者对于无机硒转化为SeNPs的转化率相差不大,且牛奶渗透培养基所得的SeNPs颗粒粒径更小一些。因此,在确定加硒浓度、加硒时间及培养时长后,还可进一步对培养基营养组成或培养条件等进行优化,以提高最终获得的SeNPs含量。
乳酸菌合成SeNPs的位置,可能是胞外,也可能是胞内,甚至有些乳酸菌在胞内胞外都可合成纳米颗粒,这就涉及到不同的合成及输送途径[14]。若是胞外合成,首先菌体会分泌一些酶或非酶等还原性物质至胞外,亚硒酸根离子再被还原为SeNPs。胞外合成途径还可以简化SeNPs的分离纯化,可直接从发酵上清液中获取SeNPs。Alam等[26]发现,嗜酸乳杆菌发酵上清液可以转化亚硒酸钠为SeNPs,并通过傅里叶转换红外光谱分析发现,应该是细胞外蛋白起到还原无机硒的作用。这验证了胞外合成SeNPs的可能性。若是胞内合成,则亚硒酸根首先需通过细胞壁被运输进胞内,然后在胞内被某些物质还原为SeNPs颗粒,之后SeNPs再同样通过细胞壁被运输至胞外。Mereno-Martin等[16]通过透射电镜观察到细胞壁破碎现象,说明SeNPs合成于胞内。而本研究通过扫描电镜结果发现,本文研究的嗜酸乳杆菌可以在胞内合成SeNPs,而且所得的SeNPs可以通过超声破碎进一步释放。但胞外是否也存在还原性物质将硒酸根离子进行转化,还需进一步研究。
SeNPs的生物活性或应用价值在很大程度上取决于其形状和粒径大小,而不同研究所得的SeNPs粒径差异较大。Visha等[27]利用嗜酸乳杆菌所得的SeNPs粒径为15~50 nm,而Moreno-Martin等[16]在嗜酸乳杆菌的培养基中添加25 μg/mL的亚硒酸钠,所得的SeNPs粒径为176±13 nm,与本文所得SeNPs粒径相近。但该研究还发现,培养基中初始亚硒酸钠浓度越高,最后所产的SeNPs颗粒粒径越大。而本研究中,高浓度硒组(450~750 μg/mL)所得的SeNPs粒径反而略小于低浓度硒组(150~300 μg/mL),这可能与培养基初始硒浓度,或者菌株差异有关。此外,纳米颗粒所带电荷及电位大小也会受到影响。微生物合成的SeNPs颗粒表面通常附着蛋白质、脂质和多糖等有机化合物,这些有机物的存在可以通过增强静电排斥来稳定纳米颗粒,影响其Zeta电位[28]。
本研究从嗜酸乳杆菌获得的SeNPs对大肠杆菌、金黄色葡萄球菌等均具有抑制作用,可作为抑菌材料应用于食品、包装等行业。SeNPs抑菌活性的机制可能涉及到细胞壁的穿透、细胞膜的损失及内容物的流出、抑制生物膜的形成,以及氧化应激等[29]。有报道称,不同粒径的SeNPs颗粒的抑菌活性不同,粒径越小,抑制作用越强[30]。这可能是因为较小的纳米颗粒具有更大的表面积,从而提供更好的相互作用和细胞内渗透[31],且SeNPs对革兰氏阴性菌的抑制作用会强于革兰氏阳性菌,可能原因是革兰氏阳性菌在细胞壁上有更强的分子网络,比革兰氏阴性菌更难让SeNPs颗粒穿透细胞[6]。但也有研究提出不一样的观点,认为SeNPs对革兰氏阳性菌的抑制作用强于革兰氏阴性菌,可能跟SeNPs表面覆盖的有机层及所带正负电荷有关[32]。由此可见,不同微生物来源所得的SeNPs颗粒性质不同,所具有的生物活性也会有一定差异。应根据实际需求,筛选合适菌株,对其还原无机硒为SeNPs的合成动力学及规律作进一步探索,获得具有所需性状的SeNPs颗粒,充分发挥其应用价值。
4. 结论
本文对嗜酸乳杆菌合成SeNPs的规律进行研究。发现当培养基中的无机硒浓度≤600 μg/mL时,SeNPs的合成量随着硒浓度的升高而增加,且适宜培养时长为32 h,适宜的硒添加时间为对数生长的中前期,即第6 h。通过电镜观察及粒径电位分析,明确嗜酸乳杆菌合成的SeNPs颗粒呈球形,粒径大小较多分布于170~210 nm,带负电荷,电位绝对值为40~50 mV,具有良好的稳定性及抑菌活性。本研究为乳酸菌生物合成SeNPs提供了一定依据,但合成涉及的作用机制尚不明确,仍需进一步的研究和探索。
-
表 1 不同硒浓度下嗜酸乳杆菌所产SeNPs的粒径及Zeta电位
Table 1 Particle sizes and zeta potentials of SeNPs produced by L. acidophilus under different selenium concentrations
硒浓度(μg/mL) SeNPs平均粒径(nm) SeNPs Zeta电位(mV) 150 208.13±1.19a −44.10±0.36a 300 200.97±3.16b −49.03±0.42c 450 172.83±1.93d −46.93±0.74b 600 176.40±1.48cd −48.40±0.98bc 750 178.97±1.36c −42.87±1.03a 注:同列数据标有不同字母表示差异显著(P<0.05)。 -
[1] VINDRY C, OHLMANN T, CHAVATTE L. Translation regulation of mammalian selenoproteins[J]. Biochimica et Biophysica Acta (BBA) - General Subjects,2018,1862(11):2480−2492. doi: 10.1016/j.bbagen.2018.05.010
[2] ZHANG L, ZENG H W, CHENG W H. Beneficial and paradoxical roles of selenium at nutritional levels of intake in healthspan and longevity[J]. Free Radical Biology & Medicine,2018,127:3−13.
[3] VINCETI M, FILIPPINI T, WISE L A. Environmental selenium and human health:An update[J]. Current Environmental Health Reports,2018,5(4):464−485. doi: 10.1007/s40572-018-0213-0
[4] 王立平, 唐德剑, 沈亚美, 等. 硒的营养缺乏现状及补充方式[J]. 食品工业,2020,41(1):339−343. [WANG L P, TANG D J, SHEN Y M, et al. The status quo of nutrient deficiency and supplementation methods of selenium[J]. The Food Industry,2020,41(1):339−343.] WANG L P, TANG D J, SHEN Y M, et al. The status quo of nutrient deficiency and supplementation methods of selenium[J]. The Food Industry, 2020, 41(1): 339−343.
[5] JIA X D, LI N, CHEN J S. A subchronic toxicity study of elemental Nano-Se in Sprague-Dawley rats[J]. Life Sciences,2005,76(17):1989−2003. doi: 10.1016/j.lfs.2004.09.026
[6] WANG Y T, YE Q, SUN Y J, et al. Selenite reduction by proteus sp. ys02:New insights revealed by comparative transcriptomics and antibacterial effectiveness of the biogenic se0 nanoparticles[J]. Frontiers in Microbiology, 2022, 845321.
[7] SHOEIBI S, MASHREGHI M. Biosynthesis of selenium nanoparticles using Enterococcus faecalis and evaluation of their antibacterial activities[J]. Journal of Trace Elements in Medicine and Biology,2017,39:135−139. doi: 10.1016/j.jtemb.2016.09.003
[8] DKHIL M, ZRIEQ R, AL-QURAISHY S, et al. Selenium nanoparticles attenuate oxidative stress and testicular damage in streptozotocin-induced diabetic rats[J]. Molecules,2016,21(11):1517. doi: 10.3390/molecules21111517
[9] DOU X N, ZHANG B H, QIAO L, et al. Biogenic selenium nanoparticles synthesized by Lactobacillus casei atcc 393 alleviate acute hypobaric hypoxia-induced intestinal barrier dysfunction in C57BL/6 mice[J]. Biological Trace Element Research,2023,201(9):4484−4496. doi: 10.1007/s12011-022-03513-y
[10] PANDEY S, AWASTHEE N, SHEKHER A, et al. Biogenic synthesis and characterization of selenium nanoparticles and their applications with special reference to antibacterial, antioxidant, anticancer and photocatalytic activity[J]. Bioprocess and Biosystems Engineering,2021,44(12):2679−2696. doi: 10.1007/s00449-021-02637-0
[11] ABDOLI M, MOHAMMADI G, MANSOURI K, et al. A review on anticancer, antibacterial and photo catalytic activity of various nanoparticles synthesized by probiotics[J]. Journal of Biotechnology,2022,354:63−71. doi: 10.1016/j.jbiotec.2022.06.005
[12] CREMONINI E, ZONARO E, DONINI M, et al. Biogenic selenium nanoparticles:characterization, antimicrobial activity and effects on human dendritic cells and fibroblasts[J]. Microbial Biotechnology,2016,9(6):758−771. doi: 10.1111/1751-7915.12374
[13] TENDENEDZAI J T, CHIRWA E M N, BRINK H G. Performance Evaluation of Selenite (SeO32−) Reduction by Enterococcus spp.[J]. Catalysts,2021,11(9):1024. doi: 10.3390/catal11091024
[14] GHOSH S, SARKAR B, KAUSHIK A, et al. Nanobiotechnological prospects of probiotic microflora:Synthesis, mechanism, and applications[J]. Science of The Total Environment,2022,838:156212. doi: 10.1016/j.scitotenv.2022.156212
[15] HUSSAIN A, LAKHAN M N, HANAN A, et al. Recent progress on green synthesis of selenium nanoparticles-a review[J]. Materials Today Sustainability,2023,23:100420. doi: 10.1016/j.mtsust.2023.100420
[16] MORENO-MARTIN G, PESCUMA M, PÉREZ-CORONA T, et al. Determination of size and mass-and number-based concentration of biogenic SeNPs synthesized by lactic acid bacteria by using a multimethod approach[J]. Analytica Chimica Acta,2017,992:34−41. doi: 10.1016/j.aca.2017.09.033
[17] STABNIKOVA O, KHONKIV M, KOVSHAR I, et al. Biosynthesis of selenium nanoparticles by lactic acid bacteria and areas of their possible applications[J]. World Journal of Microbiology & Biotechnology,2023,39(9):230.
[18] 王金泽, 李静, 郭耀东, 等. 富硒乳酸菌亚硒酸盐还原特性及产硒机理研究[J]. 粮食与油脂,2022,35(4):139−144. [WANG J Z, LI J, GUO Y D, et al. Selenite reduction characteristics and selenium production mechanism of selenium-enriched lactic acid bacteria[J]. Cereals & Oils,2022,35(4):139−144.] doi: 10.3969/j.issn.1008-9578.2022.04.034 WANG J Z, LI J, GUO Y D, et al. Selenite reduction characteristics and selenium production mechanism of selenium-enriched lactic acid bacteria[J]. Cereals & Oils, 2022, 35(4): 139−144. doi: 10.3969/j.issn.1008-9578.2022.04.034
[19] EL-SAADONY M T, SAAD A M, TAHA T F, et al. Selenium nanoparticles from Lactobacillus paracasei HM1 capable of antagonizing animal pathogenic fungi as a new source from human breast milk[J]. Saudi Journal of Biological Sciences,2021,28(12):6782−6794. doi: 10.1016/j.sjbs.2021.07.059
[20] 王丽红, 杨辉, 苏文, 等. 植物乳杆菌LP21绿色合成纳米硒及对溶藻弧菌的抑菌活性[J]. 食品科学,2022,43(2):217−223. [WANG L H, YANG H, SU W, et al. Biosynthesis and its antibacterial activity against vibrio alginolyticus of Nano-selenium by Lactobacillus plantarum Lp21[J]. Food Science,2022,43(2):217−223.] doi: 10.7506/spkx1002-6630-20210104-026 WANG L H, YANG H, SU W, et al. Biosynthesis and its antibacterial activity against vibrio alginolyticus of Nano-selenium by Lactobacillus plantarum Lp21[J]. Food Science, 2022, 43(2): 217−223. doi: 10.7506/spkx1002-6630-20210104-026
[21] SPYRIDOPOULOU K, TRYFONOPOULOU E, AINDELIS G, et al. Biogenic selenium nanoparticles produced by Lactobacillus casei ATCC 393 inhibit colon cancer cell growth in vitro and in vivo[J]. Nanoscale Advances,2021,3(9):2516−2528. doi: 10.1039/D0NA00984A
[22] 梁金钟, 王翼雪, 梅剑秋. 植物乳杆菌富硒培养条件的优化[J]. 食品工业科技,2017,38(3):137−142. [LIANG J Z, WANG Y X, MEI J Q. Optimal condition for selenium-rich Lactobacillus plantarum cultivation[J]. Science and Technology of Food Industry,2017,38(3):137−142.] LIANG J Z, WANG Y X, MEI J Q. Optimal condition for selenium-rich Lactobacillus plantarum cultivation[J]. Science and Technology of Food Industry, 2017, 38(3): 137−142.
[23] BISWAS K C, BARTON L L, TSUI W L, et al. A novel method for the measurement of elemental selenium produced by bacterial reduction of selenite[J]. Journal of Microbiological Methods,2011,86(2):140−144. doi: 10.1016/j.mimet.2011.04.009
[24] XU Y, WU S F, HE J X, et al. Salt-induced osmotic stress stimulates selenium biotransformation in Lactobacillus rhamnosus ATCC 53103[J]. LWT,2020,131:109763. doi: 10.1016/j.lwt.2020.109763
[25] ZOMMARA M, OMRAN M, GHANIMAH M. Milk permeate medium for the production of selenium nanoparticles by lactic acid bacteria[J]. International Journal of Dairy Technology,2022,75(3):603−610. doi: 10.1111/1471-0307.12875
[26] ALAM H, KHATOON N, KHAN M A, et al. Synthesis of selenium nanoparticles using probiotic bacteria Lactobacillus acidophilus and their enhanced antimicrobial activity against resistant bacteria[J]. Journal of Cluster Science,2020,31(5):1003−1011. doi: 10.1007/s10876-019-01705-6
[27] VISHA P, NANJAPPAN K, SELVARAJ P, et al. Biosynthesis and structural characteristics of selenium nanoparticles using Lactobacillus acidophilus bacteria by wet sterilization process[J]. International Journal of Advanced Veterinary Science and Technology,2015,4(1):178−183. doi: 10.23953/cloud.ijavst.183
[28] KHOEI N S, LAMPIS S, ZONARO E, et al. Insights into selenite reduction and biogenesis of elemental selenium nanoparticles by two environmental isolates of Burkholderia fungorum[J]. New Biotechnology,2017,34:1−11. doi: 10.1016/j.nbt.2016.10.002
[29] AO B, DU Q Q, LIU D C, et al. A review on synthesis and antibacterial potential of bio-selenium nanoparticles in the food industry[J]. Front Microbiol,2023,14:1229838. doi: 10.3389/fmicb.2023.1229838
[30] 张羽竹, 王冰宜, 曾梓敖, 等. 植物乳杆菌还原形成不同粒径纳米硒的培养条件及其生物活性分析[J]. 食品科学,2020,41(22):119−126. [ZHANG Y Z, WANG B Y, ZENG Z A, et al. Effect of culture conditions on the formation of selenium nanoparticles with different particle sizes by microbial reduction using Lactobacillus plantarum and their bioactivity evaluation[J]. Food Science,2020,41(22):119−126.] doi: 10.7506/spkx1002-6630-20191013-098 ZHANG Y Z, WANG B Y, ZENG Z A, et al. Effect of culture conditions on the formation of selenium nanoparticles with different particle sizes by microbial reduction using Lactobacillus plantarum and their bioactivity evaluation[J]. Food Science, 2020, 41(22): 119−126. doi: 10.7506/spkx1002-6630-20191013-098
[31] KHIRALLA G M, EL-DEEB B A. Antimicrobial and antibiofilm effects of selenium nanoparticles on some foodborne pathogens[J]. LWT - Food Science and Technology,2015,63(2):1001−1007. doi: 10.1016/j.lwt.2015.03.086
[32] ESCOBAR-RAMÍREZ M C, CASTAÑEDA-OVANDO A, PÉREZ-ESCALANTE E, et al. Antimicrobial activity of Se-nanoparticles from bacterial biotransformation[J]. Fermentation (Basel),2021,7(3):130. doi: 10.3390/fermentation7030130





 下载:
下载:
 下载:
下载:



