Optimisation of Fermentation Process of Aqueous Extract of Sophora japonica and Analysis of Its Antioxidant Activity
-
摘要: 为筛选发酵改善槐花水提液口感的微生物,优化其发酵工艺,考察发酵对其抗氧化活性的影响。本研究利用微生物群单菌、混菌发酵技术,筛选改善槐花水提液口感的微生物,通过单因素结合Box-Benhnken响应面优化试验,确定槐花水提液最佳发酵工艺,并检测发酵前后抗氧化活性变化。结果表明,发酵改善槐花水提液口感的最佳菌种组合为瑞士乳杆菌:保加利亚乳杆菌:嗜热链球菌=1:1:1,最佳发酵工艺条件:发酵时间24 h、接菌量3%、发酵温度21 ℃,此条件下发酵液的感官评分79.01分,总黄酮浓度0.3225 mg/mL。发酵后槐花水提液对DPPH自由基的清除率由发酵前的86.5%降低到67.39%(P<0.001),对超氧阴离子自由基的清除率由发酵前的89.22%降低到81.10%(P<0.01)。发酵后槐花水提液的总黄酮含量(0.3225 mg/mL)较发酵前(0.3012 mg/mL)增加,多糖含量(1.14 mg/mL)较发酵前(1.43 mg/mL)显著减少(P<0.05)。本研究获得了口感改善效果较好的槐花水提液,可为今后槐花资源的深度开发利用及延长槐花产业链提供技术资料。Abstract: To screen the microorganisms used for fermentation to improve the taste of Sophora japonica aqueous extract, optimize its fermentation process, and investigate the effect of fermentation on antioxidant activity. In this study, microorganisms were screened to improve the taste of the aqueous extract of Sophora japonica by using microbiota single-bacteria and mixed-bacteria fermentation techniques, and the optimal fermentation process of Sophora japonica aqueous extract was determined by a one-way combination of Box-Benhnken response surface optimisation test, and changes in antioxidant activity before and after fermentation were detected. The results showed that the optimal bacterial combination for improving the taste of Sophora japonica aqueous extract through fermentation was Lactobacillus suis:Lactobacillus bulgaricus:Streptococcus thermophilus=1:1:1. The optimal fermentation process conditions were: fermentation time of 24 h, inoculation amount of 3%, fermentation temperature of 21 ℃. Under these conditions, the sensory score of the fermentation broth was 79.01 points, and the total flavonoid concentration was 0.3225 mg/mL. The scavenging rate of DPPH radicals by the aqueous extract of Sophora japonica decreased from 86.5% to 67.39% (P<0.001) before fermentation, and the scavenging rate of superoxide anion radicals decreased from 89.22% to 81.10% (P<0.01) before fermentation. The total flavonoid content of the aqueous extract of Sophora japonica increased (0.3225 mg/mL) after fermentation compared with that before fermentation (0.3012 mg/mL) , and the polysaccharide content (1.14 mg/mL) decreased significantly (P<0.05) compared with that before fermentation (1.43 mg/mL). This study obtained a aqueous extract of Sophora japonica with good taste improvement effect, which would provide technical data for the deep development and utilization of Sophora japonica resources and the extension of its industrial chain in the future.
-
Keywords:
- Sophora japonica /
- taste improvement /
- fermentation process /
- antioxidant activity
-
槐花(Sophora japonica L.)为豆科植物槐的干燥花及花蕾[1],性苦,微寒,归肝、大肠经,在我国各地普遍都有生长,在越南、日本及朝鲜也有分布[2]。槐花营养丰富,含黄酮类、多糖类等物质[3−4],具有抗炎[5]、抗肿瘤[6]、抗氧化[7]、抗糖化[8]等作用。
槐花作为一种传统药食两用中药,食用起来普遍存在苦、涩等问题,《神农本草经》《本草纲目》《中华本草》均指出槐花味苦,其苦、涩味会影响人们对槐花资源的开发利用。目前槐花在食品工业中的应用,多集中在保健饮料的开发方面,通过添加甜味剂(甜蜜素、阿巴斯甜、木糖醇等)改善槐花水提液口感,开发相关饮品[9]。若能改善槐花水提液口感,将极大促进槐花资源在食品领域的深度开发利用。
目前,改善食品苦涩味的方法主要有化学法、酶法、微生物发酵法,其中微生物发酵法具有降低中药毒副作用、节省药材资源、保护生态环境等优点[10]。中药发酵就是在适当的温度、湿度、水分等条件下,利用微生物对药物进行发酵改变药物的特性,增强或产生新的药效,扩大药物应用范围,改善中药口感,是中药的重要加工方法[11−13]。
近几年,对发酵槐花的研究主要集中在改善槐花关键香味化合物及其抗氧化活性等方面[14−15],相关发酵产品有槐花米酒、槐花茶酒、槐花精油[16−18]。本研究利用十种益生菌对槐花水提液进行发酵,筛选对槐花水提液口感改善效果较好的菌种,运用响应面法优化槐花水提液发酵的最佳工艺,分析发酵前后槐花水提液对DPPH、超氧阴离子自由基清除能力的影响,以期获得改善槐花口感的最佳发酵条件,可为今后槐花资源的深度开发利用及延长槐花产业链提供技术资料。
1. 材料与方法
1.1 材料与仪器
槐花药材 安徽庆春堂药业有限公司;实验菌种 米曲霉、黑曲霉、酿酒酵母、枯草芽孢杆菌、戊糖乳杆菌、瑞士乳杆菌、植物乳杆菌、保加利亚乳杆菌、嗜酸乳杆菌、嗜热链球菌 均为冻干菌种,购于中国工业微生物菌种保藏管理中心;芦丁标准品 贵州迪大科技有限公司;无水乙醇 天津市富宇精细化工有限公司;95%乙醇 重庆万盛川东化工有限公司;硝酸铝 天津市科密欧化学试剂有限公司;氢氧化钠 广东汕头市西陇化工厂;葡萄糖标准品 北京索莱宝科技有限公司;浓硫酸 重庆川东化工有限公司;甲醇 天津市富宇精细化工有限公司;苯酚 成都市科龙化工试剂厂;亚硝酸钠 重庆江川(集团)有限公司;ELISA Kit 酶联免疫检测试剂 南京博研生物科技有限公司。
UV-2700紫外分光光度计 岛津实验器材有限公司;MOD-B3R低温大容量摇床 上海旻泉仪器有限公司;UPT-1-20T纯水机 力辰科技有限公司;JJ224BF电子分析天平 常熟市双杰测试仪器厂;SW-CJ-2FD超净工作台 苏州安泰空气技术有限公司;LRH-250生物培养箱 上海一恒科学仪器有限公司;D2M-80L-11高压灭菌锅 上海申安医疗器械厂;Sorvall ST 40R离心机 美国赛默飞世尔科技公司;Aynergy2酶标仪 成都百乐科技有限公司。
1.2 实验方法
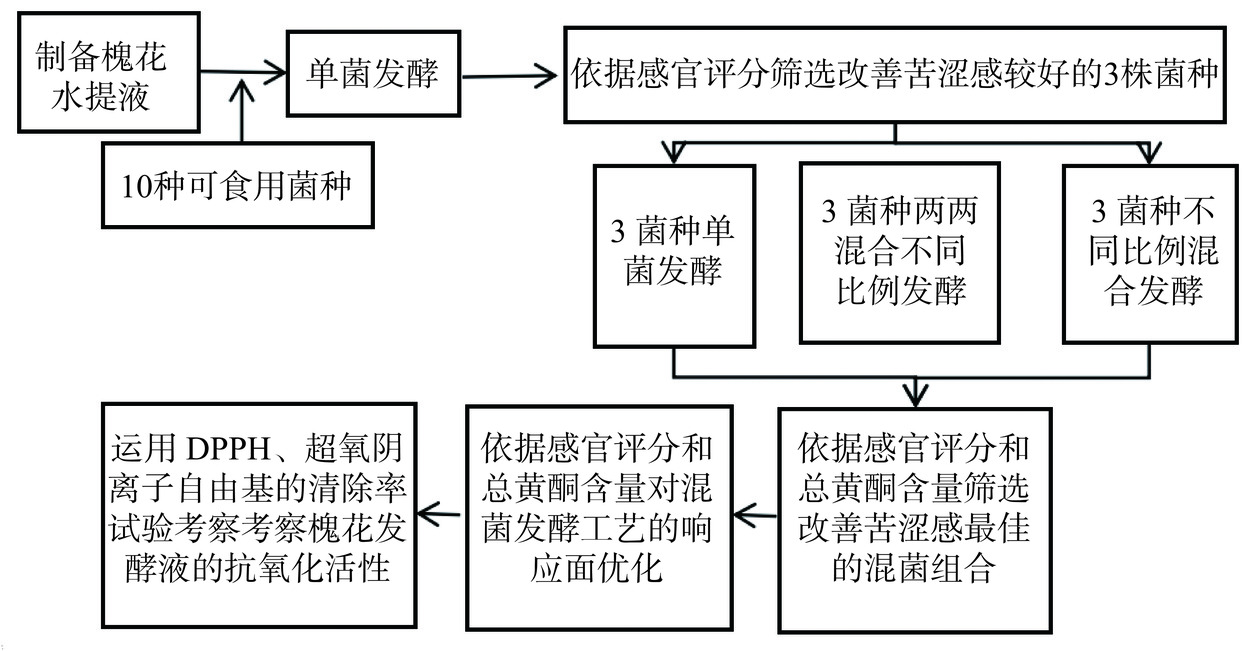
1.2.1 工艺流程
改善槐花口感的发酵工艺及抗氧化活性研究路线见图1。
1.2.2 槐花水提液的制备
称取所购买的槐花100 g,用适量自来水浸润后,再加入十倍量的自来水煎煮1 h,然后用纱布过滤后加入八倍量水,再煎煮1 h过滤,将2次水煎液合并浓缩成料液比为1:10的水提液。将槐花水提液转移至三角瓶,121 ℃高压灭菌30 min。
1.2.3 槐花水提液的单菌发酵
参照孙葳[19]方法,活化处理试验菌种,制备成可用于发酵的菌悬液。将十种益生菌(米曲霉、黑曲霉、酿酒酵母、枯草芽孢杆菌、戊糖乳杆菌、瑞士乳杆菌、植物乳杆菌、保加利亚乳杆菌、嗜酸乳杆菌、嗜热链球菌)分别接入槐花水提液中,在转速200 r/min,25 ℃以及自然pH下培养24 h。
1.2.4 槐花发酵液的感官评价
感官评价标准参考洋槐花酱的感官方法[20],根据槐花特性略有改动。感官评价小组由食品质量与安全专业10名学生及老师(5男5女)组成,对评价人员进行感官分析理论、识别感官特性和气味等感官描述性培训,同时要求其在感官评价前应避免吸烟、吃口香糖等行为,以减少感官评定的误差,分别对槐花发酵液的口感、质地、气味进行评分,满分为100分,具体感官评分指标见表1。
表 1 发酵槐花水提液感官评分标准Table 1. Sensory scoring criteria of fermented Sophora japonica aqueous extracts评分项目 评分标准 分数(100) 口感(0~50) 口感细腻,苦涩味改变或少许苦涩味,
入口无不适反应40~50 口感细腻,苦涩味明显,入口无不适反应 20~40 口感粗糙,难以下咽,入口有不适反应 0~20 质地(0~15) 均匀,无沉淀 10~15 不均匀,有少量沉淀 5~10 不均匀,有大量沉淀 0~5 气味(0~35) 槐花味浓郁伴随发酵香气,闻之无不适反应 20~35 槐花气味清淡,闻之无不适反应 10~20 无槐花气味,有大量异味,闻之有不适反应 0~10 1.2.5 槐花水提液的混菌发酵
1.2.5.1 不同菌种拮抗试验
采用滤纸片抑菌圈法[21]:取瑞士乳杆菌种子液100 µL涂布于MRS培养基表面。将两片无菌小滤纸贴在培养基表面,分别吸取2.5 µL嗜热链球菌与保加利亚乳杆菌的种子液滴在两个滤纸片上,37 ℃恒温培养24 h,观察是否出现拮抗反应。
1.2.5.2 混菌发酵
选取单菌发酵中口感较好的菌种,在接菌量4%、转速200 r/min、温度25 ℃及自然pH条件下,培养24 h。接菌比例参考刺五加-五味子的混菌发酵比例[22],略有改动,具体接菌比例见表2。
表 2 混菌发酵比例Table 2. Sterilization ratio编号 混合菌种 接菌比例(4%) 1 瑞士乳杆菌:嗜热链球菌 1:3 2 瑞士乳杆菌:嗜热链球菌 2:2 3 瑞士乳杆菌:嗜热链球菌 3:1 4 瑞士乳杆菌:保加利亚乳杆菌 1:3 5 瑞士乳杆菌:保加利亚乳杆菌 2:2 6 瑞士乳杆菌:保加利亚乳杆菌 3:1 7 嗜热链球菌:保加利亚乳杆菌 1:3 8 嗜热链球菌:保加利亚乳杆菌 2:2 9 嗜热链球菌:保加利亚乳杆菌 3:1 10 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 2:1:1 11 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 1:2:1 12 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 1:1:2 13 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 1:1:1 14 瑞士乳杆菌 4 15 保加利亚乳杆菌 4 16 嗜热链球菌 4 17 (不接菌)空白对照 0 1.2.6 总黄酮及多糖的含量测定
1.2.6.1 总黄酮标准曲线的绘制
称取10 mg的芦丁标准品,用50%乙醇水溶液定容至50 mL,摇匀,可得到浓度为0.2 mg/mL的芦丁标准贮备液。参考文献[23]的方法进行线性范围和回归方程的考察,具体过程如下:采用硝酸铝显色法,以芦丁为对照品,在430~600 nm波长范围内测定吸光度,在510.18 nm处有最大吸收波长,选用510 nm为测定波长。以吸光度值为纵坐标(A),以对照品浓度为横坐标(C)绘制标准曲线。得线性回归方程为A=2.3841C−0.0322,R2=0.9996。结果表明,芦丁浓度在0.05~0.4 mg/mL之间有良好线性关系。
1.2.6.2 总黄酮含量测定
参考文献[24]的方法取样品溶液0.28 mL,按1.2.6.1方法处理,以空白试剂为对照,于510 nm下进行检测,得到样品吸光度,代入回归方程中得到槐花发酵液总黄酮浓度。
1.2.6.3 多糖标准曲线的绘制
参考文献[25]的方法称取葡萄糖标品4 mg,溶解并定容至50 mL,配制成0.08 mg/mL的溶液。分别移取0.1、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准品溶液于试管中,加1 mL 5%苯酚溶液、5 mL浓硫酸溶液,沸水浴5 min,用紫外-可见分光光度仪在490 nm处检测样品的吸光度,横坐标为葡萄糖浓度(C),纵坐标为吸光度(A),绘制葡萄糖标准曲线,得回归方程为A=1.11C−0.8119,R2=0.9992。
1.2.6.4 多糖含量测定
将槐花水提液以4000 r/min离心10 min后,取上清液加无水乙醇8 mL,放置24 h,4000 r/min离心10 min,弃上清液,加80%乙醇溶液10 mL,洗涤,4000 r/min离心10 min,加水溶解沉淀,将其转移至25 mL容量瓶中并定容。按1.2.6.3方法处理,以空白试剂为对照,于490 nm下进行检测,得到样品吸光度,代入回归方程得到槐花水提液多糖浓度。
1.2.7 槐花水提液发酵的单因素实验
1.2.7.1 考察发酵温度对槐花水提液的影响
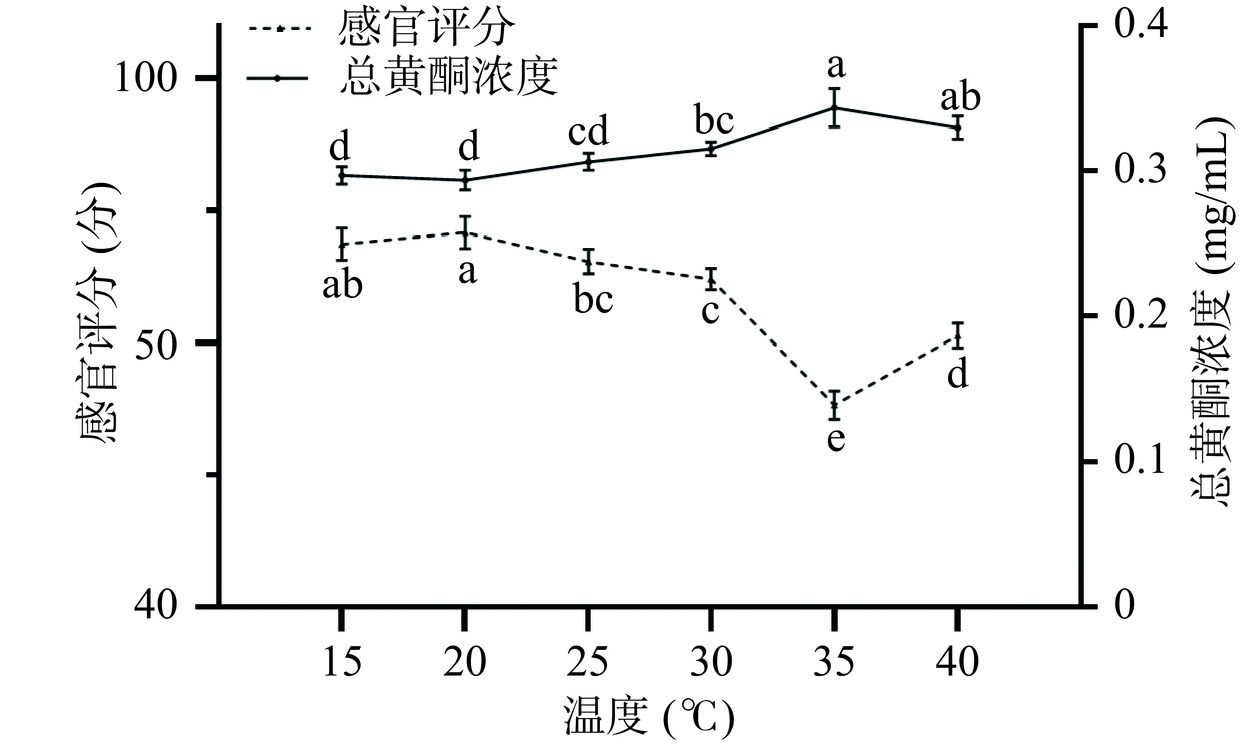
在接菌量4%、发酵时间24 h的条件下,考察不同发酵温度(15、20、25、30、35、40 ℃)对槐花水提液感官评分及总黄酮浓度的影响。
1.2.7.2 考察接菌量对槐花水提液的影响
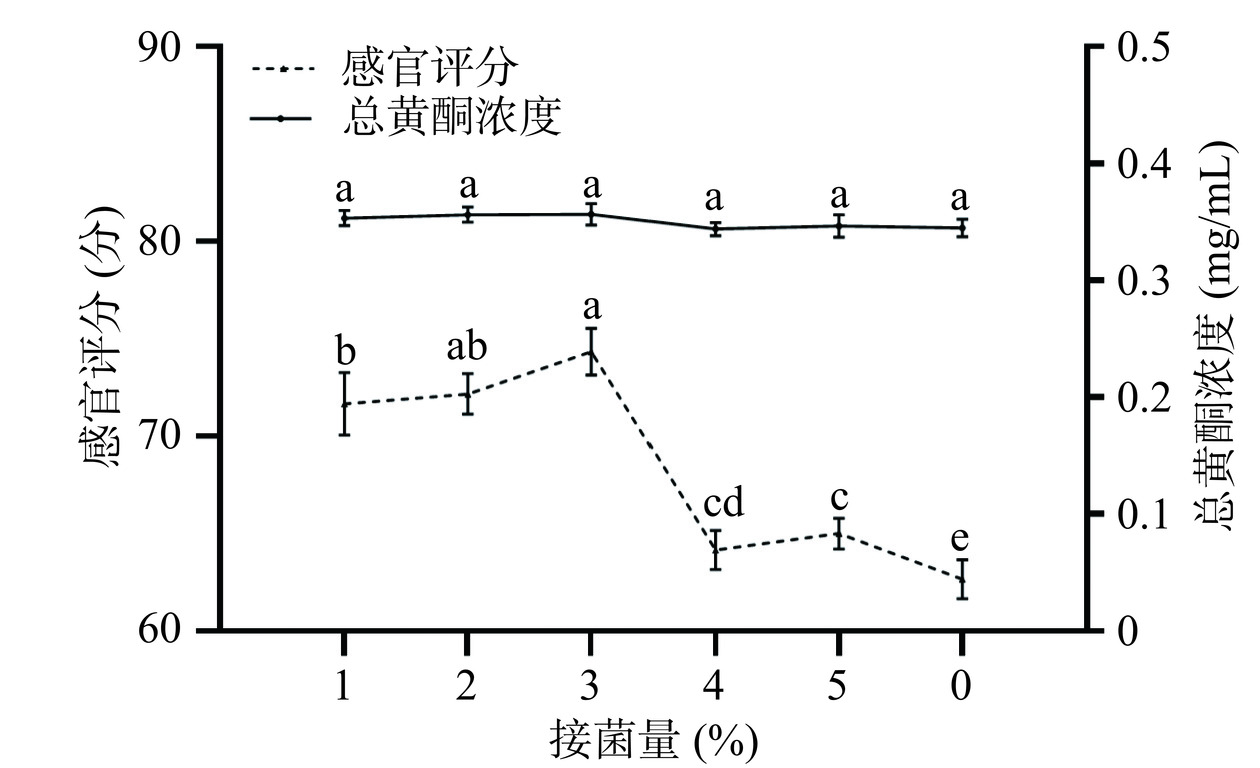
在发酵温度25 ℃、发酵时间24 h的条件下,考察不同接菌量(1%、2%、3%、4%、5%)对槐花水提液感官评分及总黄酮浓度的影响。
1.2.7.3 考察发酵时间对槐花水提液的影响
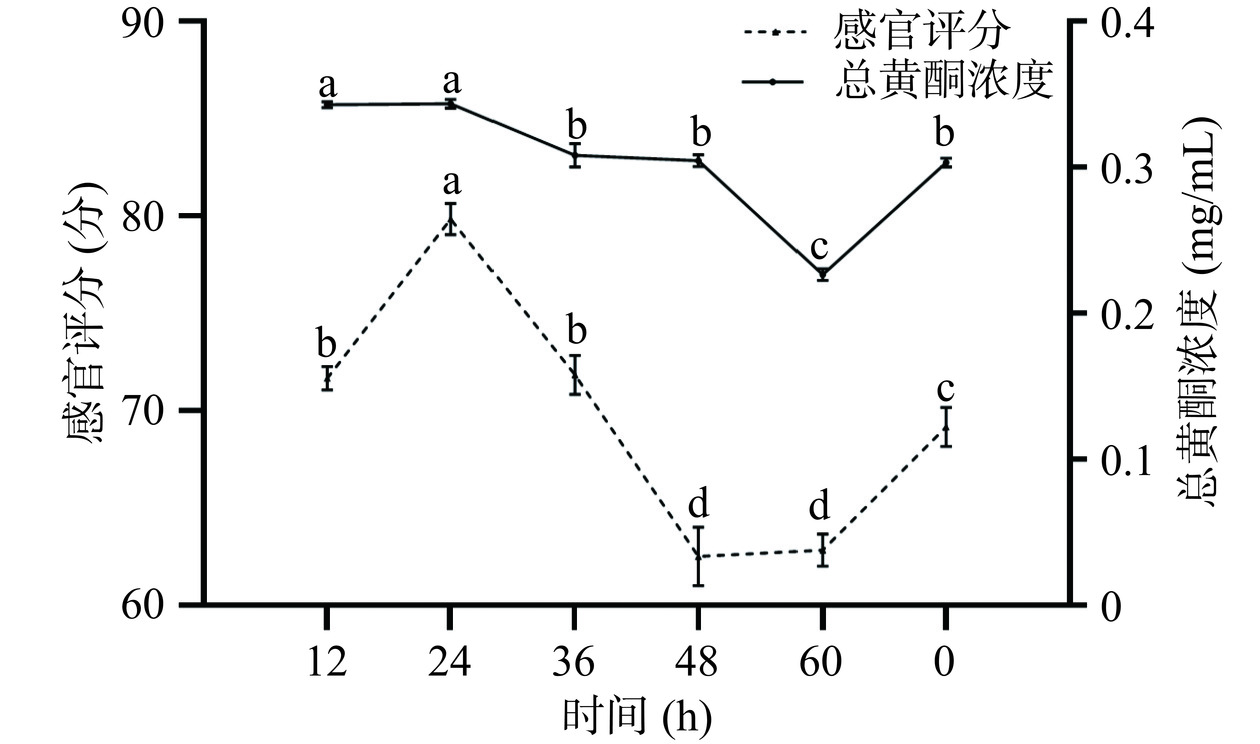
在发酵温度25 ℃、接菌量4%的条件下,考察不同发酵时间(12、24、36、48、60 h)对槐花水提液感官评分及总黄酮浓度的影响。
1.2.8 槐花水提液发酵的响应面优化试验
根据单因素实验结果,选取发酵温度、发酵时间和接菌量三个因素,进行三因素三水平试验设计,见表3。利用Box-Behnken 进行响应面优化试验设计。
表 3 响应面分析因素与水平Table 3. Factors and levels of response surface analysis
因素水平 −1 0 1 A发酵温度(℃) 15 20 25 B接菌量(%) 2 3 4 C发酵时间(h) 12 24 36 1.2.9 槐花发酵液的抗氧化活性分析
1.2.9.1 清除DPPH自由基能力的测定
将发酵前与发酵后的槐花水提液在4500 r/min下离心10 min,取上清液,按照ELISA Kit 酶联免疫检测试剂盒-DPPH自由基清除能力说明书进行操作。DPPH自由基清除率的计算公式为:
式中:A测定表示测定管的吸光度;A对照表示对照管的吸光度;A空白表示空白管的吸光度。
1.2.9.2 清除超氧阴离子自由基能力的测定
将发酵前与发酵后的槐花水提液在4500 r/min下离心10 min,取上清液按照ELISA Kit 酶联免疫检测试剂盒-超氧阴离子自由基清除能力说明书进行操作。超氧阴离子清除率的计算公式为:
式中:A测定表示测定管的吸光度;A对照表示对照管的吸光度;A空白表示空白管的吸光度。
1.3 数据处理
本实验中的实验数据均以平均值±标准差表示。采用SPSS22、GraphPad Prism 8和Design-Expert 12 软件进行分析和绘图,对结果进行二次多元回归拟合和方差分析。采用one-way ANOVA 进行单因素分析,以P<0.05为显著性差异。
2. 结果与分析
2.1 筛选发酵菌种
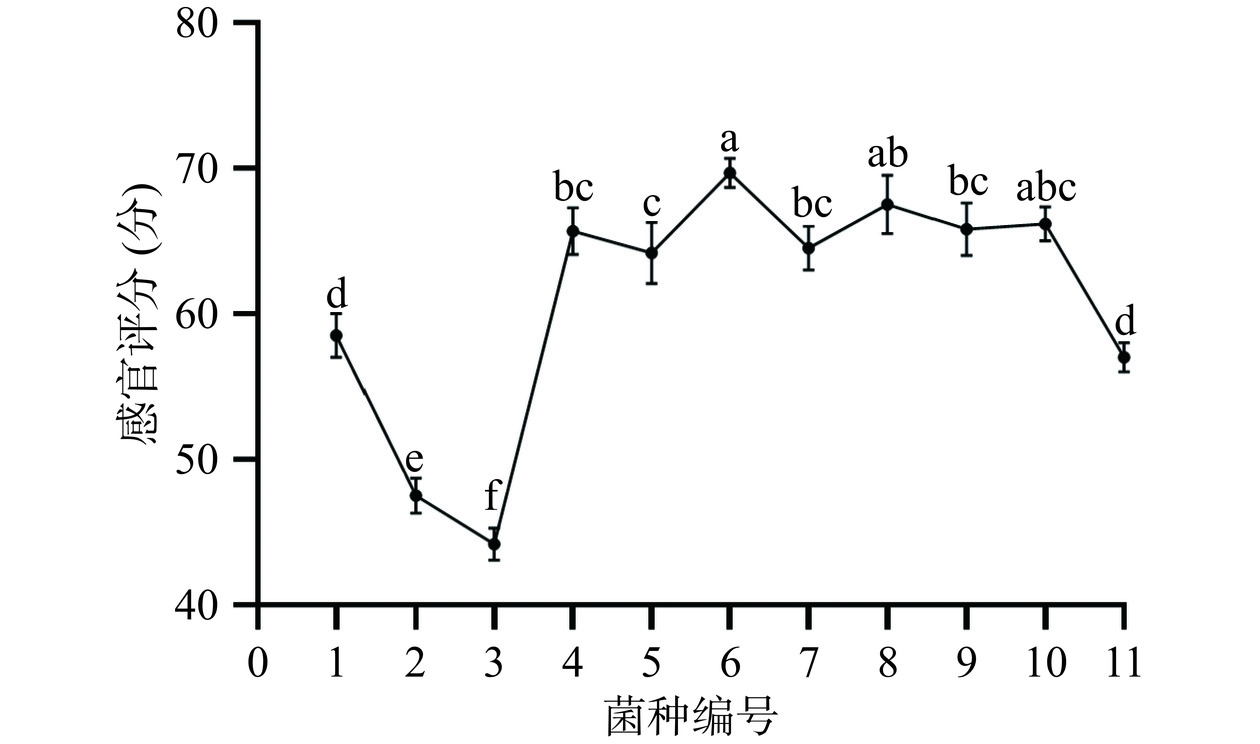
2.1.1 单菌发酵实验
由图2可知,不同菌种发酵对槐花水提液的感官评分影响显著(P<0.05),经瑞士乳杆菌、保加利亚乳杆菌与嗜热链球菌发酵的槐花水提液感官评分相对较高。前人研究也指出,瑞士乳杆菌、保加利亚乳杆菌与嗜热链球菌对改善食品风味有显著作用[26−27],因此本研究选取这三个菌种进行混菌发酵试验。
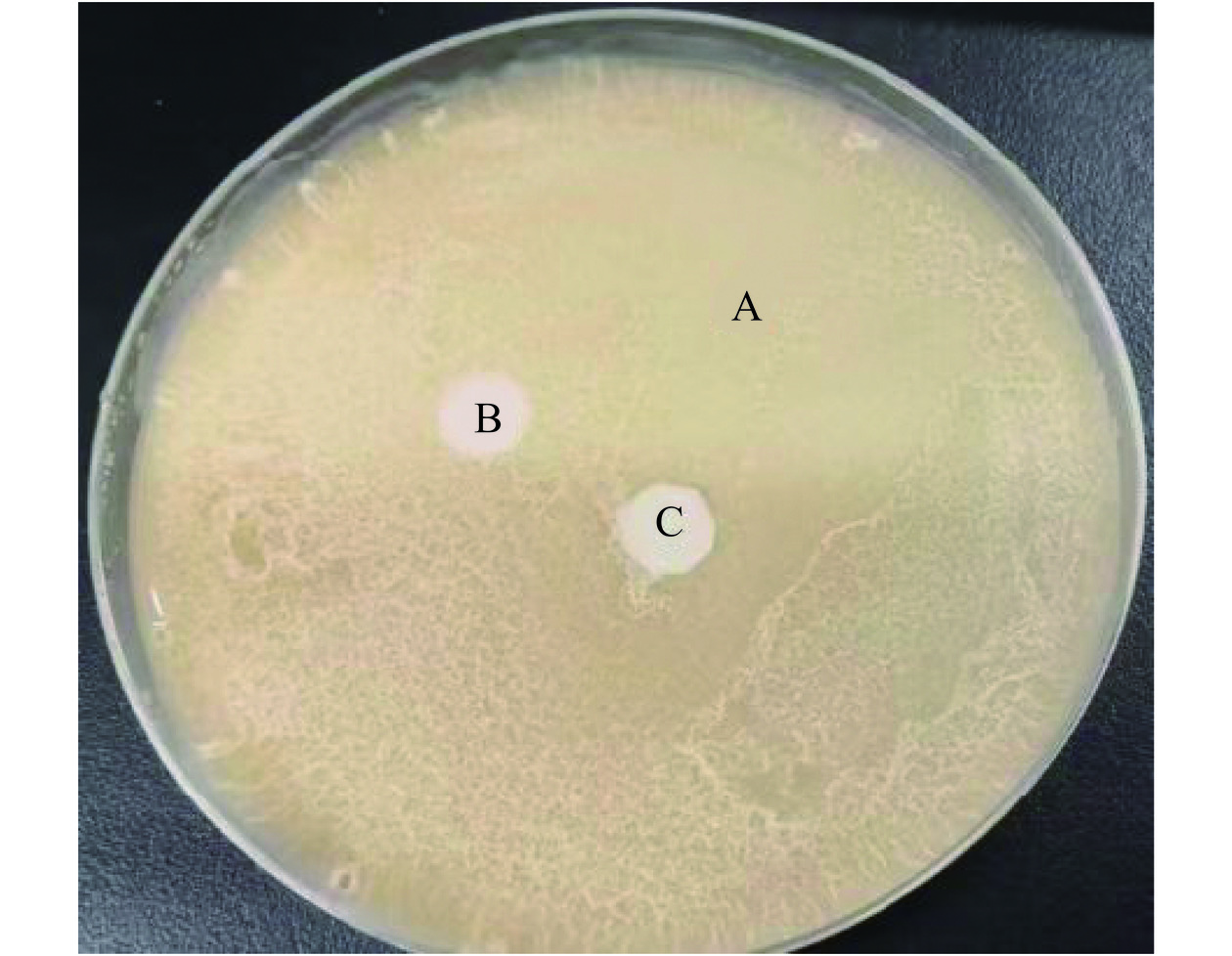
2.1.2 三菌种拮抗试验
由图3可知,瑞士乳杆菌、保加利亚乳杆菌与嗜热链球菌共培养未出现抑菌圈,前人研究也指出,三菌可进行混菌发酵[28−29]。说明三菌混合培养后不会影响彼此的生长和繁殖,可用于发酵槐花水提液。
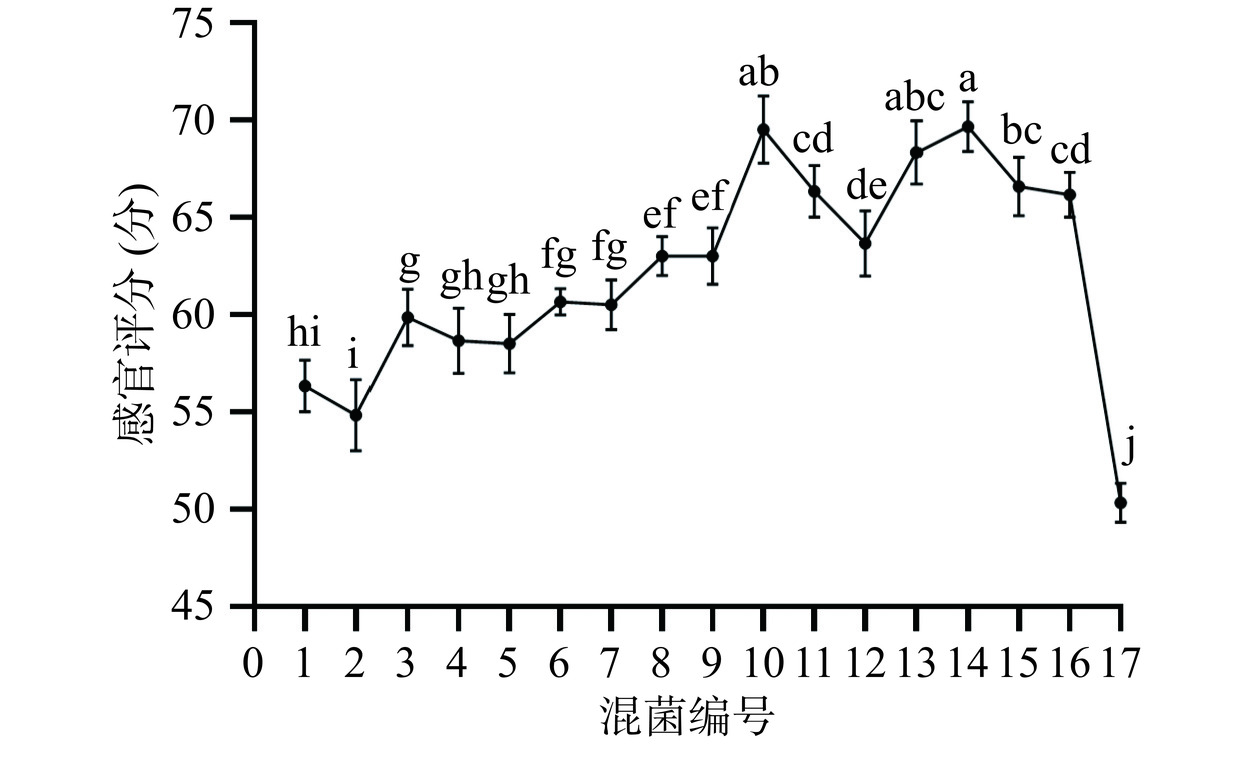
2.1.3 混菌筛选
瑞士乳杆菌、嗜热链球菌与保加利亚乳杆菌按表2比例进行混菌发酵,依据感官评分筛选出前3的混菌组合。由图4可知,瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌(2:1:1)、瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌(1:1:1)、瑞士乳杆菌三组混菌组合发酵对槐花水提液口感改善效果较好。由于三组感官评分差别不大,再分别检测三组混菌组合发酵后总黄酮含量(表4)。
表 4 混菌发酵液总黄酮含量Table 4. Total flavonoids content of mixed bacterial fermentation solution指标 空白对照 瑞士乳杆菌:嗜热链球菌:
保加利亚乳杆菌(2:1:1)瑞士乳杆菌:嗜热链球菌:
保加利亚乳杆菌(1:1:1)瑞士乳杆菌 总黄酮浓度
(mg/mL)0.3054±0.0093b 0.2928±0.0113c 0.3174±0.0108a 0.2748±0.0073d 注:不同小写字母表示组间差异显著(P<0.05)。 由表4可知,当瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌=1:1:1时,槐花水提液总黄酮含量较高。因此选择瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌(1:1:1)为发酵槐花水提液最佳混菌组合。
2.2 单因素实验结果
2.2.1 发酵温度对槐花水提液感官评分及总黄酮浓度的影响
由图5可知,随着发酵温度升高,感官评分先增加后减少,当温度为20 ℃时,感官评分最高为70.5分。总黄酮浓度随着发酵温度升高逐渐升高,在35 ℃时达到最大为0.34 mg/mL,但其感官评分最低。当发酵温度从15 ℃上升到20 ℃时,总黄酮浓度变化不大,感官评分上升可能是因为发酵产生了一些风味物质。当发酵温度从20 ℃上升到35 ℃时,总黄酮浓度逐渐上升,感官评分下降可能因为黄酮类化合物的含量与苦味有一定相关性[30],总黄酮浓度升高后,导致感官评分降低。综合考虑发酵温度选择在15、20、25 ℃进行响应面试验。
2.2.2 接菌量对槐花水提液感官评分及总黄酮浓度的影响
由图6可知,总黄酮浓度随着接菌量的增加变化不大。但随着接菌量的增加,感官评分有所下降,当接菌量为3%时,感官评分最高为72.33分。当接菌量从1%增加到3%时,感官评分上升可能是因为接菌量的增加导致槐花水提液发酵更加充分。当接菌量从3%增加到5%时,感官评分下降可能是因为接菌量超过3%以后,大量的细菌对营养和生存空间的竞争也越大,这种竞争使细菌生长和繁殖的速度减慢[31],导致槐花水提液发酵不充分。最终确定接菌量选择在2%、3%、4%进行响应面试验。
2.2.3 发酵时间对槐花水提液感官评分及总黄酮浓度的影响
从图7中可知,随着发酵时间的增加,感官评分先升高后下降,当发酵时间为24 h时,感官评分最高为79.83分。当发酵时间从12 h增加到24 h时,总黄酮浓度变化不大,感官评分逐渐上升可能是因为在发酵的初期,随着发酵时间的延长,发酵液中的风味物质在混菌的发酵作用下不断产生,感官评分逐渐升高。当发酵时间从24 h增加到60 h时,总黄酮浓度逐渐下降,感官评分也逐渐下降,可能是因为发酵时间过长时,混菌的代谢产物大量积累,影响了产品质量,导致感官评分下降[32]。综合考虑发酵时间选择在12、24、36 h进行响应面试验。
2.3 响应面法优化发酵条件
2.3.1 响应面试验设计与结果分析
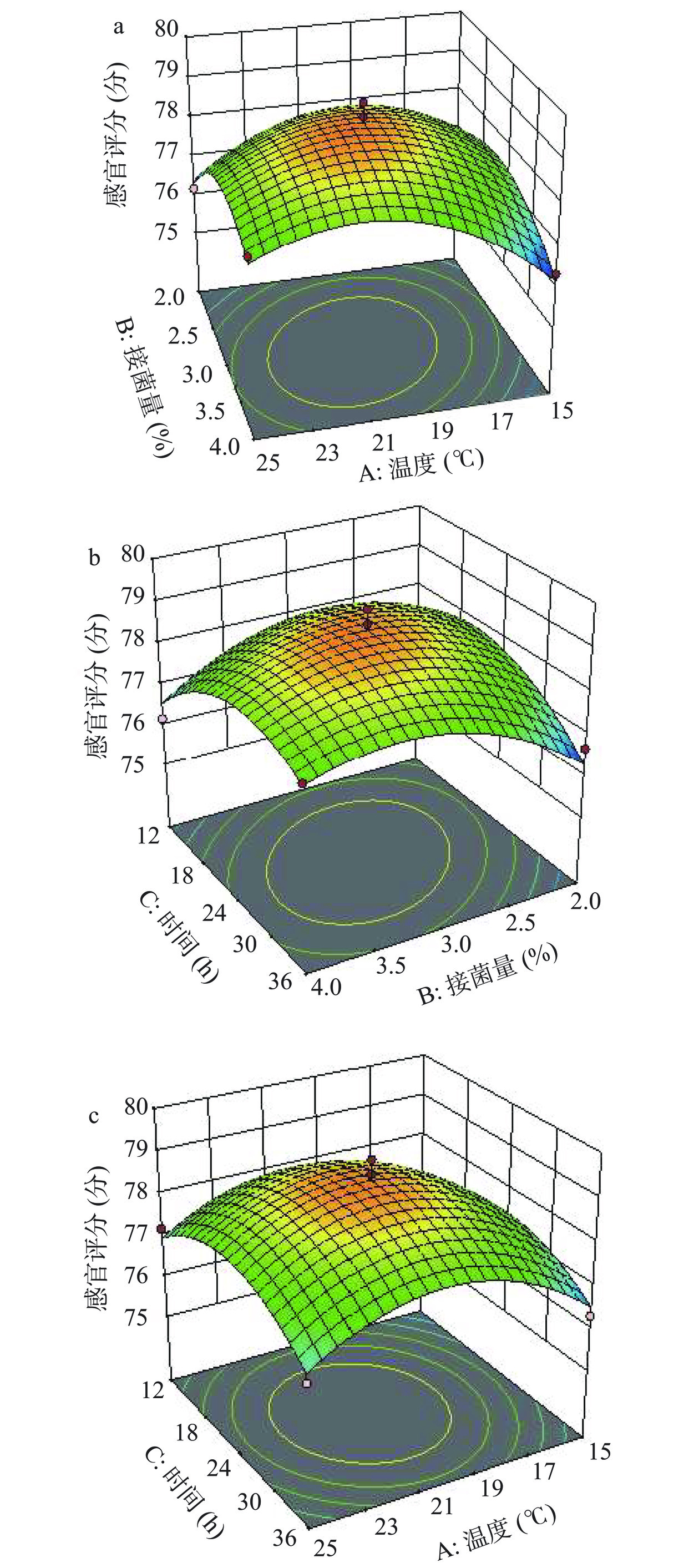
在单因素实验的基础上,选取温度、接菌量、时间3个因素作为变量进行响应面分析,经Box-Behnken响应面法设计,共有17个试验点,总黄酮含量和感官评分为响应值,结果见表5。
表 5 Box-Benhnken试验设计与结果Table 5. Design and results of Box-Benhnken experimental实验号 A:温度(℃) B:接菌量(%) C:时间(h) 感官评分
(分)总黄酮含量(mg/mL) 1 25 3 36 76.67±1.34 0.3026±0.0137 2 20 3 24 79.33±1.87 0.3189±0.0086 3 20 3 24 79.00±1.56 0.3275±0.0154 4 25 4 24 77.67±1.47 0.3046±0.0148 5 15 4 24 76.33±2.21 0.3056±0.0144 6 20 4 12 76.17±1.72 0.3060±0.0119 7 15 3 12 76.67±1.52 0.3035±0.0172 8 20 4 36 77.70±1.39 0.3097±0.0129 9 25 3 12 77.17±1.58 0.3080±0.0069 10 20 3 24 78.33±1.21 0.3173±0.0172 11 20 2 12 77.33±1.89 0.3081±0.0193 12 20 2 36 76.67±2.01 0.3049±0.0136 13 20 3 24 78.67±2.41 0.3277±0.0106 14 15 3 36 76.30±1.38 0.3033±0.0113 15 15 2 24 76.67±1.69 0.3060±0.0163 16 25 2 24 76.17±1.73 0.3027±0.0128 17 20 3 24 79.00±1.49 0.3202±0.0157 依据Design-expert 12.0软件对槐花发酵液的感官评分和总黄酮含量进行回归拟合,得到回归方程:感官评分=78.87+0.2138A+0.1288B+0.4600AB−0.0325AC+0.5475BC−1.210A2−0.9455B2−0.9530C2,总黄酮含量=0.3223+0.0005B−0.0006C+0.0006AB−0.0013AC+0.0017BC−0.0102A2−0.0074B2−0.0078C2。
对二次回归方程预测模型进行显著性检验,得感官评分的方差分析结果见表6。感官评分回归模型[33]P值<0.01,模型的相关性极显著,并且方程失拟项P值为0.3758,呈不显著(P>0.05),由此证明,该模型可以用来反应感官评分与影响因素之间的关系,实验方法可靠。由F值可知,各因素对感官评分影响强度顺序为:A>B>C。两因素相互作用对槐花发酵液感官评分的影响:BC>AB>AC。A、B、C的平方项具有极显著性(P<0.01)。说明该回归模型可以用于优化槐花发酵液的理论预测。
表 6 感官评分响应面试验方差分析Table 6. Analysis of variance of sensory scoring response surface test方差源 平方和 自由度 均方 F值 P值 显著性 模型 17.89 9 1.99 11.96 0.0018 ** A-温度 0.3655 1 0.3655 2.20 0.1817 B-接菌量 0.1326 1 0.1326 0.7978 0.4014 C-时间 0.0000 1 0.0000 0.0000 1.0000 AB 0.8464 1 0.8464 5.09 0.0586 AC 0.0042 1 0.0042 0.0254 0.8778 BC 1.20 1 1.20 7.21 0.0313 * A² 6.17 1 6.17 37.12 0.0005 ** B² 3.76 1 3.76 22.65 0.0021 ** C² 3.82 1 3.82 23.01 0.0020 ** 残差 1.16 7 0.1662 失拟项 0.5866 3 0.1955 1.36 0.3758 纯误差 0.5769 4 0.1442 总和 19.06 16 注:*为差异显著(P<0.05),**为差异极显著(P<0.01)。 总黄酮含量的方差分析结果见表7,模型的P值为0.0073(<0.01),说明该模型显著性良好,失拟值P值为0.9076(>0.05),失拟不显著,即说明其他因素对感官评分影响小。由F值可知,对槐花发酵液总黄酮含量的影响程度:C>B>A;两因素相互作用对槐花发酵液总黄酮含量的影响:BC>AC>AB,A、B、C的平方项具有极显著性(P<0.01)。说明该回归模型可以用于优化槐花发酵液的理论预测。
表 7 总黄酮含量响应面试验方差分析Table 7. Analysis of variance of total flavonoid content response surface test方差源 平方和 自由度 均方 F值 P值 显著性 模型 0.0011 9 0.0001 7.51 0.0073 ** A-温度 1.805×10−8 1 1.805×10−8 0.0012 0.9738 B-接菌量 2.301×10−6 1 2.301×10−6 0.1471 0.7127 C-时间 3.163×10−6 1 3.163×10−6 0.2023 0.6665 AB 1.311×10−6 1 1.311×10−6 0.0838 0.7805 AC 6.734×10−6 1 6.734×10−6 0.4307 0.5326 BC 0.0000 1 0.0000 0.7701 0.4093 A² 0.0004 1 0.0004 28.19 0.0011 ** B² 0.0002 1 0.0002 14.72 0.0064 ** C² 0.0003 1 0.0003 16.27 0.0050 ** 残差 0.0001 7 0.0000 失拟项 0.0000 3 4.249×10−6 0.1757 0.9076 纯误差 0.0001 4 0.0000 总和 0.0012 16 注:**为差异极显著(P<0.01)。 2.3.2 响应曲面分析
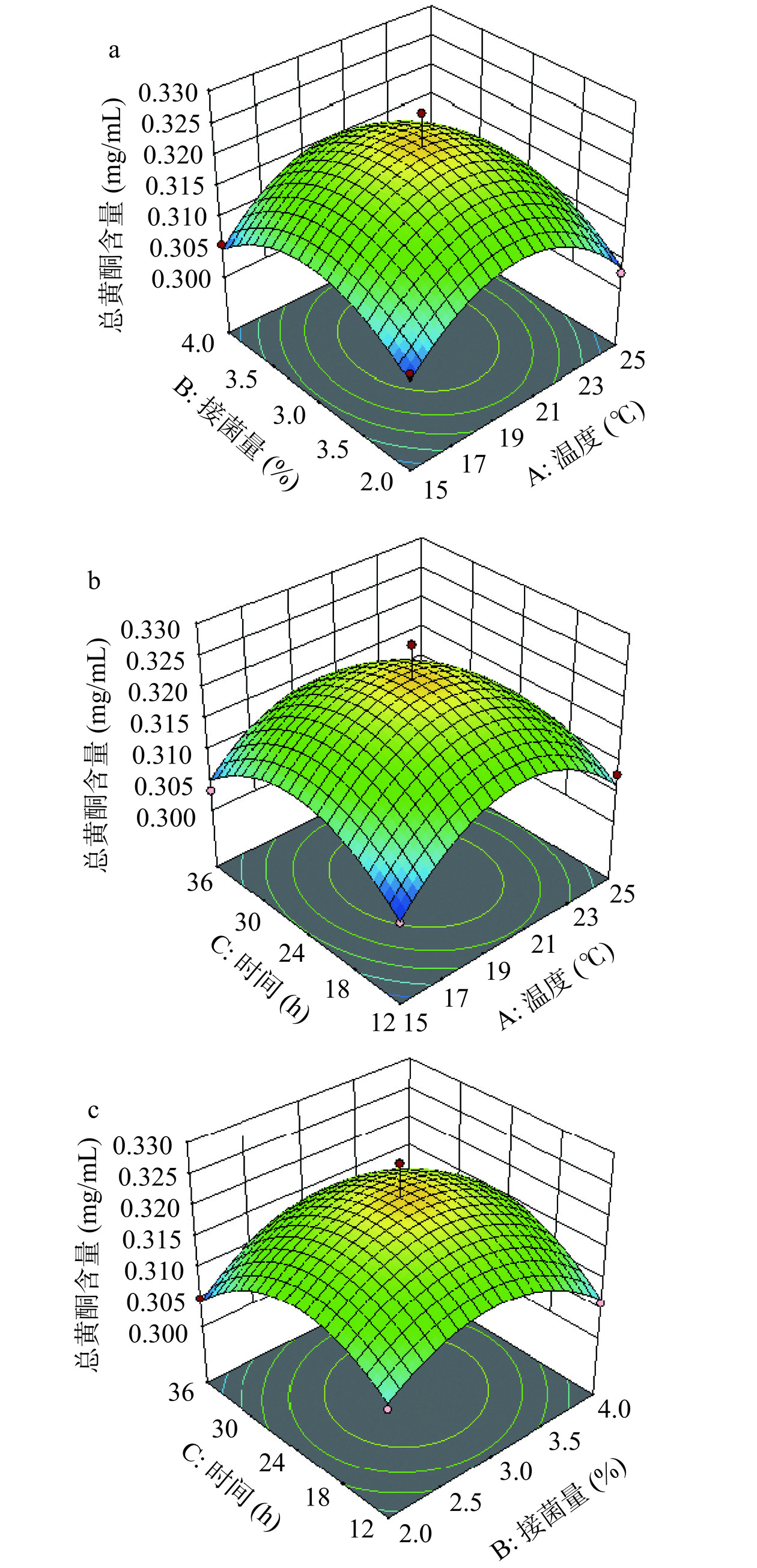
从响应面图中可以看出,曲面越陡峭,影响因素的变化对响应值的影响也越大[34]。由图8、图9可知,在本研究所选择的范围内,各影响因素之间的交互作用对槐花发酵液的感官评分及总黄酮含量的影响相似,感官评分与总黄酮含量均随着各影响因素的增加呈先增后降的趋势,响应面图存在最大值。
2.3.3 验证试验
经Design-expert 12.0软件对回归方程的预测分析,得槐花水提液的最佳发酵工艺条件为:发酵时间24.33 h、发酵温度20.54 ℃、接菌量3.10%,理论预测感官评分、总黄酮浓度分别为78.88 分、0.322 mg/mL。结合工业生产实际情况,确定槐花水提液最佳发酵条件为:发酵时间24 h,发酵温度21 ℃,接菌量3%。以确定的最佳发酵工艺进行3次验证性试验,结果见表8。
表 8 响应面验证试验结果Table 8. Response surface verification experiment项目 感官评分(分) 总黄酮浓度(mg/mL) 第一组 79.70 0.3207 第二组 78.33 0.3230 第三组 79.00 0.3239 平均值 79.01 0.3225 由表8可知,三组的感官评分平均值为79.01分,与预测值相差不大,相对误差为0.16%。三组总黄酮含量的平均浓度为0.3225 mg/mL,与理论分析结果0.322 mg/mL近似。综上可得,说明Box-Behnken响应面分析软件建立的模型准确可靠。
2.4 槐花水提取液发酵前后抗氧化活性及活性成分变化
2.4.1 槐花水提取液发酵前后的抗氧化活性分析
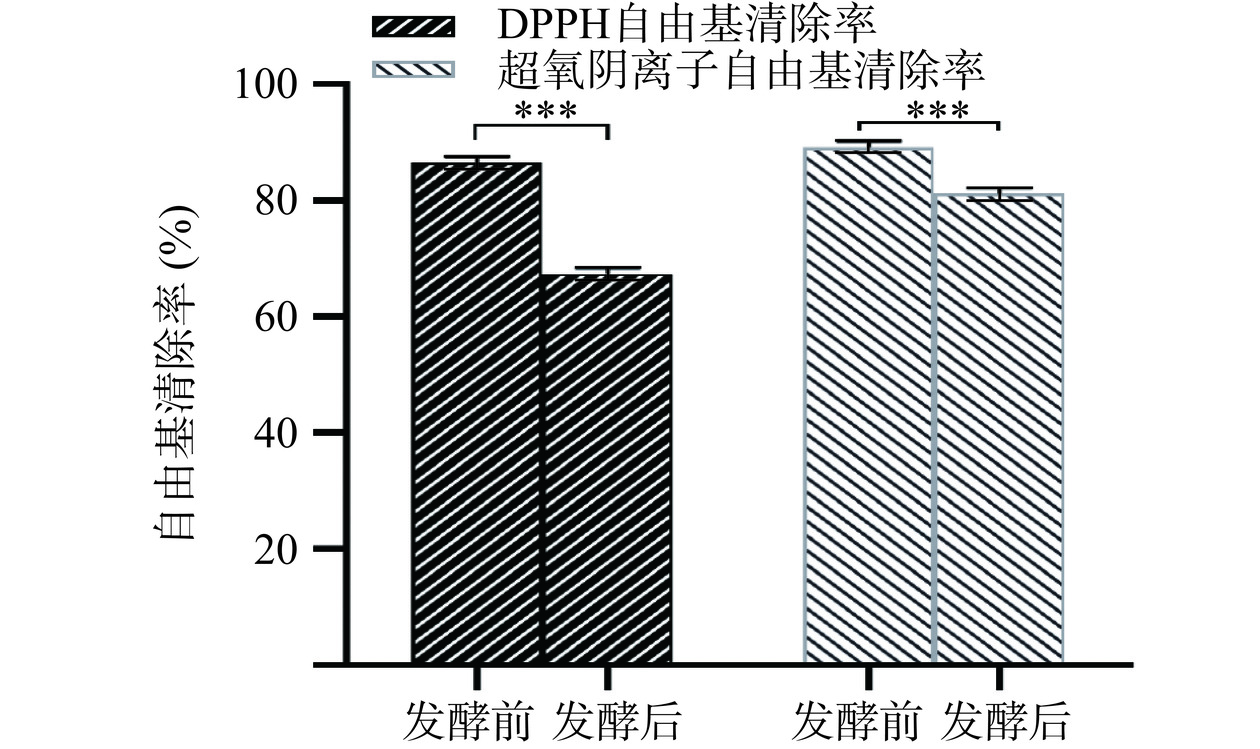
从图10可知,发酵前的槐花水提液对DPPH自由基的清除率为86.5%,发酵后的清除率为67.39%,对DPPH自由基的清除作用降低了19.11%(P<0.001)。发酵前的槐花水提液对超氧阴离子自由基的清除率为89.22%,发酵后的清除率为81.1%,对超氧阴离子自由基的清除作用降低了8.12%(P<0.01)。
研究表明,黄酮和多糖类成分与槐花抗氧化活性密切相关[35−36],微生物发酵能改变黄酮和多糖的含量,主要是由于大分子物质消耗降解,小分子物质间的相互转化频繁。综合分析,槐花水提液发酵后抗氧化活性的降低主要与黄酮和多糖类成分的含量变化有关。
2.4.2 槐花水提液发酵前后活性成分分析
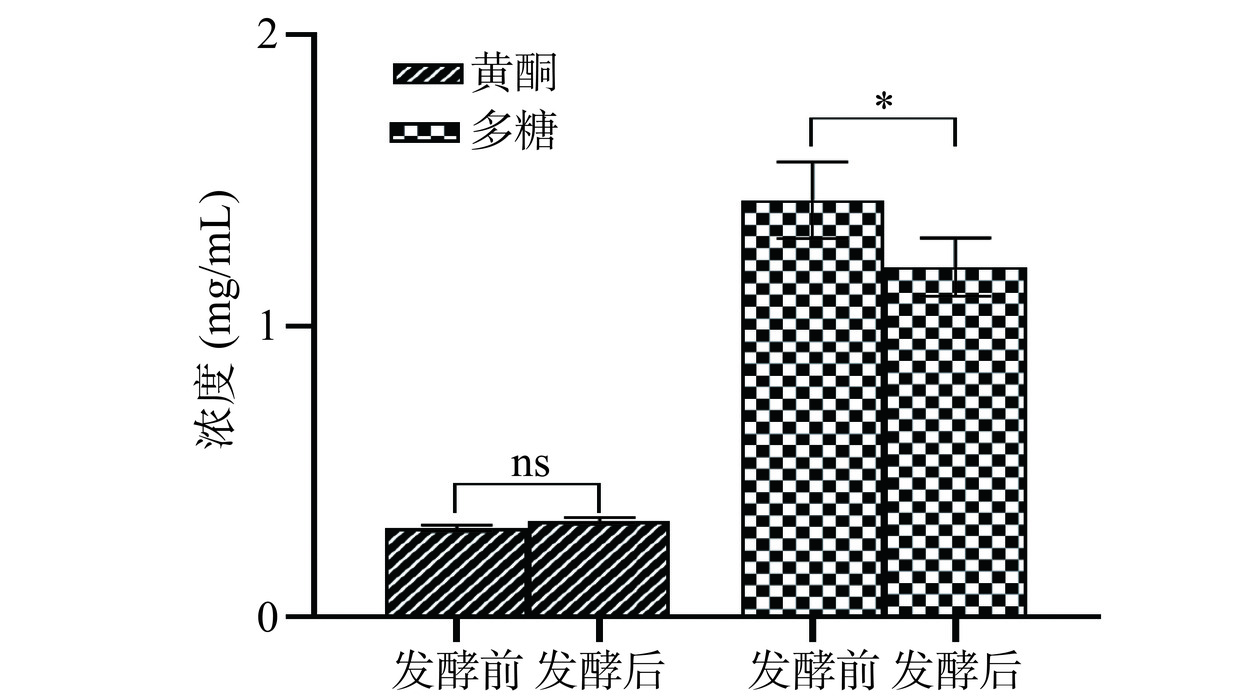
从图11可知,发酵槐花水提液能提高槐花黄酮类成分的含量,发酵前黄酮类成分含量为0.3012 mg/mL,发酵后含量为0.3225 mg/mL,含量提高了7.2%。发酵前多糖类成分含量为1.43 mg/mL,发酵后为1.14 mg/mL,含量下降了20.28%(P<0.05)。
根据中国药典的记载,黄酮类成分是槐花的主要药用成分。槐花水提液发酵后黄酮含量上升可能是由于其含有的多酚类物质转化而来,多糖含量降低可能是由于接种瑞士乳杆菌、保加利亚乳杆菌和嗜热链球菌进行发酵时,微生物生长过程中产生的酶对多糖进行降解和生物转化,导致多糖含量下降[37]。结果表明,槐花水提液发酵后抗氧化活性的降低可能主要与多糖类成分的减少有关
3. 结论
本文采用响应面法对槐花水提液的发酵工艺进行优化,同时探究槐花水提液发酵前后的抗氧化活性变化。发酵槐花水提液最佳混菌组合及比例为瑞士乳杆菌:保加利亚乳杆菌:嗜热链球菌(1:1:1),发酵最优工艺条件为温度21 ℃,时间24 h,接菌量3%。在该条件下得到的槐花水提液感官评分高达79.01分,总黄酮含量为0.3225 mg/mL,含量提高了7.2%,多糖含量为1.14 mg/mL,含量下降了20.28%。槐花水提液发酵后对DPPH自由基的清除率为67.39%,清除率降低了19.11%,对超氧阴离子自由基的清除率为81.1%,清除率降低了8.12%。经过益生菌发酵后的槐花水提液口感细腻,少许苦涩味,入口无不适反应,均匀,无沉淀,槐花味浓郁伴随发酵香气,闻之无不适反应。发酵槐花水提液的研究,有效改善了口感不适问题,为槐花资源利用开辟了新途径。
-
表 1 发酵槐花水提液感官评分标准
Table 1 Sensory scoring criteria of fermented Sophora japonica aqueous extracts
评分项目 评分标准 分数(100) 口感(0~50) 口感细腻,苦涩味改变或少许苦涩味,
入口无不适反应40~50 口感细腻,苦涩味明显,入口无不适反应 20~40 口感粗糙,难以下咽,入口有不适反应 0~20 质地(0~15) 均匀,无沉淀 10~15 不均匀,有少量沉淀 5~10 不均匀,有大量沉淀 0~5 气味(0~35) 槐花味浓郁伴随发酵香气,闻之无不适反应 20~35 槐花气味清淡,闻之无不适反应 10~20 无槐花气味,有大量异味,闻之有不适反应 0~10 表 2 混菌发酵比例
Table 2 Sterilization ratio
编号 混合菌种 接菌比例(4%) 1 瑞士乳杆菌:嗜热链球菌 1:3 2 瑞士乳杆菌:嗜热链球菌 2:2 3 瑞士乳杆菌:嗜热链球菌 3:1 4 瑞士乳杆菌:保加利亚乳杆菌 1:3 5 瑞士乳杆菌:保加利亚乳杆菌 2:2 6 瑞士乳杆菌:保加利亚乳杆菌 3:1 7 嗜热链球菌:保加利亚乳杆菌 1:3 8 嗜热链球菌:保加利亚乳杆菌 2:2 9 嗜热链球菌:保加利亚乳杆菌 3:1 10 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 2:1:1 11 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 1:2:1 12 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 1:1:2 13 瑞士乳杆菌:嗜热链球菌:保加利亚乳杆菌 1:1:1 14 瑞士乳杆菌 4 15 保加利亚乳杆菌 4 16 嗜热链球菌 4 17 (不接菌)空白对照 0 表 3 响应面分析因素与水平
Table 3 Factors and levels of response surface analysis
因素水平 −1 0 1 A发酵温度(℃) 15 20 25 B接菌量(%) 2 3 4 C发酵时间(h) 12 24 36 表 4 混菌发酵液总黄酮含量
Table 4 Total flavonoids content of mixed bacterial fermentation solution
指标 空白对照 瑞士乳杆菌:嗜热链球菌:
保加利亚乳杆菌(2:1:1)瑞士乳杆菌:嗜热链球菌:
保加利亚乳杆菌(1:1:1)瑞士乳杆菌 总黄酮浓度
(mg/mL)0.3054±0.0093b 0.2928±0.0113c 0.3174±0.0108a 0.2748±0.0073d 注:不同小写字母表示组间差异显著(P<0.05)。 表 5 Box-Benhnken试验设计与结果
Table 5 Design and results of Box-Benhnken experimental
实验号 A:温度(℃) B:接菌量(%) C:时间(h) 感官评分
(分)总黄酮含量(mg/mL) 1 25 3 36 76.67±1.34 0.3026±0.0137 2 20 3 24 79.33±1.87 0.3189±0.0086 3 20 3 24 79.00±1.56 0.3275±0.0154 4 25 4 24 77.67±1.47 0.3046±0.0148 5 15 4 24 76.33±2.21 0.3056±0.0144 6 20 4 12 76.17±1.72 0.3060±0.0119 7 15 3 12 76.67±1.52 0.3035±0.0172 8 20 4 36 77.70±1.39 0.3097±0.0129 9 25 3 12 77.17±1.58 0.3080±0.0069 10 20 3 24 78.33±1.21 0.3173±0.0172 11 20 2 12 77.33±1.89 0.3081±0.0193 12 20 2 36 76.67±2.01 0.3049±0.0136 13 20 3 24 78.67±2.41 0.3277±0.0106 14 15 3 36 76.30±1.38 0.3033±0.0113 15 15 2 24 76.67±1.69 0.3060±0.0163 16 25 2 24 76.17±1.73 0.3027±0.0128 17 20 3 24 79.00±1.49 0.3202±0.0157 表 6 感官评分响应面试验方差分析
Table 6 Analysis of variance of sensory scoring response surface test
方差源 平方和 自由度 均方 F值 P值 显著性 模型 17.89 9 1.99 11.96 0.0018 ** A-温度 0.3655 1 0.3655 2.20 0.1817 B-接菌量 0.1326 1 0.1326 0.7978 0.4014 C-时间 0.0000 1 0.0000 0.0000 1.0000 AB 0.8464 1 0.8464 5.09 0.0586 AC 0.0042 1 0.0042 0.0254 0.8778 BC 1.20 1 1.20 7.21 0.0313 * A² 6.17 1 6.17 37.12 0.0005 ** B² 3.76 1 3.76 22.65 0.0021 ** C² 3.82 1 3.82 23.01 0.0020 ** 残差 1.16 7 0.1662 失拟项 0.5866 3 0.1955 1.36 0.3758 纯误差 0.5769 4 0.1442 总和 19.06 16 注:*为差异显著(P<0.05),**为差异极显著(P<0.01)。 表 7 总黄酮含量响应面试验方差分析
Table 7 Analysis of variance of total flavonoid content response surface test
方差源 平方和 自由度 均方 F值 P值 显著性 模型 0.0011 9 0.0001 7.51 0.0073 ** A-温度 1.805×10−8 1 1.805×10−8 0.0012 0.9738 B-接菌量 2.301×10−6 1 2.301×10−6 0.1471 0.7127 C-时间 3.163×10−6 1 3.163×10−6 0.2023 0.6665 AB 1.311×10−6 1 1.311×10−6 0.0838 0.7805 AC 6.734×10−6 1 6.734×10−6 0.4307 0.5326 BC 0.0000 1 0.0000 0.7701 0.4093 A² 0.0004 1 0.0004 28.19 0.0011 ** B² 0.0002 1 0.0002 14.72 0.0064 ** C² 0.0003 1 0.0003 16.27 0.0050 ** 残差 0.0001 7 0.0000 失拟项 0.0000 3 4.249×10−6 0.1757 0.9076 纯误差 0.0001 4 0.0000 总和 0.0012 16 注:**为差异极显著(P<0.01)。 表 8 响应面验证试验结果
Table 8 Response surface verification experiment
项目 感官评分(分) 总黄酮浓度(mg/mL) 第一组 79.70 0.3207 第二组 78.33 0.3230 第三组 79.00 0.3239 平均值 79.01 0.3225 -
[1] 胡婷婷, 李金洋, 左亚锋, 等. 槐花和槐米的本草考证[J]. 辽宁中医药大学学报,2023,25(11):138−146. [HU T T, LI J Y, ZUO Y F, et al. Herbal textual research on huaihua(Sophorae flos)and huaimi(Sophorae immaturus)[J]. Journal of Liaoning University of TCM,2023,25(11):138−146.] HU T T, LI J Y, ZUO Y F, et al. Herbal textual research on huaihua(Sophorae flos)and huaimi(Sophorae immaturus)[J]. Journal of Liaoning University of TCM, 2023, 25(11): 138−146.
[2] HE X R, BAI Y J, ZHAO Z F, et al. Local and traditional uses, phytochemistry, and pharmacology of Sophora japonica L.:A review[J]. Journal of Ethnopharmacology,2016,187:160−182. doi: 10.1016/j.jep.2016.04.014
[3] JIANG S Y, SONG D N, ZHAO H H, et al. Bioactivity and component analysis of water extract of Sophora japonica against hyperuricemia by inhibiting xanthine oxidase activity[J]. Foods,2022,11(23):3772. doi: 10.3390/foods11233772
[4] 刘琳, 程伟. 槐花化学成分及现代药理研究新进展[J]. 中医药信息,2019,36(4):125−128. [LIU L, CHENG W. Research progress in chemical constituents and modern pharmacology of Sophora japonica[J]. Information on Traditional Chinese Medicine,2019,36(4):125−128.] LIU L, CHENG W. Research progress in chemical constituents and modern pharmacology of Sophora japonica[J]. Information on Traditional Chinese Medicine, 2019, 36(4): 125−128.
[5] LIU Y, HUANG W S, JI S Y, et al. Sophora japonica flowers and their main phytochemical, rutin, regulate chemically induced murine colitis in association with targeting the NF-κB signaling pathway and gut microbiota[J]. Food Chemistry,2022,393:133395. doi: 10.1016/j.foodchem.2022.133395
[6] 张玉梅. 槐花多糖的提取、结构表征及抗肿瘤活性研究[D]. 天津:天津科技大学, 2023. [ZHANG Y M. Extraction, structural characterisation and antitumour activity of polysaccharides from Sophora japonica[D]. Tianjin:Tianjin University of Science and Technology, 2023.] ZHANG Y M. Extraction, structural characterisation and antitumour activity of polysaccharides from Sophora japonica[D]. Tianjin: Tianjin University of Science and Technology, 2023.
[7] 牟登科, 吴燕芬, 周欢森. 槐花米中芦丁的抗氧化性及抑菌性研究[J]. 广东化工,2021,48(13):20−21. [MOU D K, WU Y F, ZHOU H S. Study on antioxidant activity and antibacterial property of rutin in sophora flower buds[J]. Guangdong Chemical Industry,2021,48(13):20−21.] doi: 10.3969/j.issn.1007-1865.2021.13.009 MOU D K, WU Y F, ZHOU H S. Study on antioxidant activity and antibacterial property of rutin in sophora flower buds[J]. Guangdong Chemical Industry, 2021, 48(13): 20−21. doi: 10.3969/j.issn.1007-1865.2021.13.009
[8] 周慧吉, 李廷钊, 李波. 多模型评价槐花水提物的抗糖化作用及其活性成分研究[J]. 食品工业科技,2023,44(5):371−379. [ZHOU H J, LI T Z, LI B. Multi-model evaluation of anti-glycation effect of Sophora japonica flowers aqueous extract and its active components analysis[J]. Science and Technology of Food Industry,2023,44(5):371−379.] ZHOU H J, LI T Z, LI B. Multi-model evaluation of anti-glycation effect of Sophora japonica flowers aqueous extract and its active components analysis[J]. Science and Technology of Food Industry, 2023, 44(5): 371−379.
[9] 钱文文, 辛宝, 史传道. 槐花的营养保健功能及食品开发前景[J]. 农产品加工,2016(18):59−61. [QIAN W W, XIN B, SHI C D. Nutrition and processing of sophra japonica[J]. Farm Products Processing,2016(18):59−61.] QIAN W W, XIN B, SHI C D. Nutrition and processing of sophra japonica[J]. Farm Products Processing, 2016(18): 59−61.
[10] 宋予震, 史洪涛, 范明夏, 等. 微生物发酵中药研究进展[J]. 动物医学进展,2021,42(1):105−109. [SONG Y Z, SHI H T, FAN M X, et al. Research progress of microbial fermentation of traditional Chinese medicine[J]. Progress in Veterinary Medicine,2021,42(1):105−109.] SONG Y Z, SHI H T, FAN M X, et al. Research progress of microbial fermentation of traditional Chinese medicine[J]. Progress in Veterinary Medicine, 2021, 42(1): 105−109.
[11] LI L, WANG L, FAN W X, et al. The application of fermentation technology in traditional Chinese medicine:A review[J]. The American Journal of Chinese Medicine,2020,48(4):899−921. doi: 10.1142/S0192415X20500433
[12] YANG H Y, HAN L, LIN Y Q, et al. Probiotic fermentation of herbal medicine:Progress, challenges, and opportunities[J]. Am J Chin Med,2023,51(5):1105−1126. doi: 10.1142/S0192415X23500519
[13] ZHANG L X, GAO W Y, WANG H Y. Review of traditional Chinese medicine processed by fermentation[J]. China Journal of Chinese Materia Medica,2012,37(24):3695−3700.
[14] 马利华. 乳酸菌发酵对槐花营养及抗氧化性的影响[J]. 食品工业科技,2009,30(5):200−202,207. [MA L H. Effect of lactobacillus fermentation on nutrients and function of Sophora japonica[J]. Science and Technology of Food Industry,2009,30(5):200−202,207.] MA L H. Effect of lactobacillus fermentation on nutrients and function of Sophora japonica[J]. Science and Technology of Food Industry, 2009, 30(5): 200−202,207.
[15] ZHANG Q Y, MA Z B, MENG Q, et al. Key aroma compounds and metabolic profiling of Debaryomyces hansenii L1-1-fermented flos Sophorae[J]. Journal of Food Biochemistry,2021,45(5):e13711.
[16] 贺莹. 响应曲面优化微波辅助提取槐花精油的工艺[J]. 食品工业,2020,41(6):28−31. [HE Y. Microwave-assisted extraction of essential oil from Sophora japonica[J]. Journal of Food Industry,2020,41(6):28−31.] HE Y. Microwave-assisted extraction of essential oil from Sophora japonica[J]. Journal of Food Industry, 2020, 41(6): 28−31.
[17] 王鹏. 响应面法优化槐花枸杞复合米酒发酵工艺[J]. 中国酿造,2022,41(9):209−214. [WANG P. Optimization of fermentation technology of sophorae flower and wolfberry compound rice wine by response surface methodology[J]. China Brewing,2022,41(9):209−214.] WANG P. Optimization of fermentation technology of sophorae flower and wolfberry compound rice wine by response surface methodology[J]. China Brewing, 2022, 41(9): 209−214.
[18] 张永瑞. 发酵型槐花茶酒的制作工艺优化[J]. 湖南农业科学,2020(3):67−70. [ZHANG Y R. Optimization of processing technology for fermented false acacia flower tea wine[J]. Hunan Agricultural Sciences,2020(3):67−70.] ZHANG Y R. Optimization of processing technology for fermented false acacia flower tea wine[J]. Hunan Agricultural Sciences, 2020(3): 67−70.
[19] 孙葳. 菌种活化操作方法[J]. 食品安全导刊,2020(35):78. [SUN W. Method of strain activation[J]. China Food Safety Magazine,2020(35):78.] SUN W. Method of strain activation[J]. China Food Safety Magazine, 2020(35): 78.
[20] 张璐. 洋槐花酱的研制及工艺优化[J]. 中国调味品,2021,46(2):83−88. [ZHANG L. Development and process optimization of acacia flower sauce[J]. China Condiment,2021,46(2):83−88.] doi: 10.3969/j.issn.1000-9973.2021.02.017 ZHANG L. Development and process optimization of acacia flower sauce[J]. China Condiment, 2021, 46(2): 83−88. doi: 10.3969/j.issn.1000-9973.2021.02.017
[21] 赵君洁, 曾卫军, 李艳红, 等. 大丽轮枝菌拮抗芽孢菌株的分离、鉴定及两株菌抑菌特性研究[J]. 北京师范大学学报(自然科学版),2017,53(3):294−300. [ZHAO J J, ZENG W J, LI Y H, et al. Isolation and identification of antagonistic spore strains of Verticillium dahliae and study on antibacterial characteristics of two strains[J]. Journal of Beijing Normal University (Natural Science),2017,53(3):294−300.] ZHAO J J, ZENG W J, LI Y H, et al. Isolation and identification of antagonistic spore strains of Verticillium dahliae and study on antibacterial characteristics of two strains[J]. Journal of Beijing Normal University (Natural Science), 2017, 53(3): 294−300.
[22] 茆鑫, 郑剑斌, 李广耀, 等. 响应曲面法优化刺五加-五味子混菌发酵工艺的研究[J]. 食品科技,2023,48(9):57−64. [MAO X, ZHENG J B, LI G Y, et al. Response surface methodology for optimizing the fermentation process of acanthopanax senticosus and schisandra chinensis with mixed bacteria[J]. Food Science and Technology,2023,48(9):57−64.] MAO X, ZHENG J B, LI G Y, et al. Response surface methodology for optimizing the fermentation process of acanthopanax senticosus and schisandra chinensis with mixed bacteria[J]. Food Science and Technology, 2023, 48(9): 57−64.
[23] CHEN Y J, WANG J, WAN D R. Determination of total flavonoids in three Sedum crude drugs by UV-Vis spectrophotometry[J]. Pharmacognosy Magazine,2010,6(24):259−63. doi: 10.4103/0973-1296.71784
[24] 王丽丽, 林清霞, 宋振硕, 等. 分光光度法测定茶叶中总黄酮含量[J]. 茶叶学报,2021,62(1):1−6. [WANG L L, LIN Q X, SONG Z S, et al. Spectrophotometric determination of total flavonoids in tea[J]. Acta Tea Sinica,2021,62(1):1−6.] doi: 10.3969/j.issn.1007-4872.2021.01.002 WANG L L, LIN Q X, SONG Z S, et al. Spectrophotometric determination of total flavonoids in tea[J]. Acta Tea Sinica, 2021, 62(1): 1−6. doi: 10.3969/j.issn.1007-4872.2021.01.002
[25] 黄秋凌, 雷婷, 何子昕, 等. 苯酚-硫酸法测定消渴丸中多糖含量[J]. 中西医结合研究,2023,15(5):308−310,327. [HUANG Q L, LEI T, HE Z X, et al. Determination of polysaccharides in xiaoke pill by phenol-sulfuric acid method[J]. Research of Integrated Traditional Chinese and Western Medicine,2023,15(5):308−310,327.] doi: 10.3969/j.issn.1674-4616.2023.05.004 HUANG Q L, LEI T, HE Z X, et al. Determination of polysaccharides in xiaoke pill by phenol-sulfuric acid method[J]. Research of Integrated Traditional Chinese and Western Medicine, 2023, 15(5): 308−310,327. doi: 10.3969/j.issn.1674-4616.2023.05.004
[26] 张恩馨, 刘娜, 刘玮, 等. 广谱抗菌活性瑞士乳杆菌AJT在发酵乳中的应用[J]. 中国乳品工业,2023,51(9):60−64. [ZHANG E X, LIU N, LIU W, et al. Application of L. helveticus AJT with broad-spectrum antibacterial activity in fermented milk[J]. China Dairy Industry,2023,51(9):60−64.] ZHANG E X, LIU N, LIU W, et al. Application of L. helveticus AJT with broad-spectrum antibacterial activity in fermented milk[J]. China Dairy Industry, 2023, 51(9): 60−64.
[27] 刘知非, 周婷, 胡晓磊, 等. 响应面法优化复合益生菌发酵枸杞汁的工艺研究[J]. 中国酿造,2021,40(4):95−99. [LIU Z F, ZHOU T, HU X L, et al. Optimization of fermentation technology of Lycium barbarum juice with compound probiotics by response surface methodology[J]. China Brewing,2021,40(4):95−99.] doi: 10.11882/j.issn.0254-5071.2021.04.018 LIU Z F, ZHOU T, HU X L, et al. Optimization of fermentation technology of Lycium barbarum juice with compound probiotics by response surface methodology[J]. China Brewing, 2021, 40(4): 95−99. doi: 10.11882/j.issn.0254-5071.2021.04.018
[28] 李理, 闵建. 应用益生菌发酵生产酸豆乳的研究[J]. 食品与发酵工业,2009,35(10):68−72. [LI L, MIN J. Study on the production of yogurt by probiotic fermentation[J]. Food and Fermentation Industries,2009,35(10):68−72.] LI L, MIN J. Study on the production of yogurt by probiotic fermentation[J]. Food and Fermentation Industries, 2009, 35(10): 68−72.
[29] 王孝研, 李妍, 柳羽丰. 四种乳酸菌组合在豆乳饮料中的发酵研究[J]. 化学工程师,2014,28(7):73−76. [WANG X Y, LI Y, LIU Y F. Study on fermentation of four lactobacillus combination in soybean milk[J]. Chemical Engineer,2014,28(7):73−76.] WANG X Y, LI Y, LIU Y F. Study on fermentation of four lactobacillus combination in soybean milk[J]. Chemical Engineer, 2014, 28(7): 73−76.
[30] LI L J, YAN X, CHEN F Y, et al. A comprehensive review of the metabolism of citrus flavonoids and their binding to bitter taste receptors[J]. Comprehensive Reviews in Food Science and Food Safety,2023,22(3):1763−1793. doi: 10.1111/1541-4337.13129
[31] 沈丹芸, 董科, 范紫玮, 等. 响应面法优化水豆豉纯种发酵产大豆异黄酮的条件[J]. 中国调味品,2020,45(6):31−36. [SHEN D Y, DONG K, FAN Z W, et al. Optimization of pure breed fermentation conditions for soybean isoflavones produced by fermented soybeans with response surface methodology[J]. China Condiment,2020,45(6):31−36.] doi: 10.3969/j.issn.1000-9973.2020.06.008 SHEN D Y, DONG K, FAN Z W, et al. Optimization of pure breed fermentation conditions for soybean isoflavones produced by fermented soybeans with response surface methodology[J]. China Condiment, 2020, 45(6): 31−36. doi: 10.3969/j.issn.1000-9973.2020.06.008
[32] 董璇, 魏雨晴, 吴珊珊, 等. 植物基复合谷物发酵饮料工艺优化[J]. 皖西学院学报,2023,39(5):92−99. [DONG X, WEI Y Q, WU S S, et al. Process optimisation of plant-based composite grain fermented beverage[J]. Journal of West Anhui University,2023,39(5):92−99.] doi: 10.3969/j.issn.1009-9735.2023.05.017 DONG X, WEI Y Q, WU S S, et al. Process optimisation of plant-based composite grain fermented beverage[J]. Journal of West Anhui University, 2023, 39(5): 92−99. doi: 10.3969/j.issn.1009-9735.2023.05.017
[33] 刘哲, 叶英, 李珊, 等. 基于响应面设计的藜麦酒糟饼干配方优化[J]. 食品研究与开发,2021,42(17):129−136. [LIU Z, YE Y, LI S, et al. Response surface design optimization of biscuit formula using quinoa distiller's grains[J]. Food Research and Development,2021,42(17):129−136.] doi: 10.12161/j.issn.1005-6521.2021.17.021 LIU Z, YE Y, LI S, et al. Response surface design optimization of biscuit formula using quinoa distiller's grains[J]. Food Research and Development, 2021, 42(17): 129−136. doi: 10.12161/j.issn.1005-6521.2021.17.021
[34] YUAN S, XU C Y, XIA J, et al. Extraction of polysaccharides from Codonopsis pilosula by fermentation with response surface methodology[J]. Food Science & Nutrition,2020,8(12):6660−6669.
[35] TAI Z G, CAI L, DAI L, et al. Antioxidant activity and chemical constituents of edible flower of Sophora viciifolia[J]. Food Chemistry,2011,126(4):1648−1654. doi: 10.1016/j.foodchem.2010.12.048
[36] 张玉梅, 邢慧珍, 刘会平, 等. 槐花多糖的提取、纯化和抗氧化活性分析[J/OL]. 食品工业科技:1−13[2023-11-21]. https://doi.org/10.13386/j.issn1002-0306.2023020274. [ZHANG Y M, XING H Z, LIU H P, et al. Extraction, purification and antioxidant activity of polysaccharides from Sophora japonica[J/OL]. Science and Technology of Food Industry: 1−13[2023-11-21]. https://doi.org/10.13386/j.issn1002-0306.2023020274.] ZHANG Y M, XING H Z, LIU H P, et al. Extraction, purification and antioxidant activity of polysaccharides from Sophora japonica[J/OL]. Science and Technology of Food Industry: 1−13[2023-11-21]. https://doi.org/10.13386/j.issn1002-0306.2023020274.
[37] 刘艳芳, 高坤, 冯杰, 等. 酿酒酵母发酵降解灵芝胞外多糖组分分析及活性研究[J]. 菌物学报,2020,39(2):372−380. [LIU Y F, GAO K, FENG J, et al. Characteristics and immune-enhancing activities of ganoderma lingzhi extracellular polysaccharide fermented with saccharomyces cerevisiae[J]. Mycosystema,2020,39(2):372−380.] LIU Y F, GAO K, FENG J, et al. Characteristics and immune-enhancing activities of ganoderma lingzhi extracellular polysaccharide fermented with saccharomyces cerevisiae[J]. Mycosystema, 2020, 39(2): 372−380.





 下载:
下载:
 下载:
下载:
