In Vitro Stability and Lipid-lowering Activity Analysis of Liposome/Gum Arabic Nanoparticles Loaded with Anthocyanins
-
摘要: 为解决花色苷(Anthocyanins,ACNs)在加工过程中易降解、体内生物利用度低及其在精准营养领域应用的限制性问题。本研究制备了以ACNs为核,以大豆卵磷脂构建的脂质体(Liposome,Lipo)和阿拉伯树胶(Gum Arabic,GA)为载体的ACNs纳米颗粒,即脂质体/阿拉伯树胶-花色苷(Lipo/GA-ACNs)纳米颗粒,考察环境因素和体外模拟消化对不同配方的Lipo/GA-ACNs纳米颗粒稳定性的影响,消化后Lipo/GA-ACNs纳米颗粒的体外降脂活性。结果表明,Lipo/GA-ACNs纳米颗粒在模拟热加工和不同离子环境下具有较好的稳定性;当ACNs与GA的质量比为1:10时,经模拟消化后,Lipo/GA-ACNs纳米颗粒对HepG-2细胞脂滴积聚和活性氧堆积的抑制效果分别比ACNs提高了3.8%和1.99%。因此,Lipo/1.0GA有望成为递送ACNs并实现肝脏降脂的有效口服运输体系,具备开发成具有精准营养性质的功能食品的潜力。
-
关键词:
- 花色苷 /
- 脂质体/阿拉伯树胶纳米颗粒 /
- 体外稳定性 /
- 体外降脂活性
Abstract: To address the issues of low bioavailability, degradation during processing, and limited use in precision nutrition of anthocyanins (ACNs). ACNs nanoparticles using ACNs as the core, soybean lecithin constructed-Liposome (Lipo), and Gum Arabic (GA) as the carrier were prepared in this study, namely Liposome/Gum Arabic-anthocyanins (Lipo/GA-ACNs) nanoparticles. In this study, nanoparticles of ACNs with ACNs as the core and liposomes (Lipo) constructed using soy lecithin and gum arabic (GA) as carriers, namely liposome/gum arabic-anthocyanins (Lipo/GA-ACNs) nanoparticles, were prepared. Environmental factors and in vitro simulated digestion on the stability of Lipo/GA-ACNs nanoparticles with various formulations were investigated. Additionally, the in vitro lipid-lowering activity of Lipo/GA-ACNs nanoparticles after digestion was examined. Results showed that Lipo/GA-ACNs nanoparticles had good stability under simulated thermal processing and different ion environments. When the ACNs to GA mass ratio was 1:10, the Lipo/GA-ACNs nanoparticles inhibited lipid droplet accumulation and reactive oxygen species accumulation in HepG-2 cells 3.8% and 1.99% more effectively than ACNs after simulated digestion. This study concluded that Lipo/1.0GA was a promising oral delivery system to deliver ACNs and achieve liver lipid-lowering, with the potential to be developed into functional foods with precision nutritional properties. -
大量研究表明,天然活性物质比化学药物在降脂方面具有独特的优势,尤其是安全性能[1]。天然小分子活性物质花色苷(Anthocyanins,ACNs)广泛存在于蓝莓等深色浆果中,已被证明具有良好的降脂活性[2−3]。但是ACNs在加工及开发为功能产品的过程中存在极多限制,例如热加工稳定性差、体内生物利用度低及不具备靶向性等[4−6]。因此,为了提高ACNs的生物利用度及产品开发价值,探索新的用于装载ACNs的稳态递送系统并实现精确的饮食干预具有重要意义。
脂质体(Liposome,Lipo)可由大豆卵磷脂及蛋黄卵磷脂等脂质材料通过超声破碎等手段进行构建,是具有良好的生物相容性和肝脏靶向功能的双亲性囊泡[7−9]。此外,Lipo也可以用于增强亲水性生物活性物质的脂溶性,提高其被细胞主动摄取的能力[10]。研究表明使用Lipo作为载体可以实现生物活性物质的肝脏靶向递送,但目前存在易渗漏和稳定性差等缺点[11]。阿拉伯树胶(Gum Arabic,GA)是常见的天然稳定剂和包埋剂,因含有阿拉伯糖-半乳糖寡糖和蛋白结构而具有两亲性性质[12]。将ACNs封装于Lipo的亲水腔内,再将GA包裹于Lipo/ACNs的外表面所构建的纳米颗粒,可以被假设为具有增强ACNs的物理化学稳定性的潜力。
逐层自组装(Layer by layer,LBL)是一种用于修饰模块化纳米粒子表面的工程技术,通过水基静电吸附作用可将大分子聚合物分散到小分子纳米颗粒的表面[13]。LBL可以根据需求构建和调整载体类型,使纳米颗粒具有多个腔室和连续释放的功能[14]。此外,LBL还可以通过添加靶向材料和改变材料特性以实现纳米颗粒在生物体内的靶向分布能力[15]。
综上,本研究采用食品级大豆卵磷脂构建的Lipo和亲水亲脂型多糖GA形成的载体,利用LBL技术绿色制备了用于运输ACNs的纳米递送系统,并重点探究了不同GA浓度的Lipo/GA-ACNs纳米颗粒在模拟加工过程中的稳定性差异,体外模拟消化过程中ACNs的保留率,以及Lipo/GA-ACNs纳米颗粒的体外降脂作用。旨在开发具有降脂活性的ACNs稳态化靶向递送体系,促进ACNs在精准营养领域的应用。
1. 材料与方法
1.1 材料与仪器
“蓝美1号”蓝莓花色苷(ACNs,纯度30%~40%) 浙江蓝美生物技术有限公司;大豆卵磷脂 纯度≥80%,西安瑞西生物技术有限公司;阿拉伯树胶(Gum Arabic,GA) 上海源叶生物技术有限责任公司;胃蛋白酶(25000 U/mL)、胰蛋白酶(800 U/mL)和猪胆盐 上海瑞恩生物科技有限公司;NaCl、KCl、CaCl2、K2HPO4、KH2PO4、柠檬酸、柠檬酸钠、牛血清蛋白、杜尔伯克改良伊格尔培养基(DMEM培养基)、胎牛血清、油酸、油红O、苏木素、尼罗蓝-A(Nile Blue-A)、2,7-二氯荧光素二乙酸酯(DCFH-DA) 麦克林生化技术有限公司。
Zetasizer Nano ZS90粒径仪 英国马尔文公司;S-4800扫描电镜 日本日立公司(Hitachi); Evolution 201 紫外可见分光光度计 赛默飞世尔科技公司;ACEA NovoCyte流式细胞分析仪 美国安捷伦科技有限公司。
1.2 实验方法
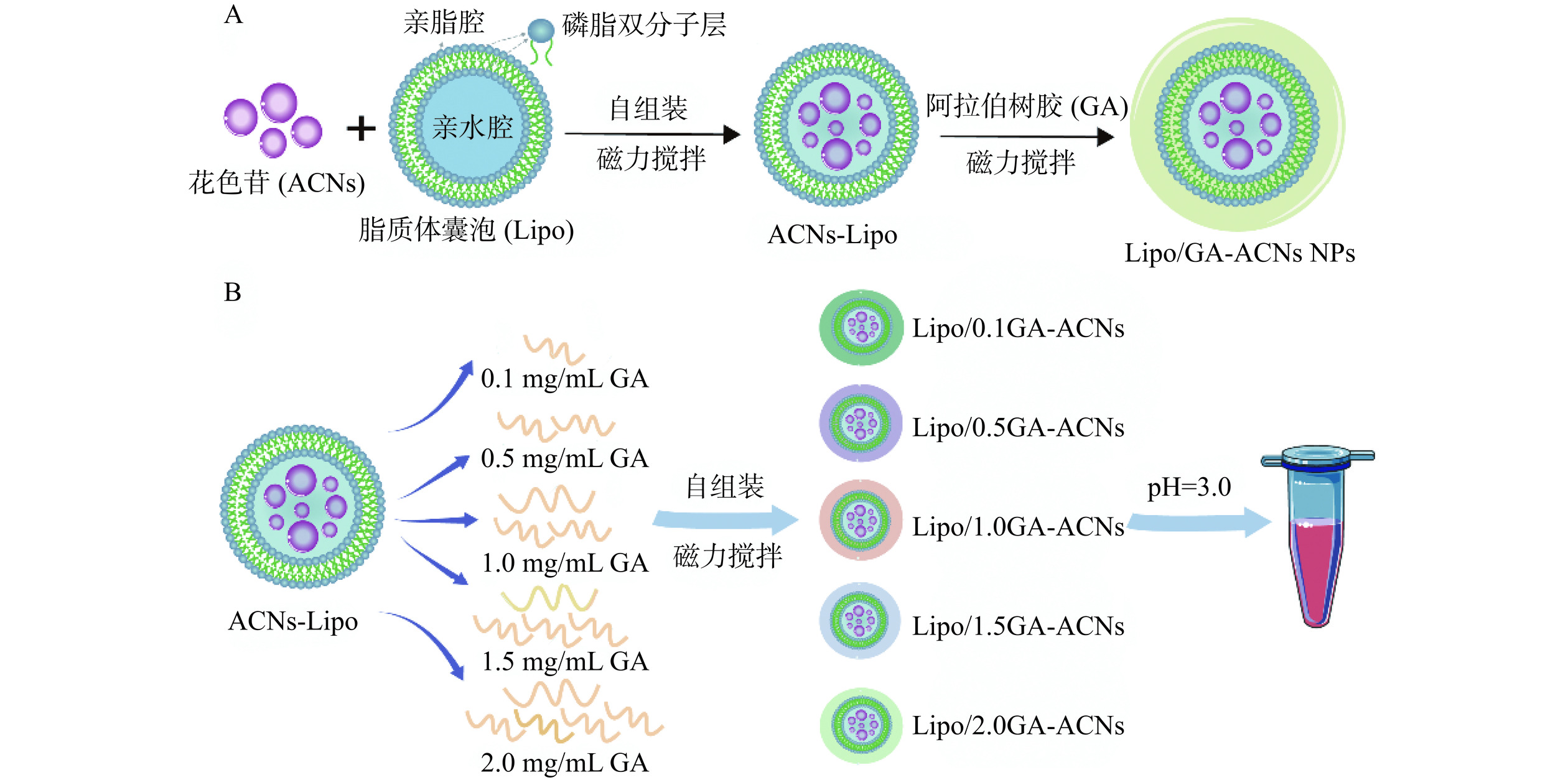
1.2.1 负载ACNs的Lipo-ACNs纳米颗粒的制备
本实验室前期的研究已经成功制备出Lipo-ACNs纳米颗粒,最终确定0.1 mg/mL的ACNs和5 mg/mL的大豆卵磷脂是制备Lipo-ACNs纳米体系的最佳浓度比,3.0是ACNs保持相对稳定的pH环境[16]。因此,本研究首先用pH3.0的柠檬酸盐缓冲溶液酸化大豆卵磷脂,并在600 r/min下磁力搅拌直至其溶解。采用探头超声破碎仪(强度60%,脉冲开启5 s,脉冲关闭2 s,10 min,冰水浴进行控温)将5 mg/mL大豆卵磷脂破碎成50 nm左右的脂质体囊泡(Lipo)工作液。随后将溶解于柠檬酸盐缓冲溶液(pH3.0)中的ACNs缓慢滴加到Lipo工作液中,在室温下磁力搅拌30 min制成Lipo-ACNs纳米颗粒。
1.2.2 不同质量浓度GA装载的Lipo/GA-ACNs纳米颗粒的制备
纳米颗粒的制备方法参考Cheng等[16]的研究并根据实际需求进行修改。将GA分散至中性去离子水中以制备成不同质量浓度(0.1、0.5、1.0、1.5和2.0 mg/mL)的GA水溶液,采用1.2.1步骤中的探头超声破碎条件对GA溶液进行预处理。随后将不同质量浓度的GA水溶液通过静电吸附作用缀合到Lipo-ACNs的表面,室温下磁力搅拌30 min,调节纳米体系最终pH至3.0(图1)。根据GA质量浓度的不同,将纳米颗粒分别命名为Lipo/0.1GA-ACNs、Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs。
1.2.3 动态光散射(DLS)分析
DLS的测定方法参考Cui等[17]的研究并进行修改。在25 ℃条件下,使用马尔文Zetasizer Nano ZS 90纳米激光粒度仪对Lipo/0.1GA-ACNs、Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs纳米颗粒原液的平均粒径(nm)、多分散系数(PDI)和表面Zeta电位(mV)进行测定。
1.2.4 扫描电镜(SEM)观察
将纳米颗粒的粉末样品置于铝柱中进行喷金,通过扫描电子显微镜(SEM)放大2000倍,观察不同质量浓度GA装载的Lipo/GA-ACNs纳米颗粒的表面形态。
1.2.5 模拟热加工对Lipo/GA-ACNs纳米颗粒稳定性的影响
Lipo/GA-ACNs的加热稳定性参考Cui等[17]的方法进行测定。Lipo/GA-ACNs纳米颗粒在90 ℃水浴中进行热处理,并分别在0、30、60和90 min时取样进行DLS分析。随后,将Lipo/GA-ACNs纳米颗粒与乙醇混合并离心,在520 nm和700 nm处测量ACNs的吸光度,使用pH示差法计算上清液中ACNs的含量[18],依公式(1)计算ACNs的保留率。
ACNs保留率(%)=ACNtACN0×100 (1) 式中,ACNt为 ACNs在t时刻的质量浓度(mg/mL);ACN0为ACNs的初始质量浓度(mg/mL)。
根据公式(2)计算ACNs在降解动力学中的反应速率常数(k)。
ln(Ct/C0)=ln(A/A0)=−k×t (2) 其中,C0是ACNs在初始时间的含量;Ct是在特定温度下加热后ACNs的含量,A0可以代替C0,Ct是ACNs样品溶液在初始时刻最大吸收波长下的吸光度值;A是在特定温度t下加热后ACNs样品溶液在最大吸收波长下的吸光度值。
1.2.6 金属离子对Lipo/GA-ACNs纳米颗粒稳定性的影响
分别制备0.05、0.1、0.2和0.5 mmol/L的NaCl、KCl和CaCl2金属离子工作液。将Lipo/GA-ACNs纳米颗粒和金属离子工作液以1:1的比例混合,并在黑暗中放置1 h,然后测定其平均粒径(nm)、多分散系数(PDI)和表面Zeta电位(mV)。
1.2.7 Lipo/GA-ACNs纳米颗粒的体外消化特性研究
将10 mL的ACNs和Lipo/GA-ACNs纳米颗粒分别与1.6 mL的猪胃蛋白酶(25000 U/mL)储备溶液、5 mL的CaCl2(0.3 mmol/L)溶液、0.2 mL的HCl(1 mmol/L)和0.695 mL的去离子水混合,将pH调节至3.0。放置在50 mL离心管中,密封并在恒温摇床水浴培养箱中孵育,37 ℃下振荡[19]。分别在60、120和240 min收集纳米颗粒样品,用于平均粒径(nm)和多分散系数(PDI)的测定。
将20 mL的胃消化样品溶液与11 mL的模拟肠液(5.0 mL猪胰蛋白酶溶液800 U/mL,12.5 mL的胆汁盐溶液(10 mmol/L),40 mL的CaCl2(0.3 mol/L)溶液,0.15 mL的NaOH溶液(1 mol/L),和1.31 mL的水,调节pH为7.0)混合。分别在60、120和240 min收集样品,用于平均粒径(nm)和多分散系数(PDI)的测定[19]。收集不同消化阶段的样品溶液并用乙醇进行分解,通过公式(1)对ACNs的保留率进行测定[17]。
1.2.8 体外高脂细胞模型的构建和给药
模型构建:油酸用于构建HepG-2高脂细胞模型,参考Vidyashankar等[20]的方法并进行了合理的修改。将1 mL处于对数生长期的HepG-2细胞接种在6孔板(2×106个细胞/孔)中并孵育48 h。
给药过程:将6孔板中原始的DMEM培养基吸出弃之,每孔加入1 mL新的DMEM培养基,空白组加入1 mL 10%的牛血清蛋白(10% 的牛血清蛋白在55 ℃水浴下溶解,−20 ℃保存备用)与1 mL DMEM培养。在油酸-模型组与给药组中,每孔先加入10%牛血清蛋白与0.6 mmol/L油酸的混合物溶液(1 mL),随后在油酸-模型组中加入1 mL DMEM培养基进行干预;ACNs组、Lipo/0.1GA-ACNs组、Lipo/0.5GA-ACNs组、Lipo/1.0GA-ACNs组、Lipo/1.5GA-ACNs组和Lipo/2.0GA-ACNs组均加入1 mL含有0.1 mg/mL的ACNs的冻干粉溶解液。最终,每孔溶液总体积为3 mL,共孵育24 h。为了相对严谨的探究Lipo/GA-ACNs纳米颗粒和ACNs的体外降脂活性,本研究在体外细胞试验过程中采用的样本形式均为经过体外模拟胃肠消化后的冻干粉。
1.2.9 油红O染色法
油红O染色方法参考Sun等[21]的研究,并进行了相应的修改。将1 mL油红O溶液(油红O:双蒸馏水=3:2)加入6孔板中对HepG-2细胞染色10 min,用60%异丙醇(1 mL)洗涤以促进细胞间质的清晰分化。随后使用苏木素对HepG-2细胞进行2 min的复染,蒸馏水洗涤两次以防过度染色造成的颜色重叠。最后,在倒置光学显微镜下400×的放大倍数观察细胞中的脂滴分布并拍照记录。
1.2.10 流式细胞术
流式细胞术的方法参考Liu等[22]的研究,并进行了相应的修改。将HepG-2细胞消化离心并重悬在PBS中,采用荧光染料尼罗蓝-A和DCFH-DA荧光探针分别对脂肪和活性氧(ROS)进行染色标记。使用ACEA NovoCyte流式细胞仪对荧光强度的分布面积进行分析。
1.3 数据处理
所有试验均进行至少三次,数据以平均值±标准偏差(SD)表示。使用GraphPad Prism 8.0.1.244(GraphPad Software股份有限公司,USA)进行标准偏差的计算和绘图,使用Adobe Illustrator对图片进行整合排版。显著性以P<0.05(*)、P<0.01(**)、P<0.001(***)和P<0.0001(****)表示。
2. 结果与分析
2.1 Lipo/GA-ACNs纳米颗粒的动态光散射(DLS)表征
通过马尔文粒径仪测定了Lipo/0.1GA-ACNs、Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs的平均粒径、PDI和Zeta电位,具体结果展示在表1中。从粒径分布范围可以得知,随着GA质量浓度从0.1 mg/mL到2.0 mg/mL的增加,纳米颗粒的平均粒径和PDI逐渐递增,这说明大分子多糖的聚集会造成纳米颗粒的外壳增厚,进而导致平均粒径和多分散系数的扩大。但是当GA的质量浓度为1.0 mg/mL时,纳米颗粒拥有最小的平均粒径和多分散系数,这可能由于具有双亲性的GA分子与Lipo-ACNs发生了最强的静电和氢键作用,使得GA在与Lipo-ACNs发生自组装的过程中产生了最紧密的连接,最终导致纳米颗粒的平均粒径和多分散系数减小。Zeta电位的变化表明随着GA质量浓度的增加,纳米颗粒的表面Zeta电位逐渐降低。推测可能的原因是GA的质量浓度较高时,大量带负电荷的GA通过静电吸附作用缀合在Lipo-ACNs纳米颗粒的表面,从而导致Lipo/GA-ACNs纳米颗粒的表面Zeta电位呈现浓度依赖性降低。
表 1 负载花色苷的脂质体-阿拉伯树胶纳米颗粒的平均粒径、多分散系数和Zeta电位Table 1. Mean particle size, polydispersity index, and zeta potential of liposome/gum Arabic nanoparticles loaded with anthocyanins纳米颗粒 平均粒径(nm) 多分散系数(PDI) Zeta电位(mV) Lipo/0.1GA-ACNs 100.90±0.24 0.469±0.006 19.80±1.36 Lipo/0.5GA-ACNs 105.40±0.64 0.489±0.007 18.20±2.18 Lipo/1.0GA-ACNs 99.97±0.82 0.459±0.013 17.90±0.50 Lipo/1.5GA-ACNs 121.10±0.77 0.518±0.009 15.30±0.56 Lipo/2.0GA-ACNs 130.60±1.22 0.513±0.021 14.80±1.15 2.2 Lipo/GA-ACNs纳米颗粒的形貌特征
使用SEM扫描电镜观察Lipo/GA-ACNs纳米颗粒冻干粉的表面微观结构,结果展示在图2A~图2E)中。当GA浓度为0.1 mg/mL时,表面颗粒聚集并不显著,多呈现较大的椭圆形囊泡,分布不均匀并存着明显的粘连和缝隙(图2A)。随着GA质量浓度的增加,脂质体囊泡的表面出现大量的球形小颗粒聚集,同时伴随颗粒聚集结构和填充脂质囊泡间隙等现象的产生。尤其是当GA的质量浓度达到1.0 mg/mL时(图2C),脂质囊泡的表面被大量的颗粒填充,呈现出相对紧密的连接结构,这可能是由于携带负电荷的GA通过静电吸附作用与正电荷的Lipo-ACNs进行桥接,从而形成疏水-亲水结构紧密的纳米颗粒,和动态光散射表征的结果(表1)是一致的。
2.3 模拟热加工对Lipo/GA-ACNs纳米颗粒稳定性的影响
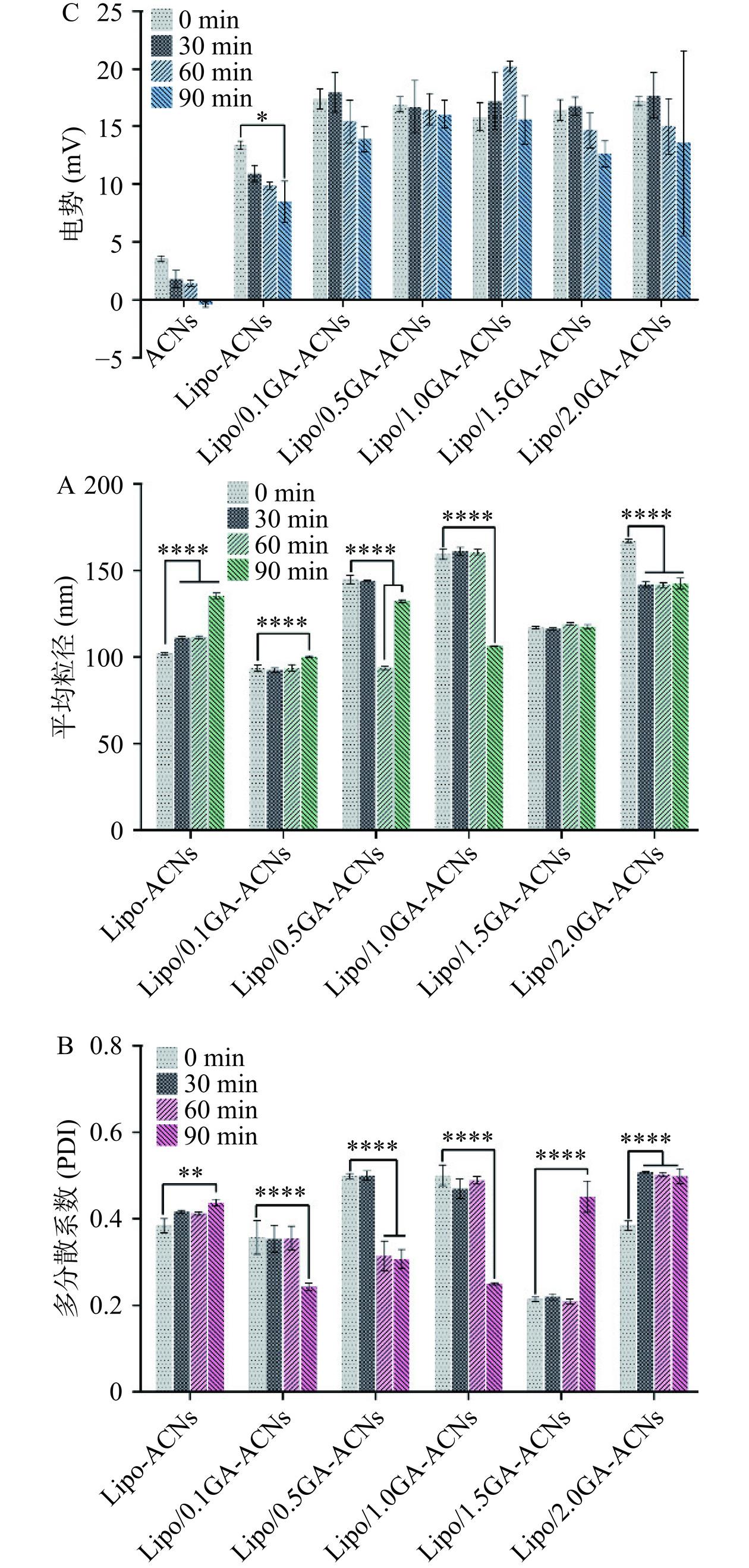
2.3.1 纳米颗粒的平均粒径、多分散系数和表面Zeta电位
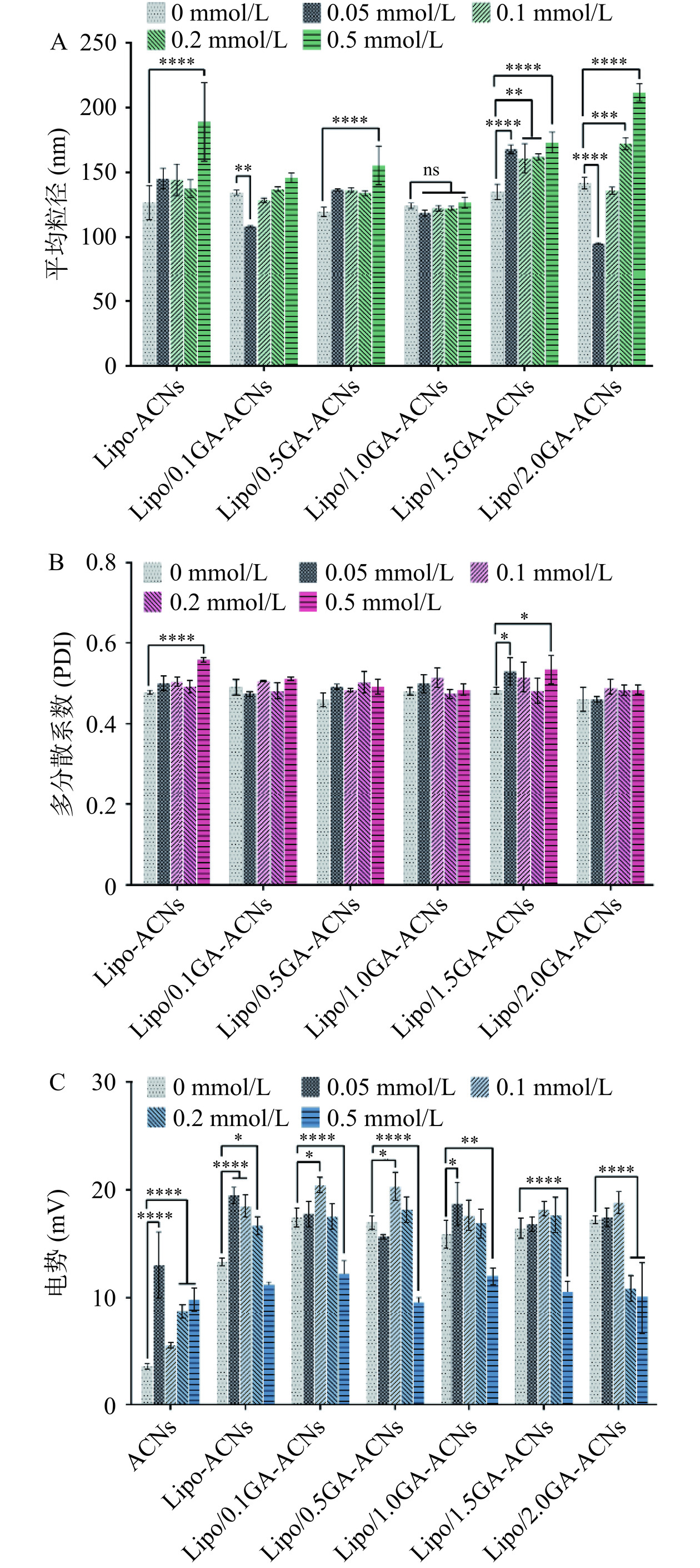
90 ℃是食品加工过程中常用的灭菌温度[17]。如图3A~图3C所示,未经过GA包封的Lipo-ACNs纳米颗粒的平均粒径随着加热时间的增加而逐渐增大,可能的原因是加热导致脂质体外壳破坏和降解,从而导致纳米体系的平均粒径扩大。而经过0.1GA、1.0GA和1.5GA包封的Lipo/GA-ACNs纳米颗粒的平均粒径在加热60 min后相比于未加热时依旧保持相对稳定(P>0.05,图3A)。多分散系数(PDI)的结果展现在图3B中,结果表明Lipo/2.0GA-ACNs纳米颗粒的PDI值随加热时间的增加逐渐递增,而0.1GA、1.0GA和1.5GA封装的纳米颗粒的多分散系数在加热至60 min时没有出现显著性变化。Lipo/2.0GA-ACNs的多分散系数随着时间的增加而扩大,原因可能是相对较高质量浓度的GA随着加热时间的增加而发生扩散和碰撞。纳米颗粒的表面Zeta电位的变化可以从图3C中观察到,Lipo-ACNs的Zeta电位随着加热时间的增加显著降低(P<0.05)。而以不同质量浓度的GA包封Lipo-ACNs纳米颗粒后,其Zeta电位可以在加热90 min后依旧保持相对稳定的状态(P>0.05),尤其是当GA的质量浓度为1.0 mg/mL时。可能的原因是0.1 mg/mL GA携带的负电荷与Lipo-ACNs结合后,纳米颗粒表面的静电斥力达到平台期。
![]() 图 3 90 ℃加热对Lipo/GA-ACNs纳米颗粒(A)平均粒径、(B)多分散系数及(C)电势的影响注:*P<0.05,**P<0.01,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在加热过程中30、60和90 min与初始时间(0 min)的显著性差异比较分析。Figure 3. Effects of heating at 90 ℃ on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 3 90 ℃加热对Lipo/GA-ACNs纳米颗粒(A)平均粒径、(B)多分散系数及(C)电势的影响注:*P<0.05,**P<0.01,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在加热过程中30、60和90 min与初始时间(0 min)的显著性差异比较分析。Figure 3. Effects of heating at 90 ℃ on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles2.3.2 ACNs的保留率
图4为ACNs、Lipo-ACNs及Lipo/GA-ACNs纳米颗粒在90 ℃加热90 min后ACNs的残留率情况。经过热处理90 min后,ACNs的保留率仅为75.96%±3.54%,而Lipo/GA递送系统使ACNs保留率提高了约9.63%~14.07%。从图4可以明显观察到,当GA的质量浓度为1.0 mg/mL时,ACNs的保留率达到最大,并且显著高于Lipo/2.0GA-ACNs纳米体系(P<0.05),这与本实验室之前关于封装在蛋白质和多糖中的ACNs具有更高的热稳定性的结论是一致的[17]。GA所发挥的ACNs保护效应可能的原因是,在加热过程中ACNs可以和GA分子间形成强大的氢键作用力,空间和静电排斥使大分子能够在Lipo-ACNs的外侧形成坚强的保护壳,物理屏障的增加也阻挡了外部能量向纳米颗粒的内部转移,从而抑制ACNs的降解速率[23]。
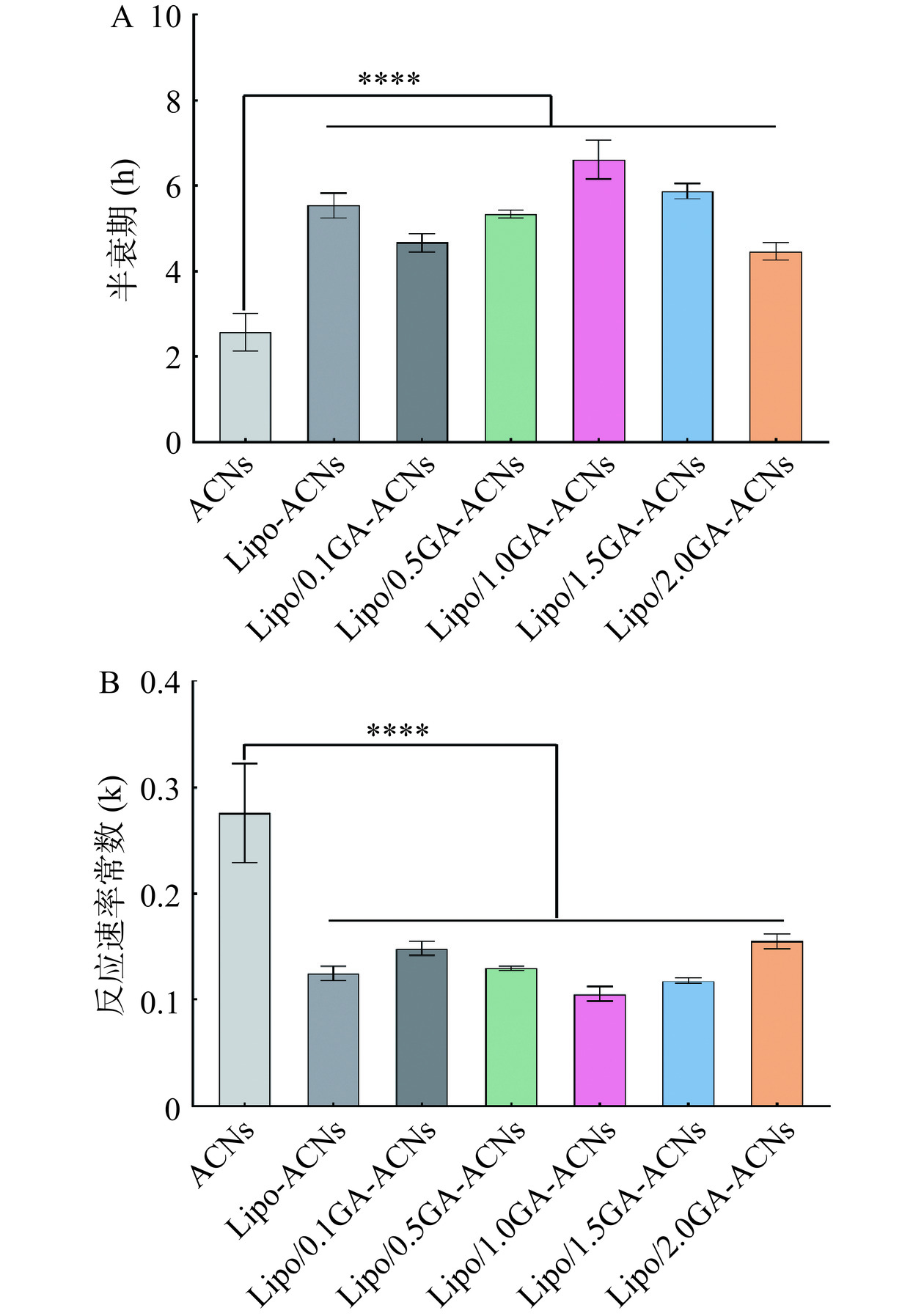
2.3.3 降解动力学评价
半衰期h(图5A)和降解速率常数k(图5B)是根据ACNs的保留率进行计算的。结果表明ACNs的热稳定性较差,90 ℃加热90 min后,ACNs的半衰期h和降解速率k分别减小和增大。但是采用质量浓度为1.0 mg/mL的GA封装Lipo-ACNs后,ACNs的半衰期h和降解速率常数k分别被最大程度的提高和降低,这说明Lipo/GA作为优良载体有效抑制了ACNs在持续高温加热过程中发生的热降解反应,尤其是GA的质量浓度为1.0 mg/mL时起到了最佳的保护效力。
2.4 不同离子环境对Lipo/GA-ACNs纳米颗粒稳定性的影响
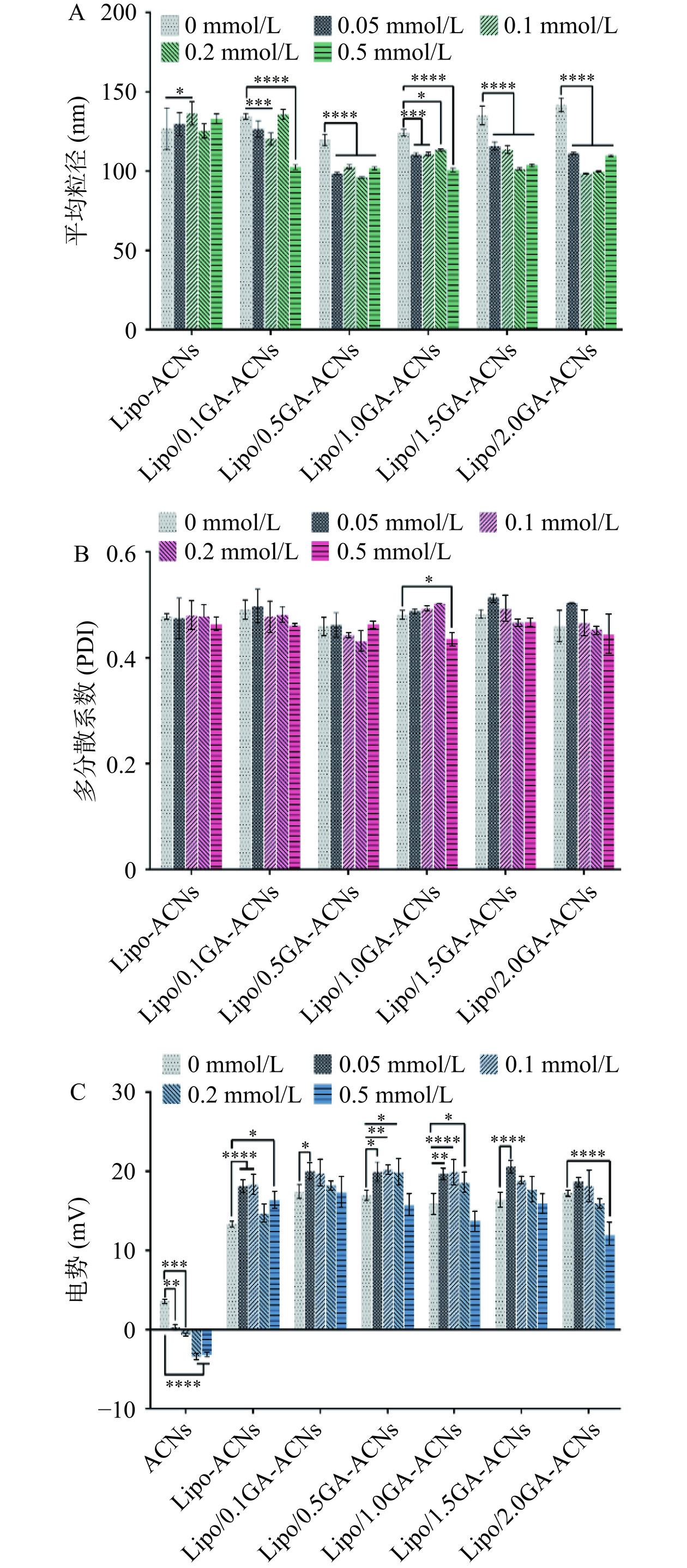
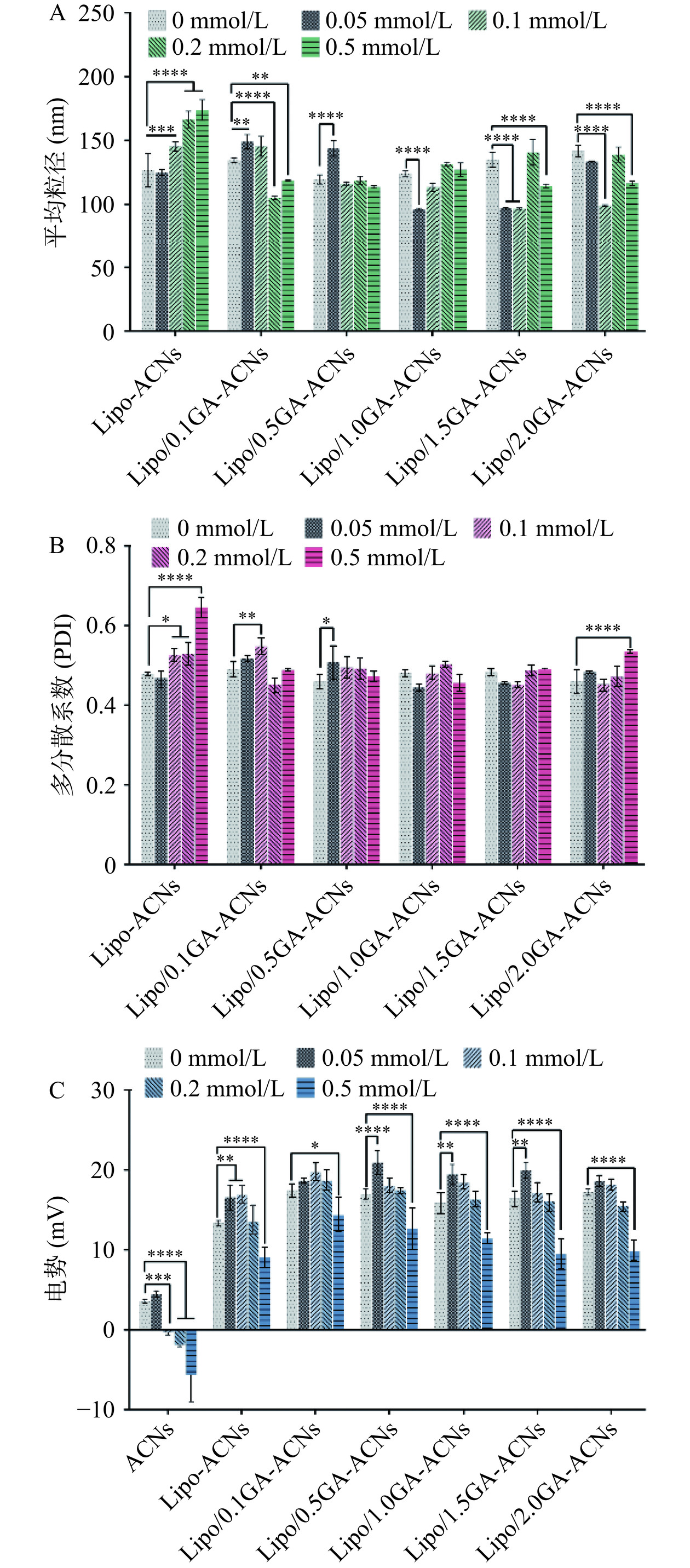
本研究评价了Na+的存在对于Lipo/GA-ACNs纳米颗粒的平均粒径(nm)、多分散系数(PDI)和表面Zeta电位(mV)稳定性的影响(图6A~图6C)。在氯化钠体系中,Na+浓度可能与纳米颗粒的平均粒径呈负相关。同时,Zeta电位的降低可能是由于Na+和纳米颗粒之间发生静电屏蔽作用,Na+的存在导致纳米颗粒之间的静电排斥减少,因此破坏纳米颗粒的稳定聚集[21,24]。从图6得到结论,在低浓度的Na+环境中,电荷屏蔽效应不足以影响Lipo/GA和ACNs之间的作用力和稳定。此外,还探索了ACNs在相同环境中的表面Zeta电位的变化,结果证明ACNs对Na+环境非常敏感,其Zeta电位随着Na+浓度的增加显著降低(P<0.0001),而Lipo/GA封装ACNs可以在一定程度上缩小这种不利影响。在K+环境中(图7A~图7C),多分散系数和Zeta电位的变化趋势与Na+环境中的变化是存在相似性的。结果表明,采用0.5和1.0 mg/mL GA封装的ACNs纳米颗粒的平均粒径在K+环境中保持相对稳定。同时,在GA浓度为1.0和1.5 mg/mL的纳米颗粒中,多分散系数并未伴随K+浓度的增加而发生具有统计学差异的变化,该现象说明GA可能通过静电吸附作用屏蔽正电荷的K+,进而促进GA在Lipo-ACNs表面的桥接和聚集[25]。最后,本研究探究了Ca2+对纳米体系的稳定性影响(图8A~图8C),当Ca2+存在时,ACNs的表面Zeta电位并没有发生显著性变化[26−27]。但对于Lipo/GA-ACNs来说,纳米颗粒的平均粒径发生了波动,GA浓度在0.1~1.0 mg/mL范围时,整体的变化趋势较小,平均粒径和多分散系数均保持相对稳定。此外,Lipo/GA-ACNs纳米颗粒在Ca2+浓度为0~0.2 mmol/L范围内保持较好的稳定性。
![]() 图 6 氯化钠对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响注:*P<0.05,**P<0.01,***P<0.001, ****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钠浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析。Figure 6. Effects of NaCl on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 6 氯化钠对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响注:*P<0.05,**P<0.01,***P<0.001, ****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钠浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析。Figure 6. Effects of NaCl on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles![]() 图 7 氯化钾对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钾浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析。Figure 7. Effects of KCl on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 7 氯化钾对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钾浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析。Figure 7. Effects of KCl on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles![]() 图 8 氯化钙对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钙浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析;ns为差异不显著。Figure 8. Effects of CaCl2 on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 8 氯化钙对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钙浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析;ns为差异不显著。Figure 8. Effects of CaCl2 on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles2.5 消化液中ACNs含量随消化时间的变化
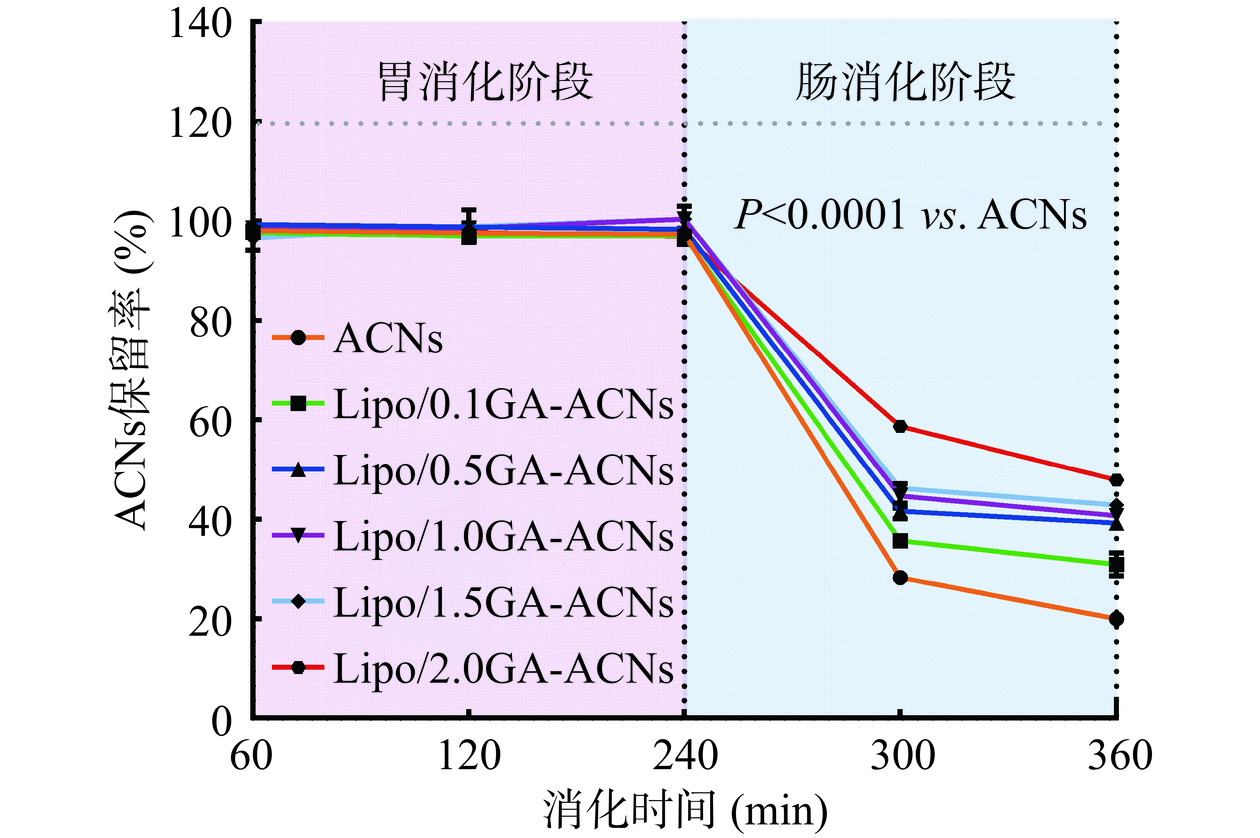
在体外模拟消化过程中,递送ACNs的纳米载体很有可能因为恶劣的pH环境以及消化酶的影响而发生降解。因此,本研究通过测定在不同模拟消化阶段ACNs的保留率来分析Lipo/GA载体对ACNs的保护作用,从而明确Lipo/GA作为ACNs递送载体的潜力和优势。在模拟胃液消化期间,ACNs和纳米颗粒中的总ACNs含量保持稳定,且在120~240 min范围内呈增加趋势,这可能是由于ACNs能够在胃酸环境下转化为糖原和类黄酮阳离子(AH+)构象[28]。在体外模拟肠液消化持续2 h后,ACNs的保留率仅为19.96%±1.45%,而Lipo/GA包覆的纳米颗粒中ACNs的保留率可随着GA浓度的增加而增加,分别为30.96%±2.36%、39.23%±0.85%、40.72%±0.40%、42.92%±0.55%和47.93%±0.81%(图9)。以上结果表明,Lipo/GA载体在体外模拟消化过程中可作为物理屏障保护ACNs被过度降解,实现ACNs在消化道中的缓释。此外,研究表明花色苷可改善高脂饮食诱导的肠道菌群失衡[29]。因此,Lipo/GA可以被视为一种良好的纳米载体,用来保护ACNs免受胃肠消化过程中恶劣环境的破坏,同时发挥肠道菌群的调节作用。
2.6 Lipo/GA-ACNs纳米颗粒的体外细胞降脂活性
2.6.1 油红O染色评估细胞脂滴积聚
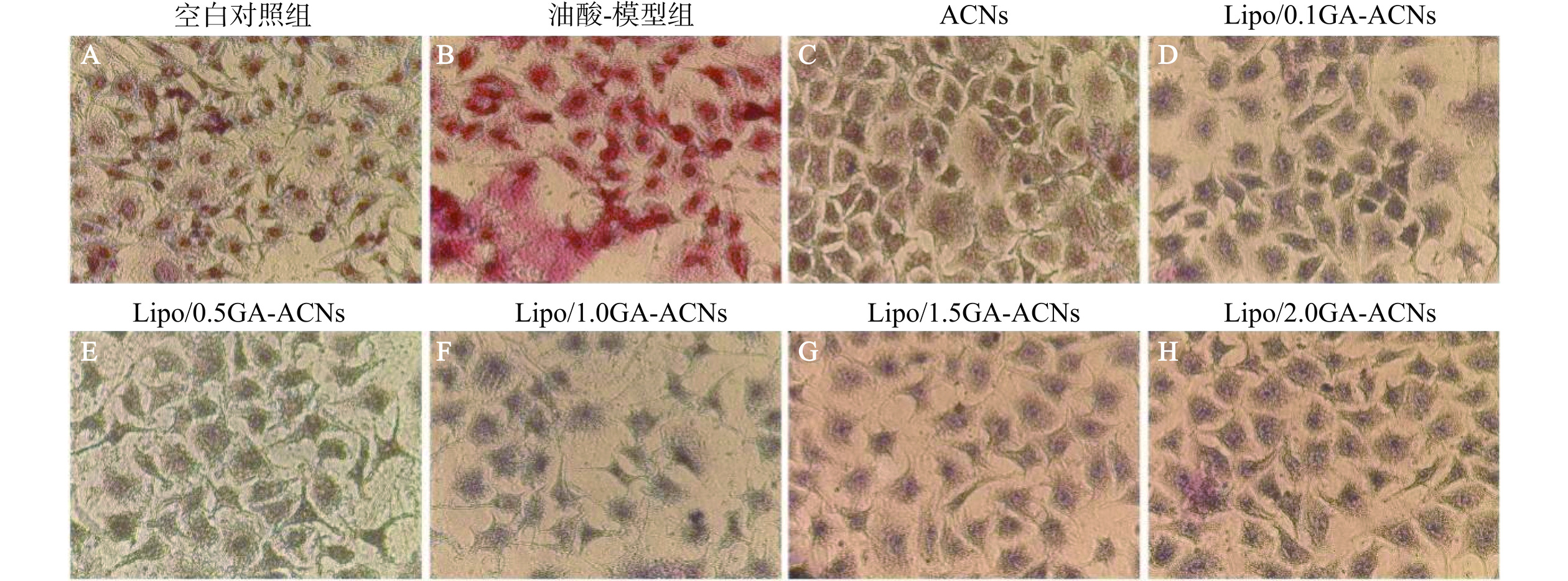
油红O染色用于评估油酸诱导的高脂HepG-2细胞模型的脂滴积聚情况,油红O可与细胞中的脂滴结合并显现为明显的红色(图10)。采用倒置光学显微镜分别400倍下观察HepG-2细胞中红色脂滴的分布。与空白对照组(图10A)相比,油酸-模型组(图10B)可观察到明显的红色脂滴聚集,细胞周围几乎被脂滴覆盖,这也表明高脂细胞模型的成功构建。用体外模拟消化后的ACNs(图10C)和Lipo/GA-ACNs纳米颗粒(图10D~图10H)处理高脂HepG-2细胞后,在ACNs组、Lipo/0.1GA-ACNs和Lipo/2.0GA-ACNs组中均可以观察到少量脂滴的存在,而在其他纳米颗粒组处理的细胞中几乎没有观察到脂滴的存在。结果表明GA修饰的Lipo-ACNs即使在经历模拟胃肠道消化后也能保留生物活性物质的降脂活性进而发挥显著的体外降脂作用,更具有优越的生物相容性。
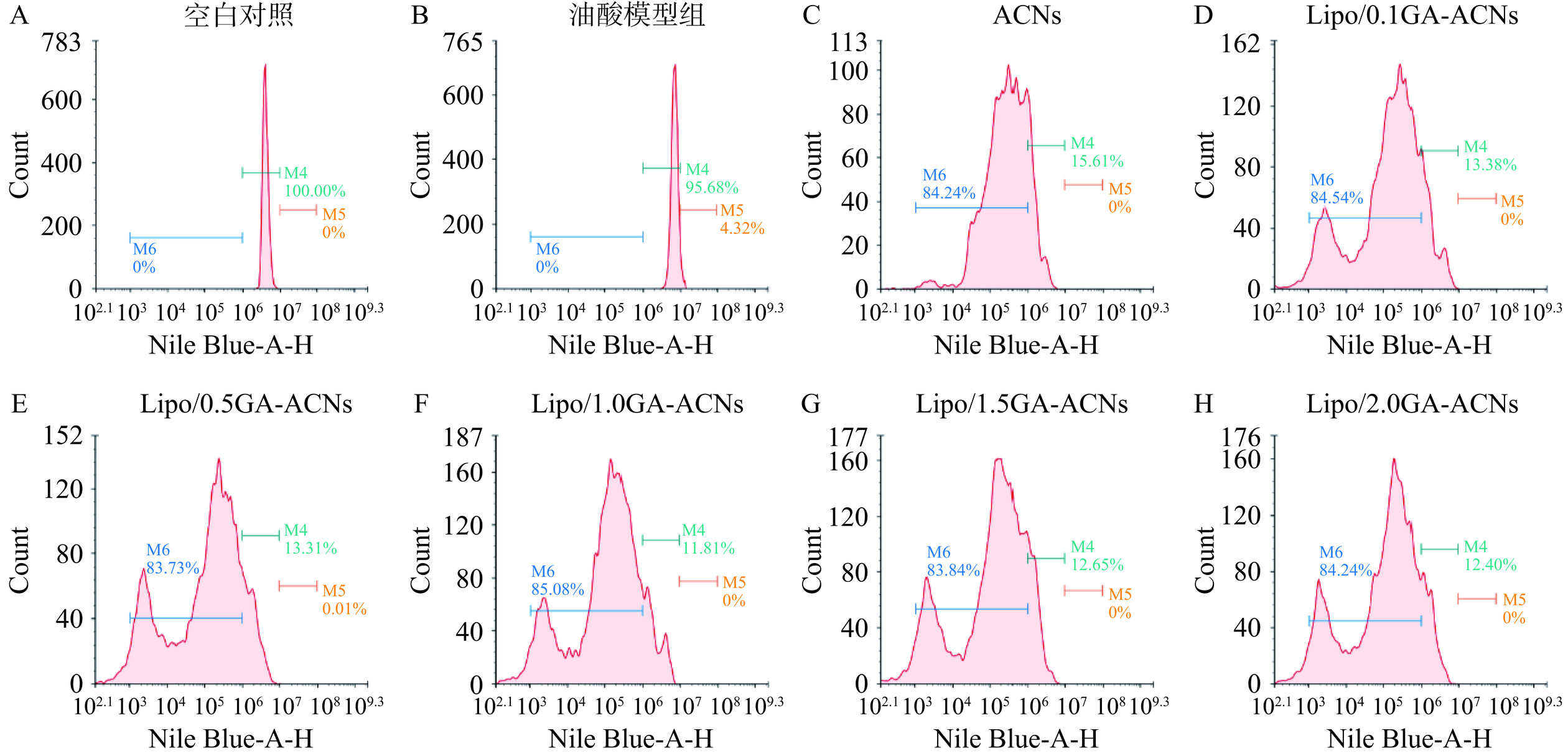
2.6.2 尼罗蓝-A染色法
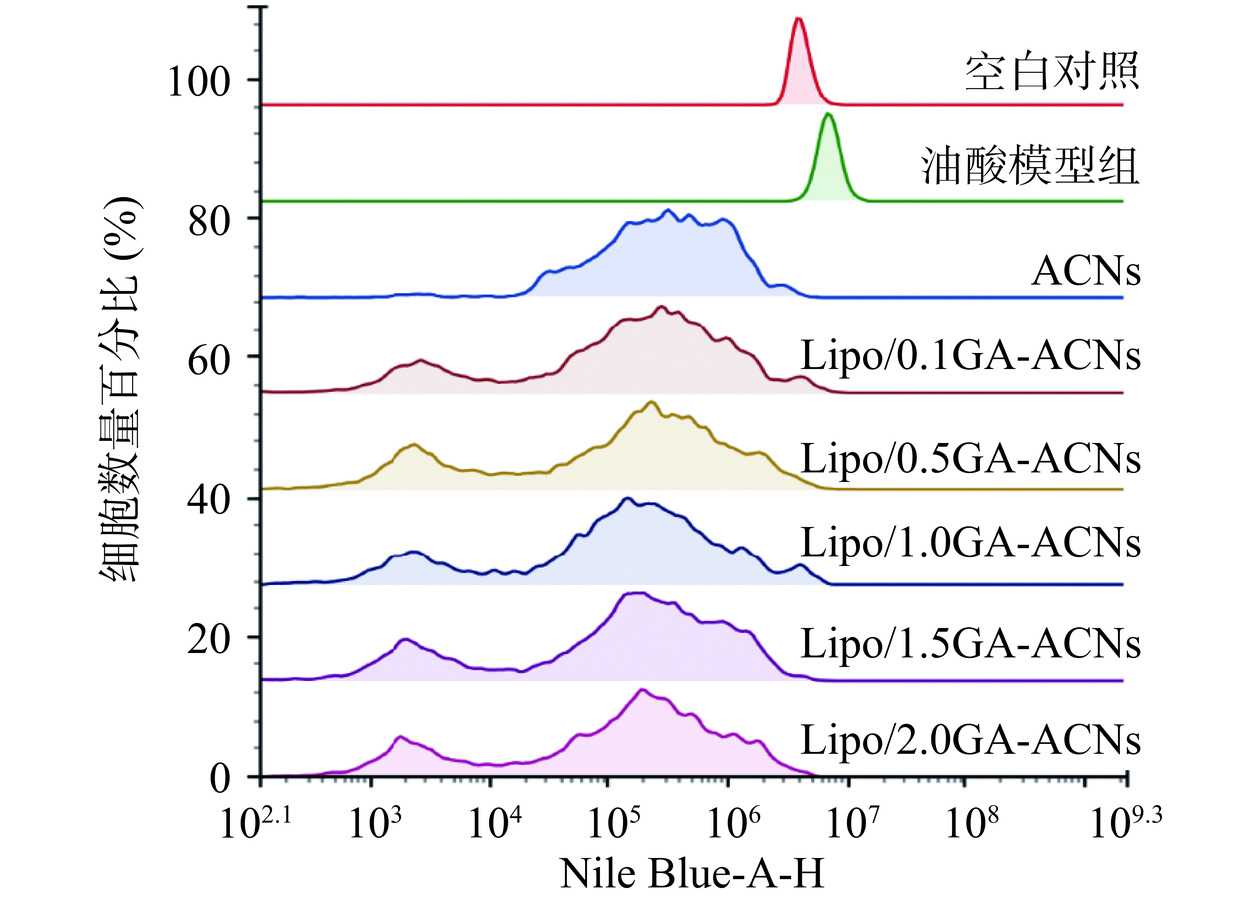
尼罗蓝-A是一种鉴定脂质含量的廉价方法,它可通过流式细胞仪分析细胞内脂质的荧光强度[30]。当尼罗蓝-A与高脂HepG-2细胞中的脂滴结合时,会产生强烈的荧光信号(右移)。在本研究中,图11的X轴为尼罗蓝-A的荧光信号强度,负向表达峰或弱势峰向左发生移动,正表达峰或强势峰向右发生移动。在本研究中,流式细胞的直方图以门M4(空白对照组的荧光信号分布区间,106~107)、M5(强荧光信号表达区间,107~108)和M6(弱荧光信号表达区间,103~106)来表达荧光信号的强度。空白对照组的荧光强度主要分布在M4区间:即106~107范围内(M4:100%,M5:0%,M6:0%),而油酸-模型组的M4区间相比于空白对照组向右移动4.32%(M4:95.68%,M5:4.32%,M6:0%),表明油酸诱导的HepG-2细胞中存在大量的脂滴积聚并与尼罗蓝-A结合产生强烈的荧光信号。当采用体外模拟消化后,ACNs及Lipo/GA-ACNs纳米颗粒处理诱导的高脂HepG-2细胞时,荧光信号强度均向左移动,M6区间分别为84.24%、84.54%、83.73%、85.08%、83.84%和84.24%。Lipo/1.0GA-ACNs相比于其他组所产生的M6区间面积最大,为85.08%,这表明1.0 mg/mL的GA封装的ACNs纳米颗粒起到相对最佳的降脂效果。此外,归一化叠加图(图12)也证明,在抑制高脂HepG-2细胞脂滴积聚方面,消化后的纳米颗粒相比消化后的ACNs均发生了峰值左移和产生弱势峰的现象,以上结果均证明消化后的ACNs纳米颗粒可以更好地发挥降脂效果,有必要进一步探索它们是否可以通过有效的肝脏靶向发挥优越的降脂能力。
2.7 Lipo/GA-ACNs纳米颗粒对HepG-2细胞活性氧堆积的抑制作用
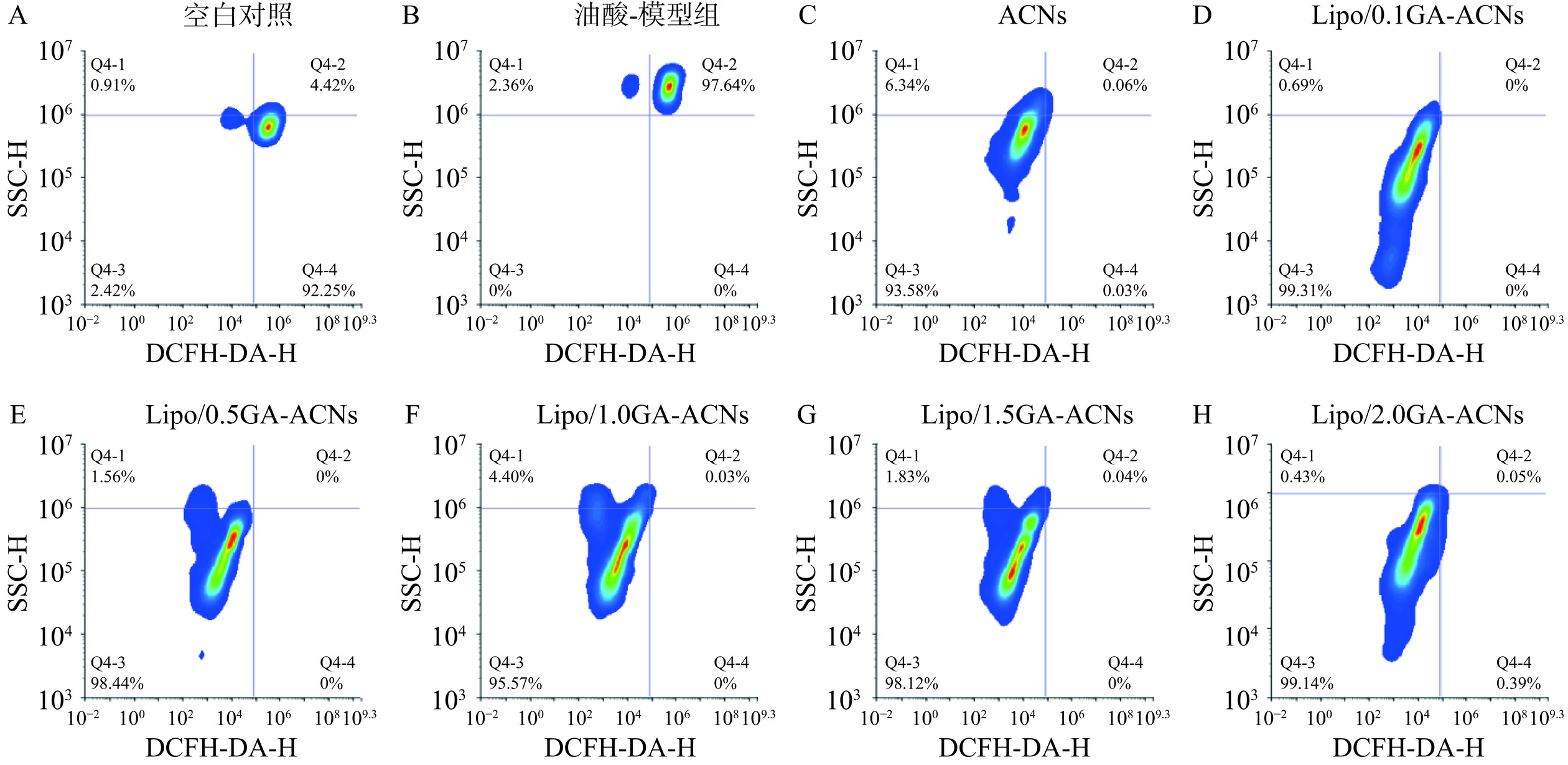
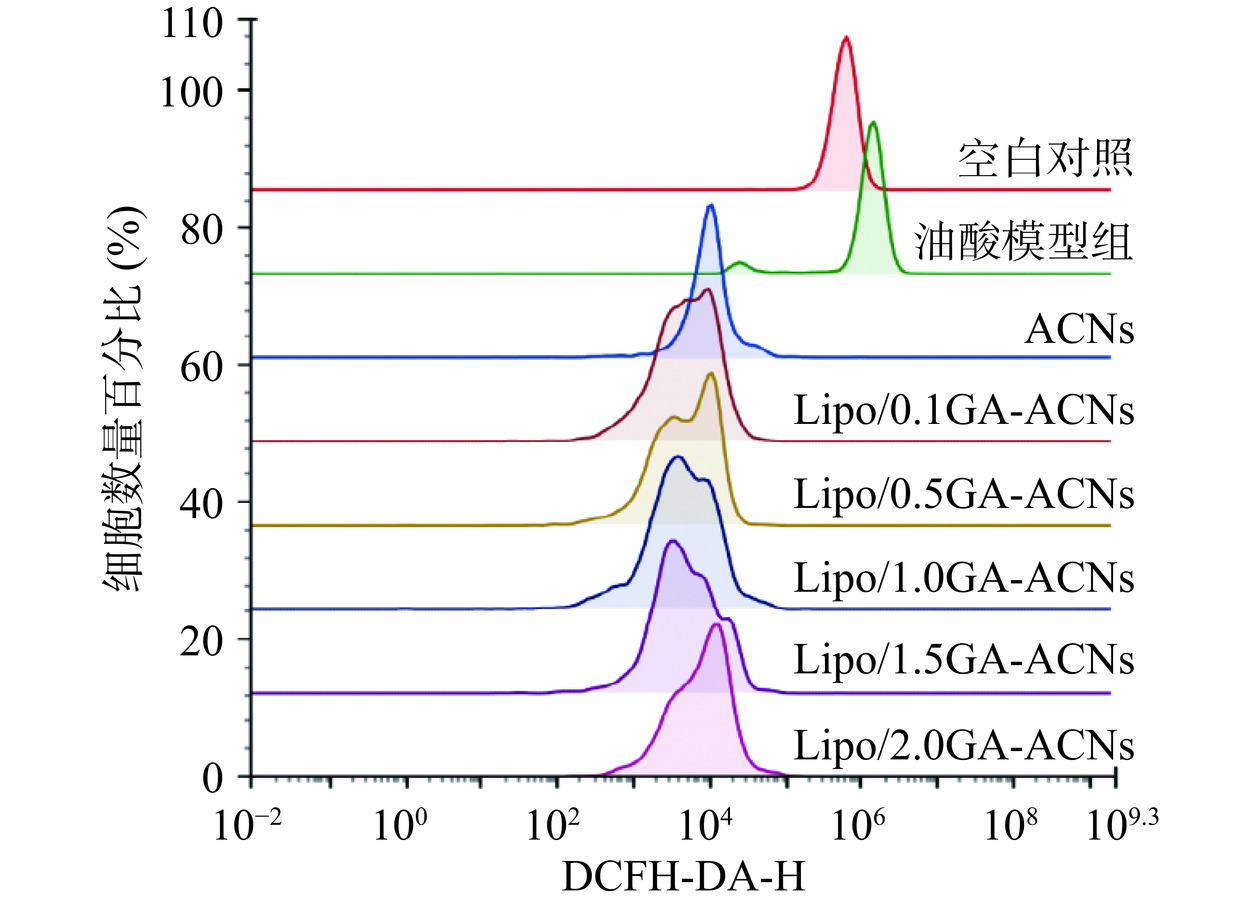
为了进一步探究相比于ACNs,模拟消化后的Lipo/GA-ACNs纳米颗粒能否更有效地发挥抑制HepG-2细胞中活性氧积聚的能力,本研究使用DCFH-DA荧光探针对活性氧进行标记[31−33]。结果表明,油酸-模型组的活性氧荧光强度97.64%分布于Q4-2象限,明显高于空白对照组(44.42%),无论是ACNs还Lipo/GA-ACNs,对油酸诱导的HepG-2细胞进行干预后均会抑制活性氧的积聚,但是纳米颗粒处理组的荧光强度分布在Q4-3的比例均显著高于ACNs处理组(图13)。流式细胞术峰面积叠加图表明(图14)Lipo/GA-ACNs对油酸诱导的HepG-2细胞中活性氧积聚的抑制作用优于ACNs,尤其当GA的质量浓度为1.0和1.5 mg/mL时,荧光强度的直方图峰值向左侧弱势峰偏移的趋势更明显。综上,将ACNs封装到Lipo/GA载体中,即使在消化后依然可以较好发挥保护细胞受到活性氧破坏的作用,有潜力应用于缓解油酸诱导的细胞中氧化应激现象。
![]() 图 13 DCFH-DA染色法鉴定Lipo/GA-ACNs纳米颗粒对细胞活性氧的抑制作用注:横坐标代表DCFH-DA的荧光信号强度,纵坐标代表SSC(侧向散射光:Side Scatter,SSC);细胞计数以密度图轮廓图的形式显示;象限标记将散点图分为四个部分,右上象限(Q4-2)表示DCFH-DA荧光标记为阳性的细胞,左下象限(Q4-3)表示荧光信号为负的细胞,左上象限(Q4-1)和右下象限(Q4-4)则分别代表只对y轴参数或x轴参数标记为正的细胞。Figure 13. Identification of the inhibitory effects of Lipo/GA-ACNs nanoparticles on cellular reactive oxygen species using DCFH-DA staining method
图 13 DCFH-DA染色法鉴定Lipo/GA-ACNs纳米颗粒对细胞活性氧的抑制作用注:横坐标代表DCFH-DA的荧光信号强度,纵坐标代表SSC(侧向散射光:Side Scatter,SSC);细胞计数以密度图轮廓图的形式显示;象限标记将散点图分为四个部分,右上象限(Q4-2)表示DCFH-DA荧光标记为阳性的细胞,左下象限(Q4-3)表示荧光信号为负的细胞,左上象限(Q4-1)和右下象限(Q4-4)则分别代表只对y轴参数或x轴参数标记为正的细胞。Figure 13. Identification of the inhibitory effects of Lipo/GA-ACNs nanoparticles on cellular reactive oxygen species using DCFH-DA staining method3. 结论
本研究设计并制备了Lipo/GA载体,探究不同质量浓度的GA制备的lipo/GA载体对ACNs体外稳定性和降脂活性的影响。结果表明Lipo/GA的加入促进了自组装ACNs纳米颗粒的形成及其在模拟加工体系和体外模拟消化过程中稳定性的提高。此外,相比于ACNs,消化后的Lipo/1.0GA-ACNs纳米颗粒对油酸诱导的高脂HepG-2细胞脂滴积聚和氧化应激的抑制作用更显著。以上结果表明,消化后的Lipo/1.0GA-ACNs纳米颗粒具有比ACNs更好的生物相容性和被细胞摄取的能力。综上所述,Lipo/1.0GA具有递送ACNs并应用于肝脏、实现特异性降脂的潜力。后续研究将通过添加靶向材料来评估Lipo/GA载体封装的ACNs纳米颗粒在体内的肝脏靶向能力及其具体的降脂作用机制,从而实现纳米颗粒的精准肝脏递送。
-
图 3 90 ℃加热对Lipo/GA-ACNs纳米颗粒(A)平均粒径、(B)多分散系数及(C)电势的影响
注:*P<0.05,**P<0.01,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在加热过程中30、60和90 min与初始时间(0 min)的显著性差异比较分析。
Figure 3. Effects of heating at 90 ℃ on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 6 氯化钠对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响
注:*P<0.05,**P<0.01,***P<0.001, ****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钠浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析。
Figure 6. Effects of NaCl on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 7 氯化钾对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响
注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钾浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析。
Figure 7. Effects of KCl on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 8 氯化钙对Lipo/GA-ACNs纳米颗粒平均粒径(A)、多分散系数(B)及电势(C)的影响
注:*P<0.05,**P<0.01,***P<0.001,****P<0.0001为Lipo-ACNs、Lipo/0.1GA-ACNs、 Lipo/0.5GA-ACNs、Lipo/1.0GA-ACNs、Lipo/1.5GA-ACNs和Lipo/2.0GA-ACNs在氯化钙浓度为0.05、0.1、0.2和0.5 mmol/L与初始浓度(0 mmol/L)的显著性差异比较分析;ns为差异不显著。
Figure 8. Effects of CaCl2 on the average particle size (A), polydispersity index (B) and zeta potential (C) of Lipo/GA-ACNs nanoparticles
图 13 DCFH-DA染色法鉴定Lipo/GA-ACNs纳米颗粒对细胞活性氧的抑制作用
注:横坐标代表DCFH-DA的荧光信号强度,纵坐标代表SSC(侧向散射光:Side Scatter,SSC);细胞计数以密度图轮廓图的形式显示;象限标记将散点图分为四个部分,右上象限(Q4-2)表示DCFH-DA荧光标记为阳性的细胞,左下象限(Q4-3)表示荧光信号为负的细胞,左上象限(Q4-1)和右下象限(Q4-4)则分别代表只对y轴参数或x轴参数标记为正的细胞。
Figure 13. Identification of the inhibitory effects of Lipo/GA-ACNs nanoparticles on cellular reactive oxygen species using DCFH-DA staining method
表 1 负载花色苷的脂质体-阿拉伯树胶纳米颗粒的平均粒径、多分散系数和Zeta电位
Table 1 Mean particle size, polydispersity index, and zeta potential of liposome/gum Arabic nanoparticles loaded with anthocyanins
纳米颗粒 平均粒径(nm) 多分散系数(PDI) Zeta电位(mV) Lipo/0.1GA-ACNs 100.90±0.24 0.469±0.006 19.80±1.36 Lipo/0.5GA-ACNs 105.40±0.64 0.489±0.007 18.20±2.18 Lipo/1.0GA-ACNs 99.97±0.82 0.459±0.013 17.90±0.50 Lipo/1.5GA-ACNs 121.10±0.77 0.518±0.009 15.30±0.56 Lipo/2.0GA-ACNs 130.60±1.22 0.513±0.021 14.80±1.15 -
[1] LI J, YU H Y, WANG S J, et al. Natural products, an important resource for discovery of multitarget drugs and functional food for regulation of hepatic glucose metabolism[J]. Drug Design Development and Therapy,2018,12:121−135. doi: 10.2147/DDDT.S151860
[2] JIAO X Y, WANG Y H, LIN Y, et al. Blueberry polyphenols extract as a potential prebiotic with anti-obesity effects on C57BL/6 J mice by modulating the gut microbiota[J]. Journal of Nutritional Biochemistry,2019,64:88−100. doi: 10.1016/j.jnutbio.2018.07.008
[3] FANG J. Bioavailability of anthocyanins[J]. Drug Metabolism Reviews,2014,46(4):508−520. doi: 10.3109/03602532.2014.978080
[4] 马小强, 白卫滨, 陈嘉莉, 等. 花色苷递送系统研究进展[J]. 食品科学,2022,43(7):245−253. [MA X Q, BAI W B, CHEN J L, et al. Progress in the delivery system for anthocyanins[J]. Food Science,2022,43(7):245−253.] doi: 10.7506/spkx1002-6630-20210310-130 MA X Q, BAI W B, CHEN J L, et al. Progress in the delivery system for anthocyanins[J]. Food Science, 2022, 43(7): 245−253. doi: 10.7506/spkx1002-6630-20210310-130
[5] 藏志焕, 丑述睿, 唐思懿, 等. 花色苷与蛋白质相互作用的研究进展[J]. 食品科学,2023,44(1):319−326. [ZANG Z H, CHOU S R, TANG S Y, et al. Advances in understanding of the interaction between anthocyanins and proteins[J]. Food Science,2023,44(1):319−326.] doi: 10.7506/spkx1002-6630-20220123-232 ZANG Z H, CHOU S R, TANG S Y, et al. Advances in understanding of the interaction between anthocyanins and proteins[J]. Food Science, 2023, 44(1): 319−326. doi: 10.7506/spkx1002-6630-20220123-232
[6] GUI H L, LI B, TIAN J L, et al. Current knowledge of anthocyanin metabolism in the digestive tract:absorption, distribution, degradation, and interconversion[J]. Critical Reviews in Food Science and Nutrition,2022,63(22):5953−5966.
[7] BOETTGER R, PAULI G, CHAO P, et al. Lipid-based nanoparticle technologies for liver targeting[J]. Advanced Drug Delivery Reviews,2020,154:79−101.
[8] ZHAO Y Z, ZHANG L, GUPTA P K, et al. Using pg-liposome-based system to enhance puerarin liver-targeted therapy for alcohol-induced liver disease[J]. AAPS Pharmscitech,2016,17(6):1376−1382. doi: 10.1208/s12249-015-0427-5
[9] LI W J, LIAN Y W, GUAN Q S, et al. Liver-targeted delivery of liposome-encapsulated curcumol using galactosylated-stearate[J]. Experimental and Therapeutic Medicine,2018,16(2):925−930.
[10] WANG Z H, SUN M Q, LI W, et al. A novel cd133- and epcam-targeted liposome with redox-responsive properties capable of synergistically eliminating liver cancer stem cells[J]. Frontiers in Chemistry,2020,8:649. doi: 10.3389/fchem.2020.00649
[11] SAHLI A, CANSELL M, TAPON-BRETAUDIERE J, et al. The stability of heparin-coated liposomes in plasma and their effect on its coagulation[J]. Colloids and Surfaces B-Biointerfaces,1998,10(4):205−215. doi: 10.1016/S0927-7765(97)00062-3
[12] ASHOUR M A, FATIMA W, IMRAN M, et al. A review on the main phytoconstituents, traditional uses, inventions, and patent literature of gum arabic emphasizing acacia seyal[J]. Molecules,2022,27(4):1171. doi: 10.3390/molecules27041171
[13] BARBERIO A E, SMITH S G, CORREA S, et al. Cancer cell coating nanoparticles for optimal tumor-specific cytokine delivery[J]. ACS Nano,2020,14(9):11238−11253. doi: 10.1021/acsnano.0c03109
[14] AI H, JONES S A, LVOV Y M. Biomedical applications of electrostatic layer-by-layer nano-assembly of polymers, enzymes, and nanoparticles[J]. Cell Biochemistry and Biophysics,2003,39(1):23−43. doi: 10.1385/CBB:39:1:23
[15] CHOI D, HONG J. Layer-by-layer assembly of multilayer films for controlled drug release[J]. Archives of Pharmacal Research,2014,37(1):79−87. doi: 10.1007/s12272-013-0289-x
[16] CHENG Z, WANG J X, BIAN Y Y, et al. Oral polysaccharide-coated liposome-modified double-layered nanoparticles containing anthocyanins:preparation, characterization, bbiocompatibility and evaluation of lipid-lowering activity in vitro[J]. Food Chemistry, 2024, 439.
[17] CUI H J, SI X, TIAN J L, et al. Anthocyanins-loaded nanocomplexes comprising casein and carboxymethyl cellulose:stability, antioxidant capacity, and bioaccessibility[J]. Food Hydrocolloids,2022,122:107073. doi: 10.1016/j.foodhyd.2021.107073
[18] JEONG D, NA K. Chondroitin sulfate based nanocomplex for enhancing the stability and activity of anthocyanin[J]. Carbohydrate Polymers,2012,90(1):507−515. doi: 10.1016/j.carbpol.2012.05.072
[19] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food Function,2014,5(6):1113−1124. doi: 10.1039/C3FO60702J
[20] VIDYASHANKAR S, VARMA R S, PATKI P S, et al. Quercetin ameliorate insulin resistance and up-regulates cellular antioxidants during oleic acid induced hepatic steatosis in HepG2 cells[J]. Toxicology in Vitro,2013,27(2):945−953. doi: 10.1016/j.tiv.2013.01.014
[21] SUN Y X, SHI F F, NIU Y J, et al. Fe3O4@OA@Poloxamer nanoparticles lower triglyceride in hepatocytes through liposuction effect and nano-enzyme effect[J]. Colloids and Surfaces B-Biointerfaces,2019,184:110528. doi: 10.1016/j.colsurfb.2019.110528
[22] LIU C, GUO H, DAINE A J, et al. Cytoprotective effects of a proprietary red maple leaves extract and its major polyphenol, ginnalin a, against hydrogen peroxide and methylglyoxal induced oxidative stress in human keratinocytes[J]. Food Function,2020,11(6):5105−5114. doi: 10.1039/D0FO00359J
[23] WEI Y, GUO A X, LIU Z K, et al. Structural design of zein-cellulose nanocrystals core-shell microparticles for delivery of curcumin[J]. Food Chemistry,2021,357:129849. doi: 10.1016/j.foodchem.2021.129849
[24] 段智颖, 王申宛, 艾斌凌, 等. 表没食子儿茶素没食子酸酯-香蕉脱支淀粉纳米颗粒的绿色制备及其性质[J]. 食品科学,2023,44(12):74−83. [DUAN Z Y, WANG S W, AI B L, et al. Green preparation and properties of epigallocatechin-3-gallate loaded debranched banana starch nanoparticles[J]. Food Science,2023,44(12):74−83.] doi: 10.7506/spkx1002-6630-20220921-210 DUAN Z Y, WANG S W, AI B L, et al. Green preparation and properties of epigallocatechin-3-gallate loaded debranched banana starch nanoparticles[J]. Food Science, 2023, 44(12): 74−83. doi: 10.7506/spkx1002-6630-20220921-210
[25] SHISHIR M R I, KARIM N, GOWD V, et al. Pectin-chitosan conjugated nanoliposome as a promising delivery system for neohesperidin:Characterization, release behavior, cellular uptake, and antioxidant property[J]. Food Hydrocolloids,2019,95:432−444. doi: 10.1016/j.foodhyd.2019.04.059
[26] 李颖畅, 孟宪军, 周艳, 等. 金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J]. 食品科学,2009,30(9):80−84. [LI Y C, MENG X J, ZHOU Y, et al. Effects of metal ions and food additives on stability of anthocyanins from blueberry[J]. Food Science,2009,30(9):80−84.] doi: 10.3321/j.issn:1002-6630.2009.09.019 LI Y C, MENG X J, ZHOU Y, et al. Effects of metal ions and food additives on stability of anthocyanins from blueberry[J]. Food Science, 2009, 30(9): 80−84. doi: 10.3321/j.issn:1002-6630.2009.09.019
[27] SUN J X, CHEN J L, BAI W B, et al. Synthesis, structural characterization, and evaluation of cyanidin-3-Oglucoside-loaded chitosan nanoparticles[J]. Food Chemistry,2020,330:127239. doi: 10.1016/j.foodchem.2020.127239
[28] HAN F L, YANG P, WANG H, et al. Digestion and absorption of red grape and wine anthocyanins through the gastrointestinal tract[J]. Trends in Food Science & Technology,2018,83:211−224.
[29] CHENG Z, WANG Y H, LI B. Dietary polyphenols alleviate autoimmune liver disease by mediating the intestinal microenvironment:challenges and hopes[J]. Journal of Agricultural & Food Chemistry,2022,70(35):10708−10737.
[30] MAEKAWA M, FAIRN G D. Molecular probes to visualize the location, organization and dynamics of lipids[J]. Journal of Cell Science,2014,127(22):4801−4812.
[31] CHEN S N, CHE S Y, LI S Q, et al. The combined impact of decabromodiphenyl ether and high fat exposure on non-alcoholic fatty liver disease in vivo and in vitro[J]. Toxicology,2021,464:153015. doi: 10.1016/j.tox.2021.153015
[32] FENF D, ZHOU S Q, WANG J, et al. Effect of total glycosides of Cistanche deserticola on the energy metabolism of human HepG2 cells[J]. Frontiers in Nutrition,2023,6(10):1117364.
[33] AZAR K A H M, EZHILARASAN D, HARINI K S. Coleus vettiveroides ethanolic root extract induces cytotoxicity by intrinsic apoptosis in HepG2 cells[J]. Journal of Applied Toxicology,2023,44(2):245−259.
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:


 下载:
下载:



