Mechanism of Poria cocos Polysaccharide Regulating Autophagy and Chemotherapy Resistance of Hepatocellular Carcinoma Cells through LncRNAHCG11/miR-539-3p 539-3p
-
摘要: 目的:探讨茯苓多糖(Poria cocos polysaccharide,PCP)对肝癌细胞增殖、自噬和化疗耐药的影响及机制。方法:对数期HepG-2/DDP细胞随机分组:对照组、PCP组(7.5、15、30 µg/mL PCP)、shNC 组、HCG11 siRNA组(转染50 nmol/L HCG1干扰序列)、pcDNA组(转染2 µg pcDNA)、pcDNA3.1-HCG11组(转染2 µg pcDNA3.1-HCG11)、PCP组(30 µg/mL)和PCP+pcDNA3.1-HCG11组(转染2 µg pcDNA3.1-HCG11+30 µg/mL PCP)。MTT检测肝癌细胞耐药情况和抑制率,Western blot检测Beclin-1、LC3 I和LC3 II水平,实时荧光定量PCR(Real time quantitative PCR,qRT-PCR)检测细胞株中LncRNA HCG11和miR-539-3p的水平,双荧光素酶报告实验检测LncRNA HCG11和miR-539-3p的靶向关系,裸鼠成瘤实验验证体内瘤体的瘤重、瘤体积及自噬相关蛋白水平。结果:4~128 µg/mL PCP抑制HepG-2/DDP细胞增殖,7.5、15、30 µg/mL的PCP能显著降低HepG-2/DDP细胞中MRP1、P-gp、Beclin-1、LC3II的水平,下调HCG11水平,增加miR-539-3p的表达水平(P<0.01);与对照组比较,HCG11 siRNA 组HepG-2/DDP细胞HCG11相对表达水平、IC50(顺铂)、Beclin-1、LC3 II/ LC3 I比值显著降低,miR-539-3p水平和抑制率(顺铂)显著增加(P<0.01);与PCP组比较,PCP+pcDNA3.1-HCG11处理组HCG11相对表达水平显著升高,Belin-1、LC3 II/LC3 I比值显著增加(P<0.01);在不同浓度的顺铂处理下,与PCP组比较,PCP+pcDNA3.1-HCG11 组抑制率显著降低(P<0.01);与PCP组比较,PCP+HCG11 shRNA 组肿瘤体积和肿瘤重量显著降低,Belin-1、LC3 II/LC3 I水平显著下调(P<0.05)。结论:PCP能通过LncRNA HCG11/miR-539-3p调控耐药和自噬,并影响肝癌细胞的增殖。
-
关键词:
- 茯苓多糖 /
- LncRNA HCG11 /
- miR-539-3p /
- 化疗耐药性 /
- 自噬
Abstract: Objective: To explore the effects and mechanism of Poria cocos polysaccharide (PCP) on proliferation, autophagy and chemotherapy resistance of hepatocellular carcinoma cells. Methods: HepG-2/DDP cells in logarithmic phase were randomly divided into control group, PCP group (7.5, 15, 30 μg/mL PCP), shNC group, HCG11 siRNA group (transfection of 50 nmol/L HCG1 interference sequence), pcDNA group (transfection of 2 μg pcDNA), pcDNA3.1-HCG11 group (transfection of 2 μg pcDNA3.1-HCG11), PCP group (30 μg/mL PCP) and PCP+pcDNA3.1-HCG11 group (transfection of 2 μg pcDNA3.1-HCG11+30 μg/mL PCP). MTT assay was used to detect the drug resistance and inhibition rate of hepatocellular carcinoma cells, western blot was used to detect the levels of Beclin-1, LC3, and quantitative real time polymerase chain reaction (qRT-PCR) was used to detect the levels of LncRNA HCG11 and miR-539-3p in the cell lines. Double luciferase report experiment was used to detect the targeting relationship between LncRNA HCG11 and miR-539-3p, and nude mice tumorigenesis experiment was used to verify the influence of tumor weight, tumor volume and autophagy-related protein level in nude mice. Results: 4~128 µg/mL PCP had a certain inhibitory effect on HepG-2/DDP cells. PCP of 7.5, 15, 30 μg/mL could significantly decrease the levels of MRP1, P-gp, Beclin-1 and LC3II, decrease the level of HCG11 and increase the expression of miR-539-3p in HepG-2/DDP cells (P<0.01). Compared with the control group, the relative expression level of HCG11, IC50 (cisplatin), Beclin-1 and LC3II/LC3I in HCG11siRNA group decreased significantly, while the level of miR-539-3p and inhibition rate (cisplatin) increased significantly (P<0.01). Compared with PCP group, the relative expression level of HCG11 in PCP+pcDNA3.1-HCG11 group increased significantly, while the ratio of Belin-1 and LC3 II/LC3 I increased significantly (P<0.01). Compared with PCP group, the inhibition rate of PCP+pcDNA3.1+HCG11 group was significantly decreased under different concentrations of cisplatin (P<0.01). Compared with PCP group, tumor volume and tumor weight in PCP+HCG11shRNA group were significantly decreased, and the levels of Belin-1 and LC3II/LC3I were significantly decreased (P<0.05). Conclusion: PCP can affect the proliferation of hepatocellular carcinoma cells by regulating drug resistance and autophagy through LncRNA HCG11/miR-539-3p.-
Keywords:
- Poria cocos polysaccharide /
- LncRNA HCG11 /
- miR-539-3p /
- chemotherapy resistance /
- autophagy
-
自噬是细胞维持稳态的一种机制,在饥饿、营养缺乏或生长因子枯竭的条件下可以降解微生物、受损的细胞器和无法被蛋白酶体降解的受损蛋白质[1−2];相反,自噬可通过破坏细胞的基本成分诱导癌细胞凋亡和死亡,是肿瘤治疗的一种有效方法[3]。
研究表明,长链非编码RNA HLA复合物11(Long non-coding RNA HCG11,LncRNA HCG11)在许多癌组织样本中异常表达,参与肿瘤的进展,与预后不良有关[4−5],并可通过自噬相关蛋白ATG12调控自噬[6]。研究显示,miR-539-3p是一组小的、长度为18~25个核苷酸的非编码 RNA,可在转录后负调控目标基因的异常表达,抑制肝细胞癌迁移和侵袭[7],但其与肝细胞癌的自噬和耐药性相关研究较少。
茯苓(Poria cocos)是一种功能性食药用真菌,茯苓多糖(Poria cocos polysaccharide,PCP)是茯苓的主要活性成分,具有中等分子量和良好的水溶性,主要由核糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成[8]。先前的研究已经显示PCP的免疫调节以及抗肿瘤活性[9],但其对肝癌自噬、耐药性的影响仍不清楚。另外本课题组前期预实验已经发现,HCG11的3'非翻译区(UTR)存在miR-539-3p的结合位点,但茯苓多糖能否通过LncRNA HCG11/miR-539-3p发挥作用仍不清楚。本研究主要探讨茯苓多糖对肝癌细胞以及体内肿瘤的影响,并分析其与LncRNA HCG11/miR-539-3p信号通路的关系,明确其机制。
1. 材料与方法
1.1 材料与仪器
BALB/c裸鼠 SPF级,雄性,80只,5~6周龄,体重(16~20 g) 购自中国科学院上海动物实验中心,动物合格证号SCXK(沪)2017-0005,并经漯河医学高等专科学校实验动物伦理委员会审批,审批号:20220017;人肝癌HepG-2、HepG-2/DDP 均购自中国科学院上海细胞生物学研究所;SMMC-7721、Huh7、Bel-7405细胞株 齐氏生物科技有限公司。正常人永生化肝细胞L-02 中国科学院细胞库;茯苓 北京同仁堂;Trizol 试剂、兔抗人LC3、Beclin-1、MRP1、P-gp抗体、HRP标记的羊抗兔IgG二抗 上海碧云天生物技术有限公司;CFX系统SYBR混合液 美国Invitrogen公司;MTT细胞活力检测试剂盒 南京建成生物研究所;miR-NC、miR-539-3p mimics、HCG11 siRNA、siNC 北京科忠智生物技术开发有限公司;慢病毒 shRNA NC、HCG11 shRNA 稳转试剂盒 上海剑钝生物科技有限公司;WT、MUT荧光素报告载体 上海吉玛制药技术有限公司。
CKX41-C31B倒置荧光显微镜 奥林巴斯有限公司;ELx800全自动酶标仪 美国BioTek公司;免疫印迹化学发光成像系统 中国Tanon公司;CFX96 荧光定量PCR仪 美国Bio-Rad公司;CO2细胞培养箱 美国Thermo公司。
1.2 实验方法
1.2.1 茯苓多糖提取
参考文献[10]的提取方法,用1000 mL蒸馏水提取500 g过40目的粉碎的茯苓粉末24 h,然后加入终体积浓度为80%的乙醇溶液,置于4 ℃下24 h。在2000 r/min 离心15 min后,通过Sevage方法去除沉淀物中的蛋白质。然后通过透析除去分子量<3500 Da的杂质。最后,通过冷冻干燥获得茯苓多糖。采用苯酚-硫酸法检测茯苓多糖的浓度[11],其浓度为93.42%±0.12%。
1.2.2 细胞培养
肝癌HepG-2、HepG-2/DDP、SMMC-7721、Huh7、Bel-7405细胞株和人永生化肝细胞L-02均采用含10%胎牛血清的DMEM培养基,在CO2培养箱中孵育,细胞融合至85%左右,0.25%胰酶消化传代[12]。
1.2.3 MTT检测肝癌细胞耐药情况
选取对数生长期肝癌HepG-2、HepG-2/DDP细胞(5×103/孔)接种到96孔板,细胞贴壁后,更换含有0、5、10、20、30和40 μg/mL顺铂的培养基培养48 h,每孔加入20 μL MTT溶液,置于37 ℃、5%的CO2培养箱温育4 h。然后每孔加入200 µL二甲基亚砜(DMSO),酶标仪检测490 nm处的OD值[13]。根据下式计算细胞抑制率。
1.2.4 MTT法分析PCP对HepG-2/DDP细胞抑制率
选择对数生长期HepG-2/DDP细胞接种96孔板(5×103个/孔),贴壁后,加入终浓度分别为0、4、8、16、32、64、128 µg/mL PCP,同时只加培养基和细胞作为对照组,每组3个复孔,孵育48 h。向每个孔中加入20 µL MTT溶液,置于37 ℃ CO2培养箱温育4 h。然后将200 µL二甲基亚砜(DMSO)添加到每个孔中。采用酶标仪检测490 nm处的OD值并分析抑制率。
1.2.5 茯苓多糖对HepG-2/DDP细胞耐药的影响
设置顺铂组和顺铂+PCP(7.5 µg/mL)组,两大组均加入含有终浓度为0、5、10、20、30和40 μg/mL顺铂的培养基,在此基础上,顺铂+PCP(7.5 µg/mL)组加入终浓度为7.5 µg/mL PCP,培养48 h,MTT法分析抑制率。
1.2.6 Western blot检测耐药相关蛋白水平
将HepG-2/DDP细胞分为对照组(培养基和细胞)、PCP组(7.5、15、30 µg/mL PCP),培养48 h。采用添加了蛋白酶抑制剂的RIPA裂解液裂解细胞,BCA™试剂盒定量。使用Bio-Rad Bis-Tris Gel系统建立Western blot系统,并将所有印迹转移到聚偏二氟乙烯(PVDF)膜上,并与MRP1(1:1000)、P-gp(1:1000)、Beclin-1(1:2000)、LC3(1:2000)一抗在4 ℃下孵育过夜,TBST洗涤三次,并与以辣根过氧化物酶(HRP,1:5000)标记的二抗在室温下孵育1 h,ECL化学发光显色液进行显色,Image Lab TM软件分析蛋白条带,以蛋白质/β-actin代表蛋白相对表达水平[14]。
1.2.7 实时荧光定量PCR(Quantitative Real time PCR,qRT-PCR)检测LncRNA HCG11和miR-539-3p表达
选择HepG-2、HepG-2/DDP、SMMC-7721、Huh7、Bel-7405、L-02细胞株,使用Trizol试剂提取总RNA,分光光度法测定RNA浓度,逆转录试剂盒逆转录生成cDNA。以GAPDH和U6为内参基因,使用SYBRH Select Master Mix for CFX进行实时定量PCR。HCG11 引物序列:上游序列:5´-TTGGGCGAGACCTACCTAGT-3´,下游序列:5´-GGCCTGTCATTCTACCA-3´;GAPDH 引物序列:上游序列:5´-TTCTTTTGCGTCGCCAGGTG-3´,下游序列:5´-GGAGGGAGAGAACAGTGAGC-3´;miR-539-3p 引物序列:上游序列:5´-TCGTTCGCTCATCAAGCT TGTTA-3´,下游序列:5´-CACGTTATGCTTGTTGACCT TCAC-3´;U6引物序列:上游序列:5´-CGGCACCATGTTGGTGGA-3´,下游序列:5´-AGGTACTTGATGGTGCTGCC-3´;PCR反应:95 ℃ 5 min,95 ℃ 5 s,60 ℃ 20 s,72 ℃ 30 s,共30个循环。2−ΔΔCt法计算HCG11和miR-539-3p的相对表达水平[15]。
1.2.8 茯苓多糖对LncRNA HCG11、miR-539-3p水平的影响
将HepG-2/DDP细胞接种到6孔板(5×105个/孔),分为对照组(0 µg/mL PCP)、PCP组(7.5、15、30 µg/mL PCP),培养48 h。qRT-PCR检测LncRNA HCG11和miR-539-3p水平,方法同1.2.7。
1.2.9 预测及荧光素酶报告基因实验分析
starbase 在线软件预测HCG11与miR-539-3p结合位点,利用Lipofectamine2000将构建含有miR-539-3p结合位点的HCG11野生型和突变型重组质粒(HCG11-WT/MUT)分别与miR-NC、miR-539-3p mimics共转染到HepG-2/DDP细胞中,48 h后,通过双重荧光素酶报告基因测定试剂盒评估荧光素酶活性[16]。
1.2.10 下调LncRNA HCG1对HepG-2/DDP细胞自噬、耐药性的影响
设置对照组(不做任何处理)、siNC组(转染50 nmol/L HCG1阴性序列)、HCG11 siRNA组(转染50 nmol/L HCG1干扰序列),分别将siNC、HCG11 siRNA共转染到HepG-2/DDP细胞中,三组均培养48 h,qRT-PCR 方法测定 HepG-2/DDP 细胞中LncRNA HCG1、miR-539-3p表达水平,MTT法检测HepG-2/DDP细胞抑制率,Western blot 法检测自噬蛋白的表达水平。
1.2.11 HCG11高表达逆转PCP对HepG-2/DDP细胞自噬、耐药性的影响
设置pcDNA组(转染2 µg pcDNA)、pcDNA3.1-HCG11组(转染2 µg pcDNA3.1-HCG11)、PCP组(30 µg/mL)和PCP+pcDNA3.1-HCG11 组(转染2 µg pcDNA3.1-HCG11并给予30 µg/mL PCP),培养48 h,qRT-PCR方法测定 HepG-2/DDP细胞中HCG11、miR-539-3p表达水平,MTT法检测HepG-2/DDP细胞对顺铂的耐药性,Western blot 法检测自噬蛋白的表达水平。
1.2.12 动物模型建立及分组
裸鼠标准动物房饲养,温度22±5 ℃,湿度57%±8%,光暗交替各12 h,自由获得标准的饲料和水。设置给药最小剂量(1.58 g/kg)和最大剂量(5.01 g/kg),按照等比数列设置5个组别(r=0.75),每组10只,每天灌胃1次,持续观察14 d,计算LD50[17]。
分别采用HCG11 shRNA(5´-UCAUUCUACCAUUUGUCUCUU-3´)和shRNA NC(5´-UUUCUAACAUUACAUUAAGGC-3´)稳定转染的HepG-2/DDP细胞建立肿瘤移植模型,每组10只。裸鼠皮下注射上述HepG-2/DDP细胞,每周测量肿瘤体积。当肿瘤达到50~100 mm3时,分为模型组(生理盐水)、PCP(50 mg/kg)组、HCG11 shRNA组、PCP(50 mg/kg)+HCG11 shRNA给药组、5-FU组(20 mg/kg,预实验获得),均为腹腔给药,1次/3 d,给药21 d后处死裸鼠,记录肿瘤重量。检测肿瘤组织中HCG11、miR-539-3p和自噬相关蛋白(Beclin-1、LC3 I、LC3 II)的水平。
1.3 数据处理
采用SPSS21.0软件对实验数据进行统计分析。数据以平均值±标准差表示,多组间比较采用单因素方差分析,组间比较采用LSD-t检验,P<0.05时认为差异有统计学意义,采用GraphPad Prism 9.0绘图。
2. 结果与分析
2.1 肝癌细胞耐药情况分析
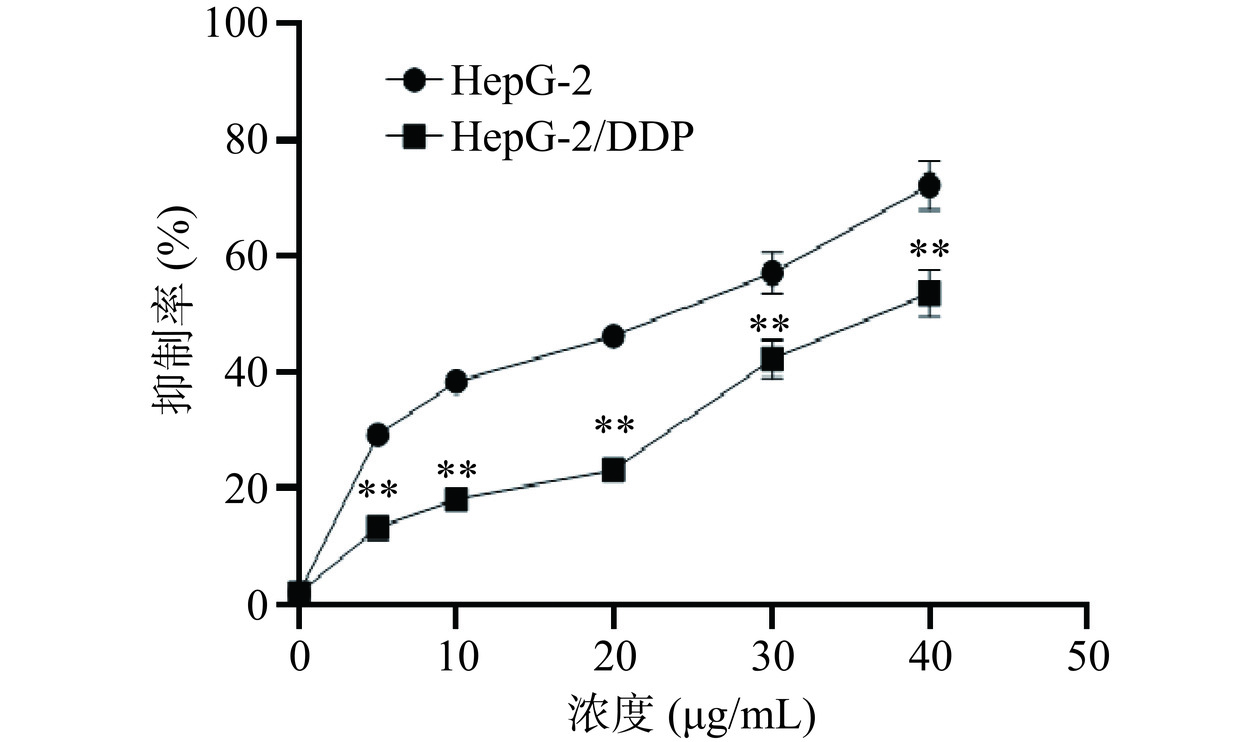
本研究中,选择HepG-2/DDP耐药株进行了分析,并与正常HepG-2细胞株进行了比较,如图1所示,结果显示,伴随浓度的增加,顺铂对HepG-2/DDP增殖的抑制率明显增加,呈现明显的浓度梯度效应。在同一浓度顺铂处理下,HepG-2/DDP细胞抑制率显著低于HepG-2细胞(P<0.01)。顺铂对HepG-2/DDP细胞的IC50值[(44.79±2.37)μg/mL]明显高于HepG-2细胞[(17.79±1.23)μg/mL],说明HepG-2/DDP细胞株对顺铂的耐药效果明显,同时也说明顺铂耐药细胞模型建立成功,可以进行后续研究。
2.2 茯苓多糖对细胞增殖、自噬蛋白和耐药的影响
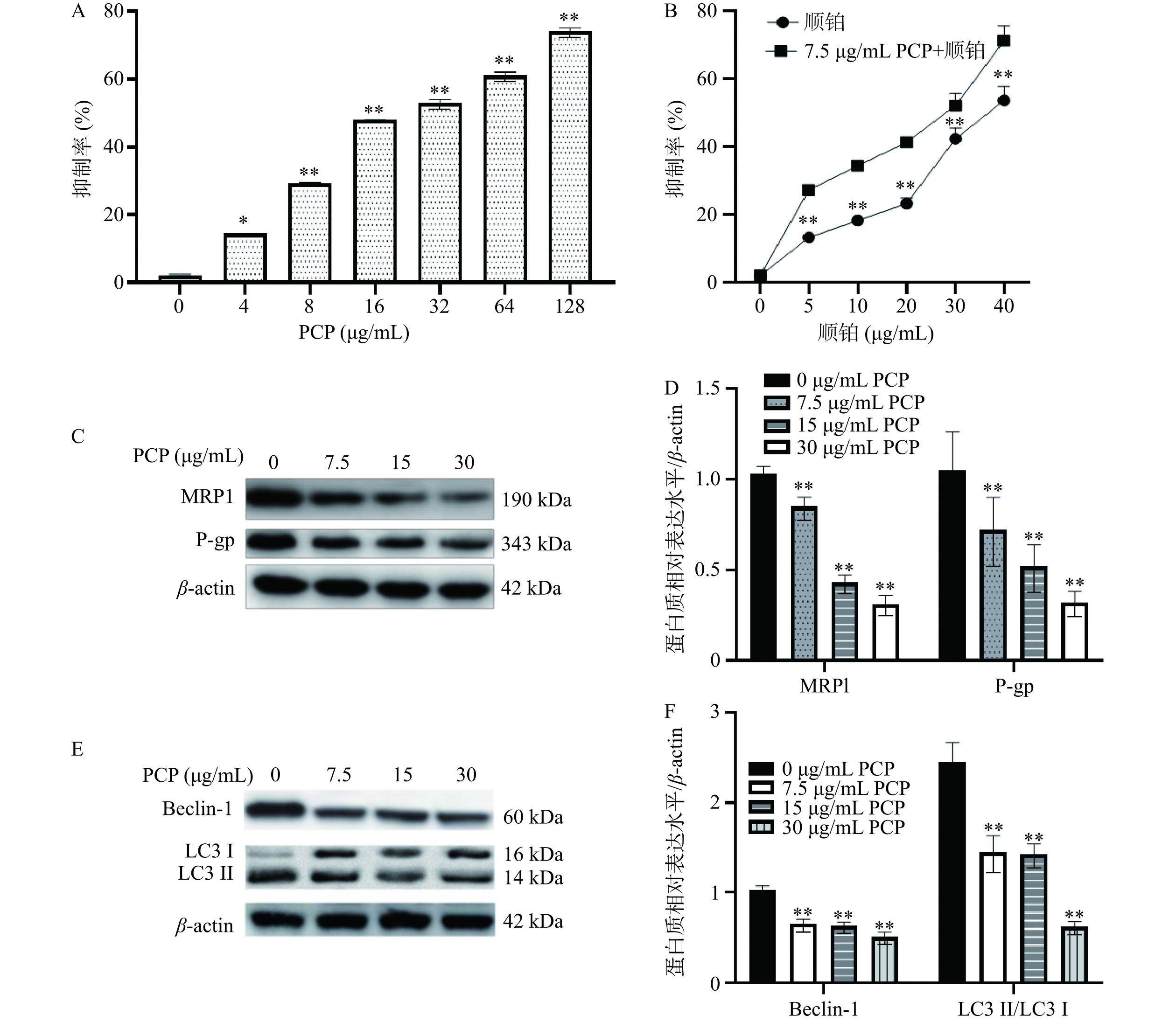
如图2A所示,浓度为4~128 µg/mL的PCP对肝癌HepG-2/DDP细胞具有一定的抑制作用(P<0.05,P<0.01),并呈现明显的浓度效应,表明PCP具有广谱的抗癌效果[18],其对肝癌HepG-2/DDP细胞的IC50值为29.25 µg/mL,考虑到后续实验效果的需要,设置7.5、15、30 µg/mL三个浓度梯度进行研究。
考虑到PCP对肝癌HepG-2/DDP细胞的抑制作用,本研究继续分析PCP对HepG-2/DDP细胞耐药的影响。结果显示,不同浓度的顺铂在结合7.5 µg/mL PCP的基础上,对HepG-2/DDP细胞的抑制率明显增加(图2B),说明HepG-2/DDP细胞的耐药性明显缓解。而MRP1为癌细胞中重要的化学抗性分子,而P-gp是一种耐药相关的肿瘤基因,P-gp的过表达能减少化疗药物在细胞内积累,增加多药耐药性[19]。本研究中,采用7.5、15、30 µg/mL的PCP能显著降低HepG-2/DDP细胞中MRP1、P-gp表达水平(图2C、图2D),这也进一步说明PCP能有效增加药物敏感性,降低耐药效果。
在致癌过程中,自噬能促进肿瘤细胞的耐药性,在此基础上,本研究针对自噬进行了研究,结果表明,7.5、15、30 µg/mL的PCP能显著降低自噬标记性蛋白Beclin-1、LC3II的水平(图2E、图2F),说明PCP能降低HepG-2/DDP细胞自噬,同时也说明当肿瘤细胞受到刺激时,肿瘤细胞可以将其自噬作为一种抵抗机制来逃避药物治疗,增加药物抵抗性。
2.3 茯苓多糖对LncRNA HCG11和miR-539-3p水平的影响
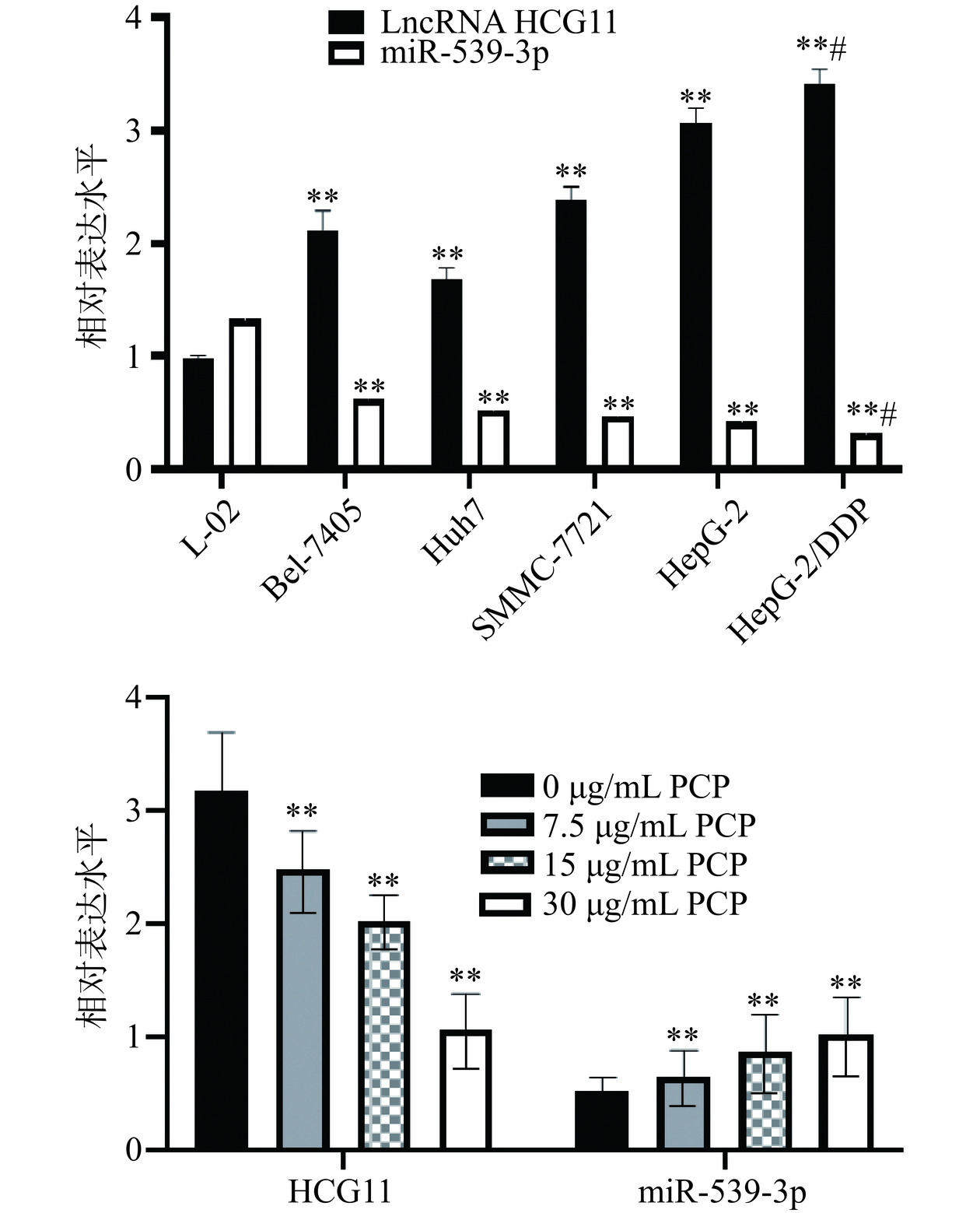
LncRNA HCG11[20]为一种常见的非编码RNA(ncRNA),在肿瘤形成、发展及免疫应答、炎症反应中发挥重要作用,参与了包括肝癌在内的多种类型癌细胞增殖、侵袭、迁移和凋亡[21]。而miR-539-3p为常见的抑癌因子,调节肿瘤的发生和进展[22]。如图3所示,本研究中,与L-02相比,HepG-2、SMMC-7721、Huh7、Bel-7405、HepG-2/DDP中HCG11的表达水平显著增加,miR-539-3p的表达水平显著降低(P<0.01),提示癌细胞中HCG11水平显著增加,而miR-539-3p水平显著降低;与HepG-2比较,HepG-2/DDP中HCG11的表达水平显著增加,miR-539-3p的表达水平显著降低(P<0.05),这也进一步说明,伴随肝癌细胞耐药性的增加,HCG11和miR-539-3p的表达水平发生明显的变化;而浓度为7.5、15和30 µg/mL的PCP能显著降低HCG11水平,增加miR-539-3p的表达水平(P<0.01),表明PCP可能是通过调控LncRNA HCG11和miR-539-3p发挥抗肿瘤作用。
2.4 LncRNA HCG11和miR-539-3p靶向关系
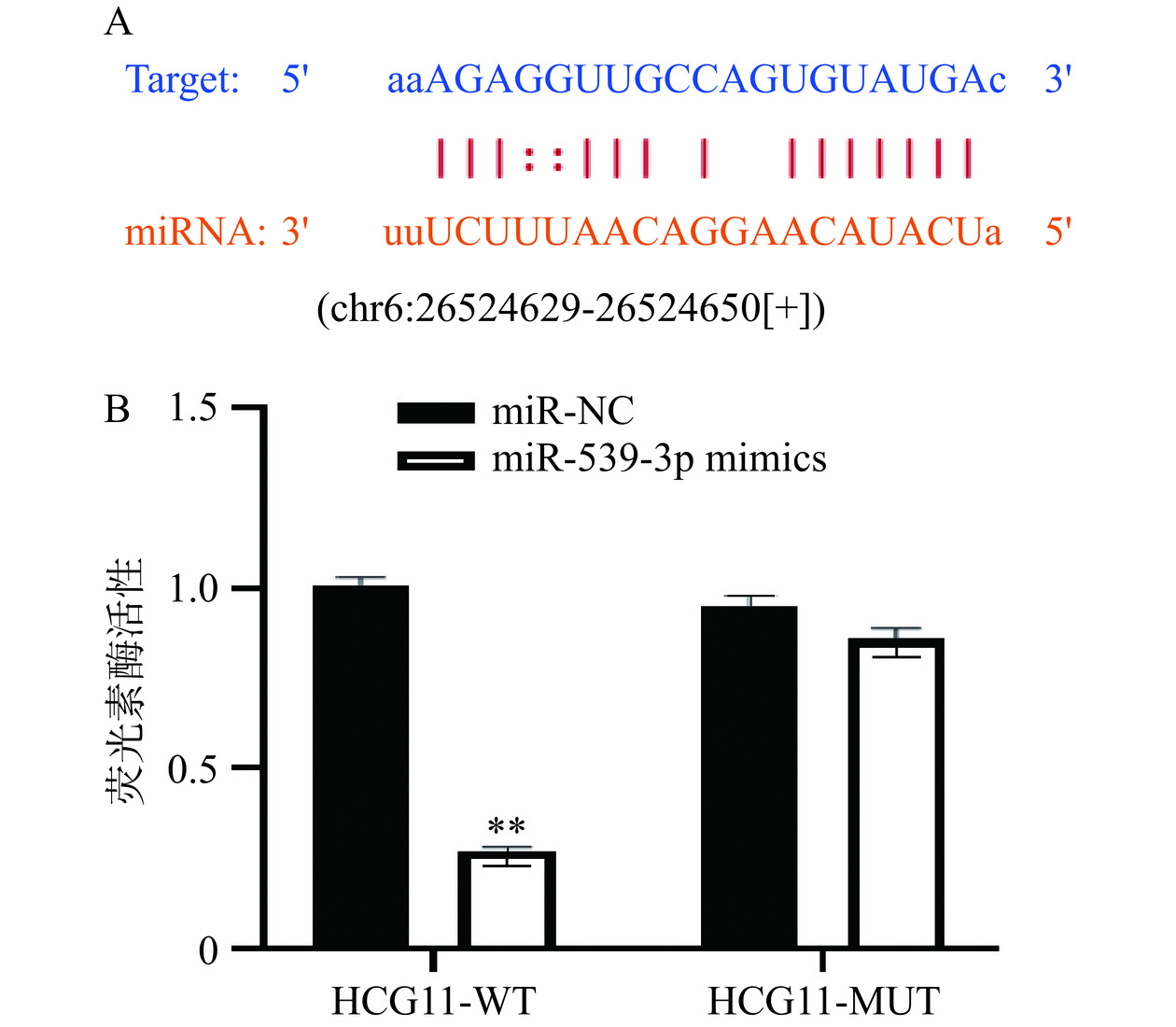
Starbase在线软件预测到HCG11与miR-539-3p存在结合位点(图4A),提示LncRNA HCG11具有“分子海绵”功能,能通过调控miR-539-3p表达水平,调节肿瘤发生和进展[23]。另外,如图4B所示,与miR-NC组比较,miR-539-3p mimics组HCG11-WT的荧光素酶活性显著降低(P<0.05),而HCG11-MUT荧光素酶活性差异无统计学意义(P>0.05),进一步证明LncRNA HCG11和miR-539-3p存在一定的靶向关系。
2.5 HCG11低表达抑制HepG-2/DDP细胞增值、自噬及耐药
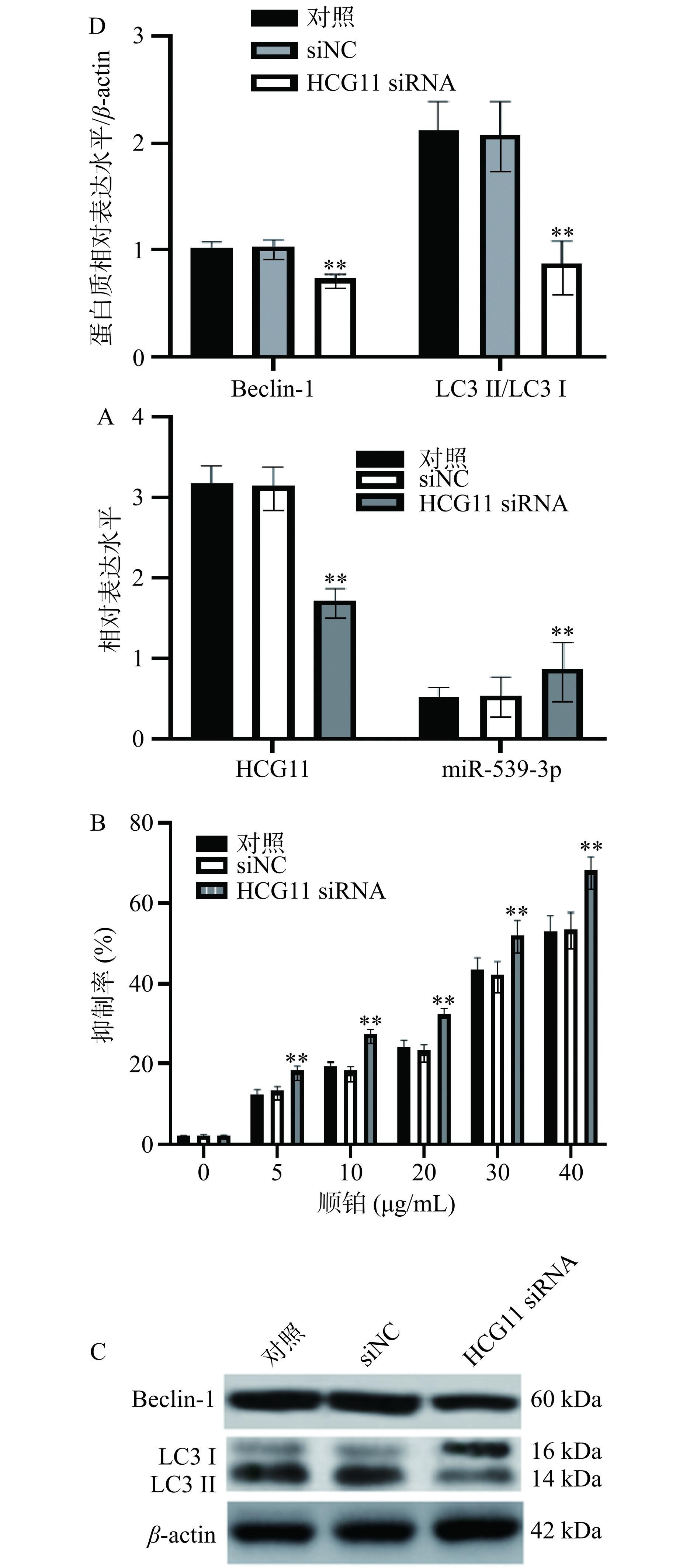
图5A结果显示,与对照组比较,HCG11 siRNA 组HepG-2/DDP细胞HCG11相对表达水平明显降低,miR-539-3p水平明显增加(P<0.01),提示HCG11低表达细胞模型建立成功。图5B结果显示,与对照组(2.12%±0.11%)比较,HCG11 siRNA组(55.12%±2.32%)HepG-2/DDP细胞抑制率显著增加(P<0.01),HCG11 siRNA 组HepG-2/DDP 细胞的 IC50值[(28.78±2.12)μmol/L]明显低于siNC组[(54.33±1.27)μmol/L]、对照组[(56.07±1.33)μmol/L],提示HCG11低表达抑制HepG-2/DDP细胞增殖,降低HepG-2/DDP细胞对顺铂的耐药性,说明HCG11可作为肝癌治疗的基因靶点。
![]() 图 5 HCG11低表达抑制HepG-2/DDP细胞增值、自噬及耐药注:A. 转染HCG11 siRNA后,HepG-2/DDP细胞中LncRNA HCG11、miR-539-3p表达水平;B. HCG11低表达抑制HepG-2/DDP细胞增值;C. HCG11低表达抑制HepG-2/DDP细胞耐药;D~E. HCG11低表达抑制HepG-2/DDP细胞自噬;与对照组比较,**表示P<0.01。Figure 5. Low expression of HCG11 inhibits proliferation, autophagy and drug resistance of HepG-2/DDP cells
图 5 HCG11低表达抑制HepG-2/DDP细胞增值、自噬及耐药注:A. 转染HCG11 siRNA后,HepG-2/DDP细胞中LncRNA HCG11、miR-539-3p表达水平;B. HCG11低表达抑制HepG-2/DDP细胞增值;C. HCG11低表达抑制HepG-2/DDP细胞耐药;D~E. HCG11低表达抑制HepG-2/DDP细胞自噬;与对照组比较,**表示P<0.01。Figure 5. Low expression of HCG11 inhibits proliferation, autophagy and drug resistance of HepG-2/DDP cells鉴于上述的研究结果,本研究继续针对自噬进行了分析。如图5C、图5D,与对照组比较,HCG11 siRNA 组HepG-2/DDP细胞Beclin-1、LC3 II/ LC3 I比值显著降低(P<0.01),说明HCG11 siRNA促进癌细胞敏化,可能与抑制自噬有关,增加抗肿瘤药物的细胞毒性。
2.6 HCG11高表达逆转PCP对耐药性和自噬的影响
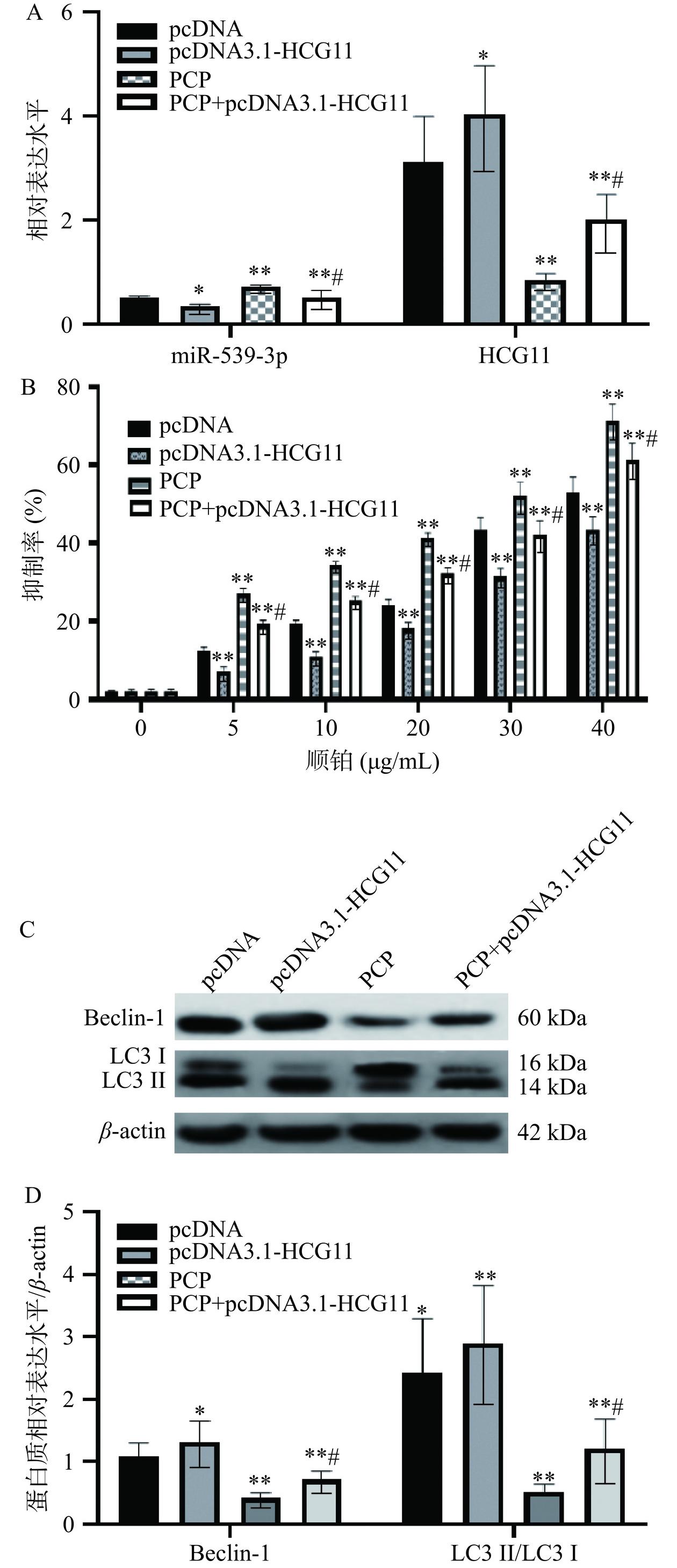
鉴于PCP对HepG-2/DDP细胞增值、自噬及耐药以及HCG11、miR-539-3p水平的影响,本研究继续探讨HCG11表达水平在调控耐药性、自噬等方面的影响。如图6A,与pcDNA组比较,pcDNA3.1-HCG11组HepG-2/DDP细胞HCG11相对表达水平明显增加,miR-539-3p水平明显降低(P<0.01),提示HCG11高表达细胞模型建立成功。同样,在PCP的参与下,PCP+pcDNA3.1-HCG11组HCG11相对表达水平较PCP组显著升高(P<0.01),说明HCG11可能是PCP发挥抗肝癌作用的靶点。而且从耐药性方面进行分析显示,如图6B,在不同浓度的顺铂处理下,PCP+pcDNA3.1-HCG11组抑制率显著低于PCP组(P<0.01),这也进一步说明PCP可以通过HCG11进一步影响顺铂的功效,增加细胞对化疗药的敏感性,同时也说明HCG11可能与肝癌细胞化疗耐药有关。
LncRNA与自噬和肿瘤进展密切相关[24],并影响肿瘤细胞耐药过程[25]。如图6C和图6D,本研究中,PCP组的HepG-2/DDP细胞Belin-1、LC3 II/LC3 I比值较pcDNA组明显降低,而PCP+pcDNA3.1-HCG11组Belin-1、LC3 II/LC3 I比值较PCP组显著增加(P<0.01),说明自噬可能在HepG-2/DDP细胞发生和发展中发挥着重要作用[26],并可帮助HepG-2/DDP细胞抵抗微环境的压力,提高细胞存活率[27]。
2.7 体内茯苓多糖通过HCG11调控自噬影响肝癌进程
实验结果如表1显示,给药PCP后,小鼠无死亡发生,活动量未见减少,食量、体重没有变化。由于小鼠未死亡,因此无法计算100%死亡药物剂量,因此无法测得LD50,也说明茯苓多糖基本是无毒的。依据预实验,后续给药剂量选择50 mg/kg。
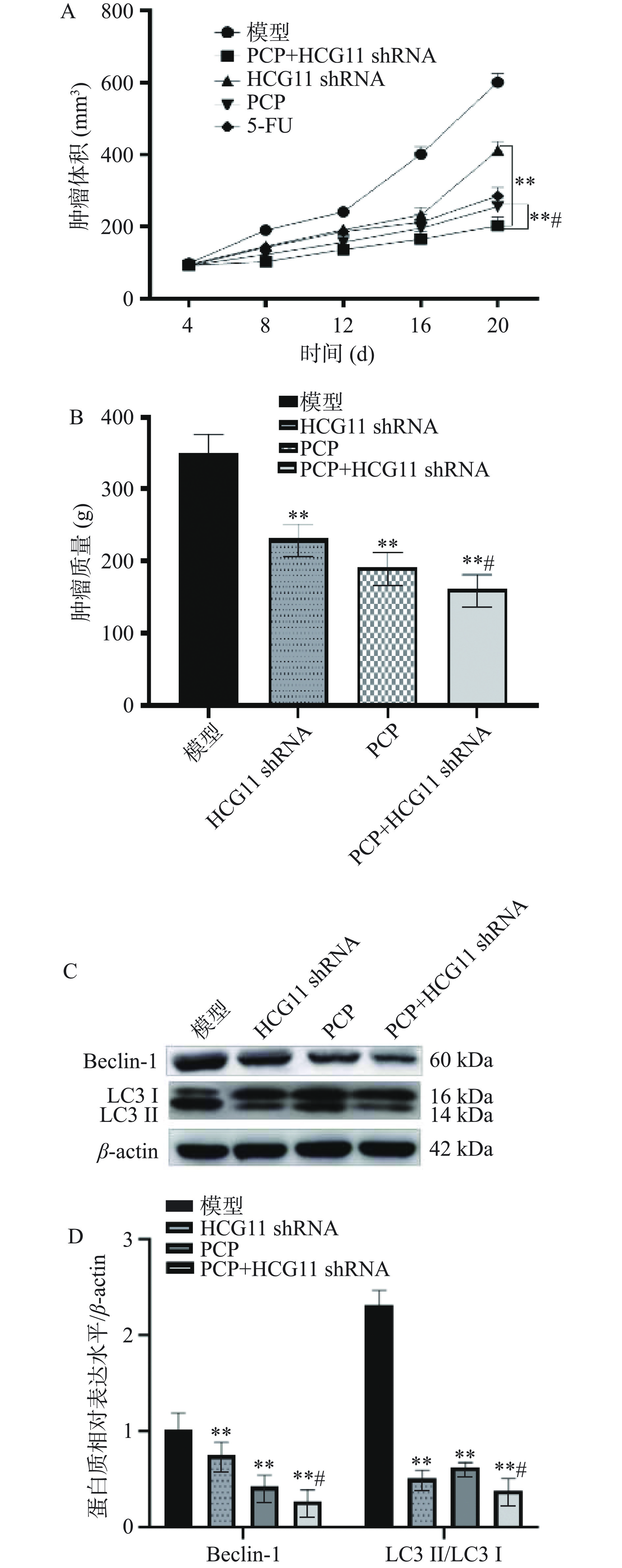
表 1 急性毒性实验Table 1. Acute toxicity tests剂量(g/kg) 死亡个数 死亡率(%) 5.01 0 0 3.75 0 0 2.81 0 0 2.12 0 0 1.58 0 0 为了证明HCG11作为具有巨大临床潜力的治疗靶点,本文分析了敲低HCG11表达水平对肿瘤生长的影响。结果显示,HCG11低表达促进了PCP对肿瘤大小和肿瘤重量的影响(图7A、图7B)。此外HCG11低表达也影响PCP对肿瘤中的自噬蛋白Belin-1、LC3 II/LC3 I水平的表达(图7C、图7D),提示PCP可能通过调控HCG11表达水平,并进一步影响肿瘤细胞自噬,并最终发挥抑瘤活性。
3. 讨论与结论
LncRNA HCG11在癌组织和细胞中高表达[28],HCG11基因过表达可促进胃癌细胞增殖、迁移,抑制细胞凋亡,并可通过调节miR-144-3p/PBX3促进卵巢癌的细胞进展,并成为卵巢癌治疗的全新靶标[29]。本研究中,HCG11在肝癌细胞中明显上调,而且miR-539-3p是LncRNA HCG11的结合靶点,可通过结合互补位点负调控miR-539-3p表达水平,并进一步影响耐药和自噬。为了证实PCP对HepG-2/DDP细胞增殖、耐药和自噬的影响,并分析其机制。本研究采用HCG11高表达分析PCP对耐药性、自噬的影响,结果显示,在不同浓度的顺铂处理下,PCP+pcDNA3.1-HCG11组抑制率显著低于PCP组,说明HCG11高表达影响了HepG-2/DDP细胞耐药效果,降低了细胞对化疗药的敏感性。同样,本研究中,PCP+pcDNA3.1-HCG11组Belin-1、LC3 II/LC3 I比值较PCP组显著增加,HCG11高表达促进了HepG-2/DDP细胞自噬,说明HCG11能调控HepG-2/DDP细胞对外界微环境的适应。而且通过体内HCG11敲除导致的miR-539-3p上调、自噬相关蛋白的水平下调,包括LC3II,并进一步影响PCP对肿瘤细胞的药效,提示PCP可能通过LncRNA HCG11/miR-539-3p调节耐药和自噬,从而发挥抗癌效果。
总之,PCP能通过LncRNA HCG11/miR-539-3p调控耐药和自噬,并影响肝癌细胞的增殖,这将为PCP的开发提供新的研究思路。
-
图 5 HCG11低表达抑制HepG-2/DDP细胞增值、自噬及耐药
注:A. 转染HCG11 siRNA后,HepG-2/DDP细胞中LncRNA HCG11、miR-539-3p表达水平;B. HCG11低表达抑制HepG-2/DDP细胞增值;C. HCG11低表达抑制HepG-2/DDP细胞耐药;D~E. HCG11低表达抑制HepG-2/DDP细胞自噬;与对照组比较,**表示P<0.01。
Figure 5. Low expression of HCG11 inhibits proliferation, autophagy and drug resistance of HepG-2/DDP cells
表 1 急性毒性实验
Table 1 Acute toxicity tests
剂量(g/kg) 死亡个数 死亡率(%) 5.01 0 0 3.75 0 0 2.81 0 0 2.12 0 0 1.58 0 0 -
[1] TIAN L Y, JI H X, WANG W Z, et al. Mitochondria-targeted pentacyclic triterpenoid carbon dots for selective cancer cell destruction via inducing autophagy, apoptosis, as well as ferroptosis[J]. Bioorg Chem,2023,130:106259−106272. doi: 10.1016/j.bioorg.2022.106259
[2] ZHOU Z, DU L Q, HUANG X M, et al. Novel glycosylation zinc (II)-cryptolepine complexes perturb mitophagy pathways and trigger cancer cell apoptosis and autophagy in SK-OV-3/DDP cells[J]. Eur J Med Chem,2022,243:114743−114753. doi: 10.1016/j.ejmech.2022.114743
[3] KHAYATI K, BHATT V, LAN T, et al. Transient systemic autophagy inhibition is selectively and irreversibly deleterious to lung cancer[J]. Cancer Res,2022,82(23):4429−4443. doi: 10.1158/0008-5472.CAN-22-1039
[4] 康书红, 蔺红丽, 赵霞. LncRNA RP 11-351J 23.1靶向miR-765对食管鳞癌细胞增殖、侵袭和迁移的影响及其机制研究[J]. 实验与检验医学,2021,39(4):762−767. [KANG S H, LIN H L, ZHAO X. Effect of LncRNA RP 11-351J 23.1 targeting miR-765 on proliferation, invasion and migration of esophageal squamous cell carcinoma cells and its mechanism[J]. J Lab Clin Med,2021,39(4):762−767.] doi: 10.3969/j.issn.1674-1129.2021.04.004 KANG S H, LIN H L, ZHAO X. Effect of LncRNA RP 11-351J 23.1 targeting miR-765 on proliferation, invasion and migration of esophageal squamous cell carcinoma cells and its mechanism[J]. J Lab Clin Med, 2021, 39(4): 762−767. doi: 10.3969/j.issn.1674-1129.2021.04.004
[5] DUAN Y, CHEN H L, LING M, et al. The curcumin analog EF24 inhibits proliferation and invasion of triple-negative breast cancer cells by targeting the long noncoding RNA HCG11/Sp1 axis[J]. Mol Cell Biol,2022,42(1):e0016321−e0016343. doi: 10.1128/MCB.00163-21
[6] LI M L, ZHANG Y, MA L T. LncRNA HCG11 accelerates the progression of hepatocellular carcinoma via miR-539-3p/ATG12 axis[J]. Eur Rev Med Pharmacol Sci,2019,23(24):10708−10720.
[7] LIU Y P, HONG W, ZHOU C C, et al. miR-539 inhibits FSCN1 expression and suppresses hepatocellular carcinoma migration and invasion[J]. Oncol Rep,2017,37:2593−2602. doi: 10.3892/or.2017.5549
[8] LI X L, HE Y L, ZENG P J, et al. Molecular basis for Poria cocos mushroom polysaccharide used as an antitumour drug in China[J]. J Cell Mol Med,2019,23(1):4−20. doi: 10.1111/jcmm.13564
[9] YANG J N, DONG X X, LI B Y, et al. Poria cocos polysaccharide-functionalized graphene oxide nanosheet induces efficient cancer immunotherapy in mice[J]. Front Bioeng Biotechnol,2023,10:1050077−1050086. doi: 10.3389/fbioe.2022.1050077
[10] DUAN Y T, HUANG J J, SUN M J, et al. Poria cocos polysaccharide improves intestinal barrier function and maintains intestinal homeostasis in mice[J]. Int J Biol Macromol,2023,249:125953−125862. doi: 10.1016/j.ijbiomac.2023.125953
[11] CHEN F, HUANG G L, YANG Z Y, et al. Antioxidant activity of Momordica charantia polysaccharide and its derivatives[J]. Int J Biol Macromol,2019,138:673−680. doi: 10.1016/j.ijbiomac.2019.07.129
[12] MA X, GAO H, YANG B, et al. Huaier polysaccharide attenuates doxorubicin-induced acute cardiotoxicity by regulating ferroptosis[J]. Bull Exp Biol Med,2022,174(1):37−42. doi: 10.1007/s10517-022-05644-7
[13] LIU Y, LIU X B, WANG H, et al. Agrimonolide inhibits cancer progression and induces ferroptosis and apoptosis by targeting SCD1 in ovarian cancer cells[J]. Phytomedicine,2022,101:154102−154110. doi: 10.1016/j.phymed.2022.154102
[14] CHURCH A J, CORSON L B, KAO P C, et al. Molecular profiling identifies targeted therapy opportunities in pediatric solid cancer[J]. Nat Med,2022,28(8):1581−1589. doi: 10.1038/s41591-022-01856-6
[15] HU Y Y, GONG C L, LI Z B, et al. Demethylase ALKBH5 suppresses invasion of gastric cancer via PKMYT1 m6A modification[J]. Mol Cancer,2022,21(1):34−42. doi: 10.1186/s12943-022-01522-y
[16] LI J, WANG S Q, WANG N, et al. Aiduqing formula inhibits breast cancer metastasis by suppressing TAM/CXCL1-induced Treg differentiation and infiltration[J]. Cell Commun Signal,2021,19(1):89−98. doi: 10.1186/s12964-021-00775-2
[17] FAN T B, ZHU W B, KONG M, et al. The significance of PAX8-PPARγ expression in thyroid cancer and the application of a PAX8-PPARγ-targeted ultrasound contrast agent in the early diagnosis of thyroid cancer[J]. Contrast Media Mol Imaging,2022,2022:3265342−3265352. doi: 10.1155/2022/3265342
[18] HONG W F, LIANG L, GU Y J, et al. Immune-related lncRNA to construct novel signature and predict the immune landscape of human hepatocellular carcinoma[J]. Mol Ther Nucleic Acids,2020,22:937−947. doi: 10.1016/j.omtn.2020.10.002
[19] CABAUD O, BERGER L, CROMPOT E, et al. Overcoming resistance to anti-nectin-4 antibody-drug conjugate[J]. Mol Cancer Ther,2022,21(7):1227−1235. doi: 10.1158/1535-7163.MCT-22-0013
[20] YANG L, DENG J X, MA W X, et al. Ablation of lncRNA Miat attenuates pathological hypertrophy and heart failure[J]. Theranostics,2021,11(16):7995−8007. doi: 10.7150/thno.50990
[21] GU J, DAI B, SHI X C, et al. lncRNA HCG11 suppresses human osteosarcoma growth through upregulating p27 Kip1[J]. Aging (Albany NY),2021,13(17):21743−21757. doi: 10.18632/aging.203517
[22] XUE H X, LI H F, WANG T, et al. LncRNA HCG11 suppresses laryngeal carcinoma cells progression via sponging miR-4469/APOM axis[J]. Eur Rev Med Pharmacol Sci,2020,24(6):3174−3182.
[23] CHEN X P, YANG Y S, SUN J, et al. LncRNA HCG11 represses ovarian cancer cell growth via AKT signaling pathway[J]. J Obstet Gynaecol Res,2022,48(3):796−805. doi: 10.1111/jog.15083
[24] LIU C Y, ZHANG Y H, II R B, et al. LncRNA CAIF inhibits autophagy and attenuates myocardial infarction by blocking p53-mediated myocardin transcription[J]. Nat Commun,2018,9(1):29−46. doi: 10.1038/s41467-017-02280-y
[25] LI X Y, JIN F, LI Y. A novel autophagy-related lncRNA prognostic risk model for breast cancer[J]. J Cell Mol Med,2021,25(1):4−14. doi: 10.1111/jcmm.15980
[26] LEMKE M D, FISHER K E, KOZLOWSKA M A, et al. The core autophagy machinery is not required for chloroplast singlet oxygen-mediated cell death in the Arabidopsis thaliana plastid ferrochelatase two mutant[J]. BMC Plant Biol,2021,21(1):342−399. doi: 10.1186/s12870-021-03119-x
[27] XIAO Y L, YANG Y P, HU D D. Knockdown of METTL3 inhibits enterovirus 71-induced apoptosis of mouse Schwann cell through regulation of autophagy[J]. Pathog Dis,2021,79(6):36−53.
[28] JIN Y M, BO J L, LI X X , et al. Long non-coding RNA HCG11 inhibits glioma cells proliferation and migration through decoying miR-590-3p and up-regulating CADM2[J]. Pathobiology, 2022, 89(4):233−244.
[29] LI X F, HU D M, ZHAO Y X, et al. Knockdown of lncRNA HCG11 suppresses cell progression in ovarian cancer by modulating miR-144-3p/PBX3[J]. Eur Rev Med Pharmacol Sci,2020,24(21):11032−11040.
-
期刊类型引用(1)
1. 章紫英 ,周汉昌 ,黄思远 ,李婷 ,余林 ,况小宝 . 烟熏对食品风味及安全性影响研究进展. 食品工业. 2024(11): 270-276 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



