Separation and Purification of Lycium barbarum Polysaccharides in Neuroinflammation by High-speed Countercurrent Chromatography
-
摘要: 目的:构建高速逆流色谱技术分离纯化枸杞多糖的新方法,并对分离得到的枸杞多糖进行结构表征,探究其对神经炎症的影响。方法:通过分配系数K值和固定相保留率Sf,筛选并优化双水相体系偶联高速逆流色谱分离纯化枸杞多糖的条件,利用高效分子排阻色谱联用激光光散射仪和示差检测器串联检测法、1-苯基-3-甲基-5-吡唑啉酮柱前衍生结合高效液相色谱法、傅立叶变换红外光谱仪、热重分析仪、扫描电子显微镜对枸杞多糖进行初步结构表征,利用脂多糖诱导的小胶质细胞炎症模型研究枸杞多糖对神经炎症的作用。结果:确定最佳双水相体系为乙醇、饱和硫酸铵、水、异丙醇的质量比为1.4:1.0:2.58:0.3,高速逆流色谱最佳分离纯化条件为转速900 r/min,流动相流速0.8 mL/min。在上述条件下,分离得到3个枸杞多糖组分LBPs-1、LBPs-2和LBPs-3,多糖含量分别为78.35%±1.52%,69.03%±1.71%和62.11%±2.31%,分子量分别为7.40×104 Da,2.73×104 Da和1.47×104 Da,单糖组成分别为甘露糖:鼠李糖:半乳糖醛酸:葡萄糖醛酸:葡萄糖:半乳糖:阿拉伯糖,其中摩尔比分别为1.9:4.9:1.3:8.1:7.6:32.6:41.8、2.1:4.3:1.5:8.3:5.1:28.6:37.9和5.9:4.6:1.1:0.7:13.8:66.8:5.3,同时热稳定性和微观形貌也有明显差异。生物活性研究结果表明,不同分子量的枸杞多糖可通过抑制炎症因子分泌,缓解脂多糖诱导的小胶质细胞炎症。结论:本研究构建了双水相体系偶联高速逆流色谱分离纯化枸杞多糖的新方法,为植物多糖高效分离纯化提供了技术支撑,为枸杞多糖在抑制神经炎症相关疾病中的应用提供了科学依据。Abstract: Objective: This study constructed a novel method for the separation and purification of polysaccharides from Lycium barbarum polysaccharide (LBPs) by high-speed countercurrent chromatography with aqueoust two-phase system, and investigated its effect on neuroinflammation. Methods: Through the partition coefficient (K) value and stationary phase retention rate Sf, the conditions for separating and purifying LBPs using aqueous two-phase system coupled with high-speed countercurrent chromatography (HSCCC) were screened and optimized. Preliminary structural characterisation of LBPs was performed using high performance size exclusion column-multiangle laser light scatter-refractive index detector (HPSEC-MALLS-RID), 1-phenyl-3-methyl-5-pyrazolone precolumn derivatization coupled to high performance liquid chromatography (HPLC), Fourier transform infrared spectroscopy (FTIR), thermogravimetric analyzer (TG) and scanning electron microscopy (SEM). Moreover, the anti-neuroinflammation effect was investigated on LPS induced BV2 cell model. Results: The optimal biphasic system consisted of ethanol, ammonium sulphate, water and isopropanol had a ratio of 1.4:1.0:2.58:0.3. Under the separation conditions (900 r/min and 0.8 mL/min mobile phase flow rate), three polysaccharide fractions, named LBPs-1, LBPs-2 and LBPs-3, was isolated. Polysaccharide contents were 78.35%±1.52%, 69.03%±1.71% and 62.11%±2.31%. Molecular weights were 7.40×104 Da, 2.73×104 Da and 1.47×104 Da. The monosaccharide composition was as follows: Man:Rha:GalA:GlcA:Glu:Gal:Ara, with the molar ratios of 1.9:4.9:1.3:8.1:7.6:32.6:41.8, 2.1:4.3:1.5:8.3:5.1:28.6:37.9 and 5.9:4.6:1.1:0.7:13.8:66.8:5.3, respectively. There was also a significant difference in terms of thermal stability and micro-morphology. The LBPs exhibited varying degrees of protective activity on LPS-induced BV2 cells. Conclusions: This study would provide technical support for the efficient separation and purification of plant polysaccharides, and scientific basis for the application of LBPs in the inhibition of neuroinflammation related diseases.
-
枸杞子为茄科植物宁夏枸杞(Lycium barbarum L.)的干燥成熟果实,也是第一批列入“药食同源”物质名单的中药[1]。枸杞多糖(Lycium barbarum polysaccharides,LBPs)是通过脱水缩合以糖苷键聚合而成的高分子化合物,分子量主要分布在8~2400 kDa之间。广泛的分子量分布和丰富的单糖组成使得枸杞多糖具有复杂的化学结构和空间构象,进而表现出众多生理活性,诸如调节免疫力、延缓衰老、抗氧化、抗肿瘤、降血脂、降血糖、神经保护作用等[2]。
多糖的生理活性与其分子量的大小有密切的关系,相同来源不同分子量的多糖片段表现出不同的生物活性和药理作用[3]。目前,分步沉淀法是将粗多糖初步分离成不同分子量片段多糖组分的通用方法,该方法根据多糖在不同浓度的有机低级醇中溶解度不同的性质,逐级达到分步沉淀。多糖的分子量范围与有机醇的浓度呈负相关,随着有机醇的添加,不同分子量的多糖依次被沉淀出来[4]。但是近年来研究发现,在多糖溶液中加入有机醇时,由于分子内氢键的增强,多糖分子开始脱水,进而发生构象转变和重新组装,这为多糖本身结构、活性及其构效关系的研究带来阻碍[5]。凝胶渗透色谱法和超滤膜分离法都是基于分子排阻原理的分离方法,该类方法能够将枸杞多糖分离成不同的分子量片段,但是也存在死吸附现象[6]。通常,枸杞多糖在提取过程中还会夹带有蛋白质和色素等杂质,需要在进一步分离之前将杂质去除。传统脱除蛋白质的方法有Sevage法、三氟三氯乙烷法、三氯乙酸法和酶法等;脱除色素的方法有H2O2氧化法、活性炭吸附法和离子交换树脂法等,上述方法在实际应用过程中会出现破坏多糖结构、多糖回收率低等缺陷[7]。
高速逆流色谱(high speed countercurrent chromatography,HSCCC)是一种连续的液-液分配色谱法,具有无不可逆吸附、制备量大、分离速度快、样品回收率高等优势,已广泛应用于天然产物的分离制备,取得了重要研究进展。本课题组前期已经构建了多种HSCCC的分离模式和分离系统,已经从复杂体系中分离出了多种类型化合物。HSCCC对目标组分的分离根据其在两相溶剂中分配系数的不同而实现[8]。因此,溶剂系统的选择很大程度上取决于被分离物质的溶解性。常用于HSCCC的溶剂系统为Ito开发的一种四元或五元溶剂体系,然而大极性化合物在这些溶剂体系中常倾向于被分配到下相,导致分配系数太小(K<0.5),因而并不能满足分离制备的要求[9]。
双水相体系(aqueous two-phase system,ATPS)通常由两种聚合物、聚合物和盐、离子液体和盐、短链醇和盐组成[10]。由于其温和的液体环境,在生物活性物质的分离和纯化中发挥着重要作用。与传统两相系统相比,ATPS具有环境友好、成本低、效率高、易于放大等优点。由于ATPS含水量较高(60%~70%)且两相中均含水。因此,大极性化合物往往在两相中都有所分配,进而实现不同性质大极性化合物的分离。
本文根据HSCCC的液-液连续分配原理,利用多糖分子特殊的带电特性和水溶性特性,结合双水相体系分离生物大分子的优势,发展了一种基于ATPS的HSCCC纯化分离枸杞多糖的新方法,利用该方法将枸杞多糖粗提物一步分离纯化得到3个不同分子量枸杞多糖片段、表征其结构特征及评价其神经保护作用,其研究结果可为HSCCC技术分离纯化中药多糖提供理论支撑,为枸杞多糖在抑制神经炎症相关疾病中的应用提供科学依据。
1. 材料和方法
1.1 材料与仪器
枸杞子 宁夏中杞枸杞贸易集团有限公司提供,经鉴定为宁夏枸杞Lycium barbarum L.的干燥成熟果实;无水乙醇、硫酸铵、异丙醇、苯酚、硫酸、盐酸、氢氧化钠、三氟乙酸、1-苯基-3-甲基-5-吡唑啉酮 分析纯,天津大茂有限公司;D-葡萄糖、D-木糖、D-半乳糖、D-甘露糖、L-阿拉伯糖、L-鼠李糖、L-岩藻糖、D-半乳糖醛酸、D-葡萄糖醛酸标准品 纯度≥99%,中国食品药品检定研究院;溴化钾碎晶 纯度≥99.5%,天津天光光学仪器有限公司;BV2小胶质细胞 中国科学院典型培养物保藏委员会细胞库;TNF-α、IL-6的ELISA试剂盒 上海科兴生物科技有限公司。
T25高速剪切机 艾卡仪器设备有限公司;TGL-15B高速离心机 上海安亨科学仪器厂;KQ-250DE型数控超声清洗机 昆山超声仪器有限公司;TBE-300B高速逆流色谱仪(包括TBP5002泵和DC-0506低温恒温槽) 上海同田生物科技有限公司;Agilent 1290高效液相色谱仪 安捷伦科技有限公司;Vivaflow® 200超滤切向流膜元件 北京赛多利斯仪器系统有限公司;DAWN8激光光散射仪 美国怀雅特技术公司;BSA224S-CW分析天平 北京赛多利斯仪器系统有限公司; V70-傅里叶变换红外光谱仪 布鲁克(北京)科技有限公司;HWS-24型电热恒温水浴锅 上海一恒科学仪器有限公司;STA449C热重分析仪 梅特勒-托利多公司;JSM-5601LV扫描电子显微镜 日本电子公司。
1.2 实验方法
1.2.1 枸杞多糖的制备
将干燥的枸杞子用手提式多功能粉碎机粉碎,过30目筛,称取100 g置于2000 mL烧杯中,加入1000 mL蒸馏水。将烧杯放置在60 ℃的水浴锅中,设置T25高速剪切机的剪切转速为10000 r/min,辅助提取30 min。提取液温度降至室温后,置于TBE-300B高速离心机中,转速为8000 r/min,离心10 min,收集并合并上清液,得到枸杞水提液。将枸杞水提取液过5 kDa Vivaflow® 200超滤膜元件,使整个系统对枸杞水取液进行过滤分离,透过液通过进料管进入储液池Ⅰ,未透过的液体通过进料管回到储液池Ⅱ,待储液池Ⅱ中的溶液剩余25.0 mL时,注入40.0 mL的蒸馏水,润洗膜元件并回收残留在膜元件上的液体,润洗液分别与25.0 mL的截留液合并,获得枸杞粗多糖溶液[11],将LBPs溶液减压浓缩至20 mL,用纯净水透析(MWCO:3500 Da)48 h。最后,置于冷冻干燥机中,得到干燥枸杞粗多糖。
1.2.2 HSCCC分离纯化枸杞多糖方法的构建
1.2.2.1 HSCCC溶剂系统筛选
配制乙醇-饱和硫酸铵-水-异丙醇双水相体系(1.4:1.0:2.58:0;1.4:1.0:2.58:0.3;1.4:1.0:2.58:0.6;1.4:1.0:2.58:0.9,w/w)。考察枸杞多糖在不同双水相体系中分配系数K和固定相保留率Sf的影响。具体过程如下:称取5 mg枸杞粗多糖置于具塞试管中,加入相同体积2 mL的待测溶剂系统的上下相,然后不断地振摇试管直到样品完全溶解。当达到平衡分层后,采用苯酚-硫酸法测定上下层多糖含量[12],分配系数K值[13]是计算多糖在两相互平衡的上下相之间的分布比例,以K值为指标,对溶剂系统的比例进行优化。计算公式如式(1)所示。
K=CUCL (1) 其中,CU和CL分别代表LBPs在上、下两相中的多糖含量。
设定高速逆流色谱的恒温水浴槽温度为25 ℃,以ATPS的上相作为固定相,下相作为流动相。固定相以10 mL/min的流速泵入柱中,设定转速为900 r/min,待达到主机稳定后,泵入流动相。设定流动相流速为0.8 mL/min,待达到流体动力学平衡后,测定该溶剂系统的固定相保留率。以固定相保留率为指标,对溶剂系统的比例进行优化,固定相保留率按照式(2)计算[14]。
Sf=VC−VMVC (2) 其中,VC是柱体积,mL;VM是为HSCCC色谱柱中达到动态平衡后固定相的体积,mL。
1.2.2.2 HSCCC分离条件优化
选用乙醇-饱和硫酸铵-水-异丙醇(1.4:1.0:2.58:0.3,w/w)作为HSCCC分离的溶剂系统。根据所选的体积比,将上述溶剂系统按照比例加入到分离漏斗中并剧烈振荡,在室温下放置分层,将平衡后的上相和下相分开,分别置于KQ-250DE型数控超声清洗机,设置功率为180 W,超声20 min,上相为HSCCC固定相,下相为HSCCC流动相,泵入HSCCC进行后续操作。设置不同流速(0.5、0.8、1.1 mL/min)和不同仪器转速(700、800、900 r/min),考察流速和转速对 HSCCC 固定相保留率的影响,以HSCCC固定相保留率为指标,对HSCCC色谱条件(流速和转速)进行优化[15]。
1.2.2.3 高速逆流色谱分离LBPs
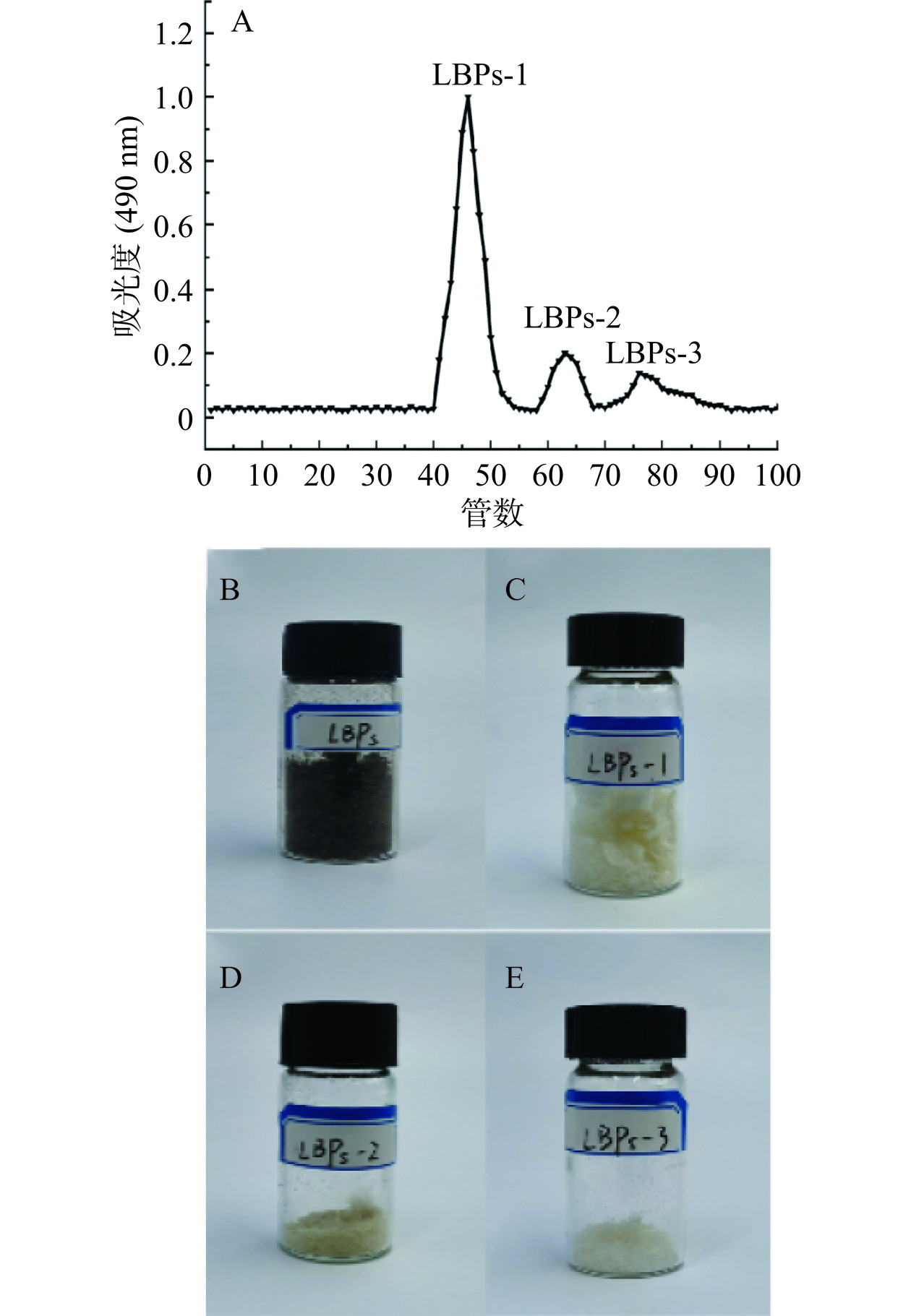
HSCCC分离纯化LBPs过程如图1所示。开启低温恒温槽,设定温度为25 ℃,以头到尾(上相作固定相,下相作流动相)洗脱模式进行HSCCC分离试验,固定相以10.0 mL/min的流速泵入高速逆流色谱仪,待完全填充螺旋管后,设定转速900 r/min,开启高速逆流色谱仪,待转速稳定后,以0.8 mL/min的流速泵入流动相,当流动相与固定相之间达到了动态平衡后[16],将20 mL多糖提取液(1.0 g枸杞粗多糖溶于20 mL上相中)注入进样环,每管收集4 mL洗脱液。使用苯酚-硫酸法检测,将属于相同多糖组分的试管合并后进行透析(3500 Da),冷冻干燥获得纯化的多糖组分。
1.2.3 多糖含量的测定
利用苯酚-硫酸法[12]测定多糖含量。具体操作为:配制质量浓度为0.1 mg/mL的无水葡萄糖对照品溶液,使用苯酚-硫酸法进行显色,在490 nm处测定吸光度,得到标准曲线为Y=0.0138X−0.143,R2=0.9985,葡萄糖在0.02~0.1 mg/mL范围内呈良好的线性关系。将枸杞多糖LBPs-1、LBPs-2和LBPs-3配制成1.0 mg/mL的溶液,按照绘制标准曲线的实验方法操作,根据标准曲线得到溶液中葡萄糖的质量,按照以下公式计算多糖含量。
多糖含量(%)=A−bk×100 (3) 其中,A为苯酚硫酸法测得的多糖吸光度值;k和b分别为标准曲线的斜率和截距。
1.2.4 不同分子量LBPs组分结构表征
1.2.4.1 分子量测定
根据Chen等[17]的方法,利用高效分子排阻色谱联用激光光散射仪和示差检测器(high performance size exclusion chromatography-multiangel laser light scattering-refractive index detection,HPSEC-MALLS-RID)测定LBPs的分子量。具体操作如下:精密称取LBPs样品各10.0 mg,配成10.0 mg/mL的样品溶液,所有溶液均过0.45 μm微孔滤膜,用进样针从进样环注入HPSEC-MALLS-RID进行分析。色谱条件如下:色谱柱:OHpak SB-806HQ(7.9 mm×300 mm,Shodex)和OHpak SB-804HQ(7.9 mm×300 mm,Shodex)串联;流动相:0.2 mol/L NaCl;流速:1.0 mL/min;检测器:多角度激光光散射检测器和示差折光检测器(RID-G7162A),利用ASTRA8软件进行数据的采集和处理。
1.2.4.2 单糖组成测定
参照文献[18]采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生-高效液相色谱(high performance liquid chromatography,HPLC)法测定LBPs的单糖组成,具体实验操作如下:
精密称取甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖、葡萄糖醛酸和半乳糖醛酸,配制为浓度1 mg/mL的单糖标准品溶液。依次精密称取5 mg枸杞多糖样品,置于安瓿瓶中,加入3 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液5 mL,在110 ℃下水解8 h,用N2吹干,除去过量的TFA,并加入300 μL水重新溶解,得到多糖样品的水解液。
分别取单糖标准品溶液和LBPs样品溶液100 μL于试管中,加入100 μL 0.5 mol/L PMP甲醇溶液和100 μL 0.3 mol/L NaOH溶液,在70 ℃避光反应1 h后,加入100 μL的0.3 mol/L HCl终止反应。然后加入700 μL二氯甲烷,分三次萃取去除残留PMP,以10000 r/min离心10 min,上清液过0.45 μm微孔滤膜,用进样针从进样环注入HPLC进行分析。色谱条件:色谱柱SinoChrom ODS-BP(5 μm,4.6 mm×250 mm,Shodex),柱温30 ℃,流动相A为82% 50 mmol/L磷酸盐缓冲液(pH=6.7),流动相B为18%乙腈,流速为1.0 mL/min,进样量:10 μL,检测波长:245 nm。
1.2.4.3 傅立叶红外光谱分析
称取多糖样品各1.5 mg,与200 mg干燥的溴化钾在玛瑙研钵充分研磨混合,压制后,用傅立叶红外光谱仪在500~4000 cm−1波段进行扫描分析[19]。
1.2.4.4 热特性分析
称取LBPs粉末各2.0 mg放入样品盘中,用热重分析仪检测各样品的热重特性。具体测定条件如下:测试温度范围:室温至800 ℃;升温速率:10 ℃/min;扫描速率:1 ℃/min [20]。
1.2.4.5 扫描电镜分析
取干燥的LBPs样品粉末少许,通过导电胶将其固定在载样台上,真空喷金,然后置于场发射扫描电子显微镜下,捕捉样品表面立体形态,在20 kV的高真空加速电压和放大倍数为500倍及2000倍下依次观察样品表面形态[21]。
1.2.5 不同分子量LBPs 对脂多糖(LPS)诱导的小胶质细胞(BV2)炎症反应作用
将BV2细胞培养于10%胎牛血清和1%青霉素-链霉素混合液的DMEM培养基中,置于37 ℃、5% CO2培养箱中进行培养。取处于对数生长期的BV2细胞,调整细胞浓度至2×105个/mL,并接种1 mL该细胞悬液于96孔板中,培养过夜后,实验分组如下:空白对照组(NC):加入1 mL细胞培养基培养24 h,不予其余任何处理;模型对照组(MC):培养基中加入1 μg/mL LPS,培养24 h;LBPs-1高、中、低剂量组:在培养基中分别加入(0.8、0.4、0.2 mg/mL)的LBPs-1处理6 h,然后分别加入1 μg/mL LPS处理24 h;LBPs-2高、中、低剂量组:在培养基中分别加入(0.8、0.4、0.2 mg/mL)的LBPs-2处理6 h,然后分别加入1 μg/mL LPS处理24 h;LBPs-3高、中、低剂量组:在培养基中分别加入(0.8、0.4和0.2 mg/mL)的LBPs-3处理6 h,然后分别加入1 μg/mL LPS处理24 h。收集不同处理组BV2细胞的上清液,按试剂盒操作说明进行,检测不同处理组BV2细胞上清液TNF-α和IL-6含量[22]。
1.3 数据处理
实验数据据以¯x±s表示,采用Graphpad Prism 9.0进行分析;对多组组间比较采用单因素方差分析(ANOVA),P<0.05表示差异具有显著性。
2. 结果与分析
2.1 HSCCC分离纯化枸杞多糖方法的构建
2.1.1 HSCCC溶剂系统筛选
HSCCC的分离基于分离物质在流动相和固定相中分配系数的差异而实现。因此,适宜的分配系数K值是HSCCC成功分离的关键,而适宜的溶剂系统是确定K值的基础[23]。由于多糖是大极性化合物,在传统小分子适宜的溶剂系统中难以溶解,而ATPS由于含水量较高(60%~70%)且两相中均含水,大极性化合物往往在两相中都有所分配,特别适用于大极性化合物的分离。固定相保留率也是HSCCC分离一个非常重要的参数,是HSCCC成功分离的前提。通常,固定相的保留率越高,分辨率也越高[24]。
在前期的研究中,利用饱和硫酸铵、乙醇和水构建的ATPS在枸杞多糖提取纯化中表现出一定的优势,但是该体系在HSCCC中的保留率较低。在溶剂系统中加入适量较高黏度的异丙醇后,由于界面张力的增大,进而可以提高固定相保留率[25]。因此,本研究设计并构建了4种ATPS体系,通过调控异丙醇的比例,研究异丙醇的添加量对ATPS固定相保留率的影响,根据固定相保留率和K值筛选最适宜分离LBPs的HSCCC系统。研究发现当异丙醇在溶剂体系中的质量比从0增加到0.3,其固定相保留率从52.6%提升到64%。但是随后异丙醇的质量继续增加时,其固定相保留率也降低。因此,添加适量的异丙醇可以使固定相保留率更大。另一方面,HSCCC分离的两相溶剂体系对样品的分配系数K应该在0.5≤K≤2.0范围内[26]。根据表1结果,发现4种溶剂体系的K值差异不大。但是当以乙醇-饱和硫酸铵-水-异丙醇(1.4:1.0:2.58:0.3,w/w)为两相溶剂体系时,K值适宜。综上所述,以乙醇-硫酸铵-水-异丙醇(1.4:1.0:2.58:0.3,w/w)的比例组成的ATPS确定为HSCCC分离枸杞多糖的最佳溶剂系统。
表 1 ATPS的K值和保留率Table 1. K-values and retention rates of ATPS序号 ATPS组成及比例(w:w) K值 固定相保留率
(%)乙醇 饱和硫酸铵 水 异丙醇 1 1.4 1.0 2.58 0 0.49 52.6 2 1.4 1.0 2.58 0.3 0.58 64.0 3 1.4 1.0 2.58 0.6 0.44 62.2 4 1.4 1.0 2.58 0.9 0.42 59.3 2.1.2 HSCCC色谱条件优化
转速和流动相流速也是HSCCC分离的重要因素,其中转速决定了离心力的大小,对固定相的保留行为产生直接的影响。较高流速的流动相也会对固定相产生较大的作用[27]。在HSCCC溶剂系统筛选的基础上,选择了乙醇-饱和硫酸铵-水-异丙醇(1.4:1.0:2.58:0.3,w/w)溶剂体系用于HSCCC分离。如表2所示,在转速为900 r/min、流动相流速为0.5 mL/min时,该固定相的最大保留率为67.8%,但在流动相流速为0.5 mL/min时,多糖洗脱所需时间过长。综合考虑,最终确定分离条件为900 r/min,流动相流速为0.8 mL/min,在此条件下固定相保留率为64%。
表 2 仪器转速和流动相流速对固定相保留率的影响Table 2. Effects on stationary phase retention of instrument speed and mobile phase flow rate转速(r/min) 流速(mL/min) 固定相保留率(%) 700 0.5 56.3 0.8 53.1 1.1 50.1 800 0.5 62.7 0.8 59.2 1.1 56.3 900 0.5 67.8 0.8 64.0 1.1 60.4 2.1.3 HSCCC分离及多糖含量测定
HSCCC分离LBPs的洗脱曲线如图2A所示,粗多糖溶液通过基于双水相体系的逆流色谱分离,得到3个多糖组分LBPs-1(120.8 mg)、LBPs-2(50.2 mg)和LBPs-3(25.3 mg),多糖含量依次为78.35%±1.52%,69.03%±1.71%,62.11%±2.31%。枸杞多糖在提取过程中夹带有色素杂质,严重干扰其化学结构和功能特征的测定,在分离之前,需要将上述杂质去除。通常用于枸杞多糖脱色的方法主要包括H2O2氧化法、活性炭吸附法和离子交换树脂法[28]。H2O2的强氧化作用会导致多糖的结构发生变化,从而影响其生物活性和构效关系;活性炭无法特异性识别色素和多糖,不仅导致多糖的保留率下降,而且活性炭不能重复使用,增加脱色成本;离子交换树脂在脱色方面表现出一定的优势,但碱性离子交换树脂会吸附酸性多糖,而后者普遍具有显著的生理活性[29]。从图2B~图2E可以看出,采用基于双水相体系的HSCCC分离技术,可以有效脱去枸杞粗多糖中的色素,这是因为将醇/盐双水相体系的高传质效率和优异的相分离能力与HSCCC技术相结合,能够加快枸杞多糖和共存杂质分别向上相和下相的选择性转移,从而实现LBPs同步分离和除杂。
2.2 不同分子量LBPs组分结构表征
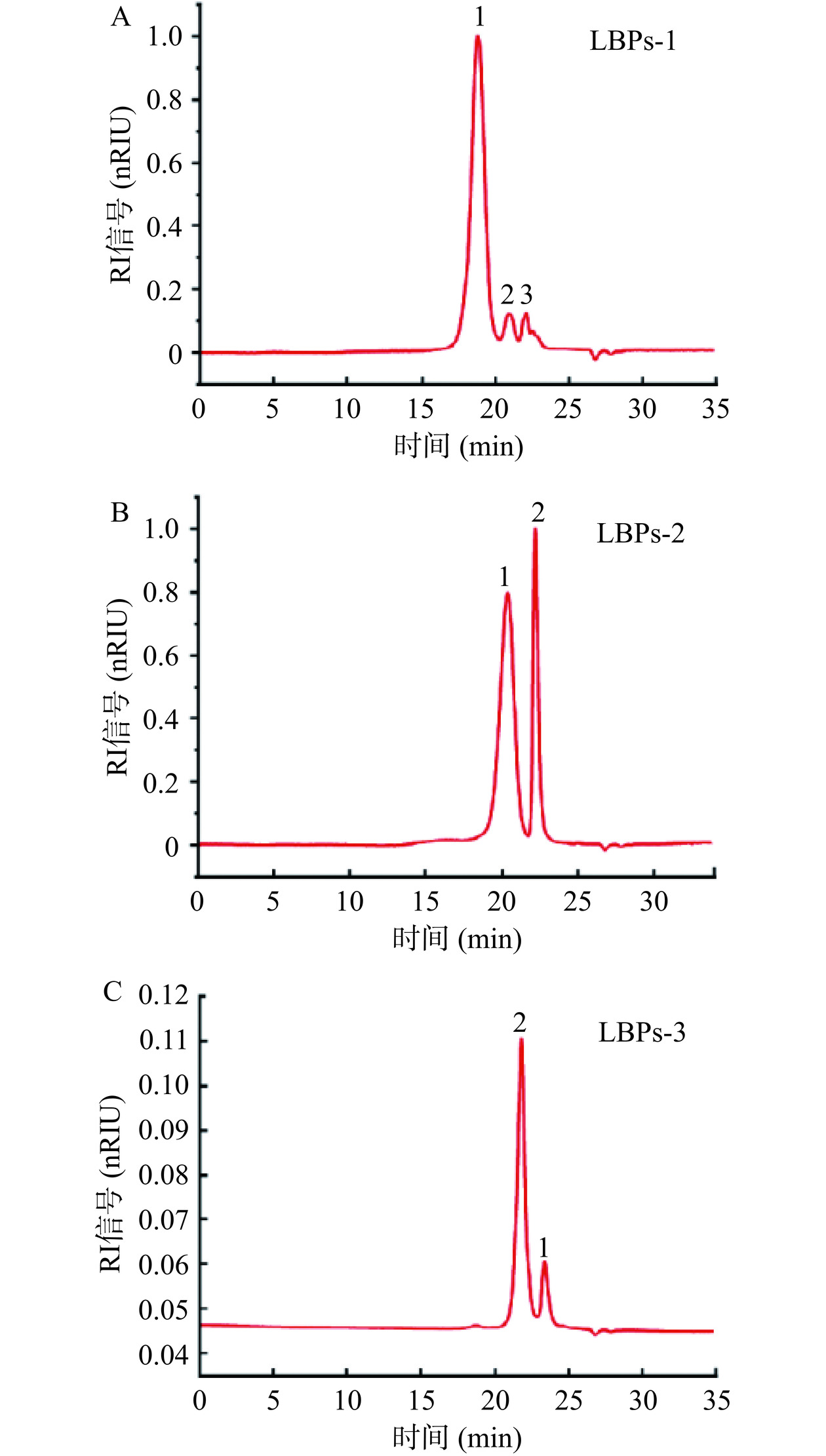
2.2.1 分子量测定
高效分子排阻色谱联用激光光散射仪和示差检测器(HPSEC-MALLS-RI)串联检测法可以准确确定样品的分子量,不依赖于对照品,是表征多糖分子量分布的灵敏方法。图3显示了LBPs的分子量分布,其中LBPs-1、LBPs-2、LBPs-3的分子量分别为7.40×104 Da、2.73×104 Da和1.47×104 Da。由图3可知样品的色谱图均出现了峰2,且分子量均约为1 kDa,进一步透析后的色谱图未见变化,故推断该峰可能为溶剂峰,这可能是由于进样时样品对流动相产生瞬间阻断,然后瞬间涌流,而产生的尖锐溶剂峰[30]。LBPs-1中峰3分子量约8 kDa,可能为未除尽的小分子等杂质。三种LBPs的分子量分布和保留时间也表明,HSCCC洗脱LBPs的顺序为高分子量多糖先洗脱,低分子量多糖后洗脱。此外,通过HSCCC分离纯化LBPs,节省了分级沉淀、脱蛋白、脱色和阴离子交换色谱等传统的繁琐步骤,为大规模制备多糖提供了一种新的分离方法。
2.2.2 单糖组成测定
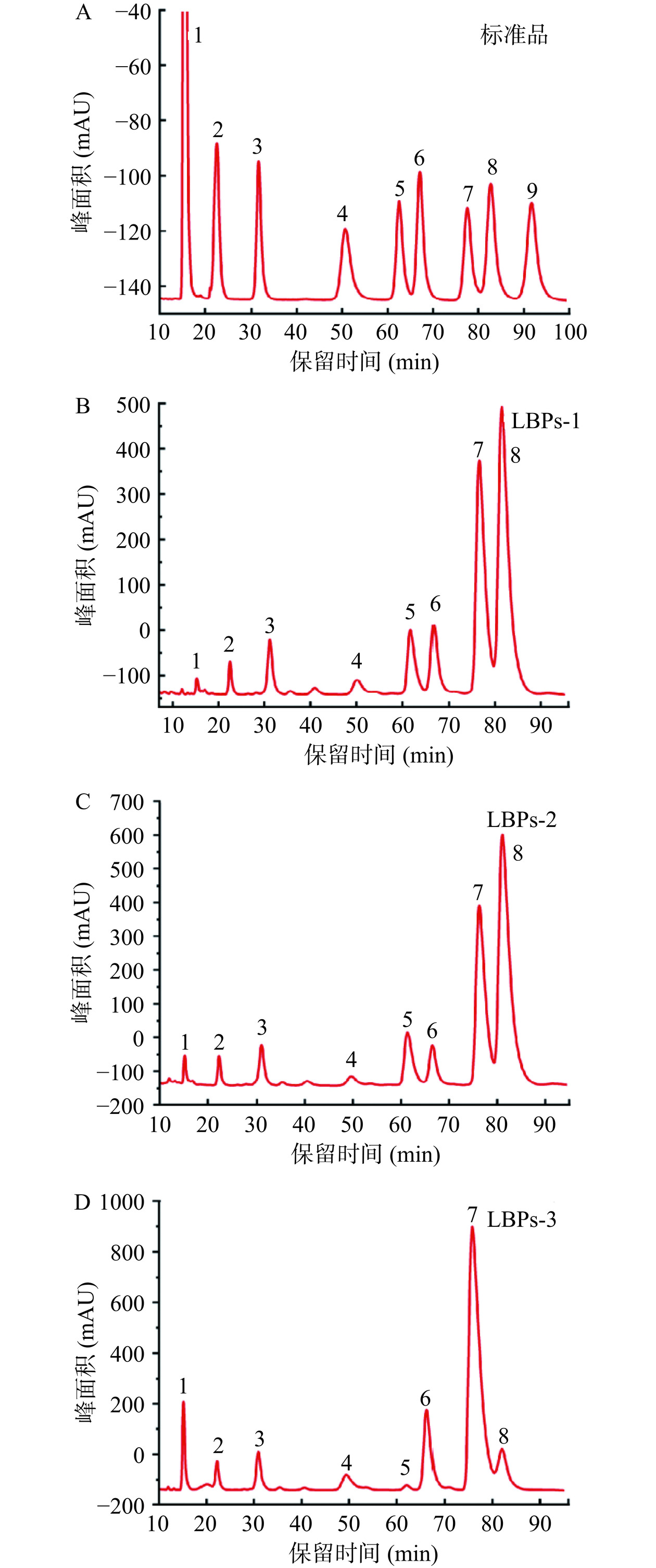
单糖组成是多糖结构解析的重要手段之一。如图4所示,3种多糖由不同摩尔百分比的甘露糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。枸杞多糖 LBPs-1的单糖组成摩尔比为1.9:4.9:1.3:8.1:7.6:32.6:41.8;枸杞多糖LBPs-2的摩尔比为2.1:4.3:1.5:8.3:5.1:28.6:37.9;枸杞多糖LBPs-3的摩尔比为5.9:4.6:1.1:0.7:13.8:66.8:5.3。LBPs-1和LBPs-2中均含有较高的半乳糖和阿拉伯糖,提示这2种LBPs中存在大量的阿拉伯半乳聚糖结构,该类多糖也是枸杞多糖的主要活性结构类型[31]。上述结果表明使用HSCCC从LBPs中分离得到的多糖组分具有不同的单糖组成。
![]() 图 4 单糖标准品混合溶液(A)与多糖样品LBP-1(B)、LBP-2(C)和LBP-3(D)的PMP衍生物色谱图注:1. PMP;2. D-甘露糖;3. L-鼠李糖;4. D-葡萄糖醛酸;5. D-半乳糖醛酸;6. D-葡萄糖;7. D-半乳糖;8. L-阿拉伯糖;9. L-岩藻糖。Figure 4. Chromatograms of mixed solutions of monosaccharide standards (A) and PMP derivatives of polysaccharide samples LBP-1 (B), LBP-2 (C) and LBP-3 (D)
图 4 单糖标准品混合溶液(A)与多糖样品LBP-1(B)、LBP-2(C)和LBP-3(D)的PMP衍生物色谱图注:1. PMP;2. D-甘露糖;3. L-鼠李糖;4. D-葡萄糖醛酸;5. D-半乳糖醛酸;6. D-葡萄糖;7. D-半乳糖;8. L-阿拉伯糖;9. L-岩藻糖。Figure 4. Chromatograms of mixed solutions of monosaccharide standards (A) and PMP derivatives of polysaccharide samples LBP-1 (B), LBP-2 (C) and LBP-3 (D)2.2.3 红外光谱分析
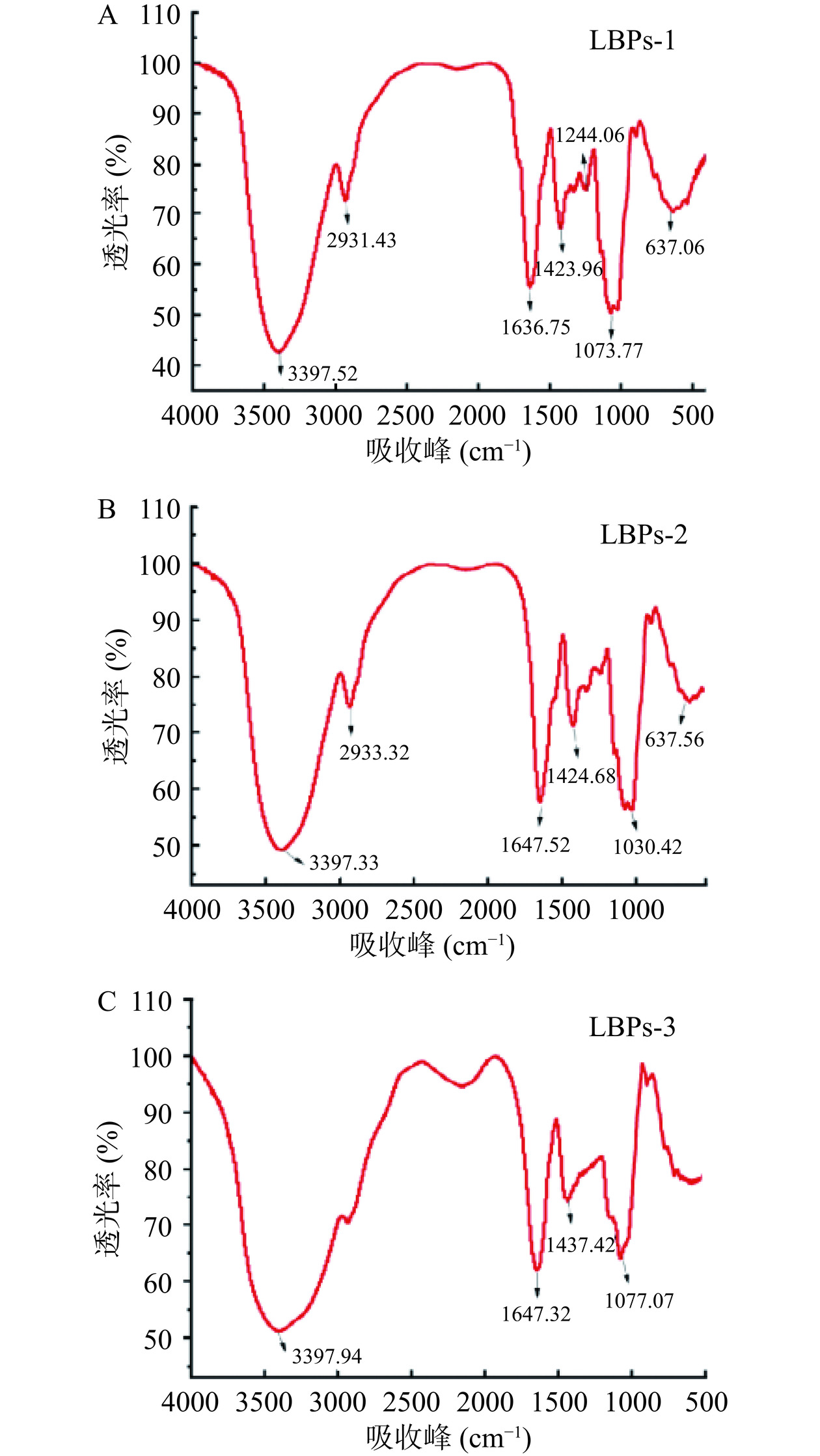
LBPs-1、LBPs-2和LBPs-3的FT-IR光谱分析结果如图5所示。3种多糖的傅立叶变换光谱中观察到类似的多糖特征吸收峰。在3397.5 cm−1附近的宽而强的吸收峰是由分子间和分子内O-H拉伸振动引起的,2931.4 cm−1左右的相对较弱的吸收峰是C-H拉伸振动的吸收[32]。1647.3 cm−1和1647.5 cm−1附近的宽吸收峰分别对应的是羧基(COO−)和由羧基中C=O对称拉伸振动引起[33],提示3种多糖组分均含有一定比例的糖醛酸,这与单糖组成的结果相似。1423.96 cm−1附近的吸收峰是由多糖的C-O引起的,1077.1 cm−1附近左右的强吸收峰是由糖苷键的C-O-C的不对称振动峰引起的,这是吡喃糖的特征吸收峰[34]。
2.2.4 热重分析
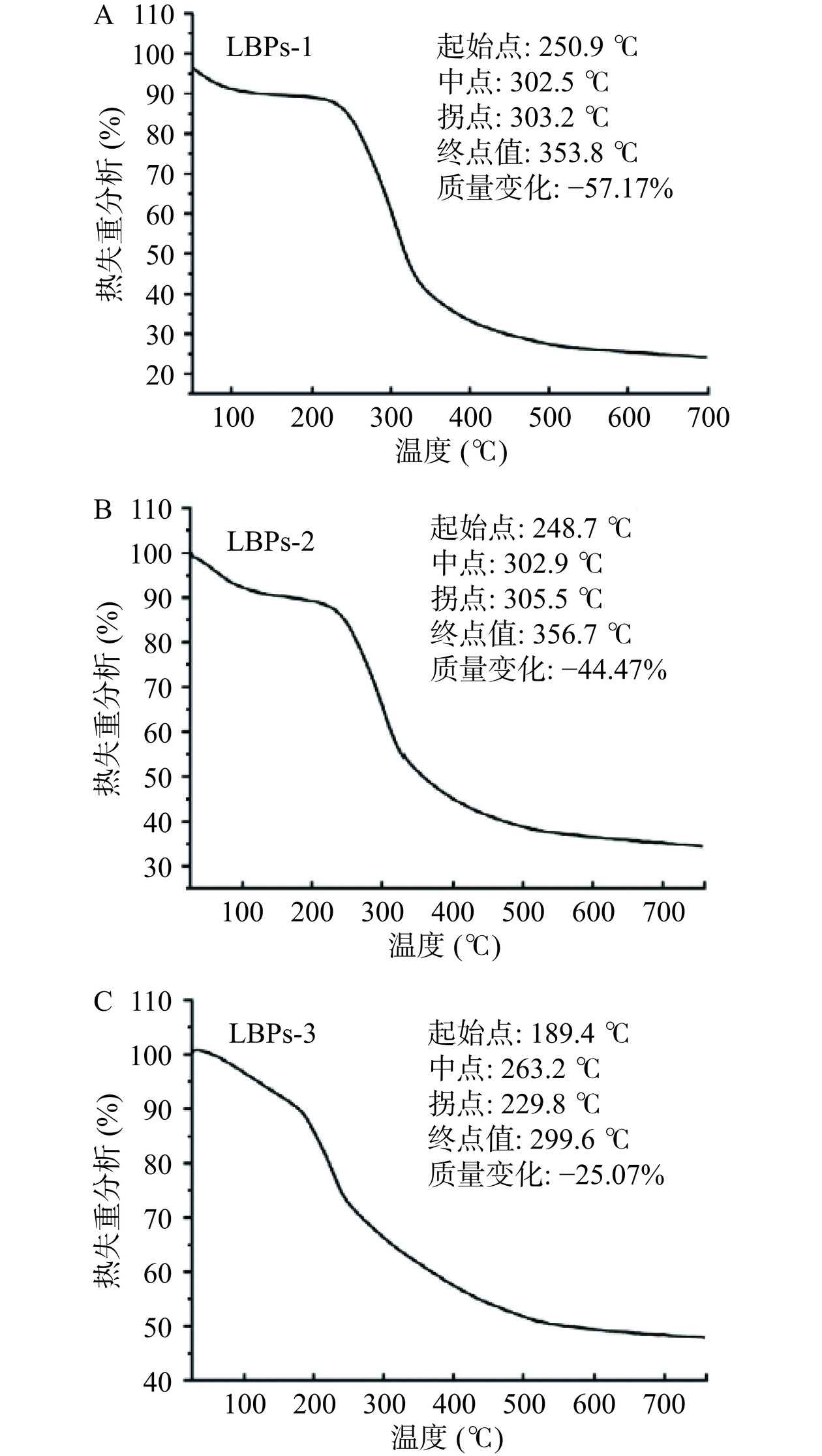
植物多糖的热性能在食品工业中尤为重要。热重分析(thermogravimetric,TG)是研究多糖热转化和热失重的常用宏观热力学方法,可以反映多糖质量随时间和温度的变化,有助于了解多糖的热行为和分析其组成[35]。如图6所示,LBPs-1和LBPs-2具有相似的热分解特征,多糖的失重主要分为3个阶段:第1个阶段主要发生在250 ℃左右,几乎都是10%的质量损失,这是多糖由于存在结合水所致,说明2个多糖在低温阶段都处于稳定状态;第2个阶段多糖失重最为明显,该阶段受高温诱导,样品发生了糖链的解聚和高级结构的破坏。该阶段两种多糖的热重分析曲线变化明显,从图6A和图6B可以看出,LBPs-1和LBPs-2在起始温度、中点温度、拐点温度和终点温度都趋于一致,但是LBPs-1的质量损失明显高于LBPs-2,说明LBPs-2在此阶段的稳定性优于LBPs-1;伴随着温度的进一步升高,多糖的裂解已经完成,所以第3阶段和第1阶段相似,失重缓慢,质量的损失都小于10%。在750 ℃时,LBPs-1的残余量为22%,LBPs-2的残余量为36%,进一步说明LBPs-2具有更好的热稳定性。从图6C可知,LBPs-3分解的过程不同于LBPs-1和LBPs-2,3个分解阶段不明显,并且质量的损失最小,残留率最高,说明其稳定性要远高于LBPs-1和LBPs-2。
2.2.5 扫描电镜分析
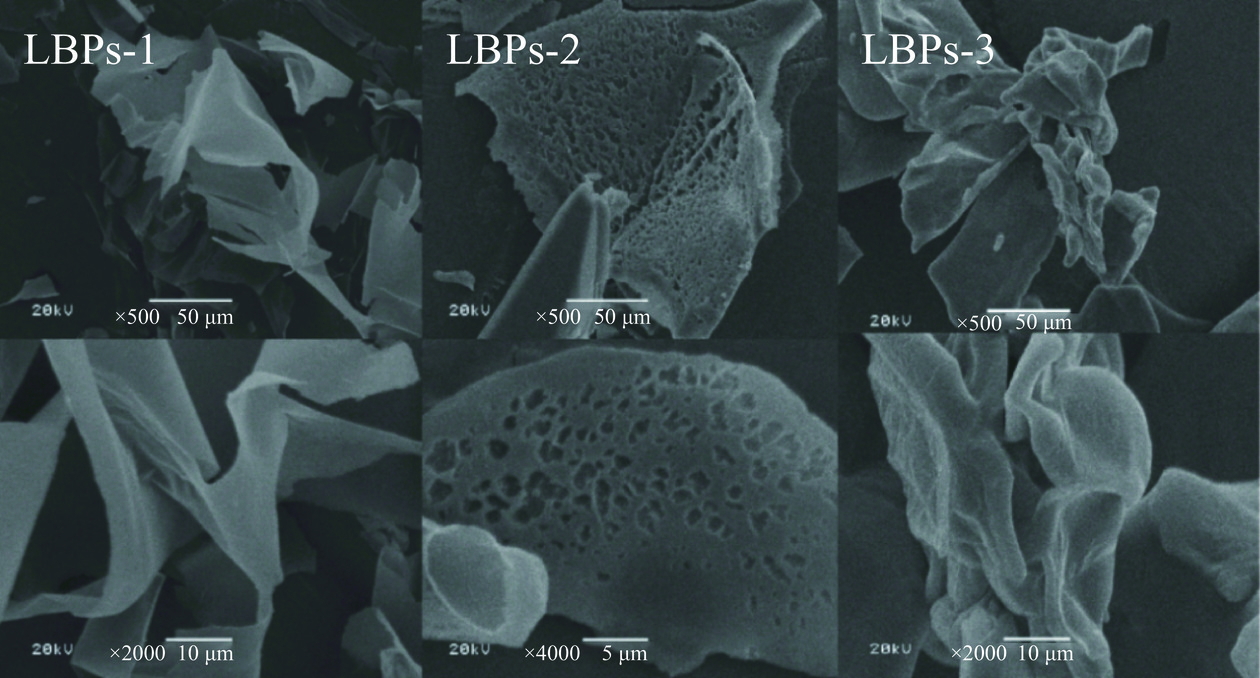
扫描电子显微镜是观察多糖尺寸、形状和孔隙度等形态特征的有效工具[36]。图7显示了3种枸杞多糖在500和2000放大倍数下的SEM图像。3种枸杞多糖的微观形态存在明显差异。其中,LBPs-1主要呈表面光滑,不规则的片状结构;LBPs-2为多孔片状结构,整个呈现出类似珊瑚的形状,随着放大倍数的增加,可以进一步观察到片层结构的表面分布着大小不均匀的多孔结构。LBPs-3表现出多分支的线状棒状结构相互缠绕,呈现出棒状粗糙的结构特征。3种多糖表面结构的差异可能是由于它们存在不同的分子量、单糖组成及分子构象。
2.3 不同分子量LBPs 对脂多糖(LPS)诱导的小胶质细胞(BV2)炎症反应作用
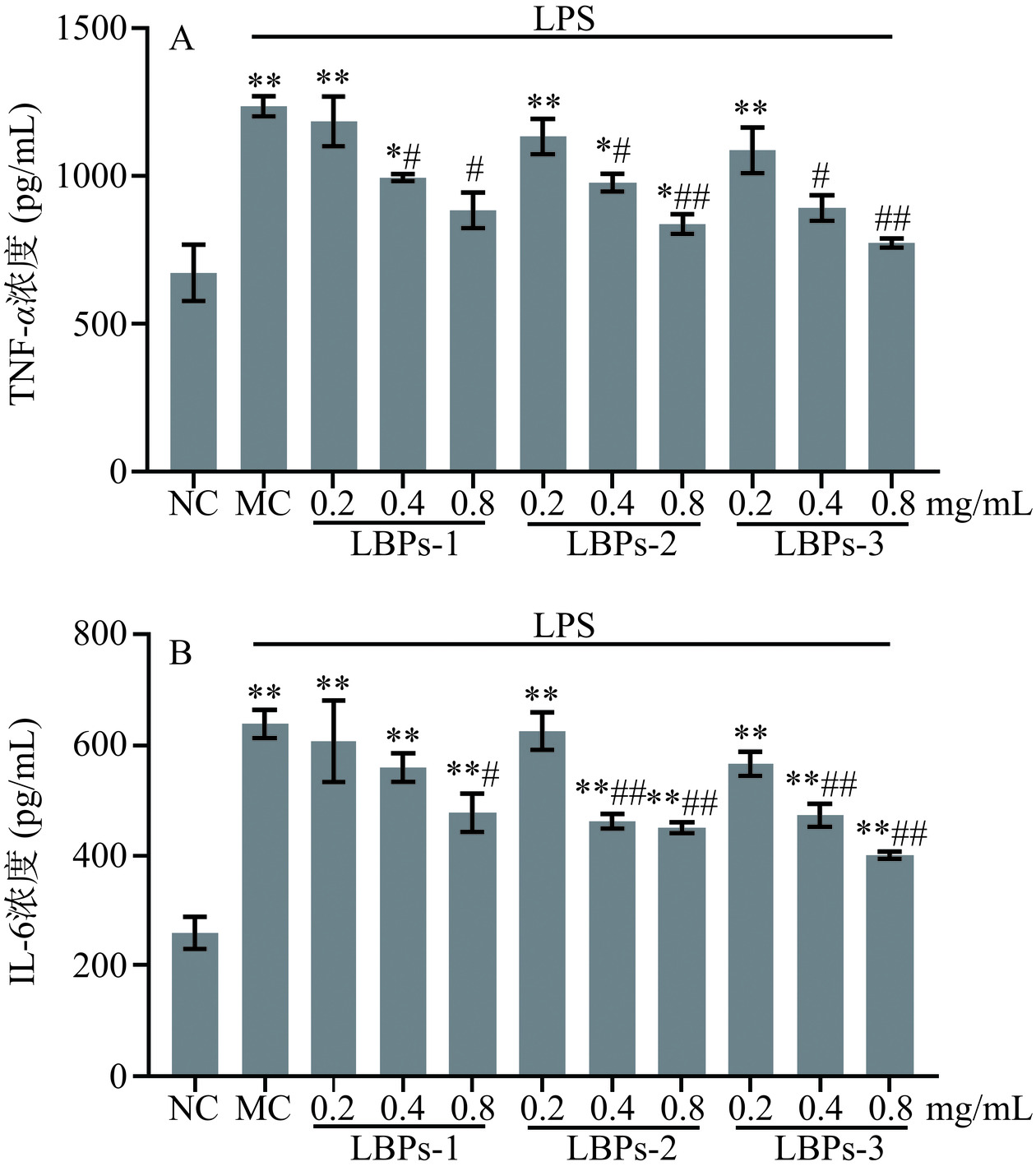
TNF-α对中枢神经系统的生理过程起着调控作用,当其与受体结合时,可增加胞内钙离子水平,进而增加促炎细胞因子IL-6的产生,诱导细胞存活或凋亡[37]。因此,本研究通过LPS刺激BV2小胶质细胞构建体外神经炎症模型,考察枸杞多糖对神经炎症的抑制作用(图8)。ELISA检测结果显示,与NC组相比,MC组BV2细胞培养液TNF-α和IL-6含量极显著增加(P<0.01)。与模型组相比,不同分子量LBPs均可剂量依赖性地降低TNF-α和IL-6浓度,提示枸杞多糖能抑制LPS引起的BV2细胞炎症因子含量增加。同时,对于不同分子量的枸杞多糖来说,抑制作用随着分子量的增长而减弱,同一剂量水平下,不同分子量枸杞多糖中LBPs-3组的TNF-α、IL-6分泌量最低,在中、高剂量(0.4和0.8 mg/mL)组中与模型组相比,差异有统计学意义(P<0.01)。因此,不同分子量的枸杞多糖可能通过抑制炎症因子分泌调控神经炎症,且该活性与枸杞多糖分子量密切相关,其结构与功能的关系以及深入的作用机制有待进一步研究。
3. 结论
本文构建的一种基于ATPS的HSCCC技术分离纯化枸杞多糖的新方法。以分配系数K值和固定相保留率Sf为指标,筛选出了乙醇-饱和硫酸铵-水-异丙醇(1.4:1.0:2.58:0.3,w/w)为最佳的双水相体系,确定转速为900 r/min,流动相流速为0.8 mL/min,在此条件下固定相保留率为64%。褐色的枸杞粗多糖经过HSCCC分离得到3个白色的多糖组分LBPs-1、LBPs-2和LBPs-3,并且通过分子量、单糖组成、红外光谱特征、热稳定性和微观形貌对3个多糖组分进行了初步的结构分析,生物活性研究表明不同分子量的枸杞多糖可能通过抑制炎症因子分泌调控神经炎症。本研究为高速逆流色谱技术在多糖分离纯化中的应用提供了科学依据,通过本研究制备的枸杞多糖具有抑制神经炎症的作用,为枸杞多糖作为神经炎症的保护剂或治疗剂奠定理论与实验基础。
-
图 4 单糖标准品混合溶液(A)与多糖样品LBP-1(B)、LBP-2(C)和LBP-3(D)的PMP衍生物色谱图
注:1. PMP;2. D-甘露糖;3. L-鼠李糖;4. D-葡萄糖醛酸;5. D-半乳糖醛酸;6. D-葡萄糖;7. D-半乳糖;8. L-阿拉伯糖;9. L-岩藻糖。
Figure 4. Chromatograms of mixed solutions of monosaccharide standards (A) and PMP derivatives of polysaccharide samples LBP-1 (B), LBP-2 (C) and LBP-3 (D)
表 1 ATPS的K值和保留率
Table 1 K-values and retention rates of ATPS
序号 ATPS组成及比例(w:w) K值 固定相保留率
(%)乙醇 饱和硫酸铵 水 异丙醇 1 1.4 1.0 2.58 0 0.49 52.6 2 1.4 1.0 2.58 0.3 0.58 64.0 3 1.4 1.0 2.58 0.6 0.44 62.2 4 1.4 1.0 2.58 0.9 0.42 59.3 表 2 仪器转速和流动相流速对固定相保留率的影响
Table 2 Effects on stationary phase retention of instrument speed and mobile phase flow rate
转速(r/min) 流速(mL/min) 固定相保留率(%) 700 0.5 56.3 0.8 53.1 1.1 50.1 800 0.5 62.7 0.8 59.2 1.1 56.3 900 0.5 67.8 0.8 64.0 1.1 60.4 -
[1] JIANG Y Y, YU J, LI Y B, et al. Extraction and antioxidant activities of polysaccharides from roots of Arctium lappa L[J]. International Journal of Biological Macromolecules,2019,123:531−538. doi: 10.1016/j.ijbiomac.2018.11.087
[2] YUAN Q X, LI H, WEI Z Y, et al. Isolation structures and biological activities of polysaccharides from Chlorella:A review[J]. International Journal of Biological Macromolecules,2020,163:2199−2209. doi: 10.1016/j.ijbiomac.2020.09.080
[3] CHEN S, KHAN B M, CHEONG K L, et al. Pumpkin polysaccharides:Purification, characterization and hypoglycemic potential[J]. International Journal of Biological Macromolecules,2019,139:842−849. doi: 10.1016/j.ijbiomac.2019.08.053
[4] WANG S N, ZHAO L L, LI Q H, et al. Rheological properties and chain conformation of soy hull water-soluble polysaccharide fractions obtained by gradient alcohol precipitation[J]. Food Hydrocolloids,2019,91:34−39. doi: 10.1016/j.foodhyd.2018.12.054
[5] WEI J T, ZHANG L H, LIU J F, et al. Protective effect of Lycium barbarum polysaccharide on ethanol-induced injury in human hepatocyte and its mechanism[J]. Journal of Food Biochemistry,2020,44(10):13412.
[6] FERNANDES P A R, COIMBRA M A. The antioxidant activity of polysaccharides:A structure-function relationship overview[J]. Carbohydrate Polymers,2023,314:120965. doi: 10.1016/j.carbpol.2023.120965
[7] WANG G H, HUANG X Y, DUAN W D, et al. Advances in technology of countercurrent chromatography for separation of protein and peptide[J]. Chinese Journal of Analytical Chemistry,2016,44(10):1600−1608. doi: 10.1016/S1872-2040(16)60965-9
[8] 宋道光, 樊鑫宇, 徐顺连, 等. 高速逆流色谱法从小叶金钱草中分离制备三种黄酮苷类化合物[J]. 食品工业科技,2019,40(42):29−33. [SONG D G, FAN X Y, XU S L, et al. Preparation of three flavonoid glycosides compounds from Hydrocotyle sibthorpioides Lam. by high speed counter current chromatography[J]. Science and Technology of Food Industry,2019,40(42):29−33.] SONG D G, FAN X Y, XU S L, et al. Preparation of three flavonoid glycosides compounds from Hydrocotyle sibthorpioides Lam. by high speed counter current chromatography[J]. Science and Technology of Food Industry, 2019, 40(42): 29−33.
[9] WANG N L, PEI D, LIU Y W, et al. Preparation of highly purified oleuropein by combinative technology off line of HSCCC-PHPLC based on dual wavelength[J]. Journal of Food Science,2021,86(10):4457−4465. doi: 10.1111/1750-3841.15903
[10] MAO G H, YU P, ZHAO T, et al. Aqueous two-phase simultaneous extraction and purification of a polysaccharide from Grifola frondosa:Process optimization, structural characteristics and antioxidant activity[J]. Industrial Crops and Products,2022,184:114962. doi: 10.1016/j.indcrop.2022.114962
[11] EHNERT S, SEEHASE J, MÜLLER-RENNO C, et al. Simultaneous quantification of total carbohydrate and protein amounts from aqueous solutions by the sulfuric acid ultraviolet absorption method (SA-UV method)[J]. Analytica Chimica Acta,2021,1174:338712. doi: 10.1016/j.aca.2021.338712
[12] LIU J F, PU Q S, QIU H D, et al. Polysaccharides isolated from Lycium barbarum L. by integrated tandem hybrid membrane technology exert antioxidant activities in mitochondria[J]. Industrial Crops and Products,2021,168:113547. doi: 10.1016/j.indcrop.2021.113547
[13] 王晓丽, 李燕, 骆佼君, 等. 高速逆流色谱仪分离纯化芦荟多糖的研究[J]. 天然产物研究与开发,2011,23(6):1151−1155. [WANG X L, LI Y, LUO J J, et al. Separation and purification of aloe polysaccharides by high-speed counter-current chromatography[J]. Natural Products Research and Development,2011,23(6):1151−1155.] doi: 10.3969/j.issn.1001-6880.2011.06.039 WANG X L, LI Y, LUO J J, et al. Separation and purification of aloe polysaccharides by high-speed counter-current chromatography[J]. Natural Products Research and Development, 2011, 23(6): 1151−1155. doi: 10.3969/j.issn.1001-6880.2011.06.039
[14] SOSA F H B, KILPELÄINEN I, ROCHA J, et al. Recovery of superbase ionic liquid using aqueous two phase systems[J]. Fluid Phase Equilibria,2023,573:113857. doi: 10.1016/j.fluid.2023.113857
[15] 高慧娟, 张佳奇, 张乐乐, 等. 乙醇-硫酸铵双水相体系萃取香椿籽总黄酮工艺优化及其抗氧化活性研究[J]. 中成药,2023,45(12):3879−3883. [GANG H J, ZHANG J Q, ZHANG L L, et al. Optimization of ethanol-ammonium sulfate aqueous two-phase extraction process for total flavonoids from Toona sinensis seeds and their anti-oxidant activity[J]. Chinese Traditional Patent Medicine,2023,45(12):3879−3883.] doi: 10.3969/j.issn.1001-1528.2023.12.003 GANG H J, ZHANG J Q, ZHANG L L, et al. Optimization of ethanol-ammonium sulfate aqueous two-phase extraction process for total flavonoids from Toona sinensis seeds and their anti-oxidant activity[J]. Chinese Traditional Patent Medicine, 2023, 45(12): 3879−3883. doi: 10.3969/j.issn.1001-1528.2023.12.003
[16] 郭好好, 王晶, 陈圆, 等. 高速逆流色谱法提取分离天然产物中生物碱的应用[J]. 中国中药杂志,2023,48(8):1989−1999. [GUO H H, WANG J, CHEN Y, et al. Application of high-speed counter current chromatography in extraction and separation of alkaloids in natural products[J]. Chinese Journal of Traditional Medicine,2023,48(8):1989−1999.] GUO H H, WANG J, CHEN Y, et al. Application of high-speed counter current chromatography in extraction and separation of alkaloids in natural products[J]. Chinese Journal of Traditional Medicine, 2023, 48(8): 1989−1999.
[17] CHEN G J, FANG C C, CHEN X H, et al. High-pressure ultrasonic-assisted extraction of polysaccharides from Mentha haplocalyx:Structure, functional and biological activities[J]. Industrial Crops and Products,2019,130:273−284. doi: 10.1016/j.indcrop.2018.12.086
[18] LÜ F Z, XU X J, ZHANG L N. Natural polysaccharides with different conformations:extraction, structure and anti-tumor activity[J]. Journal of Materials Chemistry B,2020,8(42):9652−9667. doi: 10.1039/D0TB01713B
[19] HOU R R, CHEN J, YUE C J, et al. Modification of lily polysaccharide by selenylation and the immune enhancing activity[J]. Carbohydrate Polymers,2016,142:73−81. doi: 10.1016/j.carbpol.2016.01.032
[20] 罗虹建, 王赛贞, 王联福, 等. 灵芝多糖肽GL-PPSQ2的热分析研究[J]. 药物分析杂志,2023,43(9):1468−1475. [LUO H J, WANG S Z, WANG L F, et al. Thermal analysis of Ganoderma lucidum polysacchar ride peptide GLPPSQ[J]. Chinese Journal of Pharmaceutical Analysis,2023,43(9):1468−1475.] LUO H J, WANG S Z, WANG L F, et al. Thermal analysis of Ganoderma lucidum polysacchar ride peptide GLPPSQ[J]. Chinese Journal of Pharmaceutical Analysis, 2023, 43(9): 1468−1475.
[21] YUAN Y F, WANG Y B, JIANG Y M, et al. Structure identification of a polysaccharide purified from Lycium barbarium fruit[J]. International Journal of Biological Macromolecules,2016,82:696−701. doi: 10.1016/j.ijbiomac.2015.10.069
[22] 陈婷婷, 周雪, 徐旖旎, 等. 天麻超微粉调控胆碱能系统改善血管性痴呆大鼠学习记忆能力[J]. 中国实验方剂学杂志,2020,26(15):26−32. [CHEN T T, ZHOU X, XU Y N, et al. Effect of ultrafine powder of Gastrodiae rhizoma in improving learning and memory ability of vascular dementia rats by regulating cholinergic system[J]. Chinese Journal of Experimental Traditional Medical Formulae,2020,26(15):26−32.] CHEN T T, ZHOU X, XU Y N, et al. Effect of ultrafine powder of Gastrodiae rhizoma in improving learning and memory ability of vascular dementia rats by regulating cholinergic system[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(15): 26−32.
[23] SPÓRNA K A, BERNAŚ K, GRZEGORCZYK A, et al. Liquid chromatographic techniques in betacyanin isomers separation from Gomphrena globosa L. flowers for the determination of their antimicrobial activities[J]. Journal of Pharmaceutical and Biomedical Analysis,2018,161:83−93. doi: 10.1016/j.jpba.2018.08.025
[24] YIN J Y, JIANG Z H, YU H, et al. A new application of an aqueous diphase solvent system in one-step preparation of polysaccharide from the crude water extract of Radix astragali by high-speed counter-current chromatography[J]. Journal of Chromatography A,2012,1262:92−97. doi: 10.1016/j.chroma.2012.08.099
[25] 于培良. 基于双水相系统的高速逆流色谱对大极性化合物分离方法的研究[D]. 南宁:广西中医药大学, 2023. [YU P L. Study on the separation method of highly polar compounds by high-speed counter-current chromatography based on aqueous two-phase system[D]. Nanning:Guangxi University of Chinese Medicine, 2023.] YU P L. Study on the separation method of highly polar compounds by high-speed counter-current chromatography based on aqueous two-phase system[D]. Nanning: Guangxi University of Chinese Medicine, 2023.
[26] SHI S, ZHANG W T, LIU X N, et al. A sustainable and nondestructive method to high-throughput decolor Lycium barbarum L. polysaccharides by graphene-based nano-decoloration[J]. Food Chemistry,2021,338:127749. doi: 10.1016/j.foodchem.2020.127749
[27] 吴梦琪, 黄海, 蔡狄宏, 等. 大孔吸附树脂-高速逆流色谱法分离纯化苦水玫瑰花渣中的鞣花酸[J]. 食品工业科技,2021,42(5):182−187. [WU M Q, HUANG H, CAI D H, et al. Separation and purification of ellagic acid from rosa setate x rosa rugosa waste by macroporous resin and high-speed counter current chromatography[J]. Science and Technology of Food Industry,2021,42(5):182−187.] WU M Q, HUANG H, CAI D H, et al. Separation and purification of ellagic acid from rosa setate x rosa rugosa waste by macroporous resin and high-speed counter current chromatography[J]. Science and Technology of Food Industry, 2021, 42(5): 182−187.
[28] REN Y P, LIU S X. Effects of separation and purification on structural characteristics of polysaccharide from quinoa Chenopodium quinoa Willd[J]. Biochemical and Biophysical Research Communications,2020,522(2):286−291. doi: 10.1016/j.bbrc.2019.10.030
[29] BUTT H S, ULRIKSEN E S, RISE F, et al. Structural elucidation of novel pro-inflammatory polysaccharides from Daphne mezereum L.[J]. Carbohydrate Polymers,2024,324:121554. doi: 10.1016/j.carbpol.2023.121554
[30] 金凯宁, 王飞燕, 陈丽春, 等. 薏苡仁多糖的分离纯化及抗氧化活性研究[J]. 粮食与油脂,2023,36(12):120−124. [JIN K N, WANG F Y, CHEN L C, et al. Study on isolation, purification and antioxidant activity of coix seed polysaccharides[J]. Cereals and Oils,2023,36(12):120−124.] JIN K N, WANG F Y, CHEN L C, et al. Study on isolation, purification and antioxidant activity of coix seed polysaccharides[J]. Cereals and Oils, 2023, 36(12): 120−124.
[31] KOU R B, ZUO G L, LIU J F, et al. Structural properties and hypoglycaemic activity of polysaccharides extracted from the fruits of Lycium barbarum L. using various extraction media[J]. Industrial Crops and Products,2022,188:115725. doi: 10.1016/j.indcrop.2022.115725
[32] LUO L J, WANG Y X, ZHANG S, et al. Preparation and characterization of selenium-rich polysaccharide from Phellinus igniarius and its effects on wound healing[J]. Carbohydrate Polymers,2021,264:117982. doi: 10.1016/j.carbpol.2021.117982
[33] 何源, 王露露, 张晶, 等. 3种鹿源鹿茸多糖含量、红外谱图、抗氧化活性比较[J]. 中成药,2022,44(3):1028−1031. [HE Y, WANG L L, ZHANG J, et al. Comparison of polysaccharide content, infrared spectrum and antioxidant activity of antler from three deer sources[J]. Chinese Archives of Traditional Chinese Medicine,2022,44(3):1028−1031.] doi: 10.3969/j.issn.1001-1528.2022.03.064 HE Y, WANG L L, ZHANG J, et al. Comparison of polysaccharide content, infrared spectrum and antioxidant activity of antler from three deer sources[J]. Chinese Archives of Traditional Chinese Medicine, 2022, 44(3): 1028−1031. doi: 10.3969/j.issn.1001-1528.2022.03.064
[34] CHEN G J, KAN J Q. Characterization of a novel polysaccharide isolated from Rosa roxburghii Tratt fruit and assessment of its antioxidant in vitro and in vivo[J]. International Journal of Biological Macromolecules,2018,107:166−174. doi: 10.1016/j.ijbiomac.2017.08.160
[35] 邢慧珍, 张玉梅, 刘会平, 等. 淡竹叶多糖的制备、热稳定性及其抗氧化活性[J]. 食品研究与开发,2023,44(19):86−96. [XING H Z, ZHANG Y M, LIU H P, et al. Preparation, thermal stability and antioxidant activity of polysaccharide from Lopha therum gracile Brongn[J]. Food Research and Development,2023,44(19):86−96.] doi: 10.12161/j.issn.1005-6521.2023.19.013 XING H Z, ZHANG Y M, LIU H P, et al. Preparation, thermal stability and antioxidant activity of polysaccharide from Lophatherum gracile Brongn[J]. Food Research and Development, 2023, 44(19): 86−96. doi: 10.12161/j.issn.1005-6521.2023.19.013
[36] LIU X G, XU S S, DING X D, et al. Structural characteristics of Medicago Sativa L. polysaccharides and Se-modified polysaccharides as well as their antioxidant and neuroprotective activities[J]. International Journal of Biological Macromolecules,2020,147:1099−1106. doi: 10.1016/j.ijbiomac.2019.10.078
[37] LIU S, LI M, LIU W W, et al. Structure and properties of acidic polysaccharides isolated from Massa medicata Fermentata:Neuroprotective and antioxidant activity[J]. International Journal of Biological Macromolecules,2024,259:129128. doi: 10.1016/j.ijbiomac.2023.129128






 下载:
下载:
 下载:
下载:



