Quantitative Analysis and Antioxidant Activity of Polyphenolic Compounds in Whole Grain, Rice, and Bran of Hulless Barley
-
摘要: 为对比分析青稞全谷物、青稞米和麸皮中多酚化合物的含量及其抗氧化活性,以紫青稞和糯青稞为原料,研磨收集青稞全谷物、青稞米和麸皮,提取其中的β-葡聚糖并检测含量,提取游离酚和结合酚并分析其总多酚、总黄酮含量,并采用UPLC定量分析多酚提取物中的原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、香草醛、对香豆酸、阿魏酸、芥子酸、木犀草素-7-O葡萄糖醛酸、柯伊利素-7-O葡萄糖醛酸、木樨草素、柯伊利素、花青素和8种阿魏酸二聚体,通过DPPH、ABTS评价游离和结合多酚提取物的抗氧化活性。结果表明:β-葡聚糖在全谷物和青稞米中含量较接近,但二者显著高于青稞麸皮(P<0.05);总多酚含量在紫青稞和糯青稞中均呈现麸皮>全谷物>青稞米,且均表现出总多酚含量在游离酚提取物中高于结合酚提取物;总黄酮含量在紫青稞和糯青稞的游离酚提取物中仍呈现麸皮>全谷物>青稞米,且总黄酮含量呈现游离酚提取物中高于结合酚提取物;经过对21种单体酚的定量分析,发现青稞麸皮中检测到的结合多酚种类最多,其次为青稞全谷物,青稞米中最少,所有检测到的多酚中,其含量均呈现为麸皮>全谷物>青稞米,此外,阿魏酸含量在紫青稞和糯青稞麸皮的结合酚提取物中含量远高于其他多酚。紫青稞麸皮的游离酚提取物中检测到高含量的柯伊利素-7-O葡萄糖醛酸(1780.78 μg/g)和花青素(2137.67 μg/g)。抗氧化实验表明青稞麸皮具有强于青稞全谷物和青稞米的清除DPPH和ABTS+自由基的能力。本研究为青稞全谷物以及青稞麸皮的开发利用提供了理论基础。Abstract: This study focused on the extraction and analysis of β-glucan, free and bound phenols, total phenolic content (TPC), and total flavonoid content (TFC) from whole grain, rice, and bran of purple and glutinous hulless barley, and assessment of the antioxidant activity of extracts. Ultra-high-performance liquid chromatography (UPLC) quantified various phenolic compounds, including protocatechuic aicd, p-hydroxybenzoic acid, vanillic acid, caffeic acid, vanillin, p-coumaric acid, ferulic acid, sinspic acid, luteolin-7-O-glucuronide, chrysoeriol-7-O-glucuronide, luteolin, chrysoeriol, anthocyanin and 8 types of ferulic acid dimers. The antioxidant activities of free and bound phenolic extracts were evaluated by using DPPH and ABTS+ free radical scavenging assays. The results revealed that β-glucan content was comparable in whole grains and barley rice but significantly higher than that in bran (P<0.05). TPC and TFC were higher in bran than in whole grains or rice, with free phenolic extracts showing higher content than bound phenolic extracts. Bran contained a greater variety and higher content of bound polyphenols, followed by whole grains and rice. Particularly, ferulic acid was abundant in the bound phenolic extracts of bran of both barley types. The free phenolic extract of purple hulless barley bran showed high levels of chrysoeriol-7-O-glucuronic acid (1780.78 μg/g) and anthocyanins (2137.67 μg/g). Antioxidant assays demonstrated that hulless barley bran exhibited a stronger capability to scavenge DPPH and ABTS+ free radicals than whole grains and rice. This study provides a partial theoretical basis for the development and utilization of whole grain of hulless barley and hulless barley bran.
-
Keywords:
- hulless barley /
- polyphenol /
- anthocyanin /
- UPLC /
- antioxidant activity
-
青稞(Hordeum vulgare L. var. nudum Hook. f),属禾本科大麦属一年生早本植物,是多棱大麦亚种里的多棱裸粒大麦变种群,又名裸大麦、米大麦、元麦,因其成熟以后内外颖壳分离,籽粒裸露而得名[1]。青稞具有生长周期短、耐寒、耐贫瘠等特点,主要生长于世界各地的高原地区,在我国主要分布于西藏、青海、甘肃(甘南)、四川(甘孜州和阿坝州)和云南(迪庆)等地[2]。青稞是一种优质的谷类作物,其组分具有“三高两低”的特点,即高纤维、高蛋白、高维生素和低糖、低脂肪,此外还富含矿物质、维生素,以及β-葡聚糖、γ-氨基丁酸、植物甾醇、酚酸、黄酮、花青素等功能物质[3],据报道青稞对糖尿病、心血管疾病、肠道癌等有预防和缓解作用[4−5]。
研究表明全谷物和全谷物制品的食用比单纯摄入能量和营养对人体更加健康,在一定程度上可以缓和慢性疾病的发展,这与其所含的活性成分密切相关,包括膳食纤维、多酚、β葡聚糖、生育酚、抗性淀粉等[6]。在谷物中多酚类化合物是主要的抗氧化成分,被认为是全谷物发挥作用的主要物质基础[7]。青稞中多酚类化合物主要为酚酸类、黄酮类、二苯乙烯类和木酚素类等,常与有机酸、胺类、脂质、多糖、其他酚类等以糖苷键连接[8],形成游离型、结合型、酯化型三种形态存在[9]。β-葡聚糖是青稞胚乳和糊粉层细胞壁的主要组成成分,可降低血浆中胆固醇和脂肪含量,从而有效预防高血脂症、高血压症和心血管疾病等,常被作为评价青稞品质的重要指标,是青稞中重要的功能物质,据报道青稞是世界上麦类作物中β-葡聚糖含量最高的作物[10]。青稞在加工过程中通常去除麸皮而保留胚和胚芽,青稞麸皮中含有β-葡聚糖、黄酮、多酚、花青素等活性物质[11−13],但是目前青稞麸皮多用于动物饲料或直接废弃,这导致大量生物活性物质的浪费。已有研究对青稞中活性成分的研究多以化合物定性为主[14−15],鲜有关于青稞麸皮与青稞全谷物和青稞米定量分析比较研究,本研究团队在前期对青稞中的三种形态多酚做了质谱鉴定,但因缺乏标准品仅对少量多酚单体做定量分析,本实验收集了21种多酚单体标准品,对紫青稞和糯青稞两个青稞品种的全谷物、青稞米和麸皮三个部位的游离和结合态多酚提取物进行定量分析,并检测总多酚、总黄酮和β-葡聚糖含量,同时评价其抗氧化活性,以期为青稞加工,以及青稞中多酚与β-葡聚糖的利用提供理论基础。
1. 材料与方法
1.1 材料与仪器
紫青稞(康青11号)、糯青稞(中糯8号) 甘孜藏族自治州农业科学研究所提供;甲醇、福林酚试剂、没食子酸、芦丁 上海研生生化试剂有限公司;Megazyme试剂盒 爱尔兰Megazyme公司;原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、香草醛、对香豆酸、阿魏酸、芥子酸、木犀草素-7-O-葡萄糖醛酸、木樨草素、矢车菊-3-芸香糖,阿魏酸二聚体:8-5二聚体(8-5-DFA)、8-5(脱羧)二聚体(8-5dc-DFA)、8-8开环二聚体(8-8nc-DFA)、8-8(芳基萘满)二聚体(8-8c-DFA)、8-8(四氢呋喃)二聚体(8-8thf-DFA)、5-5二聚体(5-5-DFA)、8-O-4二聚体(8-O-4-DFA)、5-O-4二聚体(5-O-4-DFA) 纯度≥98%,北京索莱宝科技有限公司;柯伊利素-7-O-葡萄糖醛酸、柯伊利素 本实验室分离纯化获得,纯度≥98%,经核磁、质谱、红外等鉴定且相关数据已发表论文[16]。
3000FA型多功能酶标仪 上海闪谱公司;1290高效液相色谱仪(配备自动进样器、二元泵、柱温箱、DAD检测器) 美国Agilent公司;JNM-III型实验室用小型碾米机 成都中储粮研究所;UPC-1-10T型优普系列超纯水机 成都超纯科技有限公司。
1.2 实验方法
1.2.1 青稞全谷物、青稞米、青稞麸皮的制备
称取20 g青稞,研磨得7%的青稞皮粉,平行三次,合并得青稞皮粉。收集青稞全谷物、研磨后的青稞米、研磨后的皮粉,粉碎过40目筛,备用。
1.2.2 β-葡聚糖的提取与测定
青稞粉0.1 g于15 mL离心管中,加0.2 mL 50%乙醇溶液混匀,再加4 mL磷酸盐缓冲液(20 mmol/L,pH6.5)混匀,于沸水浴中加热5 min,每隔半分钟取出于漩涡振荡器混匀,防止其结块。再于50 ℃水浴5 min,加0.2 mL地衣酶(10 U),于50 ℃恒温水浴锅中酶解1 h。加入5 mL醋酸钠缓冲液(200 mmol/L,pH4.0)混匀5 min,1000 r/min离心10 min,取上清液即为待测样品液,β-葡聚糖含量采用β-葡聚糖试剂盒法测定,以D-木糖为标准品绘制标准曲线(y=0.5096x−0.0073,R2=0.9959,线性范围0~0.6 mg/mL)。
1.2.3 游离酚和结合酚的提取
提取方法参考Xia等[9],略作修改。称取2.0 g样品加入20 mL 80%丙酮,30 ℃超声20 min,6000 r/min离心10 min,收集上清液,残渣再重复提取2次,合并上清液,45 ℃减压浓缩蒸干,再用甲醇定容至5 mL,得青稞游离酚提取物,−20 ℃避光保存。向提取过游离酚的残渣中加入20 mL正己烷,振荡后离心(2000 r/min,5 min)弃去上清液,向沉淀物中加入15 mL 10%甲醇硫酸溶液,70 ℃下水浴1 h。用20 mL乙酸乙酯萃取5次,离心(4000 r/min,5 min),合并乙酸乙酯萃取相,在45 ℃条件下旋转蒸发至干,残余物用甲醇定容至5 mL,得青稞结合酚提取物,−20 ℃避光保存。
1.2.4 总多酚和总黄酮含量测定
采用福林酚法测定总多酚含量,20 μL待测液中加入20 μL福林酚试剂,混匀静置5 min,加入80 μL 10% Na2CO3溶液,室温避光反应60 min,于765 nm处测吸光值。以没食子酸溶液的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。没食子酸线性回归方程为y=0.004x+0.082,线性范围为8.1~260 μg/mL,R2=0.9992。NaNO2-Al(NO3)3-NaOH比色法测定总黄酮含量,待测液中加入10 μL 25%(m/v)NaNO2反应6 min,再加入10 μL 10% AlCl3反应5 min,加入30 μL 1 mol/L NaOH,于510 nm处测定吸光值,以芦丁溶液的质量浓度(μg/mL)为横坐标,吸光值为纵坐标绘制标准曲线,得到芦丁线性回归方程为y=0.0013x+0.0655,R2=0.9993,线性范围为29.375~470 μg/mL。
1.2.5 多酚单体和花青素含量测定
应用超高效液相色谱法[9]。提取液经0.22 μm微孔水相膜过滤进样分析,色谱柱安捷伦Poroshell 120 PFP column(4.6 mm×100 mm,2.7 µm);DAD检测器,多酚检测波长254、280、320和350 nm,花青素(矢车菊-3-芸香糖)525 nm;柱温30 ℃;流速0.8 mL/min;进样量5 μL。流动相:A为0.1%甲酸水,B为乙腈,梯度洗脱:0~10 min(5%~10% B),10~20 min(10%~20% B),20~35 min(20%~40% B),35~40 min(40%~70% B),40~45 min(70%~95% B)。称取一定量标准品,分别用甲醇溶解并定容至5 mL作为标准品母液,以二倍稀释法制备不同浓度梯度标准品溶液,以质量浓度(μg/mL)为横坐标,峰面积为纵坐标绘制标准曲线,得线性方程如表1所示。
表 1 多酚单体和花青素标准品的标准曲线Table 1. Standard curves of polyphenol monomers and anthocyanin standards名称 检测波长(nm) 线性回归方程 R2 线性范围(μg/mL) 8-5-DFA 320 y=11.389x+2.4316 0.9997 1.15625~37 8-5dc-DFA 320 y=39.224x−14.206 0.9999 0.79375~50.8 8-8nc-DFA 320 y=31.932x−3.7233 0.9999 0.778~49.8 8-8c-DFA 320 y=17.158x+2.7055 0.9996 1.01~64.7 8-8thf-DFA 280 y=4.9636x−0.1315 0.9988 3.04~48.7 5-5-DFA 320 y=27.939x−0.0119 0.9998 0.8~51.2 8-O-4-DFA 320 y=30.197x+1.1451 0.9996 0.4875~31.2 5-O-4-DFA 320 y=32.246x−2.7407 0.9996 0.4828~30.9 原儿茶酸 254 y=22.073x−8.3669 0.9999 1.12~280 对羟基苯甲酸 254 y=40.37x+4.554 0.999 0.64~320.9 香草酸 280 y=19.58x+1.253 0.999 1.0~250.2 咖啡酸 320 y=34.67x−21.02 0.999 1.04~267 香草醛 280 y=23.89x−0.690 0.9999 1.2~301.5 对香豆酸 320 y=40.14x−11.39 0.998 0.67~167 阿魏酸 320 y=40.163x−1.3353 0.999 0.5~200 芥子酸 320 y=28.36x−1.624 0.999 0.5~202.8 木犀草素-7-O-葡萄糖醛酸 350 y=11.245x+2.217 0.9999 2~200 柯伊利素-7-O-葡萄糖醛酸 350 y=9.3088x−64.583 0.9999 2.5~225 木樨草素 350 y=10.11x−7.34 0.9999 2~200 柯伊利素 350 y=12.366x+1.0054 0.9999 2.46~246 矢车菊-3-芸香糖 525 y=2.6728x+5.2883 0.9999 0~0.6 1.2.6 抗氧化活性评价
采用DPPH和ABTS+自由基清除法测定青稞多酚提物的体外抗氧化活性[17],100 μL样品中加入等体积80% DPPH甲醇溶液(48 μg/mL),室温静置30 min后于517 nm测吸光值,标准曲线制作:水溶性维生素E(Trolox,母液浓度56 μg/mL,无水乙醇配制),二倍稀释,以浓度和吸光值绘制曲线,Y=0.021X−0.005,R2=0.9997,线性范围0.4375~14 μg/mL,DPPH自由基清除率以Trolox当量计算,单位为mg/g。取40 μL样品,加入160 μL 80%甲醇ABTS溶液(A=0.7左右),避光反应6 min于734 nm处测定吸光值,Trolox(母液浓度56 μg/mL,无水乙醇配制),稀释(28、14、7、5.6、2.8 μg/mL)制作标准曲线,以浓度和吸光值绘制曲线,Y=0.0117X−0.0086,R2=0.9995,线性范围2.8~28 μg/mL,ABTS+自由基清除率以Trolox当量计算,单位为mg/g。
1.3 数据处理
所有数据均为3次重复实验的平均值,应用Microsoft Excel 97-2003和SPSS 20.0对数据进行处理和分析,采用Origin 2021作图。
2. 结果与分析
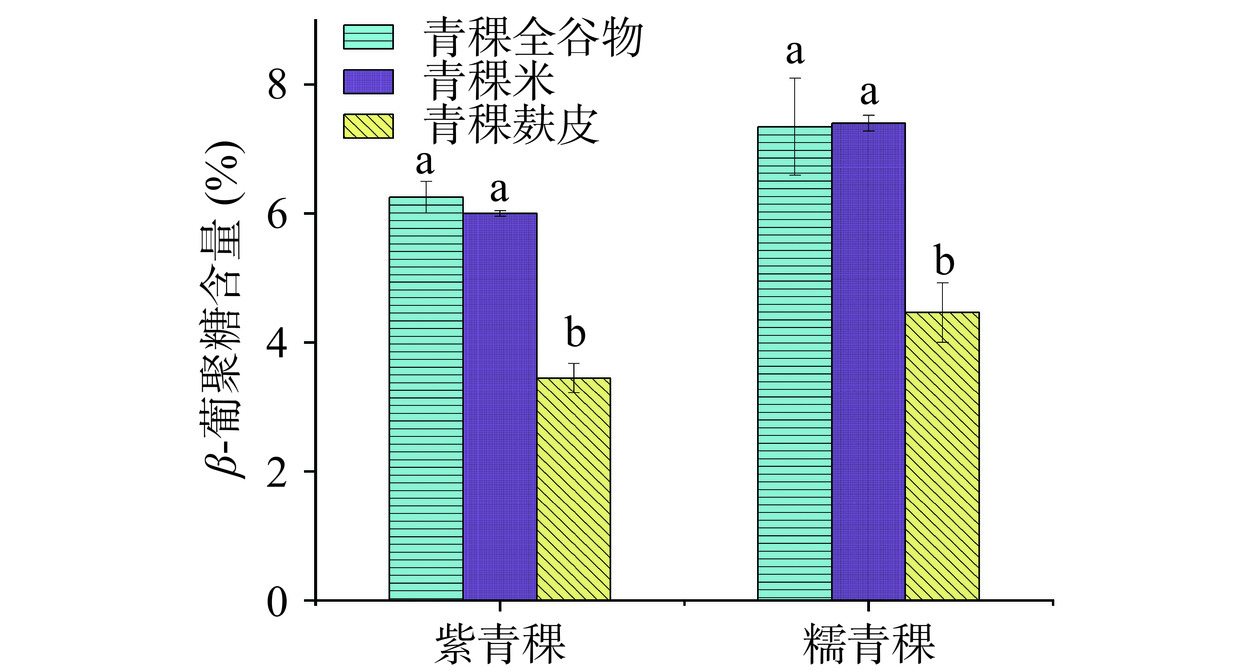
2.1 青稞全谷物、青稞米和麸皮中β-葡聚糖含量分析
由图1可知,β-葡聚糖在紫青稞和糯青稞的全谷物和青稞米中含量较接近,同时二者显著高于青稞麸皮(P<0.05),这说明β-葡聚糖既存在于青稞米(胚乳和胚芽)中也存在于麸皮中(果皮、种皮、糊粉层和亚糊粉层),但其含量在青稞麸皮中最少。江春艳等[18]报道β-葡聚糖是青稞籽粒胚乳细胞壁的主要成分,占细胞壁干重的75%左右,此外,张峰等[19]报道β-葡聚糖存在于糊粉层和亚糊层的交界面。不同颜色青稞的总β-葡聚糖含量为5.81%~6.29%,Lin等[20]认为彩色的青稞具有更高含量的β-葡聚糖,但本次实验中,β-葡聚糖在糯青稞中含量高于紫青稞,这可能与品种差异有关,有学者认为β-葡聚糖的含量会因作物的品种和栽培地的不同而存在着极大的差异[21]。
2.2 青稞中总多酚和总黄酮含量分析
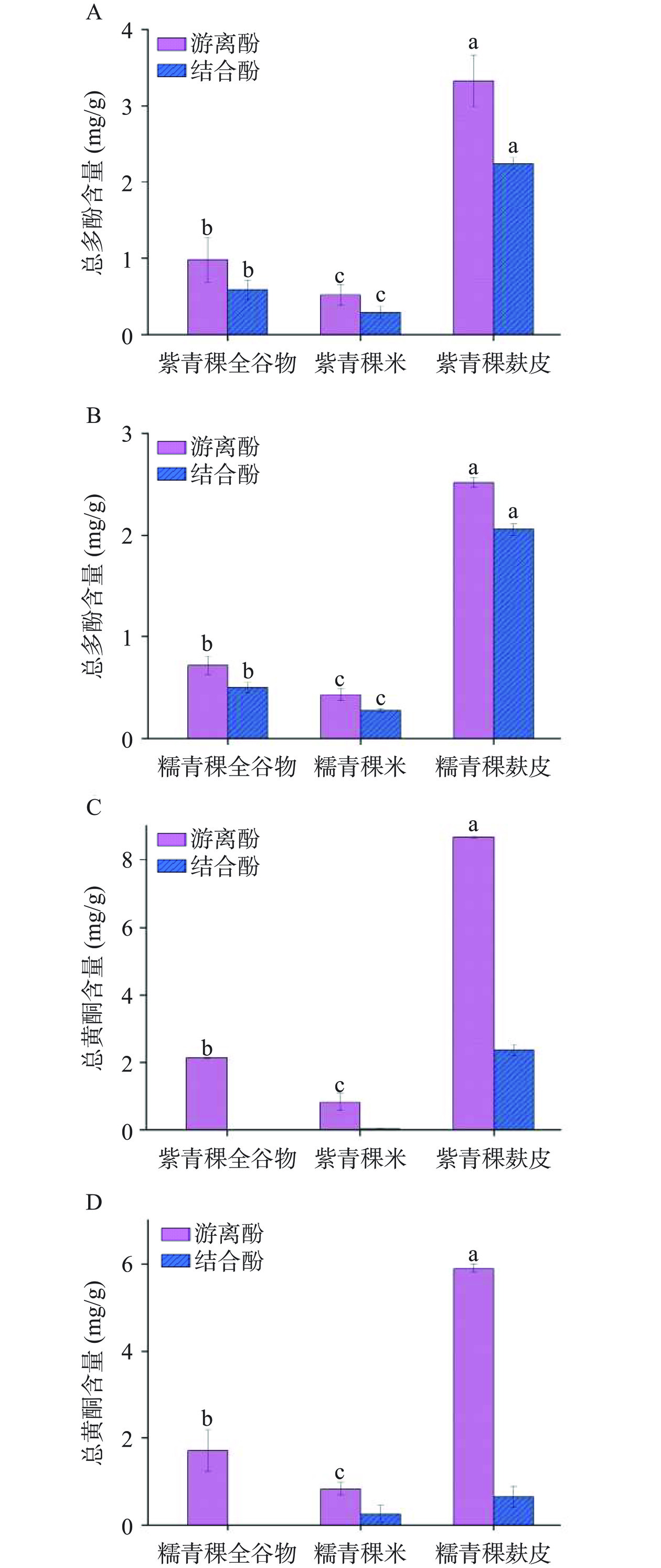
由图2A和图2B可知,游离酚和结合酚提取物中,总多酚含量在紫青稞和糯青稞中均呈现麸皮>全谷物>青稞米,这与Xia等[9]、Šimić等[22]和Feng等[23]在青稞中的研究结果一致。多酚作为植物次生代谢产物,在植物种子萌发、植物生长和发育、植物抗霜冻和防御病虫害等过程中均起到重要作用[24−25],在种子中其分布常由外到内依次降低[26]。此外,在紫青稞和糯青稞中均表现出总多酚含量在游离酚提取物中高于结合酚提取物,这与Narwal等[27]和Deng等[28]在青稞中发现结合酚含量高于游离酚的结果相反,推测这可能由品种差异造成,不同品种可能具有独特的多酚化合物,比如在表3的结果中,紫青稞的3种游离酚提取物中均检测到柯伊利素-7-O葡萄糖醛酸,且在紫青稞麸皮中含量高达1780.78 μg/g,以及在紫青稞麸皮中检测到高含量的花青素(2137.67 μg/g),但这两种化合物以及木犀草素-7-O葡萄糖醛酸、木犀草素、柯伊利素在糯青稞的3种提取物中均未检测到。但这一结果与Xia等[9]在青稞分层研磨试验中的结果相似,其将青稞通过研磨由外到内依次分成5个组分,发现这5个组分中的总多酚含量均呈现在游离酚提取物中高于结合酚提取物,此外Zhang等[29]和Pradeep等[30]在黑米麸皮和小米中也发现相似的结果。
![]() 图 2 紫青稞和糯青稞的游离酚与结合酚提取物中总多酚和总黄酮含量注:组间不同字母表示差异显著(P<0.05);图3同。Figure 2. TPC and TFC in free and bound phenolic extracts of purple and glutinous hulless barley表 3 紫青稞的游离酚提取物中多酚含量(μg/g)Table 3. Contents of polyphenols in free phenolic extracts of purple hulless barley (μg/g)
图 2 紫青稞和糯青稞的游离酚与结合酚提取物中总多酚和总黄酮含量注:组间不同字母表示差异显著(P<0.05);图3同。Figure 2. TPC and TFC in free and bound phenolic extracts of purple and glutinous hulless barley表 3 紫青稞的游离酚提取物中多酚含量(μg/g)Table 3. Contents of polyphenols in free phenolic extracts of purple hulless barley (μg/g)样品 花青素 木犀草素-7-O葡萄糖醛酸 柯伊利素-7-O葡萄糖醛酸 木犀草素 柯伊利素 紫青稞麸皮 2137.67±6.90 144.31±1.16 1780.78±4.06 48.46±2.63 274.59±0.99 紫青稞全谷物 246.77±11.62 21.53±0.03 404.40±1.14 − 41.87±0.55 紫青稞米 − − 80.28±0.18 − − 黄酮类化合物是一类以二苯基色原酮(C6-C3-C6)为基本骨架,由两个芳香环(A环与B环)通过中间三碳结构连接而成的植物次生代谢产物,具有优良的抗氧化和抗癌活性[31]。紫青稞和糯青稞的全谷物结合酚提取物中均未检测到总黄酮,这可能是含量过低导致。由图2C和图2D可知,总黄酮含量在紫青稞和糯青稞的游离酚提取物中仍呈现麸皮>全谷物>青稞米,这一趋势与总多酚在游离酚提取物中的变化趋势一致。Xia等[9]也发现青稞最外层组分中黄酮含量最高,由外到内依次降低。黄酮类化合物在多酚中所占比例最大,超过4000种天然酚类化合物都归属于此,主要以结合态(黄酮苷)存在,少量以游离态(黄酮苷元)的形式存在于植物体内[32],但本实验中紫青稞和糯青稞中总黄酮含量均呈现游离酚提取物中高于结合酚提取物,这与Xia等[9]的结果一致,推测这可能与品种差异有关,不同品种含有特异性的黄酮化合物,比如紫青稞麸皮的游离酚提取物中检测到高含量的柯伊利素-7-O葡萄糖醛酸(1780.78 μg/g)和花青素(2137.67 μg/g),但糯青稞麸皮的游离酚提取物中并未检测到这些物质。
2.3 青稞提取物中多酚化合物的定量分析
2.3.1 青稞结合酚提取物中多酚定量分析
本实验共有21种单体酚对照品,由表2可知,紫青稞麸皮中检测到16种结合酚,糯青稞麸皮中检测到13种;紫青稞全谷物检测到6种结合酚,糯青稞全谷物中检测到8种;紫青稞米中检测到4种结合酚,糯青稞米中仅检测到2种,这一结果表明青稞麸皮中检测到的结合酚种类最多,其次为青稞全谷物,青稞米中最少,所有检测到的多酚中,其含量均呈现为麸皮>全谷物>青稞米,这一结果与总多酚含量的变化趋势一致。Xia等[9]和Šimić等[22]也在青稞的麸皮中检测到比青稞胚和胚乳中更多种类和含量的结合酚。此外,阿魏酸在紫青稞和糯青稞的结合酚中含量远高于其他多酚,这与其他学者们在青稞和大麦中关于阿魏酸的研究结果一致[33−34],其次为8-O-4-DFA、8-8c-DFA、8-8nc-DFA、8-5dc-DFA、对香豆酸等。Martínez等[34]在青稞中检测到的主要多酚为阿魏酸(顺和反式),及其二聚体和三聚体、对香豆酸等。目前已知的阿魏酸脱氢二聚体共有9种[35],本实验中在紫青稞麸皮和糯青稞麸皮中均检测到7种阿魏酸二聚体,Lyons等[36]认为细胞壁的阿魏酰化在一定程度上能够抗病原体和昆虫。阿魏酸(4-羟基-3-甲氧基肉桂酸)是植物多酚中含量最高的酚酸之一,其很少以游离态存在,常与多糖、蛋白质、木质素和膳食纤维等共价结合出现[37],被认为是谷物细胞壁上含量最高的多酚[38],研究认为阿魏酸是细胞壁木质化的起点和晶核,其在细胞壁上的沉积导致了植物生长和发育期间细胞壁内大分子的交联以及控制着细胞壁内非随机模式的木素形成[39]。此外,紫青稞和糯青稞在全谷物、青稞米、麸皮中阿魏酸含量均呈现较大差异,这表明阿魏酸含量在青稞中受品种影响较大,这与Zhu等[40]的研究结果一致。除了阿魏酸及其二聚体外,还在青稞麸皮中检测到对香豆酸、香草醛、咖啡酸、香草酸、对羟基苯甲酸、柯伊利素-7-O葡萄糖醛酸、芥子酸等多酚。
表 2 紫青稞和糯青稞的结合酚提取物中多酚含量(μg/g)Table 2. Contents of polyphenols in bound phenolic extracts of purple and glutinous hulless barley (μg/g)样品 原儿
茶酸对羟基
苯甲酸香草酸 咖啡酸 香草醛 对香
豆酸阿魏酸 芥子酸 8-5-DFA 5-5-DFA 8-8thf-DFA 柯伊利素-
7-O葡萄糖
醛酸8-8c-DFA 8-8nc-DFA 8-O-4-DFA 5-O-4-DFA 8-5dc-DFA 紫青稞 麸皮 13.54±
2.514.49±
0.327.08±
0.657.35±
1.464.33±
0.347.19±
1.24158.14±
2.432.76±
0.2410.76±
1.792.05±
0.289.19±
0.7782.55±
2.7630.10±
1.7512.57±
1.3532.54±
2.30− 6.85±
0.68全谷物 − − − − − − 37.91±
0.29− 2.26±
0.20− − − 4.82±
1.232.95±
0.697.14±
1.18− 2.56±
0.02青稞米 − − − − − − 23.08±
1.70− − − − − 1.34±
0.161.62±
0.172.91±
0.42− − 糯青稞 麸皮 − − 3.91±
0.824.95±
0.643.79±
0.347.57±
0.10376.29±
0.812.27±
0.1628.74±
0.942.32±
0.05− − 39.69±
1.5033.19±
2.0965.58±
1.201.48±
0.3823.07±
1.27全谷物 − − − − 2.29±
0.554.02±
0.10176.96±
6.39− 11.27±
0.86− − − 16.83±
0.6416.97±
0.4032.11±
1.23− 8.01±
0.69青稞米 − − − − − − 13.73±
1.93− − − − − − − 1.62±
0.73− − 2.3.2 青稞游离酚提取物中多酚定量分析
紫青稞麸皮中发现有柯伊利素-7-O葡萄糖醛酸、花青素、木犀草素-7-O葡萄糖醛酸、木犀草素、柯伊利素,但在糯青稞中并未检测到这些化合物,Serafino等[21]认为大麦籽粒中黄酮类化合物的含量常与谷粒颜色的深浅成比例,紫色和蓝色大麦籽粒中黄酮含量通常比其他颜色籽粒更高。糯青稞颜色为白色,其含有较高含量的支链淀粉(经检测含量约为59%,紫青稞支链淀粉含量46%)。由表3可知,紫青稞麸皮中检测到高含量的柯伊利素-7-O葡萄糖醛酸(1780.78 μg/g),在之前关于青稞游离酚的研究中也发现游离酚中含有高含量的柯伊利素-7-O葡萄糖醛酸[9]。此外,紫青稞麸皮和全谷物中均检测到高含量的花青素2137.67、246.77 μg/g,但在糯青稞中未检测到,向卓亚等[41]在白青稞麸皮中也未检测到花青素,但在黑青稞中检测到7.08 mg/g的花青素含量。王姗姗等[42]对来自西藏地区的268份具有不同粒色的青稞种质资源的多酚与花青素含量进行了研究,发现花青素含量由高到低依次为紫青稞>蓝青稞>褐青稞>白青稞,且花青素含量与多酚含量呈线性关系。张毅等[43]认为大麦籽粒颜色与花青素含量之间存在密切关系,可通过籽粒颜色来初步判断花青素含量的高低。
2.4 青稞多酚提取物抗氧化活性评价
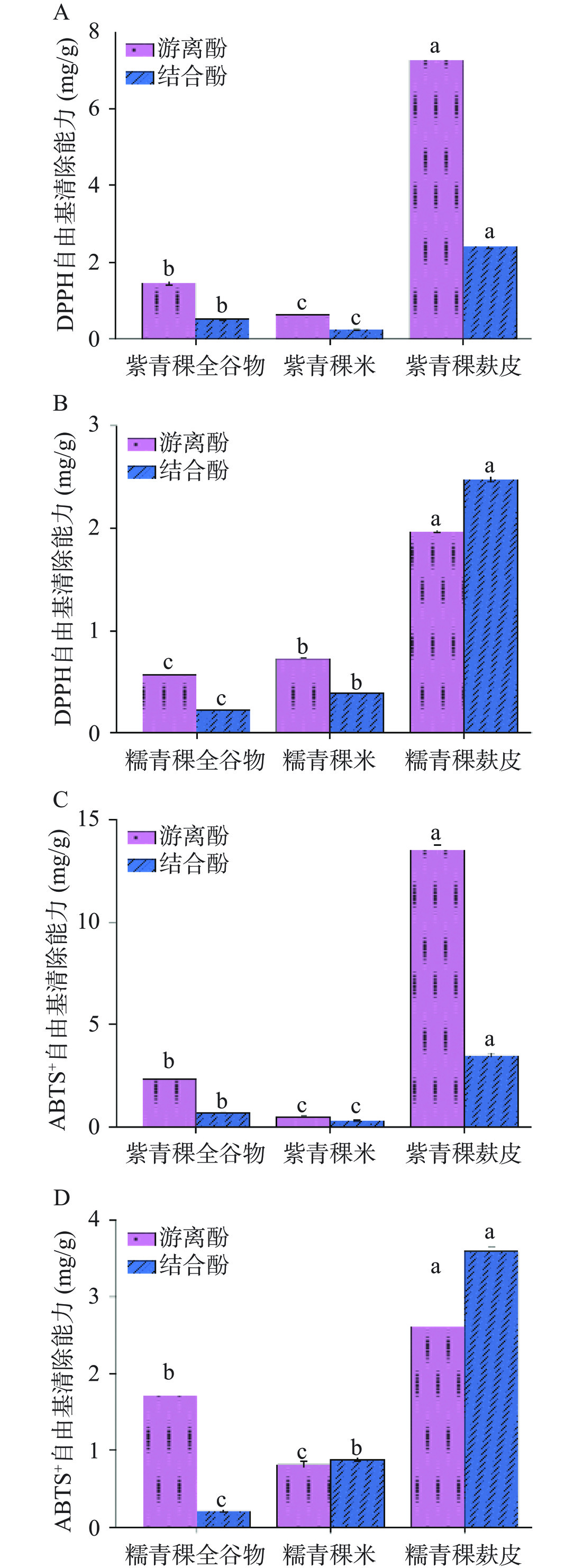
由图3可知,DPPH和ABTS+自由基清除能力在紫青稞提取物中均呈现青稞麸皮>青稞全谷物>青稞米,且游离酚提取物的清除自由基能力强于结合酚提取物,这与本实验中总多酚含量在紫青稞麸皮、全谷物和青稞米中的游离酚提取物与结合酚提取物中的变化趋势相同,多酚被认为是谷物中重要的抗氧化成分[7−8],因此推测紫青稞麸皮高含量的多酚引起更强的抗氧化活性,Serafino等[21]和Arigò等[44]也有相似的研究结果。此外表2和表3也表明紫青稞麸皮中定量分析到更多种类和更高含量的多酚化合物。
糯青稞提取物中也呈现青稞麸皮抗氧化能力强与青稞全谷物和青稞米,但是在清除DPPH自由基的能力方面,糯青稞米强于糯青稞全谷物。糯青稞全谷物的结合酚提取物中未检测到总黄酮(图2D),但在糯青稞米的结合酚提取物中检测到总黄酮(0.25 mg/g),因此推测糯青稞米结合酚检测到的这部分黄酮化合物可能具有较强的清除DPPH自由基的能力。黄酮类化合物在体外的抗氧化活性取决于母核结构上的官能团种类、数量和排列位置,进而影响其清除促氧化剂的有效性[45]。此外,糯青稞全谷物和糯青稞米对DPPH的清除能力和糯青稞全谷物对ABTS+自由基的清除能力均呈现游离酚提取物强于结合酚,这与糯青稞的游离酚提取物具有更高含量的总多酚和总黄酮相一致。但糯青稞麸皮的结合酚提取物对DPPH和ABTS+自由基的清除能力强于游离酚提取物,由表3可知,紫青稞麸皮游离酚提取物中定量分析到高含量的花青素(2137.67±6.9 μg/g),但在糯青稞的游离酚提取物中未检测到,因此推测糯青稞麸皮的游离酚提取物中花青素的缺乏,导致其对清除DPPH和ABTS+自由基的能力明显弱于紫青稞麸皮的游离酚提取物,同时也弱于糯青稞麸皮的结合酚提取物。花青素具有缺电子的结构特征,极易受到活性氧负离子和自由基的攻击,研究表明植物花青素的抗氧化作用是 VC 的 30 倍、VE 的 50 倍,是目前最好的天然抗氧化剂,其中矢车菊色素的抗氧化作用最强[46]。
3. 结论
通过对紫青稞和糯青稞两种青稞的麸皮、全谷物和青稞米进行β-葡聚糖,多酚化合物定量分析及抗氧化研究,发现青稞中β-葡聚糖在糯青稞中含量高于紫青稞,在全谷物和青稞米中含量较接近且显著高于青稞麸皮中(P<0.05);其次,青稞中总多酚在紫青稞中含量高于糯青稞,且其含量在两种青稞的游离酚和结合酚提取物中均呈现麸皮>全谷物>青稞米,总黄酮在两种青稞的游离酚提取物中也呈现麸皮>全谷物>青稞米,游离酚提取物中总多酚和总黄酮含量都高于结合酚提取物;通过UPLC定量分析发现青稞麸皮中结合酚种类最多,青稞全谷物中次之,青稞米中最少,所有检测到的多酚含量在两种青稞中均呈现麸皮>全谷物>青稞米,此外紫青稞和糯青稞麸皮的结合酚提取物中均检测到高含量的阿魏酸(158.14±2.43、376.29 μg/g),在紫青稞麸皮的游离酚提取物中检测到高含量的柯伊利素-7-O葡萄糖醛酸(1780.78 μg/g)和花青素(2137.67 μg/g);最后通过抗氧化实验表明,两种青稞的麸皮的抗氧化活性均远高于全谷物和青稞米。本研究为青稞全谷物以及青稞麸皮的开发利用提供了部分理论基础。
-
图 2 紫青稞和糯青稞的游离酚与结合酚提取物中总多酚和总黄酮含量
注:组间不同字母表示差异显著(P<0.05);图3同。
Figure 2. TPC and TFC in free and bound phenolic extracts of purple and glutinous hulless barley
表 1 多酚单体和花青素标准品的标准曲线
Table 1 Standard curves of polyphenol monomers and anthocyanin standards
名称 检测波长(nm) 线性回归方程 R2 线性范围(μg/mL) 8-5-DFA 320 y=11.389x+2.4316 0.9997 1.15625~37 8-5dc-DFA 320 y=39.224x−14.206 0.9999 0.79375~50.8 8-8nc-DFA 320 y=31.932x−3.7233 0.9999 0.778~49.8 8-8c-DFA 320 y=17.158x+2.7055 0.9996 1.01~64.7 8-8thf-DFA 280 y=4.9636x−0.1315 0.9988 3.04~48.7 5-5-DFA 320 y=27.939x−0.0119 0.9998 0.8~51.2 8-O-4-DFA 320 y=30.197x+1.1451 0.9996 0.4875~31.2 5-O-4-DFA 320 y=32.246x−2.7407 0.9996 0.4828~30.9 原儿茶酸 254 y=22.073x−8.3669 0.9999 1.12~280 对羟基苯甲酸 254 y=40.37x+4.554 0.999 0.64~320.9 香草酸 280 y=19.58x+1.253 0.999 1.0~250.2 咖啡酸 320 y=34.67x−21.02 0.999 1.04~267 香草醛 280 y=23.89x−0.690 0.9999 1.2~301.5 对香豆酸 320 y=40.14x−11.39 0.998 0.67~167 阿魏酸 320 y=40.163x−1.3353 0.999 0.5~200 芥子酸 320 y=28.36x−1.624 0.999 0.5~202.8 木犀草素-7-O-葡萄糖醛酸 350 y=11.245x+2.217 0.9999 2~200 柯伊利素-7-O-葡萄糖醛酸 350 y=9.3088x−64.583 0.9999 2.5~225 木樨草素 350 y=10.11x−7.34 0.9999 2~200 柯伊利素 350 y=12.366x+1.0054 0.9999 2.46~246 矢车菊-3-芸香糖 525 y=2.6728x+5.2883 0.9999 0~0.6 表 3 紫青稞的游离酚提取物中多酚含量(μg/g)
Table 3 Contents of polyphenols in free phenolic extracts of purple hulless barley (μg/g)
样品 花青素 木犀草素-7-O葡萄糖醛酸 柯伊利素-7-O葡萄糖醛酸 木犀草素 柯伊利素 紫青稞麸皮 2137.67±6.90 144.31±1.16 1780.78±4.06 48.46±2.63 274.59±0.99 紫青稞全谷物 246.77±11.62 21.53±0.03 404.40±1.14 − 41.87±0.55 紫青稞米 − − 80.28±0.18 − − 表 2 紫青稞和糯青稞的结合酚提取物中多酚含量(μg/g)
Table 2 Contents of polyphenols in bound phenolic extracts of purple and glutinous hulless barley (μg/g)
样品 原儿
茶酸对羟基
苯甲酸香草酸 咖啡酸 香草醛 对香
豆酸阿魏酸 芥子酸 8-5-DFA 5-5-DFA 8-8thf-DFA 柯伊利素-
7-O葡萄糖
醛酸8-8c-DFA 8-8nc-DFA 8-O-4-DFA 5-O-4-DFA 8-5dc-DFA 紫青稞 麸皮 13.54±
2.514.49±
0.327.08±
0.657.35±
1.464.33±
0.347.19±
1.24158.14±
2.432.76±
0.2410.76±
1.792.05±
0.289.19±
0.7782.55±
2.7630.10±
1.7512.57±
1.3532.54±
2.30− 6.85±
0.68全谷物 − − − − − − 37.91±
0.29− 2.26±
0.20− − − 4.82±
1.232.95±
0.697.14±
1.18− 2.56±
0.02青稞米 − − − − − − 23.08±
1.70− − − − − 1.34±
0.161.62±
0.172.91±
0.42− − 糯青稞 麸皮 − − 3.91±
0.824.95±
0.643.79±
0.347.57±
0.10376.29±
0.812.27±
0.1628.74±
0.942.32±
0.05− − 39.69±
1.5033.19±
2.0965.58±
1.201.48±
0.3823.07±
1.27全谷物 − − − − 2.29±
0.554.02±
0.10176.96±
6.39− 11.27±
0.86− − − 16.83±
0.6416.97±
0.4032.11±
1.23− 8.01±
0.69青稞米 − − − − − − 13.73±
1.93− − − − − − − 1.62±
0.73− − -
[1] 谢万宗. 本草纲目药物彩色图鉴[M]. 北京:人民卫生出版社, 2001:221. [XIE W Z. Medicine llustrated handbook of compendium of materia medica[M]. Beijing:People’s Medical Publishing House, 2001:221.] XIE W Z. Medicine llustrated handbook of compendium of materia medica[M]. Beijing: People’s Medical Publishing House, 2001: 221.
[2] 赵波. 青稞适度加工稳定化关键技术及制品品质改良机制研究[D]. 北京:中国农业科学院, 2021. [ZHAO B. Research on the key technology of hull-less barley moderate process and stabilization and mechanism for improvement of product quality[D]. Beijing:Chinese Academy of Agricultural Sciences, 2021.] ZHAO B. Research on the key technology of hull-less barley moderate process and stabilization and mechanism for improvement of product quality[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021.
[3] ZHANG K, YANG J, QIAO Z, et al. Assessment of β-glucans, phenols, flavor and volatile profiles of hulless barley wine originating from highland areas of China[J]. Food Chemistry,2019,293:32−40. doi: 10.1016/j.foodchem.2019.04.053
[4] DENG N, ZHENG B S, LI T, et al. Assessment of the phenolic profiles, hypoglycemic activity, and molecular mechanism of different highland barley (Hordeum vulgare L.) varieties[J]. International Journal of Molecular Sciences,2020,21(4):1175. doi: 10.3390/ijms21041175
[5] GUO T L, HORVATH C, CHEN L, et al. Understanding the nutrient composition and nutritional functions of highland barley (Qingke):A review[J]. Trends in Food Science and Technology,2020,103:109−117. doi: 10.1016/j.jpgs.2020.07.011
[6] BORNEOR, LEÓN A E. Whole grain cereals:Functional components and health benefits[J]. Food and Function,2012,3(2):110−119. doi: 10.1039/C1FO10165J
[7] VAN HUNG P. Phenolic compounds of cereals and their antioxidant capacity[J]. Critical Reviews in Food Science and Nutrition,2016,56(1):25−35. doi: 10.1080/10408398.2012.708909
[8] LIU R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science,2007,46(3):732−737.
[9] XIA C, YANG K, ZHU Y, et al. Distribution of free and bound phenolic compounds, β-glucan, and araboxylan in fractions of milled hulless barley[J]. LWT,2022,169:113935. doi: 10.1016/j.lwt.2022.113935
[10] 文一. 青稞β-葡聚糖的降血脂功能研究[D]. 重庆:西南农业大学, 2005. [WEN Y. Studies on antilipemic function of β-glucan from highland barley[D]. Chongqing:Southwest Agricultural University, 2005.] WEN Y. Studies on antilipemic function of β-glucan from highland barley[D]. Chongqing: Southwest Agricultural University, 2005.
[11] ZHANG W G, LAN Y L, DANG B, et al. Polyphenol profile and in vitro antioxidant and enzyme inhibitory activities of different solvent extracts of highland barley bran[J]. Molecules,2023,28(4):1665. doi: 10.3390/molecules28041665
[12] WIEGE I, SLUKOVÁ M, VACULOVÁ K, et al. Characterization of milling fractions from new sources of barley for use in food industry[J]. Starch-Stärke,2016,68(3-4):321−328.
[13] XIANG Z Y, DENG J L, YANG K J, et al. Effect of processing on the release of phenolic compounds and antioxidant activity during in vitro digestion of hulless barley[J]. Arabic Journal of Chemistry,2022,14:103447.
[14] GE X Z, JING L Z, ZHAO K, et al. The phenolic compounds profile, quantitative analysis and antioxidant activity of four naked barley grains with different color[J]. Food Chemistry,2020,335:127655.
[15] YANG Y, FAN B, MU Y W, et al. A comparative metabolomics study of polyphenols in highland barley (Hordeum vulgare L.) grains with different colors[J]. Food Research International,2023,174:113672. doi: 10.1016/j.foodres.2023.113672
[16] 王欣, 杨开俊, 刘廷辉, 等. 黑青稞麸皮的功能因子结构解析及其抗氧化功能研究[J]. 食品科技,2023,48(7):142−148. [WANG X, YANG K J, LIU T H, et al. Structural analysis of functional factors and antioxidant function of black barley bran[J]. Food Science and Technology,2023,48(7):142−148.] WANG X, YANG K J, LIU T H, et al. Structural analysis of functional factors and antioxidant function of black barley bran[J]. Food Science and Technology, 2023, 48(7): 142−148.
[17] 何扬航, 刘刚, 夏陈, 等. 挤压膨化对青稞中不同形态多酚组成及抗氧化活性的影响[J]. 食品与机械,2021,37(3):36−40. [HE Y H, LIU G, XIA C, et al. Effect of extrusion process on different forms of phenolic compounds and antioxidant activities of hulless barley[J]. Food and Machinery,2021,37(3):36−40.] HE Y H, LIU G, XIA C, et al. Effect of extrusion process on different forms of phenolic compounds and antioxidant activities of hulless barley[J]. Food and Machinery, 2021, 37(3): 36−40.
[18] 江春艳, 严冬, 谭进, 等. 青稞的研究进展及应用现状[J]. 西藏科技,2010(2):14−16. [JIANG C Y, YAN D, TAN J, et al. Research advances and application status of barley[J]. Tibet Science and Technology,2010(2):14−16.] doi: 10.3969/j.issn.1004-3403.2010.02.005 JIANG C Y, YAN D, TAN J, et al. Research advances and application status of barley[J]. Tibet Science and Technology, 2010(2): 14−16. doi: 10.3969/j.issn.1004-3403.2010.02.005
[19] 张峰, 杨勇, 赵国华, 等. 青稞β-葡聚糖研究进展[J]. 粮食与油脂,2003(12):3−5. [ZHANG F, YANG Y, ZHAO G H, et al. Advance on beta-glucan from hull-less barley[J]. Cereals and Oils,2003(12):3−5.] doi: 10.3969/j.issn.1008-9578.2003.12.001 ZHANG F, YANG Y, ZHAO G H, et al. Advance on beta-glucan from hull-less barley[J]. Cereals and Oils, 2003(12): 3−5. doi: 10.3969/j.issn.1008-9578.2003.12.001
[20] LIN S, GUO H, BU GONG J D, et al. Phenolic profiles, β-glucan contents, and antioxidant capacities of colored Qingke (Tibetan hulless barley) cultivars[J]. Journal of Cereal Science,2018,81:69−75.
[21] SURIANO S, IANNUCCI A, CODIANNI P, et al. Phenolic acids profile, nutritional and phytochemical compounds, antioxidant properties in colored barley grown in southern Italy[J]. Food Research International,2018,113:221−233. doi: 10.1016/j.foodres.2018.06.072
[22] ŠIMIĆ G, HORVAT D, LALIĆ A, et al. Distribution of β-glucan, phenolic acids, and proteins as functional phytonutrients of hulless barley grain[J]. Foods,2019,8(12):680. doi: 10.3390/foods8120680
[23] FENG Q Q, ZHANG S Q, LIN J Q, et al. Valorization of barley (Hordeum vulgare L.) brans from the sustainable perspective:A comprehensive review of bioactive compounds and health benefits with emphasis on their potential applications[J]. Food Chemistry,2024,460:140772. doi: 10.1016/j.foodchem.2024.140772
[24] WAIN R L, TAYLOR H F. Phenols as plant growth regulators[J]. Nature,1965,207:167−169. doi: 10.1038/207167a0
[25] WASTON R R. Polyphenols in plants:Isolation, purification and extract preparation[M]. 2nd ed. Salt Lake City:Academic Press, 2019:45−58.
[26] 赵广河, 张瑞芬, 苏东晓, 等. 全谷物酚类物质及其抗氧化活性研究进展[J]. 中国食品学报,2017,17(8):183−196. [ZHAO G H, ZHANG R F, SU D X, et al. The advance on polyphenols in whole grains and its antioxidant activity[J]. Journal of Chinese Institute of Food Science and Technology,2017,17(8):183−196.] ZHAO G H, ZHANG R F, SU D X, et al. The advance on polyphenols in whole grains and its antioxidant activity[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(8): 183−196.
[27] NARWAL S, KUMAR D, VERMA R P S. Effect of genotype, environment and malting on the antioxidant activity and phenolic content of Indian barley[J]. Journal of Food Biochemistry,2016,40(1):91−99. doi: 10.1111/jfbc.12198
[28] DENG J L, XIANG Z Y, XIA C, et al. Identification and quantification of free, esterified, and insoluble-bound phenolics in grains of hulless barley varieties and their antioxidant activities[J]. LWT-Food Science Technology,2021,151:112001. doi: 10.1016/j.lwt.2021.112001
[29] ZHANG M W, ZHANG R F, ZHANG F X, et al. Phenolic profiles and antioxidant activity of black rice bran of different commercially available varieties[J]. Journal of Agricultural and Food Chemistry,2010,58(13):7580−7587. doi: 10.1021/jf1007665
[30] PRADEEP P M, SREERAMA Y N. Soluble and bound phenolics of two different millet genera and their milled fractions:Comparative evaluation of antioxidant properties and inhibitory effects on starch hydrolysing enzyme activities[J]. Journal of Functional Foods,2017,35:682−693. doi: 10.1016/j.jff.2017.06.033
[31] SADASIVAM K, KUMARESAN R. Theoretical investigation on the antioxidant behavior of chrysoeriol and hispidulin flavonoid compounds-A DFT study[J]. Computational & Theoretical Chemistry,2011,963(1):227−235.
[32] XIAO J B, CAPANOGLU E, JASSBI A R, et al. Advance on the flavonoid C-glycosides and health benefits[J]. Critical Reviews in Food Science and Nutrition,2016(1):16.
[33] IDEHEN E, TANG Y, SANG S. Bioactive phytochemicals in barley[J]. Journal of Food and Drug Analysis,2017,25(1):148−161. doi: 10.1016/j.jfda.2016.08.002
[34] MARTÍNEZ M, MOTILVA M J, LÓPEZ D L H, et al. Phytochemical composition and β-glucan content of barley genotypes from two different geographic origins for human health food production[J]. Food Chemistry,2018,245:61−70. doi: 10.1016/j.foodchem.2017.09.026
[35] 张晓民. 禾本科植物细胞壁的木质化和阿魏酰化[J]. 中国野生植物资源,2011,30(6):7−13. [ZHANG X M. Lignification and feruloylation in the cell wall of grass family[J]. Chinese Wild Plant Resources,2011,30(6):7−13.] doi: 10.3969/j.issn.1006-9690.2011.06.002 ZHANG X M. Lignification and feruloylation in the cell wall of grass family[J]. Chinese Wild Plant Resources, 2011, 30(6): 7−13. doi: 10.3969/j.issn.1006-9690.2011.06.002
[36] LYONS P C, HIPSKIND J, VINCENT J R. Phenylpropanoid dissemi-nation in maize resistant or susceptible to helminthosporium-maydis[J]. Maydica,1993,38:175−181.
[37] SHIYI O, KIN-CHOR K. Ferulic acid:Pharmaceutical functions, preparation and applications in food[J]. Journal of the Science of Food and Agriculture,2004,84(11):1261−1269. doi: 10.1002/jsfa.1873
[38] BUENO-HERRERA M, P´EREZ-MAGARI˜NO S. Validation of an extraction method for the quantification of soluble free and insoluble bound phenolic compounds in wheat by HPLC-DAD[J]. Journal of Cereal Science,2020,93:102984. doi: 10.1016/j.jcs.2020.102984
[39] RALPH J, GRABBER J H, HATFIELD R D. Lignin-ferulate cross-links in grasses-active incorporation of ferulate polysaccharide esters into ryegrass lignins[J]. Carbohydrate Research,1995,275:167−178. doi: 10.1016/0008-6215(95)00237-N
[40] ZHU Y, LI T, FU X, et al. Phenolics content, antioxidant and antiproliferative activities of dehulled highland barley (Hordeum vulgare L.)[J]. Journal of Functional Foods,2015,19:439−450. doi: 10.1016/j.jff.2015.09.053
[41] 向卓亚, 黄巧莲, 夏陈, 等. 青稞麸皮营养成分及提取物抗氧化活性研究[J]. 食品与机械,2019,35(12):163−168. [XIANG Z Y, HUANG Q L, XIA C, et al. Study on the nutrient composition and antioxidant activity of highland barley bran[J]. Food and Machinery,2019,35(12):163−168.] XIANG Z Y, HUANG Q L, XIA C, et al. Study on the nutrient composition and antioxidant activity of highland barley bran[J]. Food and Machinery, 2019, 35(12): 163−168.
[42] 王姗姗, 刘小娇, 胡赟, 等. 西藏地区不同粒色青稞多酚及花青素含量分析[J]. 现代农业科技,2020(19):217−220. [WANG S S, LIU X J, HU Z, et al. Analysis of content of polyphenols and anthocyanins among different seed color highland barley cultivars from Tibet area[J]. Modern Agricultural Science and Technology,2020(19):217−220.] doi: 10.3969/j.issn.1007-5739.2020.19.078 WANG S S, LIU X J, HU Z, et al. Analysis of content of polyphenols and anthocyanins among different seed color highland barley cultivars from Tibet area[J]. Modern Agricultural Science and Technology, 2020(19): 217−220. doi: 10.3969/j.issn.1007-5739.2020.19.078
[43] 张毅, 东强, 冯西博, 等. 不同粒色大麦花青素含量与籽粒颜色关系的研究[J]. 高原农业,2022,6(3):213−219. [ZHANG Y, DONG Q, FENG X B, et al. A study on the relationship between anthocyanin concentration and grain color in barley of different grain colors[J]. Journal of Plateau Agriculture,2022,6(3):213−219.] ZHANG Y, DONG Q, FENG X B, et al. A study on the relationship between anthocyanin concentration and grain color in barley of different grain colors[J]. Journal of Plateau Agriculture, 2022, 6(3): 213−219.
[44] ATIGÒ A, ČESLA P, ŠILAROVÁ P, et al. Development of extraction method forcharacterization of free and bonded polyphenols in barley (Hordeum vulgare L.) grown in czech republic using liquid chromatography-tandem mass spectrometry[J]. Food Chemistry,2018,245:829−837. doi: 10.1016/j.foodchem.2017.11.101
[45] CHARLTON N C, MASTYUGIN M, TÖRÖK B, et al. Structural features of small molecule antioxidants and strategic modifications to improve potential bioactivity[J]. Molecules,2023,28(3):1057. doi: 10.3390/molecules28031057
[46] 朱芳, 陈鑫珠, 陆烝, 等. 花青素的生物活性及其在动物应用中的研究进展[J]. 饲料工业,2024,45(3):8−14. [ZHU F, CHEN X Z, LU C, et al. Biological activity and research progress on the application in animal production of anthocyanins[J]. Feed Industry,2024,45(3):8−14.] ZHU F, CHEN X Z, LU C, et al. Biological activity and research progress on the application in animal production of anthocyanins[J]. Feed Industry, 2024, 45(3): 8−14.





 下载:
下载:
 下载:
下载:
