Effects of TG Enzyme-Chitosan Composite Modification on the Characteristics of Fish Gelatin Gel and Its Preliminary Exploration
-
摘要: 鱼明胶(FG)较差的凝胶特性限制了其在生产中的应用,壳聚糖(CS)和谷氨酰胺转氨酶(TG)已被证明可以用于改善FG的凝胶特性。本研究采用CS和TG对FG进行改性,制备了两种不同类型的改性明胶:FG-TG、FG-TG-CS。对比研究了两种改性方式对FG凝胶强度、质构特性、流变学性质、荧光强度、红外光谱和体外消化率的影响。结果表明:单一TG改性和复合改性均能显著提高FG的凝胶强度和质构特性。CS添加量为0.7%时,复合改性的FG有最高的凝胶强度和硬度,分别为522.02±0.07 g和11.79±0.30 N。流变结果表明复合改性组有最高的粘度(η50=0.53±0.04 mPa·s)、凝胶点(23.04±0.17 ℃)和融胶点(31.30±0.25 ℃)。改性后样品荧光强度降低,且复合修饰组有更高的荧光猝灭效率。傅里叶红外光谱红移表明复合修饰增加了体系中α-螺旋含量,有助于稳定胶体的形成。因此,TG-CS复合修饰可以有效解决FG凝胶特性较弱的缺点。Abstract: The poor gel properties of fish gelatin (FG) limit its application in production. Chitosan (CS) and glutamine transaminase (TG) have been proved to be able to improve the gel properties of FG. In this study, TG and CS were used to modify FG, producing two kinds of modified gelatin: FG-TG and FG-TG-CS. The effects of two modification methods on the strength, texture characteristics, rheological properties, fluorescence intensity, infrared spectrum and in vitro digestibility of FG gel were compared. The findings revealed that both single and complex modifications could greatly improve the gel strength and textural qualities of FG. As CS addiction was 0.7%, the complex modified FG had the highest gel strength and hardness, which were 522.02±0.07 g and 11.79±0.30 N, respectively. Rheological results revealed that the complex modified gelatin had the maximum viscosity (η50=0.53±0.04 mPa·s), gelling points (23.04±0.17 ℃), and melting points (31.30±0.25 ℃). Modification decreased the fluorescence intensity of the samples and complex modification showed higher fluorescence quenching effectiveness. Fourier transform infrared spectroscopy redshift indicated that the complex modification boosted the α-helix content in the system, stabilize the formation of colloids. Thus, the TG-CS complex modification effectively solve the shortcomings of weak gelling properties.
-
Keywords:
- fish gelatin /
- complex modification /
- gel properties /
- structural characteristics
-
鱼明胶(Fish gelatin,FG)由鱼类加工副产物如鱼皮、鱼骨、鱼鳞等制备而成。因其具有与哺乳动物明胶相似的功能特性,被认为是一种潜在、优良的哺乳动物明胶替代物[1−3]。近年来随着鱼类加工业的快速发展,产生的大量鱼类加工副产物能够为鱼明胶的生产提供充足的原料。但由于原料的种类差异使得鱼明胶脯氨酸、羟脯氨酸含量比哺乳动物明胶低,导致了鱼明胶的凝胶特性和结构特性较哺乳动物明胶弱,使得鱼明胶在生产应用中受限[4]。因此,如何改善鱼明胶的凝胶特性已经成为当下的研究热点之一。目前,鱼明胶的改性技术主要有酶法改性(微生物-转谷氨酰胺酶,Transglutaminase,TG)、酪氨酸酶和漆酶改性)、化学改性(磷酸化、醛、酚改性)、物理改性(添加电解质或非电解质物质)和复合改性(酶或化学法修饰明胶-多糖体系)[2,5]。在这些修饰方法中,酶修饰、外源物质的添加和复合修饰的修饰效率远高于其他方法。然而,上述三种改性方法对FG的凝胶和结构性能的研究仍缺乏全面的研究[6]
壳聚糖(Chitosan,CS)又称脱乙酰甲壳素,是自然界中唯一的阳离子多糖,主要从甲壳类生物如虾、蟹的壳中提取,具有良好生物相容性、抗菌和成膜性[7]。谷氨酰胺转氨酶(TG)是一种具有高生物安全性、高催化效率和温和条件(广泛的温度和pH适应性)的酰基转移酶,常被用于催化蛋白质的大分子接枝和交联[2,7]。二者常被应用于蛋白质功能特性(凝胶性、成膜性)的改善。Rui等[8]研究发现,CS能提升没食子酸/壳聚糖/明胶复合膜的力学性能,使复合膜具有更好的拉伸强度。胡亚云等[9]研究发现随着CS浓度的增加,没食子酸/壳聚糖/明胶复合水凝胶的弹性和硬度也逐渐增大。Mao等[10]发现TG修饰后的A型明胶具有稳定的三螺旋状结构,凝胶网络结构更为紧密。Wang等[11]也发现了类似结果,TG修饰的明胶-碳酸钙薄膜复合膜的力学性能、流变学性能、热稳定和微观结构均有显著改善。但是有关TG和CS复合修饰对FG凝胶特性和流变特性的影响依然研究较少。因此,本文主要研究CS和TG复合改性对FG凝胶特性和流变特性的影响,并结合结构特性分析其改性机制,以期为制备高品质(高凝胶特性、融胶温度和粘度)鱼明胶产品的研发提供技术支撑和理论指导。
1. 材料与方法
1.1 材料与仪器
鱼明胶 凝冻值200 g,分子量为10~220 kDa,蛋白含量88.14%±1.57%,灰分含量4.78%±0.03%,水分含量7.93%±0.63%,购自于源叶生物科技有限公司(中国上海);壳聚糖 捷瑞生物工程有限公司(中国上海);谷氨酰胺转胺酶(100 U/g) 一鸣生物技术公司(中国太湖);其余化学试剂均为分析纯。
TA.XT Plus质构仪 英国Stable Micro Systems公司;DHR-2流变仪 美国TA Instrument Inc公司;ML104/02型电子天平 上海梅特勒-托利多仪器有限公司;DK-S22型电热恒温水浴箱 上海精宏实验设备有限公司上海;TU-1810 UV-Vis分光光度计 北京普析通用仪器有限责任公司;F-4700日立荧光分光光度计 日本日立高新技术公司。
1.2 实验方法
1.2.1 样品制备
称取适量的壳聚糖(CS)粉末溶于1wt%的醋酸溶液中,得到0、0.1%、0.3%、0.5%和0.7%(w/v)的CS溶液,并使用1 mol/L的氢氧化钠将CS溶液的pH调节至5.6。称取适量FG颗粒加入CS溶液中,40 ℃下连续搅拌2 h,得到FG溶液浓度为6.67%(w/v)的FG-CS溶液[12]。向复合溶液中加入0和0.005%(w/v)的TG酶,40 ℃下催化交联40 min,100 ℃下加热5 min灭酶,分别得到FG-TG、FG-TG-CS0.1%、FG-TG-CS0.3%、FG-TG-CS0.5%、FG-TG-CS0.7%复合凝胶。使用pH调节至5.6的1wt%的醋酸溶液配制浓度为6.67%(w/v)的FG,配制过程同上,不加CS与TG,得到FG组明胶。
1.2.2 凝胶强度及TPA的测定
使用质构仪对样品的凝胶强度和质构特性进行测定。移取15 mL样品溶液至25 mL烧杯中,10 ℃孵育16~18 h。选用P/0.5型号探头,选取穿刺距离为4 mm时的最大受力为样品的凝胶强度。测前、测试和测后速度均为1 mm/s[3]。
移取45 mL样品溶液至50 mL模具中,10 ℃下孵育16~18 h。将凝胶从模具中取出,切成直径2.2 cm、高2 cm的圆柱体。使用探头P/50测定凝胶的TPA,形变量为50%,测前、测试和测后速度均为1 mm/s,测试循环2次[13]。
1.2.3 色差测定
Huang等[13]的方法,使用色差计对凝胶的色泽进行测定,记录L*、a*和b*值。其中,L*值代表白度,指样品的透明情况;a*值为正代表样品偏红,为负代表样品偏绿;b*值为正代表样品偏黄,为负代表样品偏蓝。
1.2.4 流变学性质测定
使用DHR-2流变仪测定明胶的流变学性质,夹具为60 mm的平板,gap值为1000 μm,加入样品后以石蜡油密封。剪切速率范围为0.01~1000 s−1,借助Power law和Herschel-Bulkley流体模型分析明胶溶液的流体特性[14]。
Power law:τ=κγn Herschel−Bulkley:τ=τ0+κγn 式中:τ是剪应力(mPa);κ是一致性系数(mPa·s);γ是剪切速率(1/s);n是流动行为指数;τ0是屈服应力(mPa)。
记录明胶在降温(40~4 ℃)和升温(4~40 ℃)阶段下储能模量(G')和损耗模量(G'')的变化,测定其凝胶温度和融胶温度。变温速率:0.5 ℃/min;频率:1 Hz,应变力:1%[15]。
1.2.5 内源性荧光强度测定
明胶溶液浓度为20 mg/mL,采用荧光分光光度计测定明胶溶液的荧光光谱。激发波长为280 nm,发射波长为290~350 nm,速度为1200 nm/min。激发狭缝宽度为5 nm,发射狭缝宽度为5 nm,电压为650 V[12]。
1.2.6 傅里叶红外光谱测定
将冻干后的样品与KBr混合并充分研磨均匀,制得透明薄片。使用傅里叶红外光谱仪,以溴化钾为背景对其扫描。扫描波数4000~500 cm−1,分辨率4 cm−1,扫描次数32[16]。
1.3 数据处理
数据测定均于25 ℃下进行,所有实验重复三次。用Microsoft Office Excel 2020处理数据,计算得平均值和标准差。用SPSS软件进行单因素方差分析(ANOVA),P<0.05表示差异显著。
2. 结果与分析
2.1 凝胶强度及质构分析
凝胶强度是评价凝胶品质的重要指标之一[17]。不同修饰方法对FG凝胶强度的影响如表1所示。未经修饰的FG凝胶强度最低,两种改性方式均可显著提高FG的凝胶强度(P<0.05)。且TG-CS复合修饰对FG的凝胶强度具有更好提升效果,CS浓度为0.7%时凝胶强度最高。对于FG-TG组,TG催化FG分子链之间形成ε-(γ-谷氨酰基)赖氨酸共价键,这些共价键使得FG的凝胶网络趋于致密从而提高FG的凝胶强度[18]。而在FG-TG-CS组,FG分子上带负电荷的羧基(COO-)在酸性溶液中可与CS分子上带正电荷的胺基(NH3+)发生静电相互作用,形成稳定的复合体。TG可以催化FG、FG-CS和CS形成分子内或分子间的共价键。此外,明胶中大量的极性基团,如−OH、−NH2、−C=O,能够与壳聚糖链上的−OH、−NH2形成氢键[19]。这些均有利于增强明胶分子的网络结构,提高其凝胶强度[20]。此外,CS浓度增加至0.7%时复合修饰的明胶具有最大的凝胶强度,但与CS浓度为0.5%时的凝胶强度差异不显著(P>0.05)。这可能是由于体系中CS浓度过高从而使得FG与CS分子不能均匀混合形成良好的复合体系。周至纯等[21]也研究发现过高的CS浓度反而降低壳聚糖/明胶复合纤维的力学性能。
表 1 不同修饰方法对鱼明胶凝胶强度及质构特性影响Table 1. Various modifications methods on the gel strength and textural profile of gelatin gels指标 FG FG-TG FG-TG-CS0.1% FG-TG-CS0.3% FG-TG-CS0.5% FG-TG-CS0.7% 凝胶强度(g) 409.98±9.54a 421.56±3.45b 483.48±4.08c 496.57±3.60d 514.73±2.14e 522.02±0.07e 硬度(N) 9.17±0.22a 9.54±0.45a 10.78±0.13b 11.01±0.58b 11.70±0.28c 11.79±0.30c 黏性(g.sec) −155.74±36.75a −63.42±22.80b −145.76±39.36a −153.27±8.05a −146.40±25.51a −161.06±35.43a 弹性 0.94±0.01a 0.98±0.08c 0.96±0.01b 0.96±0.01b 0.96±0.01b 0.95±0.01b 粘聚性 0.94±0.01a 0.95±0.01a 0.93±0.01a 0.94±0.00a 0.94±0.01a 0.92±0.02a 胶着度(N) 8.60±0.26a 9.01±0.43a 10.07±0.17b 10.30±0.56bc 10.96±0.34d 10.89±0.07cd 咀嚼性(N) 8.06±0.32a 8.82±0.41b 9.63±0.23c 9.84±0.60cd 10.53±0.39d 10.37±0.11d 回复性 0.83±0.01c 0.82±0.01c 0.79±0.01b 0.76±0.01a 0.76±0.02a 0.73±0.02a 注:同行不同字母表示差异显著(P<0.05);表4同。 质构分析可以模拟食物在口中咀嚼过程中的状态变化[22]。从表1可知,两种改性方式对FG的质构特性均产生了显著影响(P<0.05),各组样品的硬度具有与凝胶强度一致的变化趋势,TG-CS复合修饰显著提高FG的硬度,且硬度随CS浓度的增加而增大,并在CS浓度为0.7%时出现最大值(11.79±0.30 N)。FG先与CS通过静电相互作用结合形成FG-CS复合体,TG酶进一步催化该混合体系形成分子内或分子间的共价键,形成更为致密的胶体网络结构,提高了FG的机械性能[23]。胡亚云等[9]研究发现随着水凝胶中CS浓度的提高,可以使多酚交联的壳聚糖/明胶复合水凝胶的凝胶网络更为致密。两种改性方式均可显著提高(P<0.05)FG的弹性、胶着度、咀嚼性且复合修饰的提升效果更好。修饰后FG的黏性和粘聚性未发生显著变化。
2.2 色差
如表2所示,单一的TG酶修饰对鱼明胶L*、a*、b*值均没有显著改变。而TG-CS复合修饰后FG的L*和a*值降低,b*值增大。凝胶色泽的变化与FG分子结构的改变有关[24]。L*值与凝胶体系中微观粒子的数量和分布有关,凝胶中聚合物的生成会导致其L*值降低[24]。TG-CS-FG组L*值降低可归因于复合修饰后凝胶体系中聚合物的数量和体积的增加。且随着CS浓度的增大形成更多数量的聚合物,从而使得复合凝胶的亮度进一步降低。此外,随着CS浓度的增大,复合凝胶形成更为致密的网络空间,不利于光线透过,这也使复合凝胶的明亮指数下降。复合修饰中CS的浓度会对FG的a*值、b*值产生显著影响,随CS的浓度增加复合凝胶的颜色朝向更绿更黄方向变化。这是由于CS自身呈现透明淡黄色,当FG与CS结合后使得FG的a*值减小、b*值增大,且CS浓度增加影响幅度增大[25]。这与Rui等[8]报道的没食子酸/壳聚糖/明胶复合膜的颜色随着体系中CS浓度增加而颜色加深相类似。
表 2 不同修饰方法对鱼明胶色泽的影响Table 2. Effects of different modification methods on the color of fish gelatin组别 L* a* b* FG 47.00±1.75b −0.05±0.10d 0.99±0.14a FG-TG 45.35±1.30ab −0.06±0.03d 0.89±0.06a FG-TG-CS0.1% 43.81±1.20a −0.14±0.08cd 1.30±0.40a FG-TG-CS0.3% 44.42±1.12ab −0.18±0.10bc 1.86±0.22b FG-TG-CS0.5% 44.96±2.55ab −0.29±0.05b 2.90±0.15c FG-TG-CS 0.7% 42.44±0.45a −0.43±0.03a 3.61±0.40c 注:同列不同字母表示差异显著(P<0.05);表3同。 2.3 流变学性质
2.3.1 表观粘度
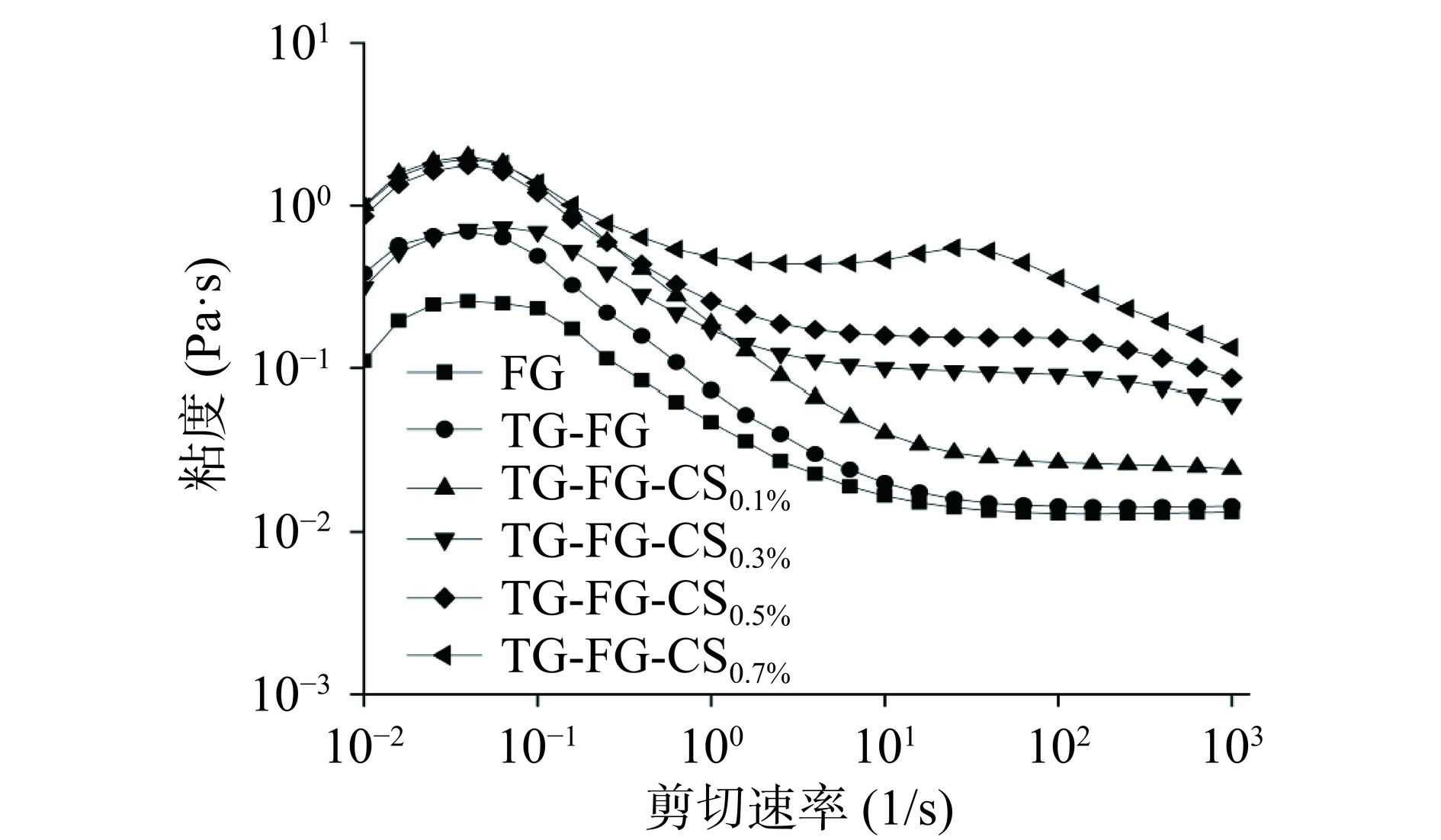
如图1所示,各组样品的粘度均表现出随剪切速率增加而降低的变化趋势。表明所有明胶溶液均是假塑性流体[10,14]。原样FG的表观粘度最低,改性后FG表观粘度均增大。复合修饰组表观粘度均高于单一TG修饰组,FG-TG-CS0.7%有最大表观粘度。η50值与牛顿流体、乳液等各种食品产品的感知厚度和粘性具有较好的相关性[15]。如表3所示,当复合修饰组CS浓度为0.3%及以上时η50显著高于(P<0.05)FG及单一TG修饰的FG。此外,复合修饰组中样品粘度及η50值均随CS浓度增加而增大。蛋白质溶液中的表观粘度与分子间相互作用/分子量的大小呈正相关[11]。对于单一的TG修饰的FG其表观粘度的增加可以归因于TG催化FG分子内或分子间通过形成共价键产生高分子量的聚合物[10]。对于FG-TG-CS组,FG先与CS形成FG-CS复合体而后在TG的催化下通过生成共价键进一步形成更高分子量的聚合物从而使得FG的表观粘度进一步增大[6]。
采用Power law和Herschel-Bulkley流体模型对明胶样品进行拟合,以探究FG-TG和FG-TG-CS复合溶液的最适流体模型。如表3所示,所有模型的R2值均>0.99,表明样品与各模型均有较高相关性。复合改性后FG溶液的一致性系数(κ)增大,表明复合改性增加溶液体系的粘稠度,而单一TG修饰不会影响FG的粘稠度。流动行为指数n反映了粘度随剪切速率变化的程度。复合修饰后样品的n值低于原始FG,表明复合修饰后样品表观粘度随剪切速率的衰减相对较快并表现出更显著的非牛顿流体行为[26]。均方根误差(RMSE)被认为是线性和非线性曲线拟合中最简单、信息量最大的参数[27]。Herschel-Bulkley模型具有最小的RMSE值,表明样品的流体性质更符合Herschel-Bulkley流体模型。
表 3 不同修饰方法对FG的η50值的影响及与流体模型拟合结果Table 3. Effects of different modification methods on the η50 value of FG and their fitting results with the fluid model组别 η50(mPa·s) Power law Herschel-Bulkley RMSE κ(mPa·s) n R2 RMSE τ0(mPa) κ(mPa·s) n R2 FG 0.01±0.00a 0.03 0.01 1.01 0.99 0.01 0.03 0.01 1.02 0.99 FG-TG 0.02±0.00a 0.04 0.01 1.01 0.99 0.02 0.05 0.01 1.02 0.99 FG-TG-CS0.1% 0.03±0.00a 0.10 0.03 0.95 0.99 0.08 0.10 0.03 0.97 0.99 FG-TG-CS0.3% 0.09±0.02b 0.48 0.23 0.81 0.99 0.45 −0.23 0.25 0.80 0.99 FG-TG-CS0.5% 0.15±0.01c 0.88 0.48 0.76 0.99 0.81 −0.48 0.53 0.74 0.99 FG-TG-CS0.7% 0.53±0.04d 1.73 2.02 0.61 0.99 1.47 −1.36 2.34 0.59 0.99 2.3.2 温度扫描
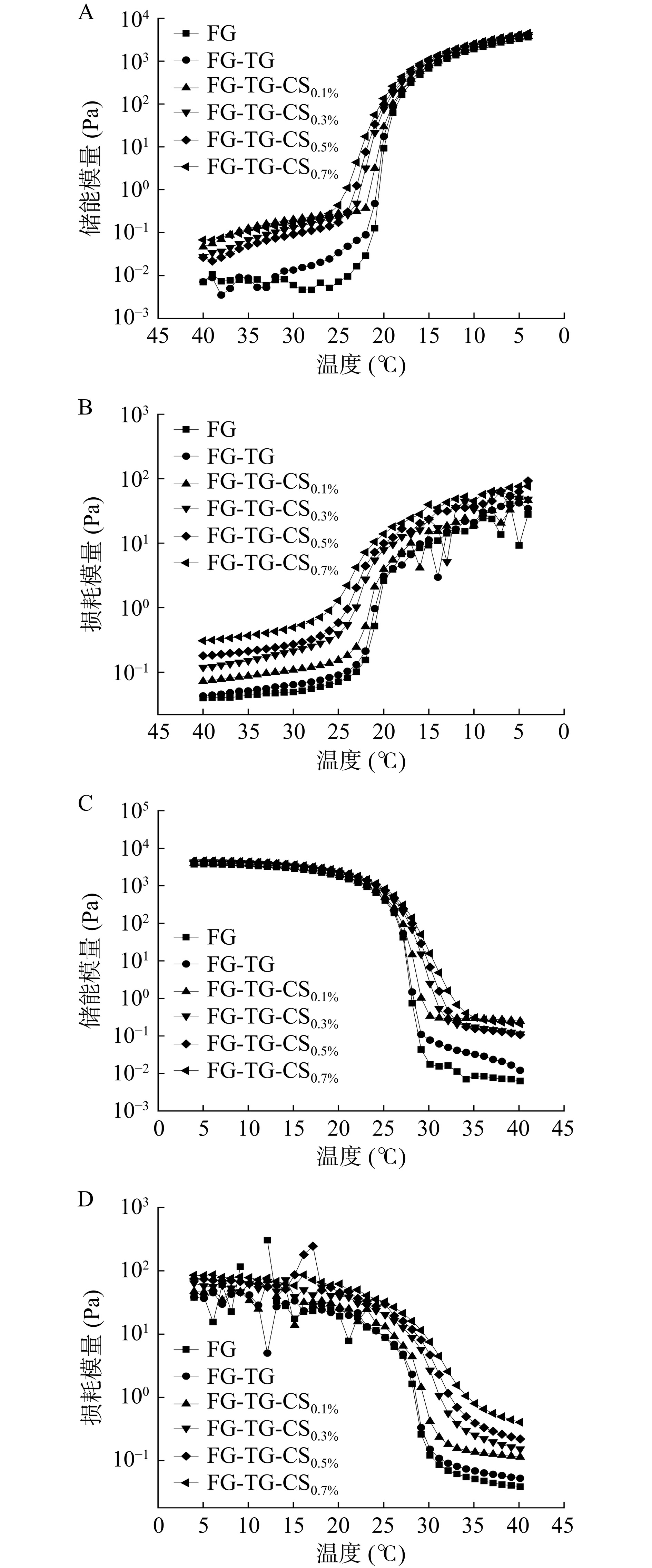
通过测量明胶样品在升温和降温过程中储能模量(G')和损耗模量(Gʺ)的变化,可以测定明胶的凝胶温度和胶融温度[15]。如图2所示,各组样品在凝胶化和融化过程中G'和Gʺ的变化趋势基本相同。在凝胶化过程(降温扫描)的初始阶段(40 ℃),各组样品的G'均低于Gʺ,表明此时样品处于液体状态,明胶分子为单链形态。随着温度的降低,G'和Gʺ曲线开始上升,且G'曲线有更大的上升幅度而后超越Gʺ曲线,当G'和Gʺ交叉时对应的温度为凝胶温度[28]。此温度下单分子链的明胶链通过离子相互作用、氢键、范德华力和疏水相互作用向三螺旋结构转变,凝胶网络结构开始出现[17]。反之,在融胶化过程(升温扫描)G'和Gʺ两条曲线的交叉对应的温度是胶融温度[15]。
如表4所示,改性后FG的凝胶温度和融胶温度都出现了显著提升。其中,TG-CS复合修饰较单一TG修饰表现出更高的凝胶温度、融胶温度,且随CS浓度的增加而升高,在TG-CS-CS0.7%时具有最高的凝胶温度和胶融温度。由此可知,两种修饰方法均可以显著提高FG的热稳定性且复合修饰法有更高的提升效率。TG可以催化FG分子内或分子间共价键的形成,这使得FG凝胶形成更紧密的网络,从而增强了FG的热稳定性[29]。FG经TG-CS复合修饰后,FG与CS之间的离子相互作用和氢键及TG催化形成的共价键,使得复合凝胶具有更为致密的网络和更为紧密的分子间相互连结区。因此,在凝胶状态发生改变时,需要更多的能量来破坏/连结交联连接区,从而使得复合凝胶具有更高的凝胶温度及胶融温度[30]。这与凝胶强度结果相一致。周志纯等[21]和李海朝等[31]的研究中也报道了CS的加入可以提升明胶的热稳定性。Chen等[16]和Wang等[6]也在TG-卡拉胶复合修饰鱼明胶的研究中发现相同结果,即复合修饰后FG热稳定性增强。
表 4 不同修饰方法对鱼明胶凝胶点及融胶点影响(℃)Table 4. Effects of different modification methods on gelling and melting points of FG gels (℃)指标 FG FG-TG FG-TG-CS0.1% FG-TG-CS0.3% FG-TG-CS0.5% FG-TG-CS0.7% 凝胶点 20.48±0.04a 20.72±0.02b 21.56±0.10c 22.17±0.08d 22.52±0.01e 23.04±0.17f 融胶点 27.89±0.01a 28.00±0.01a 28.92±0.01b 30.07±0.01c 30.62±0.03d 31.30±0.25e 2.4 内源性荧光
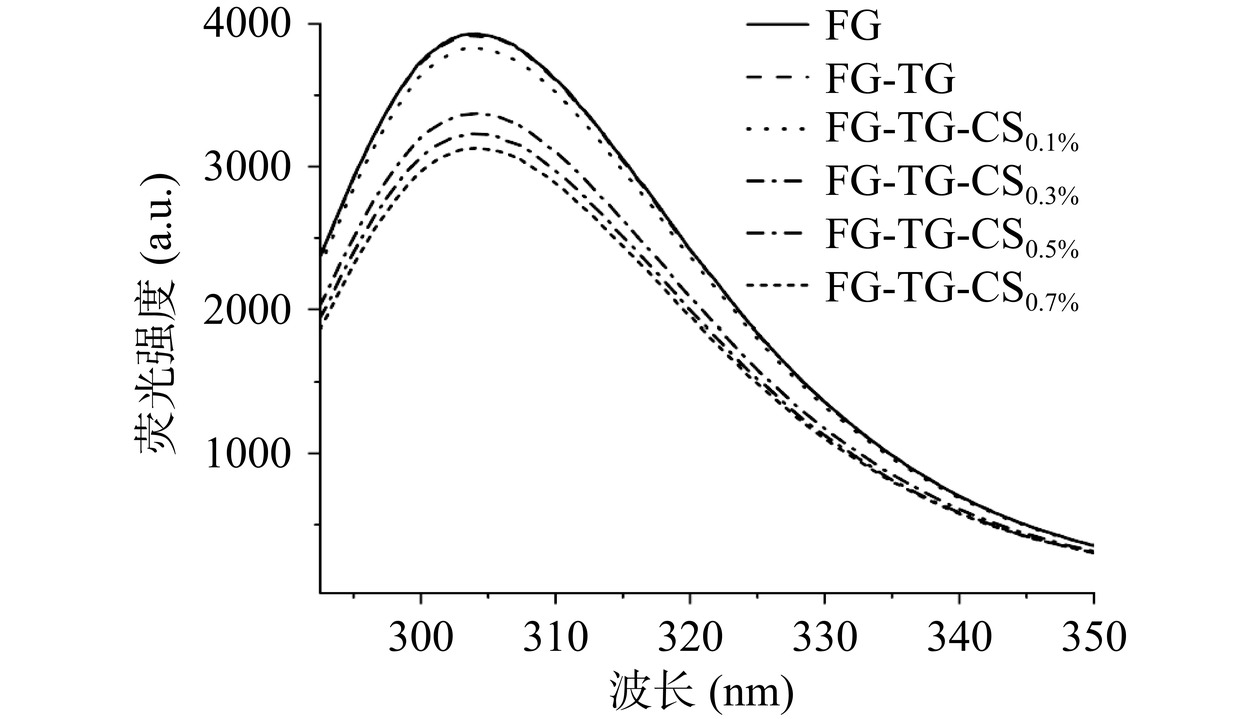
如图3所示,未经修饰的FG具有最高的荧光强度,两种修饰方法均会降低FG的荧光强度且复合修饰有更高的荧光猝灭效率。TG可以催化FG分子内和分子间交联形成的超分子结构,使得FG上部分酪氨酸和苯丙氨酸基团被遮蔽从而出现荧光猝灭[32]。与FG-TG相比,FG-TG-CS具有更低的荧光强度,且复合明胶荧光强度随体系中CS浓度增大而降低并在FG-TG-CS0.7%处出现最低荧光强度。FG先与CS之间通过离子相互作用和氢键与CS形成FG-CS络合物,而后在TG的催化下FG与FG、FG与FG-CS、FG-CS与FG-CS分子通过共价键进一步结合形成更大的聚合物。更高分子量聚合物的形成使得FG上更多荧光基团被遮蔽,因此表现出更低的荧光强度。此外,随着CS浓度的增大,形成更多数量FG-CS络合物遮蔽了更多的荧光氨基酸基团,进一步降低了复合明胶的荧光强度。
2.5 傅里叶红外光谱
傅里叶红外光谱(FTIR)可以用于分析蛋白质分子内或分子间作用力(如氢键和疏水相互作用)的变化[10]。酰胺A的峰值通常出现在3100~3500 cm−1的波数范围内,与分子内氢键耦合的-NH拉伸振动有关[15]。如图4所示,未经改性的FG酰胺A位于3316.03 cm−1处,而改性后FG的酰胺A带出显著红移。相较单一TG酶改性,复合改性组出现更大红移并在CS浓度为0.7%时有最低波数。这主要是因为FG-TG-CS复合体之间形成了氢键。CS上的极性基团(羟基和氨基)与FG的-NH残基和-OH/-COO-基团之间可以形成较强的氢键,显著增强了凝胶网络的稳定性,使样品具有更高的凝胶强度。类似的结果也在壳聚糖/明胶/果胶和壳聚糖/明胶/苹果多酚复合物的研究中被报导[33−34]。
1667 cm−1为酰胺I特征峰与肽键的C=O伸缩振动密切相关[18]。蛋白质的二级结构可以通过相应酰胺I的波数(1600~170 cm−1)进行鉴定[35]。1617~1642、1646~1652、1659~1662 cm−1分别对应蛋白二级结构中的β-片段、无规卷曲和α-螺旋[36]。未改性FG的酰胺I峰位于1658.48 cm−1处,改性后FG的酰胺I带出现偏移。表明改性显著改变FG的二级结构,这可能是由于共价键、离子间相互作用、氢键形成所导致的。复合凝胶的酰胺I带朝向α-螺旋所在峰值区间移动,这可归因于CS与FG之间氢键的作用,有助于稳定水凝胶中α-螺旋的结构,稳定胶体的凝胶网络[3]。此外,通过拟合分析发现,单纯FG的无规则卷曲和β-折叠含量分别为23.92%±0.97%、19.43%±0.22%,复合修饰显著提高FG的β-折叠含量(24.99%~30.16%),降低无规则卷曲的含量(14.02%~18.13%)。因此,复合修饰能通过增加凝胶中更有序的蛋白质的二级结构的数量来增强FG凝胶网络稳定性,且TG和CS对FG的二级结构的改善具有协同作用[18],这与凝胶强度数据相一致。
3. 结论
本研究采用TG和CS对FG进行改性,制备了FG-TG、FG-TG-CS两种复合凝胶,并对比不同改性方式对FG凝胶强度、质构特性、色泽、流变学性质及结构特性的影响。结果表明,单一的TG酶修饰与TG-CS复合修饰均可以显著改善FG的凝胶强度和质构特性,且复合改性对FG的凝胶强度增强效果最好,凝胶强度和硬度随CS浓度增加而增加,在CS为0.7%具有最高凝胶特性。流变学结果表明,改性后FG的表观粘度、凝胶温度及胶融温度均显著提高,表明两种改性技术均可以提升样品的粘度并增强样品的热稳定性。这主要是因为两种改性方法均改变了FG的分子构象,掩埋了FG的荧光基团提高了凝胶中的氢键二级结构的含量,形成了更为稳定的凝胶网络结构。总之,与单纯的TG修饰相比,TG-CS更能有效提高FG的凝胶特性、粘度和热稳定性。
-
表 1 不同修饰方法对鱼明胶凝胶强度及质构特性影响
Table 1 Various modifications methods on the gel strength and textural profile of gelatin gels
指标 FG FG-TG FG-TG-CS0.1% FG-TG-CS0.3% FG-TG-CS0.5% FG-TG-CS0.7% 凝胶强度(g) 409.98±9.54a 421.56±3.45b 483.48±4.08c 496.57±3.60d 514.73±2.14e 522.02±0.07e 硬度(N) 9.17±0.22a 9.54±0.45a 10.78±0.13b 11.01±0.58b 11.70±0.28c 11.79±0.30c 黏性(g.sec) −155.74±36.75a −63.42±22.80b −145.76±39.36a −153.27±8.05a −146.40±25.51a −161.06±35.43a 弹性 0.94±0.01a 0.98±0.08c 0.96±0.01b 0.96±0.01b 0.96±0.01b 0.95±0.01b 粘聚性 0.94±0.01a 0.95±0.01a 0.93±0.01a 0.94±0.00a 0.94±0.01a 0.92±0.02a 胶着度(N) 8.60±0.26a 9.01±0.43a 10.07±0.17b 10.30±0.56bc 10.96±0.34d 10.89±0.07cd 咀嚼性(N) 8.06±0.32a 8.82±0.41b 9.63±0.23c 9.84±0.60cd 10.53±0.39d 10.37±0.11d 回复性 0.83±0.01c 0.82±0.01c 0.79±0.01b 0.76±0.01a 0.76±0.02a 0.73±0.02a 注:同行不同字母表示差异显著(P<0.05);表4同。 表 2 不同修饰方法对鱼明胶色泽的影响
Table 2 Effects of different modification methods on the color of fish gelatin
组别 L* a* b* FG 47.00±1.75b −0.05±0.10d 0.99±0.14a FG-TG 45.35±1.30ab −0.06±0.03d 0.89±0.06a FG-TG-CS0.1% 43.81±1.20a −0.14±0.08cd 1.30±0.40a FG-TG-CS0.3% 44.42±1.12ab −0.18±0.10bc 1.86±0.22b FG-TG-CS0.5% 44.96±2.55ab −0.29±0.05b 2.90±0.15c FG-TG-CS 0.7% 42.44±0.45a −0.43±0.03a 3.61±0.40c 注:同列不同字母表示差异显著(P<0.05);表3同。 表 3 不同修饰方法对FG的η50值的影响及与流体模型拟合结果
Table 3 Effects of different modification methods on the η50 value of FG and their fitting results with the fluid model
组别 η50(mPa·s) Power law Herschel-Bulkley RMSE κ(mPa·s) n R2 RMSE τ0(mPa) κ(mPa·s) n R2 FG 0.01±0.00a 0.03 0.01 1.01 0.99 0.01 0.03 0.01 1.02 0.99 FG-TG 0.02±0.00a 0.04 0.01 1.01 0.99 0.02 0.05 0.01 1.02 0.99 FG-TG-CS0.1% 0.03±0.00a 0.10 0.03 0.95 0.99 0.08 0.10 0.03 0.97 0.99 FG-TG-CS0.3% 0.09±0.02b 0.48 0.23 0.81 0.99 0.45 −0.23 0.25 0.80 0.99 FG-TG-CS0.5% 0.15±0.01c 0.88 0.48 0.76 0.99 0.81 −0.48 0.53 0.74 0.99 FG-TG-CS0.7% 0.53±0.04d 1.73 2.02 0.61 0.99 1.47 −1.36 2.34 0.59 0.99 表 4 不同修饰方法对鱼明胶凝胶点及融胶点影响(℃)
Table 4 Effects of different modification methods on gelling and melting points of FG gels (℃)
指标 FG FG-TG FG-TG-CS0.1% FG-TG-CS0.3% FG-TG-CS0.5% FG-TG-CS0.7% 凝胶点 20.48±0.04a 20.72±0.02b 21.56±0.10c 22.17±0.08d 22.52±0.01e 23.04±0.17f 融胶点 27.89±0.01a 28.00±0.01a 28.92±0.01b 30.07±0.01c 30.62±0.03d 31.30±0.25e -
[1] KARIM A A, BHAT R. Fish gelatin:Properties, challenges, and prospects as an alternative to mammalian gelatins[J]. Food Hydrocolloids,2009,23(3):563−576. doi: 10.1016/j.foodhyd.2008.07.002
[2] HUANG T, TU Z C, SHANGGUAN X, et al. Fish gelatin modifications:A comprehensive review[J]. Trends in Food Science & Technology,2019,86:260−269.
[3] HU Z Z, SHA X M, HUANG T, et al. et al. Microbial transglutaminase (MTGase) modified fish gelatin-gamma-polyglutamic acid (γ-PGA):Rheological behavior, gelling properties, and structure[J]. Food Chemistry,2021,348:129093. doi: 10.1016/j.foodchem.2021.129093
[4] HUANG T, TU Z C, WANG H, et al. Pectin and enzyme complex modified fish scales gelatin:Rheological behavior, gel properties and nanostructure[J]. Carbohydr Polymers,2017,156:294−302. doi: 10.1016/j.carbpol.2016.09.040
[5] SHI X D, HUANG J J, WU J L, et al. Fabrication, interaction mechanism, functional properties, and applications of fish gelatin-polysaccharide composites:A review[J]. Food Hydrocolloids,2022,122:107106. doi: 10.1016/j.foodhyd.2021.107106
[6] WANG C C, SU K Y, SUN W Y, et al. Comparative investigations of various modification methods on the gelling, rheological properties and mechanism of fish gelatin[J]. Food Chemistry,2023,426:136632. doi: 10.1016/j.foodchem.2023.136632
[7] JIANG W, ZHOU Z, WANG D, et al. Transglutaminase catalyzed hydrolyzed wheat gliadin grafted with chitosan oligosaccharide and its characterization[J]. Carbohydrate Polymers,2016,153:105−114. doi: 10.1016/j.carbpol.2016.07.097
[8] RUI L, XIE M, HU B, et al. A comparative study on chitosan/gelatin composite films with conjugated or incorporated gallic acid[J]. Carbohydr Polymers,2017,173:473−481. doi: 10.1016/j.carbpol.2017.05.072
[9] 胡亚云, 张英萍, 陈琳. 多酚交联的壳聚糖水凝胶的制备及其性质研究[J]. 当代化工研究,2022(18):64−66. [HU Y Y, ZHANG Y P, CHEN L. Preparation and properties of chitosan hydrogels cross-linked whit polyphenols[J]. Modern Chemical Research,2022(18):64−66.] HU Y Y, ZHANG Y P, CHEN L. Preparation and properties of chitosan hydrogels cross-linked whit polyphenols[J]. Modern Chemical Research, 2022(18): 64−66.
[10] MAO L, M A L, FU Y, et al. Transglutaminase modified type A gelatin gel:The influence of intra-molecular and inter-molecular cross-linking on structure-properties[J]. Food Chemistry,2022,395:133578. doi: 10.1016/j.foodchem.2022.133578
[11] WANG Y, LIU A, YE R, et al. Transglutaminase-induced crosslinking of gelatin-calcium carbonate composite films[J]. Food Chemistry,2015,166:414−422. doi: 10.1016/j.foodchem.2014.06.062
[12] REZAEE M, ASKARI G, EMAMDJOMEH Z, et al. Effect of organic additives on physiochemical properties and anti-oxidant release from chitosan-gelatin composite films to fatty food simulant[J]. International Journal of Biological Macromolecules,2018,114:844−850. doi: 10.1016/j.ijbiomac.2018.03.122
[13] HUANG T, ZHAO H, FANG Y, et al. Comparison of gelling properties and flow behaviors of microbial transglutaminase (MTGase) and pectin modified fish gelatin[J]. Journal of Texture Studies,2019,50(5):400−409. doi: 10.1111/jtxs.12405
[14] CEN S, ZHANG L, LIU L, et al. Phosphorylation modification on functional and structural properties of fish gelatin:The effects of phosphate contents[J]. Food Chemistry,2022,380:132209. doi: 10.1016/j.foodchem.2022.132209
[15] HUANG T, TU Z C, SHANGGUAN X, et al. Rheological behavior, emulsifying properties and structural characterization of phosphorylated fish gelatin[J]. Food Chemistry,2018,246:428−436. doi: 10.1016/j.foodchem.2017.12.023
[16] CHEN H, WU D, MA W, et al. Strong fish gelatin hydrogels enhanced by carrageenan and potassium sulfate[J]. Food Hydrocolloids,2021,119:106841. doi: 10.1016/j.foodhyd.2021.106841
[17] HU Z Z, SHA X M, YE Y H, et al. Effects of gamma-polyglutamic acid on the gelling properties and non-covalent interactions of fish gelatin[J]. Journal of Texture Studies,2020,51(3):511−520. doi: 10.1111/jtxs.12495
[18] CHEN H, WU D, MA W, et al. Strong fish gelatin hydrogels double crosslinked by transglutaminase and carrageenan[J]. Food Chemistry,2022,376:131873. doi: 10.1016/j.foodchem.2021.131873
[19] QIAO C, MA X, ZHANG J, et al. Molecular interactions in gelatin/chitosan composite films[J]. Food Chemistry,2017,235:45−50. doi: 10.1016/j.foodchem.2017.05.045
[20] LIU Z, GE X, LU Y, et al. Effects of chitosan molecular weight and degree of deacetylation on the properties of gelatine-based films[J]. Food Hydrocolloids,2012,26(1):311−317. doi: 10.1016/j.foodhyd.2011.06.008
[21] 周志纯, 王世伟, 孟繁亮, 等. 壳聚糖/明胶复合纤维的制备与性能[J]. 大连工业大学学报,2020,39(3):198−202. [ZHOU Z C, WANG S W, MENG F L, et al. Preparation and properties of chitosan/geltain composite fibers[J]. Journal of Dalian Polytechnic University,2020,39(3):198−202.] ZHOU Z C, WANG S W, MENG F L, et al. Preparation and properties of chitosan/geltain composite fibers[J]. Journal of Dalian Polytechnic University, 2020, 39(3): 198−202.
[22] ISASCHAR-OVDAT S, DAVIDOVICH-PINHAS M, FISHMAN A. Modulating the gel properties of soy glycinin by crosslinking with tyrosinase[J]. Food Research International,2016,87:42−49. doi: 10.1016/j.foodres.2016.06.018
[23] LIU Y, WENG R, WANG W, et al. Tunable physical and mechanical properties of gelatin hydrogel after transglutaminase crosslinking on two gelatin types[J]. International Journal of Biological Macromolecules,2020,162:405−413. doi: 10.1016/j.ijbiomac.2020.06.185
[24] 刘凤华, 刘佳林, 陈浩, 等. 鱼明胶/海藻酸钠复合凝胶特性研究[J]. 食品科学技术学报,2018,36(4):61−68. [LIU F H, LIU J L, CHEN H, et al. Research on properties of fish gelatin/sodium alginate composite gelation[J]. Journal of Food Science and Technology,2018,36(4):61−68.] LIU F H, LIU J L, CHEN H, et al. Research on properties of fish gelatin/sodium alginate composite gelation[J]. Journal of Food Science and Technology, 2018, 36(4): 61−68.
[25] ESCÁRCEGA-GALAZ A A, SÁNCHEZ-MACHADO D I, LÓPEZ-CERVANTES J, et al. Mechanical, structural and physical aspects of chitosan-based films as antimicrobial dressings[J]. International Journal of Biological Macromolecules,2018,116:472−481. doi: 10.1016/j.ijbiomac.2018.04.149
[26] HUANG M, MAO Y, LI H, et al. Kappa-carrageenan enhances the gelation and structural changes of egg yolk via electrostatic interactions with yolk protein[J]. Food Chemistry,2021,360:129972. doi: 10.1016/j.foodchem.2021.129972
[27] FANG Q, MA N, DING K, et al. Interaction between negatively charged fish gelatin and cyclodextrin in aqueous solution:Characteristics and formation mechanism[J]. Gels,2021,7(4):260. doi: 10.3390/gels7040260
[28] ZHAO H, KANG X, ZHOU X, et al. Glycosylation fish gelatin with gum arabic:Functional and structural properties[J]. LWT- Food Science and Technology,2021,139:110634. doi: 10.1016/j.lwt.2020.110634
[29] CHEN Y, WANG Y, LIU R, et al. Effects of microbial transglutaminase on the gelling property and in vitro digestibility of fish scale gelatin from grass carp[J]. Food Bioscience,2023,53:102569. doi: 10.1016/j.fbio.2023.102569
[30] XIN Y, CHAI M, CHEN F, et al. Comparative study on the gel properties and nanostructures of gelatins from chicken, porcine, and tilapia skin[J]. Journal of Food Science,2021,86(5):1936−1945. doi: 10.1111/1750-3841.15700
[31] 李海朝, 杨帅帅. 明胶/壳聚糖复合膜的制备与表征[J]. 化工新型材料,2019,47(2):228−231. [LI H Z, YANG S S. Preparation and characterization of gelatin/chitosan composite film[J]. New Chemical Materials,2019,47(2):228−231.] LI H Z, YANG S S. Preparation and characterization of gelatin/chitosan composite film[J]. New Chemical Materials, 2019, 47(2): 228−231.
[32] HE C, HU Y, WOO M W, et al. Effect of microbial transglutaminase on the structural and rheological characteristics and in vitro digestion of rice glutelin-casein blends[J]. Food Research International,2021,139:109832. doi: 10.1016/j.foodres.2020.109832
[33] 张爱华. 壳聚糖/明胶/果胶复合材料的性能研究[D]. 天津:天津大学, 2006. [ZHANG A H. Study on properties of chitosan/geltain/pectin composite biomaterials[D]. Tianjin:Tianjin University, 2006.] ZHANG A H. Study on properties of chitosan/geltain/pectin composite biomaterials[D]. Tianjin: Tianjin University, 2006.
[34] 石洁, 王雪嵘, 徐朝阳. 壳聚糖/明胶/苹果多酚复合膜的制备及性能研究[J]. 包装工程,2023,44(1):1−6. [SHI J, WANG X R, XU Z Y. Preparation and properties of chitosan/gelatin/apple polyphenol composite films[J]. Packaging Engineering,2023,44(1):1−6.] SHI J, WANG X R, XU Z Y. Preparation and properties of chitosan/gelatin/apple polyphenol composite films[J]. Packaging Engineering, 2023, 44(1): 1−6.
[35] ZHAO J, HE J, DANG Y, et al. Ultrasound treatment on the structure of goose liver proteins and antioxidant activities of its enzymatic hydrolysate[J]. Journal of Food Biochemistry,2020,44(1):e13091.
[36] SOW L C, NICOLE CHONG J M, LIAO Q X, et al. Effects of κ-carrageenan on the structure and rheological properties of fish gelatin[J]. Journal of Food Engineering,2018,239:92−103. doi: 10.1016/j.jfoodeng.2018.05.035





 下载:
下载:

 下载:
下载:
